COMPITI PER IL RIPASSO ESTIVO SCIENZE DELLA TERRA CLASSI PRIME
|
|
|
- Carlotta Volpe
- 6 anni fa
- Visualizzazioni
Transcript
1 COMPITI PER IL RIPASSO ESTIVO SCIENZE DELLA TERRA CLASSI PRIME Con l aiuto degli appunti di lezione, di internet, e del libro di testo ( che puoi richiedere in segreteria) rispondi nella maniera più completa alle seguenti domande. 1. Definizione di Scienze della Terra. Descrivi 4 discipline che la studiano. 2. Che cos è un sistema? Fornisci una definizione e spiega la differenza tra sistema aperto e sistema chiuso. 3. Descrivi le 4 sfere della Terra. 4. Definizione di energia e materia 5. Che differenza c è tra geosistema e biosistema? 6. Descrivi in maniera sintetica il metodo sperimentale. Chi l ha introdotto e quando? 7. Perché una teoria scientifica non è assoluta? Motiva la tua risposta. 8. Differenza tra grandezze fondamentali e derivate? 9. Quali sono le diverse tipologie di grafici che conosci? Disegnali e Illustrane le parti fondamentali. 10. In che modo le Scienze della Terra aiutano la società? 11. Descrivi e disegna la struttura di un atomo. 12. Spiega la differenza tra ATOMI E MOLECOLE; concludi la spiegazione facendo 5 esempi per ognuno. 13. Disegna e spiega cos è, chi la ha ideata e come si utilizza la TAVOLA PERIODICA DEGLI ELEMENTI. 14. Disegna e descrivi la scala del ph, facendo 5 esempi di sostanze o alimenti acidi, basici e neutri. 15. Definisci cosa sono: le soluzioni concentrate e diluite, i miscugli eterogenei, i miscugli omogenei, le emulsioni, le sospensioni. Indica 2 esempi per ciascuno. 16. Cos è il reticolato geografico, a cosa serve e da quali elementi è costituito? 17. Cosa sono la latitudine e la longitudine? 18. Che cos è un fuso orario? Quanti ce ne sono? A cosa servono? 19. Descrivi in modo completo i moti terrestri utilizzando disegni opportuni; non dimenticare di spiegare quali sono le loro caratteristiche e le conseguenze che essi producono. 20. Descrivi le caratteristiche del nostro satellite: la Luna
2 1. Osserva il grafico sottostante e rispondi alle domande. (12 pt) - Che titolo daresti a questo grafico? - Quali sono le unità di misura utilizzate nel grafico? - In quale mese si è registrata la temperatura massima? - In quale periodo dell anno piove meno? - Quale mese dell anno è il più freddo? - Quanti mm di pioggia sono caduti nel mese più piovoso? ATOMO E MATERIA 2. Osservando l atomo rappresentato indica: - Numero atomico (Z): - Numero di massa (A): - L atomo è elettricamente neutro? SI NO - L atomo: è stabile tenderà a creare legami con altri atomi - Di quale atomo si tratta?
3 3. Indica i nomi o le formule chimiche delle seguenti molecole Acqua: CH4: CO2: Ossigeno: Sale da cucina: C6H12O6: Formula della fotosintesi: Indica se le seguenti molecole sono ELEMENTI, COMPOSTI ORGANICI O INORGANICI. MOLECOLA ELEMENTO COMPOSTO organico COMPOSTO inorganico H2 CH3CH2OH: O3 CH4 NaCl 5. Leggi le seguenti definizioni e scrivi la parola a cui si riferiscono - È la particella più piccola che compone l atomo: - Si trova nel nucleo dell atomo e non ha nessuna carica elettrica: - Sono un insieme di linee immaginarie che circondano l atomo: - Si dice di un composto del carbonio: - In un elemento sono tutti uguali: 6. Scrivi il simbolo o il nome degli elementi elencati: idrogeno - Na - calcio - K - C - azoto Si - P - alluminio - Fe - zolfo - Mg 7. Completa il seguente testo: Tutta la materia è formata da, che a loro volta contengono particelle positive, i, particelle negative chiamate e particelle (i neutroni). Allo stato fondamentale gli atomi sono elettricamente, ovvero hanno un numero uguale di e di. Gli atomi, tranne quelli dei gas non sono stabili ma tendono a creare chimici con altri atomi. Per raggiungere questa stabilità possono cedere o elettroni: la loro carica elettrica cambia creando una forza di attrazione (legame ). Il legame più forte è invece chiamato : in questo caso gli atomi per raggiungere la mettono in comune gli con altri atomi.
4 8. La tavola periodica degli elementi: quando, da chi e in che modo è stata creata? 9. Come si forma la molecola di cloruro di sodio (sale da cucina)? Disegna i due atomi e spiega come e perché si legano tra loro. MISCUGLI E SOLUZIONI 1.. Le soluzioni sono: a) sospensioni b) sostanze pure c) miscugli eterogenei d) miscugli omogenei 2. Su quale delle seguenti proprietà si basa la distillazione? a) le dimensioni dei pori del dispositivo di filtrazione b) la diversa densità dei componenti c) i diversi punti di ebollizione dei componenti d) i diversi punti di fusione dei componenti. 3. Individua tra i seguenti sistemi l unico che corrisponde a una sostanza pura: a) acqua piovana b) acqua minerale c) acqua di sorgente d) acqua distillata.
5 4. Osserva l immagine e rispondi alle domande In quali casi sono rappresentate sostanze pure? In quali casi sono rappresentati miscugli omogenei? Ci sono rappresentati miscugli eterogenei? Qual è la soluzione più concentrata? Nell immagine C quali particelle rappresentano il solvente e quali il soluto? 5. Un miscuglio eterogeneo in cui un gas è disperso in un liquido si chiama: a) fumo b) gel c) emulsione d) schiuma 6. Scrivi a fianco di ogni esempio il corrispondente fenomeno. La brina si forma quando il vapore acqueo si trasforma in ghiaccio, a contatto con superfici aventi temperature inferiori a 0 C La pioggia I panni stesi che si asciugano Le palline di naftalina negli armadi tra i vestiti, dopo qualche mese, si consumano ma rimane il forte odore della naftalina Lo sbrinamento di un frigorifero Il burro che si scioglie in pentola
6 7. Secondo la legge di Lavoisier, nota anche come legge di conservazione della massa nulla si crea, nulla si distrugge, tutto si trasforma), durante una reazione chimica la massa (e quindi il numero di atomi) non cambia. In base a questo principio controlla se la reazione seguente è correttamente bilanciata ed eventualmente correggila aggiungendo i numeri negli appositi spazi. Indica come si definisce il gruppo di elementi prima e dopo la freccia, a scrivi se si tratta di una reazione di sintesi o di scissione. Na + Cl2 NaCl Tipo di reazione: 8. Indica se le seguenti molecole sono sostanze pure o miscugli. In questo ultimo caso indica se è omogeneo o eterogeneo e da quali fasi è composto. MATERIA SOSTANZA PURA MISCUGLIO OMOGENEO MISCUGLIO ETEROGENEO acqua frizzante acqua distillata acqua del rubinetto aria che respiriamo sale da cucina fumo granito zucchero da cucina (indicare gli atomi da cui è formata) (indicare da quali fasi è composto) 9. Leggi le seguenti definizioni e scrivi la parola a cui si riferiscono - Particelle formate dall unione di due o più atomi: - Atomi che hanno ceduto o acquistato elettroni, caricandosi di carica elettrica positiva o negativa: - Termine per definire una soluzione che presenta il soluto in piccole quantità rispetto al solvente: - Si dice di un miscuglio in cui i componenti non sono più distinguibili: - Unità di misura che esprime la concentrazione di ioni H + di una sostanza: - Stato della materia che ha la più bassa densità:
7 10. Indica lungo le frecce e negli appositi spazi i termini corrispondenti. 11. Indica sulla scala del ph a quali valori corrisponde l acidità, la neutralità e l alcalinità.
L Atomo e le Molecole
 L Atomo e le Molecole L atomo L'atomo, la particella che come un mattone costituisce tutta la materia, non è un corpicciolo semplice. Esso è a sua volta composto da particelle elementari piccolissime:
L Atomo e le Molecole L atomo L'atomo, la particella che come un mattone costituisce tutta la materia, non è un corpicciolo semplice. Esso è a sua volta composto da particelle elementari piccolissime:
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
I LEGAMI CHIMICI. I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune
 I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
Le sostanze chimiche
 Le sostanze chimiche Ingredienti base della materia La materia si presenta con diverse forme. Accade perché esistono moltissimi «ingredienti di base» che mescolandosi tra loro danno innumerevoli combinazioni.
Le sostanze chimiche Ingredienti base della materia La materia si presenta con diverse forme. Accade perché esistono moltissimi «ingredienti di base» che mescolandosi tra loro danno innumerevoli combinazioni.
Classificazione della materia 3 STATI DI AGGREGAZIONE
 Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Corso di CHIMICA LEZIONE 1
 Corso di CHIMICA LEZIONE 1 MATERIA tutto ciò occupa spazio e ha massa si presenta in natura sottoforma di Miscugli: sostanze mescolate insieme in vario modo (rocce, acqua marina, aria, cellule) Sostanze
Corso di CHIMICA LEZIONE 1 MATERIA tutto ciò occupa spazio e ha massa si presenta in natura sottoforma di Miscugli: sostanze mescolate insieme in vario modo (rocce, acqua marina, aria, cellule) Sostanze
L Atomo e le Molecole
 L Atomo e le Molecole L atomo L'atomo, la particella che come un mattone costituisce tutta la materia, non è un corpicciolo semplice. Esso è a sua volta composto da particelle elementari piccolissime:
L Atomo e le Molecole L atomo L'atomo, la particella che come un mattone costituisce tutta la materia, non è un corpicciolo semplice. Esso è a sua volta composto da particelle elementari piccolissime:
FONDAMENTI DI CHIMICA
 FONDAMENTI DI CHIMICA LA CHIMICA E UNA BRANCA DELLA SCIENZA CHE STUDIA LA COMPOSIZIONE DELLA MATERIA E DELLE SOSTANZE, LE LORO PROPRIETA E LE LORO TRASFORMAZIONI IN ALTRE SOSTANZE ED ELEMENTI E/O IN ENERGIA
FONDAMENTI DI CHIMICA LA CHIMICA E UNA BRANCA DELLA SCIENZA CHE STUDIA LA COMPOSIZIONE DELLA MATERIA E DELLE SOSTANZE, LE LORO PROPRIETA E LE LORO TRASFORMAZIONI IN ALTRE SOSTANZE ED ELEMENTI E/O IN ENERGIA
VERIFICA La struttura della materia: atomi e molecole
 ERIICA La struttura della materia: atomi e molecole Cognome Nome Classe Data I/1 ero o falso? La massa atomica indica quanti neutroni sono presenti nel nucleo La massa atomica indica la massa in grammi
ERIICA La struttura della materia: atomi e molecole Cognome Nome Classe Data I/1 ero o falso? La massa atomica indica quanti neutroni sono presenti nel nucleo La massa atomica indica la massa in grammi
Compiti estivi di chimica classe 1Ag
 Compiti estivi di chimica classe Ag Separare un miscuglio secondo le tecniche studiate. Quale metodo di separazione potrebbe essere utilizzato per separare un miscuglio formato da sale mescolato con frammenti
Compiti estivi di chimica classe Ag Separare un miscuglio secondo le tecniche studiate. Quale metodo di separazione potrebbe essere utilizzato per separare un miscuglio formato da sale mescolato con frammenti
La chimica studia la materia e i cambiamenti ai quali essa va soggetta. La materia è tutto ciò che possiede massa e occupa spazio.
 La chimica studia la materia e i cambiamenti ai quali essa va soggetta. La materia è tutto ciò che possiede massa e occupa spazio. Tutto ciò che potete toccare è materia, e materia sono moltissime cose
La chimica studia la materia e i cambiamenti ai quali essa va soggetta. La materia è tutto ciò che possiede massa e occupa spazio. Tutto ciò che potete toccare è materia, e materia sono moltissime cose
CLASSE SECONDA (chimica)
 CLASSE SECONDA (chimica) MODULO N.1 : LA MATERIA Analizzare dati e interpretarli sviluppando deduzioni e ragionamenti sugli stessi anche con l ausilio di rappresentazioni grafiche UNITA DI APPRENDIMENTO
CLASSE SECONDA (chimica) MODULO N.1 : LA MATERIA Analizzare dati e interpretarli sviluppando deduzioni e ragionamenti sugli stessi anche con l ausilio di rappresentazioni grafiche UNITA DI APPRENDIMENTO
CURRICOLO VERTICALE DI SCIENZE a.s (nuovo biennio) CLASSE PRIMA CHIMICA I SISTEMI CHIMICI. Competenze. Abilità/Capacità.
 CURRICOLO VERTICALE DI SCIENZE a.s 2011-2012 (nuovo biennio) CLASSE PRIMA CHIMICA I SISTEMI CHIMICI Competenze Abilità/Capacità Conoscenze Attività di laboratorio correlate MISURARE 1 / 56 TABULARE ED
CURRICOLO VERTICALE DI SCIENZE a.s 2011-2012 (nuovo biennio) CLASSE PRIMA CHIMICA I SISTEMI CHIMICI Competenze Abilità/Capacità Conoscenze Attività di laboratorio correlate MISURARE 1 / 56 TABULARE ED
Corso di chimica generale
 Corso di chimica generale Dr. Riccardo Montioli Email: riccardo.montioli@univr.it Programma - La materia e l energia - Le particelle subatomiche e la misura della massa - L atomo, teorie e struttura -
Corso di chimica generale Dr. Riccardo Montioli Email: riccardo.montioli@univr.it Programma - La materia e l energia - Le particelle subatomiche e la misura della massa - L atomo, teorie e struttura -
Lezione 2. Leggi ponderali
 Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Cosa significa materia?
 Cosa significa materia? Deriva dal latino mater che significa «madre». Le caratteristiche fondamentali della materia Ha una massa che si esprime in chilogrammi (kg) Ha un volume che si esprime in metri
Cosa significa materia? Deriva dal latino mater che significa «madre». Le caratteristiche fondamentali della materia Ha una massa che si esprime in chilogrammi (kg) Ha un volume che si esprime in metri
CHIMICA: studio della struttura e delle trasformazioni della materia
 CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
Chimica. La scienza che studia le trasformazioni della materia. Acqua (ghiaccio) Acqua (Liquido) Trasformazione Fisica
 Nozioni di Base Chimica La scienza che studia le trasformazioni della materia Acqua (ghiaccio) ----- Acqua (Liquido) Trasformazione Fisica Metano + Ossigeno -- Anidride Carbonica + Acqua Trasformazione
Nozioni di Base Chimica La scienza che studia le trasformazioni della materia Acqua (ghiaccio) ----- Acqua (Liquido) Trasformazione Fisica Metano + Ossigeno -- Anidride Carbonica + Acqua Trasformazione
Il modello strutturale dell atomo
 Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica -
 Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare
 Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Materia. Tutto ciò che occupa spazio e ha massa
 Materia Tutto ciò che occupa spazio e ha massa Gli Stati della Materia Solido Liquido Gas I solidi sono rigidi ed hanno forma e volume definito. I liquidi prendono la forma del contenitore. Hanno un volume
Materia Tutto ciò che occupa spazio e ha massa Gli Stati della Materia Solido Liquido Gas I solidi sono rigidi ed hanno forma e volume definito. I liquidi prendono la forma del contenitore. Hanno un volume
Un elemento è una sostanza pura che non può essere divisa in sostanze più semplici. Le sue molecole sono tutte uguali.
 Elementi, composti, miscugli Un elemento è una sostanza pura che non può essere divisa in sostanze più semplici. Le sue molecole sono tutte uguali. Il composto è formato da sostanze pure scomponibili in
Elementi, composti, miscugli Un elemento è una sostanza pura che non può essere divisa in sostanze più semplici. Le sue molecole sono tutte uguali. Il composto è formato da sostanze pure scomponibili in
A_Test di valutazione di CHIMICA:
 COGNOME NOME... C.I./Patente n... MATRICOLA NO SI, n:... Prova di accertamento per la determinazione di eventuali debiti formativi A_Test di valutazione di CHIMICA: Cosa studia in generale la chimica A)
COGNOME NOME... C.I./Patente n... MATRICOLA NO SI, n:... Prova di accertamento per la determinazione di eventuali debiti formativi A_Test di valutazione di CHIMICA: Cosa studia in generale la chimica A)
Un sistema è una porzione delimitata di materia.
 1. La materia e le sue caratteristiche Un sistema è una porzione delimitata di materia. 1. La materia e le sue caratteristiche Gli stati fisici in cui la materia si può trovare sono: solido; liquido; aeriforme.
1. La materia e le sue caratteristiche Un sistema è una porzione delimitata di materia. 1. La materia e le sue caratteristiche Gli stati fisici in cui la materia si può trovare sono: solido; liquido; aeriforme.
Chimica. Lezione 2 Parte II Composti ionici e molecolari
 Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero La vita è una reazione chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola
La Vita è una Reazione Chimica Acqua Oro Zucchero La vita è una reazione chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola
Corso di CHIMICA INORGANICA
 Corso di CHIMICA INORGANICA Lezione Seconda La teoria atomica La massa atomica e il concetto di Isotopi Dentro l atomo, le particelle subatomiche La Tavola Periodica degli Elementi 2 Gli atomi di un certo
Corso di CHIMICA INORGANICA Lezione Seconda La teoria atomica La massa atomica e il concetto di Isotopi Dentro l atomo, le particelle subatomiche La Tavola Periodica degli Elementi 2 Gli atomi di un certo
Stati di Aggregazione e Composizione - elementi atomo - composti - miscele omo- ed eterogenee L Atomo - particelle subatomiche e proprietà - Numero
 1. La Materia Stati di Aggregazione e Composizione - elementi atomo - composti - miscele omo- ed eterogenee L Atomo - particelle subatomiche e proprietà - Numero Atomico e Numero di Massa Gli Isotopi La
1. La Materia Stati di Aggregazione e Composizione - elementi atomo - composti - miscele omo- ed eterogenee L Atomo - particelle subatomiche e proprietà - Numero Atomico e Numero di Massa Gli Isotopi La
L Atomo e le Molecole
 L Atomo e le Molecole La materia Tutti i corpi che ci circondano, (rocce, aria, nubi, sabbia, ) sono fatti di materia. Materia è tutto ciò che occupa uno spazio, cioè ha un volume, e ha una massa, quindi
L Atomo e le Molecole La materia Tutti i corpi che ci circondano, (rocce, aria, nubi, sabbia, ) sono fatti di materia. Materia è tutto ciò che occupa uno spazio, cioè ha un volume, e ha una massa, quindi
La formula chimica di una sostanza nota la sua composizione %
 La formula chimica di una sostanza nota la sua composizione % Si consideri la sostanza costituita dagli elementi A, B e C e sia nota la sua composizione %, che si ottiene sperimentalmente 1. Si divide
La formula chimica di una sostanza nota la sua composizione % Si consideri la sostanza costituita dagli elementi A, B e C e sia nota la sua composizione %, che si ottiene sperimentalmente 1. Si divide
Capitolo 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino
 Capitolo 3 LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!!
Capitolo 3 LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!!
Amministrazione, finanza e marketing - Turismo Ministero dell Istruzione, dell Università e della Ricerca PROGRAMMAZIONE DISCIPLINARE PER U. di A.
 MATERIA CHIMICA CLASSE 2 INDIRIZZO AFM / TUR DESCRIZIONE Unità di Apprendimento UdA n. 1 Titolo: LA MATERIA Aver acquisito la capacità di osservare, descrivere ed analizzare i fenomeni legati alle trasformazioni
MATERIA CHIMICA CLASSE 2 INDIRIZZO AFM / TUR DESCRIZIONE Unità di Apprendimento UdA n. 1 Titolo: LA MATERIA Aver acquisito la capacità di osservare, descrivere ed analizzare i fenomeni legati alle trasformazioni
Atomi, molecole e ioni
 Atomi, molecole e ioni anione + - catione Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento
Atomi, molecole e ioni anione + - catione Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
UNITA DIDATTICA P A1.01
 Titolo: Grandezze fisiche fondamentali e derivate, unità di misura. Conversioni di unità di misura e notazione scientifica. Codice: A1-P-Tec-Gra Campo di indagine della chimica. Il Sistema Internazionale
Titolo: Grandezze fisiche fondamentali e derivate, unità di misura. Conversioni di unità di misura e notazione scientifica. Codice: A1-P-Tec-Gra Campo di indagine della chimica. Il Sistema Internazionale
PERCORSI ABILITANTI SPECIALI CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA
 PERCORSI ABILITANTI SPECIALI 2014 - CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA Cognome Nome Numero progressivo sul registro 1. Viene disciolto zucchero in un certo volume di acqua pura fino a che si
PERCORSI ABILITANTI SPECIALI 2014 - CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA Cognome Nome Numero progressivo sul registro 1. Viene disciolto zucchero in un certo volume di acqua pura fino a che si
SOLUZIONI E CONCENTRAZIONE
 SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
LA STRUTTURA DELLA MATERIA
 LA STRUTTURA DELLA MATERIA La materia è tutto ciò che ci circonda, che occupa uno spazio e ha una massa La materia si presenta sotto diverse forme, dette sostanze. Sono sostanze: il vetro, il legno, il
LA STRUTTURA DELLA MATERIA La materia è tutto ciò che ci circonda, che occupa uno spazio e ha una massa La materia si presenta sotto diverse forme, dette sostanze. Sono sostanze: il vetro, il legno, il
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 2 Le trasformazioni fisiche della materia 1. La materia e le sue caratteristiche 2. I sistemi omogenei e i sistemi
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 2 Le trasformazioni fisiche della materia 1. La materia e le sue caratteristiche 2. I sistemi omogenei e i sistemi
LE TEORIE DELLA MATERIA
 IL CONCETTO DIATOMO HA RADICI ANTICHE LE TEORIE DELLA MATERIA FILOSOFI GRECI: LEUCIPPO circa 450 a.c. La materia non è continua ma è formata da particelle piccolissime. DEMOCRITO circa 400 a.c. discepolo
IL CONCETTO DIATOMO HA RADICI ANTICHE LE TEORIE DELLA MATERIA FILOSOFI GRECI: LEUCIPPO circa 450 a.c. La materia non è continua ma è formata da particelle piccolissime. DEMOCRITO circa 400 a.c. discepolo
ATOMI E MOLECOLE. Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti).
 1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383
 ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: Rosmarini Diana Classe: I Sez.:
ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: Rosmarini Diana Classe: I Sez.:
ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA
 ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA VALUTAZIONE - Prima parte: scelte multiple (26 punti = 13 domande da 2 punti) (totale: 80 punti) - Seconda parte: domande (30 punti = 5 domande da 6 punti) -
ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA VALUTAZIONE - Prima parte: scelte multiple (26 punti = 13 domande da 2 punti) (totale: 80 punti) - Seconda parte: domande (30 punti = 5 domande da 6 punti) -
Le sostanze chimiche prof. Matteo Scapellato
 1. Fenomeni fisici e fenomeni chimici a) Fenomeno fisico: è una trasformazione che non cambia la natura delle sostanze 1 b) Fenomeno chimico o reazione chimica: è una trasformazione che cambia la natura
1. Fenomeni fisici e fenomeni chimici a) Fenomeno fisico: è una trasformazione che non cambia la natura delle sostanze 1 b) Fenomeno chimico o reazione chimica: è una trasformazione che cambia la natura
Chimica. Lezione 1 La materia
 Chimica Lezione 1 La materia Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido, gassoso) o della COMPOSIZIONE
Chimica Lezione 1 La materia Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido, gassoso) o della COMPOSIZIONE
OGRAMMA DI CHIMICA 2016
 ISTITUT TO DI ISTRUZIONE SUPERIORE M MARIANO IV D ARBOREA Sede distaccata IPSIA di GHILARZA PRO OGRAMMA DI CHIMICA A.S. 2015-2016 2016 Classe: I sez. A Docenti: Federica Piras, Carmelo Floris PARTE TEORICA
ISTITUT TO DI ISTRUZIONE SUPERIORE M MARIANO IV D ARBOREA Sede distaccata IPSIA di GHILARZA PRO OGRAMMA DI CHIMICA A.S. 2015-2016 2016 Classe: I sez. A Docenti: Federica Piras, Carmelo Floris PARTE TEORICA
Istituto di Istruzione Secondaria Superiore Statale «IIS Via Silvestri 301»
 «IIS Via Silvestri 301» Programma di CHIMICA E LABORATORIO Classe 1 a B Indirizzo ELETTRONICA ED ELETTROTECNICA ARGOMENTO 1 Dai miscugli alle sostanze 1.1 Osservando la materia 1.2 Grandezze e strumenti
«IIS Via Silvestri 301» Programma di CHIMICA E LABORATORIO Classe 1 a B Indirizzo ELETTRONICA ED ELETTROTECNICA ARGOMENTO 1 Dai miscugli alle sostanze 1.1 Osservando la materia 1.2 Grandezze e strumenti
Classe4:chimicaStrutturaAtomica1. Controlla se sai definire i seguenti termini: teoria atomica di Dalton (atomo di Dalton),
 Classe4:chimicaStrutturaAtomica1. Controlla se sai definire i seguenti termini: teoria atomica di Dalton (atomo di Dalton), particelle subatomiche, protone, neutrone, elettronie, nucleo. 2. Decidi se tra
Classe4:chimicaStrutturaAtomica1. Controlla se sai definire i seguenti termini: teoria atomica di Dalton (atomo di Dalton), particelle subatomiche, protone, neutrone, elettronie, nucleo. 2. Decidi se tra
Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe
 1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
Chimica e laboratorio
 ITIS H.HERTZ Progetto Monoennio Chimica e laboratorio PARTE PRIMA I MODULO: Struttura atomica e molecolare della materia PESO : 70% UNITA ORARIE PREVISTE : 20 h Unità A: ATOMI Descrivere le caratteristiche
ITIS H.HERTZ Progetto Monoennio Chimica e laboratorio PARTE PRIMA I MODULO: Struttura atomica e molecolare della materia PESO : 70% UNITA ORARIE PREVISTE : 20 h Unità A: ATOMI Descrivere le caratteristiche
LA MATERIA E IL MODELLO PARTICELLARE
 LA MATERIA E IL MODELLO PARTICELLARE - Gli oggetti che ci circondano sono costituiti di materia. - Come possiamo definire la materia? La materia è tutto ciò che possiede una massa e occupa un volume. -
LA MATERIA E IL MODELLO PARTICELLARE - Gli oggetti che ci circondano sono costituiti di materia. - Come possiamo definire la materia? La materia è tutto ciò che possiede una massa e occupa un volume. -
SCIENZE INTEGRATE CHIMICA
 SCIENZE INTEGRATE CHIMICA Classi 2 e TECNICO ECONOMICO (REL- AMM-SPO) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO U.D.A. Periodo Ore lezione 1. Classificazione della materia: stati fisici e miscugli settembre
SCIENZE INTEGRATE CHIMICA Classi 2 e TECNICO ECONOMICO (REL- AMM-SPO) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO U.D.A. Periodo Ore lezione 1. Classificazione della materia: stati fisici e miscugli settembre
risposte agli esercizi del libro
 risposte agli esercizi del libro 1 SOLUZIONI ESERCIZI FINE CPITOLO 1 B D C 4 C 5 B 6 C 7 D 8 9 D 11 C 1 B 1 B 14 B 15 C 16 C 18 B 19 a) fisica; b) materiale; c) macroscopica; d) fusione; e) hanno-non occupano
risposte agli esercizi del libro 1 SOLUZIONI ESERCIZI FINE CPITOLO 1 B D C 4 C 5 B 6 C 7 D 8 9 D 11 C 1 B 1 B 14 B 15 C 16 C 18 B 19 a) fisica; b) materiale; c) macroscopica; d) fusione; e) hanno-non occupano
Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio:
 Reazioni chimiche Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio: CH 4 + 2O 2 CO 2 + 2H 2 O La reazione chimica è formata da reagenti
Reazioni chimiche Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio: CH 4 + 2O 2 CO 2 + 2H 2 O La reazione chimica è formata da reagenti
Le Reazioni Chimiche
 Le Reazioni Chimiche Quando gli atomi si uniscono: La Molecola Gli atomi hanno la capacità di unirsi tra loro formando le MOLECOLE. Le Formule Chimiche Per indicare le molecole si usano le FORMULE CHIMICHE
Le Reazioni Chimiche Quando gli atomi si uniscono: La Molecola Gli atomi hanno la capacità di unirsi tra loro formando le MOLECOLE. Le Formule Chimiche Per indicare le molecole si usano le FORMULE CHIMICHE
reazioni Sostanze Reazioni di sintesi Reazioni di decomposizione
 Si consumano nelle reazioni Si formano nelle reagenti Si trasformano con prodotti Sostanze Sostanze semplici Sostanze composte Non ottenibili con Non decomponibili con Reazioni di sintesi Reazioni di decomposizione
Si consumano nelle reazioni Si formano nelle reagenti Si trasformano con prodotti Sostanze Sostanze semplici Sostanze composte Non ottenibili con Non decomponibili con Reazioni di sintesi Reazioni di decomposizione
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 4 Le teorie 1. L atomo e la sua storia 2. La nascita della moderna teoria atomica: da Lavoiser
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 4 Le teorie 1. L atomo e la sua storia 2. La nascita della moderna teoria atomica: da Lavoiser
Loriano Storchi.
 Loriano Storchi loriano@storchi.org http://www.storchi.org/ Metodo scientifico Nessuna quantità di esperimenti potrà dimostrare che ho ragione; un unico esperimento potrà dimostrare che ho sbagliato Il
Loriano Storchi loriano@storchi.org http://www.storchi.org/ Metodo scientifico Nessuna quantità di esperimenti potrà dimostrare che ho ragione; un unico esperimento potrà dimostrare che ho sbagliato Il
Le Reazioni Chimiche
 I Legami chimici Quando gli atomi cedono, acquistano o mettono in comune degli elettroni formano un legame chimico. I Legami chimici Gli atomi cercano sempre di completare il loro guscio esterno cedendo,
I Legami chimici Quando gli atomi cedono, acquistano o mettono in comune degli elettroni formano un legame chimico. I Legami chimici Gli atomi cercano sempre di completare il loro guscio esterno cedendo,
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 4 Le teorie della materia 3 Sommario 1. L atomo e la sua storia 2. Le «prove sperimentali» della teoria atomica 3. La teoria
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 4 Le teorie della materia 3 Sommario 1. L atomo e la sua storia 2. Le «prove sperimentali» della teoria atomica 3. La teoria
Programmazione di Dipartimento per Scienze Integrate Chimica Indirizzo Tecnico delle Costruzioni, Ambiente e Territorio Primo Biennio
 Programmazione di Dipartimento per Scienze Integrate Chimica Indirizzo Tecnico delle Costruzioni, Ambiente e Territorio Primo Biennio COMPETENZE Osservare, descrivere e analizzare fenomeni appartenenti
Programmazione di Dipartimento per Scienze Integrate Chimica Indirizzo Tecnico delle Costruzioni, Ambiente e Territorio Primo Biennio COMPETENZE Osservare, descrivere e analizzare fenomeni appartenenti
Programma svolto nell a.s
 ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: De Rosa Giovanna Classe: I Sez.:
ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: De Rosa Giovanna Classe: I Sez.:
Capitolo 2 La chimica della vita
 Capitolo 2 La chimica della vita Atomi e molecole 2.1 Le proprietà caratteristiche dei viventi si possono osservare a ogni livello della loro struttura gerarchica Le strutture biologiche hanno un organizzazione
Capitolo 2 La chimica della vita Atomi e molecole 2.1 Le proprietà caratteristiche dei viventi si possono osservare a ogni livello della loro struttura gerarchica Le strutture biologiche hanno un organizzazione
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni
 CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni composto materia sostanza pura miscela omogenea elemento eterogenea Elementi, Composti e Miscele Miscela eterogenea
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni composto materia sostanza pura miscela omogenea elemento eterogenea Elementi, Composti e Miscele Miscela eterogenea
Struttura dell'atomo a cura di Petr Ushakov
 Struttura dell'atomo a cura di Petr Ushakov Struttura dell'atomo Gli atomi di tutti gli elementi sono formati da tre tipi di particelle elementari: protone, neutrone e elettrone. particelle elementari
Struttura dell'atomo a cura di Petr Ushakov Struttura dell'atomo Gli atomi di tutti gli elementi sono formati da tre tipi di particelle elementari: protone, neutrone e elettrone. particelle elementari
N.I413R/4811D UNI EN ISO
 Anno scolastico 2013 / 2014 A Classe 1 Sezione A Indirizzo MECCANICA Materia SCIENZE INTEGRATE - CHIMICA Docente/i Nome e cognome Eugenio Famiglietti Nome e cognome Giorgio Laganà Firma Firma Mod. SGQ-MOD-06
Anno scolastico 2013 / 2014 A Classe 1 Sezione A Indirizzo MECCANICA Materia SCIENZE INTEGRATE - CHIMICA Docente/i Nome e cognome Eugenio Famiglietti Nome e cognome Giorgio Laganà Firma Firma Mod. SGQ-MOD-06
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Diametro del nucleo: m. Diametro dell atomo: m
 Diametro del nucleo: 10 15 m Diametro dell atomo: 10 9-10 10 m The nuclear atom Thomson (Premio Nobel per la Fisica nel 1907) scopre l elettrone nel 1897 Rutherford (Premio Nobel per la Chimica nel 1908)
Diametro del nucleo: 10 15 m Diametro dell atomo: 10 9-10 10 m The nuclear atom Thomson (Premio Nobel per la Fisica nel 1907) scopre l elettrone nel 1897 Rutherford (Premio Nobel per la Chimica nel 1908)
LEZIONE 1. Materia: Proprietà e Misura
 LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
CHIMICA GENERALE CON LABORATORIO ED ELEMENTI DI ORGANICA (12 CFU) STRUTTURA DEL CORSO
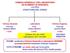 CHIMICA GENERALE CON LABORATORIO ED ELEMENTI DI ORGANICA (12 CFU) STRUTTURA DEL CORSO Chimica Generale Laboratorio Chimica Organica Prof.ssa Barbara Milani 7 CFU Prof. Tiziano Montini 2 CFU Lezione: 8/11
CHIMICA GENERALE CON LABORATORIO ED ELEMENTI DI ORGANICA (12 CFU) STRUTTURA DEL CORSO Chimica Generale Laboratorio Chimica Organica Prof.ssa Barbara Milani 7 CFU Prof. Tiziano Montini 2 CFU Lezione: 8/11
Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza?
 Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza? Fisicamente è impossibile contare gli atomi contenuti in una data quantita di sostanza. E impossibile
Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza? Fisicamente è impossibile contare gli atomi contenuti in una data quantita di sostanza. E impossibile
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia. Massa atomica MOLE. a.a.
 Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia Massa atomica MOLE a.a. 2016-17 MATERIA costituita da ATOMI Miscele OMOGENEE o soluzioni Hanno la
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia Massa atomica MOLE a.a. 2016-17 MATERIA costituita da ATOMI Miscele OMOGENEE o soluzioni Hanno la
C.I. CHIMICA-TECNOLOGIA DEI MATERIALI Modulo di Chimica. Lezione del 7 Marzo 2016
 C.I. CHIMICA-TECNOLOGIA DEI MATERIALI Modulo di Chimica Lezione del 7 Marzo 2016 Particelle Elementari Carica Massa SI (C) Atom. SI (kg) Atom. Protone 1.602x10-19 +1 1.673x10-27 1.0073 Neutrone 0 0 1.675x10-27
C.I. CHIMICA-TECNOLOGIA DEI MATERIALI Modulo di Chimica Lezione del 7 Marzo 2016 Particelle Elementari Carica Massa SI (C) Atom. SI (kg) Atom. Protone 1.602x10-19 +1 1.673x10-27 1.0073 Neutrone 0 0 1.675x10-27
Cos è un trasformazione chimica?
 Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
Elementi sistemati nella TAVOLA PERIODICA DEGLI ELEMENTI in base al numero atomico crescente O, H, N, C (+ del 96% della materia vivente)
 OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
Organizzazione della materia
 Organizzazione della materia Elementi: sostanze che non possono essere scisse in altre più semplici mediante reazioni chimiche ordinarie. Atomo: è la porzione più piccola di un elemento, formato da 3 particelle
Organizzazione della materia Elementi: sostanze che non possono essere scisse in altre più semplici mediante reazioni chimiche ordinarie. Atomo: è la porzione più piccola di un elemento, formato da 3 particelle
Sostanza pura. Il termine sostanza indica il tipo di materia di cui è fatto un corpo.
 Sostanza pura Il termine sostanza indica il tipo di materia di cui è fatto un corpo. Corpi formati da un unico tipo di materia sono costituiti da sostanze pure. Una sostanza pura ha composizione definita
Sostanza pura Il termine sostanza indica il tipo di materia di cui è fatto un corpo. Corpi formati da un unico tipo di materia sono costituiti da sostanze pure. Una sostanza pura ha composizione definita
CONFIGURAZIONE ELETTRONICA DEGLI ELEMENTI
 CONFIGURAZIONE ELETTRONICA DEGLI ELEMENTI SOSTANZE: ELEMENTI E COMPOSTI Si definisce sostanza la materia che ha sempre la stessa composizione. Ogni campione di una sostanza ha le stesse propietà chimiche
CONFIGURAZIONE ELETTRONICA DEGLI ELEMENTI SOSTANZE: ELEMENTI E COMPOSTI Si definisce sostanza la materia che ha sempre la stessa composizione. Ogni campione di una sostanza ha le stesse propietà chimiche
LE MOLECOLE DELLA VITA
 LE MOLECOLE DELLA VITA LE CELLULE SONO COSTITUITE DA ACQUA E BIOMOLECOLE Una biomolecola è un composto chimico che riveste un ruolo importante negli esseri viventi. Le molecole biologiche possono essere
LE MOLECOLE DELLA VITA LE CELLULE SONO COSTITUITE DA ACQUA E BIOMOLECOLE Una biomolecola è un composto chimico che riveste un ruolo importante negli esseri viventi. Le molecole biologiche possono essere
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni
 CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni Lavoisier e la legge di conservazione della massa Lavoisier riconobbe l importanza delle misurazioni accurate
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni Lavoisier e la legge di conservazione della massa Lavoisier riconobbe l importanza delle misurazioni accurate
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2
 ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
le reazioni chimiche
 le reazioni chimiche Una reazione (o equazione) chimica e una trasformazione di sostanze dette reagenti in altre sostanze dette prodotti. reagenti prodotti ESEMPI DI REAZIONI CHIMICHE: - ACETO + BICARBONATO
le reazioni chimiche Una reazione (o equazione) chimica e una trasformazione di sostanze dette reagenti in altre sostanze dette prodotti. reagenti prodotti ESEMPI DI REAZIONI CHIMICHE: - ACETO + BICARBONATO
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 4 Le teorie della materia 1. L atomo e la sua storia 2. Le «prove sperimentali» della teoria atomica 3. La teoria
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 4 Le teorie della materia 1. L atomo e la sua storia 2. Le «prove sperimentali» della teoria atomica 3. La teoria
Sommario della lezione 4. Proprietà periodiche. Massa atomica e massa molecolare. Concetto di mole. Prime esercitazioni
 Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
Olimpiadi di Chimica
 Olimpiadi di Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Massa atomica è la massa di un atomo espressa in unità di massa atomica (uma) Per definizione: 1 atomo 12 C pesa 12 uma
Olimpiadi di Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Massa atomica è la massa di un atomo espressa in unità di massa atomica (uma) Per definizione: 1 atomo 12 C pesa 12 uma
LICEO SCIENTIFICO STATALE GALILEO GALILEI. Siena PIANO DI LAVORO ANNO SCOLASTICO 2016/2017
 LICEO SCIENTIFICO STATALE GALILEO GALILEI Siena PIANO DI LAVORO ANNO SCOLASTICO 2016/2017 Docente: Da Pozzo Paola Classi: 1C, 1D e 1E Materia: Scienze naturali Contenuti di Scienze della Terra L Universo
LICEO SCIENTIFICO STATALE GALILEO GALILEI Siena PIANO DI LAVORO ANNO SCOLASTICO 2016/2017 Docente: Da Pozzo Paola Classi: 1C, 1D e 1E Materia: Scienze naturali Contenuti di Scienze della Terra L Universo
PROGRAMMAZIONE CONSUNTIVA Codice Mod. RQ 10.3 Pag 1/7
 I.T.C.S. ERASMO DA ROTTERDAM Liceo Artistico indirizzo Grafica - Liceo delle Scienze Umane opz. Economico sociale ITI Informatica e telecomunicazioni - ITI Costruzioni, ambiente e territorio Edile Elettronico
I.T.C.S. ERASMO DA ROTTERDAM Liceo Artistico indirizzo Grafica - Liceo delle Scienze Umane opz. Economico sociale ITI Informatica e telecomunicazioni - ITI Costruzioni, ambiente e territorio Edile Elettronico
Sostanza pura. Il termine sostanza indica il tipo di materia di cui è fatto un corpo.
 Sostanza pura Il termine sostanza indica il tipo di materia di cui è fatto un corpo. Corpi formati da un unico tipo di materia sono costituiti da sostanze pure. Una sostanza pura ha composizione definita
Sostanza pura Il termine sostanza indica il tipo di materia di cui è fatto un corpo. Corpi formati da un unico tipo di materia sono costituiti da sostanze pure. Una sostanza pura ha composizione definita
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
Laboratorio di Chimica Generale ed Inorganica. Lezione 3. Atomi ed elementi Unità di massa atomica Mole
 Laboratorio di Chimica Generale ed Inorganica Lezione 3 Atomi ed elementi Unità di massa atomica Mole Dott.ssa Lorenza Marvelli Dipartimento di Scienze Chimiche e Farmaceutiche Laboratorio di Chimica Generale
Laboratorio di Chimica Generale ed Inorganica Lezione 3 Atomi ed elementi Unità di massa atomica Mole Dott.ssa Lorenza Marvelli Dipartimento di Scienze Chimiche e Farmaceutiche Laboratorio di Chimica Generale
Trasformazioni fisiche e chimiche
 Trasformazioni fisiche e chimiche Le trasformazioni fisiche I passaggi di stato sono esempi di trasformazioni fisiche poiché la materia non cambia la sua composizione chimica, ma solo il suo stato fisico.
Trasformazioni fisiche e chimiche Le trasformazioni fisiche I passaggi di stato sono esempi di trasformazioni fisiche poiché la materia non cambia la sua composizione chimica, ma solo il suo stato fisico.
Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea.
 Le Miscele Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea. Se le proprietà sono uniformi, la miscela è una miscela omogenea
Le Miscele Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea. Se le proprietà sono uniformi, la miscela è una miscela omogenea
ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI
 ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI Nelle reazioni chimiche gli atomi reagenti non cambiano mai la loro natura ( nucleo ) ma la loro configurazione elettronica. Nello specifico ad interagire
ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI Nelle reazioni chimiche gli atomi reagenti non cambiano mai la loro natura ( nucleo ) ma la loro configurazione elettronica. Nello specifico ad interagire
Esercizi di stechiometria
 Esercizi di stechiometria La reazione globale da bilanciare) per ottenere il carbonato di sodio secondo il processo di Solvay è la seguente: Calcolare quanto cloruro di sodio NaCl) occorre per ottenere
Esercizi di stechiometria La reazione globale da bilanciare) per ottenere il carbonato di sodio secondo il processo di Solvay è la seguente: Calcolare quanto cloruro di sodio NaCl) occorre per ottenere
Testi Consigliati. I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli. Qualsiasi altro testo che tratti gli argomenti elencati nel programma
 Chimica Generale ed Inorganica Testi Consigliati I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli Chimica Organica Hart-Craine Introduzione alla Chimica Organica Zanichelli. Qualsiasi altro testo che
Chimica Generale ed Inorganica Testi Consigliati I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli Chimica Organica Hart-Craine Introduzione alla Chimica Organica Zanichelli. Qualsiasi altro testo che
