Calore, temperatura e passaggi di stato
|
|
|
- Romolo Ventura
- 8 anni fa
- Visualizzazioni
Transcript
1 Calore, temperatura e passaggi di stato Temperatura e calore sono due concetti molto simili, al punto tale che molto spesso vengono utilizzati come sinonimi. In realtà i due termini esprimono due concetti legati tra loro ma dal significato fisico molto diverso. Per illustrare i concetti che i due termini esprimono possiamo utilizzare una piccola esperienza, consideriamo due corpi di uguali dimensioni posti a contatto. Siano uno più caldo e uno più freddo: il corpo rosso è più caldo il corpo azzurro è più freddo Se prendiamo un termometro e misuriamo la temperatura otteniamo due valori diversi Dopo un certo intervallo di tempo il corpo caldo allora si raffredda e il corpo freddo si scalda, sino al punto in cui la situazione sarà di equilibrio, cioè: Se prendiamo un termometro e misuriamo la temperatura otteniamo due valori uguali. Che cosa è successo? Il termometro misura uno stato del corpo, infatti: all istante iniziale il termometro misura per i due corpi due valori diversi; successivamente, dopo che essi sono stati posti a contatto per un certo intervallo di tempo, rileva due valori uguali. Evidentemente si è verificato un stato un trasferimento di una grandezza. Questo trasferimento si è arrestato quando i corpi hanno la stessa temperatura, infatti il termometro non rileva nessuna variazione negli istanti successivi, pertanto non avviene alcun cambiamento. Il termometro, quindi, rileva un valore di stato del corpo che si può leggere su una scala graduata tale proprietà è la temperatura. La grandezza che si trasferisce da un corpo all altro invece è il calore. Possiamo ora definire calore e temperatura: Definizione: si definisce temperatura quella grandezza fisica che esprime lo stato termico di un corpo.
2 La temperatura è una proprietà intensiva, cioè una caratteristica di un sistema che non dipende dalle dimensioni o dalla quantità di materia del sistema(cioè da proprietà estensive). Definizione: il calore è la forma nella quale l'energia passa da un sistema fisico ad un altro a causa della differenza di temperatura. Tornando all esempio dei due corpi posti a contatto possiamo dare la seguente definizione. Definizione: si definisce equilibrio termico tra due o più corpi lo stato in cui i corpi a contatto raggiungono uno stato in cui non avvengono più cambiamenti, cioè in cui non avviene più trasferimento di calore. Riportiamo ora un enunciato basato sull'osservazione più che sulla teoria. Principio zero della termodinamica: se due corpi A e B, sono in equilibrio termico con un terzo corpo C allora anche i corpi A e B sono in equilibrio termico tra loro. Il termometro Per misurare la temperatura è necessario un termometro, strumento che sfrutta l equilibrio termico associato a misurazione della dilatazione termica subita dai corpi. Il convenzionale termometro a mercurio misura la variazione di volume del mercurio posto in un capillare di vetro, quando viene messo in contatto termico con il corpo di temperatura ignota. L'allungamento della colonna di mercurio è proporzionale alla temperatura del corpo. Il termometro a mercurio viene attribuito a Gabriel Fahrenheit che introdusse nel 1714 la scala di temperature in uso ancora oggi, mentre la scala centigrada si deve a Anders Celsius nel Come costruire la scala di un termometro Per "tarare" le scale in entrambi i casi si sono utilizzati gli stessi due punti di calibrazione, la temperatura di congelamento e di ebollizione dell acqua (alla pressione di 1 atmosfera). La scala Celsius associa ai due punti le temperature di 0 e 100 mentre la Fahrenheit 32 e 212. La scala viene poi suddivisa in modo da avere la misura della temperature tra i due punti di calibrazione.per temperature maggiori di quella di ebollizione o minori del punto di congelamento dell acqua, si estendono le numerazioni (in scala) oltre i due punti di riferimento.
3 Taratura del termometro a zero gradi centigradi Taratura del termometro a 100 gradi centigradi Il classico termometro Quindi possiamo concludere che: la temperatura misura uno stato di un corpo; il calore è una forma di energia; temperatura e calore sono legati tra loro; ad un determinato calore di un corpo corrisponde una ben precisa temperatura. Pertanto temperatura ed energia sono legati tra oro, ma non rappresentano lo stesso concetto.
4 Le scale di misura della temperatura Con il metodo indicato in precedenza è possibile tarare il termometro, tuttavia vi sono più scale della temperatura che assegnano ai punti di riferimento indicati in precedenza valori diversi. Vediamo come passare da una rappresentazione all altra. Scala Celsius La scala Celsius delle temperature è progettata perché il punto di congelamento dell'acqua sia a 0 gradi e il punto di ebollizione a 100 gradi, entrambi alla pressione atmosferica standard. Poiché ci sono cento divisioni tra questi due punti di riferimento, il termine di riferimento per questo sistema è il grado centigrado o centesimale. Scala Farenheit Fahrenheit è una scala di temperatura proposta dal fisico tedesco Gabriel Fahrenheit, tutt'ora in uso negli Stati Uniti d'america e in Giamaica. In questa scala il punto di congelamento dell'acqua è di 32 gradi Fahrenheit, mentre il punto di ebollizione si trova a 212 gradi, si suddividono poi i due estremi in 180 gradi. Scala Kelvin o scala assoluta Lo zero assoluto è la temperatura più bassa che teoricamente si possa ottenere e corrisponde a 0 Kelvin, cioè 273,1 C. Si può mostrare con le leggi della termodinamica che la temperatura non può mai essere esattamente pari allo zero assoluto, anche se è possibile raggiungere temperature molto prossime ad esso. Allo zero assoluto le molecole e gli atomi di un sistema possiedono il minor quantitativo possibile di energia cinetica, cioè ovvero il più basso livello di energia cui possono giungere. L'impossibilità di raggiungere lo zero assoluto è una conseguenza del secondo principio della termodinamica (che vedremo nel capitolo successivo) che normalmente è espresso come la proprietà dell'entropia di un sistema chiuso di non poter mai diminuire. Per illustrare meglio il significato di cosa rappresenti lo zero assoluto bisogna tener presente che la temperatura è legata alla misura dell'energia interna di un corpo, intesa come somma di energia cinetica e potenziale. Raggiungere lo zero assoluto significherebbe quindi riuscire ad annullare l'energia cinetica delle molecole che compongono il corpo. In questo stato le molecole che lo compongono si fermano completamente (anche nel loro moto oscillatorio rispetto al posizione di equilibrio) e la temperatura è la più bassa possibile: questa temperatura si chiama zero assoluto.
5 A temperature molto basse, prossime allo zero assoluto, la materia esibisce molte proprietà inusuali, quali la superconduttività (che vedremo in seguito in relazione al passaggio di corrente elettrica nei conduttori). Gli scienziati mediante l'uso di speciali macchine termiche sono riusciti a portare un corpo ad un solo milionesimo di C dallo zero assoluto Al 200, la temperatura più bassa mai 10 ottenuta è stata di 4, 10 K, conseguita al MIT (Massachusetts Institute of Technology). La Nebulosa Boomerang è stata recentemente scoperta come il posto più freddo conosciuto, al di fuori dei laboratori, con una temperatura di soli 272 C (1 K). La nebulosa è a.000 anni luce dalla Terra (nella costellazione del Centauro). Si noti come l'esistenza di un limite inferiore della temperatura non implichi l'esistenza di una temperatura massima raggiungibile. Infatti non essendoci limite superiore all'energia cinetica non c'è limite superiore alla temperatura. Riportiamo una tabella con alcune curiosità meteorologiche riguardanti temperature estreme. La temperatura più alta registrata sulla Terra. Al-'Aziziyah, Libia Il 13 settembre 1922 la colonnina di mercurio raggiunse 7,8 C. La temperatura più bassa registrata sulla Terra. Vostok, Antartide Presso la stazione russa di Vostok il 21 luglio 1983 viene registrata la temperatura esterna di - 89, C. Fonte: Nello spazio cosmico ci sono molte componenti che possono depositare energia scaldando un corpo. Considerando invece una porzione di spazio, la temperatura equivalente dovuta alle diverse componenti radiative o particellari si può affermare che essa sia compresa tra i 3 e i gradi Kelvin ovvero tra 270 e 268 gradi centigradi. Fonte:
6 Tabella di conversione delle temperature Conversione da a formula Celsius Farenheit F = C 1, celsius Kelvin K = C + 273, 1 Farenheit Celsius ( F 32) C = Farenheit Kelvin ( F + 49,67) K = Kelvin Celsius C = K 273, 1 Kelvin Farenheit F = ( K 1,8 ) 49, 67 1,8 1,8 Il calore è una forma di energia, in particolare esso è energia termica. Quindi il trasferimento di calore implica un trasferimento di energia termica. Il flusso di calore, o in maniera equivalente di energia, non viene misurato per motivazioni storiche in joule, unità di misura dell energia, bensì utilizzando la kilocaloria (kcal), definita come segue: Definizione: si definisce kilocaloria la quantità di calore che si deve fornire ad un litro d acqua per innalzare la temperatura di 1 C da 14, C a 1, C. Tale definizione può essere formulata utilizzando anche i grammi, ricordando che 1 litro d acqua equivale ad una massa di 1 kg, si ha Definizione: si definisce caloria la quantità di calore che si deve fornire ad un grammo d acqua per innalzare la temperatura di 1 C da 14, C a 1, C. Osservazione: la kcal è l unità di misura utilizzata per esprimere il valore energetico degli alimenti. Dal punto di vista microscopico, fornire calore ad una sostanza significa aumentare il moto di agitazione termica delle particelle che lo compongono, pertanto si aumenta in questo modo l energia cinetica media del corpo. Tale moto di agitazione termica è caratteristico di ogni sostanza, cioè se forniamo la stessa quantità di calore a due sostanze diverse, a causa dei differenti legami di coesione molecolare delle due sostanze, in generale si ha che la temperatura nei due corpi non aumenta nella stessa misura.
7 Si ha inoltre che la quantità di calore necessaria per far variare la temperatura di una sostanza è in relazione di proporzionalità diretta con la massa m della sostanza (ovvio, più sostanza ho, più deve essere il calore fornito per farne aumentare la temperatura). Quindi per far aumentare la temperatura ( t) di una certa sostanza avente massa m è necessaria una quantità di calore Q Cioè Q direttamente proporzionale m T Inoltre è necessario tener presente i legami di coesione molecolare caratteristico della sostanza per aumentare l energia cinetica delle particelle, quindi Q = mc T Dove c è il calore specifico della sostanza, costante di proporzionalità propria del materiale che si considera e che descrive la relazione della struttura molecolare. Definizione: si definisce calore specifico di una sostanza la quantità di calore necessaria per aumentare di 1 kelvin la temperatura di un'unità di massa della sostanza. Osservazione Dalla relazione precedente si deduce che Q c = m T quindi kg K kg K Q kcal J [ c ] = = = m T L aumentare del calore specifico per una sostanza richiede una maggiore quantità di calore per far aumentare la temperatura del materiale. Osservazioni Quindi se una sostanza che ha calore specifico elevato e si trova ad una alta temperatura significa che ha immagazzinato una grande quantità di calore. Ad esempio l acqua ha calore specifico elevato, quando si beve un caffè è possibile scottarsi in quanto la quantità di calore accumulata è notevole.
8 Calore specifico di alcune comuni sostanze Sostanza Stato Calore specifico J kg K Alluminio solido 880 Acqua liquido 4186 Acqua Ghiaccio solido (0 C) 2260 Aria (secca) gassoso 100 Azoto gassoso 1042 Diamante solido 02 Elio gassoso 190 Ferro solido 444 Grafite solido 720 Idrogeno gassoso Litio solido 382 Mercurio liquido 139 Olio liquido 2000 Ossigeno gassoso 920 Oro solido 129 Ottone solido 377 Piombo solido 130 Rame solido 38 Per determinare il valore del calore specifico per una sostanza si utilizza il calorimetro delle mescolanze, strumento (isolato termicamente dall esterno) in grado di misurare scambi di calore tra sostanze e nei vari passaggi di stato.
9 La temperatura di equilibrio Dati due corpi m 1,m2 a temperature diverse t 1 < t2, una volta posti a contatto modificano il loro stato sino a giungere all equilibrio, cioè quella situazione in cui hanno la stessa temperatura. Però tale temperatura dipende oltre che dalle temperature iniziali anche dalle masse dei due corpi, infatti se un corpo ha massa 10 kg e l altro ha mass 10 grammi è evidente che si dovrà tener presente anche di questo dato. Inoltre si deve tener conto del calore specifico, cioè del modo in cui si lascia attraversare dal calore. Allora il fatto che il calore acquistato da una sostanza è pari al calore ceduto dall altra, si avrà Q Q 1 = m1c1 t 1 2 m2c2 t2 cioè: m = Q1 = Q2 1c1 t1 = m2c2 t2 Possiamo indicare la temperatura di equilibrio con t eq, quindi: t1 = teq t1 > t2 = teq t2 < 0 0 Allora sostituendo si ha: m ( t t ) = m c ( t ) 1c1 eq eq t2 m 1c1t eq m1c1t1 = m2c2teq + m2c2t2 m 1c1t eq + m2c2teq = m1c1t1 + m2c2t2 ( m1c1 + m2c2 ) = m1c1t1 m2c2t 2 t eq + m c t t eq = m1c1 + + m2c2t m c Che rappresenta la formula per determinare la temperatura di equilibrio tra due corpi di masse m 1,m 2 di diverso materiale, aventi temperature diverse Osservazione Se i due corpi posti a contatto sono costituiti dallo stesso materiale, la formula diventa: m t 1 1 t eq = m1 + + m2t m 2 2
10 Equivalenza tra calore ed energia Se utilizziamo un trapano per perforare una parete di cemento armato, notiamo che dopo un certo intervallo di tempo la punta si surriscalda a tal punto che, se versiamo dell acqua per raffreddarla, in situazioni in cui il carico di lavoro sia pesante, parte del liquido evapora quando viene a contatto con il metallo. Non essendovi presenza di fuoco, ed avendo un passaggio di stato, viene trasferito del calore che deve essere generato dall attrito causato dal moto rotatorio del trapano sul muro. A stabilire l esatta corrispondenza tra calore ed energia fu James Joule che tramite un esperienza riuscì a quantificare il rapporto tra le due quantità. Con questa esperienza Joule determinò l'equivalente meccanico del calore: 1 kcal = 4186J oppure 1 cal = 4, 186J Cioè servono 4186J di lavoro meccanico per aumentare la temperatura di 1 kg di acqua di un grado. Cambiamenti di stato Gli stati in cui possiamo trovare la materia sono tre: solido, liquido, aeriforme. I tre diversi momenti sono caratterizzati da diversi stati di aggregazione delle molecole. Nel caso dei solidi le molecole della materia sono vincolate ad occupare una regione di spazio ben definita. Possono oscillare attorno ad un punto, rimanendo sempre nella regione di spazio cui sono legate. La struttura che caratterizza questo stato della materia è quindi costituita da molecole che non possono muoversi liberamente nello spazio circostante ma sono vincolate ad una disposizione e a posizioni pressoché fisse. Nel caso di un liquido i legami molecolari sono meno forti rispetto al caso precedente, infatti le molecole si possono muovere con più libertà, non dovendo occupare una posizione fissa. Infatti un liquido assume la forma del recipiente che lo contiene, fatto irrealizzabile se le molecole occupassero posizioni vincolate, come nel caso dei solidi. Le molecole presentano in questo stato una forza di coesione meno forte dei solidi, ma tale da tenerle vincolate in modo che esse non possano muoversi indipendentemente le une dalle altre. Nello stato aeriforme infine i legami molecolari sono molto deboli che le molecole possono distanziarsi tra loro e occupare qualunque posizione dello spazio senza particolari legami con le altre particelle. La posizione di ogni singola molecola dipende dalle condizioni iniziali del moto aeriforme, dalle interazioni con l ambiente (dove con ambiente si intende le eventuali interazioni con altre molecole, come gli urti, oppure l azione di forze esterne).
11 La temperatura in cui avviene una trasformazione ha un nome che la contraddistingue, la seguente tabella riassume le possibili combinazioni stato iniziale cambiamento si stato stato finale 1 Solido Fusione liquido 2 Solido Sublimazione aeriforme 3 Liquido Solidificazione solido 4 Liquido Vaporizzazione aeriforme Aeriforme Condensazione Liquido 6 Aeriforme Brinamento solido Per quanto riguarda la vaporizzazione essa può avvenire secondo due modalità: evaporazione: un processo lento che interessa solo gli strati superficiali del liquido, in quanto essi hanno legami molecolari più deboli con la parte restante della sostanza; ebollizione: un processo rapido, che avviene ad un temperatura ben determinata (in genere ma non sempre causato dall aumento del calore fornito alla sostanza). Schema dei passaggi di stato brinamento solidificazione condensazione solido liquido aeriforme fusione vaporizzazione Il calore latente sublimazione Quando si fornisce (o si sottrae) calore ad un oggetto esso risponde alla sollecitazione aumentando (o diminuendo) la sua temperatura. Vi sono tuttavia delle situazioni in cui pur fornendo (o sottraendo) calore il corpo non aumenta (o diminuisce) la temperatura. Cosa accade allora se la temperatura rimane costante ma vi è un trasferimento di calore? Semplicemente il corpo si trova in un punto in cui sta cambiando stato e il calore che viene fornito serve per poter passare da uno stato di aggregazione della materia all altro.
12 Soltanto quando tutta la sostanza è passata di stato, continuando a fornire calore, la temperature riprende a salire. Ad esempio se riscaldiamo una massa d acqua, essa aumenterà la sua temperatura sino a 100 C, successivamente se forniamo ancora calore la temperatura rimane costante ma l acqua inizia ad evaporare, soltanto quando tutta l acqua è evaporata e si continua a fornire calore, la temperatura del gas (vapore acqueo) inizia di nuovo ad aumentare. Il calore necessario per far passare di stato una determinata sostanza è detto calore latente. Definizione: il calore latente λ è la quantità di energia necessaria per ottenere un cambiamento di fase per una massa di 1 kg di una sostanza. Quindi il calore latente per ottenere un cambiamento di stato per una massa m di una certa sostanza è Q = mλ Calore latente e temperatura al cambio di stato di sostanze comuni alla pressione atmosferica Sostanza Cal. latente di fusione J kg T di fusione C Cal. latente di vaporizzazione J kg T di ebollizione C Alcool etilico , Idrogeno 0, , Azoto 0, Ossigeno Mercurio Acqua Oro 0, , , , , , , , Come si vede dalla tabella ogni sostanza ha due calori latenti uno per la fusione, uno per l ebollizione.
13 La definizione e la formula Q = mλ per il calore latente non contengono riferimenti a variazioni di temperatura, infatti durante un passaggio di stato si ha che la temperatura rimane costante e il calore fornito viene utilizzato per modificare i legami tra le molecole. Pertanto il calore latente non dipende dalla temperatura, in quanto un passaggio di stato avviene soltanto ad una temperatura ben precisa che dipende dalla sostanza. Se non si arriva a tale temperatura non ha senso parlare di calore latente. Pertanto il calore latente, una volta arrivati alla temperatura di un passaggio si stato, dipende soltanto dalla natura del materiale e dalla sua massa. Osservazione Nel passaggio di stato liquido solido si ha una diminuzione di volume (poiché le particelle tendono ad avvicinarsi). L unica eccezione è l acqua che solidificandosi aumenta il proprio volume Osservazione (utile per gli esercizi) Se si deve innalzare la temperatura di un corpo si utilizza l equazione Q = mc T Se si deve far cambiare di stato un corpo si utilizza l equazione Q = mλ. Posti due corpi a contatto il calore acquistato da una sostanza è pari al calore ceduto dall altra. Data una massa m, per portarla da una temperatura t 1 ad una temperatura t 2 e se tra t 1 e t 2 vi è una temperatura t in cui la sostanza cambia di stato, è necessario: calcolare la quantità di calore per portare la sostanza dalla temperatura t 1 alla temperatura t calcolare la quantità di calore latente per far cambiare di stato la sostanza calcolare la quantità di calore per portare la sostanza dalla temperatura t alla temperatura t 2 Analoghe osservazioni nel caso in cui si sottragga calore ad un corpo, cioè gli si fa diminuire la temperatura. Osservazione Data una sostanza s il calore latente di fusione corrisponde con il calore latente di solidificazione, cioè la quantità di calore che si deve fornire per farlo fondere è uguale alla quantità di calore che gli si deve togliere per farlo solidificare. Analogamente Data una sostanza s il calore latente di vaporizzazione corrisponde con il calore latente di condensazione, cioè la quantità di calore che si deve fornire per farlo vaporizzare è uguale alla quantità di calore che gli si deve togliere per farlo condensare.
14 Trasmissione nel calore La trasmissione del calore può avvenire in modo naturale, cioè senza spendere energia, sia forzatamente, cioè compiendo lavoro. Nel primo caso si ha un trasferimento da un ambiente (o da un corpo) a temperatura maggiore ad uno a temperatura minore. Nel secondo caso invece si trasferisce calore da un ambiente(o da un corpo) a temperatura minore ad un altro avente temperatura maggiore. E necessario quindi svolgere un lavoro per riuscire a compiere questo tipo di trasferimento, si può pensare ad esempio al lavoro svolto da un condizionatore d estate per abbassare la temperatura di una stanza: compie un lavoro (consumando energia elettrica) per trasferire calore dall interno all esterno. La trasmissione naturale del calore può avvenire in tre modi: conduzione convezione irraggiamento La conduzione è la trasmissione del calore che avviene per contatto tra due corpi aventi temperatura diverse. Essa è caratteristica dei corpi solidi. Tale passaggio avviene a causa degli scambi di energia a livello molecolare tra le particelle adiacenti delle superfici a contatto. I materiali si suddividono in due categorie, la cui causa è la struttura molecolare dell oggetto: conduttori termici : sostanze che si lasciano attraversare dal calore isolanti termici: sostanze che non si lasciano attraversare dal colore, bloccando il flusso di calore. La convezione consiste nelle scambio di calore per un fluido(gas o liquido) quando entra in contatto con un corpo la cui temperatura è maggiore di quella del fluido stesso. Aumentando di temperatura, il fluido a contatto con l'oggetto si espande e diminuisce di densità, generando moti convettivi, cioè il fluido a temperatura maggiore (e densità minore) sale e il fluido a temperatura minore (e densità maggiore) scende verso il basso. Una volta che il fluido sceso si riscalda sale di nuovo verso l alto generando un moto interno del fluido, detto appunto convettivo. Il moto convettivo è un moto macroscopico. Osservazione
15 La brezza marina è una conseguenza di un moto convettivo dell aria: scambio di calore tra l aria più fredda a contatto con l acqua e gli strati più alti di aria calda. L esempio classico di moto convettivo consiste nell acqua posta su una sorgente di calore. La parte dell acqua vicina alla sorgente si riscalda ed essendo più calda (e meno densa) risale, allora l acqua più fredda degli strati superficiali scende. Essa a sua volta si riscalda e risale prendendo il posto degli strati d acqua calda saliti in precedenza. Si instaura così un moto d acqua i cui flussi vengono detti correnti convettive. L irraggiamento consiste in una forma di trasmissione del calore che non richiede contatto diretto tra le sostanze tra cui avviene il flusso termico. Non necessita nemmeno di un mezzo per propagarsi, infatti questa è la modalità di trasferimento di tra il Sole e la Terra. Secondo questo processo il trasferimento di calore avviene sotto forma di onde elettromagnetiche, per cui il calore può propagarsi anche nel vuoto e non solo attraverso la materia. Un onda infatti trasporta energia. Osservazione L irraggiamento avviene dal corpo a temperatura maggiore a quello a temperatura minore, in realtà, l energia si propaga in entrambe le direzioni ma con minore intensità da quello freddo a quello
16 caldo. Infatti, se un corpo emanasse soltanto e non assorbisse mai energia elettromagnetica la sua temperatura raggiungerebbe lo zero assoluto che rappresenta un valore ideale. Irraggiamento solare L emissione e l assorbimento dipendono dalla natura del corpo e da alcune caratteristiche della sua superficie: un corpo avente una superficie scura è un buon assorbitore. Un esempio di irraggiamento, oltre ai raggi solari, è rappresentato dall azione di scaldarsi nelle vicinanze di un fuoco: la combustione emette radiazioni infrarosse responsabili dell azione riscaldante. La pelle è composta in gran parte d acqua le cui molecole hanno frequenza di vibrazione estremamente simile alla frequenza delle radiazioni infrarosse, per cui la pelle è particolarmente sensibile a tale sollecitazione, assorbendo l energia delle onde. Tale fenomeno è detto assorbimento per risonanza.
Termologia. Introduzione Scale Termometriche Espansione termica Capacità termica e calori specifici Cambiamenti di fase e calori latenti
 Termologia Introduzione Scale Termometriche Espansione termica Capacità termica e calori specifici Cambiamenti di fase e calori latenti Trasmissione del calore Legge di Wien Legge di Stefan-Boltzmann Gas
Termologia Introduzione Scale Termometriche Espansione termica Capacità termica e calori specifici Cambiamenti di fase e calori latenti Trasmissione del calore Legge di Wien Legge di Stefan-Boltzmann Gas
Temperatura e Calore
 Temperatura e Calore La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero
Temperatura e Calore La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero
CALORE. Compie lavoro. Il calore è energia. Temperatura e calore. L energia è la capacità di un corpo di compiere un lavoro
 Cos è il calore? Per rispondere si osservino le seguenti immagini Temperatura e calore Il calore del termosifone fa girare una girandola Il calore del termosifone fa scoppiare un palloncino Il calore del
Cos è il calore? Per rispondere si osservino le seguenti immagini Temperatura e calore Il calore del termosifone fa girare una girandola Il calore del termosifone fa scoppiare un palloncino Il calore del
Temperatura e Calore
 Temperatura e Calore 1 Temperatura e Calore Stati di Aggregazione Temperatura Scale Termometriche Dilatazione Termica Il Calore L Equilibrio Termico La Propagazione del Calore I Passaggi di Stato 2 Gli
Temperatura e Calore 1 Temperatura e Calore Stati di Aggregazione Temperatura Scale Termometriche Dilatazione Termica Il Calore L Equilibrio Termico La Propagazione del Calore I Passaggi di Stato 2 Gli
Temperatura. V(t) = Vo (1+at) Strumento di misura: termometro
 I FENOMENI TERMICI Temperatura Calore Trasformazioni termodinamiche Gas perfetti Temperatura assoluta Gas reali Principi della Termodinamica Trasmissione del calore Termoregolazione del corpo umano Temperatura
I FENOMENI TERMICI Temperatura Calore Trasformazioni termodinamiche Gas perfetti Temperatura assoluta Gas reali Principi della Termodinamica Trasmissione del calore Termoregolazione del corpo umano Temperatura
È una grandezza fisica FONDAMENTALE, SCALARE UNITÀ DI MISURA NEL S.I. : K (KELVIN)
 È una grandezza fisica FONDAMENTALE, SCALARE UNITÀ DI MISURA NEL S.I. : K (KELVIN) È STRETTAMENTE LEGATA ALLA VELOCITÀ DI VIBRAZIONE DELLE MOLECOLE IN UN CORPO: SE LA TEMPERATURA DI UN CORPO AUMENTA LE
È una grandezza fisica FONDAMENTALE, SCALARE UNITÀ DI MISURA NEL S.I. : K (KELVIN) È STRETTAMENTE LEGATA ALLA VELOCITÀ DI VIBRAZIONE DELLE MOLECOLE IN UN CORPO: SE LA TEMPERATURA DI UN CORPO AUMENTA LE
Ripasso sulla temperatura, i gas perfetti e il calore
 Ripasso sulla temperatura, i gas perfetti e il calore Prof. Daniele Ippolito Liceo Scientifico Amedeo di Savoia di Pistoia La temperatura Fenomeni non interpretabili con le leggi della meccanica Dilatazione
Ripasso sulla temperatura, i gas perfetti e il calore Prof. Daniele Ippolito Liceo Scientifico Amedeo di Savoia di Pistoia La temperatura Fenomeni non interpretabili con le leggi della meccanica Dilatazione
Termodinamica: legge zero e temperatura
 Termodinamica: legge zero e temperatura Affrontiamo ora lo studio della termodinamica che prende in esame l analisi dell energia termica dei sistemi e di come tale energia possa essere scambiata, assorbita
Termodinamica: legge zero e temperatura Affrontiamo ora lo studio della termodinamica che prende in esame l analisi dell energia termica dei sistemi e di come tale energia possa essere scambiata, assorbita
Calore e temperatura. Calore e temperatura. Cos'è il calore? Il calore si chiama anche energia termica.
 sono due cose diverse (in scienze si dice sono due grandezze diverse). 01.1 Cos'è il calore? Per spiegare cos è il calore facciamo degli esempi. Esempi: quando ci avviciniamo o tocchiamo un oggetto caldo
sono due cose diverse (in scienze si dice sono due grandezze diverse). 01.1 Cos'è il calore? Per spiegare cos è il calore facciamo degli esempi. Esempi: quando ci avviciniamo o tocchiamo un oggetto caldo
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
La materia. La materia è ogni cosa che occupa uno spazio (e possiamo percepire con i nostri sensi).
 La materia La materia è ogni cosa che occupa uno spazio (e possiamo percepire con i nostri sensi). Essa è costituita da sostanze, ciascuna delle quali è formata da un determinato tipo di particelle piccolissime,
La materia La materia è ogni cosa che occupa uno spazio (e possiamo percepire con i nostri sensi). Essa è costituita da sostanze, ciascuna delle quali è formata da un determinato tipo di particelle piccolissime,
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti.
 Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
LA TERMOLOGIA. studia le variazioni di dimensione di un corpo a causa di una
 LA TERMOLOGIA La termologia è la parte della fisica che si occupa dello studio del calore e dei fenomeni legati alle variazioni di temperatura subite dai corpi. Essa si può distinguere in: Termometria
LA TERMOLOGIA La termologia è la parte della fisica che si occupa dello studio del calore e dei fenomeni legati alle variazioni di temperatura subite dai corpi. Essa si può distinguere in: Termometria
Sono state usate altre scale ma sono tutte in disuso (Reamur e Rankine ad esempio).
 Le scale termometriche (UbiMath) - 1 Scale termometriche La temperatura di un corpo non dipende dalle nostre sensazioni. Le sensazioni di caldo e freddo dipendono dal calore che i vari oggetti scambiano
Le scale termometriche (UbiMath) - 1 Scale termometriche La temperatura di un corpo non dipende dalle nostre sensazioni. Le sensazioni di caldo e freddo dipendono dal calore che i vari oggetti scambiano
I FENOMENI TERMICI. I fenomeni termici Fisica Medica Lauree triennali nelle Professioni Sanitarie. P.Montagna ott-07. pag.1
 I FENOMENI TERMICI Temperatura Calore Trasformazioni termodinamiche Gas perfetti Temperatura assoluta Gas reali Principi della Termodinamica Trasmissione del calore Termoregolazione del corpo umano pag.1
I FENOMENI TERMICI Temperatura Calore Trasformazioni termodinamiche Gas perfetti Temperatura assoluta Gas reali Principi della Termodinamica Trasmissione del calore Termoregolazione del corpo umano pag.1
PROGRAMMA OPERATIVO NAZIONALE
 PROGRAMMA OPERATIVO NAZIONALE Fondo Sociale Europeo "Competenze per lo Sviluppo" Obiettivo C-Azione C1: Dall esperienza alla legge: la Fisica in Laboratorio Termodinamica I FENOMENI TERMICI Temperatura
PROGRAMMA OPERATIVO NAZIONALE Fondo Sociale Europeo "Competenze per lo Sviluppo" Obiettivo C-Azione C1: Dall esperienza alla legge: la Fisica in Laboratorio Termodinamica I FENOMENI TERMICI Temperatura
TERMOMETRIA E PROCESSI TERMICI
 TERMOMETRIA E PROCESSI TERMICI SISTEMA parte di materia e/o spazio, idealmente isolata, su cui si concentra ntra l attenzione dell osservatore AMBIENTE ESTERNO tutto ciò che sta al di fuori, ma pur sempre
TERMOMETRIA E PROCESSI TERMICI SISTEMA parte di materia e/o spazio, idealmente isolata, su cui si concentra ntra l attenzione dell osservatore AMBIENTE ESTERNO tutto ciò che sta al di fuori, ma pur sempre
Esercitazione IX - Calorimetria
 Esercitazione IX - Calorimetria Esercizio 1 Un blocco di rame di massa m Cu = 5g si trova a una temperatura iniziale T i = 25 C. Al blocco viene fornito un calore Q = 120J. Determinare la temperatura finale
Esercitazione IX - Calorimetria Esercizio 1 Un blocco di rame di massa m Cu = 5g si trova a una temperatura iniziale T i = 25 C. Al blocco viene fornito un calore Q = 120J. Determinare la temperatura finale
Termodinamica. Sistema termodinamico. Piano di Clapeyron. Sistema termodinamico. Esempio. Cosa è la termodinamica? TERMODINAMICA
 Termodinamica TERMODINAMICA Cosa è la termodinamica? La termodinamica studia la conversione del calore in lavoro meccanico Prof Crosetto Silvio 2 Prof Crosetto Silvio Il motore dell automobile trasforma
Termodinamica TERMODINAMICA Cosa è la termodinamica? La termodinamica studia la conversione del calore in lavoro meccanico Prof Crosetto Silvio 2 Prof Crosetto Silvio Il motore dell automobile trasforma
quale agisce una forza e viceversa. situazioni. applicate a due corpi che interagiscono. Determinare la forza centripeta di un
 CLASSE Seconda DISCIPLINA Fisica ORE SETTIMANALI 3 TIPO DI PROVA PER GIUDIZIO SOSPESO Test a risposta multipla MODULO U.D Conoscenze Abilità Competenze Enunciato del primo principio della Calcolare l accelerazione
CLASSE Seconda DISCIPLINA Fisica ORE SETTIMANALI 3 TIPO DI PROVA PER GIUDIZIO SOSPESO Test a risposta multipla MODULO U.D Conoscenze Abilità Competenze Enunciato del primo principio della Calcolare l accelerazione
Si classifica come una grandezza intensiva
 CAP 13: MISURE DI TEMPERATURA La temperatura È osservata attraverso gli effetti che provoca nelle sostanze e negli oggetti Si classifica come una grandezza intensiva Può essere considerata una stima del
CAP 13: MISURE DI TEMPERATURA La temperatura È osservata attraverso gli effetti che provoca nelle sostanze e negli oggetti Si classifica come una grandezza intensiva Può essere considerata una stima del
PRINCIPI DI TRASMISSIONE DEL CALORE
 PRINCIPI DI TRASMISSIONE DEL CALORE La trasmissione del calore può avvenire attraverso tre meccanismi: - Conduzione; - Convezione; - Irraggiamento; Nella conduzione la trasmissione del calore è riconducibile
PRINCIPI DI TRASMISSIONE DEL CALORE La trasmissione del calore può avvenire attraverso tre meccanismi: - Conduzione; - Convezione; - Irraggiamento; Nella conduzione la trasmissione del calore è riconducibile
Preparazione alle gare di II livello delle Olimpiadi della Fisica 2013
 Preparazione alle gare di II livello delle Olimpiadi della Fisica 01 Incontro su temi di termodinamica 14/1/01 Giuseppina Rinaudo - Dipartimento di Fisica dell Università di Torino Sommario dei quesiti
Preparazione alle gare di II livello delle Olimpiadi della Fisica 01 Incontro su temi di termodinamica 14/1/01 Giuseppina Rinaudo - Dipartimento di Fisica dell Università di Torino Sommario dei quesiti
Complementi di Termologia. I parte
 Prof. Michele Giugliano (Dicembre 2) Complementi di Termologia. I parte N.. - Calorimetria. Il calore è una forma di energia, quindi la sua unità di misura, nel sistema SI, è il joule (J), tuttavia si
Prof. Michele Giugliano (Dicembre 2) Complementi di Termologia. I parte N.. - Calorimetria. Il calore è una forma di energia, quindi la sua unità di misura, nel sistema SI, è il joule (J), tuttavia si
GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato gassoso
 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
Ripetizioni Cagliari di Manuele Atzeni - 3497702002 - info@ripetizionicagliari.it
 Calorimetria: soluzioni Problema di: Calorimetria - Q0001 Problema di: Calorimetria - Q0002 Scheda 8 Ripetizioni Cagliari di Manuele Atzeni - 3497702002 - info@ripetizionicagliari.it Testo [Q0001] Quanta
Calorimetria: soluzioni Problema di: Calorimetria - Q0001 Problema di: Calorimetria - Q0002 Scheda 8 Ripetizioni Cagliari di Manuele Atzeni - 3497702002 - info@ripetizionicagliari.it Testo [Q0001] Quanta
Stati di aggregazione della materia unità 2, modulo A del libro
 Stati di aggregazione della materia unità 2, modulo A del libro Gli stati di aggregazione della materia sono tre: solido, liquido e gassoso, e sono caratterizzati dalle seguenti grandezze: Quantità --->
Stati di aggregazione della materia unità 2, modulo A del libro Gli stati di aggregazione della materia sono tre: solido, liquido e gassoso, e sono caratterizzati dalle seguenti grandezze: Quantità --->
13 La temperatura - 8. Il gas perfetto
 La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
Il vetro e l isolamento termico Scambi termici
 Scambi termici Una parete vetrata separa generalmente due ambienti di diversa temperatura. Come per qualsiasi altro tipo di parete, anche attraverso il vetro ha luogo uno scambio dall'ambiente più caldo
Scambi termici Una parete vetrata separa generalmente due ambienti di diversa temperatura. Come per qualsiasi altro tipo di parete, anche attraverso il vetro ha luogo uno scambio dall'ambiente più caldo
Capitolo 2 Le trasformazioni fisiche della materia
 Capitolo 2 Le trasformazioni fisiche della materia 1.Gli stati fisici della materia 2.I sistemi omogenei e i sistemi eterogenei 3.Le sostanze pure e i miscugli 4.I passaggi di stato 5. la teoria particellare
Capitolo 2 Le trasformazioni fisiche della materia 1.Gli stati fisici della materia 2.I sistemi omogenei e i sistemi eterogenei 3.Le sostanze pure e i miscugli 4.I passaggi di stato 5. la teoria particellare
Spettrofotometria. Le onde luminose consistono in campi magnetici e campi elettrici oscillanti, fra loro perpendicolari.
 Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Energia e Lavoro. In pratica, si determina la dipendenza dallo spazio invece che dal tempo
 Energia e Lavoro Finora abbiamo descritto il moto dei corpi (puntiformi) usando le leggi di Newton, tramite le forze; abbiamo scritto l equazione del moto, determinato spostamento e velocità in funzione
Energia e Lavoro Finora abbiamo descritto il moto dei corpi (puntiformi) usando le leggi di Newton, tramite le forze; abbiamo scritto l equazione del moto, determinato spostamento e velocità in funzione
La propagazione delle onde luminose può essere studiata per mezzo delle equazioni di Maxwell. Tuttavia, nella maggior parte dei casi è possibile
 Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
9. Urti e conservazione della quantità di moto.
 9. Urti e conservazione della quantità di moto. 1 Conservazione dell impulso m1 v1 v2 m2 Prima Consideriamo due punti materiali di massa m 1 e m 2 che si muovono in una dimensione. Supponiamo che i due
9. Urti e conservazione della quantità di moto. 1 Conservazione dell impulso m1 v1 v2 m2 Prima Consideriamo due punti materiali di massa m 1 e m 2 che si muovono in una dimensione. Supponiamo che i due
CHIMICA GENERALE MODULO
 Corso di Scienze Naturali CHIMICA GENERALE MODULO 6 Termodinamica Entalpia Entropia Energia libera - Spontaneità Relatore: Prof. Finelli Mario Scienza che studia i flussi energetici tra un sistema e l
Corso di Scienze Naturali CHIMICA GENERALE MODULO 6 Termodinamica Entalpia Entropia Energia libera - Spontaneità Relatore: Prof. Finelli Mario Scienza che studia i flussi energetici tra un sistema e l
LA TERMOGRAFIA SPETTRO ONDE ELETTROMAGNETICHE
 SPETTRO ONDE ELETTROMAGNETICHE La radiazione elettromagnetica è un mezzo di trasmissione dell energia sotto forma di onde aventi entrambe le componenti elettriche e magnetiche. La sequenza ordinata delle
SPETTRO ONDE ELETTROMAGNETICHE La radiazione elettromagnetica è un mezzo di trasmissione dell energia sotto forma di onde aventi entrambe le componenti elettriche e magnetiche. La sequenza ordinata delle
352&(662',&20%867,21(
 352&(662',&20%867,21( Il calore utilizzato come fonte energetica convertibile in lavoro nella maggior parte dei casi, è prodotto dalla combustione di sostanze (es. carbone, metano, gasolio) chiamate combustibili.
352&(662',&20%867,21( Il calore utilizzato come fonte energetica convertibile in lavoro nella maggior parte dei casi, è prodotto dalla combustione di sostanze (es. carbone, metano, gasolio) chiamate combustibili.
LEZIONE 1. Materia: Proprietà e Misura
 LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
BILANCI DI ENERGIA. Capitolo 2 pag 70
 BILANCI DI ENERGIA Capitolo 2 pag 70 BILANCI DI ENERGIA Le energie in gioco sono di vario tipo: energia associata ai flussi entranti e uscenti (potenziale, cinetica, interna), Calore scambiato con l ambiente,
BILANCI DI ENERGIA Capitolo 2 pag 70 BILANCI DI ENERGIA Le energie in gioco sono di vario tipo: energia associata ai flussi entranti e uscenti (potenziale, cinetica, interna), Calore scambiato con l ambiente,
Collettori solari. 1. Elementi di un collettore a piastra
 Collettori solari Nel documento Energia solare abbiamo esposto quegli aspetti della radiazione solare che riguardano l energia solare e la sua intensità. In questo documento saranno trattati gli aspetti
Collettori solari Nel documento Energia solare abbiamo esposto quegli aspetti della radiazione solare che riguardano l energia solare e la sua intensità. In questo documento saranno trattati gli aspetti
Proprieta meccaniche dei fluidi
 Proprieta meccaniche dei fluidi 1. Definizione di fluido: liquido o gas 2. La pressione in un fluido 3. Equilibrio nei fluidi: legge di Stevino 4. Il Principio di Pascal 5. Il barometro di Torricelli 6.
Proprieta meccaniche dei fluidi 1. Definizione di fluido: liquido o gas 2. La pressione in un fluido 3. Equilibrio nei fluidi: legge di Stevino 4. Il Principio di Pascal 5. Il barometro di Torricelli 6.
Gas perfetti e sue variabili
 Gas perfetti e sue variabili Un gas è detto perfetto quando: 1. è lontano dal punto di condensazione, e quindi è molto rarefatto 2. su di esso non agiscono forze esterne 3. gli urti tra le molecole del
Gas perfetti e sue variabili Un gas è detto perfetto quando: 1. è lontano dal punto di condensazione, e quindi è molto rarefatto 2. su di esso non agiscono forze esterne 3. gli urti tra le molecole del
LA CORRENTE ELETTRICA
 L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
La teleferica dilatazione termica lineare
 La teleferica dilatazione termica lineare Una teleferica di montagna è costituita da un cavo di acciaio (λ = 1,2 10-5 K -1 ) di lunghezza 5,4 km. D'estate, la temperatura del cavo può passare dai 5 gradi
La teleferica dilatazione termica lineare Una teleferica di montagna è costituita da un cavo di acciaio (λ = 1,2 10-5 K -1 ) di lunghezza 5,4 km. D'estate, la temperatura del cavo può passare dai 5 gradi
FISICA-TECNICA Miscela di gas e vapori. Igrometria
 FISICA-TECNICA Miscela di gas e vapori. Igrometria Katia Gallucci Spesso è necessario variare il contenuto di vapore presente in una corrente gassosa. Lo studio di come si possono realizzare queste variazioni
FISICA-TECNICA Miscela di gas e vapori. Igrometria Katia Gallucci Spesso è necessario variare il contenuto di vapore presente in una corrente gassosa. Lo studio di come si possono realizzare queste variazioni
COMPONENTI TERMODINAMICI APERTI
 CAPITOLO NONO COMPONENTI TERMODINAMICI APERTI Esempi applicativi Vengono di seguito esaminati alcuni componenti di macchine termiche che possono essere considerati come sistemi aperti A) Macchina termica
CAPITOLO NONO COMPONENTI TERMODINAMICI APERTI Esempi applicativi Vengono di seguito esaminati alcuni componenti di macchine termiche che possono essere considerati come sistemi aperti A) Macchina termica
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it
 LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
L E L E G G I D E I G A S P A R T E I
 L E L E G G I D E I G A S P A R T E I Variabili di stato Equazioni di stato Legge di Boyle Pressione, temperatura, scale termometriche Leggi di Charles/Gay-Lussac Dispense di Chimica Fisica per Biotecnologie
L E L E G G I D E I G A S P A R T E I Variabili di stato Equazioni di stato Legge di Boyle Pressione, temperatura, scale termometriche Leggi di Charles/Gay-Lussac Dispense di Chimica Fisica per Biotecnologie
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
La scuola integra culture. Scheda3c
 Scheda3c Gli ELEMENTI DEL CLIMA che caratterizzano le condizioni meteorologiche di una regione sono: la temperatura, la pressione atmosferica, i venti, l umidità e le precipitazioni. La temperatura è data
Scheda3c Gli ELEMENTI DEL CLIMA che caratterizzano le condizioni meteorologiche di una regione sono: la temperatura, la pressione atmosferica, i venti, l umidità e le precipitazioni. La temperatura è data
Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose.
 Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose. 2.1 Spettro di emissione Lo spettro di emissione di
Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose. 2.1 Spettro di emissione Lo spettro di emissione di
Acqua azzurra, acqua chiara. Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao
 Acqua azzurra, acqua chiara Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao Proprietà fisiche Ecosistemi acquatici Origine della vita Ciclo dell acqua Acqua Scoperte Sensazioni Leggi La
Acqua azzurra, acqua chiara Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao Proprietà fisiche Ecosistemi acquatici Origine della vita Ciclo dell acqua Acqua Scoperte Sensazioni Leggi La
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MATERIA MATERIA. COMPOSIZIONE (struttura) Atomi che la compongono
 LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
CONDUTTORI, CAPACITA' E DIELETTRICI
 CONDUTTORI, CAPACITA' E DIELETTRICI Capacità di un conduttore isolato Se trasferiamo una carica elettrica su di un conduttore isolato questa si distribuisce sulla superficie in modo che il conduttore sia
CONDUTTORI, CAPACITA' E DIELETTRICI Capacità di un conduttore isolato Se trasferiamo una carica elettrica su di un conduttore isolato questa si distribuisce sulla superficie in modo che il conduttore sia
Tesina di scienze. L Elettricità. Le forze elettriche
 Tesina di scienze L Elettricità Le forze elettriche In natura esistono due forme di elettricità: quella negativa e quella positiva. Queste due energie si attraggono fra loro, mentre gli stessi tipi di
Tesina di scienze L Elettricità Le forze elettriche In natura esistono due forme di elettricità: quella negativa e quella positiva. Queste due energie si attraggono fra loro, mentre gli stessi tipi di
CAFFE` Il segreto è nel fisico
 CAFFE` Il segreto è nel fisico Preparata la macchina del caffè, e messala sul fuoco: L acqua raggiunge rapidamente la temperatura di ebollizione (100 C). Lo spazio del serbatoio lasciato libero viene occupato
CAFFE` Il segreto è nel fisico Preparata la macchina del caffè, e messala sul fuoco: L acqua raggiunge rapidamente la temperatura di ebollizione (100 C). Lo spazio del serbatoio lasciato libero viene occupato
5. FLUIDI TERMODINAMICI
 5. FLUIDI TERMODINAMICI 5.1 Introduzione Un sistema termodinamico è in genere rappresentato da una quantità di una determinata materia della quale siano definibili le proprietà termodinamiche. Se tali
5. FLUIDI TERMODINAMICI 5.1 Introduzione Un sistema termodinamico è in genere rappresentato da una quantità di una determinata materia della quale siano definibili le proprietà termodinamiche. Se tali
I fenomeni termici e le leggi dei gas
 modulo c indice glossario costanti calcolatrice I fenomeni termici e le leggi dei gas unitàc1 La temperatura e l equilibrio termico unitàc2 Il calore e i passaggi di stato 1 La temperatura 2 La dilatazione
modulo c indice glossario costanti calcolatrice I fenomeni termici e le leggi dei gas unitàc1 La temperatura e l equilibrio termico unitàc2 Il calore e i passaggi di stato 1 La temperatura 2 La dilatazione
'RPDQGHFRQFHWWXDOL Alcuni interrogativi su fenomeni fisici e chimici
 ,OPDWHULDOHGLGDWWLFRFKHVHJXHqVWDWRVFHOWRWUDGRWWRHDGDWWDWRGDO*UXSSRGLFKLPLFD GHOO,7,60DMRUDQDGL*UXJOLDVFR7RULQR0DUFR)DODVFD$QJHOR&LPHQLV3DROD&RVFLD /RUHGDQD$QJHOHUL$QWRQHOOD0DUWLQL'DULR*D]]ROD*UD]LD5L]]R*LXVL'L'LR
,OPDWHULDOHGLGDWWLFRFKHVHJXHqVWDWRVFHOWRWUDGRWWRHDGDWWDWRGDO*UXSSRGLFKLPLFD GHOO,7,60DMRUDQDGL*UXJOLDVFR7RULQR0DUFR)DODVFD$QJHOR&LPHQLV3DROD&RVFLD /RUHGDQD$QJHOHUL$QWRQHOOD0DUWLQL'DULR*D]]ROD*UD]LD5L]]R*LXVL'L'LR
V= R*I. LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro.
 LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
Oggi si possono elencare tre tecnologie principali che consentono di trasformare in energia utilizzabile (termica o elettrica) l energia del sole :
 L energia solare Per energia solare si intende l energia sprigionata dal Sole e trasmessa sulla Terra sotto forma di radiazione elettromagnetica (luce e calore). Sfruttando direttamente tale energia, attraverso
L energia solare Per energia solare si intende l energia sprigionata dal Sole e trasmessa sulla Terra sotto forma di radiazione elettromagnetica (luce e calore). Sfruttando direttamente tale energia, attraverso
Corso di Fisica Generale 1
 Corso di Fisica Generale 1 corso di laurea in Ingegneria dell'automazione ed Ingegneria Informatica (A-C) 22 lezione (18 / 12 /2015) Dr. Laura VALORE Email : laura.valore@na.infn.it / laura.valore@unina.it
Corso di Fisica Generale 1 corso di laurea in Ingegneria dell'automazione ed Ingegneria Informatica (A-C) 22 lezione (18 / 12 /2015) Dr. Laura VALORE Email : laura.valore@na.infn.it / laura.valore@unina.it
Visione d insieme DOMANDE E RISPOSTE SULL UNITÀ
 Visione d insieme DOMANDE E RISPOSTE SULL UNITÀ Che cos è la corrente elettrica? Nei conduttori metallici la corrente è un flusso di elettroni. L intensità della corrente è il rapporto tra la quantità
Visione d insieme DOMANDE E RISPOSTE SULL UNITÀ Che cos è la corrente elettrica? Nei conduttori metallici la corrente è un flusso di elettroni. L intensità della corrente è il rapporto tra la quantità
LEGGE GAS PERFETTI. Gas perfetto è governato dalla legge: PV=nRT=(N/NA) RT. kb=1.38*10-23 (J/K) cost Boltzmann
 LEGGE GAS PERFETTI Gas perfetto è governato dalla legge: PV=nRT=(N/NA) RT PV=NkBT dove kb=r/na kb=1.38*10-23 (J/K) cost Boltzmann TEORIA CINETICA DEI GAS Scopo: legame tra quantità macroscopiche e microscopiche
LEGGE GAS PERFETTI Gas perfetto è governato dalla legge: PV=nRT=(N/NA) RT PV=NkBT dove kb=r/na kb=1.38*10-23 (J/K) cost Boltzmann TEORIA CINETICA DEI GAS Scopo: legame tra quantità macroscopiche e microscopiche
IL SOLE. Il Sole è una stella cioè un corpo che emette luce ed energia ed è formato da gas, principalmente idrogeno (74%) ed elio (24%)
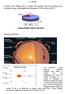 IL SOLE Il Sole è una stella cioè un corpo che emette luce ed energia ed è formato da gas, principalmente idrogeno (74%) ed elio (24%) Struttura del Sole 0 - nel NUCLEO viene prodotta l energia emessa
IL SOLE Il Sole è una stella cioè un corpo che emette luce ed energia ed è formato da gas, principalmente idrogeno (74%) ed elio (24%) Struttura del Sole 0 - nel NUCLEO viene prodotta l energia emessa
Cos è una. pompa di calore?
 Cos è una pompa di calore? !? La pompa di calore aria/acqua La pompa di calore (PDC) aria-acqua è una macchina in grado di trasferire energia termica (calore) dall aria esterna all acqua dell impianto
Cos è una pompa di calore? !? La pompa di calore aria/acqua La pompa di calore (PDC) aria-acqua è una macchina in grado di trasferire energia termica (calore) dall aria esterna all acqua dell impianto
CHIMICA. Una teoria è scientifica solo se è falsificabile (cioè se è possibile sperimentalmente smentire le sue previsioni)
 CHIMICA SCIENZA SPERIMENTALE: cioè si basa sul metodo sperimentale (Galileo è il precursore). Osservazione dei fenomeni (raccolta e interpretazioni dati) Formulazione ipotesi Verifica sperimentale (eventualmente
CHIMICA SCIENZA SPERIMENTALE: cioè si basa sul metodo sperimentale (Galileo è il precursore). Osservazione dei fenomeni (raccolta e interpretazioni dati) Formulazione ipotesi Verifica sperimentale (eventualmente
TEORIA CINETICA DEI GAS
 TEORIA CINETICA DEI GAS La teoria cinetica dei gas è corrispondente con, e infatti prevede, le proprietà dei gas. Nella materia gassosa, gli atomi o le molecole sono separati da grandi distanze e sono
TEORIA CINETICA DEI GAS La teoria cinetica dei gas è corrispondente con, e infatti prevede, le proprietà dei gas. Nella materia gassosa, gli atomi o le molecole sono separati da grandi distanze e sono
Esperienza 15: taratura. della termocoppia. Laboratorio di Fisica 1 (II Modulo) A. Baraldi, M. Riccò. Università di Parma. a.a.
 Esperienza 15: taratura Università di Parma della termocoppia a.a. 2011/2012 Laboratorio di Fisica 1 (II Modulo) A. Baraldi, M. Riccò Copyright M.Solzi Obiettivi dell esperienza Scopo dell'esperienza è
Esperienza 15: taratura Università di Parma della termocoppia a.a. 2011/2012 Laboratorio di Fisica 1 (II Modulo) A. Baraldi, M. Riccò Copyright M.Solzi Obiettivi dell esperienza Scopo dell'esperienza è
Amplificatori Audio di Potenza
 Amplificatori Audio di Potenza Un amplificatore, semplificando al massimo, può essere visto come un oggetto in grado di aumentare il livello di un segnale. Ha quindi, generalmente, due porte: un ingresso
Amplificatori Audio di Potenza Un amplificatore, semplificando al massimo, può essere visto come un oggetto in grado di aumentare il livello di un segnale. Ha quindi, generalmente, due porte: un ingresso
C V. gas monoatomici 3 R/2 5 R/2 gas biatomici 5 R/2 7 R/2 gas pluriatomici 6 R/2 8 R/2
 46 Tonzig La fisica del calore o 6 R/2 rispettivamente per i gas a molecola monoatomica, biatomica e pluriatomica. Per un gas perfetto, il calore molare a pressione costante si ottiene dal precedente aggiungendo
46 Tonzig La fisica del calore o 6 R/2 rispettivamente per i gas a molecola monoatomica, biatomica e pluriatomica. Per un gas perfetto, il calore molare a pressione costante si ottiene dal precedente aggiungendo
ENERGIA. Energia e Lavoro Potenza Energia cinetica Energia potenziale Principio di conservazione dell energia meccanica
 1 ENERGIA Energia e Lavoro Potenza Energia cinetica Energia potenziale Principio di conservazione dell energia meccanica 2 Energia L energia è ciò che ci permette all uomo di compiere uno sforzo o meglio
1 ENERGIA Energia e Lavoro Potenza Energia cinetica Energia potenziale Principio di conservazione dell energia meccanica 2 Energia L energia è ciò che ci permette all uomo di compiere uno sforzo o meglio
Cenni di Teoria Cinetica dei Gas
 Cenni di Teoria Cinetica dei Gas Introduzione La termodinamica descrive i sistemi termodinamici tramite i parametri di stato (p, T,...) Sufficiente per le applicazioni: impostazione e progettazione di
Cenni di Teoria Cinetica dei Gas Introduzione La termodinamica descrive i sistemi termodinamici tramite i parametri di stato (p, T,...) Sufficiente per le applicazioni: impostazione e progettazione di
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
Pressione. Esempio. Definizione di pressione. Legge di Stevino. Pressione nei fluidi EQUILIBRIO E CONSERVAZIONE DELL ENERGIA NEI FLUIDI
 Pressione EQUILIBRIO E CONSERVAZIONE DELL ENERGIA NEI FLUIDI Cos è la pressione? La pressione è una grandezza che lega tra di loro l intensità della forza e l aerea della superficie su cui viene esercitata
Pressione EQUILIBRIO E CONSERVAZIONE DELL ENERGIA NEI FLUIDI Cos è la pressione? La pressione è una grandezza che lega tra di loro l intensità della forza e l aerea della superficie su cui viene esercitata
LA CORRENTE ELETTRICA CONTINUA
 LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
 Il passaggio dal qualitativo al quantitativo: quando è necessario misurare Le condizioni delle misure: individuazione e controllo delle variabili significative Determinare una grandezza misurandone un
Il passaggio dal qualitativo al quantitativo: quando è necessario misurare Le condizioni delle misure: individuazione e controllo delle variabili significative Determinare una grandezza misurandone un
Che cosa è la materia?
 Che cosa è la materia? Tutti gli oggetti e le sostanze che ci stanno intorno sono costituite da materia. Ma che cosa è la materia? Il banco, la cattedra occupano uno spazio nell aula a causa del loro volume,
Che cosa è la materia? Tutti gli oggetti e le sostanze che ci stanno intorno sono costituite da materia. Ma che cosa è la materia? Il banco, la cattedra occupano uno spazio nell aula a causa del loro volume,
GAS. I gas si assomigliano tutti
 I gas si assomigliano tutti Aeriforme liquido solido GAS Descrizione macroscopica e microscopica degli stati di aggregazione della materia Fornendo energia al sistema, le forze di attrazione tra le particelle
I gas si assomigliano tutti Aeriforme liquido solido GAS Descrizione macroscopica e microscopica degli stati di aggregazione della materia Fornendo energia al sistema, le forze di attrazione tra le particelle
SSIS Sezione di Cagliari INDIRIZZO FISICO-MATEMATICO-INFORMATICO. Selezione a.a. 2002/2003
 SSIS Sezione di Cagliari INDIRIZZO FISICO-MATEMATICO-INFORMATICO Selezione a.a. 2002/2003 DOMANDE COMUNI PER INDIRIZZO 1. Quanto vale (in radianti) la somma degli angoli interni del poligono a forma di
SSIS Sezione di Cagliari INDIRIZZO FISICO-MATEMATICO-INFORMATICO Selezione a.a. 2002/2003 DOMANDE COMUNI PER INDIRIZZO 1. Quanto vale (in radianti) la somma degli angoli interni del poligono a forma di
ESERCIZI SULLA DILATAZIONE TERMICA
 ESERCIZI SULLA DILATAZIONE TERMICA Esercizio n. 1 Di quanto varia la lunghezza di una sbarra di ferro che ha, a 0 C, una lunghezza di 20 m se fosse portata alla temperatura di 50 C? (coefficiente di dilatazione
ESERCIZI SULLA DILATAZIONE TERMICA Esercizio n. 1 Di quanto varia la lunghezza di una sbarra di ferro che ha, a 0 C, una lunghezza di 20 m se fosse portata alla temperatura di 50 C? (coefficiente di dilatazione
LO STATO GASSOSO. Proprietà fisiche dei gas Leggi dei gas Legge dei gas ideali Teoria cinetico-molecolare dei gas Solubilità dei gas nei liquidi
 LO STATO GASSOSO Proprietà fisiche dei gas Leggi dei gas Legge dei gas ideali Teoria cinetico-molecolare dei gas Solubilità dei gas nei liquidi STATO GASSOSO Un sistema gassoso è costituito da molecole
LO STATO GASSOSO Proprietà fisiche dei gas Leggi dei gas Legge dei gas ideali Teoria cinetico-molecolare dei gas Solubilità dei gas nei liquidi STATO GASSOSO Un sistema gassoso è costituito da molecole
3. Le Trasformazioni Termodinamiche
 3. Le Trasformazioni Termodinamiche Lo stato termodinamico di un gas (perfetto) è determinato dalle sue variabili di stato: ressione, olume, Temperatura, n moli ffinché esse siano determinate è necessario
3. Le Trasformazioni Termodinamiche Lo stato termodinamico di un gas (perfetto) è determinato dalle sue variabili di stato: ressione, olume, Temperatura, n moli ffinché esse siano determinate è necessario
LA MATERIA Suggerimenti didattici e schede
 LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
Modulo di Meccanica e Termodinamica
 Modulo di Meccanica e Termodinamica 1) Misure e unita di misura 2) Cinematica: + Moto Rettilineo + Moto Uniformemente Accelerato [+ Vettori e Calcolo Vettoriale] + Moti Relativi 3) Dinamica: + Forza e
Modulo di Meccanica e Termodinamica 1) Misure e unita di misura 2) Cinematica: + Moto Rettilineo + Moto Uniformemente Accelerato [+ Vettori e Calcolo Vettoriale] + Moti Relativi 3) Dinamica: + Forza e
LEGGI DEI GAS / CALORI SPECIFICI. Introduzione 1
 LEGGI DEI GAS / CALORI SPECIFICI Introduzione 1 1 - TRASFORMAZIONE ISOBARA (p = costante) LA PRESSIONE RIMANE COSTANTE DURANTE TUTTA LA TRASFORMAZIONE V/T = costante (m, p costanti) Q = m c p (Tf - Ti)
LEGGI DEI GAS / CALORI SPECIFICI Introduzione 1 1 - TRASFORMAZIONE ISOBARA (p = costante) LA PRESSIONE RIMANE COSTANTE DURANTE TUTTA LA TRASFORMAZIONE V/T = costante (m, p costanti) Q = m c p (Tf - Ti)
I.T.C.G.T T. Acerbo - Pescara LABORATORIO DI FISICA A. S. 2009/10
 I.T.C.G.T T. Acerbo - Pescara LABORATORIO DI FISICA A. S. 2009/10 Cognome: D Ovidio Nome: Stefania Classe: 2 B Geometri Data: 04/12/2009 Gruppo: F. Illiceto; V. Ivanochko; M.C. Scopino; M.Terenzi N. pagine:
I.T.C.G.T T. Acerbo - Pescara LABORATORIO DI FISICA A. S. 2009/10 Cognome: D Ovidio Nome: Stefania Classe: 2 B Geometri Data: 04/12/2009 Gruppo: F. Illiceto; V. Ivanochko; M.C. Scopino; M.Terenzi N. pagine:
Forza. Forza. Esempi di forze. Caratteristiche della forza. Forze fondamentali CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA
 Forza CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA Cos è una forza? la forza è una grandezza che agisce su un corpo cambiando la sua velocità e provocando una deformazione sul corpo 2 Esempi
Forza CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA Cos è una forza? la forza è una grandezza che agisce su un corpo cambiando la sua velocità e provocando una deformazione sul corpo 2 Esempi
L H 2 O nelle cellule vegetali e
 L H 2 O nelle cellule vegetali e il suo trasporto nella pianta H 2 O 0.96 Å H O 105 H 2s 2 2p 4 tendenza all ibridizzazione sp 3 H δ+ O δ- δ+ 1.75 Å H legame idrogeno O δ- H H δ+ δ+ energia del legame
L H 2 O nelle cellule vegetali e il suo trasporto nella pianta H 2 O 0.96 Å H O 105 H 2s 2 2p 4 tendenza all ibridizzazione sp 3 H δ+ O δ- δ+ 1.75 Å H legame idrogeno O δ- H H δ+ δ+ energia del legame
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA
 EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
Siamo così arrivati all aritmetica modulare, ma anche a individuare alcuni aspetti di come funziona l aritmetica del calcolatore come vedremo.
 DALLE PESATE ALL ARITMETICA FINITA IN BASE 2 Si è trovato, partendo da un problema concreto, che con la base 2, utilizzando alcune potenze della base, operando con solo addizioni, posso ottenere tutti
DALLE PESATE ALL ARITMETICA FINITA IN BASE 2 Si è trovato, partendo da un problema concreto, che con la base 2, utilizzando alcune potenze della base, operando con solo addizioni, posso ottenere tutti
POMPA DI CALORE CICLO FRIGORIFERO A COMPRESSIONE DI VAPORE
 POMPA DI CALORE CONDENSATORE = + L T = + L C ORGANO DI ESPANSIONE LIQUIDO COMPRESSORE T COND. E D T 1 VAPORE T EVAP. A B T 2 Schema a blocchi di una macchina frigorifera EVAPORATORE Dal punto di vista
POMPA DI CALORE CONDENSATORE = + L T = + L C ORGANO DI ESPANSIONE LIQUIDO COMPRESSORE T COND. E D T 1 VAPORE T EVAP. A B T 2 Schema a blocchi di una macchina frigorifera EVAPORATORE Dal punto di vista
Una forza, per la fisica, compie un lavoro se provoca uno spostamento.
 Lavoro La forza è la causa del cambiamento di moto di un corpo (dinamica). Se la risultante di puù forze applicate ad un corpo è nulla il corpo è in equilibrio stabile (statica). Una forza può causare
Lavoro La forza è la causa del cambiamento di moto di un corpo (dinamica). Se la risultante di puù forze applicate ad un corpo è nulla il corpo è in equilibrio stabile (statica). Una forza può causare
ASPETTI TERMODINAMICI DEI SISTEMI BIOLOGICI
 ASPETTI TERMODINAMICI DEI SISTEMI BIOLOGICI Sistemi biologici: soggetti a complessi processi di trasformazione e scambio di energia; I sistemi biologici sono costituiti perlopiù da quattro elementi: H,
ASPETTI TERMODINAMICI DEI SISTEMI BIOLOGICI Sistemi biologici: soggetti a complessi processi di trasformazione e scambio di energia; I sistemi biologici sono costituiti perlopiù da quattro elementi: H,
Qual è la differenza fra la scala Celsius e la scala assoluta delle temperature?
 ISTITUTO DI ISTRUZIONE SECONDARIA DANIELE CRESPI Liceo Internazionale Classico e Linguistico VAPC02701R Liceo delle Scienze Umane VAPM027011 Via G. Carducci 4 21052 BUSTO ARSIZIO (VA) www.liceocrespi.it-tel.
ISTITUTO DI ISTRUZIONE SECONDARIA DANIELE CRESPI Liceo Internazionale Classico e Linguistico VAPC02701R Liceo delle Scienze Umane VAPM027011 Via G. Carducci 4 21052 BUSTO ARSIZIO (VA) www.liceocrespi.it-tel.
Il trasporto di materia. Principi di Ingegneria Chimica Ambientale
 Il trasporto di materia Principi di Ingegneria Chimica Ambientale 1 Considerazioni preliminari Il nostro studio sarà limitato a: miscele binarie miscele diluite (ossia in cui la frazione molare di uno
Il trasporto di materia Principi di Ingegneria Chimica Ambientale 1 Considerazioni preliminari Il nostro studio sarà limitato a: miscele binarie miscele diluite (ossia in cui la frazione molare di uno
Correnti e circuiti a corrente continua. La corrente elettrica
 Correnti e circuiti a corrente continua La corrente elettrica Corrente elettrica: carica che fluisce attraverso la sezione di un conduttore in una unità di tempo Q t Q lim t 0 t ntensità di corrente media
Correnti e circuiti a corrente continua La corrente elettrica Corrente elettrica: carica che fluisce attraverso la sezione di un conduttore in una unità di tempo Q t Q lim t 0 t ntensità di corrente media
Gas, liquidi, solidi. Tutti i gas, tranne l'elio, solidificano a basse temperature (alcuni richiedono anche alte pressioni).
 Gas, liquidi, solidi Tutti i gas raffreddati liquefano Tutti i gas, tranne l'elio, solidificano a basse temperature (alcuni richiedono anche alte pressioni). Sostanza T L ( C) T E ( C) He - -269 H 2-263
Gas, liquidi, solidi Tutti i gas raffreddati liquefano Tutti i gas, tranne l'elio, solidificano a basse temperature (alcuni richiedono anche alte pressioni). Sostanza T L ( C) T E ( C) He - -269 H 2-263
I CIRCUITI ELETTRICI. Prima di tutto occorre mettersi d accordo anche sui nomi di alcune parti dei circuiti stessi.
 I CIRCUITI ELETTRICI Prima di tutto occorre mettersi d accordo anche sui nomi di alcune parti dei circuiti stessi. Definiamo ramo un tratto di circuito senza diramazioni (tratto evidenziato in rosso nella
I CIRCUITI ELETTRICI Prima di tutto occorre mettersi d accordo anche sui nomi di alcune parti dei circuiti stessi. Definiamo ramo un tratto di circuito senza diramazioni (tratto evidenziato in rosso nella
