ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
|
|
|
- Giacinta Perini
- 8 anni fa
- Visualizzazioni
Transcript
1 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
2 1. DENOMINAZIONE DEL MEDICINALE Omidria 10 mg/ml + 3 mg/ml concentrato per soluzione per irrigazione intraoculare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni 4 ml di soluzione nel flaconcino contiene fenilefrina cloridrato, equivalente a 40,6 mg (10,2 mg/ml) di fenilefrina, e ketorolac trometamolo, equivalente a 11,5 mg (2,88 mg/ml) di ketorolac. Dopo la diluizione in 500 ml di soluzione per irrigazione, la soluzione contiene 0,081 mg/ml di fenilefrina e 0,023 mg/ml di ketorolac. Per l'elenco completo degli eccipienti, vedere paragrafo FORMA FARMACEUTICA Concentrato per soluzione per irrigazione intraoculare Soluzione limpida, da incolore a leggermente gialla, con ph: 6,3 ± 0,3. 4. INFORMAZIONI CLINICHE 4.1 Indicazioni terapeutiche Omidria è indicato negli adulti per il mantenimento della midriasi intraoperatoria, la prevenzione della miosi intraoperatoria e la riduzione del dolore oculare acuto postoperatorio negli interventi di impianto di lente intraoculare. 4.2 Posologia e modo di somministrazione Omidria deve essere somministrato in un contesto chirurgico controllato, da un chirurgo specialista in oftalmologia esperto di interventi di impianto di lente intraoculare. Posologia La dose raccomandata è 4,0 ml di Omidria, diluiti in 500 ml di soluzione per irrigazione, somministrata mediante irrigazione intraoculare nell occhio interessato durante l intervento chirurgico. Per le istruzioni sulla diluizione del medicinale prima della somministrazione, vedere paragrafo 6.6. Popolazioni speciali Compromissione renale o epatica Non sono stati condotti studi formali con Omidria in pazienti con compromissione renale o epatica. Non si prevedono aggiustamenti della dose o considerazioni particolari per i pazienti con compromissione renale o epatica (vedere paragrafo 5.2). Anziani La popolazione anziana è stata studiata nel corso degli studi clinici. Non è necessario un aggiustamento della dose.
3 Popolazione pediatrica La sicurezza e l efficacia di Omidria nei bambini di età inferiore a 18 anni non sono state stabilite. Non ci sono dati disponibili. Modo di somministrazione Uso intraoculare. Solo monouso. Omidria non è stato valutato in assenza di agenti midriatici e anestetici preoperatori standard. In fase preoperatoria, colliri antibiotici, anestetici, corticosteroidi, midriatici e FANS possono essere somministrati a discrezione dell oftalmologo curante. Prima della somministrazione del medicinale Prima dell uso Omidria deve essere diluito in 500 ml di soluzione per irrigazione. Per le istruzioni sulla diluizione, vedere paragrafo 6.6. La soluzione per irrigazione contenente Omidria è destinata ad essere usata durante la procedura chirurgica, con la stessa modalità di utilizzo della soluzione per irrigazione standard. 4.3 Controindicazioni Ipersensibilità ai principi attivi o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1. Pazienti con glaucoma ad angolo chiuso 4.4 Avvertenze speciali e precauzioni d'impiego Il medicinale deve essere diluito prima dell uso intraoculare. Omidria è indicato unicamente per l aggiunta alla soluzione per irrigazione utilizzata durante le procedure di impianto di lente intraoculare. Omidria non è indicato per l uso non diluito, per l iniezione intravitreale, per l uso oftalmico topico generale o per l uso sistemico non oftalmico. La sicurezza e l efficacia di Omidria non sono state valutate in pazienti con anamnesi positiva per uveite, trauma irideo o uso di antagonisti alfa-adrenergici. Durante l uso di Omidria devono essere considerate le seguenti avvertenze e precauzioni correlate all uso oftalmico topico di fenilefrina e ketorolac: Reazioni cardiovascolari Vi sono state segnalazioni di reazioni cardiovascolari gravi, tra cui aritmie ventricolari e infarto del miocardio, in pazienti trattati con fenilefrina oftalmica. Questi episodi, alcuni con esito fatale, si sono verificati di solito in pazienti con patologie cardiovascolari preesistenti. Aumenti significativi della pressione arteriosa sono stati segnalati dopo l instillazione di fenilefrina oftalmica topica. L esposizione sistemica prevista è minima e transitoria; tuttavia, si deve prestare cautela nel trattamento di pazienti con ipertensione non efficacemente controllata. Il rischio di un innalzamento della pressione arteriosa può essere maggiore nei pazienti che richiedono un intervento chirurgico prolungato. L ipertiroidismo e le patologie cardiovascolari instabili devono essere trattati prima dell intervento chirurgico.
4 Sensibilità crociata Esiste la possibilità che insorga sensibilità crociata all acido acetilsalicilico, ai derivati dell acido fenilacetico e ad altri farmaci antinfiammatori non steroidei (FANS). Vi sono state segnalazioni di broncospasmo o esacerbazioni dell asma, associati all uso di ketorolac soluzione oftalmica, in pazienti con ipersensibilità nota ad aspirina/fans o con anamnesi pregressa di asma. Pertanto, l uso di Omidria in soggetti che hanno manifestato in passato sensibilità a questi principi attivi richiede cautela. L uso di Omidria durante l intervento di impianto di lente intraoculare può causare un alterazione temporanea della vista (vedere paragrafo 4.7). 4.5 Interazioni con altri medicinali ed altre forme d'interazione Non sono stati effettuati studi d interazione. Le interazioni metaboliche intraoculari sono improbabili, perché fenilefrina e ketorolac vengono eliminati dalla camera anteriore mediante irrigazione, durante la procedura chirurgica, e mediante la normale circolazione di umor acqueo in fase postoperatoria. L entità dell effetto midriatico di Omidria può essere alterata nei pazienti trattati in concomitanza con medicinali che possono influire sulle dimensioni della pupilla, come oppioidi (miotici) o antistaminici non sedativi (midriatici). In alcuni pazienti, l uso concomitante di fenilefrina e atropina può potenziare gli effetti pressori e indurre tachicardia. La fenilefrina può potenziare gli effetti depressivi a livello cardiovascolare di alcuni medicinali anestetici per inalazione. In uno studio di farmacocinetica per la valutazione di Omidria, l esposizione sistemica rispettivamente a fenilefrina e ketorolac è risultata minima e transitoria. Pertanto, non si prevedono interazioni. 4.6 Fertilità, gravidanza e allattamento Donne in età fertile Omidria non è raccomandato in donne in età fertile che non usano misure contraccettive. Gravidanza Non esistono dati relativi all uso di Omidria in donne in gravidanza. Omidria non è raccomandato durante la gravidanza. Allattamento Non è noto se la fenilefrina sia escreta nel latte materno. Ketorolac è escreto nel latte materno dopo la somministrazione sistemica. Il rischio per i lattanti non può essere escluso. Omidria non deve essere usato durante l'allattamento. Fertilità Non esistono dati adeguati relativi agli effetti dell'uso di fenilefrina cloridrato o ketorolac trometamolo sulla fertilità negli esseri umani. 4.7 Effetti sulla capacità di guidare veicoli e sull'uso di macchinari Omidria può compromettere la capacità di guidare veicoli o di usare macchinari. Dopo l impianto della lente intraoculare nei pazienti trattati con Omidria la vista può essere temporaneamente alterata; pertanto, i pazienti devono essere avvertiti di non guidare né usare macchinari fino a quando la visione non sia tornata nitida. Per ulteriori informazioni sui disturbi visivi, vedere paragrafo 4.8.
5 4.8 Effetti indesiderati Riassunto del profilo di sicurezza Il profilo di sicurezza di Omidria si basa sui dati di 459 pazienti adulti raccolti durante lo sviluppo clinico, in studi clinici controllati randomizzati. Le reazioni avverse segnalate nei pazienti trattati con Omidria sono state quelle tipicamente rilevabili nel postoperatorio, per lo più di intensità lievemoderata, e si sono risolte senza intervento o sequele. Le reazioni avverse segnalate con maggiore frequenza sono state: dolore oculare (4,8%), infiammazione della camera anteriore (3,9%), iperemia congiuntivale (2,2%), fotofobia (1,7%), edema corneale (1,3%) e infiammazione (1,3%). Ciascuno di questi eventi è stato segnalato con frequenza simile nei pazienti che hanno ricevuto il placebo. Tabella delle reazioni avverse La frequenza delle reazioni avverse è definita come: molto comune ( 1/10), comune ( 1/100, <1/10), non comune ( 1/1.000, <1/100), raro ( 1/10.000, <1/1.000), molto raro (<1/10.000), non nota (la frequenza non può essere definita sulla base dei dati disponibili). Classificazione per sistemi e organi Patologie del sistema nervoso Patologie dell'occhio Patologie gastrointestinali Patologie sistemiche e condizioni relative alla sede di somministrazione Comune Dolore oculare Infiammazione della camera anteriore Iperemia congiuntivale Edema corneale Fotofobia Infiammazione Non comune Cefalea Fastidio oculare Infiammazione oculare Irritazione oculare Edema congiuntivale Patologie della cornea Midriasi Visione offuscata Riduzione dell acuità visiva Miodesopsie Prurito oculare Dolore palpebrale Sensazione di corpo estraneo negli occhi Abbagliamento Aumento della pressione intraoculare Nausea Dolore Segnalazione delle reazioni avverse sospette La segnalazione delle reazioni avverse sospette che si verificano dopo l'autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema nazionale di segnalazione riportato nell Allegato V. 4.9 Sovradosaggio In caso di iniezione intracamerale accidentale della soluzione concentrata, la camera anteriore deve essere evacuata immediatamente e irrigata con una soluzione per irrigazione oftalmica standard.
6 Il sovradosaggio sistemico di fenilefrina può causare un rapido aumento della pressione arteriosa. Può causare inoltre cefalea, ansia, nausea e vomito e aritmie ventricolari. In caso di sovradosaggio di fenilefrina, è stata raccomandata la tempestiva iniezione di un agente bloccante alfa-adrenergico ad azione rapida, come la fentolamina. 5. PROPRIETÀ FARMACOLOGICHE 5.1 Proprietà farmacodinamiche Categoria farmacoterapeutica: {non ancora assegnata}, codice ATC: {non ancora assegnato} Meccanismo d'azione La fenilefrina e il ketorolac contenuti in Omidria agiscono, con meccanismi distinti, per mantenere la midriasi intraoperatoria, per prevenire la miosi intraoperatoria e per ridurre il dolore acuto postoperatorio. La fenilefrina è un agonista dei recettori α1-adrenergici ed esercita un azione midriatica attraverso la contrazione del muscolo radiale dell iride, dilatando la pupilla con cicloplegia minima o assente. La vasocostrizione si verifica nella circolazione congiuntivale e in altri vasi oculari, nella misura in cui sono esposti al medicinale. Ketorolac è un FANS che inibisce entrambi gli enzimi ciclossigenasi (COX1 e COX2), attenuando il dolore e l infiammazione grazie alla riduzione delle concentrazioni tissutali di prostaglandine conseguenti al trauma chirurgico. Inibendo la sintesi delle prostaglandine secondaria all insulto chirurgico oculare o alla stimolazione meccanica diretta dell iride, ketorolac può contribuire inoltre alla prevenzione della miosi indotta dall intervento chirurgico. Efficacia e sicurezza clinica L efficacia e la sicurezza di Omidria sono state valutate in due studi clinici di fase 3 randomizzati, multicentrici, in doppio cieco e controllati verso placebo, condotti in 808 pazienti adulti sottoposti a impianto di lente intraoculare. La popolazione degli studi aveva un età compresa tra 26 e 90 anni (59% di sesso femminile, 41% di sesso maschile; 80% bianca, 12% nera e 8% di altra razza). Il diciannove percento delle cataratte era classificata come LOCS II nucleare di grado 2 o 3. Il cinquantatré percento dei pazienti aveva iridi marroni, il 28% iridi blu e il 19% iridi di altri colori. I pazienti sono stati randomizzati a ricevere Omidria o placebo (in rapporto 1:1). Tutti i pazienti sono stati trattati con agenti midriatici e anestetici topici preoperatori standard. Il diametro della pupilla è stato misurato durante l intera procedura chirurgica. Il dolore postoperatorio è stato valutato mediante una scala visiva analogica (VAS) su mm auto-somministrata. I test statistici per la variazione rispetto al basale del diametro della pupilla (mm) durante l intervento sono state eseguite con il test di Cochran-Mantel-Haenszel (CMH), aggiustato per i fattori di randomizzazione. Nello studio 1, la differenza media ponderata CMH (Omidria placebo) dell area sotto la curva (AUC) media è stata di 0,58 mm [intervallo di confidenza al 95%: 0,48; 0,68] (p < 0,0001). Nello studio 2, la differenza media ponderata al CMH (Omidria placebo) nell AUC media è stata di 0,59 mm [intervallo di confidenza al 95%: 0,49; 0,69] (p < 0,0001). La midriasi è stata mantenuta nei gruppi trattati con Omidria, mentre nei gruppi che hanno ricevuto il placebo si è manifestata una progressiva costrizione della pupilla (vedere figura).
7 Variazione rispetto al basale del diametro intraoperatorio della pupilla (in mm) Studio 1 Variazione media dal basale del diametro della pupilla (in mm) p<0,001 p<0,001 Studio 2 Placebo Placebo Minuti dall incisione chirurgica iniziale La prevenzione della miosi è stata confermata in un analisi categorica. Nello studio 1, solo il 4% dei pazienti nel gruppo Omidria, rispetto al 23% dei pazienti nel gruppo placebo, ha evidenziato un diametro della pupilla < 6 mm al momento della pulizia corticale, e il 3% dei pazienti nel gruppo Omidria, rispetto al 28% dei pazienti nel gruppo placebo, ha evidenziato costrizione della pupilla 2,5 mm (p < 0,0001 in entrambi i casi, test chi-quadrato). Nello studio 2, solo il 4% dei pazienti nel gruppo Omidria, rispetto al 23% dei pazienti nel gruppo placebo, ha evidenziato un diametro della pupilla < 6 mm al momento della pulizia corticale, e l 1% dei pazienti nel gruppo Omidria, rispetto al
8 27% dei pazienti nel gruppo placebo, ha evidenziato costrizione della pupilla 2,5 mm (p < 0,0001, test chi-quadrato). Studio 1 Dataset (n) Variazione dell AUC rispetto al basale del diametro della pupilla (mm) durante l intervento (endpoint coprimario) [media (DS)] Placebo Omidria N=201 N=201 (n=180) (n=184) -0,5 (0,58) 0,1 (0,41) Diametro < 6 mm in qualsiasi punto temporale 85 (47%) 19 (10%) Diametro < 6 mm alla pulizia corticale 41 (23%) 7 (4%) Costrizione della pupilla 2,5 mm 50 (28%) 6 (3%) Studio 2 Dataset (n) Variazione dell AUC rispetto al basale del diametro della pupilla (mm) durante l intervento (endpoint coprimario) [media (DS)] N=204 (n=200) N=202 (n=195) -0,5 (0,57) 0,1 (0,43) Diametro < 6 mm in qualsiasi punto temporale 76 (38%) 18 (9%) Diametro < 6 mm alla pulizia corticale 46 (23%) 8 (4%) Costrizione della pupilla 2,5 mm 53 (27%) 2 (1%) È stata dimostrata inoltre una riduzione significativa del dolore oculare durante le prime ore postoperatorie. I test statistici per il dolore, determinato dalla VAS su 100 mm, sono stati eseguiti con un test CMH, aggiustato per i fattori di randomizzazione. Nello studio 1, la differenza media ponderata al CMH (Omidria placebo) nell AUC media è stata di -5,20 mm [intervallo di confidenza al 95%: - 7,31; -3,09] (p < 0,001). Nello studio 2, la differenza media ponderata CMH (Omidria placebo) nell AUC media è stata di -4,58 mm [intervallo di confidenza al 95%: -6,92; -2,24] (p < 0,001). Studio 1 Dataset (n) AUC del punteggio VAS del dolore oculare a 12 ore (endpoint co-primario) [media ± DS] Placebo Omidria N=201 N=201 (n=201) (n=201) 9,2 ± 12,9 4,1 ± 8,07 Soggetti con VAS = 0 in tutti i punti temporali 28 (14%) 48 (24%) Soggetti con VAS 40 in qualsiasi punto temporale 30 (15%) 13 (7%) Studio 2 Dataset (n) AUC del punteggio VAS del dolore oculare a 12 ore (endpoint co-primario) [media ± DS] N=204 (n=202) N=202 (n=202) 8,9 ± 15,19 4,3 ± 8,75 Soggetti con VAS = 0 in tutti i punti temporali 41 (20%) 56 (28%) Soggetti con VAS 40 in qualsiasi punto temporale 27 (13%) 16 (8%) L esame istologico negli studi di tossicologia preclinici non ha evidenziato alcun effetto correlato al trattamento sulla cornea e, nelle sperimentazioni cliniche con Omidria, non sono stati osservati effetti negativi sulla migliore acuità visiva corretta (BCVA). Non è stata eseguita la conta delle cellule endoteliali durante gli studi clinici.
9 Popolazione pediatrica L Agenzia europea dei medicinali ha rinviato l obbligo di presentare i risultati degli studi con Omidria in uno o più sottogruppi di popolazione pediatrica per le procedure terapeutiche sul cristallino (vedere paragrafo 4.2 per informazioni sull uso pediatrico). 5.2 Proprietà farmacocinetiche In uno studio di farmacocinetica per la valutazione di Omidria, l esposizione sistemica a fenilefrina e ketorolac è risultata minima e transitoria. Concentrazioni plasmatiche rilevabili di fenilefrina sono state osservate solo in uno dei 14 pazienti. La concentrazione massima osservata in questo paziente è stata 1,7 ng/ml, raggiunta dopo l instillazione di gocce di fenilefrina preoperatorie topiche e prima dell esposizione a Omidria. Le concentrazioni plasmatiche di ketorolac sono state rilevate in 11 pazienti su 14. La concentrazione massima di ketorolac osservata è stata 4,2 ng/ml. 5.3 Dati preclinici di sicurezza I dati preclinici riportati in letteratura per i singoli componenti di Omidria non rivelano rischi particolari per l uomo sulla base di studi convenzionali di safety pharmacology, tossicità a dosi ripetute, genotossicità, potenziale cancerogeno, tossicità della riproduzione e dello sviluppo. Uno studio di tossicità a dose singola è stato condotto in scimmie verdi africane esposte a soluzioni per irrigazione oculare contenenti l associazione di fenilefrina e ketorolac, usate durante l intervento di sostituzione del cristallino. Non sono stati osservati eventi avversi correlati al farmaco o rilievi patologici con le associazioni di fenilefrina e ketorolac in soluzione per irrigazione, somministrata a concentrazioni fino a µm di fenilefrina e 900 µm di ketorolac. Queste concentrazioni sono oltre 10 volte più elevate della concentrazione di ciascun agente somministrato nella pratica clinica ai pazienti trattati con Omidria. 6. INFORMAZIONI FARMACEUTICHE 6.1 Elenco degli eccipienti Acido citrico monoidrato Sodio citrato diidrato Sodio idrossido (per l aggiustamento del ph) Acido cloridrico (per l aggiustamento del ph) Acqua per preparazioni iniettabili 6.2 Incompatibilità Questo medicinale non deve essere miscelato con altri medicinali ad eccezione di quelli menzionati nel paragrafo Periodo di validità Confezione integra: 18 mesi Una volta aperto, il medicinale deve essere diluito immediatamente. Dopo la diluizione, la stabilità chimica e fisica in uso è stata dimostrata per 6 ore a 25 C. Usare entro 6 ore dalla diluizione. Dal punto di vista microbiologico, il medicinale deve essere utilizzato
10 immediatamente. In caso contrario, l'utilizzatore è responsabile dei tempi di conservazione in uso e delle condizioni prima dell uso. 6.4 Precauzioni particolari per la conservazione Non conservare a temperatura superiore ai 25 C. Tenere il flaconcino nell imballaggio esterno per proteggere il medicinale dalla luce. Dopo la diluizione, non conservare a temperatura superiore ai 25 C. 6.5 Natura e contenuto del contenitore Flaconcino di vetro di tipo I da 5 ml incolore, con tappo in gomma butilica e una capsula di chiusura a strappo in polipropilene. Ogni flaconcino monouso è confezionato in una scatola di cartone. Confezione multipla contenente 10 (1 confezione da 10) flaconcini monouso. 6.6 Precauzioni particolari per lo smaltimento e la manipolazione Per preparare Omidria per l irrigazione intraoculare, diluire 4,0 ml di concentrato in 500 ml di soluzione per irrigazione oftalmica standard. Devono essere rispettate le istruzioni seguenti: il flaconcino deve essere ispezionato visivamente per verificare l'eventuale presenza di particolato. Deve essere usata solo una soluzione limpida, da incolore a leggermente gialla, senza particelle visibili; con una tecnica asettica, prelevare 4,0 ml di soluzione concentrata utilizzando un ago sterile idoneo; 4,0 ml di soluzione concentrata devono essere iniettati in una sacca/flacone da 500 ml di soluzione per irrigazione; la sacca deve essere delicatamente capovolta per miscelare la soluzione. La soluzione deve essere utilizzata entro 6 ore dalla preparazione; la sacca deve essere ispezionata visivamente per verificare l'eventuale presenza di particolato. Deve essere usata solo una soluzione limpida, incolore, senza particelle visibili; non devono essere aggiunti altri medicinali alla soluzione per irrigazione preparata. Il flaconcino usato e l eventuale soluzione per irrigazione non utilizzata devono essere smaltiti, dopo l uso singolo, in conformità alla normativa locale vigente. 7. TITOLARE DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO Omeros London Limited Berkeley Square London, W1J 6BD Regno Unito Tel: +44 (0) Fax: +44 (0) regulatory@omeros.co.uk
11 8. NUMERO(I) DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO EU/1/15/1018/ DATA DELLA PRIMA AUTORIZZAZIONE/RINNOVO DELL'AUTORIZZAZIONE Data della prima autorizzazione: <data della decisione UE> 10. DATA DI REVISIONE DEL TESTO Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell'agenzia europea dei medicinali:
12 ALLEGATO II A. PRODUTTORE(I) RESPONSABILE(I) DEL RILASCIO DEI LOTTI B. CONDIZIONI O LIMITAZIONI DI FORNITURA E UTILIZZO C. ALTRE CONDIZIONI E REQUISITI DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO D. CONDIZIONI O LIMITAZIONI PER QUANTO RIGUARDA L'USO SICURO ED EFFICACE DEL MEDICINALE
13 A. PRODUTTORE(I) RESPONSABILE(I) DEL RILASCIO DEI LOTTI Nome e indirizzo del(dei) produttore(i) responsabile(i) del rilascio dei lotti Almac Pharma Services Limited Seagoe Industrial Estate, Craigavon, Co. Armagh BT63 5QD Irlanda del Nord B. CONDIZIONI O LIMITAZIONI DI FORNITURA E UTILIZZO Medicinale soggetto a prescrizione medica limitativa (vedere allegato I: riassunto delle caratteristiche del prodotto, paragrafo 4.2). C. ALTRE CONDIZIONI E REQUISITI DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO Rapporti periodici di aggiornamento sulla sicurezza (PSUR) Il titolare dell'autorizzazione all'immissione in commercio deve presentare il primo PSUR per questo medicinale entro 6 mesi successivi all'autorizzazione. In seguito, il titolare dell'autorizzazione all'immissione in commercio presenterà gli PSUR per questo medicinale conformemente ai requisiti definiti nell'elenco delle date di riferimento per l'unione europea (elenco EURD) di cui all'articolo 107 quater, par. 7 della direttiva 2001/83/CE e pubblicato sul sito web dei medicinali europei. D. CONDIZIONI O LIMITAZIONI PER QUANTO RIGUARDA L'USO SICURO ED EFFICACE DEL MEDICINALE Piano di gestione del rischio (RMP) Il titolare dell'autorizzazione all'immissione in commercio deve effettuare le attività e gli interventi di farmacovigilanza richiesti e dettagliati nel RMP concordato e presentato nel modulo dell'autorizzazione all'immissione in commercio e qualsiasi successivo aggiornamento concordato del RMP. Il RMP aggiornato deve essere presentato: su richiesta dell'agenzia europea per i medicinali; ogni volta che il sistema di gestione del rischio è modificato, in particolare a seguito del ricevimento di nuove informazioni che possono portare a un cambiamento significativo del profilo beneficio/rischio o al risultato del raggiungimento di un importante obiettivo (di farmacovigilanza o di minimizzazione del rischio). Quando le date per la presentazione di un rapporto periodico di aggiornamento sulla sicurezza (PSUR) e l'aggiornamento del RMP coincidono, essi possono essere presentati allo stesso tempo.
14 ALLEGATO III ETICHETTATURA E FOGLIO ILLUSTRATIVO
15 A. ETICHETTATURA
16 INFORMAZIONI DA APPORRE SUL CONFEZIONAMENTO SECONDARIO SCATOLA DI CARTONE ESTERNA 1. DENOMINAZIONE DEL MEDICINALE Omidria 10 mg/ml + 3 mg/ml concentrato per soluzione per irrigazione intraoculare Fenilefrina/ketorolac 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN TERMINI DI PRINCIPIO(I) ATTIVO(I) Un flaconcino da 4 ml contiene fenilefrina cloridrato, pari a 40,6 mg (10,2 mg/ml) di fenilefrina, e ketorolac trometamolo, pari a 11,5 mg (2,88 mg/ml) di ketorolac. Dopo la diluizione, la soluzione contiene 0,081 mg/ml di fenilefrina e 0,023 mg/ml di ketorolac. 3. ELENCO DEGLI ECCIPIENTI Eccipienti: acido citrico monoidrato, sodio citrato diidrato, sodio idrossido/acido cloridrico (per l aggiustamento del ph), acqua per preparazioni iniettabili 4. FORMA FARMACEUTICA E CONTENUTO Concentrato per soluzione per irrigazione intraoculare Confezione multipla: 10 (1 confezione da 10) flaconcini 5. MODO E VIA(E) DI SOMMINISTRAZIONE Solo monouso. Leggere il foglio illustrativo prima dell'uso. Uso intraoculare dopo diluizione. 6. AVVERTENZA PARTICOLARE CHE PRESCRIVA DI TENERE IL MEDICINALE FUORI DALLA VISTA E DALLA PORTATA DEI BAMBINI Tenere fuori dalla vista e dalla portata dei bambini. 7. ALTRA(E) AVVERTENZA(E) PARTICOLARE(I), SE NECESSARIO Utilizzare immediatamente dopo la diluizione. 8. DATA DI SCADENZA EXP 9. PRECAUZIONI PARTICOLARI PER LA CONSERVAZIONE
17 Non conservare a temperatura superiore ai 25 C. Tenere il flaconcino nella scatola di cartone esterna per proteggere il medicinale dalla luce. 10. PRECAUZIONI PARTICOLARI PER LO SMALTIMENTO DEL MEDICINALE NON UTILIZZATO O DEI RIFIUTI DERIVATI DA TALE MEDICINALE, SE NECESSARIO NOME E INDIRIZZO DEL TITOLARE DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO Omeros London Limited London, W1J 6BD Regno Unito 12. NUMERO(I) DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO EU/1/15/1018/ NUMERO DI LOTTO Lotto 14. CONDIZIONE GENERALE DI FORNITURA ISTRUZIONI PER L'USO INFORMAZIONI IN BRAILLE Giustificazione per non apporre il Braille accettata.
18 INFORMAZIONI DA APPORRE SUL CONFEZIONAMENTO SECONDARIO SCATOLA DI CARTONE INTERMEDIA 1. DENOMINAZIONE DEL MEDICINALE Omidria 10 mg/ml + 3 mg/ml concentrato per soluzione per irrigazione intraoculare fenilefrina/ketorolac 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN TERMINI DI PRINCIPIO(I) ATTIVO(I) Un flaconcino da 4 ml contiene fenilefrina cloridrato, pari a 40,6 mg di fenilefrina, e ketorolac trometamolo, pari a 11,5 mg di ketorolac. Dopo la diluizione, la soluzione contiene 0,081 mg/ml di fenilefrina e 0,023 mg/ml di ketorolac. 3. ELENCO DEGLI ECCIPIENTI Eccipienti: acido citrico monoidrato, sodio citrato diidrato, sodio idrossido/acido cloridrico (per l aggiustamento del ph), acqua per preparazioni iniettabili 4. FORMA FARMACEUTICA E CONTENUTO Concentrato per soluzione per irrigazione intraoculare 1 flaconcino. Componente di una confezione multipla, non vendibile separatamente. 5. MODO E VIA(E) DI SOMMINISTRAZIONE Solo monouso. Leggere il foglio illustrativo prima dell'uso. Uso intraoculare dopo diluizione. 6. AVVERTENZA PARTICOLARE CHE PRESCRIVA DI TENERE IL MEDICINALE FUORI DALLA VISTA E DALLA PORTATA DEI BAMBINI Tenere fuori dalla vista e dalla portata dei bambini. 7. ALTRA(E) AVVERTENZA(E) PARTICOLARE(I), SE NECESSARIO Utilizzare immediatamente dopo la diluizione. 8. DATA DI SCADENZA EXP 9. PRECAUZIONI PARTICOLARI PER LA CONSERVAZIONE
19 Non conservare a temperatura superiore ai 25 C. Tenere il flaconcino nella scatola di cartone esterna per proteggere il medicinale dalla luce. 10. PRECAUZIONI PARTICOLARI PER LO SMALTIMENTO DEL MEDICINALE NON UTILIZZATO O DEI RIFIUTI DERIVATI DA TALE MEDICINALE, SE NECESSARIO NOME E INDIRIZZO DEL TITOLARE DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO Omeros London Limited London, W1J 6BD Regno Unito 12. NUMERO(I) DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO EU/1/15/1018/ NUMERO DI LOTTO Lotto 14. CONDIZIONE GENERALE DI FORNITURA ISTRUZIONI PER L'USO INFORMAZIONI IN BRAILLE Giustificazione per non apporre il Braille accettata.
20 INFORMAZIONI MINIME DA APPORRE SUI CONFEZIONAMENTI PRIMARI DI PICCOLE DIMENSIONI FLACONCINO 1. DENOMINAZIONE DEL MEDICINALE E VIA(E) DI SOMMINISTRAZIONE Omidria 10 mg/ml + 3 mg/ml concentrato per soluzione per irrigazione intraoculare fenilefrina/ketorolac 2. MODO DI SOMMINISTRAZIONE Uso intraoculare dopo diluizione. Solo monouso. Leggere il foglio illustrativo prima dell'uso. 3. DATA DI SCADENZA EXP 4. NUMERO DI LOTTO Lotto 5. CONTENUTO IN PESO, VOLUME O UNITÀ 6. ALTRO
21 B. FOGLIO ILLUSTRATIVO
22 Foglio illustrativo: informazioni per l'utilizzatore Omidria 10 mg/ml + 3 mg/ml concentrato per soluzione per irrigazione intraoculare fenilefrina/ketorolac Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei. - Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo. - Se ha qualsiasi dubbio, si rivolga al medico o all'infermiere. - Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico, al farmacista o all infermiere. Vedere paragrafo 4. Contenuto di questo foglio: 1. Che cos è Omidria e a cosa serve 2. Cosa deve sapere prima che sia utilizzato Omidria 3. Come viene utilizzato Omidria 4. Possibili effetti indesiderati 5. Come viene conservato Omidria 6. Contenuto della confezione e altre informazioni 1. Che cos è Omidria e a cosa serve Omidria è un medicinale utilizzato durante gli interventi chirurgici agli occhi. Contiene i principi attivi fenilefrina e ketorolac. La fenilefrina agisce manetnendo la pupilla dilatata (allargata). Ketorolac è un antidolorifico che appartiene al gruppo di medicinali chiamati farmaci antinfiammatori non steroidei (FANS); aiuta inoltre ad arrestare la contrazione (restringimento) della pupilla. Omidria è usato negli adulti per lavare l occhio durante l intervento chirurgico per l impianto di un nuovo cristallino (parte dell occhio che mette a fuoco la luce che passa attraverso la pupilla, consentendo di vedere chiaramente). Questo intervento è noto come impianto di lente intraoculare. Il medicinale è usato per mantenere la pupilla dilatata (allargata) durante l intervento e per ridurre il dolore all occhio dopo la procedura. 2. Cosa deve sapere prima che sia utilizato Omidria Omidria non deve essere usato: - se è allergico a fenilefrina o ketorolac o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6); - se soffre di una malattia dell occhio chiamata glaucoma ad angolo chiuso. Avvertenze e precauzioni Si rivolga al medico o all infermiere prima che sia utilizzato Omidria se: - ha una malattia cardiaca; - ha la pressione sanguigna alta; - ha la tiroide iperattiva (ipertiroidismo); - è allergico all acido acetilsalicilico o ad altri antidolorifici chiamati farmaci antinfiammatori non steroidei (FANS); - soffre di asma. Se rientra in uno dei casi sopra elencati, informi il medico. Il medico deciderà se Omidria è adatto a lei.
23 Bambini e adolescenti Omidria non deve essere usato nei bambini e negli adolescenti di età inferiore a 18 anni, perché non è stato studiato in questi gruppi. Altri medicinali e Omidria Informi il medico se sta assumendo, ha recentemente assunto o potrebbe assumere qualsiasi altro medicinale. - In particolare, informi il medico se sta assumendo atropina, un medicinale usato per dilatare (allargare) la pupilla. L uso concomitante di atropina e Omidria può aumentare la pressione sanguigna e causare un'accelerazione del battito cardiaco in alcuni pazienti. - Uno dei principi attivi contenuti in Omidria può reagire con diversi tipi di anestetici. Il medico ne sarà a conoscenza. Se l intervento all occhio richiede l anestesia generale, ne parli con il medico. Gravidanza e allattamento Se è in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando con latte materno chieda consiglio al medico prima di usare questo medicinale. Omidria non deve essere usato durante la gravidanza. Se è una donna in età fertile, deve usare misure contraccettive idonee prima di ricevere Omidria. Omidria non deve essere usato durante l'allattamento. Guida di veicoli e utilizzo di macchinari Questo medicinale può compromettere la capacità di guidare veicoli o di usare macchinari. Dato che la vista può essere alterata, non deve guidare veicoli o usare macchinari fino a quando non vede chiaramente. 3. Come viene utilizzato Omidria Omidria le sarà somministrato in ospedale o in clinica da un medico o chirurgo specialista di chirurgia dell occhio. Omidria è usato come soluzione per lavare l occhio (soluzione per irrigazione) durante l intervento di sostituzione del cristallino. Se riceve più Omidria di quanto deve La fenilefrina, uno dei principi attivi di Omidria, può causare un rapido aumento della pressione sanguigna se viene somministrata in dose eccessiva e se una quantità sufficiente di essa passa nel sangue, interessando altre parti dell'organismo. Può causare inoltre mal di testa, ansia, nausea e vomito e ritmo del cuore rapido e irregolare. Il medico la terrà sotto osservazione per rilevare eventuali segni o sintomi di effetti indesiderati e provvederà ad instaurare un trattamento, se necessario. Se ha qualsiasi dubbio sull'uso di questo medicinale, si rivolga al medico o all'infermiere. 4. Possibili effetti indesiderati Come tutti i medicinali, questo medicinale può causare effetti indesiderati sebbene non tutte le persone li manifestino. Gli effetti indesiderati elencati di seguito sono in genere di intensità da lieve a moderata e si risolvono di solito da soli, senza effetti a lungo termine.
24 Effetti indesiderati che interessano l occhio Effetti indesiderati comuni (possono riguardare fino a 1 persona su 10): - dolore all occhio - infiammazione della parte anteriore dell occhio - occhi rossi - gonfiore della cornea (lo strato trasparente sulla parte anteriore dell occhio) - sensibilità alla luce Effetti indesiderati non comuni (possono riguardare fino a 1 persona su 100): - fastidio all occhio - infiammazione dell occhio - irritazione dell occhio - arrossamento dell occhio - problemi alla cornea - pupilla dilatata - vista offuscata - riduzione della nitidezza della vista - piccole forme scure che si muovono nel campo visivo - prurito agli occhi - dolore alle palpebre - sensazione di corpi estranei negli occhi - abbagliamento - aumento della pressione nell occhio Effetti indesiderati che interessano l organismo Effetti indesiderati comuni: - infiammazione Effetti indesiderati non comuni: - nausea - dolore - mal di testa Segnalazione degli effetti indesiderati Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico. Lei può inoltre segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di segnalazione riportato nell Allegato V. Segnalando gli effetti indesiderati lei può contribuire a fornire maggiori informazioni sulla sicurezza di questo medicinale. 5. Come viene conservato Omidria Tenere questo medicinale fuori dalla vista e dalla portata dei bambini. Non usi questo medicinale dopo la data di scadenza che è riportata sulla scatola dopo Scad. La data di scadenza si riferisce all'ultimo giorno di quel mese. Non conservare a temperatura superiore ai 25 C. Conservare il flaconcino nella confezione originale per proteggere il medicinale dalla luce. Non usi questo medicinale se la soluzione è torbida o se contiene particelle. La soluzione diluita deve essere utilizzata entro 6 ore dalla diluizione. Non getti alcun medicinale nell'acqua di scarico e nei rifiuti domestici. Chieda al farmacista come eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l'ambiente.
25 6. Contenuto della confezione e altre informazioni Cosa contiene Omidria I principi attivi sono fenilefrina (come cloridrato) e ketorolac (come trometamolo). Ogni flaconcino di soluzione da 4,0 ml contiene 40,6 mg (10,2 mg/ml) di fenilefrina e 11,5 mg (2,88 mg/ml) di ketorolac. Gli altri componenti sono: - acido citrico monoidrato - sodio citrato diidrato - sodio idrossido (per correggere il livello di alcalinità) - acido cloridrico (per correggere il livello di acidità) - acqua per preparazioni iniettabili Descrizione dell aspetto di Omidria e contenuto della confezione Concentrato per soluzione per irrigazione intraoculare sterile, limpido, da incolore a leggermente giallo. Fornito in un flaconcino monouso concepito per contenere 4,0 ml di concentrato per la diluizione in 500 ml di soluzione per irrigazione per uso oftalmico. Flaconcino di vetro di tipo 1 da 5 ml incolore, con tappo in gomma butilica e capsula di chiusura a strappo in polipropilene. La confezione multipla contiene 10 scatole, ognuna contenente un flaconcino monouso. Titolare dell'autorizzazione all'immissione in commercio Omeros London Limited Berkeley Square London, W1J 6BD Regno Unito Tel: +44 (0) Fax: +44 (0) regulatory@omeros.co.uk Produttore Almac Pharma Services Limited Seagoe Industrial Estate, Craigavon, Co. Armagh BT63 5QD Irlanda del Nord Per qualsiasi informazione su questo medicinale, contatti il titolare dell autorizzazione all immissione in commercio. Questo foglio illustrativo è stato aggiornato il <data della decisione della Commissione> Le informazioni seguenti sono destinate esclusivamente agli operatori sanitari Per preparare Omidria per l irrigazione intraoculare, diluire 4,0 ml di Omidria concentrato in 500 ml di soluzione per irrigazione oftalmica standard. Devono essere rispettate le istruzioni seguenti:
26 il flaconcino deve essere ispezionato visivamente per verificare l'eventuale presenza di particolato. Deve essere usata solo una soluzione limpida, da incolore a leggermente gialla, senza particelle visibili; con una tecnica asettica, prelevare 4,0 ml di soluzione concentrata utilizzando un ago sterile idoneo; 4,0 ml di soluzione concentrata devono essere iniettati in una sacca/flacone da 500 ml di soluzione per irrigazione; la sacca deve essere delicatamente capovolta per miscelare la soluzione. La soluzione deve essere utilizzata entro 6 ore dalla preparazione; la sacca deve essere ispezionata visivamente per verificare l'eventuale presenza di particolato. Deve essere usata solo una soluzione limpida, incolore, senza particelle visibili; non devono essere aggiunti altri medicinali alla soluzione per irrigazione preparata. Il flaconcino usato e l eventuale soluzione per irrigazione non utilizzata devono essere smaltiti, dopo l uso singolo, in conformità alla normativa locale vigente.
FOGLIETTO ILLUSTRATIVO FUSIDIUM 1%
 FOGLIETTO ILLUSTRATIVO FUSIDIUM 1% FUSIDIUM 1 % Gocce oftalmiche Acido Fusidico CATEGORIA FARMACOTERAPEUTICA Antinfettivo oculare. INDICAZIONI Fusidium è indicato in infezioni batteriche oculari causate
FOGLIETTO ILLUSTRATIVO FUSIDIUM 1% FUSIDIUM 1 % Gocce oftalmiche Acido Fusidico CATEGORIA FARMACOTERAPEUTICA Antinfettivo oculare. INDICAZIONI Fusidium è indicato in infezioni batteriche oculari causate
Allegato III. Modifiche agli specifici paragrafi del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Modifiche agli specifici paragrafi del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Queste modifiche agli specifici paragrafi del Riassunto delle Caratteristiche
Allegato III Modifiche agli specifici paragrafi del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Queste modifiche agli specifici paragrafi del Riassunto delle Caratteristiche
Foglio illustrativo: informazioni per il paziente Soluzione Schoum soluzione orale
 Foglio illustrativo: informazioni per il paziente Soluzione Schoum soluzione orale Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni per lei.
Foglio illustrativo: informazioni per il paziente Soluzione Schoum soluzione orale Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni per lei.
Allegato I. Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Vista la relazione di valutazione del comitato di valutazione
Allegato I Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Vista la relazione di valutazione del comitato di valutazione
PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO
 FOGLIO ILLUSTRATIVO PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che potete usare per curare disturbi lievi e
FOGLIO ILLUSTRATIVO PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che potete usare per curare disturbi lievi e
Foglio illustrativo: informazioni per il paziente. Gemadol 10% crema Etofenamato
 Foglio illustrativo: informazioni per il paziente Gemadol 10% crema Etofenamato 000020_024180_20150829_Rev 01 Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
Foglio illustrativo: informazioni per il paziente Gemadol 10% crema Etofenamato 000020_024180_20150829_Rev 01 Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
Foglio illustrativo: Informazioni per l utilizzatore. Atosiban Ibisqus 6,75 mg/0,9 ml soluzione iniettabile Medicinale equivalente
 Foglio illustrativo: Informazioni per l utilizzatore Atosiban Ibisqus 6,75 mg/0,9 ml soluzione iniettabile Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale perché
Foglio illustrativo: Informazioni per l utilizzatore Atosiban Ibisqus 6,75 mg/0,9 ml soluzione iniettabile Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale perché
Foglio illustrativo: informazioni per l utilizzatore. Tobramicina e Desametasone EG 0,3% + 0,1% collirio, soluzione Medicinale equivalente
 Foglio illustrativo: informazioni per l utilizzatore Tobramicina e Desametasone EG 0,3% + 0,1% collirio, soluzione Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale
Foglio illustrativo: informazioni per l utilizzatore Tobramicina e Desametasone EG 0,3% + 0,1% collirio, soluzione Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale
100 ml contengono: ketotifene fumarato 0,069 g, pari a 0,05 g di ketotifene.
 1. DENOMINAZIONE DEL MEDICINALE EUSTAMYL 0,05% collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA EUSTAMYL 0,05% collirio, soluzione 100 ml contengono: ketotifene fumarato 0,069 g, pari a 0,05
1. DENOMINAZIONE DEL MEDICINALE EUSTAMYL 0,05% collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA EUSTAMYL 0,05% collirio, soluzione 100 ml contengono: ketotifene fumarato 0,069 g, pari a 0,05
GAZYVARO. Farmaco di nuova registrazione
 AllegatoallaDeterminaAIFANumero1012/2014del24/09/2014/ Inserimento,inaccordoall articolo12,comma5dellalegge189/2012,inappositasezione(denominataclasse C(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilitànellemoredellapresentazioneda
AllegatoallaDeterminaAIFANumero1012/2014del24/09/2014/ Inserimento,inaccordoall articolo12,comma5dellalegge189/2012,inappositasezione(denominataclasse C(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilitànellemoredellapresentazioneda
Denominazione del medicinale STILLA DECONGESTIONANTE 0,05% collirio, soluzione Tetrizolina Cloridrato
 PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo e un medicinale di AUTOMEDICAZIONE che potete usare per curare disturbi lievi e transitori facilmente
PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo e un medicinale di AUTOMEDICAZIONE che potete usare per curare disturbi lievi e transitori facilmente
Vaccino influenzale pandemico (antigeni di superficie, inattivati, adiuvati)
 A. ETICHETTATURA 29 INFORMAZIONI DA APPORRE SULL IMBALLAGGIO ESTERNO ASTUCCIO PER SIRINGA 1. DENOMINAZIONE DEL MEDICINALE Focetria sospensione iniettabile in siringa preriempita. Vaccino influenzale pandemico
A. ETICHETTATURA 29 INFORMAZIONI DA APPORRE SULL IMBALLAGGIO ESTERNO ASTUCCIO PER SIRINGA 1. DENOMINAZIONE DEL MEDICINALE Focetria sospensione iniettabile in siringa preriempita. Vaccino influenzale pandemico
ESSERE OPERATI DI CATARATTA
 DIPARTIMENTO CHIRURGICO SPECIALISTICO Unità Operativa di Oculistica Direttore: Prof. Paolo Perri ESSERE OPERATI DI CATARATTA OPUSCOLO INFORMATIVO PER I PAZIENTI Gentile Signora/e, questo opuscolo ha lo
DIPARTIMENTO CHIRURGICO SPECIALISTICO Unità Operativa di Oculistica Direttore: Prof. Paolo Perri ESSERE OPERATI DI CATARATTA OPUSCOLO INFORMATIVO PER I PAZIENTI Gentile Signora/e, questo opuscolo ha lo
VECTAVIR LABIALE 1% crema penciclovir
 FOGLIO ILLUSTRATIVO PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIETTO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che potete usare per curare disturbi lievi
FOGLIO ILLUSTRATIVO PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIETTO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che potete usare per curare disturbi lievi
INFORMAZIONE AI LAVORATORI/ UTENTI DEL COLLEGIO. PROCEDURE DI SICUREZZA: RISCHIO CHIMICO dovuto all uso di stampanti e toner
 PROCEDURE DI SICUREZZA: RISCHIO CHIMICO dovuto all uso di stampanti e toner Procedure di sicurezza: RISCHIO CHIMICO DOVUTO ALL USO DI STAMPANTI E TONER Autore: IEC S.r.l. Revisione: settembre 2014 INDICE
PROCEDURE DI SICUREZZA: RISCHIO CHIMICO dovuto all uso di stampanti e toner Procedure di sicurezza: RISCHIO CHIMICO DOVUTO ALL USO DI STAMPANTI E TONER Autore: IEC S.r.l. Revisione: settembre 2014 INDICE
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO INCURIN 1 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Principio attivo: estriolo 1 mg/compressa
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO INCURIN 1 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Principio attivo: estriolo 1 mg/compressa
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1/19
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1/19 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Eurican Herpes 205 polvere e solvente per emulsione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1/19 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Eurican Herpes 205 polvere e solvente per emulsione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
SCHEDA DI SEGNALAZIONE SITUAZIONE DI RISCHIO
 SOCIETA ITALIANA DI FARMACIA OSPEDALIERA E DEI SERVIZI FARMACEUTICI DELLE AZIENDE SANITARIE Area Scientifico-Culturale SIFO Rischio Clinico SCHEDA DI SEGNALAZIONE SITUAZIONE DI RISCHIO MODALITÀ DI COMPILAZIONE
SOCIETA ITALIANA DI FARMACIA OSPEDALIERA E DEI SERVIZI FARMACEUTICI DELLE AZIENDE SANITARIE Area Scientifico-Culturale SIFO Rischio Clinico SCHEDA DI SEGNALAZIONE SITUAZIONE DI RISCHIO MODALITÀ DI COMPILAZIONE
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Omidria 10 mg/ml + 3 mg/ml concentrato per soluzione per irrigazione intraoculare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Omidria 10 mg/ml + 3 mg/ml concentrato per soluzione per irrigazione intraoculare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Foglio illustrativo: informazioni per l utilizzatore. Dequadin 0,25 mg compresse Dequalinio cloruro
 Foglio illustrativo: informazioni per l utilizzatore Dequadin 0,25 mg compresse Dequalinio cloruro Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni
Foglio illustrativo: informazioni per l utilizzatore Dequadin 0,25 mg compresse Dequalinio cloruro Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni
Levotuss 60 mg compresse levodropropizina
 Levotuss 60 mg compresse levodropropizina LEGGA ATTENTAMENTE QUESTO FOGLIO PRIMA DI PRENDERE QUESTO MEDICINALE PERCHÉ CONTIENE IMPORTANTI INFORMAZIONI PER LEI. Prenda questo medicinale sempre come esattamente
Levotuss 60 mg compresse levodropropizina LEGGA ATTENTAMENTE QUESTO FOGLIO PRIMA DI PRENDERE QUESTO MEDICINALE PERCHÉ CONTIENE IMPORTANTI INFORMAZIONI PER LEI. Prenda questo medicinale sempre come esattamente
Foglio illustrativo: informazioni per il paziente. Voltaren Emulgel 2% gel diclofenac dietilammonio
 Foglio illustrativo: informazioni per il paziente Voltaren Emulgel 2% gel diclofenac dietilammonio Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni
Foglio illustrativo: informazioni per il paziente Voltaren Emulgel 2% gel diclofenac dietilammonio Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni
Studio di ricerca clinica sul dolore da endometriosi. Il dolore che Lei sente è reale... anche se gli altri non possono vederlo.
 Studio di ricerca clinica sul dolore da endometriosi Il dolore che Lei sente è reale... anche se gli altri non possono vederlo. A822523 Lo studio SOLSTICE verrà condotto in circa 200 centri di ricerca
Studio di ricerca clinica sul dolore da endometriosi Il dolore che Lei sente è reale... anche se gli altri non possono vederlo. A822523 Lo studio SOLSTICE verrà condotto in circa 200 centri di ricerca
ALLEGATO I. Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio
 ALLEGATO I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche - Sindrome da astinenza: Con Effentora/Actiq si
ALLEGATO I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche - Sindrome da astinenza: Con Effentora/Actiq si
Allegato 1 Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione all immissione in commercio
 Allegato 1 Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione all immissione in commercio Conclusioni scientifiche Tenendo conto della valutazione del Comitato per
Allegato 1 Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione all immissione in commercio Conclusioni scientifiche Tenendo conto della valutazione del Comitato per
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE. XALATAN 0,005% collirio, soluzione Latanoprost
 FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE XALATAN 0,005% collirio, soluzione Latanoprost Legga attentamente questo foglio prima di usare questo medicinale. Anche se ha già usato Xalatan o un
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE XALATAN 0,005% collirio, soluzione Latanoprost Legga attentamente questo foglio prima di usare questo medicinale. Anche se ha già usato Xalatan o un
CARTA INTESTATA DEL CENTRO CLINICO
 CARTA INTESTATA DEL CENTRO CLINICO CERLiguria_Mod.10_Uso_Compassionevole RICHIESTA DI PARERE AL COMITATO ETICO PER USO TERAPEUTICO DI MEDICINALE SOTTOPOSTO A SPERIMENTAZIONE CLINICA Si applica solo se
CARTA INTESTATA DEL CENTRO CLINICO CERLiguria_Mod.10_Uso_Compassionevole RICHIESTA DI PARERE AL COMITATO ETICO PER USO TERAPEUTICO DI MEDICINALE SOTTOPOSTO A SPERIMENTAZIONE CLINICA Si applica solo se
STRUMENTO EDUCATIVO PER PAZIENTI CHE ASSUMONO FARMACI CHEMIOTERAPICI ORALI
 STRUMENTO EDUCATIVO PER PAZIENTI CHE ASSUMONO FARMACI CHEMIOTERAPICI ORALI Questo strumento è stato creato per facilitare gli operatori sanitari nella valutazione e nell educazione dei pazienti trattati
STRUMENTO EDUCATIVO PER PAZIENTI CHE ASSUMONO FARMACI CHEMIOTERAPICI ORALI Questo strumento è stato creato per facilitare gli operatori sanitari nella valutazione e nell educazione dei pazienti trattati
Automedicarsi vuol dire curare da sé lievi disturbi o sintomi passeggeri,
 1. RESPONSABILE 1. CHE COSA È L AUTOMEDICAZIONE RESPONSABILE Automedicarsi vuol dire curare da sé lievi disturbi o sintomi passeggeri, come tosse, raffreddore, stitichezza: disturbi che conosciamo bene,
1. RESPONSABILE 1. CHE COSA È L AUTOMEDICAZIONE RESPONSABILE Automedicarsi vuol dire curare da sé lievi disturbi o sintomi passeggeri, come tosse, raffreddore, stitichezza: disturbi che conosciamo bene,
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1/18
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1/18 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Oncept IL-2 liofilizzato e solvente per sospensione iniettabile per gatti 2. COMPOSIZIONE QUALITATIVA
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1/18 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Oncept IL-2 liofilizzato e solvente per sospensione iniettabile per gatti 2. COMPOSIZIONE QUALITATIVA
Stefano Miglior. Il glaucoma ad angolo aperto - G. Cronico SMI
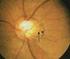 Stefano Miglior Il glaucoma ad angolo aperto - G. Cronico Concetti fondamentali E una malattia estremamente particolare caratterizzata da una progressione lenta ma continua verso la perdita della funzione
Stefano Miglior Il glaucoma ad angolo aperto - G. Cronico Concetti fondamentali E una malattia estremamente particolare caratterizzata da una progressione lenta ma continua verso la perdita della funzione
RUCONEST (Conestat alfa) RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RUCONEST (Conestat alfa) RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ruconest 2100 U polvere per soluzione iniettabile. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un flaconcino
RUCONEST (Conestat alfa) RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ruconest 2100 U polvere per soluzione iniettabile. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un flaconcino
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE. Kytril compresse rivestite con film da 1 mg Kytril compresse rivestite con film da 2 mg
 FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE Kytril compresse rivestite con film da 1 mg Kytril compresse rivestite con film da 2 mg Granisetron Legga attentamente questo foglio prima di prendere
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE Kytril compresse rivestite con film da 1 mg Kytril compresse rivestite con film da 2 mg Granisetron Legga attentamente questo foglio prima di prendere
Foglio illustrativo: informazioni per l utilizzatore Latanoprost Zentiva 0,005% collirio, soluzione
 Foglio illustrativo: informazioni per l utilizzatore Latanoprost Zentiva 0,005% collirio, soluzione Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni
Foglio illustrativo: informazioni per l utilizzatore Latanoprost Zentiva 0,005% collirio, soluzione Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni
CHECK LIST - CHIRURGIA REFRATTIVA CON LASER AD ECCIMERI
 ENTE DI CERTIFICAZIONE DI QUALITA S.O.I. S.r.l. con socio unico V.I. del c/o 1-REQUISITI STRUTTURALI 1.1-Generali 1.1.1 E' garantita una facile accessibilità dall'esterno sia per quanto concerne l'ingresso
ENTE DI CERTIFICAZIONE DI QUALITA S.O.I. S.r.l. con socio unico V.I. del c/o 1-REQUISITI STRUTTURALI 1.1-Generali 1.1.1 E' garantita una facile accessibilità dall'esterno sia per quanto concerne l'ingresso
Conclusioni scientifiche
 Allegato II Conclusioni scientifiche e motivi della revoca o variazione dei termini delle autorizzazioni all immissione in commercio e spiegazione dettagliata delle differenze rispetto alla raccomandazione
Allegato II Conclusioni scientifiche e motivi della revoca o variazione dei termini delle autorizzazioni all immissione in commercio e spiegazione dettagliata delle differenze rispetto alla raccomandazione
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO ProteqFlu sospensione iniettabile per cavalli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una dose da
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO ProteqFlu sospensione iniettabile per cavalli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una dose da
Intervento di Capsulotomia Laser INFORMAZIONI
 Intervento di Capsulotomia Laser INFORMAZIONI Gentile Signore/ Signora, Lei soffre di una opacizzazione dell involucro (capsula) che avvolge parzialmente il suo cristallino artificiale.esso è responsabile
Intervento di Capsulotomia Laser INFORMAZIONI Gentile Signore/ Signora, Lei soffre di una opacizzazione dell involucro (capsula) che avvolge parzialmente il suo cristallino artificiale.esso è responsabile
Valutazione dell IG di Frollini tradizionali e preparati con farina con l aggiunta del % di Freno SIGI.
 Valutazione dell IG di Frollini tradizionali e preparati con farina con l aggiunta del % di Freno SIGI. Premessa L'indice glicemico (IG) di un alimento, definito come l'area sotto la curva (AUC) della
Valutazione dell IG di Frollini tradizionali e preparati con farina con l aggiunta del % di Freno SIGI. Premessa L'indice glicemico (IG) di un alimento, definito come l'area sotto la curva (AUC) della
DETERMINAZIONE V&A n. 970 del 10 luglio 2012
 ALLEGATO 2 GLICINA DETERMINAZIONE V&A n. 970 del 10 luglio 2012 RIASSUNTODELLECARATTERISTICHEDELPRODOTTO 1.DENOMINAZIONEDELMEDICINALE Glicina1,5%soluzioneperirrigazione 2.COMPOSIZIONEQUALITATIVAEQUANTITATIVA
ALLEGATO 2 GLICINA DETERMINAZIONE V&A n. 970 del 10 luglio 2012 RIASSUNTODELLECARATTERISTICHEDELPRODOTTO 1.DENOMINAZIONEDELMEDICINALE Glicina1,5%soluzioneperirrigazione 2.COMPOSIZIONEQUALITATIVAEQUANTITATIVA
retina macula La macula è la parte centrale della retina. Essa consente la visione dei colori ed il riconoscimento di dettagli come ad es. la lettura.
 retina macula La macula è la parte centrale della retina. Essa consente la visione dei colori ed il riconoscimento di dettagli come ad es. la lettura. 2 Questa è l immagine schematica della macula sana.
retina macula La macula è la parte centrale della retina. Essa consente la visione dei colori ed il riconoscimento di dettagli come ad es. la lettura. 2 Questa è l immagine schematica della macula sana.
CONSENSO INFORMATO PER LA LASERVITREOLISI DEI CORPI MOBILI VITREALI
 SIG... CONSEGNATO IL... FIRMA... Gentile Signora, Signore, Lei soffre di una affezione del vitreo responsabile dei suoi disturbi visivi. Questa scheda contiene le informazioni sul trattamento che Le è
SIG... CONSEGNATO IL... FIRMA... Gentile Signora, Signore, Lei soffre di una affezione del vitreo responsabile dei suoi disturbi visivi. Questa scheda contiene le informazioni sul trattamento che Le è
TRIATEC. Caso clinico
 Caso clinico A inizio 2012: una nuova paziente di 34 anni (A.V.) mi chiede al telefono un appuntamento riferendo di essere all inizio della sua prima gravidanza (6 settimane di amenorrea). Chiedo se ha
Caso clinico A inizio 2012: una nuova paziente di 34 anni (A.V.) mi chiede al telefono un appuntamento riferendo di essere all inizio della sua prima gravidanza (6 settimane di amenorrea). Chiedo se ha
FIACCHEZZA, STANCHEZZA, MALESSERE MORALE. Carenza di ferro molto diffusa e spesso sottovalutata
 FIACCHEZZA, STANCHEZZA, MALESSERE MORALE Carenza di ferro molto diffusa e spesso sottovalutata Cari pazienti! Vi sentite spesso fiacchi, stanchi, esauriti o giù di morale? Soffrite facilmente il freddo?
FIACCHEZZA, STANCHEZZA, MALESSERE MORALE Carenza di ferro molto diffusa e spesso sottovalutata Cari pazienti! Vi sentite spesso fiacchi, stanchi, esauriti o giù di morale? Soffrite facilmente il freddo?
IL GLAUCOMA I A P B I T A L I A O N L U S P E R A M O R E D E L L A V I S T A
 IL GLAUCOMA I A P B I T A L I A O N L U S P E R A M O R E D E L L A V I S T A IL GLAUCOMA Che cos è? Campagna informativa per la prevenzione delle malattie oculari che possono compromettere la visione
IL GLAUCOMA I A P B I T A L I A O N L U S P E R A M O R E D E L L A V I S T A IL GLAUCOMA Che cos è? Campagna informativa per la prevenzione delle malattie oculari che possono compromettere la visione
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE. Unicexal 2 mg/ml gocce auricolari, soluzione Ciprofloxacina
 FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE Unicexal 2 mg/ml gocce auricolari, soluzione Ciprofloxacina Legga attentamente questo foglio prima di prendere questo medicinale. - Conservi questo
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE Unicexal 2 mg/ml gocce auricolari, soluzione Ciprofloxacina Legga attentamente questo foglio prima di prendere questo medicinale. - Conservi questo
AIFA Agenzia Italiana del Farmaco Sirolimus (Rapamune)
 AIFA - Sirolimus (Rapamune) 08/02/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Sirolimus (Rapamune) Nota Informativa Importante (08 Febbraio 2010) file:///c /documenti/sir653.htm [08/02/2010 10.47.36]
AIFA - Sirolimus (Rapamune) 08/02/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Sirolimus (Rapamune) Nota Informativa Importante (08 Febbraio 2010) file:///c /documenti/sir653.htm [08/02/2010 10.47.36]
Foglio illustrativo: informazioni per il paziente. NIMODIPINA EG 30 mg/0,75 ml gocce orali, soluzione. Medicinale equivalente
 Foglio illustrativo: informazioni per il paziente NIMODIPINA EG 30 mg/0,75 ml gocce orali, soluzione Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale perché contiene
Foglio illustrativo: informazioni per il paziente NIMODIPINA EG 30 mg/0,75 ml gocce orali, soluzione Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale perché contiene
DIPARTIMENTO CHIRURGICO SPECIALISTICO Unità Operativa di Oculistica Direttore: prof. Paolo Perri IL GLAUCOMA OPUSCOLO INFORMATIVO PER I PAZIENTI
 DIPARTIMENTO CHIRURGICO SPECIALISTICO Unità Operativa di Oculistica Direttore: prof. Paolo Perri IL GLAUCOMA OPUSCOLO INFORMATIVO PER I PAZIENTI Gentile Signora/e, questo opuscolo ha lo scopo di informarla
DIPARTIMENTO CHIRURGICO SPECIALISTICO Unità Operativa di Oculistica Direttore: prof. Paolo Perri IL GLAUCOMA OPUSCOLO INFORMATIVO PER I PAZIENTI Gentile Signora/e, questo opuscolo ha lo scopo di informarla
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Nobivac Myxo-RHD liofilizzato e solvente per sospensione iniettabile per conigli. 2. COMPOSIZIONE QUALITATIVA
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Nobivac Myxo-RHD liofilizzato e solvente per sospensione iniettabile per conigli. 2. COMPOSIZIONE QUALITATIVA
Foglio illustrativo: informazioni per il paziente. Voltalgan 3% schiuma cutanea diclofenac
 Foglio illustrativo: informazioni per il paziente Voltalgan 3% schiuma cutanea diclofenac Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei.
Foglio illustrativo: informazioni per il paziente Voltalgan 3% schiuma cutanea diclofenac Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei.
Effettuare gli audit interni
 Scopo Definire le modalità per la gestione delle verifiche ispettive interne Fornitore del Processo Input Cliente del Processo Qualità (centrale) e Referenti Qualità delle sedi territoriali Direzione Qualità
Scopo Definire le modalità per la gestione delle verifiche ispettive interne Fornitore del Processo Input Cliente del Processo Qualità (centrale) e Referenti Qualità delle sedi territoriali Direzione Qualità
La sicurezza e l efficacia dell ofloxacina negli infanti di età inferiore ad un anno non sono state stabilite.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE EUKINOFT 0,3% collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA EUKINOFT 0,3% collirio, soluzione 1 ml di soluzione
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE EUKINOFT 0,3% collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA EUKINOFT 0,3% collirio, soluzione 1 ml di soluzione
IDROSSIZINA. Redazione scientifica: S. Bertella. E. Clementi, M. Molteni, M. Pozzi, S. Radice
 a cura di: IRCCS E. MEDEA LA NOSTRA FAMIGLIA (Direttore sanitario Dott. M. Molteni) UO FARMACOLOGIA CLINICA AO L. SACCO (Direttore Prof. E. Clementi) Redazione scientifica: S. Bertella. E. Clementi, M.
a cura di: IRCCS E. MEDEA LA NOSTRA FAMIGLIA (Direttore sanitario Dott. M. Molteni) UO FARMACOLOGIA CLINICA AO L. SACCO (Direttore Prof. E. Clementi) Redazione scientifica: S. Bertella. E. Clementi, M.
Ligosan 140 mg/g gel periodontale Doxiciclina. 1. Che cos è Ligosan e a che cosa serve. 2. Cosa deve sapere prima di prendere Ligosan
 Page 1 of 6 Foglio illustrativo: Informazioni per il Paziente Ligosan 140 mg/g gel periodontale Doxiciclina Legga attentamente questo foglio prima di usare questo medicinale. Conservi questo foglio. Potrebbe
Page 1 of 6 Foglio illustrativo: Informazioni per il Paziente Ligosan 140 mg/g gel periodontale Doxiciclina Legga attentamente questo foglio prima di usare questo medicinale. Conservi questo foglio. Potrebbe
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Marzo 2009 Nuove modalità di prescrizione per i medicinali contenenti isotretinoina ad
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Marzo 2009 Nuove modalità di prescrizione per i medicinali contenenti isotretinoina ad
Foglio illustrativo: informazioni per l utilizzatore. BRIMONIDINA EG 2 mg/ml collirio, soluzione Medicinale equivalente
 Foglio illustrativo: informazioni per l utilizzatore BRIMONIDINA EG 2 mg/ml collirio, soluzione Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale. - Conservi questo
Foglio illustrativo: informazioni per l utilizzatore BRIMONIDINA EG 2 mg/ml collirio, soluzione Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale. - Conservi questo
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Purevax RC liofilizzato e solvente per sospensione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Purevax RC liofilizzato e solvente per sospensione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO NAXCEL 200 mg/ml sospensione iniettabile per bovini 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO NAXCEL 200 mg/ml sospensione iniettabile per bovini 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml
PROTOCOLLO PER LA GESTIONE DEI FARMACI
 PROTOCOLLO PER LA GESTIONE DEI FARMACI Farmaci OBIETTIVI Principale obiettivo del presente protocollo è la corretta gestione di: prescrizione approvigionamento stoccaggio somministrazione dei farmaci RISORSE
PROTOCOLLO PER LA GESTIONE DEI FARMACI Farmaci OBIETTIVI Principale obiettivo del presente protocollo è la corretta gestione di: prescrizione approvigionamento stoccaggio somministrazione dei farmaci RISORSE
ESSERE OPERATI DI GLAUCOMA
 DIPARTIMENTO CHIRURGICO SPECIALISTICO Unità Operativa di Oculistica Direttore: Prof. Paolo Perri ESSERE OPERATI DI GLAUCOMA OPUSCOLO CON INFORMAZIONI ED ISTRUZIONI PER I PAZIENTI Gentile Signora/e, questo
DIPARTIMENTO CHIRURGICO SPECIALISTICO Unità Operativa di Oculistica Direttore: Prof. Paolo Perri ESSERE OPERATI DI GLAUCOMA OPUSCOLO CON INFORMAZIONI ED ISTRUZIONI PER I PAZIENTI Gentile Signora/e, questo
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Beta-interferoni: rischio di microangiopatia trombotica e sindrome nefrosica 20 Agosto
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Beta-interferoni: rischio di microangiopatia trombotica e sindrome nefrosica 20 Agosto
VIGILANZA SU FARMACI E FITOTERAPICI
 VIGILANZA SU FARMACI E FITOTERAPICI VIGILANZA SUI FARMACI Gli operatori sanitari (medici, farmacisti, infermieri ecc.) devono: compilare l apposita scheda di segnalazione delle reazioni avverse (vedi allegato1);
VIGILANZA SU FARMACI E FITOTERAPICI VIGILANZA SUI FARMACI Gli operatori sanitari (medici, farmacisti, infermieri ecc.) devono: compilare l apposita scheda di segnalazione delle reazioni avverse (vedi allegato1);
Riassunto delle Caratteristiche del Prodotto INDICE. 01.0 DENOMINAZIONE DEL MEDICINALE Inizio Pagina.
 1 di 5 07/11/2012 14:56 A B C D E F G H I J K L M N O P Q R S T U V W X Y Riassunto delle Caratteristiche del Prodotto INDICE 01.0 DENOMINAZIONE DEL MEDICINALE 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA
1 di 5 07/11/2012 14:56 A B C D E F G H I J K L M N O P Q R S T U V W X Y Riassunto delle Caratteristiche del Prodotto INDICE 01.0 DENOMINAZIONE DEL MEDICINALE 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Foglio illustrativo: informazioni per il paziente Hexvix 85mg polvere e solvente per soluzione endovescicale Esaminolevulinato
 Foglio illustrativo: informazioni per il paziente Hexvix 85mg polvere e solvente per soluzione endovescicale Esaminolevulinato Legga attentamente questo foglio prima di usare questo medicinale perché contiene
Foglio illustrativo: informazioni per il paziente Hexvix 85mg polvere e solvente per soluzione endovescicale Esaminolevulinato Legga attentamente questo foglio prima di usare questo medicinale perché contiene
Dronedarone e insufficienza renale acuta: analisi delle segnalazioni della Rete Nazionale di Farmacovigilanza
 Dronedarone e insufficienza renale acuta: analisi delle segnalazioni della Rete Nazionale di Farmacovigilanza Domenico Motola Dipartimento di Scienze Mediche e Chirurgiche Unità di farmacologia Università
Dronedarone e insufficienza renale acuta: analisi delle segnalazioni della Rete Nazionale di Farmacovigilanza Domenico Motola Dipartimento di Scienze Mediche e Chirurgiche Unità di farmacologia Università
IAPB Agenzia internazionale per la prevenzione della cecità Sezione Italiana IL GLAUCOMA
 IAPB Agenzia internazionale per la prevenzione della cecità Sezione Italiana IL GLAUCOMA CAMPAGNA DI INFORMAZIONE DI SANITA' PUBBLICA SULLE MALATTIE CHE CAUSANO CECITA' O IPOVISIONE NELL'AMBITO DI PROGRAMMI
IAPB Agenzia internazionale per la prevenzione della cecità Sezione Italiana IL GLAUCOMA CAMPAGNA DI INFORMAZIONE DI SANITA' PUBBLICA SULLE MALATTIE CHE CAUSANO CECITA' O IPOVISIONE NELL'AMBITO DI PROGRAMMI
SCHEDA DI SICUREZZA CLEM CANDEGGINA
 Pagina: 1/5 1- INDIVIDUAZIONE DEL PRODOTTO MARCHIO PRODUTTORE/FORNITORE CLEM DETERGENTI S.R.L. INDIRIZZO Via Corcioni, 7 Ottaviano (NA) TEL./FAX 081/8279995 E-mail clem.detergenti@virgilio.it CENTRI ANTIVELENO:
Pagina: 1/5 1- INDIVIDUAZIONE DEL PRODOTTO MARCHIO PRODUTTORE/FORNITORE CLEM DETERGENTI S.R.L. INDIRIZZO Via Corcioni, 7 Ottaviano (NA) TEL./FAX 081/8279995 E-mail clem.detergenti@virgilio.it CENTRI ANTIVELENO:
Guida Compilazione Piani di Studio on-line
 Guida Compilazione Piani di Studio on-line SIA (Sistemi Informativi d Ateneo) Visualizzazione e presentazione piani di studio ordinamento 509 e 270 Università della Calabria (Unità organizzativa complessa-
Guida Compilazione Piani di Studio on-line SIA (Sistemi Informativi d Ateneo) Visualizzazione e presentazione piani di studio ordinamento 509 e 270 Università della Calabria (Unità organizzativa complessa-
Firenze 26 Settembre 2014. Antonella Leto Presidente Associazione Nazionale Infermieri Neuroscienze (ANIN)
 Firenze 26 Settembre 2014 Antonella Leto Presidente Associazione Nazionale Infermieri Neuroscienze (ANIN) Regolamento (UE) n. 536/2014 del Parlamento europeo e del Consiglio, del 16 aprile 2014, sulla
Firenze 26 Settembre 2014 Antonella Leto Presidente Associazione Nazionale Infermieri Neuroscienze (ANIN) Regolamento (UE) n. 536/2014 del Parlamento europeo e del Consiglio, del 16 aprile 2014, sulla
AGENTI CHIMICI VALUTAZIONE DEL RISCHIO
 Dipartimento di Sanità Pubblica U.O. Prevenzione e Sicurezza Ambienti di Lavoro AGENTI CHIMICI VALUTAZIONE DEL RISCHIO Arcari Claudio e Mariacristina Mazzari Piacenza 6 maggio 2011 1 CURVA DOSE-EFFETTO
Dipartimento di Sanità Pubblica U.O. Prevenzione e Sicurezza Ambienti di Lavoro AGENTI CHIMICI VALUTAZIONE DEL RISCHIO Arcari Claudio e Mariacristina Mazzari Piacenza 6 maggio 2011 1 CURVA DOSE-EFFETTO
Il farmaco generico. Contenuti tecnico-scientifici del farmaco generico: comunicazione a corrente alternata
 Il farmaco generico Contenuti tecnico-scientifici del farmaco generico: comunicazione a corrente alternata Il farmaco generico Cos è un farmaco generico? È un medicinale EQUIVALENZA terapeuticamente equivalente
Il farmaco generico Contenuti tecnico-scientifici del farmaco generico: comunicazione a corrente alternata Il farmaco generico Cos è un farmaco generico? È un medicinale EQUIVALENZA terapeuticamente equivalente
Segnaliamo le sospette reazioni avverse! Come fare?
 La Farmacovigilanza. Perché, quando e come segnalare le Reazioni Avverse da Farmaci Segnaliamo le sospette reazioni avverse! Come fare? Dr. Michele Conti Regione Lazio Farmacista collaboratore di Farmacovigilanza
La Farmacovigilanza. Perché, quando e come segnalare le Reazioni Avverse da Farmaci Segnaliamo le sospette reazioni avverse! Come fare? Dr. Michele Conti Regione Lazio Farmacista collaboratore di Farmacovigilanza
Foglio illustrativo: informazioni per il paziente. Folina 5 mg capsule molli. Acido folico
 Foglio illustrativo: informazioni per il paziente Folina 5 mg capsule molli Acido folico Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni per
Foglio illustrativo: informazioni per il paziente Folina 5 mg capsule molli Acido folico Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni per
AVVISO URGENTE DI SICUREZZA DEL PRODOTTO
 AVVISO URGENTE DI SICUREZZA DEL PRODOTTO 29 ottobre 2015 Per l apparecchiatura di emodialisi NxStage System One S Catalogo n. NX1000-3 / NX1000-3-A Gentile Dottore, NxStage ha rilevato un errore del software
AVVISO URGENTE DI SICUREZZA DEL PRODOTTO 29 ottobre 2015 Per l apparecchiatura di emodialisi NxStage System One S Catalogo n. NX1000-3 / NX1000-3-A Gentile Dottore, NxStage ha rilevato un errore del software
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1) Denominazione del medicinale Efemoline 0,1% +0,025% collirio, sospensione
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1) Denominazione del medicinale Efemoline 0,1% +0,025% collirio, sospensione 2) Composizione qualitativa e quantitativa 1 ml di collirio contiene: fluorometolone
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1) Denominazione del medicinale Efemoline 0,1% +0,025% collirio, sospensione 2) Composizione qualitativa e quantitativa 1 ml di collirio contiene: fluorometolone
Guida per l utilizzo dei rapporti online fornisce
 Protezione della salute dei pazienti La presente guida per l utilizzo dei rapporti online fornisce informazioni sui campi di dati, sul formato, sulla corretta interpretazione e sulle funzionalità delle
Protezione della salute dei pazienti La presente guida per l utilizzo dei rapporti online fornisce informazioni sui campi di dati, sul formato, sulla corretta interpretazione e sulle funzionalità delle
DOTT. FEDERICO DI TIZIO MEDICO CHIRURGO - SPECIALISTA IN OFTALMOLOGIA
 DOTT. FEDERICO DI TIZIO MEDICO CHIRURGO - SPECIALISTA IN OFTALMOLOGIA Sig./Sig. ra : Occhio da operare: OD OS Intervento: Chirurgo: Facoemulsificazione della cataratta con impianto di cristallino artificiale
DOTT. FEDERICO DI TIZIO MEDICO CHIRURGO - SPECIALISTA IN OFTALMOLOGIA Sig./Sig. ra : Occhio da operare: OD OS Intervento: Chirurgo: Facoemulsificazione della cataratta con impianto di cristallino artificiale
VICKS SINEX 0,05% SPRAY NASALE SOLUZIONE OSSIMETAZOLINA CLORIDRATO 15 ML FLACONE
 VICKS SINEX 0,05% SPRAY NASALE SOLUZIONE OSSIMETAZOLINA CLORIDRATO 15 ML FLACONE Foglio illustrativo PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo
VICKS SINEX 0,05% SPRAY NASALE SOLUZIONE OSSIMETAZOLINA CLORIDRATO 15 ML FLACONE Foglio illustrativo PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo
Istituto Scientifico di Pavia Sede di Via Salvatore Maugeri 10
 Sede legale e amministrativa: Via Salvatore Maugeri 4, 27100 Pavia Italy Tel. 0382 592504 Fax 0382 592576 www.fsm.it C.F. e P. IVA 00305700189 Registro Persone Giuridiche Private della Regione Lombardia
Sede legale e amministrativa: Via Salvatore Maugeri 4, 27100 Pavia Italy Tel. 0382 592504 Fax 0382 592576 www.fsm.it C.F. e P. IVA 00305700189 Registro Persone Giuridiche Private della Regione Lombardia
Sede Operativa: Via G. Papini n. 18 40128 Bologna (Bo) Tel. + 39 051 4172311 fax + 39 051 326006
 Alle Imprese Associate del Settore Alimentazione e Pubblici Esercizi Oggetto: etichettatura alimenti ed indicazione alergeni La piena applicazione del Regolamento (CE) 25 ottobre 2011, n. 1169 ha comportato
Alle Imprese Associate del Settore Alimentazione e Pubblici Esercizi Oggetto: etichettatura alimenti ed indicazione alergeni La piena applicazione del Regolamento (CE) 25 ottobre 2011, n. 1169 ha comportato
L Investigator s Brochure. Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari. Maglie 25 novembre 2004
 L Investigator s Brochure Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari Maglie 25 novembre 2004 Investigator s Brochure Good Clinical Practice DM 15/07/97 Cosa è? L IB è una raccolta
L Investigator s Brochure Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari Maglie 25 novembre 2004 Investigator s Brochure Good Clinical Practice DM 15/07/97 Cosa è? L IB è una raccolta
Leggere attentamente l etichetta e la Scheda di 2Sicurezza (SDS)
 Leggere attentamente l etichetta e la Scheda di 2Sicurezza (SDS) Come si legge un etichetta L etichetta di un agrofarmaco deriva dalla valutazione di numerosi studi effettuati sul prodotto inerenti aspetti
Leggere attentamente l etichetta e la Scheda di 2Sicurezza (SDS) Come si legge un etichetta L etichetta di un agrofarmaco deriva dalla valutazione di numerosi studi effettuati sul prodotto inerenti aspetti
FOLINA 15 mg/2 ml soluzione iniettabile FOLINA 5 mg capsule molli ACIDO FOLICO
 1 Foglio illustrativo FOLINA 15 mg/2 ml soluzione iniettabile FOLINA 5 mg capsule molli ACIDO FOLICO Categoria farmacoterapeutica ATC: B03BB01 preparati antianemici: acido folico e derivati. INDICAZIONI
1 Foglio illustrativo FOLINA 15 mg/2 ml soluzione iniettabile FOLINA 5 mg capsule molli ACIDO FOLICO Categoria farmacoterapeutica ATC: B03BB01 preparati antianemici: acido folico e derivati. INDICAZIONI
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE IKERVIS 1 mg/ml collirio, emulsione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml di emulsione contiene 1 mg
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE IKERVIS 1 mg/ml collirio, emulsione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml di emulsione contiene 1 mg
PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO
 OK pratica VN2/2013/65 Foglio illustrativo PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che potete usare per curare
OK pratica VN2/2013/65 Foglio illustrativo PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che potete usare per curare
PROCEDURA GESTIONALE RISTORAZIONE COLLETTIVA. Titolo : Gestione delle non conformità GESTIONE DELLE NON CONFORMITA
 Pag. 1 di 6 GESTIONE DELLE NON CONFORMITA INDICE: 1 - Campo di applicazione 2 - Scopo 3 - Documenti di riferimento 4 - Definizioni e abbreviazioni 5 Responsabilità 6 - Modalità Operative 7 Archiviazione
Pag. 1 di 6 GESTIONE DELLE NON CONFORMITA INDICE: 1 - Campo di applicazione 2 - Scopo 3 - Documenti di riferimento 4 - Definizioni e abbreviazioni 5 Responsabilità 6 - Modalità Operative 7 Archiviazione
Corso di. Dott.ssa Donatella Cocca
 Corso di Statistica medica e applicata Dott.ssa Donatella Cocca 1 a Lezione Cos'è la statistica? Come in tutta la ricerca scientifica sperimentale, anche nelle scienze mediche e biologiche è indispensabile
Corso di Statistica medica e applicata Dott.ssa Donatella Cocca 1 a Lezione Cos'è la statistica? Come in tutta la ricerca scientifica sperimentale, anche nelle scienze mediche e biologiche è indispensabile
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Yellox 0,9 mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml di soluzione contiene 0,9
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Yellox 0,9 mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml di soluzione contiene 0,9
SCHEDA INFORMATIVA ESAME ANGIOGRAFIA RETINICA
 Gentile Signora, Signore, Lei ha un problema alla retina. Questa scheda contiene le informazioni sul trattamento che Le è proposto, sui risultati e sui rischi. Tutte le espressioni tecniche è bene che
Gentile Signora, Signore, Lei ha un problema alla retina. Questa scheda contiene le informazioni sul trattamento che Le è proposto, sui risultati e sui rischi. Tutte le espressioni tecniche è bene che
AIFA Agenzia Italiana del Farmaco Valproato
 AIFA - Valproato 18/12/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Valproato Rivalutazione CHMP file:///c /documenti/val9510.htm [18/12/2009 12.44.38] Domande e risposte sulla rivalutazione dei
AIFA - Valproato 18/12/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Valproato Rivalutazione CHMP file:///c /documenti/val9510.htm [18/12/2009 12.44.38] Domande e risposte sulla rivalutazione dei
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. ENDOREM
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. ENDOREM 1. DENOMINAZIONE DEL MEDICINALE ENDOREM, 11,2 mg Fe/ml, concentrato per sospensione per infusione. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. ENDOREM 1. DENOMINAZIONE DEL MEDICINALE ENDOREM, 11,2 mg Fe/ml, concentrato per sospensione per infusione. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml
Disciplina di dispensazione al pubblico dei medicamenti
 Disciplina di dispensazione al pubblico dei medicamenti La dispensazione al pubblico dei medicamenti Tutte le attività che orbitano nel settore farmaceutico (produzione di farmaci, controllo, verifiche,
Disciplina di dispensazione al pubblico dei medicamenti La dispensazione al pubblico dei medicamenti Tutte le attività che orbitano nel settore farmaceutico (produzione di farmaci, controllo, verifiche,
Stefano Miglior. Il Glaucoma ad angolo stretto/chiuso SMI
 Stefano Miglior Il Glaucoma ad angolo stretto/chiuso Che cos e? Forma particolare di glaucoma, relativamente frequente nella popolazione generale, ad andamento sia cronico che acuto si manifesta soprattutto
Stefano Miglior Il Glaucoma ad angolo stretto/chiuso Che cos e? Forma particolare di glaucoma, relativamente frequente nella popolazione generale, ad andamento sia cronico che acuto si manifesta soprattutto
Additivi alimentari: aspetti normativi e criticità della etichettatura
 Corso di formazione sugli additivi alimentari 23 gennaio 2013 I edizione 24 gennaio 2013 II edizione Benevento Additivi alimentari: aspetti normativi e criticità della etichettatura Antonella Semeraro
Corso di formazione sugli additivi alimentari 23 gennaio 2013 I edizione 24 gennaio 2013 II edizione Benevento Additivi alimentari: aspetti normativi e criticità della etichettatura Antonella Semeraro
Specificità visita oculistica pediatrica
 Oftalmologia pediatrica Specificità visita oculistica pediatrica Nei bambini il periodo che va dai 6 mesi fino ai 10-12 anni è decisivo per il raggiungimento della stabilità visiva I danni che si verificano
Oftalmologia pediatrica Specificità visita oculistica pediatrica Nei bambini il periodo che va dai 6 mesi fino ai 10-12 anni è decisivo per il raggiungimento della stabilità visiva I danni che si verificano
PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO
 Foglio illustrativo PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che potete usare per curare disturbi lievi e
Foglio illustrativo PRIMA DELL USO LEGGERE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che potete usare per curare disturbi lievi e
La valutazione del rischio chimico
 La valutazione del rischio chimico Introduzione Per sua stessa definizione, l agente chimico è una sostanza o un preparato di natura chimica. L agente chimico può presentarsi sotto forma di gas, vapore,
La valutazione del rischio chimico Introduzione Per sua stessa definizione, l agente chimico è una sostanza o un preparato di natura chimica. L agente chimico può presentarsi sotto forma di gas, vapore,
TRATTAMENTO DEL DOLORE POSTOPERATORIO
 TRATTAMENTO DEL DOLORE POSTOPERATORIO SITUAZIONE ALGICA MAGGIORE PERIDURALE CONTINUA Analgesia OPPURE PERINERVOSO CONTINUO + AD ORARI FISSI OPPURE ENDOVENOSO CONTINUO * + AD ORARI FISSI * in mancanza di
TRATTAMENTO DEL DOLORE POSTOPERATORIO SITUAZIONE ALGICA MAGGIORE PERIDURALE CONTINUA Analgesia OPPURE PERINERVOSO CONTINUO + AD ORARI FISSI OPPURE ENDOVENOSO CONTINUO * + AD ORARI FISSI * in mancanza di
