Per una corretta impostazione della fertirrigazione, è necessario conoscere bene l'analisi dell'acqua e la sua acidificazione
|
|
|
- Concetta Romagnoli
- 6 anni fa
- Visualizzazioni
Transcript
1 Bolzano: 26 giugno 2017 Per una corretta impostazione della fertirrigazione, è necessario conoscere bene l'analisi dell'acqua e la sua acidificazione Dr. Agr. Silvio Fritegotto - 1
2 Per una corretta impostazione della fertirrigazione, è necessario l'analisi dell'acqua e la sua acidificazione L acidificazione delle soluzioni nutritive in fertirrigazione è una pratica comune e vantaggiosa sotto numerosi punti di vista. In generale, l acidificazione delle soluzioni nutritive, fino a raggiungere il ph desiderato, 5,5 6,5 si effettua mediante l applicazione di acidi minerali. 2
3 Per una corretta impostazione della fertirrigazione, è necessario l'analisi dell'acqua e la sua acidificazione 1) Composizione chimica dell acqua d irrigazione 2) Il potere tampone dell acqua prima dell addizione di un acido, e questo dipende esclusivamente dalla presenza dello ione bicarbonato HCO 3-. 3) Aggiungendo un acido, (vale a dire, qualunque sostanza capace di apportare ioni idrogeno H + ), si produce la seguente reazione di neutralizzazione. HCO H + H 2 O + CO 2 3
4 4
5 5
6 6
7 7
8 8
9 9
10 10
11 La Coca-Cola contiene acido fosforico in una concentrazione di 325 mg/l (0,325%) che le conferisce un valore di ph di circa 2,4 Succo gastrico (ph 1,5); Succo di Limone (ph 2,4); Aceto (ph 2,9). Fonte: Wikipedia 11
12 Esempio di un analisi chimica di un acqua irrigua 12
13 Curva di titolazione di un acido per abbassare il ph 13
14 Esempio di una seconda analisi chimica di un acqua irrigua con il valore di ph elevato e i Bicarbonati più bassi 14
15 Grafico di precipitazione e dissoluzione dei bicarbonati 15
16 Parametri di valutazione per diverse acque Valori bassi Valori medi Valori elevati EC ms/cm < 0,5 > 0,5 ; < 1,5 > 1,5 Parametro mg/l mmoli/l mg/l mmoli/l mg/l mmoli/l Calcio < 40 < 1,00 > 40 ; < 80 > 1,0 ; < 2,0 > 80 > 2,0 Magnesio < 12 < 0,5 > 12 ; < 24 > 0,5 ; < 1,0 > 24 > 1,0 Sodio < 23 < 1,0 > 23 ; < 46 > 1,0 ; < 2,0 > 46 > 2,0 Potassio Bicarbonati < 61 < 1,0 > 61 ; < 305 > 1,0 ; < 5,0 > 305 > 5,0 Cloruri < 18 < 0,5 > 18 ; < 35 > 0,5 ; < 1,0 > 35 > 1,0 Fosforo Solfati < 48 < 0,5 > 48 ; < 96 > 0,5 ; < 1,0 > 96 > 1,0 N Ammoniacale N Nitrico 16
17 Acidificazione: quali VANTAGGI Prevenzione e/o eliminazione di occlusioni e depositi nell impianto d irrigazione e nei gocciolatoi. 17
18 Acidificazione: quali VANTAGGI Quali sono i rischi di occlusioni a) fisiche (solidi in sospensione) b) biologiche (batteri ed alghe) c) chimiche (formazione di precipitati) Nelle condizioni agro-climatiche in Italia, molte delle acque utilizzate per l irrigazione provengono da falde sotterranee e la maggior parte possiedono un elevato contenuto di sali solubili. Il carbonato di calcio CaCO 3 è il costituente più comune delle incrostazioni, generalmente nella forma minerale di Calcite che si forma alle normali temperature esistenti dentro i sistemi di fertirrigazione. 18
19 Acidificazione: come funziona un Acido Il ph dell acqua di solito è più elevato rispetto al valore richiesto per la soluzione nutritiva, a causa della presenza di ioni bicarbonato e raramente di carbonato. Per cui è necessaria la neutralizzazione di questi ioni mediante l aggiunta di un acido. I bicarbonati e carbonati neutralizzati dall acido sono trasformati in acqua e anidride carbonica: HCO H + CO 2 + H 2 O CO 2 si libera nell aria. Agitare le soluzioni per espellere la CO 2 e far lavorare bene le sonde di misurazione del ph ed EC 19
20 Acidificazione: quali sono i principali Acidi? - Acido nitrico (HNO 3 ): anche in questo caso esistono formulazioni con diverse percentuali di concentrazione, generalmente s impiegano quelli a concentrazione pari al 65-67% e densità di 1,39-1,40 Kg/lt. Apporta una considerevole quantità di nitrati che a volte possono essere sufficienti a coprire le necessità azotate delle coltivazioni. Dato il suo potere corrosivo ed ossidante, viene anche utilizzato per la pulizia degli impianti d irrigazione. - Acido fosforico (H 3 PO 4 ): i prodotti utilizzati hanno diverse percentuali di concentrazione, generalmente s impiega quello di maggiore concentrazione, pari all 85% con una densità di 1.58 Kg/lt. Viene spesso utilizzato come fertilizzante fosfatico in fertirrigazione, e frequentemente si coprono con esso la totalità delle necessità di fosforo per la coltivazione.. - Acido solforico (H 2 SO 4 ): i prodotti in uso sono concentrati al 95%, la loro densità è approssimativamente di 1.83 Kg/lt. Non è molto esteso il suo impiego in Italia, benché lo sia a livello mondiale. Oltre all aggiustamento o correzione del ph della soluzione nutritiva, esso apporta una considerabile quantità di zolfo. 20
21 Acidificazione: quali sono i principali Acidi? Caratteristiche dei principali acidi utilizzati: Acido Nitrico HNO 3 HNO 3 +H 2 O => NO H + +H 2 O Una millimole di HNO 3 fornisce una millimole di NO 3 - e di H + Ci sono diversi tipi di Acido Nitrico, in commercio normalmente si trova a densità come gradi Baumè pari a 41,5-42,0 Tab. 1 Caratteristiche commerciali e fattori di calcolo dell Acido Nitrico HNO 3 1 *Gradi Baumè Densità kg/lt HNO 3 % 2 *N gr/kg 41,5 1,
22 Acidificazione: quali sono i principali Acidi? Caratteristiche dei principali acidi utilizzati: Acido Fosforico H 3 PO 4 L acido fosforico è un ac. poliprotico, forte in prima dissociazione, debole in seconda. Il ph delle soluzioni nutritive è tra 5,6-6,5 per cui l acido si trova dissociato secondo le seguenti reazioni: 1) H 3 PO 4 +H 2 O => H 2 PO H + +H 2 O 2) H 2 PO 4 - +H 2 O HPO H + +H 2 O Tab: 2Solo nella 1 a dissociazione si comporta da acido forte, e solo una piccola parte di H 2 PO 4 - si dissocia ulteriormente; in 2 a dissociazione si comporta come un acido debole. Caratteristiche commerciali e fattori di calcolo dell ac. fosforico H 3 PO 4. 1 *Gradi Baumè Densità kg/lt H 3 PO 4 % 2 * P gr/kg 55 1, ,
23 Acidificazione: quali sono i principali Acidi? Caratteristiche dei principali acidi utilizzati 1 *La scala delle densità può essere espressa in kg / lt oppure in altre unità come, ad esempio, i gradi Baumè ( Bè ). La scala Baumè parte dal valore = 0 corrispondente alla densità dell'acqua distillata 2 *Rapporto fra i gr di N o P ed il peso commerciale. (Ogni Kg apporta in soluzione 150 gr di N, il titolo sarebbe Il titolo dell ac. nitrico puro è 22,2-0-0). Nel caso dell acido fosforico all 85%, ogni kg di prodotto apporta in soluzione 270 gr/kg di P, il titolo sarebbe o in P 2 O 5 sarebbe (Il titolo dell acido puro sarebbe 0-72,7-0 come P 2 O 5.) 23
24 Acidificazione Correzione della reazione ph dell acqua Quanto acido aggiungere ad una soluzione acquosa per portarla ad un valore di ph compreso tra 5,6-6,5? La quantità di acido varia secondo la presenza dello ione bicarbonato. Maggiore è la quantità di ione bicarbonato da neutralizzare maggiore sarà la quantità di acido da aggiungere. Per avere la reazione ph della soluzione tra 5,6-6,5 ed un certo effetto tampone, è bene lasciare nell acqua un residuo di bicarbonato compreso tra il 20-30% del contenuto in HCO 3-, oppure circa 0,5-1,5 millimoli/litro. In altre parole siano n il numero di millimoli di bicarbonato presenti nell acqua di partenza, le millimoli di acido da aggiungere si possono calcolare così: H + millimoli/l = (n-1) 24
25 Acidificazione Ca(HCO 3 ) 2 Ca ++ 2HCO 3 - (mmol/l) (Ca ++ +2HCO 3 - )+2HNO 3 = Ca(NO 3 ) 2 +2CO 2 +2H 2 0 Acqua + Acido Nitrico = Nitrato di Calcio 25
26 Acidificazione Calcolo: Quanto Acido Nitrico HNO 3 ci vuole per acidificare m 3 di acqua irrigua per ogni mmole/lt di HCO 3-? 1 mmole/lt di HCO 3 - x 1 mmole/lt di HNO 3 al 67% = = 1 x peso molecolare di HNO 3 (63) x 67% =(94) x lt (1.000 m 3 ) = = 94 kg di HNO 3 x 15N = = 14,1 Kg di N in forma NO 3 26
27 Acidificazione Calcolo: Quanto Acido Fosforico H 3 PO 4 ci vuole per acidificare m 3 di acqua irrigua per ogni mmole/lt di HCO 3-? 1 mmole/lt di HCO 3 - x 1 mmole/lt di H 3 PO 4 al 75% = = 1 x peso molecolare di H 3 PO 4 (98) x 75% =(130) x lt (1.000 m 3 ) = = 130 kg di H 3 PO 4 x 54 P 2 O 5 = = 70 Kg di P come P 2 O 5 100% solubile in acqua 27
28 Acidificazione Calcolo: Quanto Calcio si apporta per ogni m3 di acqua irrigua che contiene 128 mg/lt di ione Ca ++? 128 mg/lt di Ca ++ x lt (1.000 m 3 ) = = 128 kg di Ca ++ x 1,399 = 179 Kg di Ca come CaO (100% solubile in acqua) 28
29 29
30 30
31 31
32 32
33 33
34 Grazie per l attenzione & Buon lavoro 34
Programma del corso: CORSO DI FERTIRRIGAZIONE & FERTILIZZANTI IDROSOLUBILI. Bergamo - 14 novembre 2012. Principi di fertirrigazione. P.
 CORSO DI FERTIRRIGAZIONE & FERTILIZZANTI IDROSOLUBILI Programma del corso: Bergamo - 14 novembre 2012 Principi di fertirrigazione Fertilizzanti & Acidi Calcolo delle soluzioni nutritive Preparazione della
CORSO DI FERTIRRIGAZIONE & FERTILIZZANTI IDROSOLUBILI Programma del corso: Bergamo - 14 novembre 2012 Principi di fertirrigazione Fertilizzanti & Acidi Calcolo delle soluzioni nutritive Preparazione della
ESERCIZI SUL ph 3 0,002 0,2 13. 2. Completa la seguente tabella relativa a acidi o basi deboli.
 ESERCIZI SUL ph Livello difficoltà 1 1. Completa la tabella relativa a soluzioni di acidi o basi forti. 1 11 ph poh [H + ] [OH - ] 3 0,002 0,2 13 2 2. Completa la seguente tabella relativa a acidi o basi
ESERCIZI SUL ph Livello difficoltà 1 1. Completa la tabella relativa a soluzioni di acidi o basi forti. 1 11 ph poh [H + ] [OH - ] 3 0,002 0,2 13 2 2. Completa la seguente tabella relativa a acidi o basi
ESERCIZI sulle SOLUZIONI
 ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
Base. Acido. Acido. Base
 ACIDI E BASI Un acido è un donatore di protoni, una base è un accettore di protoni. La base coniugata di un acido è quella che si forma quando l acido si è privato del protone. L acido coniugato di una
ACIDI E BASI Un acido è un donatore di protoni, una base è un accettore di protoni. La base coniugata di un acido è quella che si forma quando l acido si è privato del protone. L acido coniugato di una
NUMERO DI OSSIDAZIONE Es. HCl H + Cl - H = +1 Cl = -1 H 2. O 2 H + O 2- H = +1 O = -2 Es. NaCl Na + Cl - Na = +1 Cl = -1
 NUMERO DI OSSIDAZIONE Es. HCl H + Cl - H = +1 Cl = -1 H 2 O 2 H + O 2- H = +1 O = -2 Es. NaCl Na + Cl - Na = +1 Cl = -1 Es. H-H, O=O, Cu, Fe = 0 H: +1, (tranne che negli idruri metallici es. NaH 1) O:
NUMERO DI OSSIDAZIONE Es. HCl H + Cl - H = +1 Cl = -1 H 2 O 2 H + O 2- H = +1 O = -2 Es. NaCl Na + Cl - Na = +1 Cl = -1 Es. H-H, O=O, Cu, Fe = 0 H: +1, (tranne che negli idruri metallici es. NaH 1) O:
Legame metallico + + + + + + + + Elettroni di valenza + + + + Ioni Na +, Be 2+, K + etc + + + +
 Legame metallico I metalli presentano elevata conducibilità termica ed elettrica e possono subire deformazioni permanenti più facilmente dei solidi ionici. Tali proprietà fisiche sono spiegate dalla natura
Legame metallico I metalli presentano elevata conducibilità termica ed elettrica e possono subire deformazioni permanenti più facilmente dei solidi ionici. Tali proprietà fisiche sono spiegate dalla natura
Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE
 Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE Molti sali reagiscono con l acqua alterando il suo rapporto molare tra [H] e [OH] -
Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE Molti sali reagiscono con l acqua alterando il suo rapporto molare tra [H] e [OH] -
Centrali termiche: per la conduzione ci vuole la patente Obbligo del patentino di abilitazione di 2 grado per la conduzione degli impianti termici
 Centrali termiche: per la conduzione ci vuole la patente Obbligo del patentino di abilitazione di 2 grado per la conduzione degli impianti termici sopra i 232 kw Ing. Diego Danieli Libero Professionista
Centrali termiche: per la conduzione ci vuole la patente Obbligo del patentino di abilitazione di 2 grado per la conduzione degli impianti termici sopra i 232 kw Ing. Diego Danieli Libero Professionista
+ 4e - + 16H 3 O + 3S 2- + 36H 2 O 3SO 2-4 + 24e - + 24H 3 O +
 SOLUZIONI COMPITO A DI CHIMICA DEL 22-06-11 1A) 258 g di un minerale contenente il 91% di solfuro di arsenico (III), vengono immessi in 4,0 L di una soluzione acquosa di acido manganico al 10% in peso
SOLUZIONI COMPITO A DI CHIMICA DEL 22-06-11 1A) 258 g di un minerale contenente il 91% di solfuro di arsenico (III), vengono immessi in 4,0 L di una soluzione acquosa di acido manganico al 10% in peso
4) 8 g di idrogeno reagiscono esattamente con 64 g di ossigeno secondo la seguente reazione:
 Esercizi Gli esercizi sulla legge di Lavoisier che seguono si risolvono ricordando che la massa iniziale, prima della reazione, deve equivalere a quella finale, dopo la reazione. L uguaglianza vale anche
Esercizi Gli esercizi sulla legge di Lavoisier che seguono si risolvono ricordando che la massa iniziale, prima della reazione, deve equivalere a quella finale, dopo la reazione. L uguaglianza vale anche
Reazioni in Soluzioni Acquose. Capitolo 4
 Reazioni in Soluzioni Acquose Capitolo 4 Una soluzione è una miscela omogenea di 2 o più sostanze Il soluto è(sono) la(le) sostanza(e) presente(i) in minore quantità Il solvente è la sostanza presente
Reazioni in Soluzioni Acquose Capitolo 4 Una soluzione è una miscela omogenea di 2 o più sostanze Il soluto è(sono) la(le) sostanza(e) presente(i) in minore quantità Il solvente è la sostanza presente
1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di
 Unità 19 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di soluzioni acide e
Unità 19 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di soluzioni acide e
LA FERTIRRIGAZIONE DELLA FRAGOLA
 FORUM NUTRIZIONE SULLA FRAGOLA LA FERTIRRIGAZIONE DELLA FRAGOLA 18 SETTEMBRE 2014 dott. agr. Marco Valerio DEL GROSSO Libero Professionista Battipaglia (SA) presidente@antesia.it Associazione Nazionale
FORUM NUTRIZIONE SULLA FRAGOLA LA FERTIRRIGAZIONE DELLA FRAGOLA 18 SETTEMBRE 2014 dott. agr. Marco Valerio DEL GROSSO Libero Professionista Battipaglia (SA) presidente@antesia.it Associazione Nazionale
- Possibile presenza di Fosfati - Presenza di zinco a causa dell'allevamento
 Altri fertilizzanti biologici Fertilizzanti artificiali Concentrato 100% 20%-85% 100% organici 19.4% - 25,7% Flora microbica 23% min 40% Letame, Scarti di macellazione, Farina di ossa, Cenere organica
Altri fertilizzanti biologici Fertilizzanti artificiali Concentrato 100% 20%-85% 100% organici 19.4% - 25,7% Flora microbica 23% min 40% Letame, Scarti di macellazione, Farina di ossa, Cenere organica
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: H 2 O 2(aq) + MnO 4
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: 2 2(aq) + Mn 4 -(aq) 2(g) + Mn 2(s) + - (aq) + 2 (l). Calcolare il volume di 2 (g), misurato a 1.0 atm e 25
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: 2 2(aq) + Mn 4 -(aq) 2(g) + Mn 2(s) + - (aq) + 2 (l). Calcolare il volume di 2 (g), misurato a 1.0 atm e 25
Utilizzeremo un kit analitico per valutare la qualità dell acqua potabile delle nostre case, scuole e fontanelle cittadine.
 Acqua in brocca Ciao! Io sono LABBY e vi farò da guida per l analisi dell acqua del vostro rubinetto! Utilizzeremo un kit analitico per valutare la qualità dell acqua potabile delle nostre case, scuole
Acqua in brocca Ciao! Io sono LABBY e vi farò da guida per l analisi dell acqua del vostro rubinetto! Utilizzeremo un kit analitico per valutare la qualità dell acqua potabile delle nostre case, scuole
FOCUS SU EQUILIBRI ACIDO-BASE
 1 Ci sono varie definizioni di acidi e basi, tra le quali meritano di essere ricordate quella di Bronsted e quella di Lewis. Per i nostri fini pratici, ovvero gli esercizi, ci basta però ricordare le definizioni
1 Ci sono varie definizioni di acidi e basi, tra le quali meritano di essere ricordate quella di Bronsted e quella di Lewis. Per i nostri fini pratici, ovvero gli esercizi, ci basta però ricordare le definizioni
CHIMICA INORGANICA NOMENCLATURA TRADIZIONALE. Giancarlo Accattatis
 CHIMICA INORGANICA NOMENCLATURA TRADIZIONALE Suddividiamo la maggior parte dei composti in binari e ternari Binari: Idruri, Ossidi (Anidridi), Idracidi, Sali di idracidi Ternari: Idrossidi, Acidi ossigenati,
CHIMICA INORGANICA NOMENCLATURA TRADIZIONALE Suddividiamo la maggior parte dei composti in binari e ternari Binari: Idruri, Ossidi (Anidridi), Idracidi, Sali di idracidi Ternari: Idrossidi, Acidi ossigenati,
Le analisi chimiche dell acqua del fiume Padrongianus Scienze Integrate Chimica
 Le analisi chimiche dell acqua del fiume Padrongianus Scienze Integrate Chimica Nell ambito del Progetto relativo all esame dell ecosistema costituito dal Parco Fluviale del Padrongianus sono stati coinvolti
Le analisi chimiche dell acqua del fiume Padrongianus Scienze Integrate Chimica Nell ambito del Progetto relativo all esame dell ecosistema costituito dal Parco Fluviale del Padrongianus sono stati coinvolti
INFORMAZIONE QUALITÀ DELL ACQUA POTABILE ANNO 2014
 COMUNE DI ALTO MALCANTONE MUNICIPIO INFORMAZIONE QUALITÀ DELL ACQUA POTABILE ANNO 2014 Conformemente all art. 5 dell Ordinanza del Dipartimento federale dell'interno (DFI) concernente l acqua potabile,
COMUNE DI ALTO MALCANTONE MUNICIPIO INFORMAZIONE QUALITÀ DELL ACQUA POTABILE ANNO 2014 Conformemente all art. 5 dell Ordinanza del Dipartimento federale dell'interno (DFI) concernente l acqua potabile,
SOLUZIONI e DILUIZIONI
 SOLUZIONI e DILUIZIONI Introduzione In chimica viene definita soluzione un sistema in cui due o più sostanze formano un miscuglio omogeneo. Nella maggior parte dei casi una soluzione è costituita da due
SOLUZIONI e DILUIZIONI Introduzione In chimica viene definita soluzione un sistema in cui due o più sostanze formano un miscuglio omogeneo. Nella maggior parte dei casi una soluzione è costituita da due
+ NO 2 + 3H 2 O = Ce +3 + NO 3 + 2H 3 O +, b) 0.478 g
 1) Una soluzione di Na 3 PO 4 (PM = 163.94) viene titolata con una soluzione di AgNO 3 (PM = 169.87) a) Scrivere l equazione chimica del processo di titolazione e specificare di quale tecnica si tratta
1) Una soluzione di Na 3 PO 4 (PM = 163.94) viene titolata con una soluzione di AgNO 3 (PM = 169.87) a) Scrivere l equazione chimica del processo di titolazione e specificare di quale tecnica si tratta
Prova in itinere di Chimica Generale 8 Gennaio 2016 A
 Prova in itinere di Chimica Generale 8 Gennaio 2016 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
Prova in itinere di Chimica Generale 8 Gennaio 2016 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
Corso di Laurea triennale in Chimica
 Università degli Studi di Cagliari Corso di Laurea triennale in Chimica Chimica Analitica I e Laboratorio 1 (Modulo A) CFU 6 Docente Prof. Davide Atzei SSD CHIM/01 Tel. +39 070 675 4460 Fa. +39 070 675
Università degli Studi di Cagliari Corso di Laurea triennale in Chimica Chimica Analitica I e Laboratorio 1 (Modulo A) CFU 6 Docente Prof. Davide Atzei SSD CHIM/01 Tel. +39 070 675 4460 Fa. +39 070 675
Esperienza n 3: Determinazione del grado di acidità dell aceto commerciale
 Esperienza n : Determinazione del grado di acidità dell aceto commerciale Obiettivo: determinare il grado di acidità di un aceto commerciale tramite titolazione con una soluzione di NaOH a titolo noto
Esperienza n : Determinazione del grado di acidità dell aceto commerciale Obiettivo: determinare il grado di acidità di un aceto commerciale tramite titolazione con una soluzione di NaOH a titolo noto
La reazione da bilanciare è quindi: Cu + HNO 3 CuNO 3 + NO. Le due semireazioni da bilanciare saranno: HNO 3 NO (1) Cu CuNO 3 (2)
 Introducendo rame metallico (Cu) in acido nitrico diluito (HNO 3 ) si forma nitrato di rame (CuNO 3 ) e gas ossido nitrico (NO). Scrivere l equazione chimica bilanciata della reazione. La reazione da bilanciare
Introducendo rame metallico (Cu) in acido nitrico diluito (HNO 3 ) si forma nitrato di rame (CuNO 3 ) e gas ossido nitrico (NO). Scrivere l equazione chimica bilanciata della reazione. La reazione da bilanciare
Gli Attacchi di Panico
 Gli Attacchi di Panico Roberto Oste Posturologo Direttore IPS Prof. a c. Università di Catanzaro L acqua, da sempre, è innanzitutto simbolo di vita e di tutto ciò che ha a che fare con la generazione della
Gli Attacchi di Panico Roberto Oste Posturologo Direttore IPS Prof. a c. Università di Catanzaro L acqua, da sempre, è innanzitutto simbolo di vita e di tutto ciò che ha a che fare con la generazione della
Esame di Chimica Generale 13 Aprile 2012
 Esame di Chimica Generale 13 Aprile 2012 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 13 Aprile 2012 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
L equilibrio dell acqua
 L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
Un elemento è una sostanza pura che non può essere divisa in sostanze più semplici. Le sue molecole sono tutte uguali.
 Elementi, composti, miscugli Un elemento è una sostanza pura che non può essere divisa in sostanze più semplici. Le sue molecole sono tutte uguali. Il composto è formato da sostanze pure scomponibili in
Elementi, composti, miscugli Un elemento è una sostanza pura che non può essere divisa in sostanze più semplici. Le sue molecole sono tutte uguali. Il composto è formato da sostanze pure scomponibili in
La temperatura e l acidità
 La temperatura e l acidità Esistono 2 tipi di batteri metaniferi: - I batteri mesofili (5-40 ); - I batteri termofili (40-60 ). Vengono utilizzati soprattutto i batteri mesofili perchè producono humus
La temperatura e l acidità Esistono 2 tipi di batteri metaniferi: - I batteri mesofili (5-40 ); - I batteri termofili (40-60 ). Vengono utilizzati soprattutto i batteri mesofili perchè producono humus
EQUILIBRI IONICI IN SOLUZIONE
 EQUILIBRI IONICI IN SOLUZIONE 12.A PRE-REQUISITI 12.B PRE-TEST 12.C OBIETTIVI 12.1 INTRODUZIONE: SOLUZIONI DI ELETTROLITI 12.2 ACIDI E BASI 12.2.1 DEFINIZIONI DI ACIDO E BASE 12.2.2 FORZA DEGLI ACIDI E
EQUILIBRI IONICI IN SOLUZIONE 12.A PRE-REQUISITI 12.B PRE-TEST 12.C OBIETTIVI 12.1 INTRODUZIONE: SOLUZIONI DI ELETTROLITI 12.2 ACIDI E BASI 12.2.1 DEFINIZIONI DI ACIDO E BASE 12.2.2 FORZA DEGLI ACIDI E
Codice archivio : AND00008i Rapporto di Prova: 14.00839. L'Analista
 INFORMAZIONI CLIENTE Azienda ZUCCARO GIORGIO AZ. AG Indirizzo C.da Laccata, snc C.A.P 87010 Località Lauropoli Provincia COSENZA ACQUA IRRIGAZIONE Campione Campione 2 Coltura Non specificato Substrato
INFORMAZIONI CLIENTE Azienda ZUCCARO GIORGIO AZ. AG Indirizzo C.da Laccata, snc C.A.P 87010 Località Lauropoli Provincia COSENZA ACQUA IRRIGAZIONE Campione Campione 2 Coltura Non specificato Substrato
Chimica Generale. Reazioni Chimiche. Reazioni Chimiche
 Una reazione chimica è un processo in cui avviene un cambiamento chimico di uno o più composti, detti reagenti, che vengono convertiti in una nuova serie di composti detti prodotti. Spesso le reazioni
Una reazione chimica è un processo in cui avviene un cambiamento chimico di uno o più composti, detti reagenti, che vengono convertiti in una nuova serie di composti detti prodotti. Spesso le reazioni
Problema 1 Mg + 2HCl H 2 + MgCl 2. di Mg 1 Mg 1 H 2 quindi 0,823 moli di H 2 di H 2
 REAZIONI CHIMICHE 1. Con riferimento alla seguente reazione (da bilanciare): Mg + HCl H 2 + MgCl 2 calcolare i grammi di H 2 che si ottengono facendo reagire completamente 20 g di magnesio. utilizzando
REAZIONI CHIMICHE 1. Con riferimento alla seguente reazione (da bilanciare): Mg + HCl H 2 + MgCl 2 calcolare i grammi di H 2 che si ottengono facendo reagire completamente 20 g di magnesio. utilizzando
NOMENCLATURA DEI COMPOSTI INORGANICI
 QUESTA E UNA SCHEDA DI RECUPERO DEL CORSO DI CHIMICA Per andare avanti usa il mouse OGGI PARLEREMO DI NOMENCLATURA DEI COMPOSTI INORGANICI COME SAI GLI ELEMENTI CHIMICI SONO SUDDIVISI IN DUE CATEGORIE
QUESTA E UNA SCHEDA DI RECUPERO DEL CORSO DI CHIMICA Per andare avanti usa il mouse OGGI PARLEREMO DI NOMENCLATURA DEI COMPOSTI INORGANICI COME SAI GLI ELEMENTI CHIMICI SONO SUDDIVISI IN DUE CATEGORIE
9065X Chimica. Modello esame svolto. Esempio di compito scritto di Chimica. Politecnico di Torino CeTeM
 svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
FORZA DI ACIDI E BASI HA + :B HB + + A
 FORZA DI ACIDI E BASI n La forza di un acido è la misura della tendenza di una sostanza a cedere un protone. n La forza di una base è una misura dell'affinità di un composto ad accettare un protone. n
FORZA DI ACIDI E BASI n La forza di un acido è la misura della tendenza di una sostanza a cedere un protone. n La forza di una base è una misura dell'affinità di un composto ad accettare un protone. n
ATOMI E MOLECOLE. Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti).
 1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
ANALISI DELL ACQUA DISTRIBUITA NELLA SUA ZONA: MILANO NORD-EST. Parametro Limiti di Campione Unità di
 MILANO NORD-EST Concentrazione ioni idrogeno Da 6.5 a 9.5 8,1 Unità ph Durezza 15-50 27 F Cloro residuo libero 0.2 0,04 mg/l Composti Organoalogenati 30 8 µg/l Tricloroetilene + Tetracloroetilene 10 2
MILANO NORD-EST Concentrazione ioni idrogeno Da 6.5 a 9.5 8,1 Unità ph Durezza 15-50 27 F Cloro residuo libero 0.2 0,04 mg/l Composti Organoalogenati 30 8 µg/l Tricloroetilene + Tetracloroetilene 10 2
VIA ORALE MODULO DI TECNICHE E FORME FARMACEUTICHE CORSO DI LAUREA IN BIOTECNOLOGIE ANNO ACCADEMICO 2004-2005
 VIA ORALE MODULO DI TECNICHE E FORME FARMACEUTICHE CORSO DI LAUREA IN BIOTECNOLOGIE ANNO ACCADEMICO 2004-2005 2005 VANTAGGI DELLA VIA ORALE! Le forme farmaceutiche orali sono facili e convenienti da usare
VIA ORALE MODULO DI TECNICHE E FORME FARMACEUTICHE CORSO DI LAUREA IN BIOTECNOLOGIE ANNO ACCADEMICO 2004-2005 2005 VANTAGGI DELLA VIA ORALE! Le forme farmaceutiche orali sono facili e convenienti da usare
Il numero di ossidazione
 Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
Specialità fertilizzanti
 Specialità fertilizzanti per l agricoltura Nitrophoska ENTEC Novammon Solfato Ammonico Entec ENTEC perfect 14-7-17 (+2+22) Composizione 14% Azoto (N) totale 6% Azoto (N) nitrico 8% Azoto (N) ammoniacale
Specialità fertilizzanti per l agricoltura Nitrophoska ENTEC Novammon Solfato Ammonico Entec ENTEC perfect 14-7-17 (+2+22) Composizione 14% Azoto (N) totale 6% Azoto (N) nitrico 8% Azoto (N) ammoniacale
S T U D I O A G R O N
 LA CALCITAZIONE DEI TERRICCI di Fiorenzo Pandini dottore agronomo libero professionista Brescia In pieno campo (vivaio, frutteto, orticoltura, cerealicoltura, ecc.) le calcitazioni con carbonato di calcio
LA CALCITAZIONE DEI TERRICCI di Fiorenzo Pandini dottore agronomo libero professionista Brescia In pieno campo (vivaio, frutteto, orticoltura, cerealicoltura, ecc.) le calcitazioni con carbonato di calcio
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da
 Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
LEZIONE 4. Le soluzioni
 LEZIONE 4 Le soluzioni Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il componente delle
LEZIONE 4 Le soluzioni Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il componente delle
La quantità chimica LA MOLE
 La quantità chimica LA MOLE 1 QUANTO PESA UN ATOMO? Se lo misurassimo in grammi, l atomo di H, il più piccolo, avrebbe una massa di 1,6 x10-24 g. Per convenzione, si assegna un valore arbitrario (12) alla
La quantità chimica LA MOLE 1 QUANTO PESA UN ATOMO? Se lo misurassimo in grammi, l atomo di H, il più piccolo, avrebbe una massa di 1,6 x10-24 g. Per convenzione, si assegna un valore arbitrario (12) alla
Sostanze inorganiche: determinazioni qualitative
 Carbonati e Bicarbonati Indicare il tipo di sostanza basandosi sulle caratteristiche alla calcinazione e le prove di solubilità e il ph. Sodio carbonato anidro Na 2 CO 3 (F.U. X Edizione, European Pharmacopeia
Carbonati e Bicarbonati Indicare il tipo di sostanza basandosi sulle caratteristiche alla calcinazione e le prove di solubilità e il ph. Sodio carbonato anidro Na 2 CO 3 (F.U. X Edizione, European Pharmacopeia
1. Controllo dell equilibrio acido-base. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 1. Controllo dell equilibrio acido-base Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Misura dell acidità di una soluzione Definizione di acido: qualsiasi sostanza chimica che
1. Controllo dell equilibrio acido-base Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Misura dell acidità di una soluzione Definizione di acido: qualsiasi sostanza chimica che
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi
 Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi Svante Arrhenius (1859 1927) Johannes Nicolaus Brønsted (1879 1947) Thomas Martin Lowry (1874-1936) Gilbert Newton Lewis (1875-1946)
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi Svante Arrhenius (1859 1927) Johannes Nicolaus Brønsted (1879 1947) Thomas Martin Lowry (1874-1936) Gilbert Newton Lewis (1875-1946)
CORSO DI LABORATORIO DI CHIMICA Corso di Laurea triennale in Chimica Industriale
 CORSO DI LABORATORIO DI CHIMICA Corso di Laurea triennale in Chimica Industriale ESERCITAZIONE N 4 bis Stati di ossidazione del manganese Il manganese è un tipico elemento di transizione del blocco d.
CORSO DI LABORATORIO DI CHIMICA Corso di Laurea triennale in Chimica Industriale ESERCITAZIONE N 4 bis Stati di ossidazione del manganese Il manganese è un tipico elemento di transizione del blocco d.
La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di
 La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di un solido (polvere) che diverrà il ceramico, con un
La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di un solido (polvere) che diverrà il ceramico, con un
BEVANDE ANALCOLICHE. Succhi frutta bibite sciroppi Bevande nervine naturali. Base frutta a. caffè succo thè concentrati. Base di frutta non a succo
 BEVANDE ANALCOLICHE BEVANDE ANALCOLICHE Acque minerali naturali artificiali Succhi frutta bibite sciroppi Bevande nervine naturali limpidi Base frutta a caffè succo thè concentrati Base di frutta non a
BEVANDE ANALCOLICHE BEVANDE ANALCOLICHE Acque minerali naturali artificiali Succhi frutta bibite sciroppi Bevande nervine naturali limpidi Base frutta a caffè succo thè concentrati Base di frutta non a
SCUOLA PRIMARIA DI MAGGIATE Classe terza
 SCUOLA PRIMARIA DI MAGGIATE Classe terza Anno scolastico 2012-2013 TERRE ACQUE Osservando il nostro pianeta possiamo notare che la maggior parte della superficie è occupata dalle acque. Infatti esse occupano
SCUOLA PRIMARIA DI MAGGIATE Classe terza Anno scolastico 2012-2013 TERRE ACQUE Osservando il nostro pianeta possiamo notare che la maggior parte della superficie è occupata dalle acque. Infatti esse occupano
Le unità fondamentali SI. Corrente elettrica
 ESERITAZIONE 1 1 Le unità fondamentali SI Grandezza fisica Massa Lunghezza Tempo Temperatura orrente elettrica Quantità di sostanza Intensità luminosa Nome dell unità chilogrammo metro secondo Kelvin ampere
ESERITAZIONE 1 1 Le unità fondamentali SI Grandezza fisica Massa Lunghezza Tempo Temperatura orrente elettrica Quantità di sostanza Intensità luminosa Nome dell unità chilogrammo metro secondo Kelvin ampere
Nomenclatura chimica unità 1, modulo E del libro
 Nomenclatura chimica unità 1, modulo E del libro È indispensabile conoscere i nomi dei composti dei primi 30 elementi (da H a Zn), e quelli di Ba, Cd, Pb e Sn. Le molecole vengono rappresentate da formule
Nomenclatura chimica unità 1, modulo E del libro È indispensabile conoscere i nomi dei composti dei primi 30 elementi (da H a Zn), e quelli di Ba, Cd, Pb e Sn. Le molecole vengono rappresentate da formule
CAMPIONAMENTO fondamentale analisi campionamento omogenei stessa composizione variazione l abilità persona variabilità metodo analitico realtà
 CAMPIONAMENTO Un momento fondamentale di una analisi è rappresentato dal campionamento, generalmente si pensa che i campioni da analizzare siano omogenei e che abbiano in ogni punto la stessa composizione,
CAMPIONAMENTO Un momento fondamentale di una analisi è rappresentato dal campionamento, generalmente si pensa che i campioni da analizzare siano omogenei e che abbiano in ogni punto la stessa composizione,
Modulo di Chimica VII lezione. Acidi e basi Il ph
 Modulo di Chimica VII lezione Acidi e basi Il ph Un po di etimologia Acido: dal latino acidus (ac, essere pungente) Base: dal greco βασιξ (sostenere) Alcali: dall arabo al-qalì (potassa, dalle ceneri di
Modulo di Chimica VII lezione Acidi e basi Il ph Un po di etimologia Acido: dal latino acidus (ac, essere pungente) Base: dal greco βασιξ (sostenere) Alcali: dall arabo al-qalì (potassa, dalle ceneri di
Massa assoluta e relativa e mole
 Massa assoluta e relativa e mole Massa atomica assoluta.. Massa di un atomo di un dato elemento. In questo caso si parla spesso di peso atomico assoluto, che viene espresso in grammi: l'ordine dei valori
Massa assoluta e relativa e mole Massa atomica assoluta.. Massa di un atomo di un dato elemento. In questo caso si parla spesso di peso atomico assoluto, che viene espresso in grammi: l'ordine dei valori
Gli elementi nutritivi necessari per una corretta fertilizzazione dell olivo e delle piante da orto
 Gli elementi nutritivi necessari per una corretta fertilizzazione dell olivo e delle piante da orto Associazione IL GIARDINO Figline 6 marzo 2012 Dr. Simone Tofani Agronomo Gli elementi nutritivi Macro
Gli elementi nutritivi necessari per una corretta fertilizzazione dell olivo e delle piante da orto Associazione IL GIARDINO Figline 6 marzo 2012 Dr. Simone Tofani Agronomo Gli elementi nutritivi Macro
16. La fertirrigazione
 16. La fertirrigazione Giulia Carmassi, Luca Incrocci, Fernando Malorgio Introduzione La fertirrigazione è una tecnica che è già ampiamente utilizzata sia in orticoltura sia in floricoltura e che da alcuni
16. La fertirrigazione Giulia Carmassi, Luca Incrocci, Fernando Malorgio Introduzione La fertirrigazione è una tecnica che è già ampiamente utilizzata sia in orticoltura sia in floricoltura e che da alcuni
Elementi: specie chimiche che resistono bene ad ogni tentativo di decomposizione. Composti: specie chimiche definite formate da due o più elementi
 Elementi: specie chimiche che resistono bene ad ogni tentativo di decomposizione Composti: specie chimiche definite formate da due o più elementi Elemento Simbolo nomi con radici latine nomi derivati dalla
Elementi: specie chimiche che resistono bene ad ogni tentativo di decomposizione Composti: specie chimiche definite formate da due o più elementi Elemento Simbolo nomi con radici latine nomi derivati dalla
Università di Catania Facoltà di Ingegneria CdL Ingegneria Recupero Edilizio Ambientale ESERCIZI DI CHIMICA. Prof. Antonino Mamo
 Università di Catania Facoltà di Ingegneria CdL Ingegneria Recupero Edilizio Ambientale ESERCIZI DI CHIMICA Prof. Antonino Mamo 1) Scrivere le formule di struttura dei seguenti sali: a) permanganato di
Università di Catania Facoltà di Ingegneria CdL Ingegneria Recupero Edilizio Ambientale ESERCIZI DI CHIMICA Prof. Antonino Mamo 1) Scrivere le formule di struttura dei seguenti sali: a) permanganato di
BILANCIAMENTO REAZIONE DI OSSIDO-RIDUZIONE
 http://aliceappunti.altervista.org BILANCIAMENTO REAZIONE DI OSSIDO-RIDUZIONE TESTO: Il permanganato di potassio viene aggiunto ad una soluzione acida contenente perossido di idrogeno (acqua ossigenata).
http://aliceappunti.altervista.org BILANCIAMENTO REAZIONE DI OSSIDO-RIDUZIONE TESTO: Il permanganato di potassio viene aggiunto ad una soluzione acida contenente perossido di idrogeno (acqua ossigenata).
Concimazione. Irrigazione
 Lezione 3 Tecniche agronomiche Concimazione Irrigazione Concimazione La concimazione Qualsiasi organismo vegetale, per poter vivere, ha bisogno di elementi nutritivi, che trova nel terreno e che assorbe
Lezione 3 Tecniche agronomiche Concimazione Irrigazione Concimazione La concimazione Qualsiasi organismo vegetale, per poter vivere, ha bisogno di elementi nutritivi, che trova nel terreno e che assorbe
CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq) + H 2 O (l)
 2. Titolazione di un acido debole con una base forte : CH 3 COOH (aq) + NaOH (aq) (a cura di Giuliano Moretti) La titolazione è descritta dalla seguente reazione CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq)
2. Titolazione di un acido debole con una base forte : CH 3 COOH (aq) + NaOH (aq) (a cura di Giuliano Moretti) La titolazione è descritta dalla seguente reazione CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq)
NUOVE TECNOLOGIE CHIMICHE PER LA DISINFEZIONE DELLE ACQUE POTABILI
 Il settore strategico delle acque: come l innovazione chimica può aumentarne la sostenibilità Ferrara, 21 Maggio 2010 NUOVE TECNOLOGIE CHIMICHE PER LA DISINFEZIONE DELLE ACQUE POTABILI Antonio Fiusco Chimica
Il settore strategico delle acque: come l innovazione chimica può aumentarne la sostenibilità Ferrara, 21 Maggio 2010 NUOVE TECNOLOGIE CHIMICHE PER LA DISINFEZIONE DELLE ACQUE POTABILI Antonio Fiusco Chimica
regole d oro per la prevenzione della calcolosi renale
 10 regole d oro per la prevenzione della calcolosi renale La calcolosi renale è una patologia frequente, ricorrente e potenzialmente pericolosa se non adeguatamente inquadrata, prevenuta e trattata. Se
10 regole d oro per la prevenzione della calcolosi renale La calcolosi renale è una patologia frequente, ricorrente e potenzialmente pericolosa se non adeguatamente inquadrata, prevenuta e trattata. Se
In base ai coefficienti stechiometrici posso calcolare quanti grammi di sostanza reagiscono.
 ESERCITAZIONE 6 RAPPORTI PONDERALI E VOLUMETRICI NELLE REAZIONI In base ai coefficienti stechiometrici posso calcolare quanti grammi di sostanza reagiscono. 1) Quanto acido solforico reagisce con 100g
ESERCITAZIONE 6 RAPPORTI PONDERALI E VOLUMETRICI NELLE REAZIONI In base ai coefficienti stechiometrici posso calcolare quanti grammi di sostanza reagiscono. 1) Quanto acido solforico reagisce con 100g
Influenza della concentrazione dei reagenti e dei prodotti sull equilibrio chimico. Influenza della temperatura sull equilibrio chimico.
 Esperienza n. 5 Influenza della concentrazione dei reagenti e dei prodotti sull equilibrio chimico. Influenza della temperatura sull equilibrio chimico. una provetta da saggio, porta provette, spruzzetta
Esperienza n. 5 Influenza della concentrazione dei reagenti e dei prodotti sull equilibrio chimico. Influenza della temperatura sull equilibrio chimico. una provetta da saggio, porta provette, spruzzetta
NOMENCLATURA E REAZIONI
 NOMENCLATURA E REAZIONI Gli elementi chimici si dividono in: METALLI e NON METALLI I METALLI, perdendo elettroni, originano IONI POSITIVI (o CATIONI) I NON METALLI, acquistando elettroni, originano IONI
NOMENCLATURA E REAZIONI Gli elementi chimici si dividono in: METALLI e NON METALLI I METALLI, perdendo elettroni, originano IONI POSITIVI (o CATIONI) I NON METALLI, acquistando elettroni, originano IONI
ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA
 ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA VALUTAZIONE - Prima parte: scelte multiple (26 punti = 13 domande da 2 punti) (totale: 80 punti) - Seconda parte: domande (30 punti = 5 domande da 6 punti) -
ESAME DI SCIENZE SPERIMENTALI PARTE CHIMICA VALUTAZIONE - Prima parte: scelte multiple (26 punti = 13 domande da 2 punti) (totale: 80 punti) - Seconda parte: domande (30 punti = 5 domande da 6 punti) -
Soluzioni Acido Base Definizione di Brønsted
 acido + base sale + acqua Soluzioni Acido Base Definizione di Brønsted acido: sostanza capace di donare protoni* HCl + H 2 O Cl + H 3 O + * In soluzione, il protone esiste in forma idratata (H 3 O + )
acido + base sale + acqua Soluzioni Acido Base Definizione di Brønsted acido: sostanza capace di donare protoni* HCl + H 2 O Cl + H 3 O + * In soluzione, il protone esiste in forma idratata (H 3 O + )
COMPITO A DI CHIMICA DEL 15-09-09
 COMPITO A DI CHIMICA DEL 15-09-09 1A) 3,447 g di anidride arsenica (As 2 O 5 ) solida e 6,278 g di zinco metallico vengono fatti reagire con un eccesso di acido solforico. Si calcoli il volume di arsina
COMPITO A DI CHIMICA DEL 15-09-09 1A) 3,447 g di anidride arsenica (As 2 O 5 ) solida e 6,278 g di zinco metallico vengono fatti reagire con un eccesso di acido solforico. Si calcoli il volume di arsina
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
SCHEDE TECNICHE fornitura prodotti chimici e reagenti
 SCHEDE TECNICHE fornitura prodotti chimici e reagenti SCHEDA TECNICA N. 1 IPOCLORITO DI SODIO al 14,5-15% (come cloro attivo) Aspetto: liquido Colore: giallo paglierino Odore: caratteristico Densità a
SCHEDE TECNICHE fornitura prodotti chimici e reagenti SCHEDA TECNICA N. 1 IPOCLORITO DI SODIO al 14,5-15% (come cloro attivo) Aspetto: liquido Colore: giallo paglierino Odore: caratteristico Densità a
Equilibri Acido Base e ph
 Equilibri Acido Base e ph Definizioni di Acido e Base Secondo la teoria di Arrhenius, un acido è una sostanza che dissociandosi in acqua libera ioni H +, una base è invece una sostanza che dissociandosi
Equilibri Acido Base e ph Definizioni di Acido e Base Secondo la teoria di Arrhenius, un acido è una sostanza che dissociandosi in acqua libera ioni H +, una base è invece una sostanza che dissociandosi
Rapporti tra malnutrizione e salute
 La nutrizione Rapporti tra malnutrizione e salute La nutrizione è uno dei più importanti determinanti della salute. Esiste una stretta correlazione tra alimentazione non corretta e insorgenza di numerose
La nutrizione Rapporti tra malnutrizione e salute La nutrizione è uno dei più importanti determinanti della salute. Esiste una stretta correlazione tra alimentazione non corretta e insorgenza di numerose
ESERCITAZIONE 11 SOLUZIONI DI ELETTROLITI
 ESERCITAZIONE 11 SOLUZIONI DI ELETTROLITI Sono elettroliti gli acidi, le basi e i sali. Quando sono in soluzione le loro molecole sono parzialmente o totalmente scisse in particelle dotate di carica (ioni).
ESERCITAZIONE 11 SOLUZIONI DI ELETTROLITI Sono elettroliti gli acidi, le basi e i sali. Quando sono in soluzione le loro molecole sono parzialmente o totalmente scisse in particelle dotate di carica (ioni).
1. CALCOLO DELLA QUANTITÀ D'ARIA NECESSARIA ALLA COMBUSTIONE DI UN DATO COMBUSTIBILE
 1. ALL DELLA QUANTITÀ D'ARIA NEESSARIA ALLA MBUSTINE DI UN DAT MBUSTIBILE 1.1. Reazioni di combustione stechiometrica di un idrocarburo m omponente Simbolo Peso molecolare (M) arbonio (12) Idrogeno 2 (2)
1. ALL DELLA QUANTITÀ D'ARIA NEESSARIA ALLA MBUSTINE DI UN DAT MBUSTIBILE 1.1. Reazioni di combustione stechiometrica di un idrocarburo m omponente Simbolo Peso molecolare (M) arbonio (12) Idrogeno 2 (2)
Dalla visione attuale alla visione sistemica ALLEGATO 6
 372 373 3 2 Open Aerobic Reactor 3 3 376 m 3 2 imozione di composti organici e di alcuni metalli pesanti, processo di disinfezione per la rimozione di alcuni patogeni. 377 ioni proteinev irus batteri
372 373 3 2 Open Aerobic Reactor 3 3 376 m 3 2 imozione di composti organici e di alcuni metalli pesanti, processo di disinfezione per la rimozione di alcuni patogeni. 377 ioni proteinev irus batteri
SISTEMI THERMO SCIENTIFIC AQUAKEM PER L ANALISI AUTOMATICA DI ACQUE MARINE E SALMASTRE. AHSI Spa www.ahsi.it
 SISTEMI THERMO SCIENTIFIC AQUAKEM PER L ANALISI AUTOMATICA DI ACQUE MARINE E SALMASTRE AHSI Spa www.ahsi.it ORIGINE DEI DATI Apparecchiatura: Analizzatore Fotometrico AQUAKEM 200 di Thermo Scientific Cliente:
SISTEMI THERMO SCIENTIFIC AQUAKEM PER L ANALISI AUTOMATICA DI ACQUE MARINE E SALMASTRE AHSI Spa www.ahsi.it ORIGINE DEI DATI Apparecchiatura: Analizzatore Fotometrico AQUAKEM 200 di Thermo Scientific Cliente:
Farmacopea Europea (European Pharmacopeia)
 LA FARMACOPEA Le Farmacopea Ufficiale della Repubblica Italiana (XII edizione) era un codice farmaceutico, cioè un insieme di disposizioni tecniche ed amministrative rivolte a permettere il controllo della
LA FARMACOPEA Le Farmacopea Ufficiale della Repubblica Italiana (XII edizione) era un codice farmaceutico, cioè un insieme di disposizioni tecniche ed amministrative rivolte a permettere il controllo della
Composti e. reazioni. F1 Composti e
 F1 Composti e reazioni Le formule chimiche: rappresentazioni simboliche Abbiamo già avuto modo di osservare che gli elementi chimici sono caratterizzati dalla capacità di combinarsi tra loro per formare
F1 Composti e reazioni Le formule chimiche: rappresentazioni simboliche Abbiamo già avuto modo di osservare che gli elementi chimici sono caratterizzati dalla capacità di combinarsi tra loro per formare
Calcolare quante moli di zinco sono contenute in 5,50 g di Zn. (Massa molare (m.m.) Zn = 65,409 g mol -1 ).
 Calcolare quante moli di zinco sono contenute in 5,50 g di Zn. (Massa molare (m.m.) Zn = 65,409 g mol -1 ). moli Zn = massa Zn / m.m. Zn = 5,50 / 65,409 g mol -1 = 8,41 10-2 mol Calcolare a quante moli
Calcolare quante moli di zinco sono contenute in 5,50 g di Zn. (Massa molare (m.m.) Zn = 65,409 g mol -1 ). moli Zn = massa Zn / m.m. Zn = 5,50 / 65,409 g mol -1 = 8,41 10-2 mol Calcolare a quante moli
Coprono 71% superficie terrestre vita originata Fonte Contengono 97%
 Gli oceani e i mari Coprono il 71% della superficie terrestre (81% nell emisfero australe e 61% emisfero boreale) La vita si è originata nelle acqua marine Fonte di cibo, sale, acqua, petrolio Contengono
Gli oceani e i mari Coprono il 71% della superficie terrestre (81% nell emisfero australe e 61% emisfero boreale) La vita si è originata nelle acqua marine Fonte di cibo, sale, acqua, petrolio Contengono
GESTIONE NUTRIZIONALE DELLE UROLITIASI DEL GATTO Dott.ssa Miljana Glazar Libero professionista
 GESTIONE NUTRIZIONALE DELLE UROLITIASI DEL GATTO Dott.ssa Miljana Glazar Libero professionista UROLITIASI Concrezioni macroscopiche o calcoli presenti nelle vie urinarie LOCALIZZAZIONE: Bacinetto renale
GESTIONE NUTRIZIONALE DELLE UROLITIASI DEL GATTO Dott.ssa Miljana Glazar Libero professionista UROLITIASI Concrezioni macroscopiche o calcoli presenti nelle vie urinarie LOCALIZZAZIONE: Bacinetto renale
Migliorare la qualità dell acqua
 Migliorare la qualità dell acqua Migliora la qualità dell acqua con Peters Excel! E importante riconoscere la qualità dell'acqua Quali sono i fattori da considerare? Valore EC (in ms o us) ph dell'acqua
Migliorare la qualità dell acqua Migliora la qualità dell acqua con Peters Excel! E importante riconoscere la qualità dell'acqua Quali sono i fattori da considerare? Valore EC (in ms o us) ph dell'acqua
MASSE ATOMICHE RELATIVE - MOLE
 MASSE ATOMICHE RELATIVE - MOLE Massa Atomica Massa Molecolare La mole Massa Molare Composizione percentuale dei composti chimici Formula Minima e Formula Molecolare MASSA ATOMICA Pur essendo ormai note
MASSE ATOMICHE RELATIVE - MOLE Massa Atomica Massa Molecolare La mole Massa Molare Composizione percentuale dei composti chimici Formula Minima e Formula Molecolare MASSA ATOMICA Pur essendo ormai note
DISINCROSTANTI ANTICORROSIVI - VAPORE
 DISINCROSTANTI ANTICORROSIVI - VAPORE L aumento della temperatura dell acqua comporta la precipitazione di sali di calcio e magnesio che si depositano sulle superfici metalliche delle tubazioni sulla serpentina
DISINCROSTANTI ANTICORROSIVI - VAPORE L aumento della temperatura dell acqua comporta la precipitazione di sali di calcio e magnesio che si depositano sulle superfici metalliche delle tubazioni sulla serpentina
Misure di ph e titolazione acidobase con metodo potenziometrico
 - Laboratorio di Chimica 1 Misure di ph e titolazione acidobase con metodo potenziometrico PAS A.A. 2013-14 Obiettivi 2 Uso di un ph-metro per la misura del ph Titolazione acido-base: costruzione della
- Laboratorio di Chimica 1 Misure di ph e titolazione acidobase con metodo potenziometrico PAS A.A. 2013-14 Obiettivi 2 Uso di un ph-metro per la misura del ph Titolazione acido-base: costruzione della
Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali:
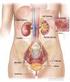 Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali: 1) Secerne Idrogenioni; 1a) Riassorbe il Bicarbonato Filtrato; 1b) Produce Nuovo Bicarbonato. 4320 meq/die
Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali: 1) Secerne Idrogenioni; 1a) Riassorbe il Bicarbonato Filtrato; 1b) Produce Nuovo Bicarbonato. 4320 meq/die
Rene ed equilibrio acido-base
 Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Corso di Laurea in Chimica e Tecnologia Farmaceutiche Esame di Chimica Analitica e Complementi di Chimica Modulo di Chimica Analitica 8 Novembre 2012
 Modulo di Chimica Analitica 8 Novembre 2012 1. Una soluzione viene preparata sciogliendo1210 mg di K 3 Fe(CN) 6 in 775 ml di acqua. Calcolare: a) la concentrazione analitica di K 3 Fe(CN) 6 b) la concentrazione
Modulo di Chimica Analitica 8 Novembre 2012 1. Una soluzione viene preparata sciogliendo1210 mg di K 3 Fe(CN) 6 in 775 ml di acqua. Calcolare: a) la concentrazione analitica di K 3 Fe(CN) 6 b) la concentrazione
Classificazione & Nomenclatura
 Classificazione sostanze chimiche Inorganici Organici Compos5 organici: forma5 da catene di atomi di C H, O, S, N Classi di compos5 organici idrocarburi: CxHy alifa5ci aroma5ci alcooli: OH eteri: O chetoni
Classificazione sostanze chimiche Inorganici Organici Compos5 organici: forma5 da catene di atomi di C H, O, S, N Classi di compos5 organici idrocarburi: CxHy alifa5ci aroma5ci alcooli: OH eteri: O chetoni
Ruolo del calcio nella cellula
 Ruolo del calcio nella cellula I meccanismi evolutivi hanno attribuito agli ioni fosfato un importanza fondamentale poiché sono necessari per sintetizzare ATP. Per questo motivo la loro concentrazione
Ruolo del calcio nella cellula I meccanismi evolutivi hanno attribuito agli ioni fosfato un importanza fondamentale poiché sono necessari per sintetizzare ATP. Per questo motivo la loro concentrazione
UNITA 3 COMBUSTIONE, CARBURANTI, LUBRIFICANTI
 UNITA 3 COMBUSTIONE, CARBURANTI, LUBRIFICANTI Esercizio 3.1 Calcolare il potere calorifico superiore e inferiore del gas metano che brucia secondo la reazione CH 4 + 2 O 2 CO 2 + 2 H 2 O sapendo che l
UNITA 3 COMBUSTIONE, CARBURANTI, LUBRIFICANTI Esercizio 3.1 Calcolare il potere calorifico superiore e inferiore del gas metano che brucia secondo la reazione CH 4 + 2 O 2 CO 2 + 2 H 2 O sapendo che l
Esercizi e problemi tratti dal libro La chimica di Rippa Cap. 14 L'equilibrio chimico
 Esercizi e problemi tratti dal libro La chimica di Rippa Cap. 14 L'equilibrio chimico 43. A 723 K in un reattore dal volume di 5,000 L sono presenti all'equilibrio 3,356 mol di azoto, 4,070 mol di idrogeno
Esercizi e problemi tratti dal libro La chimica di Rippa Cap. 14 L'equilibrio chimico 43. A 723 K in un reattore dal volume di 5,000 L sono presenti all'equilibrio 3,356 mol di azoto, 4,070 mol di idrogeno
FORMULARIO DI CHIMICA
 ARGOMENTO Grandezze chimiche fondamentali: 1. Numero di Avogadro 2. Mole 3. Massa Molare 4. Densità 5. Volume molare di un gas Modi di esprimere la concentrazione: 1. Molare M 2. Parti per milione ppm
ARGOMENTO Grandezze chimiche fondamentali: 1. Numero di Avogadro 2. Mole 3. Massa Molare 4. Densità 5. Volume molare di un gas Modi di esprimere la concentrazione: 1. Molare M 2. Parti per milione ppm
Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza?
 Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza? Fisicamente è impossibile contare gli atomi contenuti in una data quantita di sostanza. E impossibile
Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza? Fisicamente è impossibile contare gli atomi contenuti in una data quantita di sostanza. E impossibile
