EQUILIBRIO ACIDO-BASE. ACIDI, BASI e ph SISTEMI TAMPONE
|
|
|
- Oliviero Amore
- 8 anni fa
- Visualizzazioni
Transcript
1 EQUILIBRIO ACIDO-BASE ACIDI, BASI e ph Acido: sostanza che in acqua è capace di cedere H + HA + H 2 O H 3 O + + A - ; HA H + + A - Base: sostanza che in acqua è capace di accettare H + 1 B + H 2 O BH + + OH - ; B + H BH Gli acidi e le basi sono distinti in forti e deboli e la loro forza può essere misurata applicando la legge di azione di massa 2. All equilibrio, ricordando che la quantità di acqua può ritenersi costante: Acido: ([A - ] [H 3 O + ])/[HA] = K a, ove K a è la costante di ionizzazione dell acido, che è la misura della forza dell acido; Base: ([BH + ] [OH - ])/[B] = K b, ove K b è la costante di ionizzazione della base, che è la misura della forza della base. Anche l acqua, subendo un processo di autoprotolisi, è, all equilibrio, una miscela di acidi e basi: 2H 2 O H 3 O + + OH - Analogamente per gli acidi e le basi suddette, si ha: [H 3 O + ] [OH - ] = K w, ove K w è il prodotto ionico dell acqua ed a 25 C vale 1,0 x Nell acqua pura [H 3 O + ] deve essere uguale a [OH - ], dunque: [H 3 O + ] = [OH - ] = 10-7 In una soluzione per aggiunta di un acido può aumentare [H 3 O + ], mentre per aggiunta di una base può diminuire, ovvero aumentare [OH - ]; una soluzione può essere: acida: [H 3 O + ]>10-7 ; neutra: [H 3 O + ]= 10-7 basica: [H 3 O + ]<10-7 Questi valori possono essere espressi in forma logaritmica decimale anziché in forma esponenziale: ph = - log [H 3 O + ]. Una soluzione, infine, è acida se ph < 7 neutra se ph = 7 basica se ph > 7. SISTEMI TAMPONE I sistemi tampone si basano sulla teoria di Brönsted e Lowry. Normal Range ph: 7,37 7,43. Questo valore di ph è fondamentale per lo svolgimento delle funzioni fisiologiche dell organismo che, come si sa, sono legate alla perfetta funzionalità degli enzimi. Una variazione del ph può compromettere in maniera assai grave la vita delle cellule. L evoluzione ha fatto si che si formassero dei meccanismi capaci di regolare il ph verso un livello standard; questi meccanismo sono detti sistemi tampone. Ogni tampone è caratterizzato dalla presenza di un acido ed una base coniugati, entrambi moderatamente deboli. In soluzione sono all equilibrio tramite la reazione: HA+ H 2 O A - + H 3 O + Se viene aggiunto un acido forte a questo sistema, l equilibrio tende a spostarsi verso dx, per l aumento di [H 3 O + ]. Nonostante la presenza dell acido forte, [H 3 O + ] non aumenta come previsto per la presenza della base debole del sistema tampone che tede a ristabilire l equilibrio aumentando [HA]. All opposto, se viene aggiunta una base H + e OH - reagiscono sostando l equilibrio verso sx, ma HA si dissocia più del normale, limitando la diminuzione di H +. 1 Ne consegue che una base è anche una sostanza capace di liberare ioni OH - 2 La legge di azione di massa regola le reazioni all equilibrio dinamico: all equilibrio, il rapporto tra i prodotti delle [prodotti] e i prodotti delle [reagenti], elevate ad una potenza pari al coeff. stechiometrico, è costante a temperatura costante. Se K eq è grande, la reazione è spostata verso i prodotti, se piccola, verso i reagenti, se prossima all unità, è tendente all equilibrio dinamico.. alexys3 S.U.N. Napoli Pagina 1 di 22
2 PLASMA E SANGUE Il ph fisiologico del sangue e dei liquidi extracellulari in genere è tra i 7,37 7,43, 3 corrispondente ad una [H + ] arteriosa 40 meq/l; nel sangue venoso il ph è inferiore di 0,02 unità. Tale ph è mantenuto costante nonostante le cellule espellino scorie metaboliche basiche e scorie metaboliche acide (circa 72 meq di H + e 25 mol CO 2 pro die). I margini entro cui [H + ] L.E.C. può variare sono ristretti, da 16 a 160 nmol/l. Il viraggio verso l acidità è caratterizzato da (condizioni comuni): CO 2 ; Acido lattico del lavoro muscolare; Acidi da chetosi diabetica (ac acetico, acetacetico, ac.β-idrossibutirrico); Ingestione di sali acidificanti (NH 4 Cl e CaCl 2 ); Patologie renali per scarso recubero di bicarbonati. Il viraggio verso la basicità è caratterizzato da: Frutta per alto contenuto di Na + e K + con ac. organici deboli, i cui anioni sono metaboliizati a CO 2, lasciando nel corpo NaHCO 3 e KHCO 3. Ingestione di NaHCO 3 e KHCO 3 ed altri alcali; Vomito e diarrea. È importante ricordare che il ph del sangue è quello del plasma vero e cioè del plasma che si è equilibrato con Hb negli eritrociti. La produzione giornaliera di acidi fissi nell uomo normale è di circa 1 meq/kg peso corporeo ; gli acidi fissi devono essere eliminati con le urine: 70 meq/die per 70 Kg. TAMPONI INTRACELLULARI / BUFFER BIOLOGICO Buffer biologico: la presenza di H + in eccesso può determinare l ingresso di idrogeniioni all interno delle cellule, mediante meccanismi di diffusione, con la fuoriuscita di Cl -, Na + e K + ; il potassio è lo ione maggiormente mobilitato. Nei casi gravi di acidosi (vedi dopo, sezione patologie), i soggetti sono a rischio di iperpotassemia; 4 lo stesso avviene quando si rende necessaria l infusione di bicarbonato endovena: circa la metà diffonde nelle cellule. Ubiquitario: tutte le cellule accettano H + e lasciano K + ; rischio di iperpotassemia; Osteociti: le cellule dell osso accettano 2H + per Ca 2+ ; a lungo andare, rischio di osteomalacia, osteoporosi etc. N.B. Sono sistemi agiscono in poche ore. TAMPONI EXTRACELLULARI Tampone H 2 CO 3 -HCO - 3 : il sistema bicarbonato-ac.carbonico è quello più efficiente, perché mentre questi tende a regolare il ph ematico, altri apparati, respiratorio e renale, sono impegnati nel suo mantenimento. Per questo sistema tampone all equilibrio si ha: ([H + ] [HCO 3 - ])/[H 2 CO 3 ]) = K 3 Questo valore è determinato dal rapporto tra concentrazione plasmatica di bicarbonato di sodio (26-27 meq/l) e la concentrazione di CO 2 nel plasma (tensione parziale di CO 2 = 40 mmhg), secondo l equazione di Henderson- Hasselbalch. 4 Condizioni di iperpotassiemia sono le cause più frequenti di aritmia perché non si ottiene una sufficiente ripolarizzazione del miocardio specifico. I canali al K + del miocardio specifico determina efflusso di ione potassio dalle cellule dopo il potenziale avviatore, in modo da ripolarizzare le cellule; se questa corrente è ostacolata per eccesso di ione potassio fuori le cellule, non si ha una ripolarizzazione efficace, con alto rischio di aritmie, spt blocco della contrazione con morte in diastole. alexys3 S.U.N. Napoli Pagina 2 di 22
3 [H + ] = K [H 2 CO 3 ] / [HCO - 3 ] [H + ] = α PaCO 2 / [HCO - 3 ] 5 [H + ] = 40 meq/l ph = 7,40 Normal Ranges: PH = 7,37 7,43; PaCO 2 = mmhg; [HCO - 3 ] = meq/l; PaO 2 = 103,5 (0,43 x età) 6 Questo sistema tampone è peculiare per il fatto che la sua componente acida (CO 2 disciolto e H 2 CO 3 ) è un gas che si forma continuamente e la sua eliminazione avviene mediante la respirazione. La produzione metabolica di acidi forti, come H 2 SO 4 e NaH 2 PO 4 indurrà un consumo di bicarbonati perché con essi reagiranno. H 2 SO 4 + 2NaHCO 3 Na 2 SO 4 + 2H 2 CO 3 ( 2 H 2 O + CO 2 ) NaH 2 PO 4 + NaHCO 3 Na 2 HPO 4 + H 2 CO 3 ( 2 H 2 O + CO 2 ) Ogni molecola di acido solforico (H 2 SO 4 ) consuma due bicarbonati, e ogni molecola di fosfato monosodico (NaH 2 PO 4 ) consuma una molecola di bicarbonato. Viene così alterato il rapporto HCO - 3 /H 2 CO 3, che normalmente è 20:1, per la deplezione di bicarbonato ne consegue che qualsiasi diminuzione netta dei bicarbonato è indice di un evento acuto. In questi casi incrementa il respiro, con aumento dell eliminazione di CO 2 ; se ciò non avvenisse, si avrebbe una diminuzione del ph ematico. Questo è un meccanismo ad azione immediata. Proteine: i gruppi carbossilici e aminici in soluzione e all equilibrio sono dissociati e possono accettare o cedere H + ; Hb: i gruppi imidazolici dei residui istidinici. A ph tra 7,0 e 7,7 questi residui contribuiscono poco, ma la molecola di Hb presenta 38 residui istidinci e, quindi, risulta uno dei tamponi più efficienti. N.B. I sistemi tampone proteine e Hb sono immediati. Sistema respiratorio: è regolato dai chemocettori aortici e carotidei, stimolati dall elevata [H + ] e dall elevata PaCO 2, mentre sono depressi se [H + ] è bassa e se PaCO 2 è bassa. Ad un aumento della [CO 2 ] o una diminuzione di ph, il sistema respiratorio risponde con una iperventilazione e viceversa con una ipoventilazione. Sistema renale: presenta diverse vie per preservare i bicarbonati, e quindi per mantenere il ph. Il riassorbimento tubulare dei bicarbonati filtrati dal glomerulo è completo, ed avviene soprattutto (85-90%) nel tubulo prossimale. Nonostante ciò si rende necessaria la rigenerazione del pool dei bicarbonati. Avvengono, quindi, una serie di reazioni inverse a quelle sopra citate. Risparmio del Na + : fondamentale è la presenza di una pompa Na + -K + -ATPasi che trasporta 1 Na + nel L.I.C. e 1 K + nella cellula del tubulo. Da qui K + per diffusione tende a ritornare nel L.I.C.; CO 2 e H 2 O sono convertiti dall anidrasi carbonica 7 in H 2 CO 3 che subito si dissocia in HCO 3 - e H + ; dato il deficit di Na +, H + è escreto nel lume del tubulo e Na + è riassorbito dal lume. Per ciascun H + escreto, sono riassorbiti un Na + ed un HCO per effetto della respirazione, [H 2 CO 3 ] è direttamente proporzionale alla PaCO 2 mediante la costante α, coefficiente di dissociazione CO 2, dato che CO 2 + H 2 O H 2 CO 3 H + + HCO 3 -. PcCO 2. α = 0,0301; PaCO 2 = 40 mmhg. 6 Sono presenti cambiamenti fisiologici della [O 2 ] arteriosa in base all età, così come è diversa PA [O 2 ] 100 mmhg da Pa [O 2 ] 95 mmhg, data la presenza di shunt artero-venosi, ovvero anastomosi tra arterie e vene polmonari; 1,2% dell intera G.C. non passa attraverso il microcircolo. 7 La formazione di H 2 CO 3 è catalizzata dall anidrasi carbonica; molti diuretici inibiscono questo enzima deprimendo l escrezione di acido; è questo il caso dell alcalosi respiratoria. alexys3 S.U.N. Napoli Pagina 3 di 22
4 Riutilizzo di CO 2 e uso del tampone fosfato: quando vengono riassorbiti tutti HCO 3 -, si potrebbe acidificare l urina. Nel liquido tubulare è presente il tampone HPO 4 2- /H 2 PO 4 - che evita che ciò accada. CO 2 e H 2 O sono assorbiti dal capillare peri-tubulare e si ha la formazione di H + e HCO 3 -. H + viene escreto nel tubulo in scambio di Na + che è legato al tampone fosfato sottoforma di fosfato bisodico; si forma fosfato monosodico che è eliminato; Na + una volta liberato, entra nella cellula del tubulo e si lega a HCO 3 - ed è liberato nell interstizio sottoforma di NaHCO 3. Tampone NH 3 /NH 4 + : i mitocondri delle cellule dl tubulo producono NH 3 ad opera della glutaminasi che scinde il gruppo amidico della glutamina formando ac.glutammico e ammoniaca. NH 3 nel tubulo cattura H + della reazione dell anidrasi carbonica e per bilancio elettrolitico è riassorbito il Na + nel tubulo. È evidente, da quanto detto, che solo 1,5-2% degli H + secreti nel tubulo non servono alla rigenerazione dei bicarbonati, ma sono usati per l acidificazione elle urine. Si ritrovano come fosfati (acidità titolabile), e ioni ammonio (NH 4 + ). N.B. La funzione tubulare di riassorbimento dei bicarbonati è strettamente legata al VEC: Volume Extra-Cellulare. L espansione del VEC determina riduzione del riassorbimento di sodio, e, quindi, di bicarbonato. Viceversa, una contrazione del VEC determina stimolazione del riassorbimento dei bicarbonati. alexys3 S.U.N. Napoli Pagina 4 di 22
5 ESCREZIONE URINARIA DI ACIDI - ACIDITÀ TITOLABILE URINARIA AMMONIURIA Determinare il ph delle urine non è un procedimento completo. Una piccola quantità di acido forte in esse, infatti, diminuisce notevolmente il ph di urine povere di sistemi tampone. L eliminazione urinaria di acidi fissi è effettuata con il dosaggio della acidità titolabile urinaria e con il dosaggio della escrezione di ioni ammonio. L acidità titolabile delle urine indica gli ioni idrogeno presenti nelle urine soprattutto come fosfati monopodici, ed in minima parte come acidi liberi. Si determina titolando le urine con una soluzione di NaOH con la seguente: NaH 2 PO 4 + NaOH Na 2 HPO 4 + H 2 O Aggiungendo NaOH goccia a goccia, il ph delle urine non si modifica finché è presente fosfato monopodico, in quanto tutto l NaOH è consumato. Quando il fosfato è consumato, qualsiasi aggiunta di NaOH aumenterà il ph. Ne consegue che l acidità titolabile è equivalente alla quantità di NaOH necessaria a portare il ph delle urine alla alcalinità. In un soggetto adulto normale la quantità di acidi (H + ) eliminati nelle urine è uguale alla quantità di acidi fissi generati ogni giorno: 1 meq/kg di peso corporeo, quindi circa 70 meq/die (poco più della metà come NH 4 +, il resto come acidità titolabile. Gap Anionico EQUILIBRIO ACIDO-BASE ED ELETTROLITI La valutazione dell equilibrio acido-base deve comprendere sempre il calcolo del gap anionico. Per la legge dell elettroneutralità, la somma delle cariche positive deve eguagliare quella delle cariche negative. Poiché la concentrazione del sodio è maggiore della somma delle concentrazioni dei bicarbonati, si determina l anion gap. Il GA esprime la differenza sierica tra [anioni] e [cationi]; in realtà [anioni] dovrebbe essere uguale a [cationi]. [cationi] = Na + + K + + CNM; [anioni] = HCO Cl - + ANM 8. Na + + K + + CNM = Cl - + HCO ANM Dato che K + è nel plasma in piccolissime quantità, potrebbe essere compreso tra CNM, quindi: Na + (+K + ) - (Cl - + HCO 3 - ) = ANM CNM Pertanto il gap anionico è ANM CNM che è 8-16 meq/l ( 12 meq/l). È tipico l esempio della acidosi metabolica da diarrea (ipercloremica), in sui si ha una perdita eccessiva di bicarbonato, compensata da un maggiore riassorbimento tubulare di Cl - come NaCl, se il soggetto ha una funzione renale normale. Il gap anionico può aumentare, ad esempio, in condizioni di acidosi metabolica uremica, per aumento delle concentrazioni sieriche di fosfato e solfato. Può aumentare con l aumento di albumina. Aumento con normali livelli di albumina: Acidi senza cloro; Aumento di solfato e fosfato; Chetoacidi (diabete); Lattato; Salicilati o tossine; Aumento carica ionica albumina (per alcalosi). 8 CNM: cationi non misurabili; ANM: anioni non misurabili, anche proteine anioniche, fosfati, solfati e anioni inorganici. alexys3 S.U.N. Napoli Pagina 5 di 22
6 Può risultare diminuito: Aumento cationi non misurabili; Aumento di Cloro (diarrea); Cationi esogeni come Litio; Ig cationiche; Diminuzione [albumina]; Riduzione carica ionica albumina (per acidosi); Iperlipidemia marcata. Valori degli elettroliti fondamentali in questo calcolo Na + : meq/l. K + : 4-5 meq/l. Cl - : meq/l. Ca 2+ : 4,5-5 meq/l mg/100 ml. PO 4 3- :3-4,5 mg/100 ml. HCO 3 - : meq/l. Quando valutare l equilibrio acido-base? PATOLOGIE L EAB è da valutare in condizioni cliniche e laboratoristiche molto diverse. Le condizioni cliniche più comuni sono: perdite gastro-enteriche prolungate, grave ipotensione, alterazione del numero degli atti respiratori e nel diabete scompensato. Le condizioni laboratoristiche più comuni sono: variazioni della potassiemia, creatininemia elevata, variazioni della cloremia dissociate dalla sodiemia. Nota bene: la [K + ] plasmatica risente sempre delle variazioni di ph. Acidosi: aumento della potassiemia perché gli ioni H + sono scambiati con K + intracellulare. Si ha stimolazione della secrezione tubulare di H +. Alcalosi: diminuzione della potassiemia, con depressione della secrezione tubulare di H +. La potassiemia aumenta o riduce di 0,6 meq/l per ogni modificazione di ph di 0,1. ACIDOSI METABOLICA Massimo impiego ed incapacità dei bicarbonati a neutralizzare radicali acidi di qualsiasi provenienza. ph diminuito (7,25 7,35); HCO 3 - diminuito (circa 10 meq/l); PaCO 2 diminuita (20-30 mmhg per iperventilazione); PaO 2 aumentata o normale. Cambiamento primitivo: [HCO 3 - ] Risposta compensatoria: 1,2 mmhg PaCO 2 per 1 meq/l [HCO 3 - ]. N.B. Nell acidosi metabolica pura, per ogni meq di diminuzione di HCO 3 -, PaCO 2 diminuisce di 1,2 mmhg. Bisogna calcolare la PaCO 2 attesa e se corrisponde, ci si trova di fronte ad una condizione di compenso; in caso contrario si ha scompenso. Può essere, ad esempio, più alta delle attese, e ciò può indicare uno scompenso respiratorio associato. Cause: Aumento degli acidi: diabete mellito (DKA vedi riquadro dopo) e acidosi lattica). Insufficienza renale acuta (acidosi tubulare tipo secondo; no NH 4 + ; no H + ) alexys3 S.U.N. Napoli Pagina 6 di 22
7 Fuga di basi dall intestino (colera, diarrea, drenaggi). Alterazioni tubulari: acidosi tubulare. Ingestione di salicilati 9 (vedi anche alcalosi metabolica). e ClNH 4. Iperpotassemia: Addison o ipoaldosteronismo. Compenso: Sistemi tampone: Hb, bicarbonato e fosfato. Compenso respiratorio: diminusione pco 2. Difesa renale: escrezione di acidi. Si apprezza iperventilazione per stimolazione del centro del respiro. Nelle acidosi metaboliche il gap anionico è di norma aumentato, mentre è diminuito in caso di diarrea 7. Le forme di acidosi metabolica possono essere legate o meno, ad un aumento del gap anionico. Una acidosi con gap anionico normale è una condizione legata ad ipercloremia. Perdita gastroenterica di bicarbonati (diarrea). Perdita renale di bicarbonati. Uso di acetazolamide, inibitore dell anidrasi carbonica. Una acidosi con gap anionico aumentato è legato a: Aumento della produzione di acidi. Ingestione di sostanze tossiche come i salicilati. Insufficiente escrezione di acidi. Ingestione di metanolo e glico-etilenico. Il farmaco di scelta è il bicarbonato di sodio. ACIDOSI RESPIRATORIA Massimo impegno ed infine insufficiente escrezione respiratoria di CO 2 (ipercapnia); gli H + ritenuti provengono dai bicarbonati che non riescono a bilanciare il danno. ph diminuito o non modificato se c è compenso; PaCO 2 fortemente aumentata (70 80 mmhg); HCO 3 - aumentati (30 50 meq/l per esaltato riassorbimento renale) 11 ; PaO 2 diminuita. PIO 2 (pressione di O 2 a livello del mare) è circa 150 mmhg, ma nell alveolo PAO 2 è circa 100mmHg per la presenza del vapore acqueo. Per conoscere PAO 2, bisogna applicare la seguente: PAO 2 = PIO 2 (1,25 x PaCO 2 ) 12 PAO mmhg; PaO mmhg per la presenza degli shunt artero-venosi. Sindrome acuta Cambiamento primitivo: PCO 2. Compenso: 1 meq/l [HCO 3 - ] ogni 10 mmhg PaCO 2. Caratterizzata da insorgenza breve, presenta ph 7,20, PaCO 2 80 mmhg, HCO 3-38 meq/l e PaO 2 40 mmhg; è caratterizzata da ipossia; è frequente nei soggetti anziani, spesso fumatori ed enfisematosi, dovuta a lievi infezioni. Un aumento di 10 mmhg PaCO 2 corrisponde ad un aumento di 1 meq/l HCO 3 -, per assenza di compenso renale che è cronico. 9 Stimolano il centro del respiro con diminuzione di pco 2 e conseguente acidosi metabolica; determinano, quindi, una prima fase di alcalosi metabolica per la iperventilazione e poi acidosi metabolica per anaerobia muscolare. 7 Nella Acidosi Metabolica da diarrea si ha ipercloremia per l iperattivazione della pompa HCO 3 - /Cl - intestinale. 11 Se è scompensata, il livello dei bicarbonati si riduce attorno ai 25 meq/l. 12 1,25 è il coefficiente respiratorio di scambio: rapporto consumo O 2 e produzione CO 2 ; 1,25 O 2 1 CO 2. CO 2 /O 2 = 0,8: quoziente respiratorio. alexys3 S.U.N. Napoli Pagina 7 di 22
8 Sindrome cronica Cambiamento primitivo: PCO 2. Compenso: 3,5 meq/l [HCO 3 - ] ogni 10 mmhg PaCO 2. Presenta un aumento PaCO 2 protratto nel tempo. Spesso ph è normale o ridotto. Un aumento di 10 mmhg PaCO 2 corrisonde a aumento 3-4 meq/l HCO 3 -. Cause: Compromissione centri e/o vie respiro (infiammazioni, tumori pontini, traumi etc.). Compromissione apparato respiratorio (fratture, BPCO, enfisema, polmonite etc., sindrome di PICKWICK). Compenso: CO 2 in eccesso diffonde nel globulo rosso. N.B. Si ha cianosi, sudore, confusione mentale, cefalea e iperventilazione; la situazione può peggiorare in coma ipercapnico e morte per ipossia. Il ph può essere acido, normale o alcalino: Acido: nelle fasi di acuzie o riacutizzazioni; se pco 2 >80 mmhg il compenso renale è insufficiente; se si associa ad acidosi lattica; nell IRC; nell espansione del VEC (riducendo il riassorbimento tubulare di bicarbonato compromette il compenso renale). Normale o quasi: per l efficienza degli scambi anionici (ore) e renali (giorni). Alcalino: 7,5-7,6; se, realizzato il compenso, agitazione determina iperventilazione; se si aggiunge una deplezione salina ed acuta diminuzione della pco 2, con forte aumento dei bicarbonati: questa condizione sfocia in alcalosi metabolica. In questo caso si somministra un inibitore dell anidrasi carbonica: acetazolamide, per evitare l ipercompenso renale. Se ph 7,6 si ha un disturbo misto, poiché si sfocia nell Alcalosi respiratoria N.B. Per la valutazione della differenza tra Ac. Resp + Ipercompenso renale o Alc. Resp, bisogna valutare il Gradiente di O 2 (A-a): PAO 2 PaO 2 = PIO 2 (1.25 x PaCO 2 ) [103,5 (0,43 x età)] = 15 mmhg = acidosi respiratoria (espressione problemi polmonari) 15 mmhg = alcalosi respiratoria.!!!!!! N.B.!!!!! Se HCO 3 - è fortemente diminuita si ha iperventilazione. In casi in cui PaCO 2 è troppo alta, 100 mmhg, bisogna ossigenare il paziente con la maschera, perché l ipossia è un ottimo stimolo per la vasocostrizione polmonare, con ipertensione polmonare, poi cor polmonare acuto ed ulteriore aggravamento. L intubazione non si effettua, perché dopo può andare nuovamente in crisi. ALCALOSI METABOLICA Aumento [HCO 3 - ] senza un proporzionale aumento di PaCO 2. ph aumentato (7,45 o OK se compensata). PaCO 2 lievemente aumentata o normale. HCO 3 - aumentati (se basso, espressione di consumo di bicarbonato acidosi metabolica). PaO 2 normale (può variare, perché l alcalosi inibisce il centro del respiro). Cambiamento primitivo: [HCO 3 - ]. Compenso: 0,7 mmhg PCO 2 per 1 meq/l [HCO 3 - ]. Cause: Perdita di H + : vomito, drenaggi, diuretici, diarrea con perdita di cloruri. Iperaldosteronismo: sia primitivo (di CONN) che secondario. Le condizioni secondarie principali sono due: scompenso cardiaco e cirrosi epatica; in questi casi si ha ipopotassiemia marcata che determina alcalosi metabolica extracellulare e acidosi alexys3 S.U.N. Napoli Pagina 8 di 22
9 metabolica intracellulare (buffer biologico H + / K + ). Si possono avere alterazioni dell ECG tipiche: allungamento QT, T appiattita o invertita; sono segni di alterazione della ripolarizzazione ventricolare con rischio di post-potenziali d azione, fenomeni di rientro e tachiaritmie ventricolari. 13 Ipopotassemia (con passaggio di H + in cellule); Eccessiva somministrazione di alcali (apporto di bicarbonato); Perdita di acidi (vomito incoercibile); Perdita renale (uso di lassativi, eccessivi mineralcorticoidi, iperaldosteronismo, ipercalcemia tetanismo da alcalosi -). Condizioni di Ac. Resp. + ipercompenso renale (necessaria Acetazolamide!!!!). Compenso: Sistemi tampone con H + nel compartimento cellulare. Compenso respiratorio: ipoventilazione. Compenso renale: aumentata escrezione di bicarbonati. La terapia si basa, nella maggior parte dei casi, nell arrestare la perdita digestiva o renale, nel ripristinare il volume extracellulare con soluzioni di NaCl e nel reintegrare la potassiemia. ALCALOSI RESPIRATORIA Diminuzione della pco 2 per aumento della ventilazione. ph aumentato; PaCO 2 diminuita; HCO - 3 diminuita; PaO 2 aumentata, ok o diminuita. Sindrome acuta Cambiamento primitivo: PaCO 2. Compenso: 2 meq/l [HCO 3 - ] ogni 10 mmhg PCO 2. Sindrome cronica Cambiamento primitivo: PaCO 2. Compenso: 5 meq/l [HCO 3 - ] ogni 10 mmhg PCO 2. Cause: Iperventilazione volontaria o respirazione in ambienti umidi o surriscaldati; Grandi altitudini ed esercizio fisico a grandi altitudini; Intossicazione da salicilato 14 ; Setticemie da Gram -, come polmonite 15 ; Coma epatico per probabile stimolazione del centro del respiro. Asma cardiaco. La PaO 2 può variare: Diminuita per ipossiemia da polmonite, edema polmonare acuto, fibrosi interstiziale e polmoniti virali 16, 17, embolie polmonari 18, tumori pontini, infiammazioni etc 13 Somministrazione di resine a scambio ionico: carbeyexalate. 14 Determinano, una prima fase di alcalosi metabolica per la iperventilazione e poi acidosi metabolica per anaerobia muscolare. 15 Il paziente si presenta con febbre, dispnea, dolore puntorio di stimolazione pleurica, brividi; spesso ha torace iperespanso, epatizzazione alveolare, rinforzo di FVT, ipofonesi o afonesi, assenza di mormore vescicolare e soffio bronchiale. 16 La fibrosi interstiziale stimola i recettori IOTA dell interstizio alveolare determinando iperventilazione. alexys3 S.U.N. Napoli Pagina 9 di 22
10 Normale se compensata, spt a riposo con una leggera iperventilazione. Aumentata nelle anemie e talassemie per iperventilazione; ipotensione; elevata altitudine. Il ph può essere alcalino, normale e acido: Alcalino: fase acuta senza compenso; se coesiste deplezione salina (manca il compenso renale in quanto il riassorbimento tubulari aumenta anziché diminuire). Normale: compenso renale; produzione di acido lattico muscolare in risposta all ipossia. Acido: acidosi lattica molto marcata; in caso di IRC; da eccessiva espansione del VEC che riduce eccessivamente il riassorbimento tubulare di bicarbonato. Compenso: Azione dei tamponi: liberazione di H + dalle cellule. Azione renale: diminuzione di assorbimento dei bicarbonati e della escrezione di H + ; aumenta, così, escrezione di sodio e potassio. NORMOGRAMMA ACIDO-BASE Normogramma acido-base: mostra i cambiamenti di pco 2 (linee curve), bicarbonato plasmatico e ph nel sangue arterioso in casi di acidosi-alcalosi. Ac. Met. Ac. Resp. Alc. Met. Alc. Resp. PH o ok Bicarbonato pco 2 o ok ESEMPI CLINICI DI ACIDOSI METABOLICA Acidosi metabolica diabetica Nell acidosi diabetica si ha produzione e accumulo di corpi chetonici, tamponati dal sistema bicarbonato-acido carbonico, con aumento della pco 2 nel sangue arterioso, ne deriva dispnea e respiro di Kussmaul. 19 Gli scambi tra idrogenioni e potassio determinano iperpotassiemia. Ciò può sfociare in chetoacidosi diabetica (DKA). 17 In questi ultimi due casi, dopo sforzo fisico si ha diminuzione della PaO 2, invece che un aumento legato alo sforzo tipico del soggetto normale, perché le patologie interstiziali riducono lo scambio di O 2 che è 20 volte circa meno diffusibile della CO 2 che, invece, diffonde tranquillamente. 18 Insufficienza ventricolare sx ipertensione microcircolo trombo embolia polmonare ipossiemia. 19 Conosciuto anche come raspiro grosso di K., è caratterizzato da una profonda e rumorosa inspirazione, da una pausa inspiratoria, seguita da una inspirazione breve e da una pausa post-respiratoria assai prolungata. alexys3 S.U.N. Napoli Pagina 10 di 22
11 La DKA è tipica ed esclusiva dell IDDM1 (diabete giovanile, per assenza totale di Insulina); il glucagone, infatti, stimola completamente la lipolisi. La presenza, anche se in condizione di insulino-resistenza, di quest ultimo ormone, impedisce la chetogenesi massiva. La DKA può sfociare verso il coma diabetico chetoacidosico (al contrario, nell IDDM 2 si ha coma iperosmolare). Esempio di DKA: ph = 7,01 HCO 3 - = 4 meq/l pco 2 = 19 mmhg Na + = 125 meq/l K + = 3,5 meq/l Cl - = 90 meq/l Anion Gap = 34,5 meq/l Glicemia > 200 mg/dl. L anion gap è aumentato per la presenza nel sangue di quantità abnormi di anioni chetonici. Si procede con insulina nel diabetico, soluzioni contenenti glucosio nell alcolizzato, nella alimentazione con carboidrati nel denutrito e con reidratazione. Molti decessi in DKA sono dovuti a edema cerebrale. I decessi potrebbero essere evitabili riducendo l'incidenza del DKA tramite: Diagnosi precoce all'esordio Appropriata gestione del diabete durante le malattie intercorrenti Riconoscimento che DKA ricorrenti sono spesso causati dall'omissione dell'iniezione di insulina. Segni laboratoristici: Glicosuria oltre i 990 mg/dl e chetonuria. Iperglicemia (glicemia > 198 mg/dl). ph < 7.3 Bicarbonato < 15 mmol/l. Segni clinici e sintomi: Segni Cute secca e disidratata Tachicardia Ipotensione arteriosa Respiro di Kussmaul Odore di frutta marcia nell alito Ipotermia Ipotensione dei bulbi oculari Sfregamenti pleurici Coma o stato stuporoso Sintomi Sete Polidipsia Poliuria Nausea Vomito Astenia Dolori addominali Crampi muscolari In rari casi la Glicemia non è elevata TRATTAMENTO Rianimazione: n caso di shock e di deboli pulsazioni periferiche, o coma ossigeno 100% con maschera facciale. Soluzione salina normale 0.9% 10ml/kg oltre minuti (potrebbe essere ripetuta se le pulsazioni periferiche rimangono deboli). Può anche essere usata una soluzione al 4-5% di albumina 10ml/kg ma non c'è evidenza che sia preferibile. Le soluzioni per la rianimazione NON dovrebbero essere incluse nel calcolo del successivo deficit di idratazione. Terapia insulinica: alte dosi = 2 5 U/kg + glucosata per evitare ipoglicemia da ipercorrezione. Bolo iniziale = 0,1 U/kg/ora e.v. da interrompere quando glicemia è intorno ai 250 mg%. Poi sottocute = 0,2 U/kg/4-6 ore con controllo costante di glicemia, glicosuria e chetonuria. Dopo le prime 24 ore: 2-3 somministrazioni di insulina sottocute al giorno fino al alexys3 S.U.N. Napoli Pagina 11 di 22
12 max di 1-1,2 U/kg/die. N,B. Bisogna evitare una caduta tropo rapida dell Osm. Plasmatici, con riduzione della glicemia di circa il 10-20%/h (non > 100 mg/dl/h). Reidratazione: bisogna indurre un graduale aumento della pressione idrostatica con infusione di liquidi non > 4l/m 2 /die. Il deficit d acqua è calcolabile mediante la formula: deficit/eccesso di acqua = ATC x [(Posm Posm calcolata) / Posm calcolata] Osmolarità plasmatica= mosm/kg Posm calcolata = 2 x sodiemia + (glicemia /18) ATC = acqua corporea totale = 60% del peso corporeo. È buona norma infondere la prima metà entro 8 ore. Si somministrano soluzioni isotoniche di NaCl (0,9%) con aggiunta di K + (20-40 meq/l di liquidi somministrati, come KCl + K 3 PO 4, per evitare l ipopotassiemia da inversione del buffer biologico H + esce e K + entra nelle cellule). N.B. L attività vasoattiva dei corpi chetonici e l iperosmolarità ematica si trasmette alle cellule nervose e ciò determina fuoriuscita di liquidi. In caso di terapia con infusioni troppo rapide si può avere edema celebrale (trattare con mannitolo). Segnali/sintomi di allarme di edema cerebrale: Mal di testa e riduzione della frequenza cardiaca Cambio nello stato neurologico (agitazione, irritabilità, aumento della sonnolenza, incontinenza) segnali neurologici specifici (per es. paralisi N del cranio) Aumento della pressione arteriosa Bicarbonati: introduzione di bicarbonato di sodio solo in caso di ph ~ 6,9 in misura di 40 Eq NaHCO 3 in ½ h e sospesi quando il ph raggiunge 7,0. Negli altri casi è sufficiente la terapia insulina e idratante che, riattivando il metabolismo del glucosio e l ossidazione dei corpi chetonici, rigenera i bicarbonati. Esiste una formula più precisa da usare nella pratica clinica per il calcolo dei bicarbonati da infondere: bicarbonati: 0,4 x peso corporeo x (24 bicarbonati attesi/2) Acidosi metabolica nell uremia cronica Nell IRC si ha una ridotta efficienza dei reni malati nella escrezione di idrogenioni e nella rigenerazione dei bicarbonato. Si ha, quindi, una acidosi tubulare distale. Quando FG > ml/min l acidosi è modesta, normopotassica e può essere perfino ipercloremia. Se FG < ml/min si ha ritenzione di fosfati e solfati, con lieve acidosi, potassiemia ai limiti ed è normocloremica. Si ha aumento del anion gap per l aumento dei fosfato e dei solfato. Non da sintomatologia, ma se accentuata può provocare dispnea intensa, vomito e iperpotassiemia. Esempio: ph = 7,25 HCO 3 - = 11 meq/l pco 2 = 26 mmhg Creatininemia: 9 mg/dl Na + = 140 meq/l K + = 5 meq/l Cl - = 100 meq/l PO 4 3- = 7 mg/dl Anion Gap = 34 meq/l Acidosi metabolica ipercloremica alexys3 S.U.N. Napoli Pagina 12 di 22
13 La perdita di bicarbonato in un soggetto con normofunzione renale induce una acidosi metabolica ipercloremica per maggiore riassorbimento del cloro per compenso. Può avere diverse origini: Perdita gastro-enterica: ipercloremia; anion gap normale per recupero di cloruro; potassiemia variabile (aumenta per scambio con H + o normale o diminuisce per perdita); si ha attivazione del sistema renina-angiotensina. La correzione si avvale della somministrazione di solo bicarbonato di sodio, se è presente iperpotassiemia; in caso di normo e ipopotassiemia bisogna somministrare anche potassio perché lo scambio K + -H + può determinare ipopotassiemia mortale. Acidosi tubulare distale tipo I: incapacità del nefrone distale nel diminuire il ph del liquido tubulare; H + non va sotto i 5,5-6 meq/l. La diminuita escrezione di H + è compensata da secrezione di K + e ne consegue ipopotassiemia. Il riassorbimento di bicarbonato è normale. L acidosi tubulare distale può causare nefrocalcinosi e nefrolitiasi, ma queste possono anche esserne la causa insieme a patologie autoimmuni (LES) e alcune nefriti tubulo-interstiziali e farmaci come l amfotericina B. Acidosi tubulare generalizzata tipo IV: alterazione della escrezione di idrogenioni e potassio: si ha acidosi ipercloremica ed iperpotassica. Le cause possono essere: ipoaldosteronismo, diminuita attività retinica, insensibilità all aldosterone (per nefropatie tubulo-interstiziali). Si procede con la somministrazione di mineralcorticoidi, se carenti, e nel correggere l iperpotassiemia con diuretici o resine a scambio cationico. Acidosi tubulare prossimale tipo II: è dovuta all incapacità del tubulo prossimale di riassorbire i bicarbonato per l alterazione del controtrasporto sodio-idorgeno, o per inibizione dell anidrasi carbonica. Questa sindrome, peraltro rara, è legata, spesso, all alterazione dei riassorbimenti di sostanze legate al trasporto di sodio, come bicarbonato e glucosio (sindrome di Fanconi). Il ridotto riassorbimento di NaHCO 3 determina un aumento dell elettronegatività della membrana luminale del tubulo con aumento della secrezione di potassio e conseguente ipopotassiema. La terapia si basa sulla somministrazione di bicarbonato di sodio e potassio. ESEMPI CLINICI DI ALCALOSI METABOLICA Alcalosi metabolica da vomito In caso di vomito (e drenaggi naso-gastrici) il paziente perde acqua e soluti, soprattutto HCl (equivalente ad una aggiunta di NaHCO 3 nel sangue) e NaCl. Per comprendere meglio cosa accade, bisogna analizzare diverse tappe: Inizialmente l aumento della bicarbonatemia causa una diuresi alcalina, per perdita di HCO 3 - con le urine. La perdita di NaCl causa attivazione del sistema renina-angiotensina. L iperassorbimento di sodio e bicarbonato determina diminuzione dell eliminazione di urine alcaline, con la presentazione di urine acide: aciduria paradossa. In questa fase la produzione giornaliera di acidi nell organismo è uguale alla escrezione di acidi e l alcalosi metabolica è mantenuta. Il paziente è ipopotassemico, più che per il vomito, per l iperaldosteronismo iperreninemico per del VEC, che determina aumento dello scambio distale sodio-potassio, aumentato anche per l indisponibilità di idrogenioni da alcalosi; tutto ciò si associa a deplezione di cloro. La contrazione del VEC e la riduzione del filtrato glomerulare determina basse concentrazioni di Cloro nelle urine per sovrariassorbimento glomerulare di NaCl. Il trattamento si basa sulla somministrazione di NaCl 0,9% che corregge la contrazione del VEC, riducendo il riassorbimento dei bicarbonati e normalizzazione della bicarbonatemia. Se è presente ipopotassiemia, si rende necessaria l infusione di KCl. Alcalosi metabolica da Diuretici alexys3 S.U.N. Napoli Pagina 13 di 22
14 I diuretici tiazidici e dell ansa determinano un aumento della escrezione urinaria di H + per un maggiore apporto distale di sodio (da ridotto assorbimento), che comporta un maggiore scambio sodio-potassio e sodio-idrogenioni. Ciò determina aumento della rigenerazione di bicarbonati; ne deriva alcalosi metabolica, sostenuta, inoltre, dalla contrazione del VEC per perdita di sale. Sono tre i meccanismi principali che sostengono l alcalosi: Continua iperacidificazione distale. Sovrariassorbimento distale di bicarbonati. Iperaldosteronismo secondario all ipovolemia. L escrezione urinaria risulta elevata a meno che la contrazione del VEC sia così elevata da far cadere il FG. Il trattamento si basa sulla sospensione del diuretico ed infusione di NaCl e soluzioni di potassio. Alcalosi susseguente a ipercapnia Condizioni di acidosi possono evolvere in alcalosi. Il meccanismo iniziale per correggere l eccesso di pco 2 è l aumento della respirazione; l instaurazione di ipercapnia, se prolungata, come in caso di acidosi respiratoria cronica, è seguita dall attivazione del recupero dei bicarbonati nel rene. Si ha, così, alcalosi. Il maggior recupero di bicarbonati può causare perdita di Cl -, sottoforma di NaCl e KCl, con contrazione del VEC. Per risolvere la situazione bisogna eliminare le cause di acidosi respiratoria, compensando la contrazione del VEC con soluzioni di NaCl. Conviene in questi casi sospendere le diete povere di sale e l uso di diuretici. Alcalosi metabolica da deplezione di potassio La deplezione potassica stimola la secrezione tubulare di idrogenioni e la produzione di NH 3 +. Questa ha, però, anche effetto inibente sulla secrezione di aldosterone, ciò che limita l acidificazione delle urine, impedendo che si instauri una alcalosi metabolica; questa evenienza rara si presenta in deplezioni potassiche gravi (potassiemia < 2 meq/l), o in casi di iperaldosteronismo primario. Milk-alkali sindrome Questa particolare forma di alcalosi è legata all ingestione continua di latte o alcali contenenti carbonato di calcio e bicarbonato di sodio (frequente nei pz con ulcera gastrica). Questa sindrome si presenta con: Ipercalcemia: causa la nefrocalcinosi che può indurre insufficienza renale che facilita l iperfosforemia; stimola la secrezione tubulare di idrogenioni; inibisce le paratiroidi facilitando il riassorbimento di bicarbonato; può presentarsi calcinosi sistemica. Iperfosfatemia. Alcalosi metabolica. C è spesso nausea e vomito (da cipercalcemia); quest ultimo facilita l alcalosi e può causare contrazione del VEC. EMOGASANALISI La valutazione dell equilibrio acido-base impiega analizzatori automatici capaci di effettuare contemporaneamente la misura del ph, della pco 2, della po 2 e dell Hb. Il dosaggio è effettuato su un piccolo campione di sangue, 125 nl, pelevato con una siringa eparinizzata, dell arteria femorale o omerale. L analizzatore comprende elettrodi speciali ed un fotometro. Misurazione di ph Valore: 7,37 7,43. Si serve di un elettrodo di vetro sensibile al ph. Si genera, per scambio ionico, V proporzionale alla differenza di ph che c è tra le soluzioni separate dal vetrino. Misurazione della pco 2 Valori: mmhg. alexys3 S.U.N. Napoli Pagina 14 di 22
15 HCO 3 - : meq/l. Si serve dell elettrodo di Seringhaus e Bradley, rivestito da una membrana di teflon. La CO 2 diffonde attraverso la membrana in funzione del gradiente pressorio. Attraversata la membrana ed a contatto con HCO 3 e NaCl, si idrata e produce acido carbonico secondo la seguente: CO 2 + H 2 O H 2 CO 3 H - + HCO 3 Si crea, così, una variazione di ph proporzionale alla quantità di CO 2 penetrata e, quindi, alla sua pressione parziale. Misurazione della po 2 Valore: 96 mmhg. PaO 2 : 103,5 (0,43 x età) mmhg; sono presenti cambiamenti fisiologici della [O 2 ] arteriosa in base all età, così come è diversa PA [O 2 ] 100 mmhg da Pa [O 2 ] 95 mmhg, data la presenza di shunt arterovenosi, ovvero anastomosi tra arterie e vene polmonari; 1,2% dell intera G.C. non passa attraverso il microcircolo. Si serve dell elettrodo di Clarke, riempito con una soluzione elettroconduttrice con KCl a debole concentrazione in tampone fosfato, rivestito da una membrana di propilene. O 2 diffonde attraverso la membrana fino alla superficie del catodo; tra catodo ed anodo è presente una V di 630 mv: Se non è presente O 2, non ci sarà riduzione. Se è presente O 2, si genera una corrente elettrica proporzionale alla tensione di O 2. Dosaggio dell Hb Valore: 15 g% - 12,5 15,5 g/dl. Si basa sulla legge di Beer, secondo la quale, la quantità di luce monocromatica assorbita da una soluzione colorata è funzione esponziale della sostanza assorbente presente in soluzione. Basandosi su questi 4 valori, si può ricavare: Bicarbonati. CO 2 totale plasmatica. Eccesso di basi. Saturazione di O 2. Bicarbonato Standard L equilibrio acido-base può alterarsi o per alterazioni dell attività respiratoria, o per alterazioni dello stato metabolico. Il bicarbonato standard è la concentrazione di bicarbonato in un campione di sangue arterioso ossigenato, una volta equilibrato con CO 2, ad una pco 2 di 40 mmhg a 38 C. Il valore normale è meq/l. Essendo eliminate le possibilità di variazione di pco 2, ogni alterazione di questo valore esprimerebbe una alterazione metabolica, con eccesso di basi nella alcalosi metabolica, ed un difetto di basi nella acidosi metabolica. In assenza di eccesso/difetto di basi, l alterazione dell equilibrio acido-base sarebbe di orginie respiratoria. Questo test non è, però, molto attendibile. EQUILIBRIO DEI LIQUIDI CORPOREI E RICAMBIO IDRO-SALINO Il contenuto in acqua dell organismo è del 45-80%. In un uomo sano di 70 kg di peso, l acqua corporea è circa il 60%, circa 42 l, e solo il restante 40% è massa solida. L acqua ha una distribuzione peculiare nell organismo, divisa in compartimento intracellulare, compartimento extracellulare, a sua volta diviso in volume plasmatico ed intertiziale, e terzo spazio, che rappresenta quella percentuale variabile di acqua in cavità virtuali come il pericardio, la pleura, peritoneo, tubo gastro-intestinale etc (ad esempio aumenta in corso di ascite). Il contenuto è così suddiviso: Volume intracellulare: 40% - 28 l. Volume extracellulare VEC: 20% - 14 l. Volume plasmatico: circa 5% - 3,5 l. Volume interstiziale: circa 15% - 10,5 l. Terzo spazio: variabile. Lo spostamento dell acqua in questi compartimenti dipende dalla concentrazione di soluti osmoticamente attivi, ovvero particelle in grado di effettuare un richiamo dell acqua, che tende a spostarsi nel compartimento più ricco di queste particelle. Informazioni sulla quantità delle particelle attive si ha grazie la tonicità, espressa in osmoli. L osmolalità di una soluzione è la concentrazione di tutti i soluti in essa presenti. L Osm. sierica è data, principalmente, dal sodio e dagli anioni corrispondenti (Cl - e HCO 3 - ), perché la concentrazione di potassio è così bassa da influire molto poco. Un altro parametro da ricordare, importante alexys3 S.U.N. Napoli Pagina 15 di 22
16 in diverse patologie e specialmente nel diabete mellito scompensato, è la glicemia, perché il glucosio è osmoticamente attivo. Tutte le condizioni in cui si ha perdita di acqua si accompagnano a contrazione del VEC, ovvero ipertonicità. SODIEMIA La sodiemia è meq/l. Questo valore può essere considerato come l indice del contenuto corporeo di acqua, cioè lo stato di idratazione, perché, moltiplicato per due (per l anione cloruro e bicarbonato cui si accompagna), rappresenta il 90% del suo valore. Il sodio è il principale soluto osmoticamente attivo presente nel corpo, raccogliendosi maggiormente nel spazio extracellulale. Una riduzione della sua concentrazioe si associa, in generale, ad ipotensione. Un aumento della sua concentrazione si associa, invece, ad espansione del VEC fino all edema. La sodiemia è regolata da diversi fattori: Sete: stimolata dal fattore osmotico e dall attivazione del sistema renina-angiotensina-aldosterone. Questo stimolo diminuisce d intensità con l età ed è per questo che gli anziani sono più soggetti a disidratazione. ADH: oltre al fattore osmotico il release di ADH (vasopressina) è stimolato da dolore, stress emozionali e da una marcata contrazione del VEC. Concentrazione delle urine: riassorbimento di acqua - corretto funzionamento del sistema ADH, mantenimento dell ipertonia midollare, capacità del tubulo collettore di rispondere all ADH. Diluizione delle urine: eliminazione di acqua - soppressione del sistema ADH, apporto adeguato di NaCl al braccio ascendente dell ansa di Henle, conservata capacità del riassorbimento di NaCl senza acqua. Iposodiemia Sodiemia < 135 meq/l. Cause: Abnorme introito d acqua: Iatrogena: interventi chirurgici, cateterismo e/o drenaggi; l infusione di acqua senza sale può determinare IRA, soprattutto in pazienti con IRC, perché hanno maggiori difficoltà ad eliminare l acqua, avendo poco sale. L infusione nel post-operatorio deve prevedere anche soluzioni di NaCl e NaHCO 3. Polidipsia psicogena. 20 Difettosa diluizione urinaria Grave deplezione salina. Sindromi edemigene: legate a sindrome nefrosica, insufficienza cardiaca congestizia, cirrosi epatica; si ha secrezione di ADH inappropriata, rispetto ai valori di ridotta osmolarità sierica, a causa dell ipovolemia (presumibilmente l ipovolemia determina secrezione abnorme di ADH, con riassorbimento esagerato di acqua, quando, invece, l acqua c è, ma è presente nel terzo spazio). Diuretici: possono determinare marcata deplezione salina con conseguente stimolo alla secrezione di ADH, o possono determinare aumento della tonicità (riduzione della diluizione) della preurina per inibizione del riassorbimento di NaCl nel segmento ascendente dell ansa di Henle segmento diluente -. Sindrome da inappropriata secrezione di ADH: si ha in corso di neoplasie, come nel microcitoma polmonare; si ha secrezione abnorme di ADH o sostanze ADH-simili. Si ha ritenzione renale, con urine ipertoniche rispetto al plasma; si ha, inolre, diminuzione della concentrazione sierica di urea e di acido urico. Iposodiemia da cause endocrine: insufficienza surrenalica ed ipotiroidismo. Altri tipi di iposodiemia: Iposodiemia associata ad iperosmolarità sierica: è una patologia associata ad aumento del numero di molecole osmolaricamente attive nel plasma, come il glucosio nel diabete mellito scompensato; si ha iposodiemia da diluizione. In questo caso è necessario calcolare l iposodiemia corretta, che tiene conto della diminuzione fisiologica della sodiemia di circa 1,5 meq/l per ogni aumento della glicemia di 100 mg/dl. Iposodiemia essenziale. Pseudo-iposodiemia: per aumento del contenuto lipidico o proteico del plasma, che determina diminuzione relativa della sodiemia del campione in esame. 20 Il riscontro di un paziente con poliuria a basso P.M. ( ) e polidipsia pone il problema di D.D. tra polidipsia psicogena e diabete insipito. Qui è utile il controllo della sodiemia ogni ora: iposodiemia fa tendere alla polidipsia psicogena, mentre il riscontro di ipersodiemia depone per il diabete insipido. alexys3 S.U.N. Napoli Pagina 16 di 22
17 Sintomatologia Il pz è sintomatico solo se sodiemia < 125 meq/l; è tipico negli anziani. Si ipereccitabilità muscolare, irritabilità e convulsioni, vomito, letargia, confusione mentale, stupore e perfino coma. La comparsa di una iposodiemia acuta marcata è molto pericolosa, perché l encefalo subisce modifiche. Si ha edema e compressione nella scatola cranica. Terapia Restizione di acqua nel pz asintomatico. Infuzione e.v. di NaCl 0,9% nel pz acuto sintomatico. In condizioni gravi si somministrano soluzioni NaCl ipertoniche (NaCl 3%). Evitare correzione rapida per effetti letali da brusca disidratazione mesoencefalica; bisogna limitare gli incrementi al massimo a 0,5 meq/l/h (pari a 12 meq/l/die). Ipersodiemia Sodiemia > 145 meq/l. Indica, in genere, un deficit del contenuto corporeo di acqua ed in questi casi si ha sete. L ipersodiemia è tipica nei pazienti impossibilitati ad ingerire liquidi, come i pazienti in coma o chi presenta un impedimento alla deglutizione. N.B. Il riscontro di un paziente con poliuria a basso P.M. ( ) e polidipsia pone il problema di D.D. tra polidipsia psicogena e diabete insipito. Qui è utile il controllo della sodiemia ogni ora: iposodiemia fa tendere alla polidipsia psicogena, mentre il riscontro di ipersodiemia depone per il diabete insipido. Cause: Da perdita renale di acqua: Diabete insipido: malattia rara caratterizzata da poliuria a basso peso molecolare e da conseguente polidipsia. La forma centrale è caratterizzata da carenza di ADH (flogosi, tumori etc.). La forma nefrogena è caratterizzata dalla presenza di ADH, e da impossibilità del rene a rispondere ad esso. Questa patologia prevede due varianti: la forma ereditaria è caratterizzata dall insensibilità tubulare all ADH, mentre la forma acquisita è secondaria ad altre patologie (nefriti tubulo-interstiziali, abuso terapeutico con sali di litio in pz maniaco-depressivi, ipopotassemia ed ipercalcemia). Per fare diagnosi tra diabete insipido centrale e nefrogeno si somministrano analoghi dell ADH e controllare l osmolarità urinaria: aumenta solo nel diabete insipido centrale. Alterazione della coscienza. Da perdita di acqua prevalente sulla perdita di sodio: Sudorazioni profuse in caso di episodi febbrili: è tipica l ipersodiemia del paziente con febbre, perché il sudore è un liquido a ipotonico rispetto al plasma; perdite eccessive di sudore determinano ipertonicità plasmatica e, quindi, ipersodiemia. Da cause endocrine: Iperaldosteronismo primitivo. S. di Cushing. Altro: Ipersodiemia essenziale. Diuresi osmotica: mannitolo, levulosio etc. Sintomatologia Le manifestazioni cliniche dell ipersodiemia sono, in genere, poco specifiche e indistinguibili da quelle da iposodiemia. Sono presenti quando la sodiemia > meq/l: confusione mentale, irritabilità neuromuscolare, convulsioni e, nei casi gravi, coma e morte. Nei casi gravi senza morte del pz, si possono avere alterazioni neurologiche irreversibili, dovute a danni vascolari. Terapia I principali provvedimenti sono rappresentati dalla rimozione della causa e dall immediata infusione e.v. di soluzione glucosata 5%. Conviene correggere il deficit di acqua nel giro di due-tre giorni. Qualora sia presente anche ipovolemia e iposodiemia, è indicato infondere anche NaCl 0,9% (o 0,45%), con somministrazione di analoghi dell ADH (8-D-arginin-vasopressina endonasale). Nei pazienti con diabete insipido nefrogeno: dieta iposodica e diuretici tiazidici, perché la riduzione del VEC determina sovrariassorbimento tubulare d acqua e soluti con contrazione della diuresi. alexys3 S.U.N. Napoli Pagina 17 di 22
18 Sodiuria La sodiuria è un indicatore diretto della quantità di sodio introdotto con la dieta. 1 g NaCl corrisponde a 17 meq Na +. Se la sodiuria è 136 meq/24 h NaCl introdotto con la dieta: 8g. Introito dietetico di sodio 1 3 Dieta asodica Dieta moderatamente iposodica 5 6 Dieta normosodica Dieta ipersodica > 12 Le condizioni cliniche in cui è necessario misurare la sodiuria sono: Ipertensione arteriosa. Edema sistemico. Deplezione del VEC. IRA-IRC In tutti questi casi è utile moderare l introito di sodio. IL VEC È ESPRESSIONE DELLA SODIEMIA Il sodio rappresenta il 90-95% dei soluti di tutto il volume extra-cellulare e, data la sua alta attività osmolica, lo regola. Espansioni o contrazioni del VEC, pertanto, sono regolate dall aumento o dalla diminuzione della sodiemia. Deplezione del VEC Contrazione del VEC, risultato di un insufficiente introito di sodio rispetto alle perdite. Le cause possono essere: Renali: Diuresi osmotica. Malattia di Addison. Diuretici. Insufficienza renale da nefropatie tubulo-interstiziali: ridotta capacità di riassorbire il sodio. Spesso queste condizioni possono aggravarsi e determinare una contrazione così eccessiva del VEC da determinare caduta del FG; è tipico il caso della pielonefrite cronica. Extrarenali: Gastrointestinali (vomito e diarrea). Cutanee (sudorazione e ustioni). Sequestro di liquidi nel terzo spazio. Crush syndrome: sindrome da compressione; è tipica nelle compressioni muscolari, per sequestro di rilevanti quantità di liquido nei muscoli traumatizzati anche ad ore dal trauma. Iatrogene: edema da riperfusione, come, ad esempio, dopo toracentesi. Manifestazioni Le mainifestazioni sono aspecifiche: astenia, shock, aumento della sensazione di sete, ipotensione arteriosa ortostatica e tachicardia 21, collabimento delle vene del collo e diminuzione della pressione venosa centrale, perdita di peso ed oligo-anuria. Diagnosi Storia clinica: perdite gastro-intestinali, sudorazioi profuse, sequestro di liquid nel terzo spazio, decorso post-operatorio. Segni clinici: diminuzione della PA in ortostatismo, PA normale in iperteso, diminuzione del turgore delle giugulari, aumento della sete e diminuzione della diuresi e del peso. 21 Nel paziente iperteso si ha, eventualmente, normotensione. alexys3 S.U.N. Napoli Pagina 18 di 22
19 Laboratorio: aumento della creatininemia, diminuzione dell escrezione urinaria di sodio, che, in questo caso, non è indicatore del contenuto totale di sodio. Percorso diagnostico Ipovolemia sospetta Diminuzione P.A. in ortostatismo SI NO Assenza di ipovolemia Aumento Htc o protidemia? SI NO Perdita di sangue o plasma Sodiuria <20 meq/l SI NO Perdita renale Perdita extrarenale Trattamento Il trattamento è finalizzato al ripristino del VEC. Le deplezioni di lieve entità possono essere trattate per via orale (15-30 g NaCl e 2-4 litri di acqua; 1g di NaCl = 17 meq sodio). Le deplezioni gravi vanno corrette immediatamente con terapia infusiva (soluzioni di NaCl e/o NaHCO 3 ). N.B. In condizioni di marcata diminuzione della volemia efficace, come nella cirrosi e nell insufficienza cardiaca avanzata, la sodiemia è indice di prognosi sfavorevole. Terapia etiologica nella deplezione del VEC Soluzione fisiologica NaCl: vomito, diarrea, sudorazione e drenaggi GI. Infuzioni di sangue: emorragia. Albumina umana: ustioni, cirrosi, cachessia. NaHCO 3 : diarrea ed acidosi. Glucosata, aminoacidi e lipidi: ipercatabolismo. POTASSIEMIA Il potassio è il catione intracellulare più abbondante nell organismo: circa 125 meq/l in totale nelle cellule. La concentrazione media plasmatica è circa 4 meq/l. Importanza del K + nei meccanismi elettrici In tutte le cellule il potassio è tenuto nella cellula grazie alla pompa sodio-potassio, che lo spinge contro gradiente nel citoplasma. Quando si ha una depolarizzazione, dopo le correnti di sodio che entrano nella cellula, si hanno correnti di potassio rettificanti: il potassio entra nella cellula in modo da riportare il potenziale a riposo ripolarizzazione. Iperpotassiemia: aumento del potassio all esterno della cellula; il potassio non si trova più a dover uscire seguendo il gradiente elettrico, tendendo a restare nelle cellule. Si ha, così, depolarizzazione ed aumento dell eccitabilità cellulare. Ipopotassiemia: diminuzione del potassio all esterno della cellula; il potassio cerca di uscire dalla cellula seguendo un gradiente elettrico maggiore. Il suo allontanamento determina iperpolarizzazione (perché il lato citoplasmatico di una cellula è caricato negativamente), riducendo l eccitabilità. In particolare nel miocardio Le cellule del miocardio specifico scaricano spontaneamente; esse hanno un potenziale di membrana che, dopo ogni scarica, diminuisce per poi ritornare a livello di scarica; è definito pre-potenziale o potenziale avviatore. A riposo le miocellule hanno un potenziale di circa -90 mv. Il meccanismo di depolarizzazione spontanea è garantito dalla presenza di particolari canali per il Calcio ed il Potassio sulla membrana delle cellule del miocardio specifico. Al primo impulso elettrico, canali I K+ Bpermettono la ripolarizzazione il K + esce - della membrana fino a circa 60 mv, voltaggio in cui il canale I K+ si chiude; a questo punto si apre il canale I Ca2+ T (T = transitori; beta-adrenergici) il Ca 2+ entra -, che portano il potenziale di membrana alexys3 S.U.N. Napoli Pagina 19 di 22
20 fino a poco meno di 40 mv; a questo punto entrano in azione i canali I Ca2+ L (L = di lunga durata) che determinano la depolarizzazione con lo spike e ricomincia il ciclo. Le cellule del miocardio specifico sono caratterizzate dall assenza di canali per il Na + ; la depolarizzazione, quindi, avviene prima. Condizioni di iperpotassiemia sono le cause più frequenti di aritmia perché non si ottiene una sufficiente ripolarizzazione del miocardio specifico. I canali al K + del miocardio specifico determina efflusso di ione potassio dalle cellule dopo il potenziale avviatore, in modo da ripolarizzare le cellule; se questa corrente è ostacolata per eccesso di ione potassio fuori le cellule, non si ha una ripolarizzazione efficace, con alto rischio di aritmie. La stimolazione vagale aumenta la conduttanza per i canali I K+, perché l acetilcolina stimola una maggiore ripolarizzazione (diminuisce la pendenza del prepotenziale); condizioni di iperpotassiemia sono le cause più frequenti di aritmia perché non si ottiene una sufficiente ripolarizzazione del miocardio specifico. Al contrario, invece, la stimolazione simpatica aumenta la conduttanza per i canali I Ca2 T (sono, infatti beta-adrenergici, obiettivi dei farmaci beta-bloccanti) determinando una più veloce depolarizzazione (aumenta la pendenza del prepotenziale). È da ricordare, però, che il cuore ha il meccanismo di Fuga dal Vago, per restare funzionante, e per non bloccarsi in eccesso di stimolazione vagale. Iperpotassemia Potassiemia > 5 meq/l. Cause: Aumento introito. Diminuita escrezione urinaria di potassio: IRA oligo-anurica. IRC: è rara, per l instaurarsi di meccanismi di compenso. I pazienti uremici, tuttavia, sono maggiormente suscettibili. L iperpotassiemia è maggiormente frequente nei pazienti con IRC trattati con ACE-inibitori per inibizione del sistema renina-angiotensina, ma anche con diuretici del tubulo distale e del collettore. Ridotta attività mineralcorticoide: ipoaldosteronismo, Addison, beta-bloccanti, anti-infiammatori non steroidei, ACE-I, eparina. Alterazione della funzione del tubulo collettore corticale: spironolattone, canrenone, amiloride, triamtirene. Da alterata distribuzione del potassio: Acidosi. Danno tissutale: crush syndrome, ustioni, lisi tumorale, emorragia interna, emolisi. Farmaci: ACE-I, beta-bloccanti, intossicazione da digitale; questi farmaci possono interferire con la distribuzione del potassio. In particolare la digitale, per il blocco della pompa sodio-potassio, può determinare iperpotassiemia grave. Iperosmolarità acuta: mannitolo. alexys3 S.U.N. Napoli Pagina 20 di 22
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE
 FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
Alterazioni equilibrio acidobase
 Alterazioni equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Acidosi: rapporto HCO 3 /CO 2 ph. Se diminuzione dipende da: HCO 3 acidosi metabolica (nonrespiratoria)
Alterazioni equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Acidosi: rapporto HCO 3 /CO 2 ph. Se diminuzione dipende da: HCO 3 acidosi metabolica (nonrespiratoria)
Acqua: nutriente essenziale
 Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Fisiologia Renale 5. Equilibrio acido-base: Fisiologia e fisiopatologia
 Fisiologia Renale 5. Equilibrio acidobase: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Produzione e bilancio
Fisiologia Renale 5. Equilibrio acidobase: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Produzione e bilancio
Chetoacidosi diabetica (DKA)
 Università degli studi di Parma Facoltà di Medicina e Chirurgia Dipartimento dell Età evolutiva Prof. M. Vanelli Chetoacidosi diabetica (DKA) 1 È responsabile della maggior parte dei ricoveri nonché della
Università degli studi di Parma Facoltà di Medicina e Chirurgia Dipartimento dell Età evolutiva Prof. M. Vanelli Chetoacidosi diabetica (DKA) 1 È responsabile della maggior parte dei ricoveri nonché della
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Bilancio idro-elettrolitico Composizione dei liquidi corporei
 Bilancio idro-elettrolitico Composizione dei liquidi corporei L'acqua presente nei compartimenti corporei è ricca di sali o elettroliti un elettrolitita disciolto in acqua si separa in ioni si dividono
Bilancio idro-elettrolitico Composizione dei liquidi corporei L'acqua presente nei compartimenti corporei è ricca di sali o elettroliti un elettrolitita disciolto in acqua si separa in ioni si dividono
Fisiologia Renale 7. Bilancio idro-elettrolitico II. Carlo Capelli, Fisiologia Corso di Laurea in Scienze Motorie Università Verona
 Fisiologia Renale 7. Bilancio idro-elettrolitico II Carlo Capelli, Fisiologia Corso di Laurea in Scienze Motorie Università Verona Obiettivi Bilancio dell acqua Variazione del ACT e osmolalità Osmocettori
Fisiologia Renale 7. Bilancio idro-elettrolitico II Carlo Capelli, Fisiologia Corso di Laurea in Scienze Motorie Università Verona Obiettivi Bilancio dell acqua Variazione del ACT e osmolalità Osmocettori
Bilancio Sodio e Potassio
 Bilancio Sodio e Potassio Sodio E l elemento fondamentale per: Controllo osmolalità Mantenimento volume del LEC Mantenimento Pressione arteriosa L introduzione giornaliera di sodio con la dieta (200 meq/l)
Bilancio Sodio e Potassio Sodio E l elemento fondamentale per: Controllo osmolalità Mantenimento volume del LEC Mantenimento Pressione arteriosa L introduzione giornaliera di sodio con la dieta (200 meq/l)
OMEOSTASI DELLA TEMPERATURA CORPOREA
 OMEOSTASI DELLA TEMPERATURA CORPOREA Ruolo fisiologico del calcio Omeostasi del calcio ASSORBIMENTO INTESTINALE DEL CALCIO OMEOSTASI GLICEMICA Il livello normale di glicemia? 90 mg/100 ml Pancreas
OMEOSTASI DELLA TEMPERATURA CORPOREA Ruolo fisiologico del calcio Omeostasi del calcio ASSORBIMENTO INTESTINALE DEL CALCIO OMEOSTASI GLICEMICA Il livello normale di glicemia? 90 mg/100 ml Pancreas
LA CHETOACIDOSI DIABETICA DR LUIGI DI RUZZA U.O.C. PEDIATRIA P.O. FROSINONE
 LA CHETOACIDOSI DIABETICA DR LUIGI DI RUZZA U.O.C. PEDIATRIA P.O. FROSINONE La Chetoacidosi Diabetica Definizione La chetoacidosi diabetica è causata da una carenza assoluta o relativa di insulina con
LA CHETOACIDOSI DIABETICA DR LUIGI DI RUZZA U.O.C. PEDIATRIA P.O. FROSINONE La Chetoacidosi Diabetica Definizione La chetoacidosi diabetica è causata da una carenza assoluta o relativa di insulina con
CLASSIFICAZIONE del DIABETE
 Il DIABETE Malattia cronica Elevati livelli di glucosio nel sangue(iperglicemia) Alterata quantità o funzione dell insulina, che si accumula nel circolo sanguigno TASSI di GLICEMIA Fino a 110 mg/dl normalità
Il DIABETE Malattia cronica Elevati livelli di glucosio nel sangue(iperglicemia) Alterata quantità o funzione dell insulina, che si accumula nel circolo sanguigno TASSI di GLICEMIA Fino a 110 mg/dl normalità
ph = log 1/[H+] = - log [H+]
![ph = log 1/[H+] = - log [H+] ph = log 1/[H+] = - log [H+]](/thumbs/34/16948015.jpg) ph = log 1/[H+] = log [H+] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = inizio 7,36 max 6.8) ph superiori = alcalosi (limite ph inizio 7,44 max 7.8) ph intracellulare
ph = log 1/[H+] = log [H+] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = inizio 7,36 max 6.8) ph superiori = alcalosi (limite ph inizio 7,44 max 7.8) ph intracellulare
CROCE ROSSA ITALIANA COMITATO LOCALE AREA SUD MILANESE
 Opera MALORI IMPROVVISI PERDITE DI SENSI MALORI DOVUTI A DISTURBI DEL S.N. MALORI PER CAUSE AMBIENTALI 1. Perdite di coscienza transitorie Lipotimia (debolezza con o senza perdita coscienza) Sincope (improvvisa
Opera MALORI IMPROVVISI PERDITE DI SENSI MALORI DOVUTI A DISTURBI DEL S.N. MALORI PER CAUSE AMBIENTALI 1. Perdite di coscienza transitorie Lipotimia (debolezza con o senza perdita coscienza) Sincope (improvvisa
La pressione osmotica del plasma è 28mmHg
 PRESSIONE OSMOTICA capacità di una soluzione più concentrata di richiamare acqua attraverso una membrana semipermeabile (cioè permeabile solo all H 2 O). La pressione osmotica del plasma è 28mmHg 1 SPAZI
PRESSIONE OSMOTICA capacità di una soluzione più concentrata di richiamare acqua attraverso una membrana semipermeabile (cioè permeabile solo all H 2 O). La pressione osmotica del plasma è 28mmHg 1 SPAZI
DIABETE MELLITO. Organi danneggiati in corso di diabete mellito INSULINA
 DIABETE MELLITO Il diabete mellito è la più comune malattia endocrina: 1-2% della popolazione E caratterizzato da : -alterazione del metabolismo del glucosio -danni a diversi organi Complicanze acute:
DIABETE MELLITO Il diabete mellito è la più comune malattia endocrina: 1-2% della popolazione E caratterizzato da : -alterazione del metabolismo del glucosio -danni a diversi organi Complicanze acute:
INSUFFICIENZA RENALE ACUTA
 - alterazione funzione renale con quadro clinico molto vario da muto a gravissimo - patogenesi varia, distinta in tre forme: 1. pre-renale (funzionale) 2. renale (organica) 3. post-renale (ostruttiva)
- alterazione funzione renale con quadro clinico molto vario da muto a gravissimo - patogenesi varia, distinta in tre forme: 1. pre-renale (funzionale) 2. renale (organica) 3. post-renale (ostruttiva)
EMOGASANALISI ARTERIOSA
 EMOGASANALISI ARTERIOSA Prelievo arterioso Il prelievo arterioso può essere eseguito nelle arterie RADIALE, BRACHIALE o FEMORALE. Attualmente viene eseguito più frequentemente il prelievo dall arteria
EMOGASANALISI ARTERIOSA Prelievo arterioso Il prelievo arterioso può essere eseguito nelle arterie RADIALE, BRACHIALE o FEMORALE. Attualmente viene eseguito più frequentemente il prelievo dall arteria
Volume liquidi corporei. Rene
 A breve termine Riflesso barocettivo A lungo termine Controllo volume ematico Quota introduzione liquidi RPT GC Pa Volume liquidi corporei Rene Diuresi Un modo per regolare la Pa è quello di aggiungere
A breve termine Riflesso barocettivo A lungo termine Controllo volume ematico Quota introduzione liquidi RPT GC Pa Volume liquidi corporei Rene Diuresi Un modo per regolare la Pa è quello di aggiungere
Il sale è un elemento fondamentale per l alimentazione umana ed è costituito da cloruro di sodio (NaCl). Una sua eccessiva introduzione però può
 Sale e salute Il sale è un elemento fondamentale per l alimentazione umana ed è costituito da cloruro di sodio (NaCl). Una sua eccessiva introduzione però può causare gravi problemi alla salute. La quantità
Sale e salute Il sale è un elemento fondamentale per l alimentazione umana ed è costituito da cloruro di sodio (NaCl). Una sua eccessiva introduzione però può causare gravi problemi alla salute. La quantità
FISIOLOGIA CdL in Medicina e Chirurgia. Regolazione del ph. Dott.ssa Michela Anna Pia Ciliberti
 FISIOLOGIA CdL in Medicina e Chirurgia Regolazione del ph Dott.ssa Michela Anna Pia Ciliberti FUNZIONI OMEOSTATICHE INTEGRATE regolazione della temperatura corporea; controllo del ph dell organismo; regolazione
FISIOLOGIA CdL in Medicina e Chirurgia Regolazione del ph Dott.ssa Michela Anna Pia Ciliberti FUNZIONI OMEOSTATICHE INTEGRATE regolazione della temperatura corporea; controllo del ph dell organismo; regolazione
Diabete. Malattia metabolica cronica dipendente da una insufficiente produzione di insulina. Ridotta disponibilità alterazione della normale azione
 Diabete Malattia metabolica cronica dipendente da una insufficiente produzione di insulina Ridotta disponibilità alterazione della normale azione Epidemiologia Popolazione mondiale affetta intorno al 5%
Diabete Malattia metabolica cronica dipendente da una insufficiente produzione di insulina Ridotta disponibilità alterazione della normale azione Epidemiologia Popolazione mondiale affetta intorno al 5%
ENDOCRINOLOGIA E NUTRIZIONE UMANA LEZIONE 6 GHIANDOLE SURRENALI ZONE
 ENDOCRINOLOGIA E NUTRIZIONE UMANA LEZIONE 6 GHIANDOLE SURRENALI ZONE Struttura La porzione più esterna della corticale, la zona glomerulare, è costituita da piccole cellule mentre la porzione centrale,
ENDOCRINOLOGIA E NUTRIZIONE UMANA LEZIONE 6 GHIANDOLE SURRENALI ZONE Struttura La porzione più esterna della corticale, la zona glomerulare, è costituita da piccole cellule mentre la porzione centrale,
LEZIONE 12. Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA. Scaricato da Sunhope.it
 LEZIONE 12 Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA Idrolisi salina Per IDROLISI SALINA si intende il fenomeno per il quale la dissoluzione in acqua di
LEZIONE 12 Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA Idrolisi salina Per IDROLISI SALINA si intende il fenomeno per il quale la dissoluzione in acqua di
Insufficienza Renale Cronica
 Insufficienza Renale Cronica Le nefropatie croniche si classificano in: - Nefropatia con filtrazione glomerulare (FG) normale [ > 90 ml/min/1,73 m²]; - Nefropatia con diminuzione lieve del FG [89-60 ML
Insufficienza Renale Cronica Le nefropatie croniche si classificano in: - Nefropatia con filtrazione glomerulare (FG) normale [ > 90 ml/min/1,73 m²]; - Nefropatia con diminuzione lieve del FG [89-60 ML
STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE
 STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE Dott. ssa Annalisa Caravaggi Biologo Nutrizionista sabato 15 febbraio 14 STRESS: Forma di adattamento dell organismo a stimoli chiamati STRESSOR.
STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE Dott. ssa Annalisa Caravaggi Biologo Nutrizionista sabato 15 febbraio 14 STRESS: Forma di adattamento dell organismo a stimoli chiamati STRESSOR.
DISTURBI METABOLICI. Modulo 1 Lezione C Croce Rossa Italiana Emilia Romagna
 DISTURBI METABOLICI Modulo 1 Lezione C Croce Rossa Italiana Emilia Romagna IL PANCREAS Funzione esocrina: supporto alla digestione Funzione endocrina: produzione di due ormoni: insulina e glucagone I due
DISTURBI METABOLICI Modulo 1 Lezione C Croce Rossa Italiana Emilia Romagna IL PANCREAS Funzione esocrina: supporto alla digestione Funzione endocrina: produzione di due ormoni: insulina e glucagone I due
Ipoadrenocorticismo (Malattia di Addison)
 Ipoadrenocorticismo (Malattia di Addison) L ipoadrenocorticismo è una malattia endocrina causata dalla ridotta produzione di mineralcorticoidi (aldosterone) e glucocorticoidi (cortisolo) da parte delle
Ipoadrenocorticismo (Malattia di Addison) L ipoadrenocorticismo è una malattia endocrina causata dalla ridotta produzione di mineralcorticoidi (aldosterone) e glucocorticoidi (cortisolo) da parte delle
IL POTASSIO IN DIALISI AZIENDA OSPEDALIERA SAN PAOLO POLO UNIVERSITARIO UNIVERSITÀ DEGLI STUDI DI MILANO UNITÀ OPERATIVA DI NEFROLOGIA E DIALISI
 IL POTASSIO IN DIALISI Dott. Francesco Cosa AZIENDA OSPEDALIERA SAN PAOLO POLO UNIVERSITARIO UNIVERSITÀ DEGLI STUDI DI MILANO UNITÀ OPERATIVA DI NEFROLOGIA E DIALISI RESPONSABILE PROF. DANIELE CUSI METABOLISMO
IL POTASSIO IN DIALISI Dott. Francesco Cosa AZIENDA OSPEDALIERA SAN PAOLO POLO UNIVERSITARIO UNIVERSITÀ DEGLI STUDI DI MILANO UNITÀ OPERATIVA DI NEFROLOGIA E DIALISI RESPONSABILE PROF. DANIELE CUSI METABOLISMO
Quota introduzione liquidi. Volume liquidi corporei. Rene
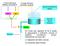 A breve termine Riflesso barocettivo A lungo termine Controllo volemia Quota introduzione liquidi RPT GC Pa Volume liquidi corporei Rene Diuresi Un modo per regolare la Pa è quello di aggiungere o sottrarre
A breve termine Riflesso barocettivo A lungo termine Controllo volemia Quota introduzione liquidi RPT GC Pa Volume liquidi corporei Rene Diuresi Un modo per regolare la Pa è quello di aggiungere o sottrarre
[H + ] X [A - ] [ HA ]
![[H + ] X [A - ] [ HA ] [H + ] X [A - ] [ HA ]](/thumbs/81/84332766.jpg) Equazione di Handerson-HasselbalchHasselbalch [H + ] X [A - ] [ HA ] = K [H + ]X[HCO3 - ] [H2C03] = K 1 Composizione aria O 2 = 20.93% CO 2 = 0.03% N 2 + gas nobili = 79.04% Pressione esercitata dai gas
Equazione di Handerson-HasselbalchHasselbalch [H + ] X [A - ] [ HA ] = K [H + ]X[HCO3 - ] [H2C03] = K 1 Composizione aria O 2 = 20.93% CO 2 = 0.03% N 2 + gas nobili = 79.04% Pressione esercitata dai gas
SOMMINISTRAZIONE DI TERAPIA ENDOVENOSA
 SOMMINISTRAZIONE DI TERAPIA ENDOVENOSA A cura di: Dott.ssa R. Fiorentini Dott.ssa E. Palma QUANTITA E COMPOSIZIONE DEI LIQUIDI CORPOREI IL 60% del peso corporeo di un adulto è costituito da liquidi. I
SOMMINISTRAZIONE DI TERAPIA ENDOVENOSA A cura di: Dott.ssa R. Fiorentini Dott.ssa E. Palma QUANTITA E COMPOSIZIONE DEI LIQUIDI CORPOREI IL 60% del peso corporeo di un adulto è costituito da liquidi. I
Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica
 Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Definizione
Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Definizione
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Patologie Cardiocircolatorie Relatore:Squicciarini Grazia
 Corso Base Patologie Cardiocircolatorie Relatore:Squicciarini Grazia Cardiopatia ischemica Definisce un quadro di malattie a diversa eziologia che interessano l integrita del cuore nelle quali il fattore
Corso Base Patologie Cardiocircolatorie Relatore:Squicciarini Grazia Cardiopatia ischemica Definisce un quadro di malattie a diversa eziologia che interessano l integrita del cuore nelle quali il fattore
Diabete Mellito 'insulina pancreas un aumento dell appetito accompagnato da una perdita di peso corporeo aumentare la diuresi della sete
 Diabete Mellito Il Diabete mellito è una comune malattia endocrina causata da una carenza relativa o assoluta di insulina. L'insulina è un ormone prodotto da particolari cellule del pancreas (cellule beta)
Diabete Mellito Il Diabete mellito è una comune malattia endocrina causata da una carenza relativa o assoluta di insulina. L'insulina è un ormone prodotto da particolari cellule del pancreas (cellule beta)
Luigi Aronne Disordini dell equilibrio acido-base
 Luigi Aronne Disordini dell equilibrio acido-base Per acidosi s intende una condizione che determinerebbe acidemia (ph < 7,36) se non fosse compensata Per alcalosi s intende una condizione che determinerebbe
Luigi Aronne Disordini dell equilibrio acido-base Per acidosi s intende una condizione che determinerebbe acidemia (ph < 7,36) se non fosse compensata Per alcalosi s intende una condizione che determinerebbe
GLI EFFETTI DELL ESERCIZIO IN ACQUA. Le risposte fisiologiche dell immersione
 GLI EFFETTI DELL ESERCIZIO IN ACQUA Le risposte fisiologiche dell immersione L acqua È importante che chi si occupa dell attività in acqua sappia che cosa essa provoca nell organismo EFFETTI DELL IMMERSIONE
GLI EFFETTI DELL ESERCIZIO IN ACQUA Le risposte fisiologiche dell immersione L acqua È importante che chi si occupa dell attività in acqua sappia che cosa essa provoca nell organismo EFFETTI DELL IMMERSIONE
Potenziale di membrana: Differenza di potenziale elettrico a cavallo della membrana cellulare dovuta ad una diversa distribuzione ionica ai due lati
 Potenziale di membrana: Differenza di potenziale elettrico a cavallo della membrana cellulare dovuta ad una diversa distribuzione ionica ai due lati della membrana. Il potenziale di membrana (negativo
Potenziale di membrana: Differenza di potenziale elettrico a cavallo della membrana cellulare dovuta ad una diversa distribuzione ionica ai due lati della membrana. Il potenziale di membrana (negativo
Come interpretare le alterazioni più frequenti di laboratorio Gli squilibri elettrolitici. Loredana Mele UO PS e Medicina D Urgenza
 Come interpretare le alterazioni più frequenti di laboratorio UO PS e Medicina D Urgenza Distribuzione dell acqua Acqua corporea totale è il 60% del peso secco negli uomini e il 50% nelle donne LEC 60%
Come interpretare le alterazioni più frequenti di laboratorio UO PS e Medicina D Urgenza Distribuzione dell acqua Acqua corporea totale è il 60% del peso secco negli uomini e il 50% nelle donne LEC 60%
Rene e bilancio idrico-salino
 Rene e bilancio idrico-salino Alterazioni del bilancio idrico sono in genere conseguenza di squilibri nell introduzione ed escrezione di acqua ed elettroliti. Disfunzione Causa Alterazione Disidratazione
Rene e bilancio idrico-salino Alterazioni del bilancio idrico sono in genere conseguenza di squilibri nell introduzione ed escrezione di acqua ed elettroliti. Disfunzione Causa Alterazione Disidratazione
PERCHE DIABETE MELLITO?
 PERCHE DIABETE MELLITO? La definizione di Diabete Mellito la si deve al medico inglese Willis, che nella seconda metà del XVIII secolo, scoprì, assaggiando l urina dei diabetici, che essa era dolce come
PERCHE DIABETE MELLITO? La definizione di Diabete Mellito la si deve al medico inglese Willis, che nella seconda metà del XVIII secolo, scoprì, assaggiando l urina dei diabetici, che essa era dolce come
Capitolo 7. Le soluzioni
 Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
13.4. Gli effetti dell'etanolo comprendono a. aumento del sonno REM b. aumento della secrezione gastrica c. (a e b) d. (nessuna delle precedenti)
 56 13. Alcol etilico - Proprietà farmacologiche, effetti collaterali, usi clinici. - Farmacocinetica. - Intossicazione acuta e cronica e loro trattamento. - Dipendenza e sindrome da astinenza, loro trattamento.
56 13. Alcol etilico - Proprietà farmacologiche, effetti collaterali, usi clinici. - Farmacocinetica. - Intossicazione acuta e cronica e loro trattamento. - Dipendenza e sindrome da astinenza, loro trattamento.
NEFROLITIASI ACUTA. Più raro dolore addominale prevalemtemete anteriore
 NEFROLITIASI ACUTA Dolore costante e non colico, localizzato al fianco eo irradiato all inguine. Micro-macroematuria. Sovente nausea e vomito. Più raro dolore addominale prevalemtemete anteriore NEFROLITIASI
NEFROLITIASI ACUTA Dolore costante e non colico, localizzato al fianco eo irradiato all inguine. Micro-macroematuria. Sovente nausea e vomito. Più raro dolore addominale prevalemtemete anteriore NEFROLITIASI
2. Fisiologia Cellulare Diffusione, Trasporto, Osmosi
 2. Fisiologia Cellulare Diffusione, Trasporto, Osmosi Prof. Carlo Capelli Fisiologia Laurea in Scienze delle attività motorie e sportive Università di Verona Obiettivi Diffusione semplice e mediata da
2. Fisiologia Cellulare Diffusione, Trasporto, Osmosi Prof. Carlo Capelli Fisiologia Laurea in Scienze delle attività motorie e sportive Università di Verona Obiettivi Diffusione semplice e mediata da
Apparato respiratorio: anatomia,fisiologia e patologia. Anatomia (2) Anatomia (1) Anatomia (3) Anatomia (4) O 2 CO 2
 P.A. Lombardia Soccorso Corso di Formazione Base per Volontari-Soccorritori A cosa serve? Apparato respiratorio: anatomia,fisiologia e patologia F. Sangalli APPARATO RESPIRATORIO: Insieme di organi che
P.A. Lombardia Soccorso Corso di Formazione Base per Volontari-Soccorritori A cosa serve? Apparato respiratorio: anatomia,fisiologia e patologia F. Sangalli APPARATO RESPIRATORIO: Insieme di organi che
P aria (livello del mare) = 760 mmhg. Composizione: O 2 : 20.84% N 2 : 78.62% CO 2 : 0.04% po 2 = 159 mmhg. pn 2 = 597mmHg. pco 2 = 0.
 Scambi alveolari Aria atmosferica = miscela di gas (principalmente O 2, N 2, CO 2 ) La velocità di diffusione di un gas (quantità di gas che diffonde nell unità di tempo) è direttamente proporzionale alla
Scambi alveolari Aria atmosferica = miscela di gas (principalmente O 2, N 2, CO 2 ) La velocità di diffusione di un gas (quantità di gas che diffonde nell unità di tempo) è direttamente proporzionale alla
www.fondazionedamico.org
 www.fondazionedamico.org COSA SONO Sono due organi situati nell addome, a forma di fagiolo, grandi poco più di un pugno, collegati alla vescica da un condotto chiamato uretere. L urina prodotta dai due
www.fondazionedamico.org COSA SONO Sono due organi situati nell addome, a forma di fagiolo, grandi poco più di un pugno, collegati alla vescica da un condotto chiamato uretere. L urina prodotta dai due
ACCOMPAGNARE IL PAZIENTE IN EMODIALISI. Dr. Fabrizio Vellani Nefrologo
 ACCOMPAGNARE IL PAZIENTE IN EMODIALISI Dr. Fabrizio Vellani Nefrologo Composizione del corpo umano e distribuzione dei liquidi corporei Per un giovane maschio: SOLIDI 40% Proteine 18 % Grassi 15 % Minerali
ACCOMPAGNARE IL PAZIENTE IN EMODIALISI Dr. Fabrizio Vellani Nefrologo Composizione del corpo umano e distribuzione dei liquidi corporei Per un giovane maschio: SOLIDI 40% Proteine 18 % Grassi 15 % Minerali
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
FIACCHEZZA, STANCHEZZA, MALESSERE MORALE. Carenza di ferro molto diffusa e spesso sottovalutata
 FIACCHEZZA, STANCHEZZA, MALESSERE MORALE Carenza di ferro molto diffusa e spesso sottovalutata Cari pazienti! Vi sentite spesso fiacchi, stanchi, esauriti o giù di morale? Soffrite facilmente il freddo?
FIACCHEZZA, STANCHEZZA, MALESSERE MORALE Carenza di ferro molto diffusa e spesso sottovalutata Cari pazienti! Vi sentite spesso fiacchi, stanchi, esauriti o giù di morale? Soffrite facilmente il freddo?
COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA.2015-16
 COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA.2015-16 OMEOSTASI Fisiologia Umana La fisiologia è la scienza che studia i meccanismi di funzionamento degli organismi viventi. E una scienza integrata che
COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA.2015-16 OMEOSTASI Fisiologia Umana La fisiologia è la scienza che studia i meccanismi di funzionamento degli organismi viventi. E una scienza integrata che
la base del benessere ph Basic AIUTA L EQUILIBRIO ACIDO-BASE
 la base del benessere ph Basic AIUTA L EQUILIBRIO ACIDO-BASE Il ph è l unità di misura dell acidità che va da 0 (acido) a 14 (basico o alcalino). 7 è il valore neutro. Il metodo più facile per avere un
la base del benessere ph Basic AIUTA L EQUILIBRIO ACIDO-BASE Il ph è l unità di misura dell acidità che va da 0 (acido) a 14 (basico o alcalino). 7 è il valore neutro. Il metodo più facile per avere un
PATOLOGIE MEDICHE in EMERGENZA
 PATOLOGIE MEDICHE in EMERGENZA COSA SONO, COME SI RICONOSCONO, COME SI OPERA Patologia Ischemica (Infarto) Cuore (infarto) Cervello (Ictus) Scompenso Cardiaco Difficoltà Respiratorie Shock Che cosa sono,
PATOLOGIE MEDICHE in EMERGENZA COSA SONO, COME SI RICONOSCONO, COME SI OPERA Patologia Ischemica (Infarto) Cuore (infarto) Cervello (Ictus) Scompenso Cardiaco Difficoltà Respiratorie Shock Che cosa sono,
scaricato da www.sunhope.it 1
 INSUFFICIENZA RESPIRATORIA Situazione clinico-laboratoristica laboratoristica complessa, di vario livello ed entità, espressione di una utilizzazione endocellulare dell ossigeno non rispondente alle esigenze
INSUFFICIENZA RESPIRATORIA Situazione clinico-laboratoristica laboratoristica complessa, di vario livello ed entità, espressione di una utilizzazione endocellulare dell ossigeno non rispondente alle esigenze
CENNI DI ELETTROCHIMICA
 CENNI DI ELETTROCHIMICA Gli elettrodi a membrana sono elettrodi che permettono la determinazione rapida e selettiva, per potenziometria diretta, di numerosi cationi ed anioni. Il meccanismo di formazione
CENNI DI ELETTROCHIMICA Gli elettrodi a membrana sono elettrodi che permettono la determinazione rapida e selettiva, per potenziometria diretta, di numerosi cationi ed anioni. Il meccanismo di formazione
Equilibri di precipitazione
 Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
K [H 2 O] 2 = K w = [H 3 O + ][OH ]
![K [H 2 O] 2 = K w = [H 3 O + ][OH ] K [H 2 O] 2 = K w = [H 3 O + ][OH ]](/thumbs/27/10717050.jpg) Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
DISTURBI METABOLICI. Modulo 1 Lezione C Croce Rossa Italiana Emilia Romagna
 DISTURBI METABOLICI Modulo 1 Lezione C Croce Rossa Italiana Emilia Romagna IL PANCREAS Funzione esocrina: supporto alla digestione Funzione endocrina: produzione di due ormoni: insulina e glucagone I due
DISTURBI METABOLICI Modulo 1 Lezione C Croce Rossa Italiana Emilia Romagna IL PANCREAS Funzione esocrina: supporto alla digestione Funzione endocrina: produzione di due ormoni: insulina e glucagone I due
CROCE ROSSA ITALIANA. Croce Rossa Italiana - Comitato Locale di Palmanova
 CROCE ROSSA ITALIANA Croce Rossa Italiana - Comitato Locale di Palmanova 1 SALUTE-MALATTIA Definizione dell OMS: La salute è uno stato di completo benessere fisico, psichico e sociale e non semplicemente
CROCE ROSSA ITALIANA Croce Rossa Italiana - Comitato Locale di Palmanova 1 SALUTE-MALATTIA Definizione dell OMS: La salute è uno stato di completo benessere fisico, psichico e sociale e non semplicemente
Cause di malattia Genetiche:
 omeostasi Cause di malattia Genetiche: relativamente poche e derivano da alterazioni a carico di uno o più geni. Esempio: sindrome di Down (dovuta a trisomia del cromosoma 21); sindrome di Turner (dovuta
omeostasi Cause di malattia Genetiche: relativamente poche e derivano da alterazioni a carico di uno o più geni. Esempio: sindrome di Down (dovuta a trisomia del cromosoma 21); sindrome di Turner (dovuta
EMOGASANALISI ARTERIOSA 20/09/14. La valutazione degli scambi gassosi: EGA, saturimetria, CO 2 transcutanea, CO 2 espirata
 La valutazione degli scambi gassosi: EGA, saturimetria, CO 2 transcutanea, CO 2 espirata FtR Luciana Ptacinsky Is6tuto Palazzolo Fondazione Don Carlo Gnocchi Milano VALUTAZIONE DEGLI SCAMBI GASSOSI È uno
La valutazione degli scambi gassosi: EGA, saturimetria, CO 2 transcutanea, CO 2 espirata FtR Luciana Ptacinsky Is6tuto Palazzolo Fondazione Don Carlo Gnocchi Milano VALUTAZIONE DEGLI SCAMBI GASSOSI È uno
Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O 2 dagli alveoli al sangue e della
 Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O 2 dagli alveoli al sangue e della CO 2 in direzione opposta. L aria che respiriamo è una
Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O 2 dagli alveoli al sangue e della CO 2 in direzione opposta. L aria che respiriamo è una
Caso clinico 2. Pz. di 50 anni, obeso (IMC: 32Kg/mq) Familiarità per diabete mellito. Asintomatico. Glicemia plasmatica di 130 mg/dl.
 Caso clinico 1 Pz di 15 anni, di sesso femminile, lievemente sottopeso (IMC: 18Kg/mq). Manifesta nausea, vomito, dolori addominali, poliuria, polidipsia e dispnea. Nel giro di poche ore, manifesta obnubilamento
Caso clinico 1 Pz di 15 anni, di sesso femminile, lievemente sottopeso (IMC: 18Kg/mq). Manifesta nausea, vomito, dolori addominali, poliuria, polidipsia e dispnea. Nel giro di poche ore, manifesta obnubilamento
Valutazione dell IG di Frollini tradizionali e preparati con farina con l aggiunta del % di Freno SIGI.
 Valutazione dell IG di Frollini tradizionali e preparati con farina con l aggiunta del % di Freno SIGI. Premessa L'indice glicemico (IG) di un alimento, definito come l'area sotto la curva (AUC) della
Valutazione dell IG di Frollini tradizionali e preparati con farina con l aggiunta del % di Freno SIGI. Premessa L'indice glicemico (IG) di un alimento, definito come l'area sotto la curva (AUC) della
Scegli il tuo cammino e mettici il cuore. Perché se lo fai con il cuore sei arrivato ancora prima di partire.
 Scegli il tuo cammino e mettici il cuore. Perché se lo fai con il cuore sei arrivato ancora prima di partire. Il cuore : è un muscolo grande all'incirca come il pugno della propria mano. pesa circa 500
Scegli il tuo cammino e mettici il cuore. Perché se lo fai con il cuore sei arrivato ancora prima di partire. Il cuore : è un muscolo grande all'incirca come il pugno della propria mano. pesa circa 500
GC = F x Gs. Gli aumenti di GC sono possibili grazie ad aumenti della frequenza cardiaca e della gittata sistolica.
 Volume di sangue espulso dal cuore in un minuto. Dipende dalle esigenze metaboliche dell organismo e quindi dal consumo di O 2 Consumo O 2 medio in condizioni basali 250 ml/min GC = 5 l/min Consumo O 2
Volume di sangue espulso dal cuore in un minuto. Dipende dalle esigenze metaboliche dell organismo e quindi dal consumo di O 2 Consumo O 2 medio in condizioni basali 250 ml/min GC = 5 l/min Consumo O 2
SINDROME NEFROSICA. Sindrome clinica caratterizzata da: - Edema (volto, piedi, mani) - Proteinuria (>3 g/die) - Ipoalbuminemia - Ipercolesterolemia
 SINDROME NEFROSICA SINDROME NEFROSICA Sindrome clinica caratterizzata da: - Edema (volto, piedi, mani) - Proteinuria (>3 g/die) - Ipoalbuminemia - Ipercolesterolemia SINDROME NEFROSICA - EPIDEMIOLOGIA
SINDROME NEFROSICA SINDROME NEFROSICA Sindrome clinica caratterizzata da: - Edema (volto, piedi, mani) - Proteinuria (>3 g/die) - Ipoalbuminemia - Ipercolesterolemia SINDROME NEFROSICA - EPIDEMIOLOGIA
CROCE ROSSA ITALIANA COMITATO LOCALE AREA SUD MILANESE
 Opera Lo shock Lo shock è uno stato di sofferenza dell organismo, grave e progressivo, potenzialmente mortale, dovuto a ridotta perfusione ai tessuti, in seguito a caduta della Pressione Arteriosa che
Opera Lo shock Lo shock è uno stato di sofferenza dell organismo, grave e progressivo, potenzialmente mortale, dovuto a ridotta perfusione ai tessuti, in seguito a caduta della Pressione Arteriosa che
SISTEMI ENERGETICI. L ATP privato di uno dei suoi 3 radicali fosforici diventa ADP (adenosindifosfato).
 SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
 forme diabetiche Diabete di tipo I o magro o giovanile (IDDM): carenza primaria di insulina, più frequente nei giovani e nei bambini. Il deficit insulinico consegue (per predisposizione ereditaria o per
forme diabetiche Diabete di tipo I o magro o giovanile (IDDM): carenza primaria di insulina, più frequente nei giovani e nei bambini. Il deficit insulinico consegue (per predisposizione ereditaria o per
DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI
 DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI - si sfrutta una proprietà chimico-fisica o fisica che varia nel corso della titolazione - tale proprietà è in genere proporzionale
DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI - si sfrutta una proprietà chimico-fisica o fisica che varia nel corso della titolazione - tale proprietà è in genere proporzionale
Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido
 Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido extracellulare e dalla loro regolazione. Membrana cellulare Ogni cellula presenta
Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido extracellulare e dalla loro regolazione. Membrana cellulare Ogni cellula presenta
DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto:
 Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
PRIMO SOCCORSO EMERGENZE MEDICHE PATOLOGIA DA CALORE CRAMPI DA CALORE ESAURIMENTO DA CALORE COLPO DI CALORE. deplezione IDRICA.
 PRIMO SOCCORSO EMERGENZE MEDICHE PATOLOGIA DA CALORE CRAMPI DA CALORE ESAURIMENTO DA CALORE deplezione SALINA deplezione IDRICA COLPO DI CALORE CRAMPI DA CALORE Insorgono in seguito ad una giornata di
PRIMO SOCCORSO EMERGENZE MEDICHE PATOLOGIA DA CALORE CRAMPI DA CALORE ESAURIMENTO DA CALORE deplezione SALINA deplezione IDRICA COLPO DI CALORE CRAMPI DA CALORE Insorgono in seguito ad una giornata di
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola.
 Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
Donazione organi e tessuti: attualità e sicurezza. Il ruolo dell infermiere
 Donazione organi e tessuti: attualità e sicurezza Il ruolo dell infermiere L infermiere di terapia intensiva con l anestesista, è responsabile dell assistenza del potenziale donatore, fino alla comunicazione
Donazione organi e tessuti: attualità e sicurezza Il ruolo dell infermiere L infermiere di terapia intensiva con l anestesista, è responsabile dell assistenza del potenziale donatore, fino alla comunicazione
La [H+], il PH e quello che l equazione di Kassirer- Bleich ci può dire nella pratica.
![La [H+], il PH e quello che l equazione di Kassirer- Bleich ci può dire nella pratica. La [H+], il PH e quello che l equazione di Kassirer- Bleich ci può dire nella pratica.](/thumbs/29/13365859.jpg) DISORDINI DELL EQUILIBRIO ACIDO-BASE : loro interpretazione Introduzione L interpretazione dei disordini dell equilibrio acido base (EAB) è stata spesso considerata dagli studenti del corso di laurea in
DISORDINI DELL EQUILIBRIO ACIDO-BASE : loro interpretazione Introduzione L interpretazione dei disordini dell equilibrio acido base (EAB) è stata spesso considerata dagli studenti del corso di laurea in
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3. Idrolisi salina Soluzioni tampone Titolazioni acido-base
 Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
Titolo della relazione: Ruolo dell infermiere professionale nella testistica" (*) Relatore: Babini Elide ( ), UOS Endocrinologia ASL Ravenna
 1 CONVEGNO AME EMILIA-ROMAGNA, 15 MAGGIO 2010 III Sessione: Incidentaloma surrenalico: problemi aperti Titolo della relazione: Ruolo dell infermiere professionale nella testistica" (*) Relatore: (*) limitatamente
1 CONVEGNO AME EMILIA-ROMAGNA, 15 MAGGIO 2010 III Sessione: Incidentaloma surrenalico: problemi aperti Titolo della relazione: Ruolo dell infermiere professionale nella testistica" (*) Relatore: (*) limitatamente
Corso per soccorritori volontari L APPARATO -CENNI DI ANATOMIA E DI FISIOLOGIA. Antonio Murolo CRI Fermignano Istruttore TSSA
 Corso per soccorritori volontari L APPARATO CARDIOCIRCOLATORIO -CENNI DI ANATOMIA E DI FISIOLOGIA Antonio Murolo CRI Fermignano Istruttore TSSA DEFINIZIONE: INSIEME DI ORGANI CHE CONCORRONO ALLA MEDESIMA
Corso per soccorritori volontari L APPARATO CARDIOCIRCOLATORIO -CENNI DI ANATOMIA E DI FISIOLOGIA Antonio Murolo CRI Fermignano Istruttore TSSA DEFINIZIONE: INSIEME DI ORGANI CHE CONCORRONO ALLA MEDESIMA
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
RIASSORBIMENTO PROF. ALESSANDRO MALFATTI. Corso di Fisiologia Speciale Veterinaria
 RIASSORBIMENTO RIASSORBIMENTO TUBULO CONTORTO PROSSIMALE RIASSORBIMENTO OBBLIGATO (indipendente dai sistemi di regolazione) Quantitativamente la gran parte della funzione di riassorbimento avviene a questo
RIASSORBIMENTO RIASSORBIMENTO TUBULO CONTORTO PROSSIMALE RIASSORBIMENTO OBBLIGATO (indipendente dai sistemi di regolazione) Quantitativamente la gran parte della funzione di riassorbimento avviene a questo
IL PAZIENTE IN DIALISI
 IL PAZIENTE IN DIALISI Storti Chiara Francesca Istruttore PSTI DIALISI OBIETTIVI Cenni sull INSUFFICIENZA RENALE Diversi tipi di DIALISI Il PAZIENTE DIALIZZATO: problematiche ed emergenze EMORRAGIE della
IL PAZIENTE IN DIALISI Storti Chiara Francesca Istruttore PSTI DIALISI OBIETTIVI Cenni sull INSUFFICIENZA RENALE Diversi tipi di DIALISI Il PAZIENTE DIALIZZATO: problematiche ed emergenze EMORRAGIE della
APPARATO ENDOCRINO. Principali ghiandole endocrine. Meccanismi di regolazione della secrezione
 APPARATO ENDOCRINO L apparato endocrino regola importanti funzioni dell organismo operando tramite gli ORMONI Gli ormoni sono sostanze di natura chimica diversa che raggiungono tramite il sangue i loro
APPARATO ENDOCRINO L apparato endocrino regola importanti funzioni dell organismo operando tramite gli ORMONI Gli ormoni sono sostanze di natura chimica diversa che raggiungono tramite il sangue i loro
LA PRESSIONE ARTERIOSA
 LA PRESSIONE ARTERIOSA La pressione arteriosa è quella forza con cui il sangue viene spinto attraverso i vasi. Dipende dalla quantità di sangue che il cuore spinge quando pompa e dalle resistenze che il
LA PRESSIONE ARTERIOSA La pressione arteriosa è quella forza con cui il sangue viene spinto attraverso i vasi. Dipende dalla quantità di sangue che il cuore spinge quando pompa e dalle resistenze che il
Università degli Studi di Catania Dipartimento di Metodologie Fisiche e Chimiche per l Ingegneria
 Università degli Studi di Catania Dipartimento di Metodologie Fisiche e Chimiche per l Ingegneria Corso di laurea in Ingegneria Meccanica Corso di Tecnologie di Chimica Applicata LA CORROSIONE Nei terreni
Università degli Studi di Catania Dipartimento di Metodologie Fisiche e Chimiche per l Ingegneria Corso di laurea in Ingegneria Meccanica Corso di Tecnologie di Chimica Applicata LA CORROSIONE Nei terreni
 Argomenti di Patologia Clinica Esami della funzione renale Rene e laboratorio Perché esaminare la funzionalità renale? Per identificare le disfunzioni renali Per diagnosticare le patologie renali Per monitorare
Argomenti di Patologia Clinica Esami della funzione renale Rene e laboratorio Perché esaminare la funzionalità renale? Per identificare le disfunzioni renali Per diagnosticare le patologie renali Per monitorare
COMPLICANZE RESPIRATORIE
 ATELETTASIA: collasso di gruppi di alveoli che continuano ad essere vascolarizzati (ma non sono più ventilati! Quindi c è un alterazione degli scambi O2/CO2) Più l atelettasia dura nel tempo, più difficile
ATELETTASIA: collasso di gruppi di alveoli che continuano ad essere vascolarizzati (ma non sono più ventilati! Quindi c è un alterazione degli scambi O2/CO2) Più l atelettasia dura nel tempo, più difficile
FAME, APPETITO E SAZIETA
 FAME, APPETITO E SAZIETA 1 FAME Necessità di un organismo ad assumere cibo Nel sistema nervoso centrale, a livello ipotalamico, si distinguono due zone il centro della fame il centro della sazietà La prima
FAME, APPETITO E SAZIETA 1 FAME Necessità di un organismo ad assumere cibo Nel sistema nervoso centrale, a livello ipotalamico, si distinguono due zone il centro della fame il centro della sazietà La prima
IPERTENSIONE IPERTENSIONE ARTERIOSA
 UNIVERSITA di FOGGIA C.D.L. in Dietistica AA. 2006-2007 IPERTENSIONE ARTERIOSA IPERTENSIONE L ipertensione è la più comune malattia cardiovascolare. Corso di Medicina Interna Docente: PROF. Gaetano Serviddio
UNIVERSITA di FOGGIA C.D.L. in Dietistica AA. 2006-2007 IPERTENSIONE ARTERIOSA IPERTENSIONE L ipertensione è la più comune malattia cardiovascolare. Corso di Medicina Interna Docente: PROF. Gaetano Serviddio
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY
 DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
Elettrolita forte = specie chimica che in soluzione si dissocia completamente (l equilibrio di dissociazione è completamente spostato verso destra)
 A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
a cura di : Alessandro Trevisan Croce Rossa Italiana Ambulanza ALS CRI-118
 a cura di : Alessandro Trevisan Croce Rossa Italiana Ambulanza ALS CRI-118 Importanza dell identificazione precoce del paziente critico Cause dell arresto cardiorespiratorio nell adulto Identificare e
a cura di : Alessandro Trevisan Croce Rossa Italiana Ambulanza ALS CRI-118 Importanza dell identificazione precoce del paziente critico Cause dell arresto cardiorespiratorio nell adulto Identificare e
Capitolo 5_d URGENZE MEDICHE ADULTO
 Capitolo 5_d URGENZE MEDICHE ADULTO 1 OBIETTIVI RICONOSCERE LE PRINCIPALI PATOLOGIE NEUROLOGICHE CHE PROVOCANO ALTERAZIONI DELLA COSCIENZA IDENTIFICARE I SEGNI E SINTOMI DI: SINCOPE, CONVULSIONI, MENINGITE,
Capitolo 5_d URGENZE MEDICHE ADULTO 1 OBIETTIVI RICONOSCERE LE PRINCIPALI PATOLOGIE NEUROLOGICHE CHE PROVOCANO ALTERAZIONI DELLA COSCIENZA IDENTIFICARE I SEGNI E SINTOMI DI: SINCOPE, CONVULSIONI, MENINGITE,
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti.
 Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Rene: le funzioni tubulari
 Rene: le funzioni tubulari Riassorbimento del Na+ Riassorbimento dell HCO3-, secrezione dell H+ Riassorbimento del glucoso, a-a ecc Riassorbimento e secrezione del K+ Riassorbimento e secrezione dell urea
Rene: le funzioni tubulari Riassorbimento del Na+ Riassorbimento dell HCO3-, secrezione dell H+ Riassorbimento del glucoso, a-a ecc Riassorbimento e secrezione del K+ Riassorbimento e secrezione dell urea
IPERALDOSTERONISMO PRIMITIVO
 IPERALDOSTERONISMO PRIMITIVO Codice di esenzione: RCG010 Definizione. L iperaldosteronismo primitivo (IP) è una sindrome clinica dovuta ad una ipersecrezione primitiva di aldosterone da parte della corteccia
IPERALDOSTERONISMO PRIMITIVO Codice di esenzione: RCG010 Definizione. L iperaldosteronismo primitivo (IP) è una sindrome clinica dovuta ad una ipersecrezione primitiva di aldosterone da parte della corteccia
Paratiroidi e regolazione del calcio e fosforo Regolazione calcio fosforo
 Paratiroidi e regolazione del calcio e fosforo Regolazione calcio fosforo La regolazione dei livelli plasmatici di calcio è un evento critico per una normale funzione cellulare, per la trasmissione nervosa,
Paratiroidi e regolazione del calcio e fosforo Regolazione calcio fosforo La regolazione dei livelli plasmatici di calcio è un evento critico per una normale funzione cellulare, per la trasmissione nervosa,
