Cos è la chimica organica
|
|
|
- Severino Pisani
- 6 anni fa
- Visualizzazioni
Transcript
1 Cos è la chimica organica La prima definizione di chimica organica si deve al chimico svedese Jacob Berzelius nel 1807: la chimica organica è la scienza che studia i comportamenti chimici e fisici dei composti elaborati dagli organismi viventi Allora si credeva che i composti organici fossero del tutto speciali, in particolare si riteneva che potessero essere prodotti solo dagli organismi viventi e non fosse possibile la loro sintesi in laboratorio. Cos è la chimica organica Nel 1828 il chimico tedesco Friedrich Wöhler riuscì per primo a sintetizzare un composto organico (l urea) e da allora i composti organici persero la loro aura di sostanze particolari. Oggi la definizione più corretta di chimica organica è: la scienza che si occupa delle caratteristiche chimiche e fisiche dei composti del carbonio 1
2 I composti organici Per ragioni storiche, tuttavia, non tutti i composti del carbonio rientrano nella chimica organica. Fanno eccezione: l anidride carbonica (biossido di carbonio) il monossido di carbonio l acido carbonico ed i suoi derivati (carbonati e bicarbonati) l acido cianidrico ed i suoi derivati (cianuri) i carburi I composti organici I composti organici attualmente conosciuti sono milioni e continuamente ne vengono scoperti di nuovi. Essi vengono suddivisi in tre grandi raggruppamenti: Perché il carbonio è in grado di formare un così gran numero di composti? Il motivo sta nella sua particolare configurazione elettronica che fa sì che l atomo acquisti alcuni aspetti particolari: 1. la possibilità di ibridazione 2. il particolare numero di ossidazione 3. l elettronegatività 4. il raggio atomico 5. la concatenazione 2
3 ha 6 elettroni: 2 nel primo livello energetico e 4 nel secondo, di questi ultimi due stanno nell orbitale 2s e due nell orbitale 2p (1s 2 2s 2 2p 2 ) Nel carbonio ibridato uno degli elettroni del 2s passa nel 2p (1s 2 2s 1 2p 3 ) promozione I tre elettroni 2p si dispongono in orbitali diversi (regola di Hund): 2p x1 2p y1 2p z 1 Si hanno così quattro orbitali incompleti: il 2s e i tre 2p Successivamente l orbitale 2s si fonde con uno o più orbitali 2p formando orbitali di tipo sp (una via di mezzo tra gli s e i p) ibridazione L ibridazione può essere di tre tipi differenti: 1. tra un orbitale s e tre orbitali p: ibridazione di tipo sp 3 si formano quattro orbitali ibridi sp 2. tra un orbitale s e due orbitali p: ibridazione di tipo sp 2 si formano tre orbitali ibridi sp e rimane un p normale 3. tra un orbitale s e un orbitale p: ibridazione di tipo sp si formano due orbitali ibridi sp e rimangono due p normali In ogni caso risultano sempre 4 orbitali incompleti con i quali il carbonio forma legami covalenti con altri atomi. I legami covalenti che coinvolgono gli orbitali ibridi vengono detti sigma (σ). I legami covalenti che coinvolgono gli orbitali non ibridi (in pratico uno o due orbitali 2p) vengono detti invece pi greco (π). 3
4 Il numero di ossidazione del carbonio assume tutti i valori compresi tra +4 e 4. Ciò permette all atomo di formare un numero infinito di composti. Nella stessa molecola, però, il carbonio può assumere valori diversi, per cui si deve attribuire il n. o. a tutti gli atomi di carbonio singolarmente. Per il calcolo del n. o. di un atomo di carbonio, si deve tenere conto dei seguenti criteri: 1. in ogni legame con altri atomi di carbonio il n. o. è zero perché gli elettroni di legame sono condivisi; 2. nel legame con l idrogeno o con i metalli il n. o. del carbonio è 1 (il carbonio è più elettronegativo); 3. nel legame con non metalli il n. o. del carbonio è +1 (il carbonio è meno elettronegativo). ha un valore medio di elettronegatività (2,5) per cui non ha tendenza a perdere o ad acquistare elettroni, ma unicamente a condividerli. Si formano così legami covalenti poco polari e quindi forti e stabili. Questo permette anche la formazione di legami multipli (doppi o tripli) che conferisce all atomo la specificità di formare molecole costituite dagli stessi atomi ma disposti in modo diverso nello spazio e quindi con differenti proprietà fisiche e chimiche. 4
5 Il raggio atomico (77 pm) è molto piccolo e lo scarso ingombro facilita la formazione di legami stabili. L assenza di coppie elettroniche libere nel livello energetico esterno e il piccolo raggio atomico consentono al carbonio la sua grande tendenza alla concatenazione. Le catene che si formano possono essere aperte (lineari o ramificate) o chiuse. Le formule A causa delle particolarità del carbonio, i composti organici non possono essere rappresentati con le consuete formule chimiche. Per essi si adottano altre simbologie rappresentate da: formule di Lewis evidenziano tutti i legami tra gli atomi della molecola Le formule formule razionali mettono in evidenza solo i legami tra atomi di carbonio 5
6 Le formule formule condensate evidenziano solo alcuni atomi e i gruppi atomici che costituiscono la molecola Le formule formule topologiche evidenziano solo la catena carboniosa mediante l uso di segmenti Le formule 6
7 Gruppi funzionali La reattività di un composto organico è determinata dalla presenza nella molecola di un legame multiplo, di un atomo molto elettronegativo (ossigeno, alogeni ) o di uno specifico gruppo atomico che attira o respinge elettroni. Il componente molecolare da cui dipende la reattività prende il nome di gruppo funzionale. Composti con lo stesso gruppo funzionale, avendo proprietà e comportamento chimico simile, vengono riuniti in una stessa classe. Gruppi funzionali Proprietà fisiche Lo stato fisico di un composto dipende dalla forza e dal numero dei legami che si possono stabilire tra le molecole del composto. Se i legami intermolecolari sono deboli il composto è presente allo stato aeriforme; se sono relativamente più forti e numerosi, il composto è sotto forma di liquido o di solido. Tra le molecole organiche si formano in genere deboli legami intermolecolari ma, all aumentare della massa molecolare, il numero di questi legami aumenta e quindi lo stato fisico risulta liquido o solido. 7
8 Proprietà fisiche La solubilità in acqua dei composti organici dipende dalla presenza nelle molecole di gruppi idrofili. I composti contenenti gruppi idrofili sono solubili in acqua. Sono gruppi idrofili OH, NH 2, COOH. I composti contenenti gruppi idrofobi sono insolubili in acqua. Sono gruppi idrofobi CH 3, (CH 2 ) n CH 3, C 6 H 5 ). I composti con gruppi idrofobi sono solubili in solventi apolari (come il benzene). Proprietà fisiche Se un composto contiene contemporaneamente gruppi idrofili e idrofobici, la sua solubilità in acqua dipende dal prevalere del carattere idrofilo o idrofobico dei gruppi. Composti organici, con un rilevante ruolo biologico, caratterizzati da una parte idrofila e da una parte idrofoba, sono i fosfolipidi e il surfactante. Proprietà fisiche I fosfolipidi sono i costituenti principali della membrana plasmatica. Regolano il passaggio delle molecole tra l interno e l esterno della cellula e si legano a recettori proteici che interagiscono con molecole regolatrici (ormoni) o altre molecole (glucosio o galattosio). Il surfactante è un tensioattivo prodotto dai polmoni e presente negli alveoli polmonari. Ha la funzione di abbassare la tensione superficiale alveolare impedendo il collasso degli alveoli e favorendo così lo scambio dei gas nella respirazione. 8
9 La presenza di un atomo con elettronegatività molto diversa dal carbonio o di un gruppo atomico che attira o respinge elettroni influenza la reattività delle molecole organiche. La differenza di elettronegatività porta a una polarizzazione del legame e ciò comporta uno spostamento di elettroni anche su tutti i legami. La trasmissione della polarizzazione lungo la catena carboniosa si chiama effetto induttivo. L effetto induttivo può essere di tipo attrattivo o repulsivo. Nel composto in cui un atomo di cloro è legato a un atomo di carbonio si ha che il cloro (fortemente più elettronegativo del carbonio) attira verso di sé gli elettroni di legame. Il cloro assume quindi una parziale carica negativa (δ ) e il carbonio una parziale carica positiva (δ + ). Ciò provoca uno spostamento di elettroni dagli atomi adiacenti, indebolendo il legame C Cl e aumentando di conseguenza la reattività della molecola. L effetto induttivo è di tipo attrattivo. Si dicono sostituenti elettron-attrattori gli atomi più elettronegativi del carbonio, i gruppi atomici con carica positiva e quelli in cui il carbonio presenta legami multipli. 9
10 Nell acetone un atomo di carbonio è legato ad un atomo di ossigeno (più elettronegativo) e due gruppi CH 3 (meno elettronegativi). L ossigeno attira verso di sé gli elettroni di legame e il carbonio assume una parziale carica positiva (δ + ), tuttavia i due gruppi CH 3 determinano uno spostamento di elettroni verso l atomo di carbonio, che tenderà a neutralizzare la sua carica positiva e diminuendo così la reattività della molecola. L effetto induttivo è di tipo repulsivo. Si dicono sostituenti elettron-donatori gli atomi meno elettronegativi del carbonio e i gruppi atomici in cui il carbonio è legato ad atomi di idrogeno. Nel corso di una qualunque reazione i legami dei reagenti devono rompersi per poterne formare di nuovi. Così accade anche per i composti organici. Un aspetto essenziale di una reazione organica è la rottura del legame covalente, che si può realizzare secondo due modalità: omolitica ed eterolitica. 10
11 Nella rottura omolitica o radicalica ciascun atomo trattiene uno dei due elettroni precedentemente condivisi. Si ha la formazione di radicali o radicali liberi: atomi o gruppi atomici aventi un elettrone spaiato. La rottura omolitica può essere provocata dal calore (termolisi) o dalla radiazione ultravioletta (fotolisi). I radicali liberi (H, Cl, CH3) sono fortemente instabili, per cui tendono a reagire con altri radicali o con molecole per ricostituire legami covalenti. Nella rottura eterolitica o polare l atomo più elettronegativo trattiene entrambi gli elettroni prima condivisi. Si formano così carbanioni e i carbocationi. Il carbanione è un anione la cui carica negativa è localizzata su un atomo di carbonio. Il carbocatione è un catione la cui carica positiva è localizzata su un atomo di carbonio. Le reazioni eterolitiche, le più frequenti tra i composti organici, coinvolgono sempre specie chimiche povere di elettroni (elettrofili) e specie chimiche ricche di elettroni (nucleofili). Gli elettrofili sono specie chimiche con una parziale o totale carica positiva oppure con l ottetto incompleto. Gli elettrofili tendono a reagire con specie chimiche ricche di elettroni (nucleofili). I nucleofili sono specie chimiche con una parziale o totale carica negativa oppure con un doppietto elettronico disponibile. 11
Cos è la chimica organica
 Cos è la chimica organica La prima definizione di chimica organica si deve al chimico svedese Jacob Berzelius nel 1807: la chimica organica è la scienza che studia i comportamenti chimici e fisici dei
Cos è la chimica organica La prima definizione di chimica organica si deve al chimico svedese Jacob Berzelius nel 1807: la chimica organica è la scienza che studia i comportamenti chimici e fisici dei
Le reazioni di ossido-riduzione
 Le reazioni di ossido-riduzione Si dicono reazioni di ossidazione e di riduzione (o ossido-riduzione) quelle reazioni che avvengono con cambiamento del numero di elettroni che una specie chimica coinvolge
Le reazioni di ossido-riduzione Si dicono reazioni di ossidazione e di riduzione (o ossido-riduzione) quelle reazioni che avvengono con cambiamento del numero di elettroni che una specie chimica coinvolge
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
ESERCIZI ESERCIZI. il basso d. aumenta lungo un periodo da sinistra verso
 ESERCIZI 1) L elettronegatività di un elemento: a è l energia che esso libera acquistando un elettrone e trasformandosi in ione negativo b è l energia necessaria per trasformarlo in ione positivo c indica
ESERCIZI 1) L elettronegatività di un elemento: a è l energia che esso libera acquistando un elettrone e trasformandosi in ione negativo b è l energia necessaria per trasformarlo in ione positivo c indica
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
LEGAMI CHIMICI. Gli elettroni esterni sono implicati nella formazione dei legami chimici
 LEGAMI CHIMICI Gli elettroni esterni sono implicati nella formazione dei legami chimici La VALENZA di un elemento è data dal numero di elettroni che esso deve perdere, o acquistare, o mettere in comune
LEGAMI CHIMICI Gli elettroni esterni sono implicati nella formazione dei legami chimici La VALENZA di un elemento è data dal numero di elettroni che esso deve perdere, o acquistare, o mettere in comune
Idrocarburi Saturi. Reazioni
 Idrocarburi Saturi Reazioni Fonti ed usi Gli alcani lineari, ramificati e ciclici si ottengono principalmente dalla lavorazione (frazionamento, cracking, etc.), del petrolio. Fonti ed usi Gli alcani, soprattutto
Idrocarburi Saturi Reazioni Fonti ed usi Gli alcani lineari, ramificati e ciclici si ottengono principalmente dalla lavorazione (frazionamento, cracking, etc.), del petrolio. Fonti ed usi Gli alcani, soprattutto
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: legame ionico, legame covalente, legame metallico
 Legame chimico: legame ionico, legame covalente, legame metallico Elettroni interni Categorie di elettroni elettroni del gas nobile che precede l elemento nella tavola periodica, riempiono tutti i livelli
Legame chimico: legame ionico, legame covalente, legame metallico Elettroni interni Categorie di elettroni elettroni del gas nobile che precede l elemento nella tavola periodica, riempiono tutti i livelli
INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA
 INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA ai primi dell 800 Il chimico svedese Jacob Berzelius (1779-1848) indicava le sostanze con il termine organico se ottenute dagli organismi viventi (animali
INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA ai primi dell 800 Il chimico svedese Jacob Berzelius (1779-1848) indicava le sostanze con il termine organico se ottenute dagli organismi viventi (animali
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
Chimica. Lezione 2 Parte II Composti ionici e molecolari
 Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
combinazione di atomi tenuti insieme da forze più o meno un insieme caratteristico di proprietà
 IL LEGAME CHIMICO La regola dell ottetto sebbene una semplificazione rende conto del perchè gli atomi reagiscono. In natura, solo i gas nobili sono presenti come specie monoatomiche. Anche le sostanze
IL LEGAME CHIMICO La regola dell ottetto sebbene una semplificazione rende conto del perchè gli atomi reagiscono. In natura, solo i gas nobili sono presenti come specie monoatomiche. Anche le sostanze
Olimpiadi di Chimica
 Olimpiadi di Chimica Acqua Oro Zucchero I Legami Chimici F N F F Il legame chimico il legame ionico Polare il legame covalente Dativo Gli elettroni di valenza sono gli elettroni del livello più esterno
Olimpiadi di Chimica Acqua Oro Zucchero I Legami Chimici F N F F Il legame chimico il legame ionico Polare il legame covalente Dativo Gli elettroni di valenza sono gli elettroni del livello più esterno
STRUTTURA DEGLI OSSIACIDI
 Chimica Silvia LICOCCIA Professore Ordinario di Fondamenti Chimici per le Tecnologie Dipartimento di Scienze e Tecnologie Chimiche Università di Roma Tor Vergata STRUTTURA DEGLI OSSIACIDI Orbitali ibridi
Chimica Silvia LICOCCIA Professore Ordinario di Fondamenti Chimici per le Tecnologie Dipartimento di Scienze e Tecnologie Chimiche Università di Roma Tor Vergata STRUTTURA DEGLI OSSIACIDI Orbitali ibridi
Costituenti chimici della materia vivente
 Costituenti chimici della materia vivente fondamenti di chimica indispensabili per lo studio della biologia Flavia Frabetti Tecnici di laboratorio 2010/2011 Cellula batterica PROTEINE (15%) 1 Composizione
Costituenti chimici della materia vivente fondamenti di chimica indispensabili per lo studio della biologia Flavia Frabetti Tecnici di laboratorio 2010/2011 Cellula batterica PROTEINE (15%) 1 Composizione
Il legame chimico ATOMI MOLECOLE
 Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
le SOSTANZE Sostanze elementari (ELEMENTI) COMPOSTI Costituiti da due o più atomi DIVERSI tra loro
 Il legame chimico In natura gli atomi sono solitamente legati ad altri in unità più complesse che, se aggregate fra loro costituiscono quello che macroscopicamente percepiamo come materia, le SOSTANZE
Il legame chimico In natura gli atomi sono solitamente legati ad altri in unità più complesse che, se aggregate fra loro costituiscono quello che macroscopicamente percepiamo come materia, le SOSTANZE
IBRIDAZIONE. MODELLO DELL ORBITALE di LEGAME
 IBRIDAZIONE MODELLO DELL ORBITALE di LEGAME Approccio più semplice per descrivere la struttura elettronica di una specie sfruttando il concetto di orbitale. METANO Gli atomi nel formare legami usano elettroni
IBRIDAZIONE MODELLO DELL ORBITALE di LEGAME Approccio più semplice per descrivere la struttura elettronica di una specie sfruttando il concetto di orbitale. METANO Gli atomi nel formare legami usano elettroni
14/11/2018. Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile.
 Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile. L atomo di carbonio ibridato sp 2 è legato a un atomo di ossigeno da un doppio legame. L ossigeno è più elettronegativo
Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile. L atomo di carbonio ibridato sp 2 è legato a un atomo di ossigeno da un doppio legame. L ossigeno è più elettronegativo
Definizioni. Vecchia: derivata da organismi viventi Nuova: la chimica dei composti del carbonio Da inorganico a organico, Wöhler, 1828
 CHIMICA ORGANICA 4 Definizioni Vecchia: derivata da organismi viventi Nuova: la chimica dei composti del carbonio Da inorganico a organico, Wöhler, 828 + - NH 4 OCN ammonio cianato calore O H 2 N C NH
CHIMICA ORGANICA 4 Definizioni Vecchia: derivata da organismi viventi Nuova: la chimica dei composti del carbonio Da inorganico a organico, Wöhler, 828 + - NH 4 OCN ammonio cianato calore O H 2 N C NH
Primo presame di chimica
 1 1. Indicare quale tra le seguenti può essere la combinazione dei numeri quantici (n, l, m, s) di un elettrone in un atomo (0, -1, 1, +1/2) (2, -1, 1, +1/2) (4, 4, 1, -1/2) (5, 4, 1, -1/2) 2. Quale delle
1 1. Indicare quale tra le seguenti può essere la combinazione dei numeri quantici (n, l, m, s) di un elettrone in un atomo (0, -1, 1, +1/2) (2, -1, 1, +1/2) (4, 4, 1, -1/2) (5, 4, 1, -1/2) 2. Quale delle
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Molecole e legami. Chimica generale
 Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Legame chimico unità 1, modulo D del libro
 Legame chimico unità 1, modulo D del libro PERCHÉ IL LEGAME CHIMICO? Gli atomi si trovano raramente isolati, spesso due o più atomi si uniscono tramite un legame chimico. Perché ciò avviene? Perché l insieme
Legame chimico unità 1, modulo D del libro PERCHÉ IL LEGAME CHIMICO? Gli atomi si trovano raramente isolati, spesso due o più atomi si uniscono tramite un legame chimico. Perché ciò avviene? Perché l insieme
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta della struttura elettronica delle molecole, come quella
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta della struttura elettronica delle molecole, come quella
Prof.ssa Stacca Prof.ssa Stacca
 La bassa differenza di elettronegatività tra C e H fa sì che i legami presenti negli alcani siano legami covalenti quasi omopolari; di conseguenza gli alcani sono composti apolari. La bassa differenza
La bassa differenza di elettronegatività tra C e H fa sì che i legami presenti negli alcani siano legami covalenti quasi omopolari; di conseguenza gli alcani sono composti apolari. La bassa differenza
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
CORSO DI CHIMICA ORGANICA. Testo consigliato: Chimica Organica H.Hart,D.J.Hart, L.E.Craine Zanichelli
 CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
I legami chimici. Perché si formano i legami? Perché si formano i legami? 16/01/2019. Come e perché gli atomi si legano tra loro
 I legami chimici Come e perché gli atomi si legano tra loro Perché si formano i legami? In natura, se non in casi eccezionali, non si trovano atomi liberi. Per separare due atomi legati è necessario fornire
I legami chimici Come e perché gli atomi si legano tra loro Perché si formano i legami? In natura, se non in casi eccezionali, non si trovano atomi liberi. Per separare due atomi legati è necessario fornire
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU)
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
IBRIDAZIONE DEL CARBONIO NEGLI ALCANI PREMESSA: COSA SONO GLI ORBITALI IBRIDI.
 ALCANI Gli alcani sono composti organici costituiti solamente da carbonio e idrogeno (per questo motivo appartengono alla più ampia classe degli idrocarburi), aventi formula bruta C n H (2n + 2). Gli alcani
ALCANI Gli alcani sono composti organici costituiti solamente da carbonio e idrogeno (per questo motivo appartengono alla più ampia classe degli idrocarburi), aventi formula bruta C n H (2n + 2). Gli alcani
1. L energia di legame. 2. I gas nobili e a regola dell ottetto. 3. Il legame covalente. 4. Il legame covalente dativo. 5. Il legame covalente polare
 Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
LEGAME COVALENTE. ( Elettronegatività tra gli atomi < 2)
 LEGAME COVALENTE ( Elettronegatività tra gli atomi < 2) Le sostanze molecolari hanno un tipo di legame che non comporta l acquisto o la cessione di e - ma la condivisione diunacoppiadie - tragliatomi Non
LEGAME COVALENTE ( Elettronegatività tra gli atomi < 2) Le sostanze molecolari hanno un tipo di legame che non comporta l acquisto o la cessione di e - ma la condivisione diunacoppiadie - tragliatomi Non
Capitolo 4 Reazioni degli alcheni
 himica Organica Informazione Scientifica sul Farmaco apitolo 4 Reazioni degli alcheni Organic hemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: richiami generali sulle reazioni chimice reattività
himica Organica Informazione Scientifica sul Farmaco apitolo 4 Reazioni degli alcheni Organic hemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: richiami generali sulle reazioni chimice reattività
Tavola periodica e previsione sul comportamento chimico degli elementi (numero di ossidazione)- orbitali ibridi
 Tavola periodica e previsione sul comportamento chimico degli elementi (numero di ossidazione)- orbitali ibridi Gli elementi sono ordinati secondo numero atomico Z ( numero dei protoni ) crescente Il numero
Tavola periodica e previsione sul comportamento chimico degli elementi (numero di ossidazione)- orbitali ibridi Gli elementi sono ordinati secondo numero atomico Z ( numero dei protoni ) crescente Il numero
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
METALLI: bassa energia di ionizzazione bassa affinità elettronica. NON METALLI: elevata energia di ionizzazione elevata affinità elettronica
 METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
Prof.Patrizia Gallucci
 Prof.Patrizia Gallucci MAPPA CONCETTUALE Gli atomi,ad eccezione dei gas nobili, si legano tra di loro a formare molecole o aggregati di ioni. Teoria di Lewis: Gli elettroni esterni, di valenza, sono implicati
Prof.Patrizia Gallucci MAPPA CONCETTUALE Gli atomi,ad eccezione dei gas nobili, si legano tra di loro a formare molecole o aggregati di ioni. Teoria di Lewis: Gli elettroni esterni, di valenza, sono implicati
Reazioni degli Alogenuri Alchilici. Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici.
 Reazioni degli Alogenuri Alchilici Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici. Un nucleofilo ( reagente amante del nucleo) è un qualsiasi reagente che dona una coppia non condivisa
Reazioni degli Alogenuri Alchilici Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici. Un nucleofilo ( reagente amante del nucleo) è un qualsiasi reagente che dona una coppia non condivisa
MOLECOLE. 2 - i legami chimici. Prof. Vittoria Patti
 MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Un po di calcoli N moli = massa [gr] / massa atomica [uma] N atomi = N moli * N A N A = numero di Avogadro Quanti
La Vita è una Reazione Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Un po di calcoli N moli = massa [gr] / massa atomica [uma] N atomi = N moli * N A N A = numero di Avogadro Quanti
Capitolo 23 Dal carbonio agli idrocarburi
 Quesiti e problemi 1 a) sp 3 ; b) sp 2 ; c) sp. 2 B, E 3 Ibridazione Legami Geometria sp 3 4 σ Tetraedrica sp 2 3 σ e 1 π Trigonale planare sp 2 σ e 2 π Lineare 4 5 1 6 7 B 8 a) 1 e 2; b) tutte e tre;
Quesiti e problemi 1 a) sp 3 ; b) sp 2 ; c) sp. 2 B, E 3 Ibridazione Legami Geometria sp 3 4 σ Tetraedrica sp 2 3 σ e 1 π Trigonale planare sp 2 σ e 2 π Lineare 4 5 1 6 7 B 8 a) 1 e 2; b) tutte e tre;
CHIMICA II (CHIMICA ORGANICA)
 CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
Le proprietà delle sostanze dipendono dal tipo di legame che unisce gli atomi e dalla forma delle molecole.
 4.1 Angolo di legame e forma delle molecole Le proprietà delle sostanze dipendono dal tipo di legame che unisce gli atomi e dalla forma delle molecole. La forma e le dimensioni delle molecole, la disposizione
4.1 Angolo di legame e forma delle molecole Le proprietà delle sostanze dipendono dal tipo di legame che unisce gli atomi e dalla forma delle molecole. La forma e le dimensioni delle molecole, la disposizione
Il legame chimico. Lezioni 17-20
 Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Complementi di Chimica Organica. Composti Aromatici: Benzene C 6 H 6 (1825) (1865) Friedrich August Kekulé
 Composti Aromatici: Benzene C 6 6 (1825) (1865) Friedrich August Kekulé Composti Aromatici: Benzene, energia di coniugazione = -119.5 KJ/mol (-119.2 x 3 = -357.6) = -208.2 KJ/mol -357.6 KJ/mol (-208.2
Composti Aromatici: Benzene C 6 6 (1825) (1865) Friedrich August Kekulé Composti Aromatici: Benzene, energia di coniugazione = -119.5 KJ/mol (-119.2 x 3 = -357.6) = -208.2 KJ/mol -357.6 KJ/mol (-208.2
Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame
 IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
A_Test di valutazione di CHIMICA:
 COGNOME NOME... C.I./Patente n... MATRICOLA NO SI, n:... Prova di accertamento per la determinazione di eventuali debiti formativi A_Test di valutazione di CHIMICA: Cosa studia in generale la chimica A)
COGNOME NOME... C.I./Patente n... MATRICOLA NO SI, n:... Prova di accertamento per la determinazione di eventuali debiti formativi A_Test di valutazione di CHIMICA: Cosa studia in generale la chimica A)
1. L energia di legame
 legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
La struttura di ioni e molecole
 La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il
Chimica. Lezione 2 Il legame chimico Parte I
 Chimica Lezione 2 Il legame chimico Parte I Gli ioni Uno ione è un ATOMO o una MOLECOLA che possiede una CARICA (positiva o negativa) È quindi una specie chimica che ha acquistato o ceduto uno o più elettroni
Chimica Lezione 2 Il legame chimico Parte I Gli ioni Uno ione è un ATOMO o una MOLECOLA che possiede una CARICA (positiva o negativa) È quindi una specie chimica che ha acquistato o ceduto uno o più elettroni
ATOMI E MOLECOLE. Psicobiologia Lezione nr. 1. Prof. Lasaponara
 ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
Gli elettroni della molecola sono quindi descritti da
 IL LEGAME COVALENTE: TEORIA DELL ORBITALE MOLECOLARE La molecola è considerata come un insieme di nuclei ed elettroni e, attraverso la valutazione delle reciproche interazioni, la teoria dell orbitale
IL LEGAME COVALENTE: TEORIA DELL ORBITALE MOLECOLARE La molecola è considerata come un insieme di nuclei ed elettroni e, attraverso la valutazione delle reciproche interazioni, la teoria dell orbitale
Alchini (C n H 2n-2 ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio doppi.
 himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio.
 La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio. Proteine, zuccheri, lipidi, DNA.. farmaci arta, fibre, plastica s2p2 Z=6 2p 1s 2
La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio. Proteine, zuccheri, lipidi, DNA.. farmaci arta, fibre, plastica s2p2 Z=6 2p 1s 2
SEZIONE D - LE BIOMOLECOLE di Mauro Festa Larel, Patrizia Panunzio, Elisabetta Rusconi, Giovanni Valsecchi
 SEZIONE D - LE BIOMOLECOLE di Mauro Festa Larel, Patrizia Panunzio, Elisabetta Rusconi, Giovanni Valsecchi SEZIONE D - LE BIOMOLECOLE D.1 - PREMESSA: UN PO DI CHIMICA Tutta la materia è formata da atomi
SEZIONE D - LE BIOMOLECOLE di Mauro Festa Larel, Patrizia Panunzio, Elisabetta Rusconi, Giovanni Valsecchi SEZIONE D - LE BIOMOLECOLE D.1 - PREMESSA: UN PO DI CHIMICA Tutta la materia è formata da atomi
CHIMICA ORGANICA (CANALE M-Z)
 CHIMICA ORGANICA (CANALE M-Z) Durata corso (8 marzo-10 maggio) + settimana recupero Orario lezioni Esercitazioni Modalità d esame Esoneri Libri di testo Ricevimento studenti e-mail/telefono docente: Michela.Salamone@uniroma2.it
CHIMICA ORGANICA (CANALE M-Z) Durata corso (8 marzo-10 maggio) + settimana recupero Orario lezioni Esercitazioni Modalità d esame Esoneri Libri di testo Ricevimento studenti e-mail/telefono docente: Michela.Salamone@uniroma2.it
REAZIONI E LORO MECCANISMI
 REAZIONI E LORO MECCANISMI Rivisitazione dei concetti di Omolisi, Eterolisi Reagenti Nucleofili e Reagenti Elettrofili Addizione elettrofila Sostituzione nucleofila Eliminazione Reazioni radicaliche Reazioni
REAZIONI E LORO MECCANISMI Rivisitazione dei concetti di Omolisi, Eterolisi Reagenti Nucleofili e Reagenti Elettrofili Addizione elettrofila Sostituzione nucleofila Eliminazione Reazioni radicaliche Reazioni
I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo
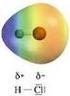 La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
L'atomo è la parte più piccola della materia che ne conserva tutte le caratteristiche. Esso è formato da particelle più piccole:
 L'atomo è la parte più piccola della materia che ne conserva tutte le caratteristiche. Esso è formato da particelle più piccole: PROTONI NEUTRONI ELETTRONI I protoni e i neutroni si trovano nella parte
L'atomo è la parte più piccola della materia che ne conserva tutte le caratteristiche. Esso è formato da particelle più piccole: PROTONI NEUTRONI ELETTRONI I protoni e i neutroni si trovano nella parte
Fondamenti di chimica organica Janice Gorzynski Smith Copyright 2009 The McGraw Hill Companies srl
 Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
I composti organici. Il carbonio e i composti organici
 I composti organici Il carbonio e i composti organici COSA SONO I COMPOSTI ORGANICI? I composti organici sono composti in cui uno o più atomi di carbonio (C) sono uniti tramite un legame covalente ad atomi
I composti organici Il carbonio e i composti organici COSA SONO I COMPOSTI ORGANICI? I composti organici sono composti in cui uno o più atomi di carbonio (C) sono uniti tramite un legame covalente ad atomi
Il Legame Chimico e la Struttura Molecolare
 A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
Corso di Laurea in CHIMICA (L.T.) Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule
 orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
Formule di Lewis e regola dell ottetto
 Formule di Lewis e regola dell ottetto 1916-1919 Lewis si accorse che: Qualcosa di unico nelle configurazioni elettroniche dei gas nobili è responsabile della loro inerzia; gli atomi degli altri elementi
Formule di Lewis e regola dell ottetto 1916-1919 Lewis si accorse che: Qualcosa di unico nelle configurazioni elettroniche dei gas nobili è responsabile della loro inerzia; gli atomi degli altri elementi
Pronti per l Università Liceo Scientifico de Caprariis Atripalda PON F
 Pronti per l Università Liceo Scientifico de Caprariis Atripalda PON F2 2011-14 La chimica del carbonio Il Carbonio Copyright 2008 PresentationFx.com Redistribution Prohibited Image 2008 clix@sxc.hu This
Pronti per l Università Liceo Scientifico de Caprariis Atripalda PON F2 2011-14 La chimica del carbonio Il Carbonio Copyright 2008 PresentationFx.com Redistribution Prohibited Image 2008 clix@sxc.hu This
Tavola periodica degli elementi
 Tavola periodica degli elementi!1 I chimici Mendeleev (russo) e Meyer (tedesco) scoprirono indipendentemente che ordinando gli elementi secondo peso atomico crescente in file orizzontali sovrapposte, si
Tavola periodica degli elementi!1 I chimici Mendeleev (russo) e Meyer (tedesco) scoprirono indipendentemente che ordinando gli elementi secondo peso atomico crescente in file orizzontali sovrapposte, si
 ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
IL LEGAME A IDROGENO
 IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
FORMULE di LEWIS. Molecole biatomiche
 FORMULE di LEWIS Molecole biatomiche Contare gli elettroni di valenza dei due atomi Nella struttura di Lewis devono comparire tanti puntini quanti sono gli elettroni al punto 1). Disporre gli elettroni
FORMULE di LEWIS Molecole biatomiche Contare gli elettroni di valenza dei due atomi Nella struttura di Lewis devono comparire tanti puntini quanti sono gli elettroni al punto 1). Disporre gli elettroni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici. Capitolo 10
 Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Esame del
 Chimica Generale ed Inorganica Esame del 08-02-2011 Chimica Generale Mazzi 1) La teoria VSEPR afferma che quando un atomo forma legami covalenti: A. tutti i suoi elettroni si respingono e si dispongono
Chimica Generale ed Inorganica Esame del 08-02-2011 Chimica Generale Mazzi 1) La teoria VSEPR afferma che quando un atomo forma legami covalenti: A. tutti i suoi elettroni si respingono e si dispongono
Sommario. Capitolo 1 La struttura della materia: miscugli e sostanze. Capitolo 2 Dalle sostanze all atomo
 Introduzione La Chimica e il metodo scientifico 1. La Chimica pag. 9 2. Il metodo scientifico pag. 10 3. Grandezze fondamentali e grandezze derivate pag. 11 3.1 Il Sistema Internazionale di unità di misura
Introduzione La Chimica e il metodo scientifico 1. La Chimica pag. 9 2. Il metodo scientifico pag. 10 3. Grandezze fondamentali e grandezze derivate pag. 11 3.1 Il Sistema Internazionale di unità di misura
Il legame chimico. Legame metallico
 Il legame chimico Legame ionico: un atomo cede elettroni e un altro li acquista con formazione di ioni di carica opposta che vengono tenuti insieme da forze elettrostatiche. Legame covalente: si realizza
Il legame chimico Legame ionico: un atomo cede elettroni e un altro li acquista con formazione di ioni di carica opposta che vengono tenuti insieme da forze elettrostatiche. Legame covalente: si realizza
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 9 Il mondo del carbonio 3 Sommario 1. Esiste un enorme varietà di composti organici 2. Gli idrocarburi saturi: alcani e cicloalcani
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 9 Il mondo del carbonio 3 Sommario 1. Esiste un enorme varietà di composti organici 2. Gli idrocarburi saturi: alcani e cicloalcani
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
ACIDI e BASI: evoluzione del concetto
 ACIDI E BASI ACIDI e BASI: evoluzione del concetto Acidi e basi di Arrhenius Gli acidi sono composti che, in soluzione acquosa, si dissociano liberando ioni H +. Esempi: HCl, H 2 SO 4, HI, H 3 PO 4 Le
ACIDI E BASI ACIDI e BASI: evoluzione del concetto Acidi e basi di Arrhenius Gli acidi sono composti che, in soluzione acquosa, si dissociano liberando ioni H +. Esempi: HCl, H 2 SO 4, HI, H 3 PO 4 Le
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Sommario delle lezioni Legami chimici
 Sommario delle lezioni 8 9-10 Legami chimici Legami chimici Complessità molecolare I legami chimici possono portare alla formazione di molecole particolarmente complesse Acqua Glucosio Emoglobina H 2
Sommario delle lezioni 8 9-10 Legami chimici Legami chimici Complessità molecolare I legami chimici possono portare alla formazione di molecole particolarmente complesse Acqua Glucosio Emoglobina H 2
Unità didattica 7. Dieni coniugati, Benzene e aromaticità, reattività
 I dieni coniugati ci pongono qualche domanda in più rispetto agli alcheni più semplici Unità didattica 7 Dieni coniugati, Benzene e aromaticità, reattività Perché il legame 2-3 è più corto che in un alcano?
I dieni coniugati ci pongono qualche domanda in più rispetto agli alcheni più semplici Unità didattica 7 Dieni coniugati, Benzene e aromaticità, reattività Perché il legame 2-3 è più corto che in un alcano?
REAZIONI DEGLI ALCHENI
 REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
IBRIDAZIONE. Approccio più semplice per descrivere la struttura elettronica di una specie sfruttando il concetto di orbitale.
 IBRIDAZIONE MODELLO DELL ORBITALE di LEGAME Approccio più semplice per descrivere la struttura elettronica di una specie sfruttando il concetto di orbitale. METANO Gli atomi nel formare legami usano elettroni
IBRIDAZIONE MODELLO DELL ORBITALE di LEGAME Approccio più semplice per descrivere la struttura elettronica di una specie sfruttando il concetto di orbitale. METANO Gli atomi nel formare legami usano elettroni
Introduzione alla Chimica Organica V Ed.
 William H. Brown - Thomas Poon Introduzione alla Chimica Organica V Ed. Capitolo 2 2.1 Cosa sono gli acidi e le basi secondo Arrhenius? Un Acido di Arrhenius è una sostanze che sciolta in acqua produce
William H. Brown - Thomas Poon Introduzione alla Chimica Organica V Ed. Capitolo 2 2.1 Cosa sono gli acidi e le basi secondo Arrhenius? Un Acido di Arrhenius è una sostanze che sciolta in acqua produce
I composti organici. Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H)
 I composti organici Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H) Gli idrocarburi Gli Alcani Costituiti da uno o più atomi di carbonio legati tra
I composti organici Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H) Gli idrocarburi Gli Alcani Costituiti da uno o più atomi di carbonio legati tra
Alcheni. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcheni Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcheni Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2
 ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
STRUTTURA ATOMICA. tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica
 STRUTTURA ATOMICA tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica il nucleo è composto da protoni e neutroni che hanno massa = 1 nella scala dei pesi atomici
STRUTTURA ATOMICA tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica il nucleo è composto da protoni e neutroni che hanno massa = 1 nella scala dei pesi atomici
