dc b dph dph dph 1 0 è grande SOLUZIONI TAMPONE POTERE TAMPONE C b grande phpiccolo
|
|
|
- Linda Serafini
- 6 anni fa
- Visualizzazioni
Transcript
1 SOLUZIONI TAMPONE Sono chimte soluzioni tmpone quelle soluzioni il cui ph non tende vrire sensibilmente si ll ggiunt di cidi che ll ggiunt di bsi. Hnno mrct proprietà tmpone le soluzioni cquose in cui è presente un cido debole (HA) e l su bse coniugt (A -, sotto form d es. di sle) oppure un bse debole B ed il suo cido coniugto HB, concentrzioni pressoché uguli. CH COOH CH COO - (CH COON) NH 4 OH NH 4 (NH 4 Cl) 1 POTERE TAMPONE Il potere tmpone β di un soluzione, è l misur dell vrizione dell concentrzione dell bse che provoc lo spostmento dph del ph dell soluzione. dc b dph dc dph 2 dph 1 0 dc b dc b è grnde dph C b grnde phpiccolo Titolzione di HCl 0.01M: volume di NOH (ml) D.S. Hge. J.D. Crr, Chimic Anlitic e Anlisi Quntittiv.Piccin
2 22/0/2017 Effetto dell pk sull titolzione di un cido debole con un bseforte dph 1 0 dc b dc b è grnde dph D.S. Hge. J.D. Crr, Chimic Anlitic e Anlisi Quntittiv.Piccin 4 Effetto dell pkb sull titolzione di un bse debolecon cido un cidoforte dph 1 0 dc dc è grnde dph D.S. Hge. J.D. Crr, Chimic Anlitic e Anlisi Quntittiv.Piccin 5 Equzione di Henderson Hsselbch cido debole sle con bse forte ph pk log [sle] [cido] 1. Nell regione di potere tmponemssimo 2. Se le concentrzioni delle specie coinvolte non sono troppo piccole (C > 10 - M).Per clcolre il ph di un soluzione tmpone costituit d un cido debole e d un suo sle con un bse forte 6
3 Equzione di Henderson Hsselbch bse debole sle con cido forte ph pk w pk b log [sle] [bse] 1. Nell regione di potere tmponemssimo 2. Se le concentrzioni delle specie coinvolte non sono troppo piccole (C > 10 - M).Per clcolre il ph di un soluzione tmpone formt d un bse debole e d un suo sle con un cido forte 7 ACIDO DEBOLE CH COOH suo SALE con bseforte CH COON Che specie sono presenti in soluzione? CH COON CH COO - N rezione complet CH COOH CH COO - H equilibrio CH COO - H 2 O CH COOH OH - equilibrio BILANCIO DI MASSA C C s = [CH COOH] [CH COO - ] BILANCIO DI CARICA [H ] [N ] = [OH - ] [CH COO - ] 8 [N ] = C s BILANCIO DI CARICA D queste ricvo l concentrzione dello ionecetto [H ] [N ] = [OH - ] [CH COO - ] [CH COO - ] = C s [H ] - [OH - ] BILANCIO DI MASSA C C s = [CH COOH] [CH COO - ] e d queste ricvo l concentrzione dell cido cetico [CH COOH] = C C s C s [H ] [OH - ]= C - {[H ] [OH - ]}..posso quindi risolvere il problem dell stim del ph usndo l equzione dell K [CH [H ]C s [H ] [OH ] K COO ] [H ] [CH COOH] C [H ] [OH ] 9
4 22/05/2017 [H ]C [H ] [OH ] K s C [H ] [OH ] Se [H ] >> [OH - ] - [OH ] può essere trscurto e si ricv [H ]C [H ] s K C [H ] se C e C s >> [H ] K C [H ] C s K C [H ] K [H ]C s C C s pk Log C s ph C 10 ph pk log C s [H ] K C C Cs L concentrzione di ioni H di un soluzione contenente un cido debole concentrzione C e l su bse coniugt in form di sle ll concentrzione C s, dipende solo dl rpporto tr le concentrzioni molri di questi soluti. Se vlgono le pprossimzioni che hnno portto ricvre quest relzione, llor il ph è indipendente dll diluizione dell soluzione. 11 Nel cso di un soluzione tmpone preprt d un bse B in presenz dell cido coniugto debole BH vente costnte di dissocizione K, l equzione che si può ricvre è ph pk log [B] [BH ] Oppure in termini di [OH - ] e poh [OH ] K b C b poh pk b log C s Cs Cb 12 4
5 Equzioni di Henderson-Hsselbch Se vlgono le pprossimzioni I) di operre nell regione di potere tmpone mssimo e II) di vere in soluzione concentrzioni delle specie coinvolte non troppo piccole (C>10 - M), llor il ph delle soluzioni tmpone può essere clcolto usndo queste relzionisemplificte. Tmpone cido debole e bse coniugt Tmpone bse debolee cidoconiugto [H O ] K C C s ph = pk log C s /C [OH ] K b C b C s poh = pk b log C s /C b 1 PROPRIETÀ DELLE SOLUZIONI TAMPONE 5 EFFETTO DELLA DILUIZIONE SUL ph 4 Soluzione tmpone HA MeA ph 2 1 Concentrzione inizile degli nliti = 1M Log(Conc.) 14 EFFETTO DELL AGGIUNTA DI ACIDI O BASI CH COOH è un cido debole (K ~ 10-5 ) L ggiunt ll soluzione di un suo sle (CH COO - ), spost l equilibrio di dissocizione verso sinistr. CH COOH CH COO - H CH COO - è l bse debole di un cido debole (K b ~ 10-9 ). L presenz in soluzione di CH COOH, spost sinistr l equilibrio CH COO - H 2 O CH COOH OH - Aggiunt di cidi ll soluzione tmpone ument l concentrzione di ioni H, m questi regiscono conch COO - CH COO - H CH COOH Aggiunt di bsi ll soluzione tmpone ument l concentrzione di ioni OH - e questi neutrlizzno CH COOH CH COOH OH - CH COO - H 2 O 15 L effetto netto di queste rezioni è che il phrimne qusi costnte
6 Clcolo del ph di un soluzione di cido cetico e sodio cetto (1M) CH COOH CH COO - H O Quntità inizile (M): Quntità regit/formt (M): -x x x Quntità ll equilibrio (M): 1-x 1x x K [H ][CH COO ] [CH COOH ] [H ] K [CH COOH ] [CH COO ] [H ] x si trscur x rispetto 1 1 x [H ] = M ph = 4.74 x = è trscurbile rispetto 1? Si, perchè < Clcolo del ph determinto d un ggiunt di idrossido di sodio tle d introdurre in soluzione 0.02 moli/l di ioni OH - CH COOH OH - CH COO - H 2 O Conc inizile (M): 1-1 Conc ggiunt (M): 0.02 Conc vrit (M): Conc dopo neutrlizz.(m): [H ] K [CH COOH ] [CH COO ] [H ] ph = Clcolo del ph determinto d un ggiunt di HCl tle d introdurre in soluzione 0.02 moli/l di ioni H O. CH COO - H O CH COOH H 2 O Conc inizile (M): 1-1 Conc ggiunt (M): 0.02 Conc vrit (M): Conc dopo neutrlizz (M): [H ] K [CH COOH] [CH COO ] [H ] ph =
7 22/05/2017 Soluzione tmpone di cido cetico e cetto di sodio 1M (CH COOH/CH COON), ph 4.74 NOH 0.02 moli/l ph 4.77 HCl 0.02 moli/l ph Clcolo del ph di un soluzione di NH 0.2M e NH 4 Cl 0.M (K = ) NH 4 H 2 O NH H O [NH ][H O ] [NH 4 ] K K [H O ] [NH 4 ] [NH ] [H O ] 0.2 ph Verifichimo se i conti tornno fcendo il clcolo con l equzione di Henderson-Hsselbch per un soluzione tmpone costituit d un bse debole (NH ) in presenz di un suo sle con un cido forte (NH4, K = ). pk pk pk K b w b Cs poh pk b log Cb K K w C s = 0.M, C b = 0.2M p[oh - ]= -Log( )Log(0./0.2) = 4.9 ph = 9.07 Verific che il risultto dto d equzione K si comptibile con quello dto d HH 21 7
8 Clcolre l vrizione di ph che si h in un soluzione di 400 ml di NH 0.2M e NH 4 Cl 0.M (K = ) in seguito ll ggiunt di ) un liquot d 100 ml di NOH 0.05M; b) un liquot d 100 ml di HCl 0.05M. ) Il ph inizile clcolto er L ggiunt di NOH trsform prte di NH 4 in NH Conc. inizile (moli): - NH 4 OH (0./1000)x400 Conc. ggiunt (moli): NH H 2 O 0.08 (0.2/1000)x400 Conc. vrit (moli): Dopo neutrlizz.(moli): Le concentrzioni finli di NH e NH 4 sono questo punto d riferire l Volume totle di soluzione relizzto: V tot =0.5L [NH ] = n NH /V tot (mol/l)=(0.085/0.5)= 0.170M [NH 4 ] = (0.115/0.5) = 0.20M [NH ][H O ] Dll relzione K ricvo quindi l [H O ] [NH ] [NH 4 ] 0.20 K [H O ] [H O ] [NH ] [H O ] = ph = 9.11 vrizione di ph = = b) L ggiunt di HCl trsform prte di NH dell soluzione tmpone in NH 4 secondo l equilibrio NH H O NH 4 H 2 O Le [NH ] e [NH 4 ] dopo l ggiunt di HCl sono [NH ] = ( ) / 500 = M [NH 4 ] = ( ) / 500 = M [H ] = ( ) / 0.15 = ph = 9.02 Vrizione di ph = =
9 Un soluzione che contiene un coppi coniugt cido-bse mostr in generle vrizioni di ph più modeste dell cqu pur. L crtteristic di un soluzione tmpone di mntenere costnte il proprio ph è direttmente correlt ll concentrzione totle delle specie che formno l coppi cidobse tmpone e l loro rpporto di concentrzione. Negli esempi illustrti, l vrizione di ph dell soluzione tmpone è di unità di ph. L ggiunt dell stess quntità di un bse forte un soluzione non tmpont, vrebbe ftto umentre il ph fino 12 con un vrizione di ph di 2.9 unità. L ggiunt di un cido forte, invece, vrebbe bbssto il ph di lmeno 7 unità. 25 Le soluz ioni tmpone possono essere preprte in modo d controllre il ph di un soluzione in un intervllo di vlori di ph definito dll relzione di Henderson-Hsselbch ph pk log C s Per ogni vrizione del rpporto C s /C pri d un potenz di 10, il ph cmbi di un unità C C s / C ph 100/1 pk 2 10/1 pk 1 1/1 pk 1/10 pk 1 1/100 pk 2 26 Tmponi di uso comune in Chimic Anlitic Acido/Bse coniugt pk IntervllopH Acido formico / Formito HCOOH /HCOO - Acido Acetico / Acetto - CH COOH / CH COO Acido citrico / Citrto C 6 H 8 O 7 / C 6 H 7 O 7 Diidrogenofosfto / Idrogenofosfto - 2- H 2 PO 4 / HPO Acido borico / Tetrborto H BO /B 4 O 7 Ammonio / Ammonic NH 4 /NH Idrogenocrbonto /Crbonto - 2- HCO / CO Idrogenofosfto / Fosfto 2- - HPO 4 / PO
10 22/05/2017 L cpcità di un tmpone dipende non solo dll concentrzione totle dei due componenti del tmpone, m nche dl loro rpporto di concentrzione. ph pk log C s C 28 D.S. Hge, J.D. Crr, Chimic Anlitic e Anlisi Quntittiv. Piccin, Pdov 2012 A un soluzione 0.1M di NH si ggiunge NH 4 Cl in quntità tle d vere ph 9.0. Supponendo trscurbile l vrizione di volume, clcolre l concentrzione di ione mmonio nell soluzione finle (pk bnh = 4.4). L relzionecheinteress è poh pk log C s b C b All equilibrio ph = 9, quindi è immedito ricvreche poh = 14-9 = 5 E dunque posso ricvre C s 5 = 4.4 Log(C s /0.1) 5 = 4.4 (log C s - log 0.1) Sono noti tutti i termini trnne C s = [NH 4 ] log C s = log 0.1 = = C s = = 0.9 = 0.4 M C s = [NH 4 ] = [NH 4 Cl] = 0.4M 0 10
11 2) Si potev comincire considerndo l equilibrio generto in cqu dll bse debole, l mmonic, di cui è dt l pk b [NH 4 ] [OH ] K b [NH ] NH H 2 O NH 4 OH - [NH 4 ] [NH 4 ] 0.4M ) Si potev comincire considerndo l equilibrio generto in cqu dll cido debole, lo ione mmonio, perché dt l pk b = 4.4, si può ricvre l pk e d quest l [NH 4 ]. NH 4 H 2 O NH H O [NH ] [H O ] K [NH 4 ] pk pk w pk b pk K ph 9 [H O ] 10 9 quindi se sostituisco questi dti nell equzione dell K ho 9 [NH 4 ] M [NH 4 ] Clcolre il ph di un soluzione contenente cido cetico 0.10M (pk = 4.7) e cetto di sodio 0.1 M. 1) Si può usre l' equzione di Henderson - Hsselbch ph pk log C s C ph=4.7log(0.1/0.1)= 4.7log(1.)=4.70.1= 4.8 2) Si può ricvre l [H ] dll K [H ][A ] K [HA] pk K [H ] [H ] ph 4.8
12 A 250mL di un soluzione di 0.10M di cido formico (pk.7) si ggiungono.00 g di formito di potssio. Nell ipotesi di un vrizione di volume null, clcolre il ph dell soluzione finle (PM formito di potssio g mol -1 ). Clcolo l concentrzione molre del formito di potssio n HCOOK =.00 g / g mol 1 = moli C HCOOK = ( mol/250ml) (1000mL/L)=0.14mol L -1 (M) A questo punto posso usre l equzione di Henderson-Hsselbch ph pk Log C s.7 Log C Clcolre qule vlore ssume il ph dell soluzione preprt come visto nel precedente esercizio se si ggiungono 10mL di un soluzione di KOH 0.075M. [HCOOH]=0.10M, n HCOOH = 0.10moli/L 0.250L=0.025 mol [HCOOK] = 0.14 M, n HCOOK =0.14moli/L 0.250L=0.06 mol All soluzione sono ggiunte n KOH =0.075moli/L 0.010L = moli di bse forte e queste regiscono neutrlizzndo l cido debole, HCOOH. L cido è in eccesso: ll equilibrio l composizione è n HCOOH = = moli n HCOOk = = moli Quindi ph =.7 log(0.0675/ ) =.9 5 Clcolre il ph dell soluzione ottenut mescolndo 50.0mL di NH 4 OH 1.5M con 150mL di NH 4 Cl 0.60M (pk bnh 4.4). Clcolre che ph h l soluzione se si ggiungono 50mL di HCl 0.060M. [NH 4 OH] i = 1.5 M, n(nh 4 OH)=1.5moli/L 0.050L=0.075 mol [NH 4 Cl] i = 0.60 M, n(nh 4 Cl)= =0.09 mol V totle = 50.0 ml 150 ml = 200mL = 0.2L [NH 4 OH] f = mol / L = 0.75 M [NH 4 Cl] f = 0.09 mol / L = 0.45 M Il ph dell soluzione inizile si clcol dll equzione di Henderson-Hsselbch poh = pk b Log(C s /C b ) poh= 4.4 Log(0.45/0.75)=4.5 ph = = 9.5 6
13 All soluzione tmpone NH 4 Cl/NH 4 OH ph 9.5 sono ggiunte n(hcl)=(0.050 L 0.060moli/L)= 0.00moli di HCl, e queste regiscono con l bse debole NH 4 OH. n(nh 4 OH) = mol NH 4 OH è in eccesso rispetto d HCl e quindi il ph finle deve risultre superiore 7. L composizione dell soluzione dopo l ggiunt di HCl è: n (NH 4 OH) = mol = mol n (NH 4 Cl) = mol = 0.09 mol A questo punto usndo l equzione di Henderson-Hsselbch poh = pk b Log(C s /C b ) si ottiene poh = 4.4 log (0.09 / 0.072) = 4.5 e quindi ph = pk w poh = = A 0.5L di un soluzione 0.1M di CH COOH (pk 4.7) e 0.5M di CH COON si ggiungono 400mL di HCl 1M. Clcolre il ph dell soluzione finle. Volume finle dell soluzione= mL (10 - L/mL)=0.9 L [CH COOH] finle = 0.5 L 0.1 M / 0.9 L = M n(ch COOH) = (0.1 / 1000) 500 = 0.05 moli n(ch COO - ) =(0.05 / 900) 1000 = M [CH COO - ] finle = 0.5 L 0.5 M / 0.9 L = M [HCl] finle = 0.4 L x 1.0 M / 0.9 L = M L cido forte ggiunto è in eccesso rispetto ll bse debole presente nel tmpone. Quindi il ph srà determinto dll eccesso di [H ] introdotto in soluzione con HCl. [H ] finle = M = ph = Clcolre i volumi delle soluzioni I e II necessri per preprre 10mL di un soluzione tmpone ph 5 vente concentrzione di CH COON finle 1M. Soluzione I: CH COOH 2M (K ) Soluzione II: CH COON 2M. Rezioni ed equilibri coinvolti nell preprzione: 1) Solubilizzzione complet dell cetto di sodio CHCOON CHCOO - N 2) Idrolisi del sle di un cido debole con un bse forte CHCOO - H2O CHCOOH OH - K i = [CH COOH] [OH - ]/[CH COO - ]=Kw/K=10-14 / = L incognit è l concentrzione finle (ll equilibrio) di CH COOH relizzt non solo per idrolisi, m soprttutto per l ggiunt di cido debole ll soluzione per ottenere un soluzione tmpone: [CH COOH] = x 9
14 - K i= [CH COOH] [OH ]/[CH COO ]= D quest, siccome [OH ] = 10 M e [CH COO ]=1M, ricvre l [CH COOH] = x: - posso x 10-9 /1= x = 0.55M Quindi il problem or è ricondotto l clcolo ) del volume dell soluzione di cetto di sodio 2M che diluito in 10mL drà un soluzione tmpone concentrzione 1M e b) del volume dell soluzione 2M di cido cetico che devo diluire in 10mL di soluzione tmpone finle in modo t.c. si [CH COOH]=0.55M. ) Clcolo del volume V x di sodio cetto 2M: n f = n i M f V f = M i V i e so che V f = 10mL 0.01L 1M 0.010L = 2M V x L L = x 40 ) Clcolo del volume V y di cido cetico 2M: n f = n i M f V f = M i V i e so che M i = 2M, [CH COOH] = M f = 0.55M, V f = 10mL 0.01L 0.55M 0.010L = 2M V y L L = V y Attenzione! L somm dei due volumi però non è 10mL, inftti V(CH COON) = L 5 ml V(CH COOH) = L 2.75 ml V totle = 7.75 ml si port l volume finle richiesto con cqu. Per preprre l soluzione tmpone richiest, occorrono 5 ml di soluzione I di sodio cetto 2M e 2.75 ml di soluzione II di cido cetico 2M, e quindi si port l volume finle richiesto di 10 ml con 2.25mL di cqu. 41 Sistemi tmpone di cidi diprotici Un tmpone formto d un cido diprotico è trttto come un tmpone formto d un cido monoprotico tenendo presenti le osservzioni ftte sugli equilibri di specie che scmbino più di un protone. 42
15 Determinre qunto idrogenofosfto di sodio diidrto (N 2 HPO 4 2H 2 O, PM g mol -1 ) e qunto diidrogenofosfto di potssio (KH 2 PO 4, PM g mol -1 ) occorrono per preprre 1 L di un soluzione tmpone ph 7 vente un concentrzione totle di fosfto pri 0.2M. K 2 (H PO 4 ) è L coppi coniugt cido-bse è costituit d H PO - e HPO 2- in equilibrio secondo l rezionecido-bse governt dll K 2 H - 2-2PO 4 H 2 O HPO 4 H [HPO 2 4 ] [H ] [H PO ] [H ][HPO 2 4 ] K 2 [HPO 2 4 ] K 2 [H PO ] [H ] [H PO ] 2 4 ph 7 si h [H ] 10-7 e quindi [HPO 2 ] [H 2PO 4 ] Inoltre deve vlere l condizione dt per l preprzione dell soluzione tmpone : [HPO 4 ] [H 2 PO 4 ] 0.2M A questo punto ho 2 equzioni e 2 incognite e posso clcolre [HPO 4 ] 0.12M e [H 2 PO 4 ] 0.08M 44 Clcolte le concentrzioni dei due componenti dell soluzione tmpone espresse in moli/l, si deve moltiplicre per il PM (in g/mole) che, in questo cso poiché il volume finle dell soluzione è di 1L, dà i g di ciscun sle dpesre. Q(H 2PO 4) 0.08 moli g g mole L Q(HPO 2 4 ) 0.12 moli g 21.6 g L e mol 45
16 Clcolre qunti grmmi di N 2 CO bisogn ggiungere 1.5L di NHCO 0.2M, per ottenere un soluzione tmpone ph = 10. K (HCO - ) = Per il tmpone N 2 CO / NHCO l equilibrio che interess è HCO - H O CO 2- H O 2 K = = [CO ] [H O ] / [HCO ] 2- - ph = 10 [H O ] eq = [CO 2- ] - eq=k [HCO ]/[H O ]=( ) (0.2)/10-10 = 0.094M moli /L moli in 1.5 L moli x PM N2CO (105.97) = g
17
C A 10 [HA] C 0 > 100 K
![C A 10 [HA] C 0 > 100 K C A 10 [HA] C 0 > 100 K](/thumbs/57/41095576.jpg) Soluzioni Tmpone Le soluzioni tmpone sono soluzioni in cui sono presenti un cido debole e l su bse coniugt sotto form di sle molto solubile. Hnno l crtteristic di mntenere il ph qusi costnte nche se d
Soluzioni Tmpone Le soluzioni tmpone sono soluzioni in cui sono presenti un cido debole e l su bse coniugt sotto form di sle molto solubile. Hnno l crtteristic di mntenere il ph qusi costnte nche se d
TITOLAZIONI ACIDO-BASE
 TITOLAZIONI ACIDO-BASE Soluzioni stndrd Le soluzioni stndrd impiegte nelle titolzioni di neutrlizzzione sono cidi forti o bsi forti poiché queste sostnze regiscono completmente con l nlit, fornendo in
TITOLAZIONI ACIDO-BASE Soluzioni stndrd Le soluzioni stndrd impiegte nelle titolzioni di neutrlizzzione sono cidi forti o bsi forti poiché queste sostnze regiscono completmente con l nlit, fornendo in
EQUILIBRI ACIDO-BASE. ione idronio La reazione viene spesso scritta in forma semplificata:
 EQUILIBRI ACIDOBASE Dissocizione di un cido forte in cqu: HCl(g) HO(l) Cl (q) H3O (q) ione idronio L rezione viene spesso scritt in form semplifict: HCl(g) Cl (q) H (q) H di per sé (protone liero!) non
EQUILIBRI ACIDOBASE Dissocizione di un cido forte in cqu: HCl(g) HO(l) Cl (q) H3O (q) ione idronio L rezione viene spesso scritt in form semplifict: HCl(g) Cl (q) H (q) H di per sé (protone liero!) non
Esercizi sulle Reazioni Acido-Base
 Insegnmento di himic Generle 08344 - S I e MT.. 015/016 (I Semestre) Esercizi sulle Rezioni cido-bse Prof. ttilio itterio Diprtimento MI Giulio Ntt http://ismp.chem.polimi.it/citterio Sistemi cido-bse
Insegnmento di himic Generle 08344 - S I e MT.. 015/016 (I Semestre) Esercizi sulle Rezioni cido-bse Prof. ttilio itterio Diprtimento MI Giulio Ntt http://ismp.chem.polimi.it/citterio Sistemi cido-bse
Grado di dissociazione = = x/ha = 0,031 [A - ] che reagisce con l acqua in una soluzione 0,10 M : Grado di associazione = = x/a - = 3,2 x 10-5
![Grado di dissociazione = = x/ha = 0,031 [A - ] che reagisce con l acqua in una soluzione 0,10 M : Grado di associazione = = x/a - = 3,2 x 10-5 Grado di dissociazione = = x/ha = 0,031 [A - ] che reagisce con l acqua in una soluzione 0,10 M : Grado di associazione = = x/a - = 3,2 x 10-5](/thumbs/73/68577646.jpg) Un soluzione tmpone è un soluzione che non subisce vrizioni di ph qundo si ggiungono moderte quntità di cidi o bsi oppure qundo viene diluit. Ess è costituit d un miscel di un cido debole e dell su bse
Un soluzione tmpone è un soluzione che non subisce vrizioni di ph qundo si ggiungono moderte quntità di cidi o bsi oppure qundo viene diluit. Ess è costituit d un miscel di un cido debole e dell su bse
Esercizi sulle Reazioni Acido-Base
 Insegnmento di himic Generle 08344 - S I e MT Esercizi sulle Rezioni cido-bse Prof. ttilio itterio Diprtimento MI Giulio Ntt http://iscmp.chem.polimi.it/citterio/eduction/generl-chemistry-exercises/ Sistemi
Insegnmento di himic Generle 08344 - S I e MT Esercizi sulle Rezioni cido-bse Prof. ttilio itterio Diprtimento MI Giulio Ntt http://iscmp.chem.polimi.it/citterio/eduction/generl-chemistry-exercises/ Sistemi
EQUILIBRI ACIDO-BASE
 EQUILIBRI ACIDO-BASE N.B. Tlvolt, per semplicità, nell trttzione si utilizzerà l notzione H + per il protone idrto in cqu m si ricordi che l form corrett è H 3 O + (q). Acidi e si secondo Arrhenius cido:
EQUILIBRI ACIDO-BASE N.B. Tlvolt, per semplicità, nell trttzione si utilizzerà l notzione H + per il protone idrto in cqu m si ricordi che l form corrett è H 3 O + (q). Acidi e si secondo Arrhenius cido:
Sali come acidi o basi: Idrolisi. Un sale è costituito dall anionediunacido e dalcationediunabase Tutti i sali sono elettroliti forti.
 Sli come cidi o i: Idrolii Un le è cotituito dll nionediuncido e dlctionediune Tutti i li ono elettroliti forti. NOH Hl Nl H 2 O OH HNO 2 NO 2 H 2 O 3 (OH) 2 2 H 3 PO 4 3 (PO 4 ) 2 6 H 2 O NH 3 HBr NH
Sli come cidi o i: Idrolii Un le è cotituito dll nionediuncido e dlctionediune Tutti i li ono elettroliti forti. NOH Hl Nl H 2 O OH HNO 2 NO 2 H 2 O 3 (OH) 2 2 H 3 PO 4 3 (PO 4 ) 2 6 H 2 O NH 3 HBr NH
Titolazione Acido Debole Base Forte. La reazione che avviene nella titolazione di un acido debole HA con una base forte NaOH è:
 Titolzione Acido Debole Bse Forte L rezione che vviene nell titolzione di un cido debole HA con un bse forte NOH è: HA(q) NOH(q) N (q) A (q) HO Per quest rezione l costnte di equilibrio è: 1 = = >>1 w
Titolzione Acido Debole Bse Forte L rezione che vviene nell titolzione di un cido debole HA con un bse forte NOH è: HA(q) NOH(q) N (q) A (q) HO Per quest rezione l costnte di equilibrio è: 1 = = >>1 w
Grado di dissociazione = = x/ha = 0,031 [A - ] che reagisce con l acqua in una soluzione 0,10 M : Grado di associazione = = x/a - = 3,2 x 10-5
![Grado di dissociazione = = x/ha = 0,031 [A - ] che reagisce con l acqua in una soluzione 0,10 M : Grado di associazione = = x/a - = 3,2 x 10-5 Grado di dissociazione = = x/ha = 0,031 [A - ] che reagisce con l acqua in una soluzione 0,10 M : Grado di associazione = = x/a - = 3,2 x 10-5](/thumbs/59/43898306.jpg) Un soluzione tmpone è un soluzione che non subisce vrizioni di ph qundo si ggiungono moderte quntità di cidi o bsi oppure qundo viene diluit. Ess è costituit d un miscel di un cido debole e dell su bse
Un soluzione tmpone è un soluzione che non subisce vrizioni di ph qundo si ggiungono moderte quntità di cidi o bsi oppure qundo viene diluit. Ess è costituit d un miscel di un cido debole e dell su bse
ESERCITAZIONE SECONDO PREESAME
 ESERCITAZIE SECD REESAME 1) Clcolre il peso molecolre di un sostnz A poco voltile che form un soluzione con il benzene spendo che qundo 18.5 g di A sono sciolti in 85.8 g di benzene, l soluzione congel
ESERCITAZIE SECD REESAME 1) Clcolre il peso molecolre di un sostnz A poco voltile che form un soluzione con il benzene spendo che qundo 18.5 g di A sono sciolti in 85.8 g di benzene, l soluzione congel
Il ph. Calcolo del ph
 Clcolo del ph Acidi forti In soluzioni cquose diluite (quntità inferiori d 1 M) l'cido forte è completmente ionizzto. HA + H 2 O H 3 O + + A - Abbimo quindi: [H 3 O + ] = [HA] = C ph = - log [H 3 O + ]
Clcolo del ph Acidi forti In soluzioni cquose diluite (quntità inferiori d 1 M) l'cido forte è completmente ionizzto. HA + H 2 O H 3 O + + A - Abbimo quindi: [H 3 O + ] = [HA] = C ph = - log [H 3 O + ]
[ ] [ ][ H 3 [ A " -SOLUZIONI TAMPONE- [ ] OH " O + K A = A" K i = HA K W = [ H 3
![[ ] [ ][ H 3 [ A -SOLUZIONI TAMPONE- [ ] OH O + K A = A K i = HA K W = [ H 3 [ ] [ ][ H 3 [ A -SOLUZIONI TAMPONE- [ ] OH O + K A = A K i = HA K W = [ H 3](/thumbs/70/62259175.jpg) -SOLUZIONI TAMPONE- Quando abbiamo in soluzione un acido debole ed il suo sale con una base forte ci sono da considerare 3 equilibri in soluzione: 1. HA + H 2 O A - + H 3 2. A - + H 2 O HA + OH - 3. 2H
-SOLUZIONI TAMPONE- Quando abbiamo in soluzione un acido debole ed il suo sale con una base forte ci sono da considerare 3 equilibri in soluzione: 1. HA + H 2 O A - + H 3 2. A - + H 2 O HA + OH - 3. 2H
Calcoli su Sistemi Acido/Base (Consigliata la stampa di 4 lucidi per foglio!)
 Scuol di Ingegneri Industrile e dell Informzione Insegnmento di Chimic Generle 08344 - CCS CHI e MAT Clcoli su Sistemi Acido/Bse (Consiglit l stmp di 4 lucidi per foglio!) Prof. Diprtimento CMIC Giulio
Scuol di Ingegneri Industrile e dell Informzione Insegnmento di Chimic Generle 08344 - CCS CHI e MAT Clcoli su Sistemi Acido/Bse (Consiglit l stmp di 4 lucidi per foglio!) Prof. Diprtimento CMIC Giulio
Acidi Deboli. Si definisce acido debole un acido con K a < 1 che risulta perciò solo parzialmente dissociato in soluzione. Esempi di acidi deboli:
 Acidi Deboli Si definisce cido debole un cido con < 1 che risult perciò solo przilmente dissocito in soluzione. Esempi di cidi deboli: Acido cetico (H OOH) 1.75 1-5 Acido scorbico (vitmin ) 1 6.76 1-5.5
Acidi Deboli Si definisce cido debole un cido con < 1 che risult perciò solo przilmente dissocito in soluzione. Esempi di cidi deboli: Acido cetico (H OOH) 1.75 1-5 Acido scorbico (vitmin ) 1 6.76 1-5.5
CALCOLO DEL ph. ph = - log [1,0x10-3 ] = 3,00
![CALCOLO DEL ph. ph = - log [1,0x10-3 ] = 3,00 CALCOLO DEL ph. ph = - log [1,0x10-3 ] = 3,00](/thumbs/68/59131328.jpg) CALCOLO DEL ph Calcolare il ph di una soluzione di HCl 1,0x10-3 M HCl acido forte che si dissocia completamente HCl H + + Cl - 1 mol di HCl produce 1 mol di H + ph = - log [1,0x10-3 ] = 3,00 Tipici acidi
CALCOLO DEL ph Calcolare il ph di una soluzione di HCl 1,0x10-3 M HCl acido forte che si dissocia completamente HCl H + + Cl - 1 mol di HCl produce 1 mol di H + ph = - log [1,0x10-3 ] = 3,00 Tipici acidi
Elettrolita forte = specie chimica che in soluzione si dissocia completamente (l equilibrio di dissociazione è completamente spostato verso destra)
 A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
NH 3 + H 2 O NH. Gli OH - sono solo quelli provenienti dalla base, perché quelli dell acqua sono molto pochi.
 D71 La costante di dissociazione ionica dell ammoniaca in acqua è uguale a 1.8 10 5. Determinare (a) il grado di dissociazione e (b) la concentrazione in ioni OH d una soluzione di NH 3 0.08 M. NH 3 +
D71 La costante di dissociazione ionica dell ammoniaca in acqua è uguale a 1.8 10 5. Determinare (a) il grado di dissociazione e (b) la concentrazione in ioni OH d una soluzione di NH 3 0.08 M. NH 3 +
-DEFINIZIONE DI ACIDI E BASI-
 -DEFINIZIONE DI ACIDI E BASI- DEFINIZIONE DI ARRHENIUS ACIDO: rilascia ioni H + HCl H + + Cl - BASE: rilascia ioni OH - NaOH Na + + OH - DEFINIZIONE DI BRÖNSTED ACIDO: rilascia ioni H + BASE: lega ioni
-DEFINIZIONE DI ACIDI E BASI- DEFINIZIONE DI ARRHENIUS ACIDO: rilascia ioni H + HCl H + + Cl - BASE: rilascia ioni OH - NaOH Na + + OH - DEFINIZIONE DI BRÖNSTED ACIDO: rilascia ioni H + BASE: lega ioni
ESERCIZI SUL ph 3 0,002 0,2 13. 2. Completa la seguente tabella relativa a acidi o basi deboli.
 ESERCIZI SUL ph Livello difficoltà 1 1. Completa la tabella relativa a soluzioni di acidi o basi forti. 1 11 ph poh [H + ] [OH - ] 3 0,002 0,2 13 2 2. Completa la seguente tabella relativa a acidi o basi
ESERCIZI SUL ph Livello difficoltà 1 1. Completa la tabella relativa a soluzioni di acidi o basi forti. 1 11 ph poh [H + ] [OH - ] 3 0,002 0,2 13 2 2. Completa la seguente tabella relativa a acidi o basi
2) L acido ipocloroso (HClO) è un acido debole e quindi all equilibrio sarà parzialmente dissociato:
 Ordinre econdo il vlore di ph crecente le eguenti oluzioni venti tutte concentrzione - : 1. Nl. HlO (.0-8 ). NOH. Hl 5. NlO 6. NH ( 1.8-5 ) 7. NH l 1) L prim oluzione contiene cloruro di odio che è un
Ordinre econdo il vlore di ph crecente le eguenti oluzioni venti tutte concentrzione - : 1. Nl. HlO (.0-8 ). NOH. Hl 5. NlO 6. NH ( 1.8-5 ) 7. NH l 1) L prim oluzione contiene cloruro di odio che è un
 2NH3(g) Pa(Ag)=108 Pa(I)=127 pf(agi)=235 -> S(g/l) =S(m/l) pf = 9.2 10-9 235 =2162 10-9 = 2.16 10-6 (g/l) Effetto del ph Anche il ph può influenzare la solubilità di un sale poco solubile. E ciò
2NH3(g) Pa(Ag)=108 Pa(I)=127 pf(agi)=235 -> S(g/l) =S(m/l) pf = 9.2 10-9 235 =2162 10-9 = 2.16 10-6 (g/l) Effetto del ph Anche il ph può influenzare la solubilità di un sale poco solubile. E ciò
SOLUZIONI TAMPONE SOLUZIONI TAMPONE
 SOLUZIONI TAMPONE Le soluzioni tampone (o tamponi) sono costituite da: un acido debole e un suo sale (tampone acido) oppure una base debole e un suo sale (tampone basico) Una soluzione di un acido debole
SOLUZIONI TAMPONE Le soluzioni tampone (o tamponi) sono costituite da: un acido debole e un suo sale (tampone acido) oppure una base debole e un suo sale (tampone basico) Una soluzione di un acido debole
EQUILIBRI ACIDO-BASE: ESERCIZI RISOLTI. Dott. Francesco Musiani
 EQUILIBRI ACIDO-BASE: ESERCIZI RISOLTI Dott. Francesco Musiani Versione aggiornata al 23.1.2017 1 - Calcolare il poh di soluzioni aventi le seguenti concentrazioni di H 3 O + : 1) 3,1 10-2 M; 2) 1,0 10-4
EQUILIBRI ACIDO-BASE: ESERCIZI RISOLTI Dott. Francesco Musiani Versione aggiornata al 23.1.2017 1 - Calcolare il poh di soluzioni aventi le seguenti concentrazioni di H 3 O + : 1) 3,1 10-2 M; 2) 1,0 10-4
AUTOIONIZZAZIONE DELL ACQUA
 AUTOIONIZZAZIONE DELL ACQUA H 2 O si comporta da acido e da base anfiprotica CH 3 COOH + H 2 O CH 3 COO - + H 3 O + NH 3 +H 2 O NH 4 + + OH - A1 B2 H 2 O + H 2 O H 3 O + + OH - B1 A1 K eq [ H O ][ OH 3
AUTOIONIZZAZIONE DELL ACQUA H 2 O si comporta da acido e da base anfiprotica CH 3 COOH + H 2 O CH 3 COO - + H 3 O + NH 3 +H 2 O NH 4 + + OH - A1 B2 H 2 O + H 2 O H 3 O + + OH - B1 A1 K eq [ H O ][ OH 3
PON C4 "LE SCIENZE IN GARA!"
 PON C4 "LE SCIENZE IN GARA!" Approfondimenti di Chimica e Biologia: ph, poh, soluzioni tampone, acidi monoprotici e poliprotici, acido acetico, acetati, ammine, ammidi. prof. Ciro Formica Calcolo della
PON C4 "LE SCIENZE IN GARA!" Approfondimenti di Chimica e Biologia: ph, poh, soluzioni tampone, acidi monoprotici e poliprotici, acido acetico, acetati, ammine, ammidi. prof. Ciro Formica Calcolo della
. G EN E ER E ALIZ I ZATA TIT I OLAZIO I NI
 1 TEORIA GENERALIZZATA DELLE TITOLAZIONI Approccio trdizionle ll insegnmento dei metodi titrimetrici: Trttmento mtemtico degli equilibri in soluzione lcolo dell concentrzione di tutte le specie in soluzione
1 TEORIA GENERALIZZATA DELLE TITOLAZIONI Approccio trdizionle ll insegnmento dei metodi titrimetrici: Trttmento mtemtico degli equilibri in soluzione lcolo dell concentrzione di tutte le specie in soluzione
Integrali de niti. Il problema del calcolo di aree ci porterà alla de nizione di integrale de nito.
 Integrli de niti. Il problem di clcolre l re di un regione pin delimitt d gr ci di funzioni si può risolvere usndo l integrle de nito. L integrle de nito st l problem del clcolo di ree come l equzione
Integrli de niti. Il problem di clcolre l re di un regione pin delimitt d gr ci di funzioni si può risolvere usndo l integrle de nito. L integrle de nito st l problem del clcolo di ree come l equzione
{ 3 x y=4. { x=2. Sistemi di equazioni
 Sistemi di equzioni Definizione Un sistem è un insieme di equzioni che devono essere verificte contempornemente, cioè devono vere contempornemente le stesse soluzioni. Definimo grdo di un sistem il prodotto
Sistemi di equzioni Definizione Un sistem è un insieme di equzioni che devono essere verificte contempornemente, cioè devono vere contempornemente le stesse soluzioni. Definimo grdo di un sistem il prodotto
La chimica degli acidi e delle basi 2
 La chimica degli acidi e delle basi 2 ph - log 10 [H O poh - log 10 [OH - a 25 C W [H O x[oh - 1.0x10-14 M 2 ph poh 14 1 lcune immagini sono state prese e modificate da Chimica di otz, Treichel & Weaver,
La chimica degli acidi e delle basi 2 ph - log 10 [H O poh - log 10 [OH - a 25 C W [H O x[oh - 1.0x10-14 M 2 ph poh 14 1 lcune immagini sono state prese e modificate da Chimica di otz, Treichel & Weaver,
Esercitazione Dicembre 2014
 Esercitzione 10 17 Dicembre 2014 Esercizio 1 Un economi chius è crtterizzt di seguenti dti: A = 400 M = 250 γ = 1.5 (moltiplictore dell politic fiscle) β = 0.8 moltiplictore dell politic monetri z = 0.25
Esercitzione 10 17 Dicembre 2014 Esercizio 1 Un economi chius è crtterizzt di seguenti dti: A = 400 M = 250 γ = 1.5 (moltiplictore dell politic fiscle) β = 0.8 moltiplictore dell politic monetri z = 0.25
Unità 3 Metodi particolari per il calcolo di reti
 Unità 3 Metodi prticolri per il clcolo di reti 1 Cos c è nell unità Metodi prticolri per il clcolo di reti con un solo genertore Prtitore di tensione Prtitore di corrente Metodi di clcolo di reti con più
Unità 3 Metodi prticolri per il clcolo di reti 1 Cos c è nell unità Metodi prticolri per il clcolo di reti con un solo genertore Prtitore di tensione Prtitore di corrente Metodi di clcolo di reti con più
FORZA DI ACIDI E BASI HA + :B HB + + A
 FORZA DI ACIDI E BASI n La forza di un acido è la misura della tendenza di una sostanza a cedere un protone. n La forza di una base è una misura dell'affinità di un composto ad accettare un protone. n
FORZA DI ACIDI E BASI n La forza di un acido è la misura della tendenza di una sostanza a cedere un protone. n La forza di una base è una misura dell'affinità di un composto ad accettare un protone. n
mentre l'acetato di sodio si dissocia completamente:
 Un sistema tampone è un sistema che impedisce (o attuisce) significative variazioni di ph per aggiunta di limitate quantità di acidi o basi. Per poter funzionare in entrambi le direzioni, cioè neutralizzare
Un sistema tampone è un sistema che impedisce (o attuisce) significative variazioni di ph per aggiunta di limitate quantità di acidi o basi. Per poter funzionare in entrambi le direzioni, cioè neutralizzare
LEGGE di AZIONE di MASSA
 LEGGE di AZIONE di MASSA Lo stato di equilibrio di una reazione chimica è rappresentata dalla concentrazione di reagenti e prodotti tali da soddisfare una opportuna relazione matematica: a A + b B + c
LEGGE di AZIONE di MASSA Lo stato di equilibrio di una reazione chimica è rappresentata dalla concentrazione di reagenti e prodotti tali da soddisfare una opportuna relazione matematica: a A + b B + c
corrispondenza dal piano in sé, che ad ogni punto P del piano fa corrispondere il punto P' in
 Cpitolo 5 Le omotetie 5. Richimi di teori Definizione Sino fissti un punto C del pino ed un numero rele. Si chim omoteti di centro C e rpporto ( che si indic con il simolo O, ) l corrispondenz dl pino
Cpitolo 5 Le omotetie 5. Richimi di teori Definizione Sino fissti un punto C del pino ed un numero rele. Si chim omoteti di centro C e rpporto ( che si indic con il simolo O, ) l corrispondenz dl pino
Soluzioni Acido Base Definizione di Brønsted
 acido + base sale + acqua Soluzioni Acido Base Definizione di Brønsted acido: sostanza capace di donare protoni* HCl + H 2 O Cl + H 3 O + * In soluzione, il protone esiste in forma idratata (H 3 O + )
acido + base sale + acqua Soluzioni Acido Base Definizione di Brønsted acido: sostanza capace di donare protoni* HCl + H 2 O Cl + H 3 O + * In soluzione, il protone esiste in forma idratata (H 3 O + )
Chimica (a.a. 2011/2012, 6CFU) Equilibri ionici in soluzione acquosa (I parte):
 Chimic (.. 011/01, 6CFU) Equiliri ionici in soluzione cquos (I prte): Acidi e Bsi: l teori di Brönsted-Lowry Forz reltiv di cidi e si Autoionizzzione (utodissocizione) dell cqu Il ph e il poh Clcolo del
Chimic (.. 011/01, 6CFU) Equiliri ionici in soluzione cquos (I prte): Acidi e Bsi: l teori di Brönsted-Lowry Forz reltiv di cidi e si Autoionizzzione (utodissocizione) dell cqu Il ph e il poh Clcolo del
Idrolisi salina. HCl + NaOH NaCl + H 2 O. In acqua i sali si dissociano nei loro ioni i quali si circondano di molecole
 Idrolisi salina I sali sono solidi ionici che si comportano in soluzione come elettroliti forti. Sappiamo anche che i sali possono venire considerati come sostanze neutre che si ottengono dalla reazione
Idrolisi salina I sali sono solidi ionici che si comportano in soluzione come elettroliti forti. Sappiamo anche che i sali possono venire considerati come sostanze neutre che si ottengono dalla reazione
VOLUMI, MASSE, DENSITÀ
 VOLUMI, MASSE, DENSITÀ In clsse è già stt ftt un'esperienz di misur dell densità prtire d misure di mss e di volume. In quel cso è stt misurt l mss in mnier dirett con un bilnci, e il volume in mnier indirett.
VOLUMI, MASSE, DENSITÀ In clsse è già stt ftt un'esperienz di misur dell densità prtire d misure di mss e di volume. In quel cso è stt misurt l mss in mnier dirett con un bilnci, e il volume in mnier indirett.
Arrhenius. HCl H + + Cl - NaOH Na + + OH -
 Arrhenius Un acido è una sostanza che contiene H ed è in grado di cedere ioni H + e base è una sostanza che ha tendenza a cedere ioni OH - in acqua H 2 O HCl H + + Cl - H 2 O NaOH Na + + OH - Reazione
Arrhenius Un acido è una sostanza che contiene H ed è in grado di cedere ioni H + e base è una sostanza che ha tendenza a cedere ioni OH - in acqua H 2 O HCl H + + Cl - H 2 O NaOH Na + + OH - Reazione
EQUILIBRI IN SOLUZIONE ACQUOSA
 Dispense CHIMICA GENERALE E ORGANICA (STAL) 010/11 Prof. P. Crloni EQUILIBRI IN SOLUZIONE ACQUOSA Qundo si prl di rezioni di equilirio dei composti inorgnici, un considerzione prticolre viene rivolt lle
Dispense CHIMICA GENERALE E ORGANICA (STAL) 010/11 Prof. P. Crloni EQUILIBRI IN SOLUZIONE ACQUOSA Qundo si prl di rezioni di equilirio dei composti inorgnici, un considerzione prticolre viene rivolt lle
COLPO D ARIETE: MANOVRE DI CHIUSURA
 Università degli studi di Rom Tor Vergt Corso di Idrulic. Prof. P. Smmrco COLPO D ARIETE: MANOVRE DI CHIUSURA Appunti integrtivi l testo E. Mrchi, A. Rubtt - Meccnic dei Fluidi dlle lezioni del prof. P.
Università degli studi di Rom Tor Vergt Corso di Idrulic. Prof. P. Smmrco COLPO D ARIETE: MANOVRE DI CHIUSURA Appunti integrtivi l testo E. Mrchi, A. Rubtt - Meccnic dei Fluidi dlle lezioni del prof. P.
Soluti in acqua. Elettroliti. Non elettroliti
 Soluti in acqua Elettroliti Forti Dissociazione Elettrolitica COMPLETA Soluto Deboli Dissociazione Elettrolitica NON COMPLETA Non elettroliti Dissociazione Elettrolitica NaCl (s) + acqua Na + (aq) + Cl
Soluti in acqua Elettroliti Forti Dissociazione Elettrolitica COMPLETA Soluto Deboli Dissociazione Elettrolitica NON COMPLETA Non elettroliti Dissociazione Elettrolitica NaCl (s) + acqua Na + (aq) + Cl
HCl è un acido NaOH è una base. HCl H + + Clˉ NaOH Na + + OHˉ. Una reazione acido-base di Arrhenius forma acqua e un sale. HCl + NaOH H 2 O + NaCl
 Secondo Arrhenius un acido è una sostanza che dissociandosi in acqua libera protoni (H + ). Una base è una sostanza che dissociandosi in acqua libera ioni ossidrile (OHˉ). H 2 O HCl H + + Clˉ H 2 O NaOH
Secondo Arrhenius un acido è una sostanza che dissociandosi in acqua libera protoni (H + ). Una base è una sostanza che dissociandosi in acqua libera ioni ossidrile (OHˉ). H 2 O HCl H + + Clˉ H 2 O NaOH
ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione
![ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione](/thumbs/57/40353116.jpg) ESERCIZI 1) Il prodotto ionico dell acqua (K w ) vale 10-14 : a. a qualunque temperatura b. solo per una soluzione acida c. solo per una soluzione basica d. solo a T = 25 C 2) Per l acqua pura risulta
ESERCIZI 1) Il prodotto ionico dell acqua (K w ) vale 10-14 : a. a qualunque temperatura b. solo per una soluzione acida c. solo per una soluzione basica d. solo a T = 25 C 2) Per l acqua pura risulta
Brady Senese Pignocchino Chimica.blu Zanichelli 2014 Soluzione degli esercizi Capitolo 22
 Brady Senese Pignocchino Chimica.blu Zanichelli 014 Soluzione degli esercizi Capitolo Esercizio Risposta PAG 515 ES 1 Basica, a causa dell idrolisi dell anione (base coniugata di un acido debole). PAG
Brady Senese Pignocchino Chimica.blu Zanichelli 014 Soluzione degli esercizi Capitolo Esercizio Risposta PAG 515 ES 1 Basica, a causa dell idrolisi dell anione (base coniugata di un acido debole). PAG
ESPONENZIALI E LOGARITMI
 Esponenzili e logritmi ESPONENZIALI E LOGARITMI Potenze Fino d or si sono definite le potenze d esponenete intero e rzionle (si positivi che negtivi). Ripssimo le definizioni e i concetti che li rigurdno:
Esponenzili e logritmi ESPONENZIALI E LOGARITMI Potenze Fino d or si sono definite le potenze d esponenete intero e rzionle (si positivi che negtivi). Ripssimo le definizioni e i concetti che li rigurdno:
2 x = 64 (1) L esponente (x) a cui elevare la base (2) per ottenere il numero 64 è detto logaritmo (logaritmo in base 2 di 64), indicato così:
 Considerimo il seguente problem: si vuole trovre il numero rele tle che: = () L esponente () cui elevre l bse () per ottenere il numero è detto ritmo (ritmo in bse di ), indicto così: In prticolre in questo
Considerimo il seguente problem: si vuole trovre il numero rele tle che: = () L esponente () cui elevre l bse () per ottenere il numero è detto ritmo (ritmo in bse di ), indicto così: In prticolre in questo
m kg M. 2.5 kg
 4.1 Due blocchi di mss m = 720 g e M = 2.5 kg sono posti uno sull'ltro e sono in moto sopr un pino orizzontle, scbro. L mssim forz che può essere pplict sul blocco superiore ffinchè i blocchi si muovno
4.1 Due blocchi di mss m = 720 g e M = 2.5 kg sono posti uno sull'ltro e sono in moto sopr un pino orizzontle, scbro. L mssim forz che può essere pplict sul blocco superiore ffinchè i blocchi si muovno
Ki = [AcH][OH ] [H3O + ] = Kw [Ac ] [H3O + ] Ka
![Ki = [AcH][OH ] [H3O + ] = Kw [Ac ] [H3O + ] Ka Ki = [AcH][OH ] [H3O + ] = Kw [Ac ] [H3O + ] Ka](/thumbs/63/49237579.jpg) Cap.11 Reazioni di idrolisi - Soluzioni saline I sali, che allo stato solido posseggono un reticolo ionico, sono composti ionici ottenibili dalla reazione di neutralizzazione di un acido + una base. Sono
Cap.11 Reazioni di idrolisi - Soluzioni saline I sali, che allo stato solido posseggono un reticolo ionico, sono composti ionici ottenibili dalla reazione di neutralizzazione di un acido + una base. Sono
Esercitazione 8. Gli equilibri acido-base: Ka, Kb. L autoprotolisi dell acqua. Misura del ph Soluzioni tampone 1,0 10-14
 Esercitazione 8 Misura del ph Soluzioni tampone Gli equilibri acido-base: Ka, Kb HA + H 2 O! H 3 O + + A - Ka = [H 3 O+ ][A - ] [HA] A - + H 2 O! OH - + HA Kb = [OH- ][HA] [A - ] Ka Kb = [ H 3 O + ] [
Esercitazione 8 Misura del ph Soluzioni tampone Gli equilibri acido-base: Ka, Kb HA + H 2 O! H 3 O + + A - Ka = [H 3 O+ ][A - ] [HA] A - + H 2 O! OH - + HA Kb = [OH- ][HA] [A - ] Ka Kb = [ H 3 O + ] [
, x 2. , x 3. è un equazione nella quale le incognite appaiono solo con esponente 1, ossia del tipo:
 Sistemi lineri Un equzione linere nelle n incognite x 1, x 2, x,, x n è un equzione nell qule le incognite ppiono solo con esponente 1, ossi del tipo: 1 x 1 + 2 x 2 + x +!+ n x n = b con 1, 2,,, n numeri
Sistemi lineri Un equzione linere nelle n incognite x 1, x 2, x,, x n è un equzione nell qule le incognite ppiono solo con esponente 1, ossi del tipo: 1 x 1 + 2 x 2 + x +!+ n x n = b con 1, 2,,, n numeri
Ionizzazione spontanea dell acqua: autoprotolisi o autoionizzazione dell acqua. [ H ] 2
![Ionizzazione spontanea dell acqua: autoprotolisi o autoionizzazione dell acqua. [ H ] 2 Ionizzazione spontanea dell acqua: autoprotolisi o autoionizzazione dell acqua. [ H ] 2](/thumbs/57/40353351.jpg) Equilibri ionici in soluzione acquosa L acqua, anche se purissima, rivela una conducibilità elettrica piccola ma misurabile che indica la presenza di ioni. Una ridotta frazione di molecole di acqua è dissociata
Equilibri ionici in soluzione acquosa L acqua, anche se purissima, rivela una conducibilità elettrica piccola ma misurabile che indica la presenza di ioni. Una ridotta frazione di molecole di acqua è dissociata
L idrolisi salina. Vi sono sali che sciolti in acqua, impartiscono alla soluzione una reazione acida o basica.
 L idrolisi salina Abbiamo imparato che i sali sono solidi ionici che si comportano in soluzione come elettroliti forti. Sappiamo anche che i sali possono venire considerati come sostanze neutre che si
L idrolisi salina Abbiamo imparato che i sali sono solidi ionici che si comportano in soluzione come elettroliti forti. Sappiamo anche che i sali possono venire considerati come sostanze neutre che si
Equazioni di 2 grado. Definizioni Equazioni incomplete Equazione completa Relazioni tra i coefficienti della equazione e le sue soluzioni Esercizi
 Equzioni di grdo Definizioni Equzioni incomplete Equzione complet Relzioni tr i coefficienti dell equzione e le sue soluzioni Esercizi Mteri: Mtemtic Autore: Mrio De Leo Definizioni Un equzione è: Un uguglinz
Equzioni di grdo Definizioni Equzioni incomplete Equzione complet Relzioni tr i coefficienti dell equzione e le sue soluzioni Esercizi Mteri: Mtemtic Autore: Mrio De Leo Definizioni Un equzione è: Un uguglinz
Il problema delle aree. Metodo di esaustione.
 INTEGRALE DEFINITO. DEFINIZIONE E SIGNIFICATO GEOMETRICO. PROPRIETA DELL INTEGRALE DEFINITO. FUNZIONE INTEGRALE. TEOREMA DELLA MEDIA. TEOREMA FONDAMENTALE DEL CALCOLO INTEGRALE. FORMULA DI LEIBNITZ NEWTON.
INTEGRALE DEFINITO. DEFINIZIONE E SIGNIFICATO GEOMETRICO. PROPRIETA DELL INTEGRALE DEFINITO. FUNZIONE INTEGRALE. TEOREMA DELLA MEDIA. TEOREMA FONDAMENTALE DEL CALCOLO INTEGRALE. FORMULA DI LEIBNITZ NEWTON.
Soluzioni tampone. Se ad un litro di acqua pura (ph=7) vengono aggiunte 0,01 moli di HCl il ph varia da 7 a 2 (ph=-log(0,01) =2,0), ovvero di 5 unità.
 Soluzioni tampone Se ad un litro di acqua pura (ph=7) vengono aggiunte 0,01 moli di HCl il ph varia da 7 a 2 (ph=-log(0,01) =2,0), ovvero di 5 unità. Un tampone è una soluzione che varia in maniera trascurabile
Soluzioni tampone Se ad un litro di acqua pura (ph=7) vengono aggiunte 0,01 moli di HCl il ph varia da 7 a 2 (ph=-log(0,01) =2,0), ovvero di 5 unità. Un tampone è una soluzione che varia in maniera trascurabile
K [H 2 O] 2 = K w = [H 3 O + ][OH ]
![K [H 2 O] 2 = K w = [H 3 O + ][OH ] K [H 2 O] 2 = K w = [H 3 O + ][OH ]](/thumbs/27/10717050.jpg) Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
COMPITO A DI CHIMICA DEL
 COMPITO A DI CHIMICA DEL 17-09-13 1A) Una miscela di solfato di rame pentaidrato e solfato di calcio diidrato viene scaldata fino alla perdita completa di acqua. La diminuzione in peso della miscela risulta
COMPITO A DI CHIMICA DEL 17-09-13 1A) Una miscela di solfato di rame pentaidrato e solfato di calcio diidrato viene scaldata fino alla perdita completa di acqua. La diminuzione in peso della miscela risulta
8 Controllo di un antenna
 8 Controllo di un ntenn L ntenn prbolic di un rdr mobile è montt in modo d consentire un elevzione compres tr e =2. Il momento d inerzi dell ntenn, Je, ed il coefficiente di ttrito viscoso, f e, che crtterizzno
8 Controllo di un ntenn L ntenn prbolic di un rdr mobile è montt in modo d consentire un elevzione compres tr e =2. Il momento d inerzi dell ntenn, Je, ed il coefficiente di ttrito viscoso, f e, che crtterizzno
Laurea triennale in Scienze della Natura a.a. 2009/2010. Regole di Calcolo
 Lure triennle in Scienze dell Ntur.. 2009/200 Regole di Clcolo In queste note esminimo lcune conseguenze degli ssiomi reltivi lle operzioni e ll ordinmento nell insieme R dei numeri reli. L obiettivo principle
Lure triennle in Scienze dell Ntur.. 2009/200 Regole di Clcolo In queste note esminimo lcune conseguenze degli ssiomi reltivi lle operzioni e ll ordinmento nell insieme R dei numeri reli. L obiettivo principle
Equilibri ionici in soluzione. M. Pasquali
 Equilibri ionici in soluzione Misura sperimentale del W Conducibilità dell acqua a T18 C χ.84*10 8 Ω 1 cm 1 Sono noti λ o 15 Ω 1 cm 2 ; λ o 174 Ω 1 cm 2 ; Λ 489 Ω 1 cm 2 Si consideri l elettrolita H 2
Equilibri ionici in soluzione Misura sperimentale del W Conducibilità dell acqua a T18 C χ.84*10 8 Ω 1 cm 1 Sono noti λ o 15 Ω 1 cm 2 ; λ o 174 Ω 1 cm 2 ; Λ 489 Ω 1 cm 2 Si consideri l elettrolita H 2
UNIVERSITÀ DEGLI STUDI DI TERAMO
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN TUTELA E BENESSERE ANIMALE Corso di : FISICA MEDICA A.A. 015 /016 Docente: Dott. Chiucchi Riccrdo il:rchiucchi@unite.it Medicin Veterinri: CFU 5 (corso
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN TUTELA E BENESSERE ANIMALE Corso di : FISICA MEDICA A.A. 015 /016 Docente: Dott. Chiucchi Riccrdo il:rchiucchi@unite.it Medicin Veterinri: CFU 5 (corso
Determinanti e caratteristica di una matrice (M.S. Bernabei & H. Thaler
 Determinnti e crtteristic di un mtrice (M.S. Bernbei & H. Thler Determinnte Il determinnte può essere definito solmente nel cso di mtrici qudrte Per un mtrice qudrt 11 (del primo ordine) il determinnte
Determinnti e crtteristic di un mtrice (M.S. Bernbei & H. Thler Determinnte Il determinnte può essere definito solmente nel cso di mtrici qudrte Per un mtrice qudrt 11 (del primo ordine) il determinnte
" Osservazione. 6.1 Integrale indefinito. R Definizione (Primitiva) E Esempio 6.1 CAPITOLO 6
 CAPITOLO 6 Clcolo integrle 6. Integrle indefinito L nozione fondmentle del clcolo integrle è quell di funzione primitiv di un funzione f (). Tle nozione è in qulche modo speculre ll nozione di funzione
CAPITOLO 6 Clcolo integrle 6. Integrle indefinito L nozione fondmentle del clcolo integrle è quell di funzione primitiv di un funzione f (). Tle nozione è in qulche modo speculre ll nozione di funzione
B8. Equazioni di secondo grado
 B8. Equzioni di secondo grdo B8.1 Legge di nnullmento del prodotto Spendo che b0 si può dedurre che 0 oppure b0. Quest è l legge di nnullmento del prodotto. Pertnto spendo che (-1) (+)0 llor dovrà vlere
B8. Equzioni di secondo grdo B8.1 Legge di nnullmento del prodotto Spendo che b0 si può dedurre che 0 oppure b0. Quest è l legge di nnullmento del prodotto. Pertnto spendo che (-1) (+)0 llor dovrà vlere
Differenziale. Consideriamo la variazione finita, x della variabile indipendente a cui corrisponde una variazione finita della funzione f x, f x y
 Differenzile Considerimo l vrizione finit, dell vriile indipendente cui corrisponde un vrizione finit dell funzione f, f y Δf 1 Δ 2 L vrizione dell vriile dipendente puo' essere molto piccol, infinitesim
Differenzile Considerimo l vrizione finit, dell vriile indipendente cui corrisponde un vrizione finit dell funzione f, f y Δf 1 Δ 2 L vrizione dell vriile dipendente puo' essere molto piccol, infinitesim
Base. Acido. Acido. Base
 ACIDI E BASI Un acido è un donatore di protoni, una base è un accettore di protoni. La base coniugata di un acido è quella che si forma quando l acido si è privato del protone. L acido coniugato di una
ACIDI E BASI Un acido è un donatore di protoni, una base è un accettore di protoni. La base coniugata di un acido è quella che si forma quando l acido si è privato del protone. L acido coniugato di una
Integrale Improprio. f(x) dx =: Osserviamo che questa definizione ha senso dal momento che per ogni y è ben definito l integrale b
 Integrle Improprio In queste lezioni riprendimo l teori dell integrzione in un vribile, l ide è di estendere l integrle definito nche in csi in cui l funzione integrnd o l intervllo di integrzione non
Integrle Improprio In queste lezioni riprendimo l teori dell integrzione in un vribile, l ide è di estendere l integrle definito nche in csi in cui l funzione integrnd o l intervllo di integrzione non
CELLE GALVANICHE E TITOLAZIONI POTENZIOMETRICHE
 CLL GALVANICH TITOLAZIONI POTNZIOMTRICH Rezione di ossidoriduzione spontne del Zinco metllico conttto con un soluzione di Solfto di Rme Cu (q.) Zn(s) Cu(s) Zn (q) Costnte di equilibrio dell rezione 5 C
CLL GALVANICH TITOLAZIONI POTNZIOMTRICH Rezione di ossidoriduzione spontne del Zinco metllico conttto con un soluzione di Solfto di Rme Cu (q.) Zn(s) Cu(s) Zn (q) Costnte di equilibrio dell rezione 5 C
Determinare il ph e il poh di una soluzione costituita da 100 ml di HCl M.
 Esercizi di stechiometria commentati sul ph Corso di Laboratorio di chimica per Scienze e tecnologie biologiche STB Università di degli Studi di Trieste Claudio Tavagnacco versione 07.04.16 La risoluzione
Esercizi di stechiometria commentati sul ph Corso di Laboratorio di chimica per Scienze e tecnologie biologiche STB Università di degli Studi di Trieste Claudio Tavagnacco versione 07.04.16 La risoluzione
Liceo Scientifico G. Salvemini Corso di preparazione per la gara provinciale delle OLIMPIADI DELLA MATEMATICA INTRO ALGEBRA
 Liceo Scientifico G. Slvemini Corso di preprzione per l gr provincile delle OLIMPIADI DELLA MATEMATICA INTRO ALGEBRA PROPRIETA DELLE POTENZE PRODOTTI NOTEVOLI QUESITO SUGGERIMENTO y è un espressione non
Liceo Scientifico G. Slvemini Corso di preprzione per l gr provincile delle OLIMPIADI DELLA MATEMATICA INTRO ALGEBRA PROPRIETA DELLE POTENZE PRODOTTI NOTEVOLI QUESITO SUGGERIMENTO y è un espressione non
alle FaColtà UNiVERSitaRiE
 tst i himi PR l SSo ll Foltà UNiVRSitRi Pitolo 18 cii e bsi 1. inicre tr i seguenti cii quello mggiormente corrosivo per i tessuti epitelili: cio citrico cio etnoico cio crbonico cio solforico cio l-scorbico
tst i himi PR l SSo ll Foltà UNiVRSitRi Pitolo 18 cii e bsi 1. inicre tr i seguenti cii quello mggiormente corrosivo per i tessuti epitelili: cio citrico cio etnoico cio crbonico cio solforico cio l-scorbico
7. Derivate Definizione 1
 7. Derivte Il concetto di derivt è importntissimo e molto nturle. Per vere un esempio concreto, penste l moto di un mcchin: se f(t) è l funzione che esprime qunt strd vete percorso fino d un certo istnte
7. Derivte Il concetto di derivt è importntissimo e molto nturle. Per vere un esempio concreto, penste l moto di un mcchin: se f(t) è l funzione che esprime qunt strd vete percorso fino d un certo istnte
Olimpiadi di Chimica
 Olimpiadi di Chimica Acqua Oro Zucchero Acidi e basi Una soluzione è una miscela omogenea di 2 o più sostanze Il soluto è(sono) la(le) sostanza(e) presente(i) in minore quantità Il solvente è la sostanza
Olimpiadi di Chimica Acqua Oro Zucchero Acidi e basi Una soluzione è una miscela omogenea di 2 o più sostanze Il soluto è(sono) la(le) sostanza(e) presente(i) in minore quantità Il solvente è la sostanza
Acidi e basi ph, costanti di acidità e basicità Idrolisi, soluzioni tampone
 Acidi e basi ph, costanti di acidità e basicità Idrolisi, soluzioni tampone Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental
Acidi e basi ph, costanti di acidità e basicità Idrolisi, soluzioni tampone Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental
Acidi e basi deboli, tamponi e titolazioni
 Lezione cidi e basi deboli, tamponi e titolazioni cidi e basi di Lewis La teoria enunciata da Lewis è ancora più generale di quella di Brønsted che non riusciva a spiegare alcune reazioni innegabilmente
Lezione cidi e basi deboli, tamponi e titolazioni cidi e basi di Lewis La teoria enunciata da Lewis è ancora più generale di quella di Brønsted che non riusciva a spiegare alcune reazioni innegabilmente
POTENZA CON ESPONENTE REALE
 PRECORSO DI MATEMATICA VIII Lezione ESPONENZIALI E LOGARITMI E. Modic mtemtic@blogscuol.it www.mtemtic.blogscuol.it POTENZA CON ESPONENTE REALE Definizione: Dti un numero rele > 0 ed un numero rele qulunque,
PRECORSO DI MATEMATICA VIII Lezione ESPONENZIALI E LOGARITMI E. Modic mtemtic@blogscuol.it www.mtemtic.blogscuol.it POTENZA CON ESPONENTE REALE Definizione: Dti un numero rele > 0 ed un numero rele qulunque,
Capitolo 5. Integrali. 5.1 Integrali di funzioni a gradinata
 Cpitolo 5 Integrli 5.1 Integrli di funzioni grdint Un concetto molto semplice m di fondmentle importnz per l trttzione dell integrle di Riemnn è quello di divisione di un intervllo [, b]. In sostnz si
Cpitolo 5 Integrli 5.1 Integrli di funzioni grdint Un concetto molto semplice m di fondmentle importnz per l trttzione dell integrle di Riemnn è quello di divisione di un intervllo [, b]. In sostnz si
Area del Trapezoide. f(x) A f(a) f(b) f(x)
 Are del Trpezoide y o A f() trpezoide h B f() f() L're del trpezoide S puo' essere pprossimt dll're del trpezio AB. Per vere un migliore pprossimzione possimo suddividere il trpezio in trpezi piu' piccoli.
Are del Trpezoide y o A f() trpezoide h B f() f() L're del trpezoide S puo' essere pprossimt dll're del trpezio AB. Per vere un migliore pprossimzione possimo suddividere il trpezio in trpezi piu' piccoli.
Teoria di Lewis. Un acido di Lewis è una specie chimica che può formare un legame covalente accettando una coppia di elettroni da un altra specie.
 Teoria di Lewis Spiega perché alcune reazioni hanno proprietà acidobase pur non avendo idrogeni. Nella teoria di Lewis le reazioni acido-base hanno come protagonista la messa in condivisione di una coppia
Teoria di Lewis Spiega perché alcune reazioni hanno proprietà acidobase pur non avendo idrogeni. Nella teoria di Lewis le reazioni acido-base hanno come protagonista la messa in condivisione di una coppia
Corso di Laboratorio Integrato di Chimica Generale BIOTEC-2011 Esercizi Svolti su Equilibri acido-base
 Corso di Laboratorio Integrato di Chimica Generale BIOTEC2011 Esercizi Svolti su Equilibri acidobase 1. Quanto vale il ph di una soluzione 0.1 M di CO 2 se si ritiene che essa non esiste più come tale
Corso di Laboratorio Integrato di Chimica Generale BIOTEC2011 Esercizi Svolti su Equilibri acidobase 1. Quanto vale il ph di una soluzione 0.1 M di CO 2 se si ritiene che essa non esiste più come tale
EQUILIBRI SIMULTANEI
 EQUILIBRI SIMULTANEI 1. Soluzioni tampone. Per soluzione tampone si intende una soluzione acquosa in grado di mantenere pressoché inalterato il proprio ph, in seguito all'aggiunta di moderate quantità
EQUILIBRI SIMULTANEI 1. Soluzioni tampone. Per soluzione tampone si intende una soluzione acquosa in grado di mantenere pressoché inalterato il proprio ph, in seguito all'aggiunta di moderate quantità
SPAZI VETTORIALI. 1. Spazi e sottospazi vettoriali
 SPAZI VETTORIALI 1. Spzi e sottospzi vettorili Definizione: Dto un insieme V non vuoto e un corpo K di sostegno si dice che V è un K-spzio vettorile o uno spzio vettorile su K se sono definite un operzione
SPAZI VETTORIALI 1. Spzi e sottospzi vettorili Definizione: Dto un insieme V non vuoto e un corpo K di sostegno si dice che V è un K-spzio vettorile o uno spzio vettorile su K se sono definite un operzione
CORSO ZERO DI MATEMATICA
 UNIVERSITÀ DEGLI STUDI DI PALERMO FACOLTÀ DI ARCHITETTURA CORSO ZERO DI MATEMATICA ESPONENZIALI E LOGARITMI Dr. Ersmo Modic ersmo@glois.it www.glois.it POTENZA CON ESPONENTE REALE Definizione: Dti un numero
UNIVERSITÀ DEGLI STUDI DI PALERMO FACOLTÀ DI ARCHITETTURA CORSO ZERO DI MATEMATICA ESPONENZIALI E LOGARITMI Dr. Ersmo Modic ersmo@glois.it www.glois.it POTENZA CON ESPONENTE REALE Definizione: Dti un numero
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Il problema delle scorte tomo G
 Il prolem delle scorte tomo G Esercizi corretti: esercizio pg 6; esercizio 3 pg. 59 N. 5 PAG 389; N. 6 PAG. 389; N. 7 PAG 389; N. 8 PAG. 389; N 9 PAG. 390; N. 30 pg 390, N. 3 pg. 390, N. 33 pg. 390. Per
Il prolem delle scorte tomo G Esercizi corretti: esercizio pg 6; esercizio 3 pg. 59 N. 5 PAG 389; N. 6 PAG. 389; N. 7 PAG 389; N. 8 PAG. 389; N 9 PAG. 390; N. 30 pg 390, N. 3 pg. 390, N. 33 pg. 390. Per
legge dell azione di massa: all equilibrio K c = [C] c [D] d / [A] a [B] b = k 1 /k -1
![legge dell azione di massa: all equilibrio K c = [C] c [D] d / [A] a [B] b = k 1 /k -1 legge dell azione di massa: all equilibrio K c = [C] c [D] d / [A] a [B] b = k 1 /k -1](/thumbs/71/65830231.jpg) EQUILIBRIO CHIMICO 1 Consideriamo la reazione chimica seguente: CH 3 COOH + C 2 H 5 OH CH 3 COOC 2 H 5 + H 2 O K c = [estere] [acqua] / [acido] [alcol] K c = costante di equilibrio legge dell azione di
EQUILIBRIO CHIMICO 1 Consideriamo la reazione chimica seguente: CH 3 COOH + C 2 H 5 OH CH 3 COOC 2 H 5 + H 2 O K c = [estere] [acqua] / [acido] [alcol] K c = costante di equilibrio legge dell azione di
BREVE APPENDICE SULLE UNITA' LOGARITMICHE
 BREVE APPENDICE SULLE UNITA' LOGARITMICHE Per esprimere gudgni e ttenuzioni, nonché cifre di rumore e rpporti segnle-rumore si usno frequentemente le unità logritmiche. Come risultto, l grndezz in questione
BREVE APPENDICE SULLE UNITA' LOGARITMICHE Per esprimere gudgni e ttenuzioni, nonché cifre di rumore e rpporti segnle-rumore si usno frequentemente le unità logritmiche. Come risultto, l grndezz in questione
Verifica di Fisica 04/12/2014 Argomenti trattati durante il corso:
 Liceo Scientifico Augusto Righi, Cesen Corso di Fisic Generle, AS 2014/15, Clsse 1C Verific di Fisic 04/12/2014 Argomenti trttti durnte il corso: Grndezze fisiche: fondmentli e derivte Notzione scientific
Liceo Scientifico Augusto Righi, Cesen Corso di Fisic Generle, AS 2014/15, Clsse 1C Verific di Fisic 04/12/2014 Argomenti trttti durnte il corso: Grndezze fisiche: fondmentli e derivte Notzione scientific
alle FaColtà UNiVERSitaRiE
 tst i HiMi PR l SSo ll Foltà UNiVRSitRi 1. indicre qule delle seguenti sostnze si scioglie meglio in un solvente polre: cetto di potssio cido solforico zolfo idrossido di sodio idrossido di potssio (Medicin
tst i HiMi PR l SSo ll Foltà UNiVRSitRi 1. indicre qule delle seguenti sostnze si scioglie meglio in un solvente polre: cetto di potssio cido solforico zolfo idrossido di sodio idrossido di potssio (Medicin
Integrali. all integrale definito all integrale indefinito. Integrali: riepilogo
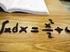 Integrli ll integrle deinito ll integrle indeinito Indice dell lezione Integrle Deinito Rettngoloide Integrle deinito come re del rettngoloide Esempi e propriet Primitiv Teorem ondmentle del clcolo integrle
Integrli ll integrle deinito ll integrle indeinito Indice dell lezione Integrle Deinito Rettngoloide Integrle deinito come re del rettngoloide Esempi e propriet Primitiv Teorem ondmentle del clcolo integrle
Anno 5. Applicazione del calcolo degli integrali definiti
 Anno 5 Appliczione del clcolo degli integrli definiti 1 Introduzione In quest lezione vedremo come pplicre il clcolo dell integrle definito per determinre le ree di prticolri figure pine, i volumi dei
Anno 5 Appliczione del clcolo degli integrli definiti 1 Introduzione In quest lezione vedremo come pplicre il clcolo dell integrle definito per determinre le ree di prticolri figure pine, i volumi dei
Siano α(x), β(x) due funzioni continue in un intervallo [a, b] IR tali che. α(x) β(x).
![Siano α(x), β(x) due funzioni continue in un intervallo [a, b] IR tali che. α(x) β(x). Siano α(x), β(x) due funzioni continue in un intervallo [a, b] IR tali che. α(x) β(x).](/thumbs/22/1643654.jpg) OMINI NORMALI. efinizione Sino α(), β() due funzioni continue in un intervllo [, b] IR tli che L insieme del pino (figur 5. pg. ) α() β(). = {(, ) [, b] IR : α() β()} si chim dominio normle rispetto ll
OMINI NORMALI. efinizione Sino α(), β() due funzioni continue in un intervllo [, b] IR tli che L insieme del pino (figur 5. pg. ) α() β(). = {(, ) [, b] IR : α() β()} si chim dominio normle rispetto ll
Calcoli di speciazione
 Mster Secondo Livello BONIFICA DEI SITI INQUINATI Crtterizzzione inquinento d etlli nelle cque Università degli Studi di Pis, 19-0-016 Clcoli di specizione Luigi Mrini Consulente in Geochiic Applict e-il:
Mster Secondo Livello BONIFICA DEI SITI INQUINATI Crtterizzzione inquinento d etlli nelle cque Università degli Studi di Pis, 19-0-016 Clcoli di specizione Luigi Mrini Consulente in Geochiic Applict e-il:
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3. Idrolisi salina Soluzioni tampone Titolazioni acido-base
 Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
Seconda prova maturita 2016 soluzione secondo problema di matematica scientifico
 Second prov mturit 06 soluzione secondo problem di mtemtic scientifico Skuol.net June, 06 Primo Problem Le tre funzioni proposte sono f () ( ) k f () 6 + 9k + f () cos( π k ). Punto Affinche l funzione
Second prov mturit 06 soluzione secondo problem di mtemtic scientifico Skuol.net June, 06 Primo Problem Le tre funzioni proposte sono f () ( ) k f () 6 + 9k + f () cos( π k ). Punto Affinche l funzione
SOLUZIONI derivate da: Acido debole/ sale (CH 3 COOH/CH 3 COONa) Base debole/ suo sale (NH 4 OH/NH 4 Cl)
 Soluzioni Tampone Si definiscono soluzioni tampone quelle soluzioni in grado di mantenere pressoché costante il proprio ph per aggiunta di una ragionevole quantità di acido o di base forte o per moderata
Soluzioni Tampone Si definiscono soluzioni tampone quelle soluzioni in grado di mantenere pressoché costante il proprio ph per aggiunta di una ragionevole quantità di acido o di base forte o per moderata
Ionizzazione dell acqua, ph, poh
 Ionizzazione dell acqua, ph, poh L acqua è una sostanza la cui ionizzazione può essere rappresentata dall equazione SEMPLIFICATA H 2 O H + + OH - in realtà gli ioni H+ allo stato libero non esistono in
Ionizzazione dell acqua, ph, poh L acqua è una sostanza la cui ionizzazione può essere rappresentata dall equazione SEMPLIFICATA H 2 O H + + OH - in realtà gli ioni H+ allo stato libero non esistono in
