Proteasi (peptidasi)
|
|
|
- Fabio Salvatori
- 6 anni fa
- Visualizzazioni
Transcript
1 DEGRADAZIONE DELLA MATRICE PROTEASI Proteasi (peptidasi) Qualsiasi enzima che catalizza la proteolisi, ossia, inizia il catabolismo delle proteine idrolizzando i legami peptidici che collegano gli aminoacidi di una catena polipeptidica. Formazione del legame peptidico Hanno subito diversi processsi di evoluzione e classi differenti di proteasi possono svolgere la stessa reazione, utilizzando meccanismi catalitici completamente diversi. Si possono trovare negli animali, piante, batteri e virus
2 Proteasi: classificazione in base al residuo catalitico 1. Serina proteasi: usano un gruppo alcoolica di un residuo di serina. 2. Cisteina proteasi: usano un gruppo tiolico di una cisteina. 3. Treonina proteasi: usano il gruppo alcoolico secondario della treonina. 4. Aspartato proteasi: unano il gruppo carbossilico dell aspartato. 5. Glutamato proteasi: usano il gruppo carbossilico del glutamato. 6. Metalloproteasi: usano un metallo, di solito lo Zinco. 7. Asparagina peptide liasi: usano un asparagina per svolgere una reazione di eliminazione (non richiede acqua). Meccanismi di azione delle proteasi Il meccanismo utilizzato per scindere un legame peptidico richiede che venga reso nucleofilico un residuo aminoacidico (cisteina o treonina proteasi) o una molecola di acqua (aspartato, metallo o glutamato proteasi) in modo che possano attaccare il gruppo carbossilico del legame peptidico. Uno dei modi per ottenere un nucleofilo si ha mediante una triade catalitica, in cui un residuo di istidina è utilizzato per attivare la serina, la cisteina o la treonina rendendoli nucleofili. [N.B. Agente nucleofilico: specie chimica che dona una coppia di elettroni ad un elettrofilo per formare un legame chimico. Tutte le molecole o ioni con una coppia di elettroni liberi o almeno un legame π possono fungere da nucleofili. Dato che i nucleofili donano elettroni sono per definizione basi di Lewis. ry_with_a_biological_emphasis/chapter_11%3a_nucleophilic_carbonyl _addition_reactions/section_11.1%3a_nucleophilic_additions_to_aldeh ydes_and_ketones%3a_the_general_picture 2
3 Regolazione degli enzimi di rimodellamento della ECM e consequenze biologiche della dinamica della ECM [1] Lu P, Takai K, Weaver VM, Werb Z. Extracellular matrix degradation and remodeling in development and disease. Cold Spring Harb Perspect Biol Dec 1;3(12). doi:pii: a /cshperspect.a Didascalia Figura A di Lu et al.: Alcuni dei meccanismi mediante i quali le attività degli enzimi che rimodellano la ECM sono regolate 1. L espressione spazio temporale degli enzimi che rimodellano la ECM è regolata da fattori di trascrizione. 2. Una volta espressi, gli enzimi possono essere consegnati a localizzazioni subcellulari specifiche, incluso il fronte di migrazione di una cellula. A seconda che essi contengano o meno un dominio transmembrana, gli enzimi possono ancorarsi alla membrana plasmatica o venire secreti. 3. Quando prodotti inizialmente, la maggior parte degli enzimi che rimodellano la ECM si trovano sotto forma di precursori inattivi finché non vengono processati e i pro domini inibitori sono rimossi da altre proteasi. 4. Gli enzimi attivi possono essere prontamente neutralizzati da inibitori endogeni specifici o da pan inibitori, 5. venendo in seguito sottoposti a rimozione permanente mediante degradazione nei lisosomi. Lu P, Takai K, Weaver VM, Werb Z. Extracellular matrix degradation and remodeling in development and disease. Cold Spring Harb Perspect Biol Dec 1;3(12). doi:pii: a /cshperspect.a
4 Regolazione degli enzimi di rimodellamento della ECM e consequenze biologiche della dinamica della ECM [2] Lu P, Takai K, Weaver VM, Werb Z. Extracellular matrix degradation and remodeling in development and disease. Cold Spring Harb Perspect Biol Dec 1;3(12). doi:pii: a /cshperspect.a Didascalia Figura B di Lu et al.: Le funzioni versatili della matrice dipendono dalle sue diverse proprietà fisiche, biochimiche e biomeccaniche 1. L ancoraggio alla lamina basale è essenziale per diversi processi biologici, che includono la divisione cellulare asimmetrica nella biologia delle cellule staminali e il mantenimento della polarità dei tessuti. 2. A seconda del contesto, la ECM può servire da barriera 3. o facilitare la migrazione cellulare. 4. Inoltre, legando molecole di segnalamento con funzione di fattori di crescita, e impedendo la loro altrimenti diffusione libera, la ECM funge da serbatoio per quei segnali ed aiuta a stabilire un gradiente di concentrazione. 5. Alcuni componenti della ECM, incluso l eparan solfato e recettori per la ECM, quali ad esempio il CD44, possono legarsi selettivamente a diversi fattori di crescita e fungere da corecettori per segnali, 6. oppure come «presentatori» di segnali, aiutando a determinare il senso della comunicazione cellula cellula. 7. Infine, le proprietà biomeccaniche della ECM, incluso la rigidità, hanno un influenza pronunciata su diversi comportamenti cellulari, quali il differenziamento cellulare. Lu P, Takai K, Weaver VM, Werb Z. Extracellular matrix degradation and remodeling in development and disease. Cold Spring Harb Perspect Biol Dec 1;3(12). doi:pii: a /cshperspect.a
5 LA DEGRADAZIONE DEI COMPONENTI DELLA MEC E STRETTAMENTE CONTROLLATA [1] Il turnover delle macromolecole della matrice extracellulare é un parametro di particolare importanza per una gran varietà di processi biologici. Una rapida degradazione ha luogo, ad es., quando nel processo di involuzione dell utero dopo il parto, o quando la coda del girino viene riassorbita durante la metamorfosi. Una degradazione più localizzata dei componenti della matrice é richiesta quando le cellule migrano attraverso la membrana basale, o quando i leucociti migrano attraverso la lamina basale vascolare verso i tessuti in risposta ad infezione o danno, o quando le cellule cancerose migrano dal loro sito originario verso organi distanti tramite il flusso sanguigno o i vasi linfatici (metastatizzazione). LA DEGRADAZIONE DEI COMPONENTI DELLA MEC E STRETTAMENTE CONTROLLATA [2] Anche nell apparentemente statica matrice extracellulare degli animali adulti vi é un lento ma continuo turnover dovuto a degradazione e re sintesi. In ciascuno di questi casi le componenti della matrice vengono degradate da enzimi proteolitici extracellulari che sono secreti localmente dalle cellule. Principali classi di proteasi coinvolte nella degradazione della MEC: Metalloproteasi: dipendono da un metallo legato nel sito attivo (es. Zn 2+ ) per la loro attività Serina proteasi: hanno un residuo di serina altamente reattivo nel loro sito attivo. 5
6 LA DEGRADAZIONE DEI COMPONENTI DELLA MEC E STRETTAMENTE CONTROLLATA [3] Insieme, le metalloproteasi e le serina proteasi collaborano per degradare le proteine della matrice come il collagene, la laminina o la fibronectina. Alcune delle metalloproteasi, come le collagenasi sono altamente specifiche, scindendo particolari proteine in un piccolo numero di siti, e sono spesso posizionate in modo tale che l integrità strutturale della matrice venga distrutta da una proteolisi relativamente limitata; in questo modo, la migrazione cellulare può essere grandemente facilitata con una proteolisi limitata. LA DEGRADAZIONE DEI COMPONENTI DELLA MEC E STRETTAMENTE CONTROLLATA [4] Una importante serina proteasi coinvolta nella degradazione della matrice é il urokinase type plasminogen activator (U PA). L attività U PA ha come risultato quello di scatenare specificamente una cascata proteolitica: il suo bersaglio specifico é il plasminogeno, un precursore di tipo serina proteasi inattivo che abbonda nel torrente sanguigno e si accumula nei siti di rimodellamento dei tessuti come le ferite, i tumori e i siti di infiammazione. L U PA scinde un singolo legame nel plasminogeno per dare la proteasi attiva, plasmina. Al contrario del U PA, la plasmina ha un ampia specificità, degradando una gran varietà di proteine, includendo la fibrina (uno dei componenti dei coagoli sanguigni), la fibronectina e la laminina. 6
7 LA DEGRADAZIONE DEI COMPONENTI DELLA MEC E STRETTAMENTE CONTROLLATA [5] Diversi meccanismi collaborano per assicurare che la degradazione dei componenti della matrice sia strettamente controllata. 1. Molte proteasi come il plasminogeno, sono secrete come precursori inattivi che possono venire attivati localmente. 2. L azione delle proteasi é confinata in aree specifiche mediante diversi inibitori delle proteasi, anche essi secreti, come gli inibitori tissutali delle metallo proteinasi ( tissue inhibitors of metalloproteinases, TIMPs e gli inibitori delle serine proteasi, noti come serpine. LA DEGRADAZIONE DEI COMPONENTI DELLA MEC E STRETTAMENTE CONTROLLATA [6] Questi inibitori sono specifici per le diverse proteasi e si legano strettamente all enzima attivato bloccandone l attività. Gli inibitori possono essere secreti dalle cellule ai confini delle aree di attiva degradazione, per proteggere la matrice non coinvolta; inoltre, gli inibitori possono proteggere la proteine della superficie cellulare coinvolte nell adesione o nella migrazione cellulare. Molte cellule hanno recettori sulla loro superficie che legano le proteasi come il U PA, così confinando l enzima soltanto laddove é necessario: l U PA legato a recettori é stato visto ad es. nei coni di crescita dei nervi e alla estremità anteriore dei leucociti migranti, dove può servire per pulire la strada per la loro migrazione, e sembra che sia necessario per alcuni tipi di cellule tumorali per metastatizzare. 7
8 Classi di enzimi proteolitici [1] Le serina proteasi (o serina endopeptidasi) sono enzimi che scindono legami peptidici delle proteina in un processo in cui la serina funge da aminoacido nucleofilico nel sito attivo dell enzima. Meccanismi delle proteasi [1] Proteasi: enzimi che catalizzano la scissione idrolitica dei legami peptidici, ossia, rompono i legami peptidici mediante l aggiunta di una molecola di acqua. Le proteasi subentrano in quattro principali classi di meccanismi: serina, cisteina, aspartil e metalloproteasi. Nei siti attivi delle serina e cisteina proteasi, il residuo che dà il nome all enzima è di solito appaiato ad un gruppo che ritira un protone per promuovere un attacco nucleofilico ad un legame peptidico. Viceversa, le aspartil proteasi e le metallo proteasi attivano una molecola di acqua che servirà da agente nucleofilico, invece di utilizzare un gruppo funzionale dell enzima stesso. Tuttavia, il processo complessivo di scissione del legame peptidico è essenzialmente lo stesso per tutte le classi. Erez E, Fass D, Bibi E. How intramembrane proteases bury hydrolytic reactions in the membrane. Nature May 21;459(7245):
9 Meccanismi delle proteasi [2] Serina proteasi solubili Le serina proteasi solubili (E.C ) usano una triade catalitica localizzata nel sito attivo dell enzima. La triade è una struttura coordinata che consiste in tre aminoacidi: istidina, serina e acido aspartico. Ciascuno di questi aminoacidi gioca un ruolo importante nel meccanismo della proteasi. L istidina, con l aiuto dell aspartato (che ritira il protone), deprotona il gruppo idrossilico della serina, permettendo un attacco nucleofilico al gruppo carbonilico del substrato. Il secondo aspetto caratteristico delle serina proteasi è un buco ossianionico, che stabilizza lo stato di transizione tetraedrico. Nella serina proteasi chimotripsina, ad es., il buco ossianionico è formato usando i gruppi NH dell impalcatura della glicina 193 e della serina 195. Erez E, Fass D, Bibi E. How intramembrane proteases bury hydrolytic reactions in the membrane. Nature May 21;459(7245): Meccanismi delle proteasi [3] Serina proteasi solubili (segue) Nell imagine, le curve azzure rappresentano i bucchi ossianionici. Le curve più spesse rappresentano schematicamente l enzima. Le frecce rosse indicano il movimento delle copie di elettroni. Le linee tratteggiate blu rappresentano legami di idrogeno o altre interazioni elettrostatiche. Le linee ondulate grigie rappresentano il proseguimento del polipeptide substrato a ciascuno dei lati del legame peptidico, che è rappresentato esplicitamente. Erez E, Fass D, Bibi E. How intramembrane proteases bury hydrolytic reactions in the membrane. Nature May 21;459(7245):
10 Meccanismi delle proteasi [4] Cisteina proteasi [E.C ] Il suo meccanismo di azione è simile a quella delle serina proteasi in quanto usano un forte agente nucleofilico e la formazione di un complesso covalente enzima substrato. Tuttavia, in questo caso l agente nucleofilico è l atomo di zolfo di un residuo di cisteina, invece dell ossigeno di una serina. Nella cisteina proteasi papaina, i gruppi NH della cisteina 25 e della glutamina 19 formano il buco ossianionico Erez E, Fass D, Bibi E. How intramembrane proteases bury hydrolytic reactions in the membrane. Nature May 21;459(7245): Meccanismi delle proteasi [5] Aspartil proteasi [E.C ] Le aspartil proteasi contengono due residui di acido aspartico che agiscono in un meccanismo generale acido base. Una molecola di acqua coordinata fra gli acidi aspartici viene attivata mediante sottrazione di un protone, il che permette all acqua polarizzata di attaccare il carbono carbonilico del legame scindibile del substrato. Lo stato di transizione tetraedrico formato nell attacco nucleofilico sembra di non essere modificato, al contrario dell ossianione che si forma durante la catalisi svolta dalle serina o cisteina proteasi. Erez E, Fass D, Bibi E. How intramembrane proteases bury hydrolytic reactions in the membrane. Nature May 21;459(7245):
11 Meccanismi delle proteasi [6] Metalloproteasi [E.C ] 1 Le metalloproteasi usano un metallo di coordinazione, spesso lo zinco, nel loro meccanismo catalitico. Nelle diverse metalloproteasi solubili, quali ad es. la termolisina e nelle metalloproteasi della matrice, la coordinazione è svolta da tre istidine, o da due istidine e da una catena acida laterale. Una molecola di acqua, che funge da ligando aggiuntivo con lo zinco, viene legata mediante un ponte di idrogeno al glutamato, che estrae un protone dalla molecola di acqua attaccante. L ione zinco stesso stabilizza l ossianione. Erez E, Fass D, Bibi E. How intramembrane proteases bury hydrolytic reactions in the membrane. Nature May 21;459(7245): Meccanismi delle proteasi [7] Metalloproteasi [E.C ] 2 Erez E, Fass D, Bibi E. How intramembrane proteases bury hydrolytic reactions in the membrane. Nature May 21;459(7245):
12 Meccanismo di azione delle serina proteasi Classi di enzimi proteolitici [2] Serina proteasi: includono gli enzimi digestivi tripsina, chimotripsina e elastasi. Le differenti serina proteasi differiscono nella specificità per il substrato: Ad es., la chimotripsina preferisce una catena laterale aromatica nel residuo aminoacidico il cui atomo di carbono carbonilico è parte del legame peptidico che verrà scisso (gruppo R colorato in blu, figura precedente). La tripsina preferisce un residuo di Lys o Arg carico in quella posizione 12
13 Classi di enzimi proteolitici [3] Aspartato proteasi: includono l enzima digestivi pepsina, alcune proteasi dei lisosomi, l enzima renale renina, e la HIVproteasi. Due residui di aspartato partecipano a catalisi di tipo acido/base nel sito attivo. Cisteina proteasi: includono le caspasi, che funzionano nella degradazione delle proteine durante l apoptosi (morte cellulare programmata), l enzima delle piante papaina e alcune delle catepsine dei lisosomi. Tutte le caspasi scindono il lato carbonilico di un residuo di aspartato. Classi di enzimi proteolitici [4] Zinco proteasi (metalloproteasi): includono gli enzimi digestivi carbossipeptidasi, diverse metalloproteasi della matrice ( matrix metalloproteases, MMPs), che possono essere secrete dalle cellule (oppure rimangono legate alla membrana plasmatica), e una proteasi lisosomiale. Alcune MMPs (ad es. le collagenasi) sono coinvolte nella degradazione della matrice durante il rimodellamento dei tessuti. Alcune MMPs giocano un ruolo nel segnalamento cellulare, correlato alla loro capacità di rilasciare citochine e fattori di crescita dalla superficie cellulare mediante scissione di pre proteine legate alla membrana. Il motivo legante lo zinco nel sito attivo della metalloproteasi include due residui di istidina, i cui anelli imidazolici laterali sono ligandi per il Zn 2+. Durante la catalisi, lo Zn 2+ promuove l attacco nucleofilico dell ossigeno dell acqua nel sito attivo al carbono carbonilico. 13
DEGRADAZIONE DELLA MATRICE
 DEGRADAZIONE DELLA MATRICE http://www.nature.com/nature/journal/v459/n7245/box/nature08146_bx1.html Regolazione degli enzimi di rimodellamento della ECM e consequenze biologiche della dinamica della ECM
DEGRADAZIONE DELLA MATRICE http://www.nature.com/nature/journal/v459/n7245/box/nature08146_bx1.html Regolazione degli enzimi di rimodellamento della ECM e consequenze biologiche della dinamica della ECM
DEGRADAZIONE DELLA MATRICE
 Regulation of ECM remodeling enzymes and biological consequences of ECM dynamics [1] DEGRADAZIONE DELLA MATRICE http://www.nature.com/nature/journal/v459/n7245/box/nature08146_bx1.html Lu P, Takai K, Weaver
Regulation of ECM remodeling enzymes and biological consequences of ECM dynamics [1] DEGRADAZIONE DELLA MATRICE http://www.nature.com/nature/journal/v459/n7245/box/nature08146_bx1.html Lu P, Takai K, Weaver
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Proteasi Serina proteasi Serina proteasi-coagulazione del sangue
 Proteasi Serina proteasi Serina proteasi-coagulazione del sangue PROTEASI Le proteasi catalizzano la scissione idrolitica di un legame peptidico Peptide bond -carboxyl group & -amino group La reazione
Proteasi Serina proteasi Serina proteasi-coagulazione del sangue PROTEASI Le proteasi catalizzano la scissione idrolitica di un legame peptidico Peptide bond -carboxyl group & -amino group La reazione
Gli enzimi. Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici
 Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
Enzimi: catalizzatori biologici
 Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
Turn-over delle proteine
 Prof. Giorgio Sartor Turn-over delle proteine Copyright 2001-2013 by Giorgio Sartor. All rights reserved. M07 - Versione 1.4 nov 2013 Turn-over delle proteine Le proteine cellulari vengono regolarmente
Prof. Giorgio Sartor Turn-over delle proteine Copyright 2001-2013 by Giorgio Sartor. All rights reserved. M07 - Versione 1.4 nov 2013 Turn-over delle proteine Le proteine cellulari vengono regolarmente
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
Continua. Peptidasi H 2 O
 Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Glicosaminoglicani e proteoglicani
 Proteoglicani I proteoglicani sono una famiglia di glicoproteine altamente glicosilate, in cui le componenti glucidiche sono predominantemente glicosaminoglicani. Si conoscono le strutture solo di alcuni
Proteoglicani I proteoglicani sono una famiglia di glicoproteine altamente glicosilate, in cui le componenti glucidiche sono predominantemente glicosaminoglicani. Si conoscono le strutture solo di alcuni
Applicazioni biotecnologiche degli enzimi: le proteasi
 Applicazioni biotecnologiche degli enzimi: le proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento più o meno elevata 4 classi sulla
Applicazioni biotecnologiche degli enzimi: le proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento più o meno elevata 4 classi sulla
FUNZIONI BIOLOGICHE DELLE PROTEINE
 FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
I MEDIATORI CHIMICI DELLA FLOGOSI
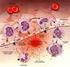 I MEDIATORI CHIMICI DELLA FLOGOSI I mediatori chimici della flogosi attualmente noti sono numerosissimi e la loro conoscenza dettagliata va ben oltre gli obiettivi del corso. Punteremo, pertanto, l attenzione
I MEDIATORI CHIMICI DELLA FLOGOSI I mediatori chimici della flogosi attualmente noti sono numerosissimi e la loro conoscenza dettagliata va ben oltre gli obiettivi del corso. Punteremo, pertanto, l attenzione
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
Meccanismi effettori dei linfociti T citotossici
 Meccanismi effettori dei linfociti T citotossici Immunità specifica: caratteristiche generali Immunità umorale - Riconoscimento dell antigene mediante anticorpi - Rimozione patogeni e tossine extracellulari
Meccanismi effettori dei linfociti T citotossici Immunità specifica: caratteristiche generali Immunità umorale - Riconoscimento dell antigene mediante anticorpi - Rimozione patogeni e tossine extracellulari
Esempi di funzioni svolte dalle proteine
 Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
Principi di Citologia e Istologia. Prof. Pucci, La Matrice Extracellulare
 Principi di Citologia e Istologia. Prof. Pucci, 2003 La Matrice Extracellulare La matrice extracellulare è composta da quattro classi di macromolecole Collageni Proteoglicani Elastina Glicoproteine Essa
Principi di Citologia e Istologia. Prof. Pucci, 2003 La Matrice Extracellulare La matrice extracellulare è composta da quattro classi di macromolecole Collageni Proteoglicani Elastina Glicoproteine Essa
Termodinamica ENTALPIA...6
 Termodinamica ORGANISMI PRIMO VIVENTI ED ENERGIA...2 PRINCIPIO DELLA TERMODINAMICA...5 ENTALPIA...6 SECONDO PRINCIPIO DELLA TERMODINAMICA... 7 energia libera di Gibbs (G)...9 Variazione di energia libera
Termodinamica ORGANISMI PRIMO VIVENTI ED ENERGIA...2 PRINCIPIO DELLA TERMODINAMICA...5 ENTALPIA...6 SECONDO PRINCIPIO DELLA TERMODINAMICA... 7 energia libera di Gibbs (G)...9 Variazione di energia libera
Acido maleico anidride maleica acido ftalico andidride ftalica
 Le anidridi si ottengono per disidratazione da due molecole di acido (la reazione è particolarmente facile per ottenere anidridi cicliche) Acido maleico anidride maleica acido ftalico andidride ftalica
Le anidridi si ottengono per disidratazione da due molecole di acido (la reazione è particolarmente facile per ottenere anidridi cicliche) Acido maleico anidride maleica acido ftalico andidride ftalica
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
Applicazioni biotecnologiche degli enzimi: le proteasi
 Applicazioni biotecnologiche degli enzimi: le proteasi Campi di applicazione delle proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento
Applicazioni biotecnologiche degli enzimi: le proteasi Campi di applicazione delle proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
Immagini e concetti della biologia
 Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
 Proteasi della Matrice SERINA PROTEASI http://en.wikipedia.org/wiki/serine_protease Nature/Scitable: Serina proteasi [a] Le serina proteasi sono coinvolte in un gran numero di processi biologici. Sono
Proteasi della Matrice SERINA PROTEASI http://en.wikipedia.org/wiki/serine_protease Nature/Scitable: Serina proteasi [a] Le serina proteasi sono coinvolte in un gran numero di processi biologici. Sono
INTRODUZIONE ALLE REAZIONI FLOGISTICHE
 INTRODUZIONE ALLE REAZIONI FLOGISTICHE INCONTRO FRA CELLUA E NOXA PATOGENA: SEQUENZA DEGLI EVENTI noxa patogena adattamento cellula danno irreversibile danno reversibile - stress proteins - enzimi di riparazione
INTRODUZIONE ALLE REAZIONI FLOGISTICHE INCONTRO FRA CELLUA E NOXA PATOGENA: SEQUENZA DEGLI EVENTI noxa patogena adattamento cellula danno irreversibile danno reversibile - stress proteins - enzimi di riparazione
Macromolecole Biologiche. La struttura secondaria (III)
 La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
FABBISOGNO CALORICO kcal kcal
 FABBISOGNO CALORICO DONNA UOMO 1500-2000 kcal 2000-2500 kcal Al contrario di quanto accade per i carboidrati e i lipidi non esistono riserve di proteine. Le proteine, come tutti i componenti cellulari,
FABBISOGNO CALORICO DONNA UOMO 1500-2000 kcal 2000-2500 kcal Al contrario di quanto accade per i carboidrati e i lipidi non esistono riserve di proteine. Le proteine, come tutti i componenti cellulari,
scaricato da I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE
 Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
REGOLAZIONE DELL ATTIVITA ENZIMATICA 1) MODULAZIONE ALLOSTERICA NON-COVALENTE (REVERSIBILE)
 REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Fisiologia cellulare e Laboratorio di Colture cellulari
 Corso di laurea BIOTECNOLOGIE UNIVERSITA DEGLI STUDI DI TERAMO Fisiologia cellulare e Laboratorio di Colture cellulari Prof.ssa Luisa Gioia Corso di laurea BIOTECNOLOGIE Fisiologia cellulare e Laboratorio
Corso di laurea BIOTECNOLOGIE UNIVERSITA DEGLI STUDI DI TERAMO Fisiologia cellulare e Laboratorio di Colture cellulari Prof.ssa Luisa Gioia Corso di laurea BIOTECNOLOGIE Fisiologia cellulare e Laboratorio
TRASDUZIONE DEL SEGNALE CELLULARE
 TRASDUZIONE DEL SEGNALE CELLULARE RECETTORI I recettori ormonali sono proteine (spesso glicoproteine) capaci di riconoscere e legare l ormone L interazione tra ormone e recettore è estremamente specifica
TRASDUZIONE DEL SEGNALE CELLULARE RECETTORI I recettori ormonali sono proteine (spesso glicoproteine) capaci di riconoscere e legare l ormone L interazione tra ormone e recettore è estremamente specifica
INIBIZIONE ENZIMATICA REVERSIBILE
 INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
Proteine strutturali Sostegno meccanico Cheratina: costituisce i capelli Collagene: costituisce le cartilagini Proteine di immagazzinamento
 Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Chimica generale e inorganica Studia gli elementi e i composti inorganici
 Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
INTRODUZIONE AL METABOLISMO. dal gr. metabolè = trasformazione
 INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
Complesso Maggiore di Istocompatibilita (MHC)
 Complesso Maggiore di Istocompatibilita (MHC) Scoperta dell MHC I geni dell MHC sono stati inizialmente identificati come responsabili del rapido rigetto dei tessuti trapiantati. I geni dell MHC sono polimorfi:
Complesso Maggiore di Istocompatibilita (MHC) Scoperta dell MHC I geni dell MHC sono stati inizialmente identificati come responsabili del rapido rigetto dei tessuti trapiantati. I geni dell MHC sono polimorfi:
La fissazione dell azoto
 La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
STRUTTURA TRIDIMENSIONALE DELLE PROTEINE
 STRUTTURA TRIDIMENSIONALE DELLE PROTEINE Biologia della Cellula Animale 2016 1 STRUTTURA PROTEINE Cooper: The Cell, a Molecular Approach, 2 nd ed. http://en.wikipedia.org/wiki/protein_structure STRUTTURA
STRUTTURA TRIDIMENSIONALE DELLE PROTEINE Biologia della Cellula Animale 2016 1 STRUTTURA PROTEINE Cooper: The Cell, a Molecular Approach, 2 nd ed. http://en.wikipedia.org/wiki/protein_structure STRUTTURA
TESSUTO MUSCOLARE TESSUTO NERVOSO TESSUTO CONNETTIVO TESSUTO EPITELIALE
 TESSUTO MUSCOLARE TESSUTO NERVOSO TESSUTO CONNETTIVO TESSUTO EPITELIALE TESSUTO EPITELIALE poca matrice extracellulare (lamina basale) TESSUTO CONNETTIVO abbondante matrice extracellulare ADESIONE: fenomeno
TESSUTO MUSCOLARE TESSUTO NERVOSO TESSUTO CONNETTIVO TESSUTO EPITELIALE TESSUTO EPITELIALE poca matrice extracellulare (lamina basale) TESSUTO CONNETTIVO abbondante matrice extracellulare ADESIONE: fenomeno
Le molecole biologiche. Le proteine
 Le molecole biologiche Le proteine Le proteine sono macromolecole che costituiscono la maggior parte delle strutture cellulari ed extra-cellulari Così come nel caso di lipidi e carboidrati, anch esse
Le molecole biologiche Le proteine Le proteine sono macromolecole che costituiscono la maggior parte delle strutture cellulari ed extra-cellulari Così come nel caso di lipidi e carboidrati, anch esse
Uso didattico, vietate riproduzione e vendita 1
 1 Negli organismi pluricellulari, ciascuna cellula risponde alle informazioni che ricevute dalle altre cellule. Questo meccanismo rende ciascuna cellula dipendente dalle altre. La communicazione cellulare
1 Negli organismi pluricellulari, ciascuna cellula risponde alle informazioni che ricevute dalle altre cellule. Questo meccanismo rende ciascuna cellula dipendente dalle altre. La communicazione cellulare
Serina Proteasi. Matrice Extracellulare. SERINA PROTEASI (segue) SERINA PROTEASI (segue - 2)
 Serina Proteasi Matrice Extracellulare Il sito attivo di ogni serina proteasi include un residuo di serina (Ser), un residuo di istidina (His) e un residuo di aspartato (Asp). Serina Proteasi 1 http://www.rpi.edu/dept/bcbp/molbiochem/mbweb/mb2/part1/protease.htm
Serina Proteasi Matrice Extracellulare Il sito attivo di ogni serina proteasi include un residuo di serina (Ser), un residuo di istidina (His) e un residuo di aspartato (Asp). Serina Proteasi 1 http://www.rpi.edu/dept/bcbp/molbiochem/mbweb/mb2/part1/protease.htm
Introduzione al Citoscheletro
 http://zeiss-campus.magnet.fsu.edu/galleries/cells/index.html Le cellule animali sono cellule eucariotiche caratteristiche, racchiuse da una membrana plasmatica e contenenti un nucleo circondato da una
http://zeiss-campus.magnet.fsu.edu/galleries/cells/index.html Le cellule animali sono cellule eucariotiche caratteristiche, racchiuse da una membrana plasmatica e contenenti un nucleo circondato da una
LE MEMBRANE Le membrane sono composte da lipidi e proteine in composizioni che variano in base alla specie,al tipo cellulare e all organello.
 LE MEMBRANE Le membrane sono composte da lipidi e proteine in composizioni che variano in base alla specie,al tipo cellulare e all organello.il modello a mosaico fluido descrive la struttura comune a tutte
LE MEMBRANE Le membrane sono composte da lipidi e proteine in composizioni che variano in base alla specie,al tipo cellulare e all organello.il modello a mosaico fluido descrive la struttura comune a tutte
Di cosa è fatta una cellula?
 Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O,P,S rappresentano il 99% della massa della cellula - Altri elementi più rari
Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O,P,S rappresentano il 99% della massa della cellula - Altri elementi più rari
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH. ) ed un gruppo carbossilico ( COOH) nella stessa molecola
 Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Lezione 1: Atomi e molecole:
 Lezione 1: Atomi e molecole: La materia è costituita da elementi chimici in forma pura o in combinazioni dette composti. La vita richiede circa 25 elementi chimici. La struttura atomica determina il comportamento
Lezione 1: Atomi e molecole: La materia è costituita da elementi chimici in forma pura o in combinazioni dette composti. La vita richiede circa 25 elementi chimici. La struttura atomica determina il comportamento
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Proteine. Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana)
 Proteine Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana) Ormoni e Fattori di crescita Anticorpi Trasporto Trasporto (emoglobina, LDL, HDL.) Fenotipo Proteine
Proteine Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana) Ormoni e Fattori di crescita Anticorpi Trasporto Trasporto (emoglobina, LDL, HDL.) Fenotipo Proteine
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi. Possono assumere forme diverse a seconda della funzione
 Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Vittoria Patti MACROMOLECOLE BIOLOGICHE. 4. proteine
 Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
La catalisi enzimatica. Copyright 2013 Zanichelli editore S.p.A.
 La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Concetti chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Concetti chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
IMMUNOISTOCHIMICA ASPETTI BIOCHIMICI
 Università degli Studi di Ferrara Facoltà di Scienze MM.FF.NN. Laurea Triennale in Scienze Biologiche IMMUNOISTOCHIMICA ASPETTI BIOCHIMICI Guastella Giuseppe email giuseppe.guastella@unife.it telefono
Università degli Studi di Ferrara Facoltà di Scienze MM.FF.NN. Laurea Triennale in Scienze Biologiche IMMUNOISTOCHIMICA ASPETTI BIOCHIMICI Guastella Giuseppe email giuseppe.guastella@unife.it telefono
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
Leucociti circolanti 5-10% 2-3% 60-70% 20-25% 0.1%
 Leucociti circolanti 5-10% 2-3% 60-70% 20-25% 0.1% 5% CFU=unità formante colonie Le cellule effettrici più numerose del SI innato sono cellule derivate dal midollo osseo che circolano nel sangue e migrano
Leucociti circolanti 5-10% 2-3% 60-70% 20-25% 0.1% 5% CFU=unità formante colonie Le cellule effettrici più numerose del SI innato sono cellule derivate dal midollo osseo che circolano nel sangue e migrano
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I materiali della vita
 I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
Di cosa è fatta una cellula?
 Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O rappresentano il 96% della massa della cellula - Altri component frequenti
Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O rappresentano il 96% della massa della cellula - Altri component frequenti
Una risposta cellulare specifica può essere determinata dalla presenza di mediatori chimici (ormoni o altre molecole), dall interazione con altre
 Una risposta cellulare specifica può essere determinata dalla presenza di mediatori chimici (ormoni o altre molecole), dall interazione con altre cellule (contatto cellula-cellula) o con strutture extracellulari
Una risposta cellulare specifica può essere determinata dalla presenza di mediatori chimici (ormoni o altre molecole), dall interazione con altre cellule (contatto cellula-cellula) o con strutture extracellulari
INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe.
 INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe. Gli inibitori reversibili si legano all enzima mediante
INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe. Gli inibitori reversibili si legano all enzima mediante
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
COMUNICAZIONE INTERCELLULARE
 COMUNICAZIONE INTERCELLULARE TRASFERIMENTO DIRETTO DI SEGNALI CHIMICI E ELETTRICI ATTRAVERSO GIUNZIONI COMUNICANTI COMUNICAZIONE CHIMICA LOCALE (SOSTANZE PARACRINE E AUTOCRINE) COMUNICAZIONE A LUNGA DISTANZA
COMUNICAZIONE INTERCELLULARE TRASFERIMENTO DIRETTO DI SEGNALI CHIMICI E ELETTRICI ATTRAVERSO GIUNZIONI COMUNICANTI COMUNICAZIONE CHIMICA LOCALE (SOSTANZE PARACRINE E AUTOCRINE) COMUNICAZIONE A LUNGA DISTANZA
10/03/2016. Glicosaminoglicani e proteoglicani. Membrana plasmatica GLICOCALICE 2 parte
 Membrana plasmatica GLICOCALICE 2 parte Glicosaminoglicani e proteoglicani http://biology-forums.com/index.php?action=gallery;sa=view;id=283 Glicosaminoglicani (GAGs) 1 Classe molto eterogenea di macromolecole
Membrana plasmatica GLICOCALICE 2 parte Glicosaminoglicani e proteoglicani http://biology-forums.com/index.php?action=gallery;sa=view;id=283 Glicosaminoglicani (GAGs) 1 Classe molto eterogenea di macromolecole
TCR e maturazione linfociti T
 ATTENZIONE: questi file compresi testo ed immagini in essi contenuti sono destinati esclusivamente agli studenti del corso per favorirne lo studio. Nessun file, che potrebbe contenere materiale soggetto
ATTENZIONE: questi file compresi testo ed immagini in essi contenuti sono destinati esclusivamente agli studenti del corso per favorirne lo studio. Nessun file, che potrebbe contenere materiale soggetto
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
TCR e maturazione linfociti T
 TCR e maturazione linfociti T Il recettore per l Ag dei linfociti T, T-Cell Receptor (TCR) eterodimero composto da catene a e b o g e d TCR a/b presente in 95% delle cellule T periferiche eterodimero legato
TCR e maturazione linfociti T Il recettore per l Ag dei linfociti T, T-Cell Receptor (TCR) eterodimero composto da catene a e b o g e d TCR a/b presente in 95% delle cellule T periferiche eterodimero legato
La chimica della pelle
 La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
Introduzione alla biologia della cellula. Lezione 2 Le biomolecole
 Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa.
 La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
catabolismo anabolismo
 Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
I ribosomi liberi nel citoplasma sintetizzano le proteine destinate alla via citoplasmatica, cioè quelle destinate a:
 I ribosomi liberi nel citoplasma sintetizzano le proteine destinate alla via citoplasmatica, cioè quelle destinate a: filmato Rimanere nel citoplasma Essere trasportate dal citoplasma al nucleo Essere
I ribosomi liberi nel citoplasma sintetizzano le proteine destinate alla via citoplasmatica, cioè quelle destinate a: filmato Rimanere nel citoplasma Essere trasportate dal citoplasma al nucleo Essere
Gerard Tortora, Brian Derrickson. Conosciamo
 1 Gerard Tortora, Brian Derrickson Conosciamo il corpo umano Capitolo 1 L organizzazione del corpo umano 1. Che cosa sono l anatomia e la fisiologia 2. I livelli di organizzazione e gli apparati del corpo
1 Gerard Tortora, Brian Derrickson Conosciamo il corpo umano Capitolo 1 L organizzazione del corpo umano 1. Che cosa sono l anatomia e la fisiologia 2. I livelli di organizzazione e gli apparati del corpo
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI
 REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
Chimica Biologica A.A α-elica foglietto β reverse turn
 Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
STRUTTURA E FUNZIONI
 STRUTTURA E FUNZIONI Typical Cell Membrana plasmatica Chiamata anche membrana cellulare Circonda ogni cellula Separa il contenuto cellulare dal cio che la circonda Separa il LIC dal LEC Controlla il movimento
STRUTTURA E FUNZIONI Typical Cell Membrana plasmatica Chiamata anche membrana cellulare Circonda ogni cellula Separa il contenuto cellulare dal cio che la circonda Separa il LIC dal LEC Controlla il movimento
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
La battaglia contro l influenza
 La battaglia contro l influenza Il contributo della biologia strutturale allo sviluppo di inibitori della sialidasi Prof. Elena Luraschi Virus dell influenza I virus dell influenza sono virus a RNA, con
La battaglia contro l influenza Il contributo della biologia strutturale allo sviluppo di inibitori della sialidasi Prof. Elena Luraschi Virus dell influenza I virus dell influenza sono virus a RNA, con
Tirosin chinasi senza o con funzione recettoriale
 Tirosin chinasi senza o con funzione recettoriale elica di poliprolina Il dominio chinasico di Src è mantenuto nello stato inattivo mediante due distinte interazioni intramolecolari: il legame del dominio
Tirosin chinasi senza o con funzione recettoriale elica di poliprolina Il dominio chinasico di Src è mantenuto nello stato inattivo mediante due distinte interazioni intramolecolari: il legame del dominio
I componenti chimici delle cellule
 I componenti chimici delle cellule Piccole molecole Macromolecole Piccole molecole C, H, N ed O costituiscono quasi il 99% del peso di una cellula Il 70 % della massa di una cellula è costituito da acqua
I componenti chimici delle cellule Piccole molecole Macromolecole Piccole molecole C, H, N ed O costituiscono quasi il 99% del peso di una cellula Il 70 % della massa di una cellula è costituito da acqua
MORTE CELLULARE PROGRAMMATA (PCD) O APOPTOSI Eliminazione di cellule non desiderate
 MORTE CELLULARE PROGRAMMATA (PCD) O APOPTOSI Eliminazione di cellule non desiderate meccanismo comune a tutti gli organismi SERVE PER Rimodellamento di organi e tessuti Regolazione del numero di cellule
MORTE CELLULARE PROGRAMMATA (PCD) O APOPTOSI Eliminazione di cellule non desiderate meccanismo comune a tutti gli organismi SERVE PER Rimodellamento di organi e tessuti Regolazione del numero di cellule
Le molecole biologiche. Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012
 Le molecole biologiche 1 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 2 Il carbonio deve acquistare quattro elettroni
Le molecole biologiche 1 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 2 Il carbonio deve acquistare quattro elettroni
I PROTIDI ASPETTI GENERALI
 I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
LE MOLECOLE BIOLOGICHE
 LE MOLECOLE BIOLOGICHE Le cellule contengono quattro famiglie principali di molecole organiche Zuccheri (monosaccaridi) - forniscono una fonte di energia - subunità dei polisaccaridi Amminoacidi - subunità
LE MOLECOLE BIOLOGICHE Le cellule contengono quattro famiglie principali di molecole organiche Zuccheri (monosaccaridi) - forniscono una fonte di energia - subunità dei polisaccaridi Amminoacidi - subunità
Biosintesi non ribosomiale di metaboliti peptidici bioattivi
 Biosintesi non ribosomiale di metaboliti peptidici bioattivi Strutture di alcuni peptidi bioattivi prodotti da batteri e funghi Come vengono prodotti questi peptidi? Hanno strutture complesse (spesso
Biosintesi non ribosomiale di metaboliti peptidici bioattivi Strutture di alcuni peptidi bioattivi prodotti da batteri e funghi Come vengono prodotti questi peptidi? Hanno strutture complesse (spesso
N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi
 Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Immunologia e Immunologia Diagnostica MATURAZIONE DEI LINFOCITI
 Immunologia e Immunologia Diagnostica MATURAZIONE DEI LINFOCITI Il percorso di maturazione dei linfociti Sviluppo della specicifità immunologica I linfociti B e T avviano le risposte immunitarie dopo il
Immunologia e Immunologia Diagnostica MATURAZIONE DEI LINFOCITI Il percorso di maturazione dei linfociti Sviluppo della specicifità immunologica I linfociti B e T avviano le risposte immunitarie dopo il
10/03/ Proteine di membrana
 Proteine di membrana http://www.nfsdsystems.com/w3bio315/; http://www.ncbi.nlm.nih.gov/books/nbk28193/figure/a105/?report=objectonly Proteine di membrana 1 I domini transmembrana delle proteine integrali
Proteine di membrana http://www.nfsdsystems.com/w3bio315/; http://www.ncbi.nlm.nih.gov/books/nbk28193/figure/a105/?report=objectonly Proteine di membrana 1 I domini transmembrana delle proteine integrali
LE PROTEINE -struttura tridimensionale-
 LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
Gli amminoacidi ( 20) hanno proprietà strutturali comuni
 Quando nel XIX secolo gli scienziati rivolsero per la prima volta la loro attenzione alla nutrizione, in breve tempo scoprirono che i prodotti naturali contenenti azoto erano essenziali per la nutrizione
Quando nel XIX secolo gli scienziati rivolsero per la prima volta la loro attenzione alla nutrizione, in breve tempo scoprirono che i prodotti naturali contenenti azoto erano essenziali per la nutrizione
Il livello cellulare di organizzazione: la struttura cellulare. Cattedra di Fisiologia Umana
 Il livello cellulare di organizzazione: la struttura cellulare Cattedra di Fisiologia Umana 1. La diversità delle cellule nel corpo umano Le cellule del corpo hanno molte differenti forme ed una varietà
Il livello cellulare di organizzazione: la struttura cellulare Cattedra di Fisiologia Umana 1. La diversità delle cellule nel corpo umano Le cellule del corpo hanno molte differenti forme ed una varietà
Dischi piatti (cisterne) impilate con una polarità. Microvescicole (trasporto) Macrovescicole (secrezione) Tre regioni: Cis Mediale Trans
 Apparato di Golgi Aspetto dell apparato di Golgi Dischi piatti (cisterne) impilate con una polarità. Microvescicole (trasporto) Macrovescicole (secrezione) Tre regioni: Cis Mediale Trans Funzioni dell
Apparato di Golgi Aspetto dell apparato di Golgi Dischi piatti (cisterne) impilate con una polarità. Microvescicole (trasporto) Macrovescicole (secrezione) Tre regioni: Cis Mediale Trans Funzioni dell
