Materia. Tutto ciò che occupa spazio e ha massa
|
|
|
- Alberto Coco
- 6 anni fa
- Visualizzazioni
Transcript
1 ISBN:
2 Materia Tutto ciò che occupa spazio e ha massa
3 Gli Stati della Materia Solido Liquido Gas I solidi sono rigidi ed hanno forma e volume definito. I liquidi prendono la forma del contenitore. Hanno un volume proprio. I gas assumono il volume e la forma del contenitore.
4 Materia Proprietà Fisiche Sono quelle che possono essere misurate senza alterare il tipo o la composizione del sistema materiale in considerazione Proprietà Chimiche Sono quelle legate alla capacità di trasformazione in tipologie di materia diversa
5 Proprietà Fisiche della Materia PROPRIETA CHE POSSONO ESSERE OSSERVATE E MISURATE SENZA ALTERARE LA COMPOSIZIONE DEL SISTEMA MATERIALE stato di aggregazione, dimensione, massa, volume, colore, odore, punto di fusione (T m ), punto di ebollizione (T b ), densità,...
6 DENSITA una proprietà fisica utile ed importante Densità = massa (g) volume (cm 3) Mercurio Platino Alluminio 13.6 g/cm g/cm g/cm 3
7 DENSITA La densità è una proprietà INTENSIVA della materia. NON dipende dalla quantità di materia. (come la temperatura ed il colore) Al contrario delle proprietà ESTENSIVE che Dipendono dalla quantità di materia (come la massa ed il volume )
8 La materia si può trovare sotto tre stati fisici diversi (STATI DI AGGREGAZIONE) Una fase è una porzione definita di materia con proprietà chimiche e fisiche omogenee (uniformi). I passaggi fra stati diversi della materia sono detti transizioni di fase o cambiamenti di stato e sono dei cambiamenti fisici I cambiamenti fisici avvengono senza alterazione chimica dei componenti. Chimica
9 Trasformazioni Fisiche TRASFORMAZIONI CHE AVVENGONO SENZA ALTERARE LA COMPOSIZIONE DEL SISTEMA MATERIALE ebollizione di un liquido fusione di un solido
10 Classificazione chimica della Materia Sostanze Pure Miscugli
11 Sostanze pure ELEMENTI CHIMICI - sostanze pure che non possono essere decomposte in altre sostanze più semplici, hanno una propria identità fisica e chimica e sono costituite da atomi tutti uguali. Gli elementi, i loro nomi ed i simboli sono riassunti nella TAVOLA PERIODICA Sono noti 112 elementi e quindi 112 tipi diversi di atomi Atomo: particella più piccola di un elemento che conserva le proprietà chimiche dell elemento stesso
12 La Tavola Periodica
13 Densità relative degli elementi Relative alla densità dell acqua per convenzione uguale a 1 g/cm 3 a 4 o C
14 Sostanze pure Composti sostanza pura costituita da atomi di uno o più elementi tenuti insieme da un legame chimico. Ogni composto è caratterizzato dalla sua formula chimica Un composto ha proprietà fisiche e chimiche proprie e diverse dagli elementi costituenti Molecole: le più piccole unità discrete che conservano la composizione e le caratteristiche chimiche del composto: H 2 O, CO 2, NH 3, CH 4 N.B. Non tutti i composti hanno natura molecolare
15 Sostanze pure Zinco (Zn): solido a T ambiente Zn Mercurio (Hg): liquido a T ambiente Hg Composti: costituiti da atomi almeno due elementi diversi in rapporto fisso e caratteristico K 2 Cr 2 O 7 CoCl 2 dicromato di potassio cloruro di colbalto K 2 Cr 2 O 7 NaCl CuSO 4 cloruro di sodio solfato di rame CoCl 2 NiCl 2 cloruro di nichel NiCl 2 CuSO 4 NaCl Chimica
16 composto materia sostanza pura miscela Omogenea (Soluzioni) eterogenea elemento
17 Miscele Due o più sostanze pure, composizione variabile, proprietà dipendenti dalla composizione. La composizione percentuale varia da campione a campione I componenti sono specie chimicamente diverse che mantengono la loro identità nella miscela. Temperatura di fusione/ebollizione dipendono dalla composizione e non sono più proprietà caratteristiche della sostanza. OMOGENEE: presente un unica fase (soluzione). ETEROGENEE: presenti più fasi.
18 Miscele eterogenee liquido-liquido e liquido-solido
19 Nella vita di tutti i giorni Miscela eterogenea Miscela omogenea
20 Materia Tutto ciò che occupa uno spazio e ha una massa (può essere solida, liquida o gassosa) Miscugli Combinazione di più sostanze pure avente composizione percentuale variabile; le varie sostanze pure possono essere separate con metodi fisici e mantengono le loro proprietà specifiche all interno del miscuglio; miscugli delle stesse sostanze ma con composizione diversa possono avere proprietà diverse. Metodi fisici di separazione Sostanze pure Composizione percentuale fissa dei componenti che li costituiscono; le sostanze pure NON possono essere decomposte in sostanze più semplici con metodi fisici; le proprietà sono specifiche e diverse da quelle di altre sostanze nei tre stati di aggregazione. Miscugli omogenei Hanno la stessa composizione percentuale in ogni loro parte. Miscugli eterogenei Non hanno la stessa composizione percentuale in ogni loro parte. Composti Sono formati dalla combinazione di elementi secondo rapporti di combinazione definiti e hanno proprietà diverse da quelle degli elementi costituenti. Gli elementi componenti possono essere separati solo con metodi chimici. Trasformazione chimica Elementi Non possono essere separati in sostanze più semplici neanche con metodi chimici.
21 Trasformazioni Chimiche Le trasformazioni chimiche o reazioni chimiche sono quelle che portano alla trasformazione di una o più sostanze pure in nuove sostanze con proprietà fisiche e chimiche diverse.
22 Che cosa è la Chimica? La chimica è la disciplina scientifica che studia la struttura, la composizione le proprietà dei sistemi materiali naturali e artificiali, interessandosi soprattutto alle trasformazioni chimiche delle sostanze di cui tali sistemi sono costituiti. La chimica è la scienza che studia la materia: la sua struttura le sue proprietà le sue trasformazioni le sue interazioni con l energia
23 Obiettivi minimi 1) Classificare la materia: a) riconoscere la differenza tra i diversi stati della materia; b) Riconoscere le differenze fra sostanze pure e miscele; c) riconoscere la differenza tra miscele omogenee ed eterogenee. 2) Usare correttamente i termini atomo, elemento, molecola e composto 3) Elencare le proprietà fisiche più comuni della materia 4) Cogliere la differenza tra trasformazione fisica e trasformazione chimica 5) Cogliere la differenza tra proprietà intensiva ed estensiva
Materia. Tutto ciò che occupa spazio e ha massa
 Materia Tutto ciò che occupa spazio e ha massa Gli Stati della Materia Solido Liquido Gas I solidi sono rigidi ed hanno forma e volume definito. I liquidi prendono la forma del contenitore. Hanno un volume
Materia Tutto ciò che occupa spazio e ha massa Gli Stati della Materia Solido Liquido Gas I solidi sono rigidi ed hanno forma e volume definito. I liquidi prendono la forma del contenitore. Hanno un volume
reazioni Sostanze Reazioni di sintesi Reazioni di decomposizione
 Si consumano nelle reazioni Si formano nelle reagenti Si trasformano con prodotti Sostanze Sostanze semplici Sostanze composte Non ottenibili con Non decomponibili con Reazioni di sintesi Reazioni di decomposizione
Si consumano nelle reazioni Si formano nelle reagenti Si trasformano con prodotti Sostanze Sostanze semplici Sostanze composte Non ottenibili con Non decomponibili con Reazioni di sintesi Reazioni di decomposizione
Un sistema è una porzione delimitata di materia.
 1. La materia e le sue caratteristiche Un sistema è una porzione delimitata di materia. 1. La materia e le sue caratteristiche Gli stati fisici in cui la materia si può trovare sono: solido; liquido; aeriforme.
1. La materia e le sue caratteristiche Un sistema è una porzione delimitata di materia. 1. La materia e le sue caratteristiche Gli stati fisici in cui la materia si può trovare sono: solido; liquido; aeriforme.
Chimica. Lezione 1 La materia
 Chimica Lezione 1 La materia Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido, gassoso) o della COMPOSIZIONE
Chimica Lezione 1 La materia Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido, gassoso) o della COMPOSIZIONE
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 2 Le trasformazioni fisiche della materia 1. La materia e le sue caratteristiche 2. I sistemi omogenei e i sistemi
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 2 Le trasformazioni fisiche della materia 1. La materia e le sue caratteristiche 2. I sistemi omogenei e i sistemi
Classificazione della materia: Sostanze pure e miscugli
 Classificazione della materia: Sostanze pure e miscugli la composizione e quindi le proprietà intensive sono le stesse in ogni parte del sistema La composizione e le proprietà intensive variano da una
Classificazione della materia: Sostanze pure e miscugli la composizione e quindi le proprietà intensive sono le stesse in ogni parte del sistema La composizione e le proprietà intensive variano da una
Sostanza pura. Il termine sostanza indica il tipo di materia di cui è fatto un corpo.
 Sostanza pura Il termine sostanza indica il tipo di materia di cui è fatto un corpo. Corpi formati da un unico tipo di materia sono costituiti da sostanze pure. Una sostanza pura ha composizione definita
Sostanza pura Il termine sostanza indica il tipo di materia di cui è fatto un corpo. Corpi formati da un unico tipo di materia sono costituiti da sostanze pure. Una sostanza pura ha composizione definita
Sostanza pura. Il termine sostanza indica il tipo di materia di cui è fatto un corpo.
 Sostanza pura Il termine sostanza indica il tipo di materia di cui è fatto un corpo. Corpi formati da un unico tipo di materia sono costituiti da sostanze pure. Una sostanza pura ha composizione definita
Sostanza pura Il termine sostanza indica il tipo di materia di cui è fatto un corpo. Corpi formati da un unico tipo di materia sono costituiti da sostanze pure. Una sostanza pura ha composizione definita
Classificazione della materia 3 STATI DI AGGREGAZIONE
 Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
CHIMICA GENERALE ED INORGANICA
 Corso di Laurea in Biotecnologie CHIMICA GENERALE ED INORGANICA Autori: Nivaldo J. Tro Chimica Un approccio molecolare EdiSES Per gli esercizi Autori : Rossi, Tesauro, Saviano, Randazzo Casa Editrice :
Corso di Laurea in Biotecnologie CHIMICA GENERALE ED INORGANICA Autori: Nivaldo J. Tro Chimica Un approccio molecolare EdiSES Per gli esercizi Autori : Rossi, Tesauro, Saviano, Randazzo Casa Editrice :
Chimica Generale ed Inorganica
 CCS-Biologia CCS- Scienze Geologiche A.A. 2016-2017 Chimica Generale ed Inorganica Prof. Francesco Isaia Prof. Vito Lippolis Dipartimento di Scienze Chimiche e Geologiche Cittadella Universitaria Email:
CCS-Biologia CCS- Scienze Geologiche A.A. 2016-2017 Chimica Generale ed Inorganica Prof. Francesco Isaia Prof. Vito Lippolis Dipartimento di Scienze Chimiche e Geologiche Cittadella Universitaria Email:
LA MATERIA E IL MODELLO PARTICELLARE
 LA MATERIA E IL MODELLO PARTICELLARE - Gli oggetti che ci circondano sono costituiti di materia. - Come possiamo definire la materia? La materia è tutto ciò che possiede una massa e occupa un volume. -
LA MATERIA E IL MODELLO PARTICELLARE - Gli oggetti che ci circondano sono costituiti di materia. - Come possiamo definire la materia? La materia è tutto ciò che possiede una massa e occupa un volume. -
CdS Ingegneria Industriale: Corso di Chimica
 CdS Ingegneria Industriale: Corso di Chimica Docente : Informazioni generali Candida MILONE cmilone@ingegneria.unime.it Ricevimento Mar e Gio 15:00-17:00 Struttura del corso: Verifiche: 54 ore di lezioni
CdS Ingegneria Industriale: Corso di Chimica Docente : Informazioni generali Candida MILONE cmilone@ingegneria.unime.it Ricevimento Mar e Gio 15:00-17:00 Struttura del corso: Verifiche: 54 ore di lezioni
Introduzione alla Chimica. Paolo Mazza
 Introduzione alla Chimica Paolo Mazza 2 aprile 2013 Indice 1 Introduzione 2 2 Le teorie della materia 4 2.1 Teoria atomica.................................... 4 2.2 Teoria cinetica.....................................
Introduzione alla Chimica Paolo Mazza 2 aprile 2013 Indice 1 Introduzione 2 2 Le teorie della materia 4 2.1 Teoria atomica.................................... 4 2.2 Teoria cinetica.....................................
DAI MISCUGLI ALLE SOSTANZE PURE
 Come si presenta la materia? DAI MISCUGLI ALLE SOSTANZE PURE Il criterio per distinguere i materiali è la presenza di una o più FASI porzioni di materia fisicamente distinte tra loro delimitate da nette
Come si presenta la materia? DAI MISCUGLI ALLE SOSTANZE PURE Il criterio per distinguere i materiali è la presenza di una o più FASI porzioni di materia fisicamente distinte tra loro delimitate da nette
Cosa studia la chimica?
 Cosa studia la chimica? MATERIA : COMPOSIZIONE STRUTTURA TRASFORMAZIONI Materia: tutto ciò che è dotato di massa e volume. Sistema: porzione di materia oggetto del nostro studio. SISTEMI OMOGENEI (identiche
Cosa studia la chimica? MATERIA : COMPOSIZIONE STRUTTURA TRASFORMAZIONI Materia: tutto ciò che è dotato di massa e volume. Sistema: porzione di materia oggetto del nostro studio. SISTEMI OMOGENEI (identiche
La chimica studia la materia e i cambiamenti ai quali essa va soggetta. La materia è tutto ciò che possiede massa e occupa spazio.
 La chimica studia la materia e i cambiamenti ai quali essa va soggetta. La materia è tutto ciò che possiede massa e occupa spazio. Tutto ciò che potete toccare è materia, e materia sono moltissime cose
La chimica studia la materia e i cambiamenti ai quali essa va soggetta. La materia è tutto ciò che possiede massa e occupa spazio. Tutto ciò che potete toccare è materia, e materia sono moltissime cose
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero La vita è una reazione chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola
La Vita è una Reazione Chimica Acqua Oro Zucchero La vita è una reazione chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola
Corso di chimica generale
 Corso di chimica generale Dr. Riccardo Montioli Email: riccardo.montioli@univr.it Programma - La materia e l energia - Le particelle subatomiche e la misura della massa - L atomo, teorie e struttura -
Corso di chimica generale Dr. Riccardo Montioli Email: riccardo.montioli@univr.it Programma - La materia e l energia - Le particelle subatomiche e la misura della massa - L atomo, teorie e struttura -
CHIMICA (Corso Integrato) CHIMICA GENERALE ED INORGANICA Dott. Francesco Musiani (6 crediti -48 ore)
 CHIMICA (Corso Integrato) CHIMICA GENERALE ED INORGANICA Dott. Francesco Musiani (6 crediti -48 ore) Orario (prime tre settimane di Ottobre) Mercoledì 14-16 Giovedì 14-16 Venerdì 14-16 Chimica Generale
CHIMICA (Corso Integrato) CHIMICA GENERALE ED INORGANICA Dott. Francesco Musiani (6 crediti -48 ore) Orario (prime tre settimane di Ottobre) Mercoledì 14-16 Giovedì 14-16 Venerdì 14-16 Chimica Generale
Le sostanze chimiche
 Le sostanze chimiche Ingredienti base della materia La materia si presenta con diverse forme. Accade perché esistono moltissimi «ingredienti di base» che mescolandosi tra loro danno innumerevoli combinazioni.
Le sostanze chimiche Ingredienti base della materia La materia si presenta con diverse forme. Accade perché esistono moltissimi «ingredienti di base» che mescolandosi tra loro danno innumerevoli combinazioni.
CURRICOLO VERTICALE DI SCIENZE a.s (nuovo biennio) CLASSE PRIMA CHIMICA I SISTEMI CHIMICI. Competenze. Abilità/Capacità.
 CURRICOLO VERTICALE DI SCIENZE a.s 2011-2012 (nuovo biennio) CLASSE PRIMA CHIMICA I SISTEMI CHIMICI Competenze Abilità/Capacità Conoscenze Attività di laboratorio correlate MISURARE 1 / 56 TABULARE ED
CURRICOLO VERTICALE DI SCIENZE a.s 2011-2012 (nuovo biennio) CLASSE PRIMA CHIMICA I SISTEMI CHIMICI Competenze Abilità/Capacità Conoscenze Attività di laboratorio correlate MISURARE 1 / 56 TABULARE ED
Le soluzioni. Lezioni d'autore di Giorgio Benedetti
 Le soluzioni Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) La materia che ci circonda normalmente non è formata da elementi chimici o da composti, ma da miscugli, cioè insiemi di più sostanze
Le soluzioni Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) La materia che ci circonda normalmente non è formata da elementi chimici o da composti, ma da miscugli, cioè insiemi di più sostanze
Chimica. La Chimica è la scienza che cerca di comprendere il comportamento della materia studiando il comportamento di atomi e molecole
 Chimica La Chimica è la scienza che descrive la materia, le sue proprietà e le trasformazioni che essa subisce, insieme alle variazioni energetiche che accompagnano questi processi La Chimica è la scienza
Chimica La Chimica è la scienza che descrive la materia, le sue proprietà e le trasformazioni che essa subisce, insieme alle variazioni energetiche che accompagnano questi processi La Chimica è la scienza
Corso di Studi in Scienze Naturali Corso di Chimica Generale e Inorganica Dott.ssa Maria Cristina Paganini Prof. Elio Giamello
 Corso di Studi in Scienze Naturali Corso di Chimica Generale e Inorganica Dott.ssa Maria Cristina Paganini Prof. Elio Giamello Avvertenza: Le immagini seguenti, proiettate durante le lezioni sono tratte
Corso di Studi in Scienze Naturali Corso di Chimica Generale e Inorganica Dott.ssa Maria Cristina Paganini Prof. Elio Giamello Avvertenza: Le immagini seguenti, proiettate durante le lezioni sono tratte
LA COSTITUZIONE DELLA MATERIA
 LA COSTITUZIONE DELLA MATERIA 1.1 La chimica e le altre discipline scientifiche 1.2 Il metodo scientifico 1.3 Le proprietà della materia 1.4 Gli stati di aggregazione della materia 1 ATOMI ED ELEMENTI:
LA COSTITUZIONE DELLA MATERIA 1.1 La chimica e le altre discipline scientifiche 1.2 Il metodo scientifico 1.3 Le proprietà della materia 1.4 Gli stati di aggregazione della materia 1 ATOMI ED ELEMENTI:
Un elemento è una sostanza pura che non può essere divisa in sostanze più semplici. Le sue molecole sono tutte uguali.
 Elementi, composti, miscugli Un elemento è una sostanza pura che non può essere divisa in sostanze più semplici. Le sue molecole sono tutte uguali. Il composto è formato da sostanze pure scomponibili in
Elementi, composti, miscugli Un elemento è una sostanza pura che non può essere divisa in sostanze più semplici. Le sue molecole sono tutte uguali. Il composto è formato da sostanze pure scomponibili in
Cos è un trasformazione chimica?
 Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
UNITA DIDATTICA P A1.01
 Titolo: Grandezze fisiche fondamentali e derivate, unità di misura. Conversioni di unità di misura e notazione scientifica. Codice: A1-P-Tec-Gra Campo di indagine della chimica. Il Sistema Internazionale
Titolo: Grandezze fisiche fondamentali e derivate, unità di misura. Conversioni di unità di misura e notazione scientifica. Codice: A1-P-Tec-Gra Campo di indagine della chimica. Il Sistema Internazionale
Chimica Generale ed Inorganica
 Dipartimento di Ecologia e Biologia Chimica Generale ed Inorganica Prof.ssa Giorgia Botta Contatti Tel: 0761-357314 Dipartimento DEB Facoltà di Agraria, lab 08 e-mail: botta.giorgia@gmail.com Proprietà,
Dipartimento di Ecologia e Biologia Chimica Generale ed Inorganica Prof.ssa Giorgia Botta Contatti Tel: 0761-357314 Dipartimento DEB Facoltà di Agraria, lab 08 e-mail: botta.giorgia@gmail.com Proprietà,
PROGRAMMAZIONE CONSUNTIVA Codice Mod. RQ 10.3 Pag 1/7
 I.T.C.S. ERASMO DA ROTTERDAM Liceo Artistico indirizzo Grafica - Liceo delle Scienze Umane opz. Economico sociale ITI Informatica e telecomunicazioni - ITI Costruzioni, ambiente e territorio Edile Elettronico
I.T.C.S. ERASMO DA ROTTERDAM Liceo Artistico indirizzo Grafica - Liceo delle Scienze Umane opz. Economico sociale ITI Informatica e telecomunicazioni - ITI Costruzioni, ambiente e territorio Edile Elettronico
Cosa significa materia?
 Cosa significa materia? Deriva dal latino mater che significa «madre». Le caratteristiche fondamentali della materia Ha una massa che si esprime in chilogrammi (kg) Ha un volume che si esprime in metri
Cosa significa materia? Deriva dal latino mater che significa «madre». Le caratteristiche fondamentali della materia Ha una massa che si esprime in chilogrammi (kg) Ha un volume che si esprime in metri
Le trasformazioni chimiche e fisiche della materia. Lezioni d'autore di Giorgio Benedetti
 Le trasformazioni chimiche e fisiche della materia Lezioni d'autore di Giorgio Benedetti INTRODUZIONE (I) VIDEO INTRODUZIONE (II) La comprensione delle proprietà delle sostanze e le trasformazioni che
Le trasformazioni chimiche e fisiche della materia Lezioni d'autore di Giorgio Benedetti INTRODUZIONE (I) VIDEO INTRODUZIONE (II) La comprensione delle proprietà delle sostanze e le trasformazioni che
Compiti estivi di chimica classe 1Ag
 Compiti estivi di chimica classe Ag Separare un miscuglio secondo le tecniche studiate. Quale metodo di separazione potrebbe essere utilizzato per separare un miscuglio formato da sale mescolato con frammenti
Compiti estivi di chimica classe Ag Separare un miscuglio secondo le tecniche studiate. Quale metodo di separazione potrebbe essere utilizzato per separare un miscuglio formato da sale mescolato con frammenti
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
Struttura atomica della materia
 Struttura atomica della materia 1 FASE fase 3 fase 1 fase 2 FASE: porzione di materia chimicamente e fisicamente omogenea delimitata da superfici di separazione ben definite 2 Classificazione della materia
Struttura atomica della materia 1 FASE fase 3 fase 1 fase 2 FASE: porzione di materia chimicamente e fisicamente omogenea delimitata da superfici di separazione ben definite 2 Classificazione della materia
Lezione 2. Leggi ponderali
 Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Chimica. Lezione 2 La materia Il legame chimico (Parte I)
 Chimica Lezione 2 La materia Il legame chimico (Parte I) Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido,
Chimica Lezione 2 La materia Il legame chimico (Parte I) Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido,
Chimica. La Chimica è la scienza che cerca di comprendere il comportamento della materia studiando il comportamento di atomi e molecole
 Chimica La Chimica è la scienza che descrive la materia, le sue proprietà e le trasformazioni che essa subisce, insieme alle variazioni energetiche che accompagnano questi processi La Chimica è la scienza
Chimica La Chimica è la scienza che descrive la materia, le sue proprietà e le trasformazioni che essa subisce, insieme alle variazioni energetiche che accompagnano questi processi La Chimica è la scienza
Capitolo 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino
 Capitolo 3 LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!!
Capitolo 3 LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!!
CLASSE SECONDA (chimica)
 CLASSE SECONDA (chimica) MODULO N.1 : LA MATERIA Analizzare dati e interpretarli sviluppando deduzioni e ragionamenti sugli stessi anche con l ausilio di rappresentazioni grafiche UNITA DI APPRENDIMENTO
CLASSE SECONDA (chimica) MODULO N.1 : LA MATERIA Analizzare dati e interpretarli sviluppando deduzioni e ragionamenti sugli stessi anche con l ausilio di rappresentazioni grafiche UNITA DI APPRENDIMENTO
Esercizi di. Stechiometria dei composti. mercoledì 9 dicembre 2015
 Esercizi di Stechiometria dei composti mercoledì 9 dicembre 2015 Il cloro ha due isotopi stabili contenenti rispettivamente 18 e 20 neutroni. Utilizzando la tavola periodica degli elementi, scrivere i
Esercizi di Stechiometria dei composti mercoledì 9 dicembre 2015 Il cloro ha due isotopi stabili contenenti rispettivamente 18 e 20 neutroni. Utilizzando la tavola periodica degli elementi, scrivere i
CHIMICA GENERALE CON LABORATORIO ED ELEMENTI DI ORGANICA (12 CFU) STRUTTURA DEL CORSO
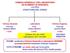 CHIMICA GENERALE CON LABORATORIO ED ELEMENTI DI ORGANICA (12 CFU) STRUTTURA DEL CORSO Chimica Generale Laboratorio Chimica Organica Prof.ssa Barbara Milani 7 CFU Prof. Tiziano Montini 2 CFU Lezione: 8/11
CHIMICA GENERALE CON LABORATORIO ED ELEMENTI DI ORGANICA (12 CFU) STRUTTURA DEL CORSO Chimica Generale Laboratorio Chimica Organica Prof.ssa Barbara Milani 7 CFU Prof. Tiziano Montini 2 CFU Lezione: 8/11
La CHIMICA, come tutte le scienze, ha un suo LINGUAGGIO e un METODO
 La CHIMICA, come tutte le scienze, ha un suo LINGUAGGIO e un METODO La Chimica è lo studio delle trasformazioni della materia La materia è Tutto ciò che ha massa Tutto ciò che occupa spazio Tutto ciò che
La CHIMICA, come tutte le scienze, ha un suo LINGUAGGIO e un METODO La Chimica è lo studio delle trasformazioni della materia La materia è Tutto ciò che ha massa Tutto ciò che occupa spazio Tutto ciò che
LICEO SCIENTIFICO STATALE R. CACCIOPPOLI ANNO SCOLASTICO 2012/13 CLASSE III G PROGRAMMA DI SCIENZE PROF.SSA ANGELOZZI ROBERTA CHIMICA
 LICEO SCIENTIFICO STATALE R. CACCIOPPOLI ANNO SCOLASTICO 2012/13 CLASSE III G PROGRAMMA DI SCIENZE PROF.SSA ANGELOZZI ROBERTA CHIMICA Misure e grandezze: Il Sistema Internazionale di unità di misura Grandezze
LICEO SCIENTIFICO STATALE R. CACCIOPPOLI ANNO SCOLASTICO 2012/13 CLASSE III G PROGRAMMA DI SCIENZE PROF.SSA ANGELOZZI ROBERTA CHIMICA Misure e grandezze: Il Sistema Internazionale di unità di misura Grandezze
Amministrazione, finanza e marketing - Turismo Ministero dell Istruzione, dell Università e della Ricerca PROGRAMMAZIONE DISCIPLINARE PER U. di A.
 MATERIA CHIMICA CLASSE 2 INDIRIZZO AFM / TUR DESCRIZIONE Unità di Apprendimento UdA n. 1 Titolo: LA MATERIA Aver acquisito la capacità di osservare, descrivere ed analizzare i fenomeni legati alle trasformazioni
MATERIA CHIMICA CLASSE 2 INDIRIZZO AFM / TUR DESCRIZIONE Unità di Apprendimento UdA n. 1 Titolo: LA MATERIA Aver acquisito la capacità di osservare, descrivere ed analizzare i fenomeni legati alle trasformazioni
LE PROPRIETA DELLA MATERIA
 LE PROPRIETA DELLA MATERIA Gli aspetti macroscopico, microscopico e particellare della materia La materia è tutto ciò che possiede una massa e occupa un volume, cioè una porzione di spazio Un campione
LE PROPRIETA DELLA MATERIA Gli aspetti macroscopico, microscopico e particellare della materia La materia è tutto ciò che possiede una massa e occupa un volume, cioè una porzione di spazio Un campione
LEGAMI INTERMOLECOLARI LEGAMI INTERMOLECOLARI
 I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
PROGRAMMAZIONE DIPARTIMENTO LE SCIENZE CHIMICA CLASSI PRIME. Le misure le trasformazioni chimiche e fisiche la mole A.S. 2016/2017
 PROGRAMMAZIONE DIPARTIMENTO LE SCIENZE CHIMICA CLASSI PRIME Le misure le trasformazioni chimiche e fisiche la mole A.S. 2016/2017 Rev. 0 del 08-03-04 pag. 1 5 Le Misure e le Grandezze Per stuare la composizione,
PROGRAMMAZIONE DIPARTIMENTO LE SCIENZE CHIMICA CLASSI PRIME Le misure le trasformazioni chimiche e fisiche la mole A.S. 2016/2017 Rev. 0 del 08-03-04 pag. 1 5 Le Misure e le Grandezze Per stuare la composizione,
14. Transizioni di Fase_a.a. 2009/2010 TRANSIZIONI DI FASE
 TRANSIZIONI DI FASE Fase: qualsiasi parte di un sistema omogenea, di composizione chimica costante e in un determinato stato fisico. Una fase può avere le stesse variabili intensive (P, T etc) ma ha diverse
TRANSIZIONI DI FASE Fase: qualsiasi parte di un sistema omogenea, di composizione chimica costante e in un determinato stato fisico. Una fase può avere le stesse variabili intensive (P, T etc) ma ha diverse
Scienziati in Erba Chimica
 Scienziati in Erba Chimica Acqua Oro Zucchero La Chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola periodica degli elementi
Scienziati in Erba Chimica Acqua Oro Zucchero La Chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola periodica degli elementi
Intro & Stechiometria
 CHIMICA Studio della materia (composizione, stru7ura e proprietà) e dei suoi cambiamen; (trasformazioni) Azione: su due livelli macroscopico (proprietà e trasformazioni della materia visibile) microscopico
CHIMICA Studio della materia (composizione, stru7ura e proprietà) e dei suoi cambiamen; (trasformazioni) Azione: su due livelli macroscopico (proprietà e trasformazioni della materia visibile) microscopico
R E L A Z I O N E F I N A L E. disponibilità alla collaborazione. Discreta l attenzione e l interesse sia durante le
 ISTITUTO STATALE di ISTRUZIONE SUPERIORE DI SAN DANIELE DEL FRIULI VINCENZO MANZINI CORSI DI STUDIO: Amministrazione, Finanza e Marketing/IGEA Costruzioni, Ambiente e Territorio/Geometri Liceo Linguistico/Linguistico
ISTITUTO STATALE di ISTRUZIONE SUPERIORE DI SAN DANIELE DEL FRIULI VINCENZO MANZINI CORSI DI STUDIO: Amministrazione, Finanza e Marketing/IGEA Costruzioni, Ambiente e Territorio/Geometri Liceo Linguistico/Linguistico
Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza?
 Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza? Fisicamente è impossibile contare gli atomi contenuti in una data quantita di sostanza. E impossibile
Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza? Fisicamente è impossibile contare gli atomi contenuti in una data quantita di sostanza. E impossibile
OGRAMMA DI CHIMICA 2016
 ISTITUT TO DI ISTRUZIONE SUPERIORE M MARIANO IV D ARBOREA Sede distaccata IPSIA di GHILARZA PRO OGRAMMA DI CHIMICA A.S. 2015-2016 2016 Classe: I sez. A Docenti: Federica Piras, Carmelo Floris PARTE TEORICA
ISTITUT TO DI ISTRUZIONE SUPERIORE M MARIANO IV D ARBOREA Sede distaccata IPSIA di GHILARZA PRO OGRAMMA DI CHIMICA A.S. 2015-2016 2016 Classe: I sez. A Docenti: Federica Piras, Carmelo Floris PARTE TEORICA
Programma di CHIMICA E LABORATORIO
 Istituto di Istruzione Secondaria Superiore Statale «IIS Via Silvestri 301» Plesso «ALESSANDRO VOLTA» Programma di CHIMICA E LABORATORIO Classe 1 a A Indirizzo ELETTRONICA ED ELETTROTECNICA Anno Scolastico
Istituto di Istruzione Secondaria Superiore Statale «IIS Via Silvestri 301» Plesso «ALESSANDRO VOLTA» Programma di CHIMICA E LABORATORIO Classe 1 a A Indirizzo ELETTRONICA ED ELETTROTECNICA Anno Scolastico
SCIENZE INTEGRATE CHIMICA
 SCIENZE INTEGRATE CHIMICA Classi 2 e TECNICO ECONOMICO (REL- AMM-SPO) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO U.D.A. Periodo Ore lezione 1. Classificazione della materia: stati fisici e miscugli settembre
SCIENZE INTEGRATE CHIMICA Classi 2 e TECNICO ECONOMICO (REL- AMM-SPO) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO U.D.A. Periodo Ore lezione 1. Classificazione della materia: stati fisici e miscugli settembre
Corso di CHIMICA INORGANICA
 Corso di CHIMICA INORGANICA Lezione Seconda La teoria atomica La massa atomica e il concetto di Isotopi Dentro l atomo, le particelle subatomiche La Tavola Periodica degli Elementi 2 Gli atomi di un certo
Corso di CHIMICA INORGANICA Lezione Seconda La teoria atomica La massa atomica e il concetto di Isotopi Dentro l atomo, le particelle subatomiche La Tavola Periodica degli Elementi 2 Gli atomi di un certo
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni
 CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni composto materia sostanza pura miscela omogenea elemento eterogenea Elementi, Composti e Miscele Miscela eterogenea
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni composto materia sostanza pura miscela omogenea elemento eterogenea Elementi, Composti e Miscele Miscela eterogenea
La mole e la massa molare
 La mole e la massa molare Un concetto strettamente correlato al peso relativo e fondamentale in chimica per i calcoli quantitativi è quello di mole. La mole è l unità di misura di una delle sette grandezze
La mole e la massa molare Un concetto strettamente correlato al peso relativo e fondamentale in chimica per i calcoli quantitativi è quello di mole. La mole è l unità di misura di una delle sette grandezze
COMPITI PER IL RIPASSO ESTIVO SCIENZE DELLA TERRA CLASSI PRIME
 COMPITI PER IL RIPASSO ESTIVO SCIENZE DELLA TERRA CLASSI PRIME Con l aiuto degli appunti di lezione, di internet, e del libro di testo ( che puoi richiedere in segreteria) rispondi nella maniera più completa
COMPITI PER IL RIPASSO ESTIVO SCIENZE DELLA TERRA CLASSI PRIME Con l aiuto degli appunti di lezione, di internet, e del libro di testo ( che puoi richiedere in segreteria) rispondi nella maniera più completa
9065X Chimica. Modello esame svolto. Esempio di compito scritto di Chimica. Politecnico di Torino CeTeM
 svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
INDICAZIONI ED ESERCIZI PER LA PREPARAZIONE ALLA PROVA DI VERIFICA DI SETTEMBRE SCIENZE INTEGRATE (CHIMICA)
 ISTITUTO DI ISTRUZIONE SUPERIORE CHINO CHINI Via Pietro Caiani 68-50032 Borgo San Lorenzo (Fi) Tel. 055.8459.268 - Fax 055.8495.131 Sito Web: www.chinochini.it - E-mail: chinochini@tin.it - PEC FIIS02300N@PEC.ISTRUZIONE.IT
ISTITUTO DI ISTRUZIONE SUPERIORE CHINO CHINI Via Pietro Caiani 68-50032 Borgo San Lorenzo (Fi) Tel. 055.8459.268 - Fax 055.8495.131 Sito Web: www.chinochini.it - E-mail: chinochini@tin.it - PEC FIIS02300N@PEC.ISTRUZIONE.IT
Chimica. 1) Il simbolo del Carbonio è: A) C B) Ca. C) Ce D) Cu. 2) Secondo il principio della conservazione della materia:
 Chimica 1) Il simbolo del Carbonio è: A) C B) Ca C) Ce D) Cu 2) Secondo il principio della conservazione della materia: A) Durante le reazioni chimiche il numero totale di atomi di ciascun elemento chimico
Chimica 1) Il simbolo del Carbonio è: A) C B) Ca C) Ce D) Cu 2) Secondo il principio della conservazione della materia: A) Durante le reazioni chimiche il numero totale di atomi di ciascun elemento chimico
Istituto di Istruzione Secondaria Superiore Statale «IIS Via Silvestri 301»
 «IIS Via Silvestri 301» Programma di CHIMICA E LABORATORIO Classe 1 a B Indirizzo ELETTRONICA ED ELETTROTECNICA ARGOMENTO 1 Dai miscugli alle sostanze 1.1 Osservando la materia 1.2 Grandezze e strumenti
«IIS Via Silvestri 301» Programma di CHIMICA E LABORATORIO Classe 1 a B Indirizzo ELETTRONICA ED ELETTROTECNICA ARGOMENTO 1 Dai miscugli alle sostanze 1.1 Osservando la materia 1.2 Grandezze e strumenti
CHIMICA QUANTITATIVA. Massa atomica. Unità di massa atomica. Massa molare
 CHIMICA QUANTITATIVA Unità di massa atomica Massa atomica Mole Massa molare 1 L unità di misura della massa è pari a 1/12 della massa dell isotopo 12 6C Questa quantità si chiama unità di massa atomica
CHIMICA QUANTITATIVA Unità di massa atomica Massa atomica Mole Massa molare 1 L unità di misura della massa è pari a 1/12 della massa dell isotopo 12 6C Questa quantità si chiama unità di massa atomica
ISTITUTO D ISTRUZIONE SUPERIORE Vincenzo Manzini
 ISTITUTO D ISTRUZIONE SUPERIORE Vincenzo Manzini Corsi di Studio: Amministrazione, Finanza e Marketing/IGEA- Costruzioni, Ambiente e Territorio/Geometra Liceo Linguistico/Linguistico Moderno - Liceo Scientifico
ISTITUTO D ISTRUZIONE SUPERIORE Vincenzo Manzini Corsi di Studio: Amministrazione, Finanza e Marketing/IGEA- Costruzioni, Ambiente e Territorio/Geometra Liceo Linguistico/Linguistico Moderno - Liceo Scientifico
LE TRASFORMAZIONI FISICHE DELLA MATERIA
 Capitolo 2 LE TRASFORMAZIONI FISICHE DELLA MATERIA N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo
Capitolo 2 LE TRASFORMAZIONI FISICHE DELLA MATERIA N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 4 Le teorie della materia 3 Sommario 1. L atomo e la sua storia 2. Le «prove sperimentali» della teoria atomica 3. La teoria
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 4 Le teorie della materia 3 Sommario 1. L atomo e la sua storia 2. Le «prove sperimentali» della teoria atomica 3. La teoria
risposte agli esercizi del libro
 risposte agli esercizi del libro 1 SOLUZIONI ESERCIZI FINE CPITOLO 1 B D C 4 C 5 B 6 C 7 D 8 9 D 11 C 1 B 1 B 14 B 15 C 16 C 18 B 19 a) fisica; b) materiale; c) macroscopica; d) fusione; e) hanno-non occupano
risposte agli esercizi del libro 1 SOLUZIONI ESERCIZI FINE CPITOLO 1 B D C 4 C 5 B 6 C 7 D 8 9 D 11 C 1 B 1 B 14 B 15 C 16 C 18 B 19 a) fisica; b) materiale; c) macroscopica; d) fusione; e) hanno-non occupano
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni
 CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni Lavoisier e la legge di conservazione della massa Lavoisier riconobbe l importanza delle misurazioni accurate
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni Lavoisier e la legge di conservazione della massa Lavoisier riconobbe l importanza delle misurazioni accurate
Atomi, molecole e ioni
 Atomi, molecole e ioni anione + - catione Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento
Atomi, molecole e ioni anione + - catione Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento
Chimica: Studio della materia e delle sue interazioni.
 Chimica: Studio della materia e delle sue interazioni. La descrizione della materia viene affrontata da: punto di vista microscopico: studio di atomi e molecole le loro interazioni e le reazioni chimiche
Chimica: Studio della materia e delle sue interazioni. La descrizione della materia viene affrontata da: punto di vista microscopico: studio di atomi e molecole le loro interazioni e le reazioni chimiche
Il modello strutturale dell atomo
 Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
*M I03* 3/20. perforiran list
 *M15143112I* 2/20 *M15143112I02* *M15143112I03* 3/20 P perforiran list 4/20 *M15143112I04* Pagina vuota *M15143112I05* 5/20 1. L'atomo di un certo elemento contiene 20 neutroni e 17 protoni. 1.1. Scrivete
*M15143112I* 2/20 *M15143112I02* *M15143112I03* 3/20 P perforiran list 4/20 *M15143112I04* Pagina vuota *M15143112I05* 5/20 1. L'atomo di un certo elemento contiene 20 neutroni e 17 protoni. 1.1. Scrivete
DALL ANALISI QUALITATIVA ALLE
 DALL ANALISI QUALITATIVA ALLE LEGGI MASSALI Michele Kodrič RISCALDANDO GLI ELEMENTI ZOLFO E RAME,QUESTI REAGISCONO,DANDO UNA NUOVA SOSTANZA DI COLORE NERO ZOLFO + RAME = SOLFURO RAMEICO GIALLO + ROSSO
DALL ANALISI QUALITATIVA ALLE LEGGI MASSALI Michele Kodrič RISCALDANDO GLI ELEMENTI ZOLFO E RAME,QUESTI REAGISCONO,DANDO UNA NUOVA SOSTANZA DI COLORE NERO ZOLFO + RAME = SOLFURO RAMEICO GIALLO + ROSSO
I.I.S. N. BOBBIO di CARIGNANO - PROGRAMMAZIONE PER L A. S
 I.I.S. N. BOBBIO di CARIGNANO - PROGRAMMAZIONE PER L A. S. 2016-17 DISCIPLINA: SCIENZE NATURALI (Indirizzi Liceo scientifico tradizionale e sportivo) CLASSE: PRIMA (tutte le sezioni) COMPETENZE DI BASE
I.I.S. N. BOBBIO di CARIGNANO - PROGRAMMAZIONE PER L A. S. 2016-17 DISCIPLINA: SCIENZE NATURALI (Indirizzi Liceo scientifico tradizionale e sportivo) CLASSE: PRIMA (tutte le sezioni) COMPETENZE DI BASE
Loriano Storchi.
 Loriano Storchi loriano@storchi.org http://www.storchi.org/ Metodo scientifico Nessuna quantità di esperimenti potrà dimostrare che ho ragione; un unico esperimento potrà dimostrare che ho sbagliato Il
Loriano Storchi loriano@storchi.org http://www.storchi.org/ Metodo scientifico Nessuna quantità di esperimenti potrà dimostrare che ho ragione; un unico esperimento potrà dimostrare che ho sbagliato Il
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
LEGGI PONDERALI DELLA CHIMICA
 LEGGI PONDERALI DELLA CHIMICA LEGGE DI LAVOISIER (1743-1794) In ogni reazione la massa totale dei reagenti è uguale alla massa totale dei prodotti. Massa Totale R = Massa Totale P Esempio rame + zolfo
LEGGI PONDERALI DELLA CHIMICA LEGGE DI LAVOISIER (1743-1794) In ogni reazione la massa totale dei reagenti è uguale alla massa totale dei prodotti. Massa Totale R = Massa Totale P Esempio rame + zolfo
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 4 Le teorie della materia 1. L atomo e la sua storia 2. Le «prove sperimentali» della teoria atomica 3. La teoria
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 4 Le teorie della materia 1. L atomo e la sua storia 2. Le «prove sperimentali» della teoria atomica 3. La teoria
Struttura dell atomo e della materia unità 1, modulo C del libro
 Struttura dell atomo e della materia unità 1, modulo C del libro Gli elementi sono costituiti da specie atomiche, dette nuclidi. Tali specie atomiche sono formate da tre tipi di particelle elementari:
Struttura dell atomo e della materia unità 1, modulo C del libro Gli elementi sono costituiti da specie atomiche, dette nuclidi. Tali specie atomiche sono formate da tre tipi di particelle elementari:
Chimica e laboratorio - classe 1 A B C D
 PROGRAMMAZIONE DIDATTICA Chimica e laboratorio - classe 1 A B C D Anno Scolastico 2008-2009 Docenti Proff. Galleni L., Pizzolorusso L.M. Righi S., Sensi E, ITP Prof. S. Fersini COMPETENZE MINIME IN USCITA
PROGRAMMAZIONE DIDATTICA Chimica e laboratorio - classe 1 A B C D Anno Scolastico 2008-2009 Docenti Proff. Galleni L., Pizzolorusso L.M. Righi S., Sensi E, ITP Prof. S. Fersini COMPETENZE MINIME IN USCITA
ESERCIZI sulle SOLUZIONI
 ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
Fenomeno fisico. Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici
 Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
Le soluzioni e il loro comportamento
 A. A. 2016 2017 1 CCS Scienze geologiche CCS Biologia Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli
A. A. 2016 2017 1 CCS Scienze geologiche CCS Biologia Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica -
 Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 19 L energia si trasferisce 3 Sommario (I) 1. L «ABC» dei trasferimenti energetici 2. Durante le reazioni varia l energia chimica
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 19 L energia si trasferisce 3 Sommario (I) 1. L «ABC» dei trasferimenti energetici 2. Durante le reazioni varia l energia chimica
Chimica. Lezione 2 Parte II Composti ionici e molecolari
 Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
PROGRAMMAZIONE DISCIPLINARE INDIVIDUALE a. s / 14. Elenco moduli Argomenti Strumenti / Testi Letture. Le proprietà fisiche della materia.
 Pagina 1 di 6 DISCIPLINA: SCIENZE INTEGRATE : CHIMICA INDIRIZZO: 2TU DOCENTE : prof. Paola Leggeri Elenco moduli Argomenti Strumenti / Testi Letture 1 LE FORME DELLA MATERIA Le proprietà fisiche della
Pagina 1 di 6 DISCIPLINA: SCIENZE INTEGRATE : CHIMICA INDIRIZZO: 2TU DOCENTE : prof. Paola Leggeri Elenco moduli Argomenti Strumenti / Testi Letture 1 LE FORME DELLA MATERIA Le proprietà fisiche della
Aspetti formali e ponderali delle reazioni chimiche
 i g t c unità g1 obiettivo x + Aspetti formali e ponderali delle reazioni chimiche 1 L equazione chimica Saper rappresentare una trasformazione chimica mediante un equazione che utilizza simboli e formule
i g t c unità g1 obiettivo x + Aspetti formali e ponderali delle reazioni chimiche 1 L equazione chimica Saper rappresentare una trasformazione chimica mediante un equazione che utilizza simboli e formule
- Riconoscere un elemento da un composto, un miscuglio omogeneo da uno eterogeneo
 Primo biennio Istituto Tecnico per il Turismo Saper distinguere una trasformazione fisica da una trasformazione chimiche Determinare la quantità chimica in un campione di una sostanza Calcolare il numero
Primo biennio Istituto Tecnico per il Turismo Saper distinguere una trasformazione fisica da una trasformazione chimiche Determinare la quantità chimica in un campione di una sostanza Calcolare il numero
ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383
 ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: Rosmarini Diana Classe: I Sez.:
ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: Rosmarini Diana Classe: I Sez.:
LA MATERIA LA MATERIA 1.B PRE-TEST 1.C OBIETTIVI 1.1 COS È LA MATERIA? 1.2 CORPI E SOSTANZE 1.3 L IDEA DI ELEMENTO E LA SUA EVOLUZIONE STORICA
 LA MATERIA 1.B PRE-TEST 1.C OBIETTIVI 1.1 COS È LA MATERIA? 1.2 CORPI E SOSTANZE 1.2.1 CORPI PURI E MISCELE 1.2.2 LE SOSTANZE 1.3 L IDEA DI ELEMENTO E LA SUA EVOLUZIONE STORICA 1.V VERIFICA SE HAI CAPITO
LA MATERIA 1.B PRE-TEST 1.C OBIETTIVI 1.1 COS È LA MATERIA? 1.2 CORPI E SOSTANZE 1.2.1 CORPI PURI E MISCELE 1.2.2 LE SOSTANZE 1.3 L IDEA DI ELEMENTO E LA SUA EVOLUZIONE STORICA 1.V VERIFICA SE HAI CAPITO
GAS. Forze di legame intermolecolari ridotte Stato altamente disordinato
 I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
Sotto articolazione dell esperienza: misura della densità di una sostanza solida (pura) di forma irregolare
 Obiettivi: determinare la misura della densità di varie sostanze pure e non; imparare a redigere una relazione di laboratorio, acquisire dimestichezza con il concetto di misura, accuratezza e precisione,
Obiettivi: determinare la misura della densità di varie sostanze pure e non; imparare a redigere una relazione di laboratorio, acquisire dimestichezza con il concetto di misura, accuratezza e precisione,
TERMODINAMICA. Studia le trasformazioni dei sistemi in relazione agli scambi di calore e lavoro. GENERALITÀ SUI SISTEMI TERMODINAMICI
 TERMODINAMICA Termodinamica: scienza che studia le proprietà e il comportamento dei sistemi, la loro evoluzione e interazione con l'ambiente esterno che li circonda. Studia le trasformazioni dei sistemi
TERMODINAMICA Termodinamica: scienza che studia le proprietà e il comportamento dei sistemi, la loro evoluzione e interazione con l'ambiente esterno che li circonda. Studia le trasformazioni dei sistemi
