CHIMICA PER BIOLOGIA
|
|
|
- Silvana Giuliano
- 6 anni fa
- Visualizzazioni
Transcript
1 CHIMICA PER BIOLOGIA UNITÁ DIDATTICA N 1 LA STRUTTURA DELLE MOLECOLE CONTENUTI Una molecola è un aggregato di due o più atomi, uguali o diversi, legati tra loro da un legame chimico. La quasi totalità della materia che ci circonda è formata da atomi legati tra loro da un legame chimico. La formazione di un legame chimico altera profondamente le caratteristiche e le proprietà degli atomi. Per esempio ossigeno e idrogeno allo stato atomico sono molto dannosi, mentre la molecola formata da due atomi di ossigeno è il gas che ci permette di respirare e l unione di due atomi di idrogeno e uno di ossigeno forma l acqua, la molecola inorganica indispensabile alla vita. Possiamo paragonare gli atomi alle lettere dell alfabeto che, combinate in vario modo, danno origine alle parole. Per esempio una molecola di fosforo è formata da 4 atomi di fosforo (P 4 ), mentre 2 atomi di idrogeno, uno di carbonio e 3 di ossigeno formano l acido carbonico (H 2 C O 3 ). Se spezziamo una parola ne cambiamo il significato ( lavello diviso diventa la e vello con un significato totalmente diverso) così una parte della molecola ha proprietà diverse dalla molecola intera, perciò: la molecola è la più piccola quantità di sostanza che conserva intatte le proprietà della sostanza. La formula bruta indica solamente il tipo ed il numero degli atomi legati tra loro, ma si possono anche mettere in evidenza i legami che tengono uniti gli atomi, in questo caso si ha la formula di struttura, in cui si indica con un trattino ogni legame che unisce due atomi. O H Formula bruta: H 2 C O 3 Formula di struttura: C O H O Affinché due atomi si legano devono avvicinarsi e il contatto avviene tra le due superfici degli atomi stessi e quindi solo gli elettroni che si trovano nel guscio esterno vengono utilizzati per la formazione dei legami. Ma cosa spinge gli atomi a legarsi tra loro?
2 Tutti i sistemi tendono a raggiungere la minima energia e quando realizzano ciò raggiungono la stabilità. Per un atomo la stabilità si raggiunge quando, nella configurazione elettronica, l ultimo livello è tutto pieno o tutto vuoto. Infatti gli elementi che nella tavola periodica si trovano nell ottavo gruppo hanno una scarsa reattività, sono molto stabili ( per questo sono stati chiamati gas nobili ) ed esistono in natura allo stato monoatomico. Essi hanno la configurazione elettronica esterna s 2 p 6, cioè 8 elettroni negli orbitali s e p : questa configurazione è detta ottetto. Tutti gli altri elementi cercano di completare ( o di svuotare) l ultimo livello acquistando o cedendo o condividendo gli elettroni con altri atomi, cercano, cioè, di raggiungere l ottetto. Gli elettroni presenti sull ultimo livello sono detti elettroni di legame e la valenza indica quanti legami un atomo può fare. Un concetto fondamentale è quello di elettronegatività : l elettronegatività è la forza con la quale un atomo trattiene i suoi elettroni di legame. Se un atomo ha pochi elettroni sull ultimo livello tenderà a cederli per raggiungere l ottetto, mentre se lo ha quasi pieno cercherà di acquistare tutti gli elettroni che gli occorrono per completarlo, naturalmente se un atomo deve disfarsi dei suoi elettroni esterni occorre che ci sia un altro atomo disposto ad accettarli, mentre se un atomo necessita di elettroni per completare l ottetto è necessario che un altro atomo glieli ceda: è appunto questo scambio di elettroni che tiene uniti gli atomi. Legame ionico Se fra gli atomi che reagiscono c è una forte differenza di elettronegatività l atomo più elettronegativo può acquistare uno o più elettroni dall atomo meno elettronegativo. In questo caso si formano due ioni, di cariche opposte, che si attraggono tra loro.
3 Gli elementi molto elettronegativi (detti non metalli) sono quelli che acquistano facilmente elettroni diventando ioni negativi, mentre quelli con elettronegatività bassa, detti anche elettropositivi ( i cosiddetti metalli), tendono a cedere elettroni e a diventare ioni positivi. Per esempio, il Cl ha elettronegatività 3,0 mentre il Na ha 0,9: quando questi due elementi entrano in contatto interagiscono nel senso che il cloro acquista un elettrone dal sodio, diventando rispettivamente Cl - e Na +, che, in quanto di carica opposta, si attraggono elettricamente. Dunque, Na e Cl reagiscono facilmente tra loro perché uno cede elettroni, ma deve esserci chi li acquista e questa è la proprietà del Cl. In realtà la formazione di ioni non riguarda due soli atomi,ma molti milioni di atomi e perciò si forma un cristallo ionico all interno del quale ogni ione Cl - è attratto da uno ione Na + e viceversa. La formula bruta NaCl rappresenta l unità elementare del cristallo. Legame covalente Cosa succede quando si avvicinano due atomi con la stessa elettronegatività e quindi con la stessa tendenza ad acquistare elettroni? Non può esserci uno spostamento di elettroni e quindi la formazione di ioni, ma il legame si stabilisca lo stesso, con modalità diverse. Immaginiamo di avvicinare due atomi di idrogeno ( si ricordi che ha un solo elettrone e quindi per raggiungere per raggiungere la stabilità gliene occorre un altro): inizialmente prevale la forza di repulsione tra gli elettroni dei due atomi, ma ad un certo punto il nucleo positivo del primo attira l elettrone del secondo ( elettrone di cui ha bisogno per diventare stabile) e il nucleo positivo del secondo attira quello del primo (anch esso necessita di un altro elettrone per completare la sua configurazione esterna); la forza che ora tiene uniti i due atomi è il legame covalente.
4 In questo tipo di legame non è più possibile attribuire a ciascun atomo il proprio elettrone: la coppia di elettroni è condivisa. Poiché i due atomi hanno la stessa elettronegatività la coppia di elettroni sarà equidistante dai due nuclei, ma quando i due atomi hanno una certa differenza di elettronegatività la coppia di elettroni è spostata verso l elemento più elettronegativo. Nel primo caso il legame covalente è puro, nel secondo caso è polare. E il caso dell acqua. In questa molecola l O ha elettronegatività 3,5, mentre l H ha elettronegatività 2,1. La differenza di elettronegatività non è tale da far formare ioni ( e quindi un legame ionico ) ma costringe la coppia di elettroni condivisa a spostarsi verso l O. Le molecole tenute assieme da questi legami sono nel complesse neutre, ma polari, cioè gli elettroni non sono ugualmente distribuiti al suo interno, ma sono addensati verso l atomo con elettronegatività maggiore. La più importante molecola polare è l acqua. Legame idrogeno Quando un atomo di idrogeno è legato covalentemente ad un atomo più elettronegativo ( F, O, N) gli elettroni di legami si spostano verso l atomo più elettronegativo e quindi sull idrogeno si localizza una parziale carica positiva; essa farà attrarre l idrogeno da una molecola con una parziale carica negativa: è detto anche ponte idrogeno in quanto l atomo di idrogeno si trova tra due atomi con residuo di carica negativa. Per esempio, nell acqua il legame covalente è polarizzato con un residuo di carica negativa (σ - ) sull ossigeno e un residuo di carica positiva sull idrogeno (σ + ). Quando due molecole di acqua si avvicinano le due polarità opposte si attraggono e l H viene a trovarsi ( fa da ponte) tra due atomi di O.
5 I legami idrogeno sono molto importanti in biologia in quanto sono deboli e quindi possono formarsi e rompersi con estrema facilità. O H H H O H Energia di legame Gli atomi possono unirsi con legami più o meno forti: è definita energia di legame quella energia necessaria a romperlo e separare i due atomi. Questa proprietà è fondamentale per i sistemi biologici perché l energia necessaria ai processi vitali è fornita appunto dalle molecole che scindendosi rendono disponibile l energia immagazzinata nel legame; più il legame è forte più energia è disponibile. Per esempio, la reazione di respirazione cellulare, che avviene in tutte le cellule, consiste nella demolizione del glucosio e successiva liberazione dell energia che è immagazzinata nei suoi legami con formazione di composti più semplici e meno ricchi di energia. Molecole inorganiche e molecole organiche Le molecole organiche sono quelle presenti negli organismi viventi e da essi sintetizzate; quelle inorganiche sono presenti nel mondo non vivente. Tuttavia questa distinzione non può essere così netta, infatti nei viventi troviamo anche una molteplicità di sostanze inorganiche ( si pensi all acqua e i Sali minerali degli scheletri) e,d altra parte, fuori dalla materia vivente possiamo ritrovare sostanze organiche ( lo zucchero che usiamo normalmente). Si può dire allora che la caratteristica distintiva fondamentale è il fatto che una molecola organica può essere costruita solo da un sistema biologico, usando sostanze inorganiche reperite in natura. I chimici che studiano la composizione della materia hanno scelto come criterio distintivo il fatto che le molecole organiche contengono atomi di carbonio ai quali sono legati atomi di H e di O, prevalentemente, ma che possono contenere anche altri elementi ( N,P,S ). Il Carbonio è un elemento chimico con numero atomico 6 e con la possibilità di formare 4 legami covalenti.
6 Tutta la materia dell universo è costituita da un centinaio di tipi di atomi, variamente legati fra loro a formare una moltitudine di molecole differenti; invece la materia vivente è costituita per oltre il 99% di soli 4 elementi: O,C, H e N. elemento Simb. Num. Atom. % appros. nella crosta terrestre % nel corpo umano Funzione nell organismo Ossigeno O 8 46,6 65,0 Respirazione. Costituente dell acqua. Silicio Si 14 27,7 tracce Alluminio Al 13 6,5 tracce Ferro Fe 26 5,0 tracce Componente dell emoglobina Calcio Ca 20 3,6 1,5 Componente di ossa e denti. Interviene nella contrazione muscolare. Sodio Na 11 2,8 0,2 Principale ione positivo all esterno della cellula. Importante nella funzione nervosa (trasmissione stimoli) potassio K 19 2,6 0,4 Principale ione positivo della cellula. Importante nella funzione nervosa (trasmissione stimoli) Magnesio Mg 12 2,1 0,1 Componente importante di enzimi che trasferiscono energia. Idrogeno H 1 0,14 9,5 Trasportatore di elettroni. Componente dell acqua e di molte molecole organiche. Fluoro F 9 0,07 Tracce Fosforo P 15 0,07 1,0 Componente degli acidi nucleici. Carbonio C 6 0,03 18,5 Componente di tutte le molecole organiche. Zolfo S 16 0,03 0,3 Componente di proteine. Cloro Cl 17 0,01 0,2 Principale ione negativo all esterno della cellula. Rame Cu 29 0,01 Tracce Componente di molti enzimi. Azoto N 7 tracce 3,3 Componente di tutte le proteine e degli acidi nucleici. Boro B 5 tracce Tracce cobalto Co 27 tracce Tracce Zinco Zn 30 tracce Tracce Componente di alcuni enzimi. Molibdeno Mo 42 tracce Tracce Componente di alcuni enzimi. Stagno Sn 50 tracce Tracce iodio I 53 tracce Tracce Componente dell ormone tiroideo.
7 UNITÁ DIDATTICA N 2 LE MOLECOLE ORGANICHE CONTENUTI Le molecole organiche che compongono gli organismi viventi sono dette anche biomolecole, esse sono piuttosto grandi e spesso hanno una struttura polimerica. Gruppi funzionali Le molecole organiche sono costituite da uno scheletro, lineare o ad anello, più o meno ramificato, di atomi di carbonio, al quale si legano gruppi di atomi detti gruppi funzionali che determinano le caratteristiche, la solubilità e il comportamento chimio-fisico delle molecole. Le varie famiglie nelle quali sono raggruppati i composti organici si caratterizzano per il gruppo funzionale, esso è come un marchio di riconoscimento; per esempio tutti gli acidi organici hanno un gruppo funzionale formato da 1C 2O e 1 H così sistemati: O R C O H Con il simbolo R si indica la catena laterale quella parte della molecola, cioè, variabile.
8 Monomeri e polimeri Il monomero è una sola molecola, mentre il polimero è la ripetizione di molti monomeri che possono essere tutti uguali o diversi. Un polimero è come un treno i cui vagoni rappresentano i monomeri. Il più classico esempio è rappresentato dallo zucchero glucosio, che è una singola molecola formata da 6 atomi di carbonio cui sono legati O e H, quando migliaia di queste molecole si uniscono tra loro i forma l amido. Le subunità si collegano l una all altra quasi sempre con il medesimo tipo di legame, mediante reazioni dette di condensazione: un atomo di idrogeno di un gruppo funzionale e un ossidrile ( un gruppo -OH) condensano tra loro con un legame covalente per formare una molecola di acqua, contemporaneamente si legano le due subunità con i legami rimasti liberi dopo l abbandono dell idrogeno e dell ossidrile. La reazione opposta è l idrolisi, con essa l ossidrile e l idrogeno di una molecola d acqua scindono i legami fra le subunità e si legano ai legami rimasti liberi ricostituendo le due molecole intere. Le principali categorie di molecole organiche di importanza biologica sono: gli zuccheri, i grassi, le proteine e gli acidi nucleici. Zuccheri Sono detti anche glucidi o carboidrati e raggruppano composti con molecole di varie dimensioni e complessità. Alcuni sono zuccheri semplici, in quanto sono formati da una sola molecola, altri sono dei polimeri formati dalla condensazione di molti monomeri. Monosaccaridi Sono formati da una sola molecola. I più importanti sono molecole formate da 5 o 6 atomi di carbonio con un gruppo funzionale aldeidico o chetonico.
9 Esempio: Sciogliendosi in acqua la catena si chiude su se tessa formando un anello. Il glucosio può essere considerato il più importante dei monosaccaridi, esso viene sintetizzato dagli organismi autotrofi a partire da acqua, anidride carbonica ed energia (fotosintesi). Il glucosio viene poi trasformato in molti altri composti attraverso i metabolismi delle cellule vegetali, successivamente, attraverso la catena alimentare anche gli animali potranno avere a disposizione questi composti. Esso non è soltanto la molecola di partenza di molti composti, ma è anche la molecola energetica fondamentale dalla quale le cellule ricavano energia per tutte le loro attività: infatti nei legami covalenti degli atomi che lo costituiscono è immagazzinata energia che si rende disponibile in seguito alla demolizione del glucosio stesso. Disaccaridi Sono formati dalla condensazione di due molecole di monosaccaride.
10 Il più comune è il saccarosio, il comune zucchero da cucina. Il maltosio si forma dalla degradazione dell amido di cereali come orzo, malto, ecc. che vengono usati per la fabbricazione della birra. Il lattosio è il tipico zucchero del latte. Precisamente: SACCAROSIO = GLUCOSIO+FRUTTOSIO MALTOSIO = GLUCOSIO+GLUCOSIO LATTOSIO = GLUCOSIO+GALATTOSIO Polisaccaridi Sono formati dalla condensazione di molte subunità di monosaccaridi. I più importanti sono i polimeri del glucosio, uno zucchero a sei atomi di carbonio. H O H C OH 1 HO C H 2 H C OH 3 H C OH 4 H C OH 5 C 6 H 2 OH Il legame tra due molecole di glucosio può essere di due tipi a seconda della posizione degli ossidrili (-OH) interessati rispetto al piano della molecola: il legame si indica con la lettera α se entrambi gli ossidrili si trovano sotto il piano della molecola; se invece i due ossidrili si trovano uno sopra e l altro sotto il piano della molecola il legame viene detto β. Inoltre viene indicato il numero del carbonio interessato al legame.
11 L'amido. L'amido rappresenta la più importante sorgente alimentare per l'uomo nel mondo. Esso è contenuto negli organi di riserva delle piante (semi, tuberi); dalle stesse viene elaborato con la fotosintesi clorofilliana utilizzando l'acqua del terreno e l'anidride carbonica dell'aria. L'amido si presenta come una polvere bianca, inodore, insipida, insolubile in acqua fredda, con la quale dà una sospensione. In acqua calda, invece, i granuli si rigonfiano per assorbimento ed infine scoppiano dando una dispersione colloidale gelatinosa. È interessante notare che i granuli di amido di cereali diversi visti al microscopio appaiono con forme diversificate e caratteristiche delle varie specie cui appartengono. Questo fatto è utile nell'analisi delle frodi su farine e derivati. Le differenti forme dei granuli di amido derivano dal fatto che esso è costituito da due componenti: l'amilosio e l'amilopectina. Hanno composizione chimica identica, essendo entrambi formate da molecole di glucosio, tuttavia differiscono enormemente nella configurazione spaziale e nel numero dì molecole costituenti. L'amilosio è la frazione dell'amido che possiamo definire lineare: è formato da molecole di glucosio con legami α (1-4) distribuite nello spazio a guisa di spirale. La molecola dell'amilosio è anche la frazione più piccola essendo formata da meno di 500 molecole di glucosio (in media 300). È insolubile in acqua. L'amilopectina è la frazione ramificata dell'amido ed anche la più complessa in quanto le molecole di glucosio in una molecola di amilopectina possono essere anche qualche migliaio. Esse sono legate come nell'amilosio con legami α (1-4),tranne che nei punti delle ramificazioni ove avvengono legami
12 α (1-6). E avidissima di acqua nella quale forma geli a freddo. Studi recenti hanno evidenziato che le ramificazioni nell' amilopectina avvengono mediamente ogni 25 molecole di glucosio. Poiché la quantità reciproca dei due componenti dipende esclusivamente dal gene della pianta che sintetizza l'amido, ogni specie vegetale contiene amidi con diverse percentuali di amilosio e di amilopectina. Ciò conduce a forme di granuli diverse, come si è detto sopra, ed anche a caratteristiche fisiche leggermente differenti tra amido e amido, come l'aspetto, l'uniformità, il potere assorbente. Il glicogeno. Gli organismi viventi dispongono sovente di una quantità di glucosio superiore al suo fabbisogno, una parte di esso viene accantonata nel fegato e nei muscoli sotto forma di glicogeno. Per questa caratteristica di fungere da deposito, il glicogeno viene anche definito come amido animale. La molecola del glicogeno è costituita da un gran numero di molecole di glucosio con legame α (1-4). L'andamento strutturale della molecola è simile a quella dell'amilopectina, con la differenza nel numero delle ramificazioni. L'intervallo di ramificazione (cioè il numero di molecole di glucosio tra due ramificazioni consecutive) nel glicogeno ha un valore medio di 15. La cellulosa. Anche se formata dalla stessa unità-base (il glucosio), la cellulosa si differenzia nettamente dall'amido e dal glicogeno. Infatti, essa ha funzione strutturale o di sostegno nel mondo vegetale, costituendo le pareti delle cellule e le fibre vegetali. L'andamento strutturale della molecola della cellulosa somiglia a quello dell'amilosio, con la differenza insita nel tipo di legame. Infatti, nella molecola della cellulosa - costituita mediamente da unità di glucosio - si hanno legami β (14). La presenza di questo tipo di legame nella cellulosa costituisce un handicap per l'uomo (e per gli animali carnivori) in quanto il suo apparato digerente non è provvisto dell'enzima
13 (cellulasi) capace di compierne l'idrolisi cioè di digerirlo. Ciò porta alla mancata utilizzazione della cellulosa ai fini nutritivi (non essendo possibile l'estrazione del glucosio ai fini di un utilizzo energetico). Tuttavia in questi ultimi anni è stata riconosciuta l'importanza dell'assunzione di alimenti ricchi in cellulosa per la sua azione di stimolo sulla peristalsi intestinale. Lipidi Detti anche grassi. Di origine animale o vegetale sono insolubili in acqua perché sono formati da lunghe catene costituite da atomi di carbonio e idrogeno. Non sono polimeri. I lipidi sono divisi in diverse categorie a seconda della loro composizione; i più semplici sono gli acidi grassi, lunghe catene che ad una estremità hanno il gruppo funzionale carbossilico. Es.: COOH CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 Acido palmitico ( con 16 atomi di carbonio) COOH CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 Acido oleico (con 18 atomi di carbonio)
14 La condensazione di tre molecole di acidi grassi con il glicerolo, un alcool a tre atomi di carbonio, porta alla formazione dei trigliceridi, la classe dei lipidi più diffusa. Un grasso può essere saturo o insaturo, dipende dal numero di doppi legami presenti nell acido grasso: se non ci sono doppi legami sono saturi e sono generalmente solidi; se ci sono uno o più doppi legami sono insaturi e a temperatura ambiente sono liquidi perché la presenza di doppi legami causa il ripiegamento delle catene determinando un minor addensamento delle molecole lipidiche. In genere i grassi hanno funzione di riserva, quelli saturi negli animali e quelli insaturi nei semi ( esempio nelle olive). Nei fosfolipidi una molecola di acido grasso è sostituita da una di acido fosforico; la sua presenza conferisce alla molecola la caratteristica di essere amfipatica, di avere, cioè, una parte idrofila, la testa, formata da fosfato e glicerolo ( che ha affinità per l acqua) e una parte idrofoba, le catene di acido grasso, ( che respinge l acqua). Ciò rende i fosfolipidi importanti per le membrane biologiche infatti in un ambiente acquoso queste molecole si dispongono in un doppio strato in modo da avere le teste rivolte verso l ambiente acquoso e le code isolate nello spessore della membrana. Altri lipidi di notevole importanza biologica sono gli steroidi, esempio il colesterolo e alcuni ormoni.
15 Proteine Le proteine sono i principali componenti organici delle cellule; esse sono dei polimeri costituiti dalla condensazione di circa 20 tipi diversi di monomeri detti aminoacidi (abbreviazione: a.a.). Un a.a. ha due gruppi funzionali, come dice il nome: un gruppo amminico e un gruppo carbossilico. COOH H 2 N C H R I gruppi variabili dei diversi tipi di aminoacidi Gli a.a. si legano fra loro con una reazione di condensazione che porta alla formazione di un legame covalente detto peptidico. L unione di 2 a.a. forma un dipeptide, di 3 un tripeptide, numerosi a.a. formano un polipeptide. Nelle proteine si riconoscono 4 livelli di organizzazione. La struttura primaria è la sequenza dei diversi a.a.
16 È una catena lineare e non ha funzioni se non raggiunge i successivi livelli di organizzazione. Struttura primaria La struttura secondaria è rappresentata dall avvolgimento o ripiegamento della catena primaria;ciò è dovuto allo stabilirsi di legami idrogeno fra i gruppi laterali dei vari a.a. Per esempio la cheratina dei capelli è avvolta ad elica, mentre la seta è ripiegata come un foglietto a ventaglio. Struttura secondaria Con la struttura terziaria la proteina assume una forma tridimensionale ed è funzionante. Struttura terziaria Come sempio si riporta la struttura dell insulina
17 Molte proteine hanno anche una struttura quaternaria che consiste nell assemblaggio di più molecole di polipeptide; la più nota è l emoglobina formata da 4 catene, uguali a due a due e tenute insieme da un gruppo eme. Struttura quaternaria La grande diversità di strutture possibili per le proteine è alla base delle molteplici funzioni che queste svolgono negli organismi, come per esempio la funzione enzimatica che controlla lo svolgersi delle innumerevoli reazioni chimiche che costituiscono il metabolismo cellulare. Altre proteine hanno funzioni strutturali formando l impalcatura delle cellule. Altre vengono usate come riserva di energia e materiali (albumina e caseina), altre come trasportatrici ( emoglobina),altre ancora per il movimento ( proteine muscolari); anche molti ormoni sono di natura proteica. I responsabili delle strutture secondaria, terziaria e quaternaria sono legami idrogeni che possono rompersi facilmente, per esempio per effetto della temperatura o di un ambiente acido, determinando la cosiddetta denaturazione della proteina che la rende non funzionante. Acidi nucleici Essi sono responsabili di tutte le caratteristiche dei sistemi viventi: controllano le attività cellulari attraverso la sintesi delle proteine e permettono la trasmissione dei caratteri ereditari. Sono polimeri costituiti da monomeri detti nucleotidi. Ci sono due tipi di acidi nucleici: il DNA e l RNA i cui nucleotidi differiscono per poco. Ogni nucleotide è formato da una base azotata, uno zucchero e un gruppo fosfato. Le basi azotate sono cinque: adenina, timida, guanina, citosina nel DNA, mentre nell RNA a
18 posto dell adenina troviamo l uracile. Lo zucchero è un pentoso, il ribosio nell RNA e il desossiribosio nel DNA. La molecola del DNA è una doppia elica formata da due filamenti appaiati. Ogni filamento è formato dalla sequenza di nucleotidi che si risultano legati dal fosforo di un nucleotide con lo zucchero del nucleotide successivo: così si forma uno scheletro invariabile, formato dalla ripetizione alternata di uno zucchero e di un gruppo fosfato, a cui sono legate le basi in modo estremamente variabile a determinare la sequenza di basi responsabile della diversità dei geni ( un gene è un pezzo di DNA che contiene le informazioni per un carattere). Infine due filamenti si accoppiano attraverso legami idrogeno fra le basi di un filamento e quelle di un altro: il legame non è, però, casuale, ma le basi si uniscono a coppie l adenina di un filamento con la timida dell altro e la citosina con la guanina, questo perché le molecole sono complementari. Si forma così una specie di scala a pioli che si avvolge su se stessa ottenendo la conformazione a spirale. La molecola dell RNA differisce per non essere doppia e per avere l uracile a posto della timida e il ribosio a posto del desossiribosio. Una delle caratteristiche più importanti della molecola del DNA è la sua capacità di autoduplicarsi: i legami idrogeni che tengono uniti i due filamenti si rompono facilmente e ogni filamento può fungere da stampo per la sintesi un altro filamento ad esso complementare.
19 Le due molecole di nuova sintesi sono uguali tra di loro e alla molecola madre che non esiste più. Ogni molecola figlia è formata da un filamento vecchio e da uno di nuova sintesi: la duplicazione è semiconservativa.
I materiali della vita
 I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
Immagini e concetti della biologia
 Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 10 Le basi della biochimica 3 Sommario 1. Le molecole biologiche si dividono in quattro classi 2. I carboidrati sono il «carburante»
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 10 Le basi della biochimica 3 Sommario 1. Le molecole biologiche si dividono in quattro classi 2. I carboidrati sono il «carburante»
 http://digilander.libero.it/glampis64 Idrogeno, ossigeno, carbonio e azoto costituiscono il 99% delle cellule. I composti del carbonio sono chiamati composti organici o molecole organiche. I composti organici
http://digilander.libero.it/glampis64 Idrogeno, ossigeno, carbonio e azoto costituiscono il 99% delle cellule. I composti del carbonio sono chiamati composti organici o molecole organiche. I composti organici
Le molecole biologiche. Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012
 Le molecole biologiche 1 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 2 Il carbonio deve acquistare quattro elettroni
Le molecole biologiche 1 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 2 Il carbonio deve acquistare quattro elettroni
La chimica della vita
 La chimica della vita La materia presente nell universo è formata da 92 elementi Gli elementi si legano tra loro per formare le molecole che costituiscono i composti Legame covalente O H H Molecola Composto
La chimica della vita La materia presente nell universo è formata da 92 elementi Gli elementi si legano tra loro per formare le molecole che costituiscono i composti Legame covalente O H H Molecola Composto
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
LA CHIMICA DELLA VITA
 LA CHIMICA DELLA VITA L elemento presente in tutte le molecole caratteristiche degli esseri viventi è IL CARBONIO Il carbonio ha numero atomico 6 (Z=6). Ha valenza 4: ai suoi atomi mancano 4 elettroni
LA CHIMICA DELLA VITA L elemento presente in tutte le molecole caratteristiche degli esseri viventi è IL CARBONIO Il carbonio ha numero atomico 6 (Z=6). Ha valenza 4: ai suoi atomi mancano 4 elettroni
Biologia. Lezione 09/11/2010
 Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
Introduzione alla biologia della cellula. Lezione 2 Le biomolecole
 Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
I PROTIDI ASPETTI GENERALI
 I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
CARBOIDRATI C H O ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO
 CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
I composti organici. Il carbonio e i composti organici
 I composti organici Il carbonio e i composti organici COSA SONO I COMPOSTI ORGANICI? I composti organici sono composti in cui uno o più atomi di carbonio (C) sono uniti tramite un legame covalente ad atomi
I composti organici Il carbonio e i composti organici COSA SONO I COMPOSTI ORGANICI? I composti organici sono composti in cui uno o più atomi di carbonio (C) sono uniti tramite un legame covalente ad atomi
CPIA 1 FOGGIA punto di erogazione San Severo. Prof.ssa ANNA LUCIA L. CANCELLIERE
 CPIA 1 FOGGIA punto di erogazione San Severo Prof.ssa ANNA LUCIA L. CANCELLIERE Sono delle grandi molecole che troviamo nel mondo dei viventi sia come molecole costituenti gli organismi viventi che come
CPIA 1 FOGGIA punto di erogazione San Severo Prof.ssa ANNA LUCIA L. CANCELLIERE Sono delle grandi molecole che troviamo nel mondo dei viventi sia come molecole costituenti gli organismi viventi che come
LE MOLECOLE BIOLOGICHE
 LE MOLECOLE BIOLOGICHE Le cellule contengono quattro famiglie principali di molecole organiche Zuccheri (monosaccaridi) - forniscono una fonte di energia - subunità dei polisaccaridi Amminoacidi - subunità
LE MOLECOLE BIOLOGICHE Le cellule contengono quattro famiglie principali di molecole organiche Zuccheri (monosaccaridi) - forniscono una fonte di energia - subunità dei polisaccaridi Amminoacidi - subunità
Le macromolecole, a loro volta, derivano dall associazione di piccole molecole che risultano formate da atomi. LA MATERIA E GLI ATOMI
 7. Biologia 7 La biologia (dal greco bìos vita e lògos discorso) è la scienza della vita; essa comprende tutte le discipline che studiano la forma e la struttura (per esempio l anatomia e la citologia),
7. Biologia 7 La biologia (dal greco bìos vita e lògos discorso) è la scienza della vita; essa comprende tutte le discipline che studiano la forma e la struttura (per esempio l anatomia e la citologia),
Capitolo 3 Le biomolecole
 apitolo 3 Le biomolecole opyright 2006 Zanichelli editore I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare
apitolo 3 Le biomolecole opyright 2006 Zanichelli editore I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare
Indagine biologica: elevato livello di organizzazione delle strutture coinvolte.
 Indagine biologica: elevato livello di organizzazione delle strutture coinvolte. L organizzazione biologica si basa su una gerarchia di livelli strutturali Si parte dall atomo tessuti organi molecola organismo
Indagine biologica: elevato livello di organizzazione delle strutture coinvolte. L organizzazione biologica si basa su una gerarchia di livelli strutturali Si parte dall atomo tessuti organi molecola organismo
Di cosa è fatta una cellula?
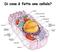 Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O rappresentano il 96% della massa della cellula - Altri component frequenti
Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O rappresentano il 96% della massa della cellula - Altri component frequenti
LA CLASSIFICAZIONE DEI COMPOSTI CHIMICI
 LA LASSIFIAZIONE DEI OMPOSTI IMII Inorganici Acqua Sali minerali omposti chimici Idrocarburi arboidrati Organici Alcoli, aldeidi Molecole biologiche o biomolecole Lipidi Proteine Acidi nucleici Vitamine
LA LASSIFIAZIONE DEI OMPOSTI IMII Inorganici Acqua Sali minerali omposti chimici Idrocarburi arboidrati Organici Alcoli, aldeidi Molecole biologiche o biomolecole Lipidi Proteine Acidi nucleici Vitamine
CARBOIDRATI SEMPLICI
 CARBOIDRATI Dal greco glucos =dolce Glucidi Zuccheri Sostanze formate acqua e carbonio Hanno forma molecolare (CH₂O)n 1 CARBOIDRATI SEMPLICI Monosaccaridi, una sola unità di poliidrossi aldeide o di poliidrossi
CARBOIDRATI Dal greco glucos =dolce Glucidi Zuccheri Sostanze formate acqua e carbonio Hanno forma molecolare (CH₂O)n 1 CARBOIDRATI SEMPLICI Monosaccaridi, una sola unità di poliidrossi aldeide o di poliidrossi
Gerard Tortora, Brian Derrickson. Conosciamo
 1 Gerard Tortora, Brian Derrickson Conosciamo il corpo umano Capitolo 1 L organizzazione del corpo umano 1. Che cosa sono l anatomia e la fisiologia 2. I livelli di organizzazione e gli apparati del corpo
1 Gerard Tortora, Brian Derrickson Conosciamo il corpo umano Capitolo 1 L organizzazione del corpo umano 1. Che cosa sono l anatomia e la fisiologia 2. I livelli di organizzazione e gli apparati del corpo
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
I composti organici e i loro polimeri
 I ARBIDRATI I composti organici e i loro polimeri La diversità molecolare della vita è basata sulle proprietà del ARBNI. Un atomo di carbonio può formare quattro legami covalenti. Questi legami gli permettono
I ARBIDRATI I composti organici e i loro polimeri La diversità molecolare della vita è basata sulle proprietà del ARBNI. Un atomo di carbonio può formare quattro legami covalenti. Questi legami gli permettono
I MACRONUTRIENTI. Principi nutritivi energetici
 I MACRONUTRIENTI Principi nutritivi energetici I GLUCIDI o ZUCCHERI o CARBOIDRATI Sono composti organici ternari perché formati da tre elementi: C, H, O. I Glucidi semplici sono caratterizzati da una formula
I MACRONUTRIENTI Principi nutritivi energetici I GLUCIDI o ZUCCHERI o CARBOIDRATI Sono composti organici ternari perché formati da tre elementi: C, H, O. I Glucidi semplici sono caratterizzati da una formula
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
Di cosa è fatta una cellula?
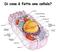 Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O,P,S rappresentano il 99% della massa della cellula - Altri elementi più rari
Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O,P,S rappresentano il 99% della massa della cellula - Altri elementi più rari
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
Lezione 1 ELEMENTI, COMPOSTI E LEGAMI
 Lezione 1 ELEMENTI, COMPOSTI E LEGAMI 1 1.4 Le particolari proprietà dell acqua favoriscono la vita esplorando Nell acqua, l ossigeno acquista una parziale carica negativa, mentre gli atomi di idrogeno
Lezione 1 ELEMENTI, COMPOSTI E LEGAMI 1 1.4 Le particolari proprietà dell acqua favoriscono la vita esplorando Nell acqua, l ossigeno acquista una parziale carica negativa, mentre gli atomi di idrogeno
Chimica generale e inorganica Studia gli elementi e i composti inorganici
 Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
I composti organici. Per composto organico si intende un composto contenente carbonio, che forma o deriva da esseri viventi.
 I composti organici Per composto organico si intende un composto contenente carbonio, che forma o deriva da esseri viventi. I composti organici possono essere costituiti da lunghe catene grazie alla capacità
I composti organici Per composto organico si intende un composto contenente carbonio, che forma o deriva da esseri viventi. I composti organici possono essere costituiti da lunghe catene grazie alla capacità
Gli Acidi Nucleici DNA RNA
 Gli Acidi Nucleici DNA RNA Gli Acidi nucleici Gli acidi nucleici sono il: DNA (acido desossiribonucleico) RNA (acido ribonucleico) Essi sono formati dai polimeri (molecole molto grosse) i cui monomeri
Gli Acidi Nucleici DNA RNA Gli Acidi nucleici Gli acidi nucleici sono il: DNA (acido desossiribonucleico) RNA (acido ribonucleico) Essi sono formati dai polimeri (molecole molto grosse) i cui monomeri
CHIMICA ORGANICA. 2 a D. Novembre Scuola Secondaria di Primo Grado «Bonazzi Lilli» IC PG 14. Ponte Felcino Perugia.
 CHIMICA ORGANICA 2 a D Novembre 2014 Scuola Secondaria di Primo Grado «Bonazzi Lilli» IC PG 14 Ponte Felcino Perugia Manuela Casasoli IL CARBONIO La chimica organica studia i composti organici in cui il
CHIMICA ORGANICA 2 a D Novembre 2014 Scuola Secondaria di Primo Grado «Bonazzi Lilli» IC PG 14 Ponte Felcino Perugia Manuela Casasoli IL CARBONIO La chimica organica studia i composti organici in cui il
Molecole e legami. Chimica generale
 Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
ACIDI GRASSI INSATURI
 LIPIDI ACIDI GRASSI SATURI ACIDI GRASSI INSATURI TRIGLICERIDI TRIGLICERIDI Grassi neutri o lipidi semplici glicerolo + 1 acido grasso monogliceride glicerolo + 2 acidi grassi digliceride glicerolo + 3
LIPIDI ACIDI GRASSI SATURI ACIDI GRASSI INSATURI TRIGLICERIDI TRIGLICERIDI Grassi neutri o lipidi semplici glicerolo + 1 acido grasso monogliceride glicerolo + 2 acidi grassi digliceride glicerolo + 3
LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI PROTEINE. sono ACIDI NUCLEICI. molecole complesse = POLIMERI. formate dall'unione di
 LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
Organizzazione della materia
 Organizzazione della materia Elementi: sostanze che non possono essere scisse in altre più semplici mediante reazioni chimiche ordinarie. Atomo: è la porzione più piccola di un elemento, formato da 3 particelle
Organizzazione della materia Elementi: sostanze che non possono essere scisse in altre più semplici mediante reazioni chimiche ordinarie. Atomo: è la porzione più piccola di un elemento, formato da 3 particelle
LE MOLECOLE DELLA VITA
 LE MOLECOLE DELLA VITA LE CELLULE SONO COSTITUITE DA ACQUA E BIOMOLECOLE Una biomolecola è un composto chimico che riveste un ruolo importante negli esseri viventi. Le molecole biologiche possono essere
LE MOLECOLE DELLA VITA LE CELLULE SONO COSTITUITE DA ACQUA E BIOMOLECOLE Una biomolecola è un composto chimico che riveste un ruolo importante negli esseri viventi. Le molecole biologiche possono essere
I MACRONUTRIENTI sono: glucidi, protidi e lipidi
 I MACRONUTRIENTI sono: glucidi, protidi e lipidi Copyright 2014 Clitt, Roma Questo file è una estensione online del corso Rodato CIBO CHE NUTRE Clitt 2014 1 I Carboidrati Sono sostanze ternarie composte
I MACRONUTRIENTI sono: glucidi, protidi e lipidi Copyright 2014 Clitt, Roma Questo file è una estensione online del corso Rodato CIBO CHE NUTRE Clitt 2014 1 I Carboidrati Sono sostanze ternarie composte
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) POLIMERI Le cellule sintetizzano un enorme numero di grosse molecole a partire da una ristretta serie di
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) POLIMERI Le cellule sintetizzano un enorme numero di grosse molecole a partire da una ristretta serie di
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
2. La chimica della vita Tutta la MATERIA è soggetta alle leggi della CHIMICA e della FISICA
 Tutta la MATERIA è soggetta alle leggi della CHIMICA e della FISICA Simbolo Numero atomico % in organismi viventi Elementi che costituiscono circa il 96% del peso degli organismi viventi O 8 65.0 C 6 18.5
Tutta la MATERIA è soggetta alle leggi della CHIMICA e della FISICA Simbolo Numero atomico % in organismi viventi Elementi che costituiscono circa il 96% del peso degli organismi viventi O 8 65.0 C 6 18.5
MONOMERI E POLIMERI BIOLOGICI
 1 MATERIA VIVENTE costituita da COMPOSTI ORGANICI (composti del C) ACQUA (75%) CORPO UMANO costituito da SALI MINERALI COMPOSTI INORGANICI CARBONIO(18%) MOLECOLE ORGANICHE sono dette BIOMOLECOLE il cui
1 MATERIA VIVENTE costituita da COMPOSTI ORGANICI (composti del C) ACQUA (75%) CORPO UMANO costituito da SALI MINERALI COMPOSTI INORGANICI CARBONIO(18%) MOLECOLE ORGANICHE sono dette BIOMOLECOLE il cui
Chimica. Lezione 2 Parte II Composti ionici e molecolari
 Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
MOLECOLE. 2 - i legami chimici. Prof. Vittoria Patti
 MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
PRINCIPI NUTRITIVI. I principi nutritivi sono sostanze che si trovano negli alimenti e che hanno particolari funzioni per il nostro organismo.
 PRINCIPI NUTRITIVI I principi nutritivi sono sostanze che si trovano negli alimenti e che hanno particolari funzioni per il nostro organismo. I principi nutritivi sono : 1. I glucidi detti anche carboidrati
PRINCIPI NUTRITIVI I principi nutritivi sono sostanze che si trovano negli alimenti e che hanno particolari funzioni per il nostro organismo. I principi nutritivi sono : 1. I glucidi detti anche carboidrati
I LEGAMI CHIMICI. I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune
 I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
1. L energia di legame. 2. I gas nobili e a regola dell ottetto. 3. Il legame covalente. 4. Il legame covalente dativo. 5. Il legame covalente polare
 Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
BIOMOLECOLE. I mattoni delle cellule.
 BIMLECLE I mattoni delle cellule PRINCIPALI GRUPPI FUNZINALI I gruppi funzionali sono gruppi di atomi, uniti da legami covalenti, che conferiscono alla molecola di cui fanno parte un comportamento chimico
BIMLECLE I mattoni delle cellule PRINCIPALI GRUPPI FUNZINALI I gruppi funzionali sono gruppi di atomi, uniti da legami covalenti, che conferiscono alla molecola di cui fanno parte un comportamento chimico
L ALIMENTAZIONE IL NOSTRO CORPO È UNA MACCHINA CHE HA BISOGNO CONTINUAMENTE DI ENERGIA ANCHE QUANDO È A RIPOSO.
 L ALIMENTAZIONE IL NOSTRO CORPO È UNA MACCHINA CHE HA BISOGNO CONTINUAMENTE DI ENERGIA ANCHE QUANDO È A RIPOSO. L ENERGIA VIENE RICAVATA DAI PRINCIPI NUTRITIVI O NUTRIENTI ALIMENTARSI VUOL DIRE SODDISFARE
L ALIMENTAZIONE IL NOSTRO CORPO È UNA MACCHINA CHE HA BISOGNO CONTINUAMENTE DI ENERGIA ANCHE QUANDO È A RIPOSO. L ENERGIA VIENE RICAVATA DAI PRINCIPI NUTRITIVI O NUTRIENTI ALIMENTARSI VUOL DIRE SODDISFARE
H N H R N H R N R R N R H H H
 AMMINE Sono derivati dell ammoniaca (NH 3 ) nei quali uno o più atomi di idrogeno sono sostituiti da altrettanti radicali alchilici (R-, come ad esempio il gruppo -CH 3 ). Come l ammoniaca anche le ammine
AMMINE Sono derivati dell ammoniaca (NH 3 ) nei quali uno o più atomi di idrogeno sono sostituiti da altrettanti radicali alchilici (R-, come ad esempio il gruppo -CH 3 ). Come l ammoniaca anche le ammine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi. Possono assumere forme diverse a seconda della funzione
 Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
CARBOIDRATI Sono aldeidi o chetoni con diversi gruppi ossidrilici (formula molecolare di base (CH2O)n, con n =>3) Funzioni riserva energetica
 CARBOIDRATI Sono aldeidi o chetoni con diversi gruppi ossidrilici (formula molecolare di base (CH2O)n, con n =>3) Funzioni riserva energetica combustibili intermedi metabolici Impalcatura del DNA e RNA
CARBOIDRATI Sono aldeidi o chetoni con diversi gruppi ossidrilici (formula molecolare di base (CH2O)n, con n =>3) Funzioni riserva energetica combustibili intermedi metabolici Impalcatura del DNA e RNA
LIPIDI. I lipidi (la parola deriva dal greco lìpos, grasso) sono un gruppo di sostanze grasse presente in tutti gli organismi viventi.
 LIPIDI I lipidi (la parola deriva dal greco lìpos, grasso) sono un gruppo di sostanze grasse presente in tutti gli organismi viventi. I lipidi sono composti idrofobi perché non sono solubili in acqua ma
LIPIDI I lipidi (la parola deriva dal greco lìpos, grasso) sono un gruppo di sostanze grasse presente in tutti gli organismi viventi. I lipidi sono composti idrofobi perché non sono solubili in acqua ma
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici
 I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE
 CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
BIOMOLECOLE LE BASI DELLA BIOCHIMICA. Capitolo 1 Dal Carbonio agli OGM PLUS
 BIOMOLECOLE LE BASI DELLA BIOCHIMICA Capitolo 1 Dal Carbonio agli OGM PLUS BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici Proteine BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici - monosaccaridi - disaccaridi
BIOMOLECOLE LE BASI DELLA BIOCHIMICA Capitolo 1 Dal Carbonio agli OGM PLUS BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici Proteine BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici - monosaccaridi - disaccaridi
Il DNA: istruzioni per la vita Bibliografia I colori della Biologia Gatti- Giusti- Anelli Ed. Pearson
 Il DNA: istruzioni per la vita Bibliografia I colori della Biologia Gatti- Giusti- Anelli Ed. Pearson Una divisione equa Quando una cellula si divide, si formano due nuove cellule che contengono esattamente
Il DNA: istruzioni per la vita Bibliografia I colori della Biologia Gatti- Giusti- Anelli Ed. Pearson Una divisione equa Quando una cellula si divide, si formano due nuove cellule che contengono esattamente
SOLUZIONI DEGLI ESERCIZI
 Dal carbonio agli OGM Biochimica e biotecnologie SOLUZIONI DEGLI ESERCIZI Capitolo 0 Il mondo del carbonio 1. b, e 2. d 3. 7 4. 5. 6. 7. a) Isomeria di posizione; b) i due composti non sono isomeri; c)
Dal carbonio agli OGM Biochimica e biotecnologie SOLUZIONI DEGLI ESERCIZI Capitolo 0 Il mondo del carbonio 1. b, e 2. d 3. 7 4. 5. 6. 7. a) Isomeria di posizione; b) i due composti non sono isomeri; c)
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
1. L energia di legame
 legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
I carboidrati sono poli-idrossialdeidiidrossialdeidi o poli-idrossichetoniidrossichetoni o derivati di questi.
 CARBOIDRATI I CARBOIDRATI I carboidrati sono poli-idrossialdeidiidrossialdeidi o poli-idrossichetoniidrossichetoni o derivati di questi. Unità di base dei carboidrati sono i monosaccaridi. Formula bruta
CARBOIDRATI I CARBOIDRATI I carboidrati sono poli-idrossialdeidiidrossialdeidi o poli-idrossichetoniidrossichetoni o derivati di questi. Unità di base dei carboidrati sono i monosaccaridi. Formula bruta
METALLI: bassa energia di ionizzazione bassa affinità elettronica. NON METALLI: elevata energia di ionizzazione elevata affinità elettronica
 METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Le sostanze chimiche prof. Matteo Scapellato
 1. Fenomeni fisici e fenomeni chimici a) Fenomeno fisico: è una trasformazione che non cambia la natura delle sostanze 1 b) Fenomeno chimico o reazione chimica: è una trasformazione che cambia la natura
1. Fenomeni fisici e fenomeni chimici a) Fenomeno fisico: è una trasformazione che non cambia la natura delle sostanze 1 b) Fenomeno chimico o reazione chimica: è una trasformazione che cambia la natura
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Carboidrati. Principale ciclo energetico della biosfera si basa sul metabolismo dei carboidrati
 Carboidrati Principale ciclo energetico della biosfera si basa sul metabolismo dei carboidrati Carboidrati: funzioni Fornire energia chimica Sostegno (parete cellulare vegetale) Protezione (parete batterica)
Carboidrati Principale ciclo energetico della biosfera si basa sul metabolismo dei carboidrati Carboidrati: funzioni Fornire energia chimica Sostegno (parete cellulare vegetale) Protezione (parete batterica)
IL LEGAME A IDROGENO
 IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
F. Fogolari Milano, Marzo
 Biomolecole - 1 Federico Fogolari Dipartimento Scientifico e Tecnologico Universita di Verona Ca Vignal 1, Strada Le Grazie 15 37134 Verona, Italy tel. ++39-045-8027906 fax. ++39-045-8027929 email: fogolari@sci.univr.it
Biomolecole - 1 Federico Fogolari Dipartimento Scientifico e Tecnologico Universita di Verona Ca Vignal 1, Strada Le Grazie 15 37134 Verona, Italy tel. ++39-045-8027906 fax. ++39-045-8027929 email: fogolari@sci.univr.it
Elementi sistemati nella TAVOLA PERIODICA DEGLI ELEMENTI in base al numero atomico crescente O, H, N, C (+ del 96% della materia vivente)
 OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
I Composti Organici. Le Biomolecole
 I Composti Organici I composti organici sono molecole tutte contenenti carbonio. Essi comprendono. 1. composti di interesse energetico che sono gli Idrocarburi ( i derivati del petrolio), 2. composti a
I Composti Organici I composti organici sono molecole tutte contenenti carbonio. Essi comprendono. 1. composti di interesse energetico che sono gli Idrocarburi ( i derivati del petrolio), 2. composti a
Università degli studi di MILANO Facoltà di AGRARIA. El. di Chimica e Chimica Fisica. Mod. 1 CHIMICA. Mod. 2 CHIMICA FISICA.
 Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 4 Anno Accademico 2010-2011 Docente: Dimitrios Fessas Si riconoscono così
Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 4 Anno Accademico 2010-2011 Docente: Dimitrios Fessas Si riconoscono così
Le reazioni di ossido-riduzione
 Le reazioni di ossido-riduzione Si dicono reazioni di ossidazione e di riduzione (o ossido-riduzione) quelle reazioni che avvengono con cambiamento del numero di elettroni che una specie chimica coinvolge
Le reazioni di ossido-riduzione Si dicono reazioni di ossidazione e di riduzione (o ossido-riduzione) quelle reazioni che avvengono con cambiamento del numero di elettroni che una specie chimica coinvolge
LE PROTEINE -struttura tridimensionale-
 LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
I componenti chimici delle cellule
 I componenti chimici delle cellule Piccole molecole Macromolecole Piccole molecole C, H, N ed O costituiscono quasi il 99% del peso di una cellula Il 70 % della massa di una cellula è costituito da acqua
I componenti chimici delle cellule Piccole molecole Macromolecole Piccole molecole C, H, N ed O costituiscono quasi il 99% del peso di una cellula Il 70 % della massa di una cellula è costituito da acqua
CHIMICA II (CHIMICA ORGANICA)
 CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
Cos è la chimica organica
 Cos è la chimica organica La prima definizione di chimica organica si deve al chimico svedese Jacob Berzelius nel 1807: la chimica organica è la scienza che studia i comportamenti chimici e fisici dei
Cos è la chimica organica La prima definizione di chimica organica si deve al chimico svedese Jacob Berzelius nel 1807: la chimica organica è la scienza che studia i comportamenti chimici e fisici dei
Cellula batterica. ioni, piccole molecole 4% Fosfolipidi 2% DNA 1% RNA 6%
 Le macromolecole, assieme, costituiscono la maggior parte del contenuto secco degli organismi viventi Cellula batterica ioni, piccole molecole 4% Fosfolipidi 2% DNA 1% RNA 6% CLASSIFICAZIONE DEI CARBOIDRATI:
Le macromolecole, assieme, costituiscono la maggior parte del contenuto secco degli organismi viventi Cellula batterica ioni, piccole molecole 4% Fosfolipidi 2% DNA 1% RNA 6% CLASSIFICAZIONE DEI CARBOIDRATI:
Lezione 1: Atomi e molecole:
 Lezione 1: Atomi e molecole: La materia è costituita da elementi chimici in forma pura o in combinazioni dette composti. La vita richiede circa 25 elementi chimici. La struttura atomica determina il comportamento
Lezione 1: Atomi e molecole: La materia è costituita da elementi chimici in forma pura o in combinazioni dette composti. La vita richiede circa 25 elementi chimici. La struttura atomica determina il comportamento
02/12/2014. Tutti gli esseri viventi sono composti da cellule LA CELLULA E L UNITA STRUTTURALE E FUNZIONALE DEGLI ORGANISMI VIVENTI
 Tutti gli esseri viventi sono composti da cellule Eubatteri Procarioti unicellulari Archebatteri LA CELLULA E L UNITA STRUTTURALE E FUNZIONALE DEGLI ORGANISMI VIVENTI -Autoconservazione mantenimento della
Tutti gli esseri viventi sono composti da cellule Eubatteri Procarioti unicellulari Archebatteri LA CELLULA E L UNITA STRUTTURALE E FUNZIONALE DEGLI ORGANISMI VIVENTI -Autoconservazione mantenimento della
La chimica della vita. Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012
 La chimica della vita 1 Tutta la materia è composta da elementi chimici È materia qualsiasi cosa, vivente e non vivente, che occupi dello spazio e che abbia una massa. La materia è composta da elementi
La chimica della vita 1 Tutta la materia è composta da elementi chimici È materia qualsiasi cosa, vivente e non vivente, che occupi dello spazio e che abbia una massa. La materia è composta da elementi
Idrogeno (H) Azoto (N) La materia è costituita da elementi chimici. In natura sono presenti 92 elementi
 Gli organismi sono fatti da MATERIA*. (*qualsiasi cosa che occupa uno spazio e ha una massa) Gli antichi filosofi greci dicevano che la materia deriva da 4 ingredienti di base o ELEMENTI (ARIA, ACQUA,
Gli organismi sono fatti da MATERIA*. (*qualsiasi cosa che occupa uno spazio e ha una massa) Gli antichi filosofi greci dicevano che la materia deriva da 4 ingredienti di base o ELEMENTI (ARIA, ACQUA,
Le molecole biologiche. Prof. Lasaponara
 Le molecole biologiche Prof. Lasaponara 2 1 3 Le molecole biologiche Zuccheri ed i Lipidi Lezione 3 Psicobiologia Gli zuccheri rappresentano una classe di molecole organiche detta anche dei carboidrati,
Le molecole biologiche Prof. Lasaponara 2 1 3 Le molecole biologiche Zuccheri ed i Lipidi Lezione 3 Psicobiologia Gli zuccheri rappresentano una classe di molecole organiche detta anche dei carboidrati,
Percorsi di chimica organica - Soluzioni degli esercizi del testo
 ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
Atomi e molecole. Gli atomi degli elementi si trovano in natura generalmente combinati tra loro in molecole o composti ionici
 IL LEGAME CHIMICO Atomi e molecole È estremamente difficile trovare in natura una sostanza formata da singoli atomi isolati Solo i gas nobili sono presenti in natura come gas monoatomici Gli atomi degli
IL LEGAME CHIMICO Atomi e molecole È estremamente difficile trovare in natura una sostanza formata da singoli atomi isolati Solo i gas nobili sono presenti in natura come gas monoatomici Gli atomi degli
Le molecole della vita
 Le molecole della vita Inorganici -Acqua -Ossigeno (O 2 ), Anidride carbonica (CO 2 ) -Elementi minerali quali Calcio (Ca), Fosforo (P), Magnesio (Mg), Sodio(Na), Potassio (K), Zolfo (S), Cloro (Cl), Ferro
Le molecole della vita Inorganici -Acqua -Ossigeno (O 2 ), Anidride carbonica (CO 2 ) -Elementi minerali quali Calcio (Ca), Fosforo (P), Magnesio (Mg), Sodio(Na), Potassio (K), Zolfo (S), Cloro (Cl), Ferro
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO
 I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
Unità 1. Le molecole della vita
 Unità 1 Le molecole della vita In apertura: Lattosio, sì o no? Latte e latticini sono cibi nutrienti, ricchi di proteine e minerali Per milioni di persone, però, i benefici di questi alimenti sono accompagnati
Unità 1 Le molecole della vita In apertura: Lattosio, sì o no? Latte e latticini sono cibi nutrienti, ricchi di proteine e minerali Per milioni di persone, però, i benefici di questi alimenti sono accompagnati
Irrancidimento (ossidazione) degli acidi grassi insaturi
 Irrancidimento (ossidazione) degli acidi grassi insaturi Aldeidi STPA-Chimica rganica Alcuni saggi sui grassi numero di acidità (titolazione in presenza di fenolftaleina con base forte diluita a temperatura
Irrancidimento (ossidazione) degli acidi grassi insaturi Aldeidi STPA-Chimica rganica Alcuni saggi sui grassi numero di acidità (titolazione in presenza di fenolftaleina con base forte diluita a temperatura
Costituenti chimici della materia vivente
 Costituenti chimici della materia vivente Le macromolecole biologiche Macromolecole (dal greco macros = grande) biologiche. Classi di composti biologici multifunzionali: Polisaccaridi proteine acidi
Costituenti chimici della materia vivente Le macromolecole biologiche Macromolecole (dal greco macros = grande) biologiche. Classi di composti biologici multifunzionali: Polisaccaridi proteine acidi
I principi nutritivi
 I principi nutritivi Quali sono? Qual è la loro funzione? In quali cibi si trovano? Perché sono importanti? Quante Kilocalorie sviluppano? Kilocalorie Unità di misura dell energia accumulata negli alimenti
I principi nutritivi Quali sono? Qual è la loro funzione? In quali cibi si trovano? Perché sono importanti? Quante Kilocalorie sviluppano? Kilocalorie Unità di misura dell energia accumulata negli alimenti
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
Si dividono in monosaccaridi, disaccaridi, oligosaccaridi e polisaccaridi.
 Glucidi, carboidrati o zuccheri I glucidi, detti anche carboidrati, zuccheri o saccàridi, sono sostanze ternarie (costituite da,, ), di fondamentale importanza biologica. Innanzitutto sono i soli composti
Glucidi, carboidrati o zuccheri I glucidi, detti anche carboidrati, zuccheri o saccàridi, sono sostanze ternarie (costituite da,, ), di fondamentale importanza biologica. Innanzitutto sono i soli composti
Chimica e chimica della vita. Chimica della vita. Atomi. Materia ed elementi. Tavola periodica degli elementi. Elementi ed atomi
 Chimica e chimica della vita Tocca, Oliver diceva, lanciandomi una barretta non c è niente al mondo come il tungsteno sinterizzato Batteva sulle barrette e queste emettevano un tintinnio profondo Il suono
Chimica e chimica della vita Tocca, Oliver diceva, lanciandomi una barretta non c è niente al mondo come il tungsteno sinterizzato Batteva sulle barrette e queste emettevano un tintinnio profondo Il suono
