PRINCIPALI SISTEMI TAMPONE
|
|
|
- Angelo Bellini
- 6 anni fa
- Visualizzazioni
Transcript
1 SISTEMI TAMPONE PROF.SSA AUSILIA ELCE
2 Indice 1 INTRODUZIONE PRINCIPALI SISTEMI TAMPONE RECUPERO DEI BICARBONATI BIBLIOGRAFIA SITOGRAFIA di 14
3 1 Introduzione L omeostasi dei valori fisiologici di ph dei liquidi biologici rappresenta una delle attività fisiologiche essenziali dell organismo umano. Il ph è la misura della concentrazione di ioni idrogeno o idrogenioni (H + ) in una data soluzione e viene espressa tramite il logaritmo negativo della concentrazione idrogenionica in quella data soluzione, come riportato nella seguente formula: ph = log[h] + Trattandosi di relazione logaritmica negativa esistente fra i valori di ph e la concentrazione degli idrogenioni, aumenti della concentrazione idrogenionica equivalgono a riduzioni del ph e viceversa così come mostrato in figura 1. Tale convenzione è stata adottata poiché nei liquidi biologici la concentrazione degli idrogenioni è di gran lunga più bassa rispetto alle altre specie ioniche. Dunque sarebbe stato scomodo adoperare la scala decimale al fine di valutare i rapporti fra la varie specie in soluzione. Figura 1 3 di 14
4 Se volessimo comparare la concentrazione degli ioni idrogeno con quella degli ioni sodio nel plasma, la concentrazione di H + nel sangue arterioso è pari in media a 0,00004mEq/L, mentre la concentrazione di Na + nel sangue arterioso è circa 135 meq/l. Pertanto risulta particolarmente complesso adoperare la stessa scala per descrivere le concentrazioni delle due specie.il fatto che si adoperi una misura logaritmica piuttosto che una decimale nel descrivere la concentrazione degli idrogenioni comporta che a piccole variazioni di ph corrispondono a grosse variazioni nella concentrazione idrogenionica e viceversa, così come riportato in figura 2. Figura 2 4 di 14
5 Si assume per convenzione che a 25 C una data soluzione è: Acida se il ph è < 7 Neutra se il ph è = 7 Basica se il ph è > 7. L acidità è la misura della tendenza di una sostanza a cedere un protone, mentre la basicità è una misura dell affinità di una sostanza per il protone. Un acido forte, dunque, è una sostanza che ha una forte tendenza a cedere il suo protone. E il caso dell acido cloridrico (HCl), che troviamo in soluzione acquosa sempre nella sua forma dissociata (H + + Cl - ). Un acido debole, invece, ha scarsa tendenza a cedere il suo protone. Nella maggior parte dei distretti corporei il ph è leggermente alcalino e pari all incirca a 7.4. Perturbazioni del ph possono determinare stati patologici acuti o cronici di entità anche grave. Diversi sono i fattori che possono alterare il ph sanguigno, tra questi, l alimentazione, il metabolismo, la funzionalità renale e la funzionalità polmonare. Patologie caratterizzate da una maggior concentrazioni di idrogenioni nel sangue sono le acidosi, queste si suddividono a loro volta, a seconda dell eziopatogenesi, in acidosi respiratorie e metaboliche. L acidosi respiratoria è patologia causata da un alterata attività polmonare con una riduzione degli scambi di anidride carbonica, mentre l acidosi metabolica è una patologia che può essere innescata da fattori differenti, quali: Eccessivo accumulo di acidi non volatili, Perdita di alcali non volatili, come il bicarbonato, Ridotta capacità dei reni di eliminare gli acidi. 5 di 14
6 Le acidosi sono patologie di gran lunga più frequenti rispetto alle alcalosi, le quali possono essere anch esse o di tipo respiratorio o di tipo metabolico, e sono caratterizzate da un alcalinizzazione del ph sanguigno. 6 di 14
7 2 Principali sistemi tampone Le proteine sono estremamente sensibili al cambiamento del ph. Tali cambiamenti alterano la struttura terziaria delle proteine e dunque la funzionalità stesse. A livello macroscopico una condizione prolungata di acidosi è in grado di causare alterazioni a carico del sistema nervoso centrale, con una inibizione dell eccitazione neuronale che può progressivamente condurre al coma ed alla morte, per inibizione del centro del respiro. Invece, un alcalosi prolungata può altresì produrre danni a livello centrale, caratterizzati prevalentemente da una iperattivazione della scarica neuronale tale da provocare contrazioni muscolari e spasmi tali da sfociare anche nella paralisi dei muscoli respiratori. Il metabolismo di un individuo è fisiologicamente spostato verso la produzione di acidi a causa del fatto che la dieta è ricca in sostanze di natura acida ed il metabolismo contribuisce alla produzione di ioni H +. Varie sono le vie metaboliche che determinano la produzione di acidi, anche in condizioni fisiologiche. Per evitare danni da alterazioni del ph l organismo umano dispone di alcune sostanze chimiche (definite sistemi tampone) che reagiscono tra loro ammortizzando i cambiamenti di concentrazione idrogenionica ed evitando che il valore di ph si modifichi. Queste sostanze vengono definiti sistemi tampone. Nell organismo umano i tre principali sistemi tampone sono: Il sistema del bicarbonato di primaria importanza (in particolare a livello extracellulare), Il sistema delle proteine, fra queste soprattutto l emoglobina, Il sistema del fosfato. Il sistema del bicarbonato è quello che analizzeremo nell ambito di questa lezione ed è caratterizzato dalla seguente reazione all equilibrio: 7 di 14
8 H + + HCO 3 - H 2 CO 3 H 2 O + CO 2 Quando si verifica un aumento della concentrazione di H +, come ad esempio accade in seguito ad uno sforzo fisico prolungato, il sistema reagisce spostando l equilibrio della reazione a destra (verso la produzione della CO 2 ); se la concentrazione degli H + si riduce, il sistema si sposta verso sinistra, determinando la produzione di H + (fig 3). Figura 3 8 di 14
9 In accordo alla reazione per ogni mole di H + prodotta, viene generata una mole di ioni HCO - 3, tuttavia la concentrazione di tale ione nel plasma è pari a 24 meq/l, maggiore rispetto a quella degli ioni H +. Ciò è dovuto in parte all azione tamponante esplicata dai globuli rossi. Infatti, lo spostamento a destra della reazione del sistema tampone del bicarbonato causa la produzione di CO 2. Una parte di CO 2 entra nel globulo rosso dove, in presenza dell enzima anidrasi carbonica, viene convertita in acido carbonico. Quest ultimo si scinde in H + (che lega l emoglobina) e in ione bicarbonato che viene rilasciato nel sangue e va a rifornire la coppia tampone. Tale reazione è più veloce rispetto alla reazione spontanea dell anidride carbonica con l acqua. L entrata della CO 2 nei globuli rossi è favorita dal fatto che queste cellule non svolgono ciclo di Krebs e quindi non producono CO 2 endogena; quindi, sono disponibili ad acquisire CO 2 dal sangue (fig 4). 9 di 14
10 Figura 4 Ovviamente a livello polmonare il meccanismo si inverte, e la CO 2 viene ceduta in cambio di ossigeno. Naturalmente questo meccanismo è a rapida saturazione, cioè è in grado di ammortizzare soltanto una limitata quantità di CO 2, per cui occorrono anche altri meccanismi (recupero polmonare e renale). 10 di 14
11 3 Recupero dei bicarbonati Lo ione H + che lega l emoglobina ha a sua volta un ruolo fisiologico: esso determina una modifica strutturale della molecola, causando una ridotta affinità per l ossigeno e quindi una maggior cessione di ossigeno proprio a quei tessuti che stanno effettuando un più attivo metabolismo e quindi stanno producendo maggiori quantità di CO 2. Questo meccanismo prende il nome di effetto Bohr. In ogni caso il meccanismo appena descritto è a rapida saturazione, vale a dire che non può di certo compensare anomalie del ph che si verificano per periodi prolungati oppure in maniera ingente. Pertanto, altri meccanismi vengono attivati in caso di acidosi, al fine di ripristinare il ph fisiologico a livello sanguigno. Tali meccanismi riguardano l intervento renale e polmonare nel processo di omeostasi del ph, in caso di acidosi o di alcalosi. Le modifiche principali a carico del polmone riguardano la ventilazione polmonare. Mentre, a carico del rene vengono attivati diversi meccanismi di recupero dei bicarbonati. Fra questi i cambiamenti riguardanti l escrezione ed il riassorbimento dell idrogeno e dei bicarbonati (fig 5). 11 di 14
12 Figura 5 12 di 14
13 Bibliografia Nelson L., Cox M. M. I principi di biochimica di Lehninger. Edizione Zanichelli Barrett K. E., Barman S. M., Boitano S., Brooks H. L. Fisiologia Medica di Ganong. Piccin, 12 edizione italiana. Lewin B, Krebs J. E., Goldstein E. S, Kilpatrick S. T. Il gene X. Zanichelli Silverthorn D.U. Fisiologia umana, un approccio integrato. Sesta edizione italiana a cura di Vellea Franca Sacchi. Pearson editore, di 14
14 Sitografia di 14
Plasma ph Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca
 Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
Tamponi Biologici. AO/Febbraio 2016
 Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI
 EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI SOMMARIO ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO ACIDO-BASE EGA (EMOGAS-ANALISI) ANALISI) ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO
EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI SOMMARIO ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO ACIDO-BASE EGA (EMOGAS-ANALISI) ANALISI) ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi Lezione 24 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante
L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi Lezione 24 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante
Tamponi biologici per il controllo del ph
 Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
Equilibrio acido base
 Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
ph e indicatori acido-base
 ph e indicatori acido-base La dissociazione ionica dell acqua H 2 O + H 2 O OH - + H 3 O + acido base base acido coniugata coniugato 2 H 2 O (l) OH - (aq) + H 3 O + (aq) Il numero di molecole di acqua
ph e indicatori acido-base La dissociazione ionica dell acqua H 2 O + H 2 O OH - + H 3 O + acido base base acido coniugata coniugato 2 H 2 O (l) OH - (aq) + H 3 O + (aq) Il numero di molecole di acqua
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE 1 I tamponi fisiologici del ph 1 - Il sistema acido carbonico-bicarbonato: H 2 CO 3 H + + HCO 3 pka = 6.1 ph = 6.1 + log [HCO 3 ] [H 2 CO 3 ] 2 - Il sistema fosfato:
L EQUILIBRIO ACIDO-BASE NEL SANGUE 1 I tamponi fisiologici del ph 1 - Il sistema acido carbonico-bicarbonato: H 2 CO 3 H + + HCO 3 pka = 6.1 ph = 6.1 + log [HCO 3 ] [H 2 CO 3 ] 2 - Il sistema fosfato:
L'EQUILIBRIO ACIDO-BASE
 L'EQUILIBRIO ACIDO-BASE La concentrazione nell'organismo degli ioni H+ è finemente regolata perché quasi tutte le attività enzimatiche sono influenzate sostanzialmente dalle variazioni di ph. Quindi l'attività
L'EQUILIBRIO ACIDO-BASE La concentrazione nell'organismo degli ioni H+ è finemente regolata perché quasi tutte le attività enzimatiche sono influenzate sostanzialmente dalle variazioni di ph. Quindi l'attività
ph = log 1/[H + ] = log [H + ]
![ph = log 1/[H + ] = log [H + ] ph = log 1/[H + ] = log [H + ]](/thumbs/49/24977942.jpg) ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra ). La stabilità del ph è insidiata da
 Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
2.Controllo dell equilibrio acido-base - II. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 2.Controllo dell equilibrio acidobase II Carlo Capelli Fisiologia Facoltà di Scienze Motorie Università di Verona 1. Tampone bicarbonatoco 2 E il sistema tampone fisiologico più importante [ CO 2] = PCO
2.Controllo dell equilibrio acidobase II Carlo Capelli Fisiologia Facoltà di Scienze Motorie Università di Verona 1. Tampone bicarbonatoco 2 E il sistema tampone fisiologico più importante [ CO 2] = PCO
Alterazione della capacità tampone nell'organismo. Alterazione capacità tampone rev. 0 - data: 5 luglio
 Alterazione della capacità tampone nell'organismo Alterazione capacità tampone rev. 0 - data: 5 luglio 2008 1 Il ph fisiologico dell'organismo è compreso tra 7.38 e 7.44 Nel liquido extracellulare sono
Alterazione della capacità tampone nell'organismo Alterazione capacità tampone rev. 0 - data: 5 luglio 2008 1 Il ph fisiologico dell'organismo è compreso tra 7.38 e 7.44 Nel liquido extracellulare sono
Emogasanalisi in t.i.
 Emogasanalisi in t.i. 9 volte su 10 6 volte su 10 100 e più alterati rispetto ai v.n. interpretazioni inesatte diagrammi, nomogrammi, equazioni e sistemi di valutazione 100 anni dall equazione di Handerson
Emogasanalisi in t.i. 9 volte su 10 6 volte su 10 100 e più alterati rispetto ai v.n. interpretazioni inesatte diagrammi, nomogrammi, equazioni e sistemi di valutazione 100 anni dall equazione di Handerson
Equilibri acido-base, ph e sistemi tampone
 Equilibri acido-base, ph e sistemi tampone Tiziana Bellini Dipartimento di Scienze Biomediche Chirurgico Specialistiche Facoltà di Medicina Farmacia e Prevenzione Università di Ferrara Cos è un acido?
Equilibri acido-base, ph e sistemi tampone Tiziana Bellini Dipartimento di Scienze Biomediche Chirurgico Specialistiche Facoltà di Medicina Farmacia e Prevenzione Università di Ferrara Cos è un acido?
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO
 L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
Trasporto di O 2 nel sangue
 Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Trasporto dei gas respiratori nel sangue
 Trasporto dei gas respiratori nel sangue La soluzione dei gas nei liquidi C Legge di Henry acq P gas S gas C acq = quantità di gas disciolta nella fase acquosa P gas = pressione parziale del gas nella
Trasporto dei gas respiratori nel sangue La soluzione dei gas nei liquidi C Legge di Henry acq P gas S gas C acq = quantità di gas disciolta nella fase acquosa P gas = pressione parziale del gas nella
1. Controllo dell equilibrio acido-base. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 1. Controllo dell equilibrio acido-base Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Misura dell acidità di una soluzione Definizione di acido: qualsiasi sostanza chimica che
1. Controllo dell equilibrio acido-base Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Misura dell acidità di una soluzione Definizione di acido: qualsiasi sostanza chimica che
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da
 Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Soluzioni tampone. Francesca Montemurro
 Soluzioni tampone Francesca Montemurro DEFINIZIONE ACIDO BASE ü ARRENIUS: acido libera H + e la base OH -, era una definizione che andava bene per reazioni in soluzione acquosa ma non in ambiente gassoso.
Soluzioni tampone Francesca Montemurro DEFINIZIONE ACIDO BASE ü ARRENIUS: acido libera H + e la base OH -, era una definizione che andava bene per reazioni in soluzione acquosa ma non in ambiente gassoso.
FORZA DI ACIDI E BASI HA + :B HB + + A
 FORZA DI ACIDI E BASI n La forza di un acido è la misura della tendenza di una sostanza a cedere un protone. n La forza di una base è una misura dell'affinità di un composto ad accettare un protone. n
FORZA DI ACIDI E BASI n La forza di un acido è la misura della tendenza di una sostanza a cedere un protone. n La forza di una base è una misura dell'affinità di un composto ad accettare un protone. n
Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio
 Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
CORSO DI CHIMICA PER L AMBIENTE. Lezione del 5 Maggio 2016
 CORSO DI CHIMICA PER L AMBIENTE Lezione del 5 Maggio 2016 Sali Acidi o Basici La neutralità acido-base dell acqua può essere alterata anche dal discioglimento di alcuni sali. Prendiamo ad esempio NH 4
CORSO DI CHIMICA PER L AMBIENTE Lezione del 5 Maggio 2016 Sali Acidi o Basici La neutralità acido-base dell acqua può essere alterata anche dal discioglimento di alcuni sali. Prendiamo ad esempio NH 4
DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE
 VOLUMI POLMONARI DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE DEFINIRE LE RESISTENZE POLMONARI DEFINIRE IL LAVORO POLMONARE Equazione
VOLUMI POLMONARI DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE DEFINIRE LE RESISTENZE POLMONARI DEFINIRE IL LAVORO POLMONARE Equazione
In acqua pura o in soluzione acquosa, si ha sempre il seguente equilibrio: + +
 Ionizzazione dell Acqua e ph In acqua pura o in soluzione acquosa, si ha sempre il seguente equilibrio: + + L acqua è una sostanza anfiprotica, cioè può sia donare che accettare protoni (ioni H + ). Costante
Ionizzazione dell Acqua e ph In acqua pura o in soluzione acquosa, si ha sempre il seguente equilibrio: + + L acqua è una sostanza anfiprotica, cioè può sia donare che accettare protoni (ioni H + ). Costante
Mioglobina ed emoglobina
 Mioglobina ed emoglobina α β Muscolo Deposito di O 2 Alta affinità per O 2 β α Globulo rosso Trasporto di O 2 Bassa affinità per O 2 Cooperativa ed allosterica Animali Mb-knockout (2003) : funzionalità
Mioglobina ed emoglobina α β Muscolo Deposito di O 2 Alta affinità per O 2 β α Globulo rosso Trasporto di O 2 Bassa affinità per O 2 Cooperativa ed allosterica Animali Mb-knockout (2003) : funzionalità
Raffaele Alvisi 14 gennaio 1916
 Raffaele Alvisi 14 gennaio 1916 Alterazioni del ph = Alterazioni dell equilibrio Acido-Base X 1 2 3 4 5 6 7 8 9 Conoscenze o Capacità Acquisite SI/NO Il clinico sospetta e dimostra l alterazione dell equilibrio
Raffaele Alvisi 14 gennaio 1916 Alterazioni del ph = Alterazioni dell equilibrio Acido-Base X 1 2 3 4 5 6 7 8 9 Conoscenze o Capacità Acquisite SI/NO Il clinico sospetta e dimostra l alterazione dell equilibrio
Controllo nervoso del respiro
 Controllo nervoso del respiro La respirazione è una funzione involontaria controllata da 3 gruppi di neuroni (centri) localizzati nel tronco encefalico: Controllo nervoso del respiro Centro respiratorio
Controllo nervoso del respiro La respirazione è una funzione involontaria controllata da 3 gruppi di neuroni (centri) localizzati nel tronco encefalico: Controllo nervoso del respiro Centro respiratorio
FISIOLOGIA dell ALLENAMENTO. dai processi fisiologici alle metodiche di allenamento
 FISIOLOGIA dell ALLENAMENTO dai processi fisiologici alle metodiche di allenamento Introduzione alla fisiologia Metabolismo cellulare Il sistema cardiovascolare: funzione cardiaca vasi, flusso, pressione
FISIOLOGIA dell ALLENAMENTO dai processi fisiologici alle metodiche di allenamento Introduzione alla fisiologia Metabolismo cellulare Il sistema cardiovascolare: funzione cardiaca vasi, flusso, pressione
SOLUZIONI derivate da: Acido debole/ sale (CH 3 COOH/CH 3 COONa) Base debole/ suo sale (NH 4 OH/NH 4 Cl)
 Soluzioni Tampone Si definiscono soluzioni tampone quelle soluzioni in grado di mantenere pressoché costante il proprio ph per aggiunta di una ragionevole quantità di acido o di base forte o per moderata
Soluzioni Tampone Si definiscono soluzioni tampone quelle soluzioni in grado di mantenere pressoché costante il proprio ph per aggiunta di una ragionevole quantità di acido o di base forte o per moderata
Ionizzazione spontanea dell acqua: autoprotolisi o autoionizzazione dell acqua. [ H ] 2
![Ionizzazione spontanea dell acqua: autoprotolisi o autoionizzazione dell acqua. [ H ] 2 Ionizzazione spontanea dell acqua: autoprotolisi o autoionizzazione dell acqua. [ H ] 2](/thumbs/57/40353351.jpg) Equilibri ionici in soluzione acquosa L acqua, anche se purissima, rivela una conducibilità elettrica piccola ma misurabile che indica la presenza di ioni. Una ridotta frazione di molecole di acqua è dissociata
Equilibri ionici in soluzione acquosa L acqua, anche se purissima, rivela una conducibilità elettrica piccola ma misurabile che indica la presenza di ioni. Una ridotta frazione di molecole di acqua è dissociata
Arrhenius. HCl H + + Cl - NaOH Na + + OH -
 Arrhenius Un acido è una sostanza che contiene H ed è in grado di cedere ioni H + e base è una sostanza che ha tendenza a cedere ioni OH - in acqua H 2 O HCl H + + Cl - H 2 O NaOH Na + + OH - Reazione
Arrhenius Un acido è una sostanza che contiene H ed è in grado di cedere ioni H + e base è una sostanza che ha tendenza a cedere ioni OH - in acqua H 2 O HCl H + + Cl - H 2 O NaOH Na + + OH - Reazione
Rene ed equilibrio acido-base
 Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
L equilibrio dell acqua
 L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
Sistema urinario: la funzione renale
 Sistema urinario: la funzione renale FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici, i reni ne regolano la concentrazione plasmatica
Sistema urinario: la funzione renale FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici, i reni ne regolano la concentrazione plasmatica
17/05/2010. Equilibrio idrico. Variazioni del volume ematico indicono risposte omeostatiche
 Equilibrio idrico Variazioni del volume ematico indicono risposte omeostatiche 1 Ruolo del rene nel bilancio idrico Variazioni dell osmolarità attraverso la midollare 2 Scambio per controcorrente nella
Equilibrio idrico Variazioni del volume ematico indicono risposte omeostatiche 1 Ruolo del rene nel bilancio idrico Variazioni dell osmolarità attraverso la midollare 2 Scambio per controcorrente nella
45. Fisiologia dell'equilibrio acido-base
 Lezioni di Patologia generale Capitolo 45. Fisiologia dell'equilibrio acido-base 1465 45. Fisiologia dell'equilibrio acido-base III edizione ebook Luigi Barbieri (opzionale) 45. Fisiologia dell'equilibrio
Lezioni di Patologia generale Capitolo 45. Fisiologia dell'equilibrio acido-base 1465 45. Fisiologia dell'equilibrio acido-base III edizione ebook Luigi Barbieri (opzionale) 45. Fisiologia dell'equilibrio
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 22 Acidi e basi si scambiano protoni 3 Sommario 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. La forza
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 22 Acidi e basi si scambiano protoni 3 Sommario 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. La forza
Teorie Acido-Base. Gli acidi in acqua si dissociano e rilasciano H + Le basi in acqua si dissociano e rilasciano OH -
 Teorie Acido-Base Arrhenius: Gli acidi in acqua si dissociano e rilasciano H + Le basi in acqua si dissociano e rilasciano OH - Broensted-Lowry: Gli acidi rilasciano H + Le basi accettano H + Lewis gli
Teorie Acido-Base Arrhenius: Gli acidi in acqua si dissociano e rilasciano H + Le basi in acqua si dissociano e rilasciano OH - Broensted-Lowry: Gli acidi rilasciano H + Le basi accettano H + Lewis gli
Le soluzioni tampone
 Le soluzioni tampone Se in una soluzione acquosa sono presenti un acido debole e la sua base coniugata (CH 3 COOH e CH 3 COO - ;H 2 CO 3 e HCO 3 -, etc.) si ha una soluzione tampone (o come detto in alcuni
Le soluzioni tampone Se in una soluzione acquosa sono presenti un acido debole e la sua base coniugata (CH 3 COOH e CH 3 COO - ;H 2 CO 3 e HCO 3 -, etc.) si ha una soluzione tampone (o come detto in alcuni
EQUILIBRIO ACIDO - BASE
 EQUILIBRIO ACIDO - BASE da appunti del dott. Claudio Italiano, internista ospedaliero Che significa? Vuol dire che l organismo ha un suo equilibrio, detto omeòstasi, cioè il sangue deve necessariamente
EQUILIBRIO ACIDO - BASE da appunti del dott. Claudio Italiano, internista ospedaliero Che significa? Vuol dire che l organismo ha un suo equilibrio, detto omeòstasi, cioè il sangue deve necessariamente
-DEFINIZIONE DI ACIDI E BASI-
 -DEFINIZIONE DI ACIDI E BASI- DEFINIZIONE DI ARRHENIUS ACIDO: rilascia ioni H + HCl H + + Cl - BASE: rilascia ioni OH - NaOH Na + + OH - DEFINIZIONE DI BRÖNSTED ACIDO: rilascia ioni H + BASE: lega ioni
-DEFINIZIONE DI ACIDI E BASI- DEFINIZIONE DI ARRHENIUS ACIDO: rilascia ioni H + HCl H + + Cl - BASE: rilascia ioni OH - NaOH Na + + OH - DEFINIZIONE DI BRÖNSTED ACIDO: rilascia ioni H + BASE: lega ioni
Rene ed equilibrio acido base. La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica. Principali funzioni renali
 Rene ed equilibrio acido base La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica Savi Umberto Scuola di Specializzazione in Nefrologia S.C. di Nefrologia e Dialisi Cattinara
Rene ed equilibrio acido base La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica Savi Umberto Scuola di Specializzazione in Nefrologia S.C. di Nefrologia e Dialisi Cattinara
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE
 FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
Fisiologia Renale 4. Equilibrio acido-base: Fisiologia e fisiopatologia
 Fisiologia Renale 4. Equilibrio acido-base: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Tamponi fisiologici
Fisiologia Renale 4. Equilibrio acido-base: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Tamponi fisiologici
Proprietà delle Soluzioni
 Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO
 EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Trasporto dell ossigeno In tutti gli animali superiori, il metabolismo è aerobico L energia che si può estrarre dal glucosio
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Trasporto dell ossigeno In tutti gli animali superiori, il metabolismo è aerobico L energia che si può estrarre dal glucosio
Interpretazione dell emogasanalisi
 Interpretazione dell emogasanalisi Guglielmo IMBRIACO Gaetano TAMMARO Rianimazione Terapia Intensiva Ospedale MAGGIORE - Bologna A cosa serve l emogasanalisi? Esame rapido Valutare la ventilazione Valutare
Interpretazione dell emogasanalisi Guglielmo IMBRIACO Gaetano TAMMARO Rianimazione Terapia Intensiva Ospedale MAGGIORE - Bologna A cosa serve l emogasanalisi? Esame rapido Valutare la ventilazione Valutare
L EMOGASANALISI. P. Scavalli, M. Vitto, S. Mosillo
 L EMOGASANALISI P. Scavalli, M. Vitto, S. Mosillo EMOGASANALISI Consente la misurazione immediata dei due gas più importanti del sangue e di un terzo parametro fondamentale per la valutazione dell omeostasi
L EMOGASANALISI P. Scavalli, M. Vitto, S. Mosillo EMOGASANALISI Consente la misurazione immediata dei due gas più importanti del sangue e di un terzo parametro fondamentale per la valutazione dell omeostasi
Teoria di Lewis. Un acido di Lewis è una specie chimica che può formare un legame covalente accettando una coppia di elettroni da un altra specie.
 Teoria di Lewis Spiega perché alcune reazioni hanno proprietà acidobase pur non avendo idrogeni. Nella teoria di Lewis le reazioni acido-base hanno come protagonista la messa in condivisione di una coppia
Teoria di Lewis Spiega perché alcune reazioni hanno proprietà acidobase pur non avendo idrogeni. Nella teoria di Lewis le reazioni acido-base hanno come protagonista la messa in condivisione di una coppia
Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia
 Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia Obiettivi Produzione e bilancio degli idrogenioni Regolazione respiratoria e renale del ph Riassorbimento del bicarbonato e secrezione
Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia Obiettivi Produzione e bilancio degli idrogenioni Regolazione respiratoria e renale del ph Riassorbimento del bicarbonato e secrezione
Il Monossido di Di-Idrogeno
 Il Monossido di Di-Idrogeno Equilibri in Soluzione Acquosa In soluzione acquosa, per un equilibrio generico: + + La legge di azione di massa si scrive: = Si usano le concentrazioni molari dei soluti in
Il Monossido di Di-Idrogeno Equilibri in Soluzione Acquosa In soluzione acquosa, per un equilibrio generico: + + La legge di azione di massa si scrive: = Si usano le concentrazioni molari dei soluti in
ACIDI E BASI LA TEORIA DI ARRHENIUS
 ACIDI E BASI LA TEORIA DI ARRHENIUS Il chimico svedese Arrhenius nel 1887 diede la prima definizione di acido e base, basata sulla capacità di queste sostanze di condurre la corrente elettrica. Secondo
ACIDI E BASI LA TEORIA DI ARRHENIUS Il chimico svedese Arrhenius nel 1887 diede la prima definizione di acido e base, basata sulla capacità di queste sostanze di condurre la corrente elettrica. Secondo
Fisiologia Umana - 6 CFU Docente: Loriana Castellani PROGRAMMA
 Fisiologia Umana - 6 CFU Docente: Loriana Castellani PROGRAMMA Fisiologia cellulare: Membrana cellulare. Trasporto di ioni e molecole attraverso la membrana cellulare. Canali ionici, pompe e proteine vettrici.
Fisiologia Umana - 6 CFU Docente: Loriana Castellani PROGRAMMA Fisiologia cellulare: Membrana cellulare. Trasporto di ioni e molecole attraverso la membrana cellulare. Canali ionici, pompe e proteine vettrici.
SOLUZIONI TAMPONE SOLUZIONI TAMPONE
 SOLUZIONI TAMPONE Le soluzioni tampone (o tamponi) sono costituite da: un acido debole e un suo sale (tampone acido) oppure una base debole e un suo sale (tampone basico) Una soluzione di un acido debole
SOLUZIONI TAMPONE Le soluzioni tampone (o tamponi) sono costituite da: un acido debole e un suo sale (tampone acido) oppure una base debole e un suo sale (tampone basico) Una soluzione di un acido debole
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 17 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 17 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione
BIOCHIMICA BIOCHIMICA APPLICATA
 BIOCHIMICA BIOCHIMICA APPLICATA Corso di Laurea in Farmacia Prof. Ivano F. Santarelli Introduzione Testi consigliati -I principi di Biochimica di Lehninger. D.L.Nelson, M.M. Cox. Zanichelli -Biochimica
BIOCHIMICA BIOCHIMICA APPLICATA Corso di Laurea in Farmacia Prof. Ivano F. Santarelli Introduzione Testi consigliati -I principi di Biochimica di Lehninger. D.L.Nelson, M.M. Cox. Zanichelli -Biochimica
Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE
 Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE Molti sali reagiscono con l acqua alterando il suo rapporto molare tra [H] e [OH] -
Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE Molti sali reagiscono con l acqua alterando il suo rapporto molare tra [H] e [OH] -
La chimica della vita. Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012
 La chimica della vita 1 Tutta la materia è composta da elementi chimici È materia qualsiasi cosa, vivente e non vivente, che occupi dello spazio e che abbia una massa. La materia è composta da elementi
La chimica della vita 1 Tutta la materia è composta da elementi chimici È materia qualsiasi cosa, vivente e non vivente, che occupi dello spazio e che abbia una massa. La materia è composta da elementi
Acqua: nutriente essenziale
 Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
AUTOIONIZZAZIONE DELL ACQUA
 AUTOIONIZZAZIONE DELL ACQUA H 2 O si comporta da acido e da base anfiprotica CH 3 COOH + H 2 O CH 3 COO - + H 3 O + NH 3 +H 2 O NH 4 + + OH - A1 B2 H 2 O + H 2 O H 3 O + + OH - B1 A1 K eq [ H O ][ OH 3
AUTOIONIZZAZIONE DELL ACQUA H 2 O si comporta da acido e da base anfiprotica CH 3 COOH + H 2 O CH 3 COO - + H 3 O + NH 3 +H 2 O NH 4 + + OH - A1 B2 H 2 O + H 2 O H 3 O + + OH - B1 A1 K eq [ H O ][ OH 3
In base all equazione di Henderson-Hasselbalch
 Alterazioni dell equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Si ha acidosi quando il rapporto HCO 3 /CO 2 diminuisce, causando una diminuzione del ph.
Alterazioni dell equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Si ha acidosi quando il rapporto HCO 3 /CO 2 diminuisce, causando una diminuzione del ph.
SCUOLA DI FARMACIA E NUTRACEUTICA C.I. FISIOLOGIA UMANA E DELL ALIMENTAZIONE CORSO DI LAUREA MAGISTRALE IN FARMACIA A/A 2016/17. Prof.
 SCUOLA DI FARMACIA E NUTRACEUTICA C.I. FISIOLOGIA UMANA E DELL ALIMENTAZIONE CORSO DI LAUREA MAGISTRALE IN FARMACIA A/A 2016/17 Prof. Diego Russo Professore Ordinario del settore scientifico disciplinare
SCUOLA DI FARMACIA E NUTRACEUTICA C.I. FISIOLOGIA UMANA E DELL ALIMENTAZIONE CORSO DI LAUREA MAGISTRALE IN FARMACIA A/A 2016/17 Prof. Diego Russo Professore Ordinario del settore scientifico disciplinare
Controllo nervoso del respiro
 Controllo nervoso del respiro La respirazione è una funzione involontaria controllata da 3 gruppi di neuroni (centri) localizzati nel tronco encefalico: Controllo nervoso del respiro Centro respiratorio
Controllo nervoso del respiro La respirazione è una funzione involontaria controllata da 3 gruppi di neuroni (centri) localizzati nel tronco encefalico: Controllo nervoso del respiro Centro respiratorio
Equilibrio acido-base
 Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
SCOPI DELL EMOGASANALISI
 EMOGASANALISI SCOPI DELL EMOGASANALISI La funzione principale della respirazione è quella di assicurare ossigeno all organismo e di eliminare l eccesso di anidride carbonica. L emogasanalisi arteriosa
EMOGASANALISI SCOPI DELL EMOGASANALISI La funzione principale della respirazione è quella di assicurare ossigeno all organismo e di eliminare l eccesso di anidride carbonica. L emogasanalisi arteriosa
Qualità dell'acqua Pagina 1 di 5
 Qualità dell'acqua Pagina 1 di 5 DISTRETTO CISANO Alcalinità equivalente a bicarbonati (HCO3) 17/11/2016 120 mg/l - Ammoniaca (NH4) 17/11/2016 0,093 mg/l 0-0,5 Arsenico (As) 17/11/2016 0 µg/l 0-10 Calcio
Qualità dell'acqua Pagina 1 di 5 DISTRETTO CISANO Alcalinità equivalente a bicarbonati (HCO3) 17/11/2016 120 mg/l - Ammoniaca (NH4) 17/11/2016 0,093 mg/l 0-0,5 Arsenico (As) 17/11/2016 0 µg/l 0-10 Calcio
LEGGE di AZIONE di MASSA
 LEGGE di AZIONE di MASSA Lo stato di equilibrio di una reazione chimica è rappresentata dalla concentrazione di reagenti e prodotti tali da soddisfare una opportuna relazione matematica: a A + b B + c
LEGGE di AZIONE di MASSA Lo stato di equilibrio di una reazione chimica è rappresentata dalla concentrazione di reagenti e prodotti tali da soddisfare una opportuna relazione matematica: a A + b B + c
GLI ACIDI E LE BASI nel quotidiano L acido acetico: è presente nell aceto; L acido formico: a questo composto si deve il bruciore che si avverte dopo
 GLI ACIDI E LE BASI nel quotidiano L acido acetico: è presente nell aceto; L acido formico: a questo composto si deve il bruciore che si avverte dopo il morso di una formica; L acido citrico: è contenuto
GLI ACIDI E LE BASI nel quotidiano L acido acetico: è presente nell aceto; L acido formico: a questo composto si deve il bruciore che si avverte dopo il morso di una formica; L acido citrico: è contenuto
Qualità dell'acqua Pagina 1 di 7
 Qualità dell'acqua Pagina 1 di 7 DISTRETTO CECINA Alcalinità equivalente a bicarbonati (HCO3) 04/01/2017 152,5 mg/l - Ammoniaca (NH4) 04/01/2017 0,0935 mg/l 0-0,5 Calcio (Ca) 04/01/2017 56,35 mg/l - Cloro
Qualità dell'acqua Pagina 1 di 7 DISTRETTO CECINA Alcalinità equivalente a bicarbonati (HCO3) 04/01/2017 152,5 mg/l - Ammoniaca (NH4) 04/01/2017 0,0935 mg/l 0-0,5 Calcio (Ca) 04/01/2017 56,35 mg/l - Cloro
Emogasanalisi Arteriosa
 Emogasanalisi Arteriosa Dr. Francesco Ponzetta UO Anestesia Rianimazione NOCSAE Modena L'EGA è un analisi dei gas ematici su sangue arterioso, può essre effettuata in laboratorio ma anche, in maniera decentralizzata,
Emogasanalisi Arteriosa Dr. Francesco Ponzetta UO Anestesia Rianimazione NOCSAE Modena L'EGA è un analisi dei gas ematici su sangue arterioso, può essre effettuata in laboratorio ma anche, in maniera decentralizzata,
Qualità dell'acqua Pagina 1 di 5
 Qualità dell'acqua Pagina 1 di 5 DISTRETTO CASTELLETTO Alcalinità equivalente a bicarbonati (HCO3) 31/10/2016 384 mg/l - Ammoniaca (NH4) 31/10/2016 0,11 mg/l 0-0,5 Arsenico (As) 31/10/2016 0 µg/l 0-10
Qualità dell'acqua Pagina 1 di 5 DISTRETTO CASTELLETTO Alcalinità equivalente a bicarbonati (HCO3) 31/10/2016 384 mg/l - Ammoniaca (NH4) 31/10/2016 0,11 mg/l 0-0,5 Arsenico (As) 31/10/2016 0 µg/l 0-10
I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg
 LEZIONE RENE 6 I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg BL 4.2mM 150mM BILANCIO DEL POTASSIO 4 moli di K nei compartimenti liquidi Liquido intracellulare
LEZIONE RENE 6 I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg BL 4.2mM 150mM BILANCIO DEL POTASSIO 4 moli di K nei compartimenti liquidi Liquido intracellulare
Iniziativa realizzata con il contributo della Regione Toscana nell ambito del progetto. Rete Scuole LSS. a.s. 2016/2017
 Iniziativa realizzata con il contributo della Regione Toscana nell ambito del progetto Rete Scuole LSS a.s. 2016/2017 ph CHIMICA Classi IV A-B Liceo Linguistico Orbetello a.s. 2016 17 Docente: Carmelina
Iniziativa realizzata con il contributo della Regione Toscana nell ambito del progetto Rete Scuole LSS a.s. 2016/2017 ph CHIMICA Classi IV A-B Liceo Linguistico Orbetello a.s. 2016 17 Docente: Carmelina
Olimpiadi di Chimica
 Olimpiadi di Chimica Acqua Oro Zucchero Acidi e basi Una soluzione è una miscela omogenea di 2 o più sostanze Il soluto è(sono) la(le) sostanza(e) presente(i) in minore quantità Il solvente è la sostanza
Olimpiadi di Chimica Acqua Oro Zucchero Acidi e basi Una soluzione è una miscela omogenea di 2 o più sostanze Il soluto è(sono) la(le) sostanza(e) presente(i) in minore quantità Il solvente è la sostanza
Qualità dell'acqua Pagina 1 di 9
 Qualità dell'acqua Pagina 1 di 9 DISTRETTO DESENZANO CENT Alcalinità equivalente a bicarbonati (HCO3) 23/12/2016 148,5 mg/l - Ammoniaca (NH4) 23/12/2016 0,1275 mg/l 0-0,5 Arsenico (As) 23/12/2016 0,8125
Qualità dell'acqua Pagina 1 di 9 DISTRETTO DESENZANO CENT Alcalinità equivalente a bicarbonati (HCO3) 23/12/2016 148,5 mg/l - Ammoniaca (NH4) 23/12/2016 0,1275 mg/l 0-0,5 Arsenico (As) 23/12/2016 0,8125
INTRODUZIONE AL METABOLISMO
 INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
Qualità dell'acqua Pagina 1 di 9
 Qualità dell'acqua Pagina 1 di 9 DISTRETTO DESENZANO CENTRO Alcalinità equivalente a bicarbonati (HCO3) 22/06/2017 141,6 mg/l - Ammoniaca (NH4) 22/06/2017 0,147 mg/l 0-0,5 Arsenico (As) 22/06/2017 0,27
Qualità dell'acqua Pagina 1 di 9 DISTRETTO DESENZANO CENTRO Alcalinità equivalente a bicarbonati (HCO3) 22/06/2017 141,6 mg/l - Ammoniaca (NH4) 22/06/2017 0,147 mg/l 0-0,5 Arsenico (As) 22/06/2017 0,27
equilibrio acido base
 Alterazioni dell equilibrio equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [ ] [CO 2 ] Si ha acidosi quando, per diminuzione del rapporto /CO 2 il ph diminuisce. L acidosi
Alterazioni dell equilibrio equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [ ] [CO 2 ] Si ha acidosi quando, per diminuzione del rapporto /CO 2 il ph diminuisce. L acidosi
Acidi e basi sono sostanze note da molto tempo e diverse classificazioni sono state fatte nel corso del tempo in base alle loro proprietà.
 TEORIE ACIDO-BASE Acidi e basi sono sostanze note da molto tempo e diverse classificazioni sono state fatte nel corso del tempo in base alle loro proprietà. Teoria di Arrhenius Arrhenius fu il primo a
TEORIE ACIDO-BASE Acidi e basi sono sostanze note da molto tempo e diverse classificazioni sono state fatte nel corso del tempo in base alle loro proprietà. Teoria di Arrhenius Arrhenius fu il primo a
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
L APPARATO CIRCOLATORIO
 L APPARATO CIRCOLATORIO Il sangue Il sangue è un tessuto liquido connettivo (presenza di importante materia extracellulare), formato da una parte liquida, il plasma e una parte corpuscolare formata da
L APPARATO CIRCOLATORIO Il sangue Il sangue è un tessuto liquido connettivo (presenza di importante materia extracellulare), formato da una parte liquida, il plasma e una parte corpuscolare formata da
Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali:
 Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali: 1) Secerne Idrogenioni; 1a) Riassorbe il Bicarbonato Filtrato; 1b) Produce Nuovo Bicarbonato. 4320 meq/die
Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali: 1) Secerne Idrogenioni; 1a) Riassorbe il Bicarbonato Filtrato; 1b) Produce Nuovo Bicarbonato. 4320 meq/die
EMOGASANALISI ARTERIOSA INTERPRETAZIONE
 EMOGASANALISI ARTERIOSA INTERPRETAZIONE A cosa serve? Esame rapido Valutare la ventilazione Valutare il metabolismo Valutare parametri quali: Emoglobina Glicemia Elettroliti Interpretazione emogasanalisi
EMOGASANALISI ARTERIOSA INTERPRETAZIONE A cosa serve? Esame rapido Valutare la ventilazione Valutare il metabolismo Valutare parametri quali: Emoglobina Glicemia Elettroliti Interpretazione emogasanalisi
4ª UNITA DIDATTICA Modello Nutrizionale metabolico
 4ª UNITA DIDATTICA Modello Nutrizionale metabolico Contenuti Modello Nutrizionale metabolico Sezione del modello: Equilibrio idro-elettrolitico e acido-base Assistenza alla persona con problemi relativi
4ª UNITA DIDATTICA Modello Nutrizionale metabolico Contenuti Modello Nutrizionale metabolico Sezione del modello: Equilibrio idro-elettrolitico e acido-base Assistenza alla persona con problemi relativi
L apparato respiratorio. In movimento Marietti Scuola 2010 De Agostini Scuola S.p.A. Novara
 L apparato respiratorio Fasi della respirazione La ventilazione polmonare (o esterna) La diffusione Il trasporto dei gas La respirazione cellulare (o interna) Le vie aeree Le vie aeree I polmoni Il destro
L apparato respiratorio Fasi della respirazione La ventilazione polmonare (o esterna) La diffusione Il trasporto dei gas La respirazione cellulare (o interna) Le vie aeree Le vie aeree I polmoni Il destro
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione
![ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione](/thumbs/57/40353116.jpg) ESERCIZI 1) Il prodotto ionico dell acqua (K w ) vale 10-14 : a. a qualunque temperatura b. solo per una soluzione acida c. solo per una soluzione basica d. solo a T = 25 C 2) Per l acqua pura risulta
ESERCIZI 1) Il prodotto ionico dell acqua (K w ) vale 10-14 : a. a qualunque temperatura b. solo per una soluzione acida c. solo per una soluzione basica d. solo a T = 25 C 2) Per l acqua pura risulta
1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di
 Unità 19 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di soluzioni acide e
Unità 19 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di soluzioni acide e
Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O2 dagli alveoli al sangue e della
 Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O2 dagli alveoli al sangue e della CO2 in direzione opposta. R = quoziente respiratorio,
Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O2 dagli alveoli al sangue e della CO2 in direzione opposta. R = quoziente respiratorio,
INTERPRETAZIONE DELL EMOGASANALISI ACQUA ELETTROLITI ED EQUILIBRIO ACIDI-BASE
 INTERPRETAZIONE DELL EMOGASANALISI ACQUA ELETTROLITI ED EQUILIBRIO ACIDI-BASE Il prelievo arterioso può essere eseguito a livello di arteria femorale e arteria radiale (più doloroso) Il prelievo venoso
INTERPRETAZIONE DELL EMOGASANALISI ACQUA ELETTROLITI ED EQUILIBRIO ACIDI-BASE Il prelievo arterioso può essere eseguito a livello di arteria femorale e arteria radiale (più doloroso) Il prelievo venoso
Acidi e basi ph, costanti di acidità e basicità Idrolisi, soluzioni tampone
 Acidi e basi ph, costanti di acidità e basicità Idrolisi, soluzioni tampone Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental
Acidi e basi ph, costanti di acidità e basicità Idrolisi, soluzioni tampone Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental
Anatomia del sistema respiratorio
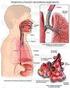 Funzioni del sistema respiratorio 1. Convogliare l aria muovendola verso le vie respiratorie e viceversa. 2. Proteggere le superfici di scambio da danni ambientali e disidratazione. 3. Riscaldare e umidificare
Funzioni del sistema respiratorio 1. Convogliare l aria muovendola verso le vie respiratorie e viceversa. 2. Proteggere le superfici di scambio da danni ambientali e disidratazione. 3. Riscaldare e umidificare
Biofisica e Fisiologia I semestre-ii anno 8 crediti. Elementi di Fisiologia e Biofisica Cellulare. Fisiologia dell apparato muscolare
 Biofisica e Fisiologia I semestre-ii anno 8 crediti Docenti: G. Irace I. Sirangelo http://dbb.unina2.it Obiettivi formativi Elementi di Fisiologia e Biofisica Cellulare Eccitabilità Fisiologia dell apparato
Biofisica e Fisiologia I semestre-ii anno 8 crediti Docenti: G. Irace I. Sirangelo http://dbb.unina2.it Obiettivi formativi Elementi di Fisiologia e Biofisica Cellulare Eccitabilità Fisiologia dell apparato
Anatomia del sistema respiratorio
 Funzioni del sistema respiratorio 1. Fornire una vasta area per lo scambio gassoso tra sangue e ambiente esterno (aria) per consentire ingresso di ossigeno ed eliminazione di anidride carbonica. 2. Convogliare
Funzioni del sistema respiratorio 1. Fornire una vasta area per lo scambio gassoso tra sangue e ambiente esterno (aria) per consentire ingresso di ossigeno ed eliminazione di anidride carbonica. 2. Convogliare
INTRODUZIONE. I farmaci antinfiammatori non steroidei (FANS) sono un gruppo. eterogeneo di composti, spesso chimicamente non correlati, che tuttavia
 INTRODUZIONE Fans e analgesia I farmaci antinfiammatori non steroidei (FANS) sono un gruppo eterogeneo di composti, spesso chimicamente non correlati, che tuttavia condividono alcune azioni terapeutiche
INTRODUZIONE Fans e analgesia I farmaci antinfiammatori non steroidei (FANS) sono un gruppo eterogeneo di composti, spesso chimicamente non correlati, che tuttavia condividono alcune azioni terapeutiche
NOZIONI DI ANATOMIA E FISIOLOGIA
 NOZIONI DI ANATOMIA E FISIOLOGIA SISTEMA RESPIRATORIO FUNZIONI: Rifornire l organismo di ossigeno Eliminare l anidride carbonica Mantenere il normale equilibrio acido-base del sangue Ventilare i polmoni
NOZIONI DI ANATOMIA E FISIOLOGIA SISTEMA RESPIRATORIO FUNZIONI: Rifornire l organismo di ossigeno Eliminare l anidride carbonica Mantenere il normale equilibrio acido-base del sangue Ventilare i polmoni
