SDD Seconde Proteine. Le proteine. Le funzioni delle proteine. Le proteine sono macromolecole
|
|
|
- Uberto Perri
- 8 anni fa
- Visualizzazioni
Transcript
1 1 Le proteine Entriamo nell'ultima parte del nostro viaggio nella chimica iniziato l'anno scorso e incontriamo finalmente le molecole della vita. Inizieremo ad analizzare la struttura e le funzioni delle proteine. Analizzando le proteine tuttavia inciamperemo in alcuni concetti di chimica che ancora non conosciamo. Per questo motivo il capitolo sarà lungo, ma per lo stesso motivo ogni considerazione teorica sarà agganciata ad aspetti importanti per la fisiologia del corpo umano. Le funzioni delle proteine Le proteine hanno molteplici applicazioni all'interno degli organismi Trasporto: pensa all'emoglobina che trasporta l'ossigeno nel sangue, oppure ricorda che sulla membrana cellulare vi sono delle proteine che hanno il compito di trasportare dentro fuori della cellula determinate sostanze tramite il trasporto attivo. Difesa: Gli anticorpi sono una classe di proteine. Movimento: Astina e miosina nei muscoli. Strutturale: Peli, unghie, penne, squame sono strutture proteiche. Riserva energetica: In certi casi anche le proteine vengono utilizzate per produrre energia. Catalitica: Le proteine aiutano i processi chimici e metabolici dell'organismo rendendoli più veloci. Le proteine sono macromolecole Le proteine sono costituenti essenziali di tutte le cellule; circa 1/5 del corpo umano è costituito di proteine, che sono distribuite nelle cellule di tutti i tessuti, ma sono presenti nella maggior parte nei muscoli. In tutti i processi biologici le proteine svolgono funzioni essenziali, fra cui assume particolare importanza quella catalitica; infatti, il maggior numero delle reazioni che si svolgono negli esseri viventi è catalizzato (reso più veloce) dagli enzimi che sono una classe particolare di proteine. A livello energetico, il metabolismo delle proteine soddisfa solo una minima parte del fabbisogno di un organismo (in un uomo adulto circa il 10-15%). Le proteine, infatti, vengono scisse nei singoli amminoacidi che hanno soprattutto il compito di costruire le proteine specifiche di cui il corpo ha bisogno, quali le proteine dei muscoli, dell'epidermide, dei peli, ecc. (biosintesi delle proteine). Tuttavia in alcuni casi, esse intervengono come combustibili: quando non sono richieste per la sintesi di nuove proteine, quando sono in eccesso rispetto alla quantità richiesta a questo scopo, durante il digiuno o quando, per altri motivi, L'organismo è carente di carboidrati o questi non vengono utilizzati propriamente. Il potere calorico medio delle proteine è di 17 KJ/g (4.1Kcal/g).
2 2 Gli amminoacidi Le proteine sono polimeri di amminoacidi (aa), la cui struttura generica è: Il radicale R differenzia un amminoacido da un altro. Gli amminoacidi che costituiscono le proteine sono 20, di cui 8 sono detti essenziali per l'uomo visto che devono essere assunti con il cibo poiché il nostro organismo non è in grado di sintetizzarli. In particolare trovate nelle immagini la rappresentazione di tutti gli amminoacidi. Si può notare come alcuni di questi hanno radicali apolari, altri invece sono polari se non addirittura ionici (a dipendenza del ph). Gli amminoacidi polari solitamente di trovano sulla superficie delle proteine mentre quelli apolari spesso si trovano all'interno delle proteine, senza essere a contatto con l'acqua. Ci sono poi alcuni amminoacidi particolari. La metionina è molto importante perché, come vedremo
3 3 più avanti, è il segnale di inizio di ogni nuova proteina: ogni proteina inizia quindi con una metionina. La prolina è l'unico amminoacido che differisce drasticamente, essendo ciclico. Questo amminoacido forma catene molto rigide ed è soprattutto presente nelle strutture proteiche di sostegno, cioè nella cartilagine, nei tendini, ecc. È l'amminoacido principale contenuto nel collagene. Infine la cisteina è anche molto importante perché é in grado di formare dei ponti disolfuro (vedrete più avanti). Legame peptidico Nelle proteine gli amminoacidi sono legati tra loro con un legame peptidico, che si stabiliscono tra il gruppo carbossilico (acido) di una molecola e il gruppo amminico (basico) di un'altra; la catena che così si forma è detta catena polipeptidica, chiamata anche peptide.la reazione di formazione dei peptidi è prevede che per ogni legame tra aa che si forma si libera una molecola di acqua.questa reazione è anche chiamata condensazione. A livello biologico la reazione di condensazione di aa per formare peptidi è controllata da enzimi. La reazione può anche essere facilmente invertita e dai peptidi l'organismo è in grado di smontare i singoli mattoni che possono essere riutilizzati per nuove e diverse strutture. Si può tranquillamente affermare che questa catena di montaggio e smontaggio lavori incessantemente. Le proteine possono avere svariate dimensioni a dipendenza del numero di amminoacidi che le formano; possono raggiungere gradi di complessità e masse molecolari elevatissime: un enzima del fegato bovino è formato da 8300 aa e la sua massa molecolare è di circa 1'000'000 uma. La struttura delle proteine può risultare molto complessa; infatti la catena polipeptidica si avvolge su sé stessa in maniera precisa. Per questo motivo si suddivide la struttura in quattro livelli di organizzazione.
4 4 Struttura primaria La struttura primaria esprime la sequenza degli aa. La sua conoscenza è fondamentale, anche perché è proprio la sequenza degli amminoacidi che determina poi i livelli superiori di organizzazione. La prima dimostrazione di una sequenza di aa fu eseguita su una proteina molto importante, l'insulina. Questa scoperta dimostrò che ogni proteina ha una sua sequenza specifica di aa, determinata geneticamente. Malattie gravissime sono collegate all'alterazione anche di un singolo aa nella sequenza del peptide; per esempio l'anemia falciforme è dovuta ad un difetto della molecola dell'emoglobina: in questo caso solo 2 aa sui 600 che formano l'emoglobina sono diversi da quelli "normali". Struttura secondaria Gli amminoacidi, una volta legatici tra loro secondo la specifica sequenza della proteina, non restano lineari ma si avvolgono generalmente ad elica alfa, oppure a strati beta. Entrambe queste strutture sono legate alla formazione di specifici ponti idrogeno. La funzione di una proteina è strettamente legata alla sua conformazione in 3D. Struttura terziaria Può succedere che le eliche e gli strati beta si aggreghino tra loro formando strutture più complesse e raggomitolate, ancorché molto precise e ben definite. Questo raggomitolamento si chiama struttura terziaria. Struttura quaternaria Se singole proteine con la propria struttura si aggregano tra loro formando una struttura ancora più complessa, questa viene chiamata struttura quaternaria. È il caso per esempio dell'emoglobina che è composta da 4 proteine (2 di un tipo e 2 di un altro tipo). Questa aggregarsi è anche fondamentale e vedremo più avanti il perché, parlando dell'attività degli enzimi.
5 5 Le forze che tengono unite le proteine Vi sarete forse posti la domanda: come mai i peptidi si ripiegano su sé stessi?. Ebbene la risposta già la conoscete. Tutte le forze che si osservano tra le molecole e che abbiamo precedentemente analizzato (capitolo 3) si ritrovano qui unite a collaborare affinché i peptidi assumano una forma ben precisa. Osservando le immagini potete vedere come all'interno della catena di aa, singoli aa si attirano tra loro per le diverse forze già incontrate. È proprio la combinazione di tutte le innumerevoli forze di attrazione tra i singoli aa che si trovano in punti anche molto distanti della catena a far si che questa si ripieghi con ordine su sé stessa. Osservando questo fatto potete anche capire la importanza del ph. se infatti il ph dell'acqua, nella quale si trova la nostra proteina, varia, può succedere che alcuni amminoacidi cambino la propria carica elettrica e la propria caratteristica morfologica; questa variazione spesso porta alla distruzione delle specifiche interazioni tra aa e quindi alla denaturazione della proteina. Una volta che una proteina perde il proprio ordine 3D, perde automaticamente anche la sua funzionalità. Spesso poi (lo vedremo più avanti), questo processo è irreversibile. Immaginate per esempio la denaturazione che avviene tramite l'azione del calore sulle proteine dell'albume dell'uovo. Una volta che è sodo, è sodo, non torna più "crudo". Ricordate anche come si produce il formaggio... e l'attività di laboratorio collegata. Si osservi la formazione del ponte disolfuro. Questa è una tipica reazione di ossidoriduzione, nella quale vengono scambiati degli elettroni. Per megli interpretare questo dato di fatto dobbiamo introdurre un nuovo paragrafo riguardante appunto le ossidoriduzioni e il modo con il quale i chimici conteggiano gli elettroni scambiati e cioè il numero di ossidazione.
6 6 Definizione di ossidoriduzione Fu il chimico francese Lavoisier ( ) a introdurre il concetto di ossidazione; con ciò egli voleva indicare una reazione di combinazione con l'ossigeno, ossia una combustione. Nel procedimento inverso, chiamato riduzione, venivano scritte tutte quelle operazioni nelle quali l'ossigeno veniva eliminato da un composto. Questi due concetti vennero poi estesi a tutti i processi di combustione; si riconobbe che essa non era altro che una rapida ossidazione di una sostanza combustibile con sviluppo di calore e luce. Un modo per rappresentare la combustione potrebbe essere: C + O > CO2 Siccome poi l'ossigeno è presente nell'atmosfera ed è alla portata di mano, era logico, una volta riconosciuto il ruolo essenziale che questo elemento giocava nelle combustioni, che le prime reazioni studiate e analizzate a fondo fossero proprio quelle nelle quali l'ossigeno vi partecipava, non solo con la sua azione specifica, ma con il suo nome; da qui la parola ossidazione. Anche se più tardi si riconobbe che le combustioni erano solo casi particolari di ossidazioni, questo nome non venne più modificato. Le ossido-riduzioni Possiamo collegare le reazioni la reazione di formazione di un sale tramite legame ionico alle reazioni di ossidoriduzione. Queste reazioni rivestono un'enorme importanza, non solo nel settore della chimica, ma anche in quello della biologia e della biochimica. Occorre ricordare che una buona parte delle reazioni chimiche che avvengono nell'organismo umano sono reazioni redox come, ad esempio, quelle che forniscono l'energia indispensabile al funzionamento delle cellule (respirazione). Il decorso delle reazioni redox può essere spiegato tramite un trasferimento di elettroni da certi atomi (o gruppi di atomi) ad altri (questo modo di esprimersi corrisponde a quanto viso nel caso del legame ionico. La perdita di elettroni è definita come ossidazione L'acquisto di elettroni è definito come riduzione Nel caso dei legami ionici è abbastanza facile capire quali sono gli atomi che si ossidano e quali sono quelli che si riducono. La cosa diventa decisamente più difficile quando si parla di ossidoriduzione tra i composti covalenti. Per fare questo bisogna il concetto di numero di ossidazione. Il numero di ossidazione viene assegnato supponendo che nella formazione di un composto alcuni atomi cedano elettroni e alcuni li prendano, e questo anche quando il legame che si stabilisce non è ionico ma covalente puro o polare. In questo caso il passaggio di elettroni (virtuale) avviene dall'atomo meno elettronegativo verso quello più elettronegativo. Quando nelle reazioni redox partecipano composti con legami covalenti, gli elettroni di legame vengono assegnati all'atomo più elettronegativo. Con questa scelta arbitraria tutti gli atomi ricevono delle cariche elettriche virtuali che definiscono il numero di ossidazione. Il numero di ossidazione corrisponde al numero reale o apparente di cariche elettriche positive o negative che possono essere attribuite ad un atomo in un composto, qualora tutti i legami presenti nella molecola in cui si trova, vengano considerati ionici. Nello molecola di acqua, per esempio, gli elettroni in comune devono essere completamente
7 7 assegnati all'ossigeno che possiede un'elettronegatività maggiore rispetto all'idrogeno. Procedendo in questo modo l'atomo di ossigeno riceve4 due elettroni in più rispetto a quando so trova nel suo stato naturale. Pertanto il N.O. dell'ossigeno è -II. Ogni singolo atomo di idrogeno che ha perso il suo elettrone assume il N.O. +I. Nella molecola di CO2 gli elettroni che formano il legame devono essere assegnati agli atomi di ossigeno che sono più elettronegativi rispetto all'atomo di carbonio. Visto che l'atomo di ossigeno allo stato naturale appartiene al sesto gruppo, riceve due elettroni ed il suo N.O. è -II. L'atomo di carbonio è del quarto gruppo e perde quattro elettroni che sono stati messi in comune. Il suo N.O. è +IV. Considerando questi primi due esempi si può dedurre che gli N.O. degli atomi nei composti ionici corrisponde alla carica elettrica realmente posseduta dagli ioni mentre è apparente in tutti gli altri casi (legame covalente apolare e legame covalente polare) poiché non corrisponde ad uno stato reale dell'atomo o del gruppo di atomi. Si tratta semplicemente di un artificio che permette di esprimere in modo semplice il complicato meccanismo delle reazioni di ossido riduzione. Regole generali per determinare il N.O. degli atomi nei composti Il N.O. viene indicato con una cifra romana preceduta dal segno di carica e va posto in alto a destra del simbolo chimico dell'atomo. Na +I, S -II. Il N.O. può essere positivo, negativo o nullo Il N.O. degli atomi allo stato libero, non combinato è zero. Infatti quando un atomo non è combinato, non acquista e non cede elettroni. Per alcuni elementi che allo stato naturale si presentano sotto forma di molecole il N.O. è pure zero. Fe 0, Cu 0, O 2 0, ecc. il N.O. dell'idrogeno, quando è combinato è sempre +I e il N.O. dell'ossigeno, quando è combinato è sempre -II (tranne rare eccezioni, per es nell'acqua ossigenata, dove c'è un legame O-O (-I)) Il N.O. di ciascun ione in un composto ionico coincide, come numero e segno, con la carica elettrica effettiva dello ione. Esempio: in NaCl sappiamo che il sodio è presente come ione Na+ de il cloro come Cl-, e per quanto riguarda gli N.O. possiamo indicare Na +I e Cl -I. Il N.O. di ciascun atomo in un composto covalente si determina tenendo conto dell'elettronegatività per cui, riassumendo, all'elemento più elettronegativo sarà attribuito il segno meno e rispettivamente il segno più andrà all'elemento meno elettronegativo. Esempi: vedi quanto detto nel paragrafo precedente. Nei composti chimici, in generale, la somma algebrica dei N.O. dei vari atomi che compongono il composto è pari alla carica totale del composto (e quindi solitamente pari a zero). Questa regola permette di calcolare il N.O. di molti elementi, deducendolo in funzione degli altri. Esempio: NaH 2 PO 4. Dalla regola 4 so che il N.O. dell'idrogeno è +I e quello dell'ossigeno -II. Dalla tavola periodica so che il sodio (Na) si trova nel primo gruppo ed origina lo ione Na+ quindi il suo N.O. (regola 5) è +I. Con la regola 7 trovo il N.O. del P: +I*2 (Na) + (+1I)*2 (H 2 ) + (-II)*4 (O 4 )= -V. Poiché la somma algebrica deve essere 0 allora il N.O. di P è +V. Gli enzimi Una classe fondamentale delle proteine è proprio quella degli enzimi. Gli enzimi sono responsabili
8 8 per il funzionamento di tutti i processi biologici. Rendono possibili reazioni chimiche che altrimenti necessiterebbero di temperature e condizioni non accettabili per un organismo vivente. Pensate per esempio che la combustione del glucosio nel nostro corpo avviene a temperatura fisiologica, mentre la reazione diretta, non mediata dagli enzimi, è una normalissima combustione con tanto di fiamma... Osserviamo un meccanismo catalizzato da un enzima. L'enzima sta al suo substrato (la o le sostanze che devono reagire tra loro) come la serratura sta alla chiave. Il substrato avendo la forma corretta (cariche corrette, dipoli corretti, VdW corretti, ecc) si inserisce nell'enzima. (tutta una serie di deboli forze di attrazione concorrono a far si che avvenga questo inserimento). Questo permette loro di reagire correttamente e in modo controllato, formando esattamente il prodotto desiderato. Dopo la reazione il prodotto si stacca dall'enzima. Il prodotto è stato modificato, mentre l'enzima è rimasto integro, ed è pronto per catalizzare una nuova reazione. Si osservi anche come gli enzimi hanno specificità non solo nella reazione chimica da loro catalizzata, ma anche nelle condizioni esterne nelle quali sono in grado di funzionare. Piccole variazioni di ph e di temperatura conducono inevitabilmente alla loro disattivazione. Per meglio interpretare questo fenomeno dobbiamo introdurre alcuni concetti teorici di chimica, e cioè la spontaneità e la velocità delle reazioni chimiche. Reazioni reversibili e irreversibili Non sempre si riesce ad individuare una reazione chimica, poiché non sempre sono percepibili le differenze tra le sostanze che si hanno prima e quelle che si ottengono dopo la reazione. Richiamando il concetto di reazione chimica vediamo di elencare quali caratteristiche si possono considerare normalmente per renderci conto che è avvenuta una reazione. Si ha reazione quando la struttura della materia cambia o, detto in un altro modo, i composti che ottieni dopo lo svolgimento della reazione non sono per niente uguali a quelli che avevi all'inizio, prima della reazione. Un primo parametro che si può prendere in considerazione per giustificare che è avvenuta una reazione chimica è il cambiamento di colore. Prendiamo una striscia di magnesio; essa presenta tutte le caratteristiche del metallo che conosci ed è di colore grigio. Bruciandolo otteniamo l'ossido di magnesio che è una polvere di colore bianco. Nella reazione si osserva anche uno sviluppo di energia termica e luminosa. Ricorda che tutte le combustioni sono delle reazioni.
9 9 Se noi facciamo friggere un uovo, l'albume, che all'inizio è trasparente, dopo la cottura diventa di colore bianco; segno che è avvenuta una reazione chimica e più precisamente le proteine dell'albume si sono denaturate. Generalizzando possiamo dire che i tipici sintomi che indicano l'avvenuta reazione sono Cambiamento di colore Sviluppo di gas Formazione di un precipitato Formazione di gas o di sostanze con odore caratteristico Sviluppo o assorbimento di energia La reversibilità delle reazioni Solitamente si parla di processi reversibili quando si considerano quelli fisici (fusione, ebollizione, ecc.); si tratta però, in questo caso, di cambiamenti di stato della materia e non di cambiamenti della sua struttura interna. La reversibilità esiste anche nei processi chimici? A questa domanda possiamo già rispondere in modo affermativo pensando per esempio alle soluzioni acquose contenenti un sale saturo oppure, nel campo acido base, pensando ad un acido debole o ad una base debole e al loro effetto tampone. I processi chimici possono essere suddivisi, associandoli alla reversibilità, in tre categorie. Le reazioni irreversibili Una reazione irreversibile per definizione è la combustione. Non è mai successo, considerando per esempio la combustione del legno, di vedere la cenere che fa una reazione chimica per ridare il pezzo di legno iniziale, liberando ossigeno. Occorre considerare quest'aspetto sotto due punti di vista; il primo problema è che parte dei composti che si sono formati durante la combustione di disperdono nell'ambiente (fumi), è quindi impossibile tornare indietro se alcuni composti formatisi vanno persi. Il secondo problema, quello più importante, è di tipo energetico. Possiamo rappresentare la combustione del legno, dal punto di vista dell'energia tramite il grafico seguente: L'energia di attivazione corrisponde a quella quantità di energia che occorre fornire all'inizio perché la reazione s'inneschi; quando si accende un fuoco solitamente può essere rappresentata dal fiammifero che si usa. In natura, nei periodi estivi, è il sole a fornire l'energia che, in certi casi, innesca l'autocombustione (fenomeno abbastanza frequente a certe latitudini che può causare gli incedi.
10 10 La differenza di energia tra stato iniziale e finale è così grande che diventa inimmaginabile la reazione inversa. La combustione è descritta di conseguenza, come reazione irreversibile. Reazioni irreversibili che in certi casi diventano reversibili Questo caso può anche essere visto come sottocaso del precedente. Partiamo da una reazione che si conosce bene sulla carta, la combustione dell'idrogeno La reazione inversa non si è mai vista (ce ne saremmo accorti giacché l'idrogeno è esplosivo). Essa può però avvenire in condizioni particolari, ossia fornendo un enorme quantità di energia (ciò è possibile con apparecchiature di laboratorio ma non avverrà mai in natura). Il grafico che ne risulta, dal punto di vista energetico, è il seguente: È possibile in laboratorio scomporre l'acqua nei suoi elementi costituenti; occorre fornire però una certa quantità di energia. Questi primi due casi che abbiamo considerato sono caratteristici per le reazioni esotermiche, ossia quelle che liberano energia quando avvengono. Di per sé, anche la reazione che abbiamo visto potrebbe essere reversibile ma solo a condizioni particolari, e, visto che in natura esse non si presentano, si può affermare che questa reazione è irreversibile. Il termine reazione reversibile è usato per le reazioni nelle quali è possibile tornare indietro. Un esempio tipico è la dissociazione di un acido debole, per esempio quello acetico. Sappiamo che un acido debole non si dissocia completamente, per cui in una bottiglia contenente aceto, per esempio, saranno presenti tutte le componenti indicati nella reazione. Se le due reazioni (quella di andata e quella di ritorno) avvengono con la stessa velocità si parla di equilibrio chimico. Dal punto di vista energetico si può rappresentare la reazione riportata sopra con il seguente grafico: Reazioni reversibili La velocità di reazione La difficoltà di individuare una reazione chimica è collegabile, certe volte, alla lentezza con cui essa
11 11 si svolge. La velocità di una reazione si misura in base alla quantità di sostanze che si trasformano. Tale misura però, riesce agevole solo nei casi in cui qualche proprietà cambia in modo evidente, come per esempio il colore, ed in un tempo relativamente breve. La velocità di reazione costituisce un aspetto di particolare rilevanza. Pensa a quello che finora sai della biologia per quanto concerne gli enzimi che intervengono nella scomposizione degli alimenti durante la digestione; oppure per esempio, quando siamo confrontati con una reazione particolarmente lenta: in questo caso ci possono essere dei problemi: in un'industria, ad esempio, un aumento dei tempi di lavorazione provoca un aumento dei costi di produzione e questo incide negativamente sul prezzo del prodotto finito. Allo stesso modo una reazione troppo veloce può risultare incontrollabile e se è istantanea come una combustione esplosiva, diventa certamente indesiderabile. Come estremi di velocità di reazione si possono considerare la formazione delle stalattiti e delle stalagmiti che è un caso di reazione chimica lentissima, mentre l'esplosione di fuochi di artificio è dovuta a reazioni velocissime. La velocità di una determinata reazione non è sempre uguale, ma varia in funzione di alcuni fattori: la superficie di contatto, i catalizzatori, la concentrazione dei reagenti e la temperatura. La superficie di contatto Per accendere il fuoco in un barbecue si utilizza la carbonella e on i pezzi grossi di carbone; se utilizzassimo polvere di carbone si avrebbe una combustione molto più vivace, addirittura esplosiva. La spiegazione va nella direzione seguente: maggiore è la suddivisione del carbone, maggiore è la superficie di contatto fra carbone e ossigeno, maggiore è la velocità di reazione. Pensando al nostro sistema digerente, abbiamo i denti che si occupano della masticazione, che a sua volta serve ad aumentare la superficie di contatto. Più il cibo viene ridotto in piccoli pezzetti, maggiore è la superficie di contatto tra l'alimento e la saliva, che contenendo ptialina inizia a scomporre gli amidi in zuccheri semplici. mangiare lentamente e masticare correttamente vuol dire allora aumentare la superficie di contatto tra cibo e ptialina, cosa che una masticazione affrettata non permette di fare. Il sale da cucina o lo zucchero sono venduti a granelli e non in blocchi interi poiché, in questo modo, la superficie di contatto è maggiore e di conseguenza si sciolgono più rapidamente. La concentrazione dei reagenti La concentrazione dei reagenti è un altro fattore direttamente collegato alla velocità di reazione. Se aumenta la quantità di uno dei reagenti, aumenta anche la velocità con la quale una reazione avviene. A questo proposito pensa a che cosa succede al fuoco quando c'è vento; la quantità di ossigeno è maggiore, la fiamma è più intensa e la legna brucia più velocemente. Le reazioni catalizzate da enzimi sono molto veloci; in genere si verificano circa un milione di volte più velocemente delle reazioni non catalizzate. Anche il ritmo con cui sono fabbricati i prodotti enzimatici dipende dal fatto che essi possono formarsi più velocemente quando è presente una maggiore quantità di substrato. Infatti un enzima e il suo substrato si uniscono per effetto di urti casuali; se sono presenti molecole di substrato in quantità maggiore, le probabilità di collisione aumenta. Alla fine potrebbe avvenire che tutte le molecole siano saturate dal substrato e perciò, se si aumenta ancora più la quantità di quest?ultimo senza aumentare la quantità di enzima, il ritmo di formazione del prodotto non aumenterà. Se invece la concentrazione del substrato è molto bassa la
12 12 velocità di formazione del prodotto sarà proporzionale alla quantità di substrato presente. La temperatura Un aumento della temperatura aumenta sempre il decorso di una reazione. Misure sperimentali hanno provato che se la temperatura aumenta di 10 C, la velocità di reazione raddoppia. Vi sono due fattori da indicare che spiegano questa osservazione empirica: se si aumenta la temperatura, aumenta l'energia cinetica delle molecole per cui vi saranno più scontri e gli urti efficaci aumentano (per poter reagire due molecole devono scontrarsi con un orientamento ben preciso e al momento in cui le due molecole si scontrano nel modo giusto, reagiscono formando i prodotti: si dice che l'urto è stato efficace). L'altro aspetto che occorre considerare è dato dal fatto che se la temperatura aumenta, aumenta anche l'energia con la quale le molecole si scontrano per cui gli urti, oltre che essere più frequenti, sono anche più violenti e si raggiunge più in fretta quella che abbiamo chiamato prima energia di attivazione. Ritornando a parlare di enzimi, possiamo aggiungere che l'aumento della temperatura accelera le reazioni chimiche, ma può anche intaccare il funzionamento degli enzimi. L'aumento di temperatura determina l'aumento dell'energia cinetica delle molecole di substrato e di enzima che si scontrano più frequentemente e più velocemente aumentando la probabilità di urti efficaci. Naturalmente c?è un limite alla quantità di calore che può essere immesso in un sistema; gli enzimi sono delle proteine ripiegate su se stesse con un preciso ordine e il calore altera il loro ordine interno (denaturazione). Per esempio se la temperatura corporea salisse al di sopra di 42 C i danni ai sistemi enzimatici sarebbero irreparabili e la morte interverrebbe rapidamente. Un ragionamento analogo è possibile per il surgelamento dei cibi. Temperature basse impediscono agli enzimi di lavorare e quindi il deperimento degli alimenti è molto più lento. Vvelocità di reazione ed equilibrio chimico A questo punto ci siamo fatti un'idea abbastanza chiara sul concetto espresso dalla velocità di reazione; in parole povere ci viene detto che se una reazione chimica avviene velocemente oppure no. In termini più precisi si potrebbe dire che rappresenta la variazione di concentrazione dei reagenti in funzione del tempo (velocità di distruzione dei reagenti), oppure la variazione di concentrazione dei prodotti in funzione del tempo (velocità di formazione dei prodotti). In conclusione possiamo richiamare il concetto di equilibrio chimico. In questo caso le due reazioni (andata e ritorno) avvengono esattamente con la stessa velocità. Possiamo notare come, modificando la temperatura, la concentrazione di uno dei reagenti, la superficie di contatto o aggiungendo un catalizzatore noi possiamo variare una delle due velocità e quindi spostare l'equilibrio creandone uno nuovo.
13 13 I catalizzatori I catalizzatori sono sostanze capaci di accelerare una reazione. Generalmente sono specifici, nel senso che il catalizzatore di un certo tipo di reazione non risulta efficace per un altro tipo; inoltre, ne sono sufficienti quantità molto ridotte, che si ritrovano tali e quali alla fine della reazione. Un catalizzatore non opera però miracoli, cioè non è in grado di far avvenire una reazione che per la natura stessa dei reagenti non può avvenire; il suo ruolo è quello di accelerare reazioni che altrimenti avverrebbero in un tempo molto più lungo. Considerando l'aspetto energetico di una reazione, l'enzima interviene secondo lo schema qui sotto illustrato: il catalizzatore non fa altro che abbassare l'energia di attivazione di una determinata reazione. In altre parole, se occorre meno energia per attivare la reazione vuol dire che tutto sommato ci vuole meno tempo per raggiungere le condizioni alle quali la reazione si innesca; di conseguenza avviene ad una temperatura più bassa e più velocemente. I catalizzatori più diffusi sono gli enzimi, caratteristici catalizzatori biologici, che dal punto di vista chimico sono proteine. Negli organismi migliaia di reazioni possono realizzarsi in condizioni compatibili con la vita grazie all'azione catalitica di queste proteine. L'azione degli enzimi è solitamente altamente specifica, nel senso che sono in grado di accelerare soltanto singole reazioni o gruppi di reazioni. Per esempio nella nostra saliva è contenuto un enzima, la ptialina, che trasforma l'amido (che trovi per esempio nel riso, nella pasta e nel pane) in maltosio. La ptialina è specifica per il polisaccaride amido, la cellulosa, un altro polisaccaride molto simile non viene intaccato dalla ptialina. Molte proteine prodotte nel nostro organismo (vedremo poi come), solitamente si ripiega in modo spontaneo nella sua forma corretta; in altre parole la sequenza di amminoacidi determina la struttura secondaria, terziaria ed eventualente quaternaria della proteina. Queste proteine sono allo stato nativo. Ciò significa che possono anche essere alterate in "maniera sintetica", ma una volta tolta la fonte di alterazione tornano alla loro forma originale, perfettamente funzionanti. Ripiegamento nativo e non-nativo delle proteine
14 14 Tuttavia le cose non sono sempre così semplici. Molte altre proteine vengono modificate dopo la loro preparazione biologica, e prima della loro messa in funzione. Osserviamo l'esempio dell'insulina. L'insulina viene dapprima preparata come proinsulina. Affinché la proinsulina si trasformi in insulina vera e propria l'organismo provvede a tagliarne letteralmente via un pezzettino. La proinsulina è una proteina nativa, si ripiega cioè spontaneamente nella forma corretta. L'insulina invece è una proteina non-nativa. Se venisse alterata chimicamente, e in un secondo tempo si rimuovesse la fonte di alterazione, non sarebbe più in grado di tornare ad essere ripiegata nella sua forma corretta e quindi funzionante. Per questo motivo la sua denaturazione è irreversibile.questo è uno dei meccanismi di funzionamento di farmaci e disinfettanti. Alterare in maniera irreversibile proteine non native significa sostanzialmente uccidere la cellula che le ha prodotte perché non sarebbe più in grado di far funzionare i suoi meccanismi enzimatici.
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI PROTEINE. sono ACIDI NUCLEICI. molecole complesse = POLIMERI. formate dall'unione di
 LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas
 1 Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas Capitolo 7 Enzimi, le macchine della vita Piccole macchine regolano la funzione del corpo umano in un orchestrazione perfetta e a velocità
1 Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas Capitolo 7 Enzimi, le macchine della vita Piccole macchine regolano la funzione del corpo umano in un orchestrazione perfetta e a velocità
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
CORRENTE E TENSIONE ELETTRICA LA CORRENTE ELETTRICA
 CORRENTE E TENSIONE ELETTRICA La conoscenza delle grandezze elettriche fondamentali (corrente e tensione) è indispensabile per definire lo stato di un circuito elettrico. LA CORRENTE ELETTRICA DEFINIZIONE:
CORRENTE E TENSIONE ELETTRICA La conoscenza delle grandezze elettriche fondamentali (corrente e tensione) è indispensabile per definire lo stato di un circuito elettrico. LA CORRENTE ELETTRICA DEFINIZIONE:
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
PROTEINE. sono COMPOSTI ORGANICI QUATERNARI
 PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
Siamo così arrivati all aritmetica modulare, ma anche a individuare alcuni aspetti di come funziona l aritmetica del calcolatore come vedremo.
 DALLE PESATE ALL ARITMETICA FINITA IN BASE 2 Si è trovato, partendo da un problema concreto, che con la base 2, utilizzando alcune potenze della base, operando con solo addizioni, posso ottenere tutti
DALLE PESATE ALL ARITMETICA FINITA IN BASE 2 Si è trovato, partendo da un problema concreto, che con la base 2, utilizzando alcune potenze della base, operando con solo addizioni, posso ottenere tutti
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B
 Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
APPUNTI DI MATEMATICA LE FRAZIONI ALGEBRICHE ALESSANDRO BOCCONI
 APPUNTI DI MATEMATICA LE FRAZIONI ALGEBRICHE ALESSANDRO BOCCONI Indice 1 Le frazioni algebriche 1.1 Il minimo comune multiplo e il Massimo Comun Divisore fra polinomi........ 1. Le frazioni algebriche....................................
APPUNTI DI MATEMATICA LE FRAZIONI ALGEBRICHE ALESSANDRO BOCCONI Indice 1 Le frazioni algebriche 1.1 Il minimo comune multiplo e il Massimo Comun Divisore fra polinomi........ 1. Le frazioni algebriche....................................
MPT Capitolo 12 Redox. Le ossidoriduzioni. Obiettivo. Definizioni di ossidazione e di riduzione
 1 Le ossidoriduzioni Obiettivo In questo capitolo svilupperemo i concetti fondamentali delle reazioni di ossido-riduzione. Si tratta di conoscenze fondamentali sia per la vita comune, sia, per molti di
1 Le ossidoriduzioni Obiettivo In questo capitolo svilupperemo i concetti fondamentali delle reazioni di ossido-riduzione. Si tratta di conoscenze fondamentali sia per la vita comune, sia, per molti di
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
9. Urti e conservazione della quantità di moto.
 9. Urti e conservazione della quantità di moto. 1 Conservazione dell impulso m1 v1 v2 m2 Prima Consideriamo due punti materiali di massa m 1 e m 2 che si muovono in una dimensione. Supponiamo che i due
9. Urti e conservazione della quantità di moto. 1 Conservazione dell impulso m1 v1 v2 m2 Prima Consideriamo due punti materiali di massa m 1 e m 2 che si muovono in una dimensione. Supponiamo che i due
Le Biomolecole I parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
BIOLOGIA GENERALE 22-24 ottobre 2007
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 22-24 ottobre 2007 Facoltà di Psicologia Tecniche di Psicologia Generale e Sperimentale Alessandro Massolo Dip.
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 22-24 ottobre 2007 Facoltà di Psicologia Tecniche di Psicologia Generale e Sperimentale Alessandro Massolo Dip.
352&(662',&20%867,21(
 352&(662',&20%867,21( Il calore utilizzato come fonte energetica convertibile in lavoro nella maggior parte dei casi, è prodotto dalla combustione di sostanze (es. carbone, metano, gasolio) chiamate combustibili.
352&(662',&20%867,21( Il calore utilizzato come fonte energetica convertibile in lavoro nella maggior parte dei casi, è prodotto dalla combustione di sostanze (es. carbone, metano, gasolio) chiamate combustibili.
LA TRASMISSIONE DELLE INFORMAZIONI QUARTA PARTE 1
 LA TRASMISSIONE DELLE INFORMAZIONI QUARTA PARTE 1 I CODICI 1 IL CODICE BCD 1 Somma in BCD 2 Sottrazione BCD 5 IL CODICE ECCESSO 3 20 La trasmissione delle informazioni Quarta Parte I codici Il codice BCD
LA TRASMISSIONE DELLE INFORMAZIONI QUARTA PARTE 1 I CODICI 1 IL CODICE BCD 1 Somma in BCD 2 Sottrazione BCD 5 IL CODICE ECCESSO 3 20 La trasmissione delle informazioni Quarta Parte I codici Il codice BCD
CALORE. Compie lavoro. Il calore è energia. Temperatura e calore. L energia è la capacità di un corpo di compiere un lavoro
 Cos è il calore? Per rispondere si osservino le seguenti immagini Temperatura e calore Il calore del termosifone fa girare una girandola Il calore del termosifone fa scoppiare un palloncino Il calore del
Cos è il calore? Per rispondere si osservino le seguenti immagini Temperatura e calore Il calore del termosifone fa girare una girandola Il calore del termosifone fa scoppiare un palloncino Il calore del
Le proteine. Le proteine sono i mattoncini che costituiscono gli organismi viventi.
 Le proteine Le proteine sono i mattoncini che costituiscono gli organismi viventi. Per avere un idea più precisa, basti pensare che tutti i muscoli del nostro corpo sono composti da filamenti di proteine
Le proteine Le proteine sono i mattoncini che costituiscono gli organismi viventi. Per avere un idea più precisa, basti pensare che tutti i muscoli del nostro corpo sono composti da filamenti di proteine
La candela accesa. Descrizione generale. Obiettivi. Sequenza didattica e metodo di lavoro. Esperimenti sulla crescita delle piante
 Esperimenti sulla crescita delle piante unità didattica 1 La candela accesa Durata 60 minuti Materiali per ciascun gruppo - 1 candela - 1 vaso di vetro - 1 cronometro - 1 cannuccia - fiammiferi - 1 pezzo
Esperimenti sulla crescita delle piante unità didattica 1 La candela accesa Durata 60 minuti Materiali per ciascun gruppo - 1 candela - 1 vaso di vetro - 1 cronometro - 1 cannuccia - fiammiferi - 1 pezzo
V= R*I. LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro.
 LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
4. Conoscere il proprio corpo
 4. Conoscere il proprio corpo Gli esseri viventi sono fatti di parti che funzionano assieme in modo diverso. Hanno parti diverse che fanno cose diverse. Il tuo corpo è fatto di molte parti diverse. Alcune
4. Conoscere il proprio corpo Gli esseri viventi sono fatti di parti che funzionano assieme in modo diverso. Hanno parti diverse che fanno cose diverse. Il tuo corpo è fatto di molte parti diverse. Alcune
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola.
 Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
La combustione. Docente: prof.ssa Lobello Carmela
 La combustione Percorso didattico realizzato dalla classe II D Istituto d Istruzione secondaria di I grado S Francesco d Assisi Francavilla Fontana (Br) Docente: prof.ssa Lobello Carmela Perché la combustione?
La combustione Percorso didattico realizzato dalla classe II D Istituto d Istruzione secondaria di I grado S Francesco d Assisi Francavilla Fontana (Br) Docente: prof.ssa Lobello Carmela Perché la combustione?
4 3 4 = 4 x 10 2 + 3 x 10 1 + 4 x 10 0 aaa 10 2 10 1 10 0
 Rappresentazione dei numeri I numeri che siamo abituati ad utilizzare sono espressi utilizzando il sistema di numerazione decimale, che si chiama così perché utilizza 0 cifre (0,,2,3,4,5,6,7,8,9). Si dice
Rappresentazione dei numeri I numeri che siamo abituati ad utilizzare sono espressi utilizzando il sistema di numerazione decimale, che si chiama così perché utilizza 0 cifre (0,,2,3,4,5,6,7,8,9). Si dice
Come visto precedentemente l equazione integro differenziale rappresentativa dell equilibrio elettrico di un circuito RLC è la seguente: 1 = (1)
 Transitori Analisi nel dominio del tempo Ricordiamo che si definisce transitorio il periodo di tempo che intercorre nel passaggio, di un sistema, da uno stato energetico ad un altro, non è comunque sempre
Transitori Analisi nel dominio del tempo Ricordiamo che si definisce transitorio il periodo di tempo che intercorre nel passaggio, di un sistema, da uno stato energetico ad un altro, non è comunque sempre
INTRODUZIONE I CICLI DI BORSA
 www.previsioniborsa.net 1 lezione METODO CICLICO INTRODUZIONE Questo metodo e praticamente un riassunto in breve di anni di esperienza e di studi sull Analisi Tecnica di borsa con specializzazione in particolare
www.previsioniborsa.net 1 lezione METODO CICLICO INTRODUZIONE Questo metodo e praticamente un riassunto in breve di anni di esperienza e di studi sull Analisi Tecnica di borsa con specializzazione in particolare
SISTEMI DI NUMERAZIONE E CODICI
 SISTEMI DI NUMERAZIONE E CODICI Il Sistema di Numerazione Decimale Il sistema decimale o sistema di numerazione a base dieci usa dieci cifre, dette cifre decimali, da O a 9. Il sistema decimale è un sistema
SISTEMI DI NUMERAZIONE E CODICI Il Sistema di Numerazione Decimale Il sistema decimale o sistema di numerazione a base dieci usa dieci cifre, dette cifre decimali, da O a 9. Il sistema decimale è un sistema
f(x) = 1 x. Il dominio di questa funzione è il sottoinsieme proprio di R dato da
 Data una funzione reale f di variabile reale x, definita su un sottoinsieme proprio D f di R (con questo voglio dire che il dominio di f è un sottoinsieme di R che non coincide con tutto R), ci si chiede
Data una funzione reale f di variabile reale x, definita su un sottoinsieme proprio D f di R (con questo voglio dire che il dominio di f è un sottoinsieme di R che non coincide con tutto R), ci si chiede
LA MATERIA Suggerimenti didattici e schede
 LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
La catalasi: un enzima in azione
 Percorso di Didattica laboratoriale La catalasi: un enzima in azione Scuola Secondaria di Secondo Grado IISS - IPSIA E. Majorana Bari Classe IV B Docente: Miralma Serio Organizzatore cognitivo: Le trasformazioni
Percorso di Didattica laboratoriale La catalasi: un enzima in azione Scuola Secondaria di Secondo Grado IISS - IPSIA E. Majorana Bari Classe IV B Docente: Miralma Serio Organizzatore cognitivo: Le trasformazioni
LA CORRENTE ELETTRICA
 L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
LA RISPOSTA ALL INSULINA NON E UGUALE PER TUTTI NOTA BENE: DOPO QUESTO ARTICOLO VI DARO IL MENU DI PAOLINO.
 LA RISPOSTA ALL INSULINA NON E UGUALE PER TUTTI NOTA BENE: DOPO QUESTO ARTICOLO VI DARO IL MENU DI PAOLINO.. MA SE AVRETE LETTO QUANTO SCRITTO FINORA, CAPIRETE ANCHE PERCHE PAOLINO MANGIA COSI. Ma soprattutto
LA RISPOSTA ALL INSULINA NON E UGUALE PER TUTTI NOTA BENE: DOPO QUESTO ARTICOLO VI DARO IL MENU DI PAOLINO.. MA SE AVRETE LETTO QUANTO SCRITTO FINORA, CAPIRETE ANCHE PERCHE PAOLINO MANGIA COSI. Ma soprattutto
Amplificatori Audio di Potenza
 Amplificatori Audio di Potenza Un amplificatore, semplificando al massimo, può essere visto come un oggetto in grado di aumentare il livello di un segnale. Ha quindi, generalmente, due porte: un ingresso
Amplificatori Audio di Potenza Un amplificatore, semplificando al massimo, può essere visto come un oggetto in grado di aumentare il livello di un segnale. Ha quindi, generalmente, due porte: un ingresso
Nascita e morte delle stelle
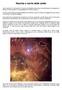 Nascita e morte delle stelle Se la materia che componeva l universo primordiale fosse stata tutta perfettamente omogenea e diffusa in modo uguale, non esisterebbero né stelle né pianeti. C erano invece
Nascita e morte delle stelle Se la materia che componeva l universo primordiale fosse stata tutta perfettamente omogenea e diffusa in modo uguale, non esisterebbero né stelle né pianeti. C erano invece
Progetto macchina con tetto fotovoltaico
 ITIS A.PACINOTTI Via Montaione 15 Progetto macchina con tetto fotovoltaico Classe 2 C Informatica Docente referente: Prof.ssa Leccesi Progetto: Educarsi al futuro Premessa Motivazione per la partecipazione
ITIS A.PACINOTTI Via Montaione 15 Progetto macchina con tetto fotovoltaico Classe 2 C Informatica Docente referente: Prof.ssa Leccesi Progetto: Educarsi al futuro Premessa Motivazione per la partecipazione
risulta (x) = 1 se x < 0.
 Questo file si pone come obiettivo quello di mostrarvi come lo studio di una funzione reale di una variabile reale, nella cui espressione compare un qualche valore assoluto, possa essere svolto senza necessariamente
Questo file si pone come obiettivo quello di mostrarvi come lo studio di una funzione reale di una variabile reale, nella cui espressione compare un qualche valore assoluto, possa essere svolto senza necessariamente
-assicurare il fabbisogno plastico necessario alla riparazione protezione e ricambio dei tessuti.
 Il principali compiti derivanti dall assunzione periodica di cibo sono: -assicurare il giusto fabbisogno energetico necessario alla vita ed all attività muscolare (tenendo conto che entrate ed uscite devono
Il principali compiti derivanti dall assunzione periodica di cibo sono: -assicurare il giusto fabbisogno energetico necessario alla vita ed all attività muscolare (tenendo conto che entrate ed uscite devono
Il bilanciamento delle reazioni chimiche
 1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
Dimensione di uno Spazio vettoriale
 Capitolo 4 Dimensione di uno Spazio vettoriale 4.1 Introduzione Dedichiamo questo capitolo ad un concetto fondamentale in algebra lineare: la dimensione di uno spazio vettoriale. Daremo una definizione
Capitolo 4 Dimensione di uno Spazio vettoriale 4.1 Introduzione Dedichiamo questo capitolo ad un concetto fondamentale in algebra lineare: la dimensione di uno spazio vettoriale. Daremo una definizione
Capitolo 13: L offerta dell impresa e il surplus del produttore
 Capitolo 13: L offerta dell impresa e il surplus del produttore 13.1: Introduzione L analisi dei due capitoli precedenti ha fornito tutti i concetti necessari per affrontare l argomento di questo capitolo:
Capitolo 13: L offerta dell impresa e il surplus del produttore 13.1: Introduzione L analisi dei due capitoli precedenti ha fornito tutti i concetti necessari per affrontare l argomento di questo capitolo:
SISTEMI ENERGETICI. L ATP privato di uno dei suoi 3 radicali fosforici diventa ADP (adenosindifosfato).
 SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
CONOSCERE IL PROPRIO CORPO
 CONOSCERE IL PROPRIO CORPO Gli esseri viventi sono fatti di parti che funzionano assieme in modo diverso. Hanno parti diverse che fanno cose diverse. Il tuo corpo è fatto di molte parti diverse. Alcune
CONOSCERE IL PROPRIO CORPO Gli esseri viventi sono fatti di parti che funzionano assieme in modo diverso. Hanno parti diverse che fanno cose diverse. Il tuo corpo è fatto di molte parti diverse. Alcune
Capitolo 1. Dimagrimento e calo ponderale
 Introduzione Numerosi anni di esperienza nel settore Fitness come Personal Trainer mi hanno consentito di assistere ai meravigliosi e strabilianti mutamenti fisici di centinaia di persone; le loro manifestazioni
Introduzione Numerosi anni di esperienza nel settore Fitness come Personal Trainer mi hanno consentito di assistere ai meravigliosi e strabilianti mutamenti fisici di centinaia di persone; le loro manifestazioni
Il modello generale di commercio internazionale
 Capitolo 6 Il modello generale di commercio internazionale [a.a. 2013/14] adattamento italiano di Novella Bottini (ulteriore adattamento di Giovanni Anania) 6-1 Struttura della presentazione Domanda e
Capitolo 6 Il modello generale di commercio internazionale [a.a. 2013/14] adattamento italiano di Novella Bottini (ulteriore adattamento di Giovanni Anania) 6-1 Struttura della presentazione Domanda e
Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica.
 Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
Termodinamica. Sistema termodinamico. Piano di Clapeyron. Sistema termodinamico. Esempio. Cosa è la termodinamica? TERMODINAMICA
 Termodinamica TERMODINAMICA Cosa è la termodinamica? La termodinamica studia la conversione del calore in lavoro meccanico Prof Crosetto Silvio 2 Prof Crosetto Silvio Il motore dell automobile trasforma
Termodinamica TERMODINAMICA Cosa è la termodinamica? La termodinamica studia la conversione del calore in lavoro meccanico Prof Crosetto Silvio 2 Prof Crosetto Silvio Il motore dell automobile trasforma
DIPARTIMENTO DI SCIENZE INTEGRATE CHIMICA FISICA SCIENZE DELLA TERRA - BIOLOGIA
 IISS A. De Pace Lecce A.S. 2012-2013 DIPARTIMENTO DI SCIENZE INTEGRATE FISICA SCIENZE DELLA TERRA - BIOLOGIA PIANI DI STUDIO DELLE DISCIPLINE SECONDO ANNO Piano di studi della disciplina DESCRIZIONE Lo
IISS A. De Pace Lecce A.S. 2012-2013 DIPARTIMENTO DI SCIENZE INTEGRATE FISICA SCIENZE DELLA TERRA - BIOLOGIA PIANI DI STUDIO DELLE DISCIPLINE SECONDO ANNO Piano di studi della disciplina DESCRIZIONE Lo
Statistica e biometria. D. Bertacchi. Variabili aleatorie. V.a. discrete e continue. La densità di una v.a. discreta. Esempi.
 Iniziamo con definizione (capiremo fra poco la sua utilità): DEFINIZIONE DI VARIABILE ALEATORIA Una variabile aleatoria (in breve v.a.) X è funzione che ha come dominio Ω e come codominio R. In formule:
Iniziamo con definizione (capiremo fra poco la sua utilità): DEFINIZIONE DI VARIABILE ALEATORIA Una variabile aleatoria (in breve v.a.) X è funzione che ha come dominio Ω e come codominio R. In formule:
A livello della loro struttura chimica, come i grassi, anche i carboidrati sono composti ternari, formati cioè da tre molecole:
 I carboidrati costituiscono la fonte di energia principale per lo svolgimento di tutte le funzioni organiche (mantenimento della temperatura corporea, battito cardiaco, funzioni cerebrali, digestione,
I carboidrati costituiscono la fonte di energia principale per lo svolgimento di tutte le funzioni organiche (mantenimento della temperatura corporea, battito cardiaco, funzioni cerebrali, digestione,
La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di
 La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di un solido (polvere) che diverrà il ceramico, con un
La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di un solido (polvere) che diverrà il ceramico, con un
MODELLI ATOMICI. Modello Atomico di Dalton
 MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
UNA LEZIONE SUI NUMERI PRIMI: NASCE LA RITABELLA
 UNA LEZIONE SUI NUMERI PRIMI: NASCE LA RITABELLA Tutti gli anni, affrontando l argomento della divisibilità, trovavo utile far lavorare gli alunni sul Crivello di Eratostene. Presentavo ai ragazzi una
UNA LEZIONE SUI NUMERI PRIMI: NASCE LA RITABELLA Tutti gli anni, affrontando l argomento della divisibilità, trovavo utile far lavorare gli alunni sul Crivello di Eratostene. Presentavo ai ragazzi una
Mangiamo perché abbiamo bisogno di energia, di materiali con cui costruire il nostro corpo, di materiali per riparare parti del nostro corpo, di
 Mangiamo perché abbiamo bisogno di energia, di materiali con cui costruire il nostro corpo, di materiali per riparare parti del nostro corpo, di materiali per fare funzionare il nostro corpo È il carboidrato
Mangiamo perché abbiamo bisogno di energia, di materiali con cui costruire il nostro corpo, di materiali per riparare parti del nostro corpo, di materiali per fare funzionare il nostro corpo È il carboidrato
1. Introduzione. 2. Simulazioni elettromagnetiche per la misura del SAR
 Relazione Tecnica Analisi simulative e misure con termocamera relative al confronto tra l utilizzo di un telefono smartphone in assenza e in presenza di dispositivo distanziatore EWAD Annamaria Cucinotta
Relazione Tecnica Analisi simulative e misure con termocamera relative al confronto tra l utilizzo di un telefono smartphone in assenza e in presenza di dispositivo distanziatore EWAD Annamaria Cucinotta
Appunti sulla Macchina di Turing. Macchina di Turing
 Macchina di Turing Una macchina di Turing è costituita dai seguenti elementi (vedi fig. 1): a) una unità di memoria, detta memoria esterna, consistente in un nastro illimitato in entrambi i sensi e suddiviso
Macchina di Turing Una macchina di Turing è costituita dai seguenti elementi (vedi fig. 1): a) una unità di memoria, detta memoria esterna, consistente in un nastro illimitato in entrambi i sensi e suddiviso
Determinare la grandezza della sottorete
 Determinare la grandezza della sottorete Ogni rete IP possiede due indirizzi non assegnabili direttamente agli host l indirizzo della rete a cui appartiene e l'indirizzo di broadcast. Quando si creano
Determinare la grandezza della sottorete Ogni rete IP possiede due indirizzi non assegnabili direttamente agli host l indirizzo della rete a cui appartiene e l'indirizzo di broadcast. Quando si creano
Corrispondenze e funzioni
 Corrispondenze e funzioni L attività fondamentale della mente umana consiste nello stabilire corrispondenze e relazioni tra oggetti; è anche per questo motivo che il concetto di corrispondenza è uno dei
Corrispondenze e funzioni L attività fondamentale della mente umana consiste nello stabilire corrispondenze e relazioni tra oggetti; è anche per questo motivo che il concetto di corrispondenza è uno dei
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
BIOLOGIA GENERALE. Alessandro Massolo Dip. Biologia Animale e Genetica c/o Prof. F. Dessì-Fulgheri (Via Romana 17) massolo@unifi.
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
Un po di statistica. Christian Ferrari. Laboratorio di Matematica
 Un po di statistica Christian Ferrari Laboratorio di Matematica 1 Introduzione La statistica è una parte della matematica applicata che si occupa della raccolta, dell analisi e dell interpretazione di
Un po di statistica Christian Ferrari Laboratorio di Matematica 1 Introduzione La statistica è una parte della matematica applicata che si occupa della raccolta, dell analisi e dell interpretazione di
Il concetto di valore medio in generale
 Il concetto di valore medio in generale Nella statistica descrittiva si distinguono solitamente due tipi di medie: - le medie analitiche, che soddisfano ad una condizione di invarianza e si calcolano tenendo
Il concetto di valore medio in generale Nella statistica descrittiva si distinguono solitamente due tipi di medie: - le medie analitiche, che soddisfano ad una condizione di invarianza e si calcolano tenendo
Testo alla base del Pitgame redatto dal prof. Yvan Lengwiler, Università di Basilea
 Testo alla base del Pitgame redatto dal prof. Yvan Lengwiler, Università di Basilea Funzionamento di un mercato ben organizzato Nel Pitgame i giocatori che hanno poche informazioni private interagiscono
Testo alla base del Pitgame redatto dal prof. Yvan Lengwiler, Università di Basilea Funzionamento di un mercato ben organizzato Nel Pitgame i giocatori che hanno poche informazioni private interagiscono
Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ]
![Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ] Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ]](/thumbs/34/16945364.jpg) La molecola d acqua è un dipolo perché l atomo di ossigeno è molto elettronegativo ed attira più vicini a sé gli elettroni di legame. Questo, unito alla forma della molecola, produce un accumulo di carica
La molecola d acqua è un dipolo perché l atomo di ossigeno è molto elettronegativo ed attira più vicini a sé gli elettroni di legame. Questo, unito alla forma della molecola, produce un accumulo di carica
Mais, riso, patate, granozucchero di canna o barbabietola Latte da zucchero Polisaccaride Amido - - Disaccaride Maltosio Saccarosio Lattosio
 Abbiamo visto che i carboidrati sono la principale fonte di energia nell'alimentazione umana. Nella nostra dieta, sono sopratutto presenti nella forma di amido, ma anche il saccarosio è presente in una
Abbiamo visto che i carboidrati sono la principale fonte di energia nell'alimentazione umana. Nella nostra dieta, sono sopratutto presenti nella forma di amido, ma anche il saccarosio è presente in una
Le proprietà periodiche degli elementi LA LEZIONE
 Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
PREVENZIONE INCENDI. Celsino Govoni
 PREVENZIONE INCENDI Celsino Govoni Che cos è un ESPLOSIONE? Cosa c era dentro a quell ambulatorio? Cosa è rimasto di quel centro medico posto in quel paesino!! La causa, a volte, è di piccole dimensioni
PREVENZIONE INCENDI Celsino Govoni Che cos è un ESPLOSIONE? Cosa c era dentro a quell ambulatorio? Cosa è rimasto di quel centro medico posto in quel paesino!! La causa, a volte, è di piccole dimensioni
Energia e Lavoro. In pratica, si determina la dipendenza dallo spazio invece che dal tempo
 Energia e Lavoro Finora abbiamo descritto il moto dei corpi (puntiformi) usando le leggi di Newton, tramite le forze; abbiamo scritto l equazione del moto, determinato spostamento e velocità in funzione
Energia e Lavoro Finora abbiamo descritto il moto dei corpi (puntiformi) usando le leggi di Newton, tramite le forze; abbiamo scritto l equazione del moto, determinato spostamento e velocità in funzione
CALCOLO COMBINATORIO
 CALCOLO COMBINATORIO 1 Modi di formare gruppi di k oggetti presi da n dati 11 disposizioni semplici, permutazioni Dati n oggetti distinti a 1,, a n si chiamano disposizioni semplici di questi oggetti,
CALCOLO COMBINATORIO 1 Modi di formare gruppi di k oggetti presi da n dati 11 disposizioni semplici, permutazioni Dati n oggetti distinti a 1,, a n si chiamano disposizioni semplici di questi oggetti,
Complemento al corso di Fondamenti di Informatica I corsi di laurea in ingegneria, settore dell informazione Università la Sapienza Consorzio Nettuno
 Rappresentazione di numeri Complemento al corso di Fondamenti di Informatica I corsi di laurea in ingegneria, settore dell informazione Università la Sapienza Consorzio Nettuno Un numero e un entità teorica,
Rappresentazione di numeri Complemento al corso di Fondamenti di Informatica I corsi di laurea in ingegneria, settore dell informazione Università la Sapienza Consorzio Nettuno Un numero e un entità teorica,
CO 2 aq l anidride carbonica disciolta, reagendo con l'acqua, forma acido carbonico secondo la reazione:
 DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
Gli organismi viventi
 Gli organismi viventi Gli organismi viventi Quali caratteristiche contraddistinguono i viventi? È facile distinguere un organismo vivente da un oggetto non vivente? Gli organismi viventi Tutti gli organismi
Gli organismi viventi Gli organismi viventi Quali caratteristiche contraddistinguono i viventi? È facile distinguere un organismo vivente da un oggetto non vivente? Gli organismi viventi Tutti gli organismi
ESEMPIO 1: eseguire il complemento a 10 di 765
 COMPLEMENTO A 10 DI UN NUMERO DECIMALE Sia dato un numero N 10 in base 10 di n cifre. Il complemento a 10 di tale numero (N ) si ottiene sottraendo il numero stesso a 10 n. ESEMPIO 1: eseguire il complemento
COMPLEMENTO A 10 DI UN NUMERO DECIMALE Sia dato un numero N 10 in base 10 di n cifre. Il complemento a 10 di tale numero (N ) si ottiene sottraendo il numero stesso a 10 n. ESEMPIO 1: eseguire il complemento
Dissociazione elettrolitica
 Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
INTEGRATORE E DERIVATORE REALI
 INTEGRATORE E DERIVATORE REALI -Schemi elettrici: Integratore reale : C1 R2 vi (t) R1 vu (t) Derivatore reale : R2 vi (t) R1 C1 vu (t) Elenco componenti utilizzati : - 1 resistenza da 3,3kΩ - 1 resistenza
INTEGRATORE E DERIVATORE REALI -Schemi elettrici: Integratore reale : C1 R2 vi (t) R1 vu (t) Derivatore reale : R2 vi (t) R1 C1 vu (t) Elenco componenti utilizzati : - 1 resistenza da 3,3kΩ - 1 resistenza
RICHIAMI DI TERMOCHIMICA
 CAPITOLO 5 RICHIAMI DI TERMOCHIMICA ARIA TEORICA DI COMBUSTIONE Una reazione di combustione risulta completa se il combustibile ha ossigeno sufficiente per ossidarsi completamente. Si ha combustione completa
CAPITOLO 5 RICHIAMI DI TERMOCHIMICA ARIA TEORICA DI COMBUSTIONE Una reazione di combustione risulta completa se il combustibile ha ossigeno sufficiente per ossidarsi completamente. Si ha combustione completa
Analisi e diagramma di Pareto
 Analisi e diagramma di Pareto L'analisi di Pareto è una metodologia statistica utilizzata per individuare i problemi più rilevanti nella situazione in esame e quindi le priorità di intervento. L'obiettivo
Analisi e diagramma di Pareto L'analisi di Pareto è una metodologia statistica utilizzata per individuare i problemi più rilevanti nella situazione in esame e quindi le priorità di intervento. L'obiettivo
Capitolo 2. Operazione di limite
 Capitolo 2 Operazione di ite In questo capitolo vogliamo occuparci dell operazione di ite, strumento indispensabile per scoprire molte proprietà delle funzioni. D ora in avanti riguarderemo i domini A
Capitolo 2 Operazione di ite In questo capitolo vogliamo occuparci dell operazione di ite, strumento indispensabile per scoprire molte proprietà delle funzioni. D ora in avanti riguarderemo i domini A
Excel. A cura di Luigi Labonia. e-mail: luigi.lab@libero.it
 Excel A cura di Luigi Labonia e-mail: luigi.lab@libero.it Introduzione Un foglio elettronico è un applicazione comunemente usata per bilanci, previsioni ed altri compiti tipici del campo amministrativo
Excel A cura di Luigi Labonia e-mail: luigi.lab@libero.it Introduzione Un foglio elettronico è un applicazione comunemente usata per bilanci, previsioni ed altri compiti tipici del campo amministrativo
IDROGENO IN PRATICA. del gruppo degli allievi del Volta. Laboratorio di chimica I.T. I. Volta
 IDROGENO IN PRATICA Pratiche di laboratorio su iniziative del gruppo degli allievi del Volta Laboratorio di chimica I.T. I. Volta da: L Isola Misteriosa Giulio Verne 1874 Senza il carbone non ci sarebbero
IDROGENO IN PRATICA Pratiche di laboratorio su iniziative del gruppo degli allievi del Volta Laboratorio di chimica I.T. I. Volta da: L Isola Misteriosa Giulio Verne 1874 Senza il carbone non ci sarebbero
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero Il numero atomico, il numero di massa e gli isotopi numero atomico (Z) = numero di protoni nel nucleo numero di massa (A) = numero di protoni + numero
La Vita è una Reazione Chimica Acqua Oro Zucchero Il numero atomico, il numero di massa e gli isotopi numero atomico (Z) = numero di protoni nel nucleo numero di massa (A) = numero di protoni + numero
LA CORRENTE ELETTRICA CONTINUA
 LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
Termodinamica: legge zero e temperatura
 Termodinamica: legge zero e temperatura Affrontiamo ora lo studio della termodinamica che prende in esame l analisi dell energia termica dei sistemi e di come tale energia possa essere scambiata, assorbita
Termodinamica: legge zero e temperatura Affrontiamo ora lo studio della termodinamica che prende in esame l analisi dell energia termica dei sistemi e di come tale energia possa essere scambiata, assorbita
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it
 LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
La fotosintesi: energia dal Sole
 La fotosintesi: energia dal Sole Gli organismi fotosintetici usano la luce del Sole, l acqua del suolo e il CO 2 dell atmosfera per produrre composti organici e liberare O 2 grazie alla fotosintesi. Sadava
La fotosintesi: energia dal Sole Gli organismi fotosintetici usano la luce del Sole, l acqua del suolo e il CO 2 dell atmosfera per produrre composti organici e liberare O 2 grazie alla fotosintesi. Sadava
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti.
 Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
La preparazione per le gare brevi
 I documenti di www.mistermanager.it La preparazione per le gare brevi La maggior parte delle competizioni su cui si cimentano i podisti, sono le gare su strada, le cui lunghezze solitamente sono intorno
I documenti di www.mistermanager.it La preparazione per le gare brevi La maggior parte delle competizioni su cui si cimentano i podisti, sono le gare su strada, le cui lunghezze solitamente sono intorno
Matematica generale CTF
 Successioni numeriche 19 agosto 2015 Definizione di successione Monotonìa e limitatezza Forme indeterminate Successioni infinitesime Comportamento asintotico Criterio del rapporto per le successioni Definizione
Successioni numeriche 19 agosto 2015 Definizione di successione Monotonìa e limitatezza Forme indeterminate Successioni infinitesime Comportamento asintotico Criterio del rapporto per le successioni Definizione
Elettroforesi. Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita.
 Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY
 DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
QUESTIONARIO DI GRADIMENTO
 QUESTIONARIO DI GRADIMENTO Il BRUCO Asilo Nido e Scuola d Infanzia Via Case Basse San Vittore, 24 Pavia www.asiloilbruco.com Tel. 0382.1726.241 Tel. 393.900.6211 Cari Genitori, il questionario è stato
QUESTIONARIO DI GRADIMENTO Il BRUCO Asilo Nido e Scuola d Infanzia Via Case Basse San Vittore, 24 Pavia www.asiloilbruco.com Tel. 0382.1726.241 Tel. 393.900.6211 Cari Genitori, il questionario è stato
Inizia presentazione
 Inizia presentazione Che si misura in ampère può essere generata In simboli A da pile dal movimento di spire conduttrici all interno di campi magnetici come per esempio nelle dinamo e negli alternatori
Inizia presentazione Che si misura in ampère può essere generata In simboli A da pile dal movimento di spire conduttrici all interno di campi magnetici come per esempio nelle dinamo e negli alternatori
ALIMENTAZIONE NELL UOMO
 ALIMENTAZIONE NELL UOMO Alimentazione e Nutrizione Corpo umano come macchina chimica che utilizza l energia chimica degli alimenti (quando si spezzano i legami chimici tra gli atomi che formano le macromolecole
ALIMENTAZIONE NELL UOMO Alimentazione e Nutrizione Corpo umano come macchina chimica che utilizza l energia chimica degli alimenti (quando si spezzano i legami chimici tra gli atomi che formano le macromolecole
Circuiti amplificatori
 Circuiti amplificatori G. Traversi Strumentazione e Misure Elettroniche Corso Integrato di Elettrotecnica e Strumentazione e Misure Elettroniche 1 Amplificatori 2 Amplificatori Se A V è negativo, l amplificatore
Circuiti amplificatori G. Traversi Strumentazione e Misure Elettroniche Corso Integrato di Elettrotecnica e Strumentazione e Misure Elettroniche 1 Amplificatori 2 Amplificatori Se A V è negativo, l amplificatore
Dispense di Informatica per l ITG Valadier
 La notazione binaria Dispense di Informatica per l ITG Valadier Le informazioni dentro il computer All interno di un calcolatore tutte le informazioni sono memorizzate sottoforma di lunghe sequenze di
La notazione binaria Dispense di Informatica per l ITG Valadier Le informazioni dentro il computer All interno di un calcolatore tutte le informazioni sono memorizzate sottoforma di lunghe sequenze di
I CIRCUITI ELETTRICI. Prima di tutto occorre mettersi d accordo anche sui nomi di alcune parti dei circuiti stessi.
 I CIRCUITI ELETTRICI Prima di tutto occorre mettersi d accordo anche sui nomi di alcune parti dei circuiti stessi. Definiamo ramo un tratto di circuito senza diramazioni (tratto evidenziato in rosso nella
I CIRCUITI ELETTRICI Prima di tutto occorre mettersi d accordo anche sui nomi di alcune parti dei circuiti stessi. Definiamo ramo un tratto di circuito senza diramazioni (tratto evidenziato in rosso nella
