*Prodotta in cellule ovariche di criceto cinese (CHO) attraverso la tecnica del DNA ricombinante.
|
|
|
- Marisa Bonfanti
- 8 anni fa
- Visualizzazioni
Transcript
1 1. DENOMINAZIONE DEL MEDICINALE NeoRecormon UI soluzione iniettabile in siringa preriempita 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una siringa preriempita con 0,6 ml di soluzione iniettabile contiene unità internazionali (UI) corrispondenti a 250 microgrammi di epoetina beta* (eritropoietina umana ricombinante). Un ml di soluzione iniettabile contiene UI di epoetina beta. *Prodotta in cellule ovariche di criceto cinese (CHO) attraverso la tecnica del DNA ricombinante. Eccipienti con effetti noti: Fenilalanina (fino a 0,3 mg per siringa) Sodio (meno di 1 mmol per siringa) Per l elenco completo degli eccipienti, vedere paragrafo FORMA FARMACEUTICA Soluzione iniettabile. Soluzione incolore, da chiara a lievemente opalescente. 4. INFORMAZIONI CLINICHE 4.1 Indicazioni terapeutiche NeoRecormon è indicato per: - trattamento dell anemia sintomatica associata ad insufficienza renale cronica in pazienti adulti e pediatrici. - prevenzione dell anemia dei neonati prematuri con un peso alla nascita compreso tra 750 e 1500 g e con un periodo di gestazione inferiore a 34 settimane. - trattamento dell anemia sintomatica in pazienti adulti con tumore non mieloide sottoposti a chemioterapia. - incrementare la quantità di sangue autologo in pazienti facenti parte di un programma di predonazione. Il suo uso in questa indicazione deve essere valutato in rapporto all aumentato rischio di eventi tromboembolici. Il trattamento deve essere riservato solo a pazienti con anemia di grado moderato (emoglobina g/dl [6,21-8,07 mmol/l], in assenza di carenza di ferro) se le procedure di conservazione non sono disponibili o sono insufficienti quando l intervento elettivo di chirurgia maggiore richiede un notevole volume di sangue (4 o più unità di sangue per le donne o 5 o più unità per gli uomini). Vedere paragrafo Posologia e modo di somministrazione La terapia con NeoRecormon deve essere iniziata da medici esperti nelle sopracitate indicazioni. Essendo state segnalate in casi isolati reazioni anafilattoidi, si raccomanda di somministrare la prima dose sotto il controllo del medico. Posologia Trattamento dell anemia sintomatica in pazienti adulti e pediatrici con insufficienza renale cronica: Sintomi e sequele dell anemia possono variare in funzione dell'età, del sesso e del carico complessivo della malattia; è necessario che il decorso clinico e le condizioni del singolo paziente siano valutati dal medico. NeoRecormon deve essere somministrato per via sottocutanea o endovenosa per aumentare l emoglobina fino a un livello non superiore a 12 g/dl (7,5 mmol/l). La via sottocutanea è da preferirsi in pazienti non
2 sottoposti a emodialisi per evitare punture alle vene periferiche. In caso di somministrazione endovenosa, la soluzione deve essere iniettata in circa 2 minuti, nei pazienti emodializzati attraverso la fistola arterovenosa alla fine della dialisi. In considerazione della variabilità intrapaziente, possono essere occasionalmente rilevati, in un paziente, singoli valori di emoglobina superiori e inferiori al livello di emoglobina desiderato. La variabilità dell emoglobina deve essere gestita attraverso l aggiustamento della dose, in riferimento ad un intervallo target di emoglobina tra 10 g/dl (6,2 mmol/l) e 12 g/dl (7,5 mmol/l). Si deve evitare un livello prolungato di emoglobina superiore a 12 g/dl (7,5 mmol/l); le indicazioni per una appropriata correzione del dosaggio per quando vengono osservati valori di emoglobina superiori a 12 g/dl (7,5 mmol/l) sono riportate di seguito. Si deve evitare un incremento dell emoglobina maggiore di 2 g/dl (1,25 mmol/l) nell arco di quattro settimane. Se ciò si verifica, si deve procedere ad una appropriata correzione del dosaggio, come indicato. Se l entità dell aumento dell emoglobina è superiore a 2 g/dl (1,25 mmol/l) in un mese o se il livello di emoglobina aumenta e si avvicina a 12 g/dl (7,45 mmol/l), la dose deve essere ridotta del 25% circa. Se il livello di emoglobina continua a crescere, si deve interrompere la terapia fino a quando il livello di emoglobina comincia a diminuire, punto al quale la terapia deve essere ricominciata a una dose inferiore del 25% circa rispetto a quella somministrata in precedenza. I pazienti devono essere monitorati attentamente per garantire che venga utilizzata la più bassa dose efficace autorizzata di NeoRecormon per controllare adeguatamente i sintomi dell anemia mantenendo una concentrazione di emoglobina inferiore o uguale a 12g / dl (7.45mmol / l). Si deve usare cautela nell incremento delle dosi di NeoRecormon in pazienti con insufficienza renale cronica. Nei pazienti con una scarsa risposta emoglobinica a NeoRecormon devono essere prese in considerazione spiegazioni alternative per tale scarsa risposta (vedere paragrafi 4.4 e 5.1). In presenza di ipertensione o di patologie cardiovascolari, cerebrovascolari o vascolari periferiche, l incremento settimanale di Hb e il valore massimo di Hb da raggiungere devono essere determinati su base individuale, considerando il quadro clinico. Il trattamento con NeoRecormon è diviso in due fasi: 1. Fase di correzione - Somministrazione sottocutanea: Il dosaggio iniziale è di 3 x 20 UI/kg di peso corporeo alla settimana. Se l aumento di Hb non fosse adeguato (< 0,25 g/dl/settimana), il dosaggio può essere aumentato ogni 4 settimane di 3 x 20 UI/kg alla settimana. Il dosaggio settimanale può essere ripartito in somministrazioni giornaliere. - Somministrazione endovenosa: Il dosaggio iniziale è di 3 x 40 UI/kg alla settimana. Il dosaggio può essere aumentato, dopo 4 settimane, a 80 UI/kg - tre volte alla settimana - e con ulteriori incrementi di 20 UI/kg, se necessario, tre volte alla settimana, ad intervalli mensili. Per entrambe le vie di somministrazione, non si deve superare la dose massima di 720 UI/kg alla settimana. 2. Fase di mantenimento Per mantenere il livello dell Hb entro un range compreso tra 10 e 12 g/dl, la dose è inizialmente ridotta alla metà di quella precedentemente somministrata. Successivamente, la dose viene adattata su base individuale per paziente (dose di mantenimento) ad intervalli di una o due settimane. In caso di somministrazione sottocutanea, la dose totale settimanale può essere somministrata con un'unica iniezione settimanale o può essere divisa in tre o sette dosi settimanali. Pazienti stabili con un regime di singola somministrazione settimanale possono passare ad una somministrazione ogni due settimane. In tal caso potrebbe essere necessario incrementare la dose.
3 I risultati emersi dagli studi clinici in bambini hanno dimostrato che, mediamente, più giovani sono i pazienti, più elevate sono le dosi di NeoRecormon necessarie. Tuttavia ci si deve attenere allo schema posologico raccomandato, in quanto la risposta individuale non può essere prevista. Il trattamento con NeoRecormon è di norma a lungo termine. Tuttavia, qualora fosse necessario, può essere interrotto in ogni momento. I dati relativi allo schema posologico una volta alla settimana si basano su studi clinici della durata di 24 settimane di terapia. Prevenzione dell anemia del prematuro: La soluzione viene somministrata per via sottocutanea ad una dose di 3 x 250 UI/kg di peso corporeo alla settimana. I bambini prematuri che, all inizio del trattamento con NeoRecormon, abbiano già ricevuto trasfusioni, rispondono meno alla terapia rispetto ai bambini non trasfusi. La durata del trattamento raccomandata è di 6 settimane. Trattamento dell anemia sintomatica indotta da chemioterapia in pazienti con tumori: NeoRecormon deve essere somministrato per via sottocutanea in pazienti anemici (ad es. con concentrazione di emoglobina 10 g/dl (6,2 mmol/l)). Sintomi e sequele dell anemia possono variare in funzione dell età, del sesso e del carico complessivo della malattia; è necessario che il decorso clinico e le condizioni del singolo paziente siano valutati dal medico. La dose settimanale può essere fornita attraverso una unica somministrazione settimanale oppure attraverso 3-7 iniezioni settimanali. La dose iniziale raccomandata è di UI alla settimana (pari a circa 450 UI/kg di peso corporeo alla settimana, in base al peso corporeo del paziente). In considerazione della variabilità intrapaziente, possono essere occasionalmente rilevati, in un paziente, singoli valori di emoglobina superiori e inferiori al livello di emoglobina desiderato. La variabilità dell emoglobina deve essere gestita attraverso l aggiustamento della dose, in riferimento ad un intervallo target di emoglobina tra 10 g/dl (6,2 mmol/l) e 12 g/dl (7,5 mmol/l). Si deve evitare un livello prolungato di emoglobina superiore a 12 g/dl (7,5 mmol/l); le indicazioni per una appropriata correzione del dosaggio per quando vengono osservati valori di emoglobina superiori a 12 g/dl (7,5 mmol/l) sono riportate di seguito. Se, dopo 4 settimane di terapia, il valore emoglobinico è aumentato di almeno 1 g/dl (0,62 mmol/l), deve essere mantenuta la dose corrente. Se il valore emoglobinico non è aumentato di almeno 1 g/dl (0,62 mmol/l), si può considerare il raddoppio della dose settimanale. Se, dopo 8 settimane di terapia, il valore emoglobinico non è aumentato di almeno 1 g/dl (0,62 mmol/l), è improbabile che si verifichi una risposta e il trattamento deve essere interrotto. La terapia deve essere continuata per 4 settimane dopo la fine della chemioterapia. La dose massima non deve superare UI a settimana. Una volta raggiunto l obiettivo terapeutico per un paziente, la dose deve essere ridotta dal 25 al 50% al fine di mantenere l emoglobina a quel livello. Occorre considerare di effettuare una appropriata titolazione della dose. Se l emoglobina supera 12 g/dl (7,5 mmol/l), la dose deve essere ridotta del 25-50% circa. Il trattamento con NeoRecormon deve essere interrotto temporaneamente se i livelli di emoglobina superano 13 g/dl (8,1 mmol/l). Quando il livello dell emoglobina scende a un valore uguale o inferiore a 12 g/dl (7,5 mmol/l), la terapia deve essere ripresa a una dose inferiore di circa il 25% rispetto alla precedente. Se l aumento dell emoglobina è maggiore di 2 g/dl (1,3 mmol/l) in 4 settimane, la dose deve essere ridotta dal 25 al 50%. I pazienti devono essere monitorati attentamente per garantire che venga utilizzata la più bassa dose autorizzata di NeoRecormon per controllare adeguatamente i sintomi dell anemia.
4 Trattamento per incrementare la quantità di sangue autologo: La soluzione viene somministrata per via endovenosa in circa 2 minuti o per via sottocutanea. NeoRecormon viene somministrato due volte alla settimana per 4 settimane. Nei casi in cui il valore di ematocrito sia tale da rendere possibile la donazione di sangue (Ht 33 %), NeoRecormon viene somministrato al termine della donazione di sangue. Durante l intero ciclo di trattamento, l ematocrito non deve superare il valore di 48 %. Il dosaggio deve essere determinato dall équipe chirurgica su base individuale per ogni paziente in funzione della quantità di sangue predonato richiesta e della riserva endogena eritrocitaria: 1. La quantità richiesta di sangue predonato dipende dalla perdita di sangue prevista, dall uso delle procedure impiegate per la conservazione del sangue e dalle condizioni fisiche del paziente. Tale quantità di sangue dovrebbe essere quella prevista essere sufficiente per evitare trasfusioni omologhe di sangue. La quantità di sangue predonato richiesta è espressa in unità, dove una unità nel nomogramma corrisponde a 180 ml di eritrociti. 2. La capacità di donare il sangue dipende principalmente dal volume ematico del paziente e dal valore basale di ematocrito. Entrambe le variabili determinano la riserva endogena eritrocitaria che può essere calcolata in accordo alla seguente formula: Riserva eritrocitaria endogena = volume ematico [ml] x (Ht - 33): 100 donne: volume ematico [ml] = 41 [ml/kg] x peso corporeo [kg] [ml] uomini: volume ematico [ml] = 44 [ml/kg] x peso corporeo [kg] [ml] (peso corporeo 45 kg) L indicazione per intraprendere il trattamento con NeoRecormon e per determinare la singola dose deve essere ricavata in base alla quantità di sangue predonato richiesta e alla riserva eritrocitaria endogena in accordo ai grafici seguenti. Donne Quantità di sangue predonato richiesta [unità] Uomini Quantità di sangue predonato richiesta [unità] Riserva endogena eritrocitaria [ml] Riserva endogena eritrocitaria [ml] La singola dose, così determinata, viene somministrata 2 volte alla settimana per 4 settimane. La dose massima non deve superare 1600 UI/kg di peso corporeo alla settimana per la somministrazione endovenosa o 1200 UI/kg di peso corporeo alla settimana per la somministrazione sottocutanea. Modalità di somministrazione
5 La siringa pre-riempita di NeoRecormon è pronta per l uso. Possono essere iniettate solo soluziomni che siano chiare o leggermente opalescenti, incolori e praticamente prive di particelle visibili.neorecormon in siringa pre-riempitaè un medicinale sterile ma senza conservanti.per nessun motivo si deve somministrare più di una dose per siriga; il medicinale è esclusivamente per dose singola. 4.3 Controindicazioni Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1. Ipertensione scarsamente controllata. Nell indicazione incremento della quantità di sangue autologo : infarto miocardico o ictus nel mese precedente il trattamento, angina pectoris instabile, aumentato rischio di trombosi venose profonde come anamnesi di malattia venosa tromboembolica. 4.4 Avvertenze speciali e precauzioni di impiego NeoRecormon deve essere usato con cautela in presenza di anemia refrattaria con eccesso di blasti in trasformazione, epilessia, trombocitosi, insufficienza epatica cronica. Deficit di acido folico e di vitamina B 12 devono essere compensati poichè riducono l efficacia di NeoRecormon. Si deve usare cautela nell incremento delle dosi di NeoRecormon in pazienti con insufficienza renale cronica poiché dosi cumulative elevate di epoetina possono essere associate ad un aumentato rischio di mortalità e di gravi eventi cardiovascolari e cerebrovascolari. Nei pazienti con una scarsa risposta emoglobinica alle epoetine, devono essere prese in considerazione spiegazioni alternative per tale scarsa risposta (vedere paragrafi 4.2 e 5.1). Per assicurare un efficace eritropoiesi, lo stato marziale deve essere valutato in tutti i pazienti prima e durante il trattamento e può essere necessaria una terapia integrativa con ferro, condotta in accordo alle linee guida relative alla terapia. Un grave sovraccarico di alluminio conseguente il trattamento dell insufficienza renale, può compromettere l efficacia di NeoRecormon. L indicazione per il trattamento con NeoRecormon di pazienti con nefrosclerosi, non ancora sottoposti a dialisi, deve essere stabilita individualmente, dal momento che non può essere esclusa un eventuale accelerazione nella progressione della insufficienza renale. Aplasia pura della serie rossa (PRCA) E' stata segnalata aplasia specifica della serie rossa (PRCA) causata da anticorpi neutralizzanti antieritropoietina in associazione alla terapia con eritropoietina, incluso NeoRecormon. E stato dimostrato che questi anticorpi reagiscono in modo crociato con tutte le proteine eritropoietiche e i pazienti con sospetta o confermata presenza di anticorpi neutralizzanti anti-eritropoietina non devono passare al trattamento con NeoRecormon (vedere paragrafo 4.8). PRCA in pazienti affetti da epatite C: una diminuzione paradossa dell emoglobina e lo sviluppo di anemia severa associata a una bassa conta reticolocitaria deve indurre a interrompere il trattamento con epoetina e ad eseguire test anticorpali antieritropoietina. Casi sono stati riportati in pazienti con epatite C trattati con interferone e ribavirina, contemporaneamente all utilizzo di epoetine. Le epoetine non sono approvate per il trattamento dell anemia associata a epatite C. Monitoraggio della pressione arteriosa: Può verificarsi un aumento della pressione arteriosa o un aggravamento di uno stato ipertensivo esistente soprattutto in caso di aumento rapido dell ematocrito. Questi aumenti della pressione arteriosa possono essere trattati con farmaci. Se gli aumenti della pressione arteriosa non possono essere controllati con i
6 farmaci si consigli un interruzione temporanea della terapia con NeoRecormon. In particolare, all inizio della terapia è raccomandato il regolare monitoraggio della pressione arteriosa, inclusi gli intervalli tra le dialisi. Possono verificarsi crisi ipertensive con sintomi simil-encefalopatia che richiedono l immediato intervento di un medico e cure mediche intensive. Come segnale d allarme, occorre prestare particolare attenzione a episodi improvvisi di emicrania lancinante, come cefalee. Insufficienza Renale Cronica In pazienti con insufficienza renale cronica si può osservare un moderato aumento dose-dipendente nella conta piastrinica all interno dell intervallo di normalità durante il trattamento con NeoRecormon, soprattutto in seguito a somministrazione endovenosa. Questo fenomeno regredisce con il proseguimento della terapia. Si raccomanda di controllare regolarmente la conta piastrinica durante le prime 8 settimane di terapia. Concentrazione dell emoglobina In pazienti con insufficienza renale cronica, la concentrazione di mantenimento dell'emoglobina non deve superare il limite superiore del livello target di emoglobina, raccomandato nel paragrafo 4.2. Negli studi clinici è stato osservato un rischio aumentato di morte e di gravi eventi cardiovascolari o eventi cerebrovascolari che includono l ictus quando sono stati somministrati agenti stimolanti l eritropoiesi (ESA), per raggiungere un livello target di emoglobina superiore a 12 g/dl (7,5 mmol/l). Studi clinici controllati non hanno dimostrato benefici significativi attribuibili alla somministrazione di epoetine, quando la concentrazione di emoglobina viene aumentata oltre il livello necessario a controllare i sintomi dell anemia e ad evitare trasfusioni ematiche. Nei neonati prematuri si può manifestare un lieve aumento nella conta piastrinica, in particolar modo fino al giorno di vita; deve pertanto essere controllata regolarmente la conta piastrinica. Effetto sulla crescita tumorale Le eritropoietine sono fattori di crescita che stimolano principalmente la produzione di globuli rossi. I recettori dell eritropoietina possono essere espressi sulla superficie di diverse cellule tumorali. Come avviene con tutti i fattori di crescita, c è la possibilità che le eritropoietine possano stimolare la crescita di tumori. In diversi studi controllati le epoetine non hanno dimostrato di migliorare la sopravvivenza globale o di determinare una riduzione del rischio di progressione tumorale in pazienti con anemia associata a cancro. In studi clinici controllati, l impiego di NeoRecormon e di altri agenti stimolanti l eritropoiesi (ESA) ha dimostrato: - una riduzione del tempo alla progressione tumorale in pazienti con tumore della testa e del collo allo stadio avanzato sottoposti a radioterapia, se trattati per raggiungere un livello target di emoglobina superiore a 14 g/dl (8,7 mmol/l); - una ridotta sopravvivenza globale e un aumento delle morti attribuiti a progressione della malattia a 4 mesi, in pazienti con tumore mammario metastatico in chemioterapia quando trattati per raggiungere un livello target di emoglobina tra 12 e 14 g/dl (7,5-8,7 mmol/l); - un aumentato rischio di morte in pazienti con tumore maligno attivo non sottoposti a chemioterapia né radioterapia, quando trattati per raggiungere un livello target di emoglobina di 12 g/dl (7,5 mmol/l). L'impiego degli ESA non è indicato in questa popolazione di pazienti. Sulla base di quanto riportato sopra, in alcune condizioni cliniche la trasfusione di sangue deve essere il trattamento preferito per la gestione dell anemia nei pazienti affetti da neoplasia. La decisione di somministrare eritropoietine ricombinanti deve essere basata sulla valutazione del rapporto beneficio-rischio con il coinvolgimento del singolo paziente e deve prendere in considerazione lo specifico contesto clinico. I fattori che devono essere considerati in questa valutazione devono includere il tipo di tumore e il relativo stadio, il grado di anemia, l aspettativa di vita, l ambiente nel quale il paziente è trattato e le preferenze del paziente stesso (vedere paragrafo 5.1). Può verificarsi un aumento della pressione arteriosa che può essere trattato con farmaci. Si raccomanda quindi di monitorare la pressione arteriosa, in particolare nella fase iniziale del trattamento nei pazienti con tumore.
7 Anche la conta piastrinica e il valore di emoglobina devono essere controllati ad intervalli regolari nei pazienti con tumore. In pazienti coinvolti in un programma di predonazione di sangue autologo si può manifestare un aumento della conta piastrinica, prevalentemente all interno dell intervallo di normalità. Perciò si raccomanda di misurare la conta piastrinica almeno una volta alla settimana in questi pazienti. Se il numero delle piastrine è superiore a 150 x 10 9 /l o supera i valori normali, il trattamento con NeoRecormon deve essere interrotto. Nei neonati prematuri non si può escludere un rischio potenziale di retinopatia causata da eritropoietina, pertanto, si deve prestare particolare attenzione, e la decisione di trattare un neonato prematuro deve essere bilanciata considerando il beneficio potenziale ed il rischio di tale trattamento, nonché le opzioni alternative disponibili. In pazienti con insufficienza renale cronica un aumento della dose di eparina durante l emodialisi è spesso richiesto nel corso del trattamento con NeoRecormon a causa di un incremento del valore di ematocrito. E possibile che si verifichi un occlusione del sistema dialitico se l eparinizzazione non è ottimale. In pazienti con insufficienza renale cronica a rischio di trombosi dello shunt artero-venoso devono essere prese in considerazione una revisione precoce dello shunt ed una profilassi antitrombotica attraverso, ad esempio, la somministrazione di acido acetilsalicilico. Durante la terapia con NeoRecormon i livelli sierici di potassio e di fosfato devono essere regolarmente controllati. In un numero limitato di pazienti uremici in trattamento con NeoRecormon è stato riportato un incremento del potassio, sebbene il rapporto di causalità non sia stato stabilito. Nel caso in cui si osservi un valore elevato, o in aumento, di potassio si deve prendere in considerazione l interruzione del trattamento con NeoRecormon fino al ripristino dei valori normali. Per l impiego di NeoRecormon in un programma di predonazione autologa, si devono seguire le linee guida ufficiali sulla donazione di sangue, in particolare: - possono sottoporsi a donazioni soltanto pazienti con un valore di Ht 33 % (emoglobina 11 g/dl [6.83 mmol/l]); - speciale cautela deve essere osservata in pazienti di peso inferiore a 50 kg; - il volume di un singolo prelievo non deve superare approssimativamente il 12 % del volume totale stimato di sangue del paziente. Il trattamento deve essere riservato a pazienti per i quali sia considerato di particolare importanza evitare trasfusioni di sangue omologo e sia stato valutato il rapporto rischio/beneficio derivante da trasfusioni omologhe. Uso improprio L uso improprio da parte di soggetti sani può indurre un eccessivo aumento dell ematocrito. Ciò può essere associato a complicazioni a carico del sistema cardiovascolare con rischio per la vita. Eccipienti NeoRecormon in siringhe preriempite contiene fino a 0,3 mg di fenilalanina/siringa come eccipiente. Pertanto si deve tenere conto di ciò nei pazienti affetti da gravi forme di fenilchetonuria. Questo medicinale contiene meno di 1 mmol (23 mg) di sodio per dose, cioè è praticamente senza sodio. Tracciabilità di Neorecormon: Al fine di migliorare la tracciabilità degli agenti stimolanti l eritropoiesi (ESA), la denominazione commerciale dell ESA somministrato deve essere registrata (o specificata) in modo chiaro nella cartella del paziente. 4.5 Interazioni con altri medicinali ed altre forme di interazione I risultati clinici ottenuti fino ad ora non hanno evidenziato alcuna interazione di NeoRecormon con altri medicinali.
8 Esperimenti effettuati su animali hanno dimostrato che epoetina beta non potenzia l effetto mielotossico di medicinali citostatici quali etoposide, cisplatino, ciclofosfamide e fluorouracile. 4.6 Fertilità, gravidanza e allattamento Fertilità: Gli studi su animali non indicano effetti dannosi diretti o indiretti su gravidanza, sviluppo embrionale/fetale, parto o sviluppo post-natale (vedere paragrafo 5.3). Gravidanza: Non esistono dati relativi all uso di NeoRecormon nelle donne in gravidanza. È necessario essere prudenti nel prescrivere il medicinale a donne in stato di gravidanza. Allattamento: Non è noto se la beta epoetina sia escreta nel latte materno.la decisione se continuare/interrompere l'allattamento al seno o continuare/interrompere la terapia con beta epoetina deve essere presa tenendo in considerazione il beneficio dell'allattamento al seno per il bambino e il beneficio della terapia con beta epoetina per la donna. 4.7 Effetti sulla capacità di guidare veicoli e sull uso di macchinari NeoRecormon non altera la capacità di guidare veicoli o di usare macchinari. 4.8 Effetti indesiderati Sulla base dei risultati degli studi clinici che hanno coinvolto 1725 pazienti, si prevede che circa l 8 % dei pazienti trattati con NeoRecormon sperimenti reazioni avverse. - Pazienti anemici con insufficienza renale cronica La più frequente reazione avversa durante il trattamento con NeoRecormon è rappresentata da un aumento della pressione arteriosa o dall aggravamento di uno stato ipertensivo preesistente, specialmente nei casi di aumento rapido del valore di ematocrito (vedere paragrafo 4.4). Crisi ipertensive accompagnate da sintomi analoghi a quelli dell encefalopatia (ad es. mal di testa e stato confusionale, disturbi sensorio-motori - come disturbi della parola e della deambulazione - fino a convulsioni tonico-cloniche) possono anche insorgere in pazienti normotesi o ipotesi (vedere paragrafo 4.4). Possono verificarsi trombosi dello shunt in pazienti che hanno la tendenza all ipotensione o le cui fistole arteriovenose presentano complicanze (ad es. stenosi, aneurismi), vedere paragrafo 4.4. In molti casi si osserva una riduzione del valore di ferritina sierica associata ad un incremento dell ematocrito (vedere paragrafo 4.4). Inoltre, in casi isolati, sono stati osservati aumenti transitori dei livelli sierici di potassio e fosfato (vedere paragrafo 4.4). In casi isolati è stata riportata aplasia della serie rossa causata da anticorpi neutralizzanti anti eritropoietina, associata a terapia con NeoRecormon. Nel caso sia diagnosticata aplasia della serie rossa causata da anticorpi anti eritropoietina, la terapia con NeoRecormon deve essere interrotta e i pazienti non devono essere trattati con un altra proteina eritropoietica (vedere paragrafo 4.4). Le reazioni avverse sono elencate nella Tabella 1 sottostante. - Pazienti con tumori L ipertensione e la cefalea correlati al trattamento con Epoetina beta, che possono essere trattati con farmaci, sono comuni (vedere paragrafo 4.4). In alcuni pazienti si è osservata una riduzione dei parametri sierici del ferro (vedere paragrafo 4.4). Gli studi clinici hanno mostrato una frequenza più elevata di eventi tromboembolici nei pazienti con tumore trattati con NeoRecormon rispetto ai pazienti dei gruppi di controllo trattati con placebo o non trattati. Nei
9 pazienti trattati con NeoRecormon questa incidenza è del 7 % rispetto al 4 % nel gruppo di controllo; questo non è associato con nessun aumento della mortalità per eventi tromboembolici rispetto al gruppo di controllo. Le reazioni avverse sono elencate nella Tabella 2 sottostante. - Pazienti in un programma di predonazione autologa di sangue Nei pazienti sottoposti ad un programma di predonazione autologa di sangue è stata riportata una incidenza di eventi tromboembolici lievemente superiore. Tuttavia non poteva essere stabilito un rapporto causale con la terapia con NeoRecormon. In studi controllati verso placebo, il deficit temporaneo di ferro è più pronunciato nel gruppo trattato con NeoRecormon rispetto al controllo (vedere paragrafo 4.4). Le reazioni avverse sono elencate nella Tabella 3 sottostante. Classificazione degli eventi avversi Gli eventi avversi sono elencati secondo la classificazione MeDRA per sistemi e organi e per categoria di frequenza Le categorie di frequenza sono definite mediante la seguente convenzione: molto comune (>1/10); comune (>1%, <10%); non comune (>0,1%, <1%); raro (>0,01%, <0,1%); molto raro (<1/10.000); non nota (la frequenza non può essere definita sulla base dei dati disponibili Tabella 1: Reazioni avverse attribuite al trattamento con Neorecormon in studi clinici controllati condotti su pazienti affetti da MRC Classificazione sistemica organica Patologie vascolari Patologie del sistema nervoso Patologie del sistema emolinfopoietico Reazione avversa al farmaco Ipertensione Crisi ipertensive Cefalea Trombosi dell accesso vascolare Trombocitosi Frequenza Comune Non comune Comune Raro Molto raro Tabella 2: Reazioni avverse attribuite al trattamento con NeoRecormon in studi clinici controllati condotti su pazienti oncologici Classificazione sistemica Reazione avversa al Frequenza organica farmaco Patologie vascolari Ipertensione Comune Patologie del sistema Eventi tromboembolici Comune emolinfopoietico Patologie del sistema nervoso Cefalea Comune Tabella 3: Reazioni avverse attribuite al trattamento con Neorecormon in studi clinici controllati condotti su pazienti in un programma di predonazione autologa di sangue Classificazione sistemica organica Patologie del sistema nervoso Reazione avversa al farmaco Cefalea Frequenza Comune - Bambini prematuri Una riduzione dei valori di ferritina sierica è molto comune (vedere paragrafo 4.4).
10 - Descrizione delle reazioni avverse selezionate Sono state osservate raramente reazioni cutanee correlate al trattamento con epoetina beta, quali eruzione cutanea, prurito, orticaria o reazioni nella sede di iniezione. In casi molto rari, sono state osservate reazioni anafilattoidi correlate al trattamento con epoetina beta. Tuttavia, in studi clinici controllati non si è osservata una più elevata incidenza delle reazioni di ipersensibilità. In casi molti rari, in particolare all inizio del trattamento, sono stati riportati sintomi di tipo influenzale correlati al trattamento con epoetina beta, quali febbre, brividi, mal di testa, dolore agli arti, malessere e/o dolore alle ossa. Queste reazioni erano di grado lieve o moderato e scomparivano nell arco di un paio di ore o giorni. Dati provenienti da uno studio controllato con epoetina alfa o darbepoetina alfa, hanno riportato un incidenza di ictus come comune. Segnalazione delle reazioni avverse sospette La segnalazione delle reazioni avverse sospette che si verificano dopo l autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema nazionale di segnalazione all indirizzo Sovradosaggio La finestra terapeutica di NeoRecormon è molto ampia. Non sono stati osservati sintomi di sovradosaggio anche a concentrazioni sieriche molto elevate. 5. PROPRIETÀ FARMACOLOGICHE 5.1 Proprietà farmacodinamiche Categoria farmacoterapeutica: antianemico, codice ATC: B03XA01 Meccanismo d azione: L eritropoietina è una glicoproteina che stimola la formazione di eritrociti dai suoi precursori obbligati. Essa agisce come fattore stimolante la mitosi e come ormone che stimola la differenziazione. Dal punto di vista della composizione di aminoacidi e carboidrati, epoetina beta, il principio attivo di NeoRecormon, è identica all eritropoietina isolata dall urina di pazienti anemici. L efficacia biologica di epoetina beta è stata dimostrata dopo somministrazione endovenosa e sottocutanea in vari modelli animali in vivo (ratti normali e uremici, topi policitemici, cani). Dopo somministrazione di epoetina beta, il numero di eritrociti, i valori di emoglobina e il conteggio dei reticolociti aumentano come pure la velocità di incorporazione del 59 Fe. Nei test in vitro (colture di cellule spleniche di topo), dopo incubazione con epoetina beta si è osservato un incremento di incorporazione di 3 H-timidina nelle cellule eritroidi spleniche nucleate. Studi effettuati su colture cellulari di cellule di midollo osseo umano hanno dimostrato che epoetina beta stimola in modo specifico l eritropoiesi, senza alterare la leucopoiesi. Non è stata osservata alcuna attività citotossica di epoetina beta su midollo osseo o su cellule epidermiche umane. Dopo singola somministrazione di epoetina beta, non si sono riscontrate alterazioni del comportamento o dell attività locomotoria nei topi e della funzionalità circolatoria o respiratoria nei cani. Efficacia clinica e sicurezza: In uno studio randomizzato, in doppio cieco, controllato con placebo, condotto su pazienti con insufficienza renale cronica non in dialisi, con diabete di tipo 2 e livelli di emoglobina 11 g/dl, i pazienti hanno ricevuto o un trattamento con darbepoetina alfa per raggiungere un target di emoglobina di 13 g/dl o placebo (vedere paragrafo 4.4). Lo studio non ha raggiunto l obiettivo primario di dimostrare una riduzione
11 di rischio di mortalità per qualsiasi causa, morbidità cardiovascolare o insufficienza renale terminale (IRT). L analisi dei singoli componenti dell endpoint composito ha mostrato i seguenti HR (95% IC): morte 1,05 (0,92, 1,21), ictus 1,92 (1,38, 2,68), insufficienza cardiaca congestizia (CHF) 0,89 (0,74, 1,08), infarto miocardico (IM) 0,96 (0,75, 1,23), ospedalizzazione per ischemia miocardica 0,84 (0,55, 1,27), IRT 1,02 (0,87, 1,18). Sono state eseguite analisi aggregate di dati post-hoc relativi a studi clinici con ESA condotti in pazienti con IRC (in dialisi, non in dialisi, con o senza diabete). È stata osservata una tendenza all'incremento delle stime di rischio di mortalità per tutte le cause, di eventi cardiovascolari e cerebrovascolari associata alle dosi cumulative di ESA più elevate indipendentemente dallo stato del diabete o della dialisi (vedere paragrafi 4.2 e 4.4). L eritropoietina è un fattore di crescita che stimola principalmente la produzione di globuli rossi. Recettori dell eritropoietina possono essere espressi sulla superficie di diverse cellule tumorali. Sopravvivenza e progressione tumorale sono state esaminate in cinque ampi studi controllati, che hanno coinvolto in totale 2833 pazienti, quattro dei quali erano studi in doppio cieco, controllati con placebo, e uno era uno studio in aperto. Due degli studi hanno arruolato pazienti che erano in trattamento chemioterapico. La concentrazione target di emoglobina in due studi era superiore a 13 g/dl; negli altri tre studi era tra 12 e 14 g/dl. Nello studio in aperto non sono emerse differenze in termini di sopravvivenza globale tra i pazienti trattati con eritropoietina umana ricombinante e i pazienti dei gruppi di controllo. Nei quattro studi controllati con placebo, i valori di hazard ratio relativi alla sopravvivenza globale hanno oscillato tra 1,25 e 2,47 a favore dei pazienti dei gruppi di controllo. Questi studi hanno dimostrato un inspiegabile costante eccesso di mortalità, statisticamente significativo, nei pazienti che presentavano un anemia associata a diversi tipi comuni di tumore che erano stati trattati con eritropoietina umana ricombinante rispetto ai pazienti dei gruppi di controllo. L esito relativo alla sopravvivenza globale in questi studi non ha potuto essere spiegato in modo soddisfacente dalle differenze nell incidenza di trombosi e complicanze correlate, tra i soggetti trattati con eritropoietina umana ricombinante e i soggetti dei gruppi di controllo. Una meta-analisi basata sui dati dei singoli pazienti, che ha incluso i dati di tutti i 12 studi clinici controllati condotti con NeoRecormon su pazienti oncologici anemici (n=2301), ha mostrato una stima puntuale del valore di hazard ratio relativo alla sopravvivenza di 1,13 in favore di soggetti dei gruppi di controllo (IC 95%: 0,87-1,46). Nei pazienti con un livello basale di emoglobina inferiore o uguale a 10 g/dl (n=899), la stima puntuale del valore di hazard ratio relativo alla sopravvivenza è stata di 0,98 (IC 95%: 0,68-1,40). Un maggiore rischio relativo di eventi tromboembolici è stato rilevato nella popolazione complessiva (RR: 1,62; IC 95%: 1,13-2,31). E stata effettuata anche un analisi dei dati per singolo paziente su più di pazienti oncologici (sottoposti a chemioterapia, radioterapia, chemio-radioterapia o a nessuna terapia) che hanno partecipato a 53 studi clinici controllati i quali hanno coinvolto diverse epoetine. La meta-analisi dei dati relativi alla sopravvivenza globale ha portato a una stima puntuale del valore di hazard ratio di 1,06 in favore dei soggetti dei gruppi di controllo (IC 95 %: 1,00, 1,12; 53 studi e pazienti) e per i pazienti oncologici trattati con chemioterapia, il valore di hazard ratio relativo alla sopravvivenza globale è stato di 1,04 (IC 95 %: 0,97, 1,11; 38 studi e pazienti). Le meta-analisi indicano anche in modo coerente un rischio relativo di eventi tromboembolici significativamente aumentato in pazienti oncologici trattati con eritropoietina umana ricombinante (vedere paragrafo 4.4). In casi veramente rari sono stati riscontrati anticorpi neutralizzanti anti-eritropoietina, in presenza o meno di aplasia specifica della serie rossa, durante la terapia con rhu-epo. 5.2 Proprietà farmacocinetiche Studi di farmacocinetica, effettuati in volontari sani ed in pazienti uremici, mostrano che il tempo di emivita di epoetina beta somministrata per via endovenosa è compreso tra 4 e 12 ore e che il volume di distribuzione corrisponde a 1-2 volte il volume plasmatico. Risultati analoghi sono stati osservati negli studi effettuati su ratti normali ed uremici.
12 Dopo somministrazione sottocutanea di epoetina beta a pazienti uremici, l assorbimento prolungato determina una concentrazione sierica a plateau, per cui la massima concentrazione viene raggiunta dopo circa ore. L emivita terminale, mediamente pari a ore, è superiore a quella ottenuta in seguito alla somministrazione endovenosa. La biodisponibilità di epoetina beta, dopo somministrazione sottocutanea, è del %, rispetto a quella ottenuta dopo somministrazione endovenosa. 5.3 Dati preclinici di sicurezza I dati non-clinici non rivelano rischi particolari per l uomo sulla base di studi convenzionali di safety pharmacology, tossicità a dosi ripetute, genotossicità e tossicità riproduttiva. Uno studio di cancerogenesi con eritropoietina omologa nel topo non ha messo in evidenza segni di potenziale proliferativo o oncogenico. 6. INFORMAZIONI FARMACEUTICHE 6.1 Elenco degli eccipienti Urea, Sodio cloruro, Polisorbato 20, Sodio fosfato monobasico diidrato, Sodio fosfato dibasico dodecaidrato, Calcio cloruro diidrato, Glicina, L-Leucina, L-Isoleucina, L-Treonina, L-Acido glutammico, L-Fenilalanina, Acqua per preparazioni iniettabili. 6.2 Incompatibilità In assenza di studi di incompatibilità, il medicinale non deve essere miscelato con altri prodotti. 6.3 Periodo di validità 2 anni. 6.4 Precauzioni particolari per la conservazione Conservare in frigorifero (2 C 8 C). Tenere la siringa preriempita nell'imballaggio esterno per tenerla al riparo dalla luce. Per l uso ambulatoriale, il paziente può togliere il prodotto dal frigorifero e conservarlo a temperatura ambiente (non superiore ai 25 C) per un singolo periodo di 3 giorni al massimo. 6.5 Natura e contenuto del contenitore Siringa pre-riempita (vetro tipo I) con un tappo e blocco dello stantuffo (gomma teflonizzata) con ago per iniezione (27G1/2).Ogni siringa contiene 0.6 ml di soluzione.
13 Confezioni da 1 siringa pre-riempita e 1 ago o 4 siringhe pre-riempite e 4 aghi. È possibile che non tutte le confezioni siano commercializzate. 6.6 Precauzioni particolari per lo smaltimento e la manipolazione Innanzitutto lavarsi le mani! 1. Togliere dalla confezione una siringa e controllare che la soluzione sia chiara, incolore e praticamente priva di particelle visibili. Rimuovere il cappuccio dalla siringa. 2. Togliere un ago dalla confezione, fissarlo sulla siringa e rimuovere il cappuccio protettivo dell ago. 3. Espellere l aria dalla siringa e dall ago mantenendo la siringa in posizione verticale e spingendo leggermente verso l alto lo stantuffo. Tenere premuto lo stantuffo fino a quando la siringa conterrà la quantità di NeoRecormon prescritta. 4. Pulire la cute con alcool nel sito di iniezione. Sollevare una piega cutanea, pizzicandola con pollice e indice. Tenere il cilindro della siringa vicino all ago e inserire l ago nella piega della cute con movimento veloce e deciso. Iniettare NeoRecormon soluzione. Estrarre velocemente l ago e tenere premuto il sito di iniezione con una garza sterile e asciutta. Questo medicinale è solo per dose singola. Il prodotto non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità alla normativa locale vigente. 7. TITOLARE DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO Roche Registration Limited 6 Falcon Way Shire Park Welwyn Garden City AL7 1TW Regno Unito 8. NUMERI DELLE AUTORIZZAZIONI ALL IMMISSIONE IN COMMERCIO EU/1/97/031/ DATA DELLA PRIMA AUTORIZZAZIONE/RINNOVO DELL AUTORIZZAZIONE Data della prima autorizzazione: 16 luglio 1997 Data dell ultimo rinnovo: 16 luglio DATA DI REVISIONE DEL TESTO Luglio 2015 Informazioni più dettagliate su questo medicinale sono disponibili sul sito web della Agenzia Europea dei Medicinali :
Allegato I. Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Vista la relazione di valutazione del comitato di valutazione
Allegato I Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Vista la relazione di valutazione del comitato di valutazione
Riassunto delle Caratteristiche Tecniche del Prodotto
 Riassunto delle Caratteristiche Tecniche del Prodotto 1. DENOMINAZIONE DEL MEDICINALE Nespo 10, 15, 20, 30, 40, 50, 60, 80, 100, 150, 300, 500 microgrammi soluzione iniettabile in siringa preriempita.
Riassunto delle Caratteristiche Tecniche del Prodotto 1. DENOMINAZIONE DEL MEDICINALE Nespo 10, 15, 20, 30, 40, 50, 60, 80, 100, 150, 300, 500 microgrammi soluzione iniettabile in siringa preriempita.
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Silapo 1 000 UI/0,3 ml soluzione iniettabile in siringa preriempita 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Silapo 1 000 UI/0,3 ml soluzione iniettabile in siringa preriempita 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Allegato III. Modifiche agli specifici paragrafi del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Modifiche agli specifici paragrafi del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Queste modifiche agli specifici paragrafi del Riassunto delle Caratteristiche
Allegato III Modifiche agli specifici paragrafi del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Queste modifiche agli specifici paragrafi del Riassunto delle Caratteristiche
Riassunto delle caratteristiche del prodotto
 Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE INFLEXAL V Sospensione iniettabile Vaccino influenzale (antigene di superficie, inattivato, virosomale) Stagione 2007/2008 2.
Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE INFLEXAL V Sospensione iniettabile Vaccino influenzale (antigene di superficie, inattivato, virosomale) Stagione 2007/2008 2.
Riassunto delle caratteristiche del prodotto
 Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE INFLEXAL V Sospensione iniettabile Vaccino influenzale (antigene di superficie, inattivato, virosomale) Stagione 2011/2012 2.
Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE INFLEXAL V Sospensione iniettabile Vaccino influenzale (antigene di superficie, inattivato, virosomale) Stagione 2011/2012 2.
FIACCHEZZA, STANCHEZZA, MALESSERE MORALE. Carenza di ferro molto diffusa e spesso sottovalutata
 FIACCHEZZA, STANCHEZZA, MALESSERE MORALE Carenza di ferro molto diffusa e spesso sottovalutata Cari pazienti! Vi sentite spesso fiacchi, stanchi, esauriti o giù di morale? Soffrite facilmente il freddo?
FIACCHEZZA, STANCHEZZA, MALESSERE MORALE Carenza di ferro molto diffusa e spesso sottovalutata Cari pazienti! Vi sentite spesso fiacchi, stanchi, esauriti o giù di morale? Soffrite facilmente il freddo?
FOGLIETTO ILLUSTRATIVO FUSIDIUM 1%
 FOGLIETTO ILLUSTRATIVO FUSIDIUM 1% FUSIDIUM 1 % Gocce oftalmiche Acido Fusidico CATEGORIA FARMACOTERAPEUTICA Antinfettivo oculare. INDICAZIONI Fusidium è indicato in infezioni batteriche oculari causate
FOGLIETTO ILLUSTRATIVO FUSIDIUM 1% FUSIDIUM 1 % Gocce oftalmiche Acido Fusidico CATEGORIA FARMACOTERAPEUTICA Antinfettivo oculare. INDICAZIONI Fusidium è indicato in infezioni batteriche oculari causate
FINASTERIDE ZENTIVA 5 MG COMPRESSE RIVESTITE CON FILM. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA FINASTERIDE ZENTIVA 5 MG COMPRESSE RIVESTITE CON FILM Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
FARMACOVIGILANZA FINASTERIDE ZENTIVA 5 MG COMPRESSE RIVESTITE CON FILM Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
Ricerca farmacologica priclinica e clinica
 Ricerca farmacologica priclinica e clinica SPERIMENTAZIONE PRECLINICA DURATA MEDIA?? ANNI Consente di isolare, dalle migliaia di sostanze sottoposte al primo screening di base farmacologico e biochimico,
Ricerca farmacologica priclinica e clinica SPERIMENTAZIONE PRECLINICA DURATA MEDIA?? ANNI Consente di isolare, dalle migliaia di sostanze sottoposte al primo screening di base farmacologico e biochimico,
INTERFERONE POTENZIALI EFFETTI COLLATERALI
 INTERFERONE POTENZIALI EFFETTI COLLATERALI 1 Le informazioni contenute in questo modello sono fornite in collaborazione con la Associazione Italiana Malati di Cancro, parenti ed amici ; per maggiori informazioni:
INTERFERONE POTENZIALI EFFETTI COLLATERALI 1 Le informazioni contenute in questo modello sono fornite in collaborazione con la Associazione Italiana Malati di Cancro, parenti ed amici ; per maggiori informazioni:
GAZYVARO. Farmaco di nuova registrazione
 AllegatoallaDeterminaAIFANumero1012/2014del24/09/2014/ Inserimento,inaccordoall articolo12,comma5dellalegge189/2012,inappositasezione(denominataclasse C(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilitànellemoredellapresentazioneda
AllegatoallaDeterminaAIFANumero1012/2014del24/09/2014/ Inserimento,inaccordoall articolo12,comma5dellalegge189/2012,inappositasezione(denominataclasse C(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilitànellemoredellapresentazioneda
Il sale è un elemento fondamentale per l alimentazione umana ed è costituito da cloruro di sodio (NaCl). Una sua eccessiva introduzione però può
 Sale e salute Il sale è un elemento fondamentale per l alimentazione umana ed è costituito da cloruro di sodio (NaCl). Una sua eccessiva introduzione però può causare gravi problemi alla salute. La quantità
Sale e salute Il sale è un elemento fondamentale per l alimentazione umana ed è costituito da cloruro di sodio (NaCl). Una sua eccessiva introduzione però può causare gravi problemi alla salute. La quantità
Foglio illustrativo: Informazioni per l utilizzatore. Atosiban Ibisqus 6,75 mg/0,9 ml soluzione iniettabile Medicinale equivalente
 Foglio illustrativo: Informazioni per l utilizzatore Atosiban Ibisqus 6,75 mg/0,9 ml soluzione iniettabile Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale perché
Foglio illustrativo: Informazioni per l utilizzatore Atosiban Ibisqus 6,75 mg/0,9 ml soluzione iniettabile Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale perché
SCHEDA DI SEGNALAZIONE SITUAZIONE DI RISCHIO
 SOCIETA ITALIANA DI FARMACIA OSPEDALIERA E DEI SERVIZI FARMACEUTICI DELLE AZIENDE SANITARIE Area Scientifico-Culturale SIFO Rischio Clinico SCHEDA DI SEGNALAZIONE SITUAZIONE DI RISCHIO MODALITÀ DI COMPILAZIONE
SOCIETA ITALIANA DI FARMACIA OSPEDALIERA E DEI SERVIZI FARMACEUTICI DELLE AZIENDE SANITARIE Area Scientifico-Culturale SIFO Rischio Clinico SCHEDA DI SEGNALAZIONE SITUAZIONE DI RISCHIO MODALITÀ DI COMPILAZIONE
Foglio illustrativo: informazioni per il paziente Soluzione Schoum soluzione orale
 Foglio illustrativo: informazioni per il paziente Soluzione Schoum soluzione orale Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni per lei.
Foglio illustrativo: informazioni per il paziente Soluzione Schoum soluzione orale Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni per lei.
Riassunto delle Caratteristiche del Prodotto INDICE. 01.0 DENOMINAZIONE DEL MEDICINALE Inizio Pagina.
 1 di 5 07/11/2012 14:56 A B C D E F G H I J K L M N O P Q R S T U V W X Y Riassunto delle Caratteristiche del Prodotto INDICE 01.0 DENOMINAZIONE DEL MEDICINALE 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA
1 di 5 07/11/2012 14:56 A B C D E F G H I J K L M N O P Q R S T U V W X Y Riassunto delle Caratteristiche del Prodotto INDICE 01.0 DENOMINAZIONE DEL MEDICINALE 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Conferenza di consenso Quale informazione per la donna in menopausa sulla terapia ormonale sostitutiva? Torino 17 maggio 2008
 Conferenza di consenso Quale informazione per la donna in menopausa sulla terapia ormonale sostitutiva? Torino 17 maggio 2008 1 Quali aspetti della menopausa possono essere divulgati come problemi di salute?
Conferenza di consenso Quale informazione per la donna in menopausa sulla terapia ormonale sostitutiva? Torino 17 maggio 2008 1 Quali aspetti della menopausa possono essere divulgati come problemi di salute?
UTILIZZATORI A VALLE: COME RENDERE NOTI GLI USI AI FORNITORI
 UTILIZZATORI A VALLE: COME RENDERE NOTI GLI USI AI FORNITORI Un utilizzatore a valle di sostanze chimiche dovrebbe informare i propri fornitori riguardo al suo utilizzo delle sostanze (come tali o all
UTILIZZATORI A VALLE: COME RENDERE NOTI GLI USI AI FORNITORI Un utilizzatore a valle di sostanze chimiche dovrebbe informare i propri fornitori riguardo al suo utilizzo delle sostanze (come tali o all
Studio di ricerca clinica sul dolore da endometriosi. Il dolore che Lei sente è reale... anche se gli altri non possono vederlo.
 Studio di ricerca clinica sul dolore da endometriosi Il dolore che Lei sente è reale... anche se gli altri non possono vederlo. A822523 Lo studio SOLSTICE verrà condotto in circa 200 centri di ricerca
Studio di ricerca clinica sul dolore da endometriosi Il dolore che Lei sente è reale... anche se gli altri non possono vederlo. A822523 Lo studio SOLSTICE verrà condotto in circa 200 centri di ricerca
ALLEGATO I. Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio
 ALLEGATO I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche - Sindrome da astinenza: Con Effentora/Actiq si
ALLEGATO I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche - Sindrome da astinenza: Con Effentora/Actiq si
Dronedarone e insufficienza renale acuta: analisi delle segnalazioni della Rete Nazionale di Farmacovigilanza
 Dronedarone e insufficienza renale acuta: analisi delle segnalazioni della Rete Nazionale di Farmacovigilanza Domenico Motola Dipartimento di Scienze Mediche e Chirurgiche Unità di farmacologia Università
Dronedarone e insufficienza renale acuta: analisi delle segnalazioni della Rete Nazionale di Farmacovigilanza Domenico Motola Dipartimento di Scienze Mediche e Chirurgiche Unità di farmacologia Università
CARTA INTESTATA DEL CENTRO CLINICO
 CARTA INTESTATA DEL CENTRO CLINICO CERLiguria_Mod.10_Uso_Compassionevole RICHIESTA DI PARERE AL COMITATO ETICO PER USO TERAPEUTICO DI MEDICINALE SOTTOPOSTO A SPERIMENTAZIONE CLINICA Si applica solo se
CARTA INTESTATA DEL CENTRO CLINICO CERLiguria_Mod.10_Uso_Compassionevole RICHIESTA DI PARERE AL COMITATO ETICO PER USO TERAPEUTICO DI MEDICINALE SOTTOPOSTO A SPERIMENTAZIONE CLINICA Si applica solo se
Valutazione dell IG di Frollini tradizionali e preparati con farina con l aggiunta del % di Freno SIGI.
 Valutazione dell IG di Frollini tradizionali e preparati con farina con l aggiunta del % di Freno SIGI. Premessa L'indice glicemico (IG) di un alimento, definito come l'area sotto la curva (AUC) della
Valutazione dell IG di Frollini tradizionali e preparati con farina con l aggiunta del % di Freno SIGI. Premessa L'indice glicemico (IG) di un alimento, definito come l'area sotto la curva (AUC) della
IMATINIB (Glivec) POTENZIALI EFFETTI COLLATERALI
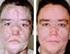 IMATINIB (Glivec) POTENZIALI EFFETTI COLLATERALI Le informazioni contenute in questo modello sono fornite in collaborazione con la Associazione Italiana Malati di Cancro, parenti ed amici ; per maggiori
IMATINIB (Glivec) POTENZIALI EFFETTI COLLATERALI Le informazioni contenute in questo modello sono fornite in collaborazione con la Associazione Italiana Malati di Cancro, parenti ed amici ; per maggiori
SEBASTIANO FILETTI. Dipartimento di Medicina Interna e Specialità Mediche. Università di Roma Sapienza, Roma
 SEBASTIANO FILETTI Dipartimento di Medicina Interna e Specialità Mediche Università di Roma Sapienza, Roma La malattia tiroidea è in aumento negli ultimi anni. Quali le ragioni? Dati epidemiologici provenienti
SEBASTIANO FILETTI Dipartimento di Medicina Interna e Specialità Mediche Università di Roma Sapienza, Roma La malattia tiroidea è in aumento negli ultimi anni. Quali le ragioni? Dati epidemiologici provenienti
Orientamenti sul sottomodulo del rischio di catastrofe per l assicurazione malattia
 EIOPA-BoS-14/176 IT Orientamenti sul sottomodulo del rischio di catastrofe per l assicurazione malattia EIOPA Westhafen Tower, Westhafenplatz 1-60327 Frankfurt Germany - Tel. + 49 69-951119-20; Fax. +
EIOPA-BoS-14/176 IT Orientamenti sul sottomodulo del rischio di catastrofe per l assicurazione malattia EIOPA Westhafen Tower, Westhafenplatz 1-60327 Frankfurt Germany - Tel. + 49 69-951119-20; Fax. +
CUORE E MONTAGNA ALTITUDINE. Bassa quota fino a 1800 m. Media quota tra 1800 e 3000 m. Alta quota tra 3000 e 5500 m. Altissima quota sopra i 5500 m.
 CUORE E MONTAGNA ALTITUDINE Bassa quota fino a 1800 m. Media quota tra 1800 e 3000 m. Alta quota tra 3000 e 5500 m. Altissima quota sopra i 5500 m. CARATTERISTICHE FISICHE DELL AMBIENTE DI MONTAGNA riduzione
CUORE E MONTAGNA ALTITUDINE Bassa quota fino a 1800 m. Media quota tra 1800 e 3000 m. Alta quota tra 3000 e 5500 m. Altissima quota sopra i 5500 m. CARATTERISTICHE FISICHE DELL AMBIENTE DI MONTAGNA riduzione
Il rischio cancerogeno e mutageno
 Il rischio cancerogeno e mutageno Le sostanze cancerogene Un cancerogeno è un agente capace di provocare l insorgenza del cancro o di aumentarne la frequenza in una popolazione esposta. Il cancro è caratterizzato
Il rischio cancerogeno e mutageno Le sostanze cancerogene Un cancerogeno è un agente capace di provocare l insorgenza del cancro o di aumentarne la frequenza in una popolazione esposta. Il cancro è caratterizzato
ANNO MASCHI FEMMINE TOTALE TOTALE 1974 2513 4487
 MORTALITÀ Tra i residenti della ULSS n. 1 nel corso del triennio 2010-2012 si sono verificati 4487 decessi (1974 nei maschi e 2513 nelle femmine, media per anno 1496), in leggero aumento rispetto al dato
MORTALITÀ Tra i residenti della ULSS n. 1 nel corso del triennio 2010-2012 si sono verificati 4487 decessi (1974 nei maschi e 2513 nelle femmine, media per anno 1496), in leggero aumento rispetto al dato
Ministero della Salute
 Ministero della Salute Dipartimento della sanità pubblica e dell innovazione Direzione generale dei rapporti europei ed internazionali INFORMATIVA OMS: ATTIVITÀ FISICA Traduzione non ufficiale a cura di
Ministero della Salute Dipartimento della sanità pubblica e dell innovazione Direzione generale dei rapporti europei ed internazionali INFORMATIVA OMS: ATTIVITÀ FISICA Traduzione non ufficiale a cura di
Allegato 1 Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione all immissione in commercio
 Allegato 1 Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione all immissione in commercio Conclusioni scientifiche Tenendo conto della valutazione del Comitato per
Allegato 1 Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione all immissione in commercio Conclusioni scientifiche Tenendo conto della valutazione del Comitato per
Potenza dello studio e dimensione campionaria. Laurea in Medicina e Chirurgia - Statistica medica 1
 Potenza dello studio e dimensione campionaria Laurea in Medicina e Chirurgia - Statistica medica 1 Introduzione Nella pianificazione di uno studio clinico randomizzato è fondamentale determinare in modo
Potenza dello studio e dimensione campionaria Laurea in Medicina e Chirurgia - Statistica medica 1 Introduzione Nella pianificazione di uno studio clinico randomizzato è fondamentale determinare in modo
PASQUALE FREGA Assobiotec
 ITALIAN ORPHAN DRUGS DAY Venerdì 13 febbraio 2015 Sala conferenze Digital for Business - Sesto San Giovanni (MI) PASQUALE FREGA Assobiotec www.digitalforacademy.com Italian Orphan Drug Day Malattie Rare
ITALIAN ORPHAN DRUGS DAY Venerdì 13 febbraio 2015 Sala conferenze Digital for Business - Sesto San Giovanni (MI) PASQUALE FREGA Assobiotec www.digitalforacademy.com Italian Orphan Drug Day Malattie Rare
Statistica. Lezione 6
 Università degli Studi del Piemonte Orientale Corso di Laurea in Infermieristica Corso integrato in Scienze della Prevenzione e dei Servizi sanitari Statistica Lezione 6 a.a 011-01 Dott.ssa Daniela Ferrante
Università degli Studi del Piemonte Orientale Corso di Laurea in Infermieristica Corso integrato in Scienze della Prevenzione e dei Servizi sanitari Statistica Lezione 6 a.a 011-01 Dott.ssa Daniela Ferrante
PATENTE: PER LE PERSONE CON DIABETE UN ODISSEA INFINITA
 PATENTE: PER LE PERSONE CON DIABETE UN ODISSEA INFINITA ROBERTO COCCI Presidente FTD e Diabete Forum Componente CC DIABETE ITALIA LA PATENTE AL CITTADINO AFFETTO DA DIABETE: IL PUNTO DI VISTA DI DIABETE
PATENTE: PER LE PERSONE CON DIABETE UN ODISSEA INFINITA ROBERTO COCCI Presidente FTD e Diabete Forum Componente CC DIABETE ITALIA LA PATENTE AL CITTADINO AFFETTO DA DIABETE: IL PUNTO DI VISTA DI DIABETE
ESERCITAZIONE. CdL Fisioterapia e Podologia. 25 novembre 2015
 ESERCITAZIONE CdL Fisioterapia e Podologia 25 novembre 2015 Epidemiologia Domanda 1 Le neoplasie gastriche sono: a. diminuite in tutta Europa b. diminuite fino agli anni 80, poi stabili c. aumentate in
ESERCITAZIONE CdL Fisioterapia e Podologia 25 novembre 2015 Epidemiologia Domanda 1 Le neoplasie gastriche sono: a. diminuite in tutta Europa b. diminuite fino agli anni 80, poi stabili c. aumentate in
Sistema Informativo per il monitoraggio dell Assistenza Domiciliare (SIAD)
 Sistema Informativo per il monitoraggio dell Assistenza Domiciliare (SIAD) INDICATORI SIAD - SISTEMA ASSISTENZA DOMICILIARE Schede descrittive degli Indicatori per la lettura integrata dei fenomeni sanitari
Sistema Informativo per il monitoraggio dell Assistenza Domiciliare (SIAD) INDICATORI SIAD - SISTEMA ASSISTENZA DOMICILIARE Schede descrittive degli Indicatori per la lettura integrata dei fenomeni sanitari
CETUXIMAB (Erbitux) POTENZIALI EFFETTI COLLATERALI
 CETUXIMAB (Erbitux) POTENZIALI EFFETTI COLLATERALI Le informazioni contenute in questo modello sono fornite in collaborazione con la Associazione Italiana Malati di Cancro, parenti ed amici ; per maggiori
CETUXIMAB (Erbitux) POTENZIALI EFFETTI COLLATERALI Le informazioni contenute in questo modello sono fornite in collaborazione con la Associazione Italiana Malati di Cancro, parenti ed amici ; per maggiori
Università del Piemonte Orientale. Corsi di Laurea Triennale. Corso di Statistica e Biometria. Elementi di Epidemiologia
 Università del Piemonte Orientale Corsi di Laurea Triennale Corso di Statistica e Biometria Elementi di Epidemiologia Corsi di Laurea Triennale Corso di Statistica e Biometria: Elementi di epidemiologia
Università del Piemonte Orientale Corsi di Laurea Triennale Corso di Statistica e Biometria Elementi di Epidemiologia Corsi di Laurea Triennale Corso di Statistica e Biometria: Elementi di epidemiologia
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Beta-interferoni: rischio di microangiopatia trombotica e sindrome nefrosica 20 Agosto
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Beta-interferoni: rischio di microangiopatia trombotica e sindrome nefrosica 20 Agosto
SMID a.a. 2004/2005 Corso di Metodi Statistici in Biomedicina Tassi di incidenza 9/2/2005
 SMID a.a. 2004/2005 Corso di Metodi Statistici in Biomedicina Tassi di incidenza 9/2/2005 Ricerca epidemiologica Gli epidemiologi sono interessati a conoscere l incidenza delle malattie per prevedere i
SMID a.a. 2004/2005 Corso di Metodi Statistici in Biomedicina Tassi di incidenza 9/2/2005 Ricerca epidemiologica Gli epidemiologi sono interessati a conoscere l incidenza delle malattie per prevedere i
Il vostro bambino e lo Screening Neonatale
 Il vostro bambino e lo Screening Neonatale Guida per i Genitori A cura di: Centro Fibrosi Cistica e Centro Malattie Metaboliche AOU A. Meyer, Firenze Cari genitori, la Regione Toscana, secondo un programma
Il vostro bambino e lo Screening Neonatale Guida per i Genitori A cura di: Centro Fibrosi Cistica e Centro Malattie Metaboliche AOU A. Meyer, Firenze Cari genitori, la Regione Toscana, secondo un programma
INFORMATIVA ALLA ECOGRAFIA CON MEZZO DI CONTRASTO_CEUS
 Pag. 1/4 Cognome Nome Nato/a il N.B. Il presente modulo informativo deve essere firmato per presa visione e riconsegnato al sanitario che propone/esegue la procedura di seguito descritta. Questo modulo
Pag. 1/4 Cognome Nome Nato/a il N.B. Il presente modulo informativo deve essere firmato per presa visione e riconsegnato al sanitario che propone/esegue la procedura di seguito descritta. Questo modulo
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO NAXCEL 200 mg/ml sospensione iniettabile per bovini 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO NAXCEL 200 mg/ml sospensione iniettabile per bovini 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml
DONAZIONE SANGUE DA CORDONE OMBELICALE
 DONAZIONE SANGUE DA CORDONE OMBELICALE Sono passati molti anni da quando si sono sperimentati i primi trapianti. Oggi trasferire gli organi da un corpo che muore ad uno che può continuare a vivere, non
DONAZIONE SANGUE DA CORDONE OMBELICALE Sono passati molti anni da quando si sono sperimentati i primi trapianti. Oggi trasferire gli organi da un corpo che muore ad uno che può continuare a vivere, non
Conclusioni scientifiche
 Allegato II Conclusioni scientifiche e motivi della revoca o variazione dei termini delle autorizzazioni all immissione in commercio e spiegazione dettagliata delle differenze rispetto alla raccomandazione
Allegato II Conclusioni scientifiche e motivi della revoca o variazione dei termini delle autorizzazioni all immissione in commercio e spiegazione dettagliata delle differenze rispetto alla raccomandazione
Monossido d azoto NO (Nitric Oxide) Messaggero del segnale cellulare. Molecola regolatoria nel sistema nervoso centrale e periferico
 Monossido d azoto NO (Nitric Oxide) Ruolo biologico: Messaggero del segnale cellulare Molecola regolatoria nel sistema cardiovascolare Molecola regolatoria nel sistema nervoso centrale e periferico Componente
Monossido d azoto NO (Nitric Oxide) Ruolo biologico: Messaggero del segnale cellulare Molecola regolatoria nel sistema cardiovascolare Molecola regolatoria nel sistema nervoso centrale e periferico Componente
Dalla Diagnostica per Immagini all Imaging Molecolare
 Dalla Diagnostica per Immagini all Imaging Molecolare L imaging Molecolare è l insieme di metodiche che consentono di ottenere contemporaneamente informazioni morfologiche e funzionali per la caratterizzazione
Dalla Diagnostica per Immagini all Imaging Molecolare L imaging Molecolare è l insieme di metodiche che consentono di ottenere contemporaneamente informazioni morfologiche e funzionali per la caratterizzazione
LA PANDEMIA SILENTE DEL DIABETE: UN EMERGENZA SANITARIA, SOCIALE ED ECONOMICA
 LA PANDEMIA SILENTE DEL DIABETE: UN EMERGENZA SANITARIA, SOCIALE ED ECONOMICA Antonio Nicolucci Direttore Dipartimento di Farmacologia Clinica e Epidemiologia, Consorzio Mario Negri Sud Coordinatore Data
LA PANDEMIA SILENTE DEL DIABETE: UN EMERGENZA SANITARIA, SOCIALE ED ECONOMICA Antonio Nicolucci Direttore Dipartimento di Farmacologia Clinica e Epidemiologia, Consorzio Mario Negri Sud Coordinatore Data
LA SOLUZIONE AI NODULI BENIGNI DELLA TIROIDE
 LA SOLUZIONE AI NODULI BENIGNI DELLA TIROIDE www.modilite.info MODILITE In Italia la patologia nodulare tiroidea è piuttosto frequente ed è spesso asintomatica. Circa l 80% dei noduli tiroidei sono benigni
LA SOLUZIONE AI NODULI BENIGNI DELLA TIROIDE www.modilite.info MODILITE In Italia la patologia nodulare tiroidea è piuttosto frequente ed è spesso asintomatica. Circa l 80% dei noduli tiroidei sono benigni
EPOETINA ALFA UMANA RICOMBINANTE BIOSIMILARE (HX575) (11-02-2009)
 EPOETINA ALFA UMANA RICOMBINANTE BIOSIMILARE (HX (11-02-2009) Specialità: BINOCRIT, ABSEAMED (Sandoz spa, Fidia farmaceutici spa) Forma farmaceutica: soluzione iniettabile in siringa preriempita 1000 UI/0,5
EPOETINA ALFA UMANA RICOMBINANTE BIOSIMILARE (HX (11-02-2009) Specialità: BINOCRIT, ABSEAMED (Sandoz spa, Fidia farmaceutici spa) Forma farmaceutica: soluzione iniettabile in siringa preriempita 1000 UI/0,5
STRUMENTO EDUCATIVO PER PAZIENTI CHE ASSUMONO FARMACI CHEMIOTERAPICI ORALI
 STRUMENTO EDUCATIVO PER PAZIENTI CHE ASSUMONO FARMACI CHEMIOTERAPICI ORALI Questo strumento è stato creato per facilitare gli operatori sanitari nella valutazione e nell educazione dei pazienti trattati
STRUMENTO EDUCATIVO PER PAZIENTI CHE ASSUMONO FARMACI CHEMIOTERAPICI ORALI Questo strumento è stato creato per facilitare gli operatori sanitari nella valutazione e nell educazione dei pazienti trattati
STUDI CLINICI 1. Che cosa è uno studio clinico e a cosa serve? 2. Come nasce la sperimentazione clinica e che tipi di studi esistono?
 STUDI CLINICI 1. Che cosa è uno studio clinico e a cosa serve? Si definisce sperimentazione clinica, o studio clinico controllato, (in inglese: clinical trial), un esperimento scientifico che genera dati
STUDI CLINICI 1. Che cosa è uno studio clinico e a cosa serve? Si definisce sperimentazione clinica, o studio clinico controllato, (in inglese: clinical trial), un esperimento scientifico che genera dati
Il farmaco generico. Contenuti tecnico-scientifici del farmaco generico: comunicazione a corrente alternata
 Il farmaco generico Contenuti tecnico-scientifici del farmaco generico: comunicazione a corrente alternata Il farmaco generico Cos è un farmaco generico? È un medicinale EQUIVALENZA terapeuticamente equivalente
Il farmaco generico Contenuti tecnico-scientifici del farmaco generico: comunicazione a corrente alternata Il farmaco generico Cos è un farmaco generico? È un medicinale EQUIVALENZA terapeuticamente equivalente
della Valvola Mitrale
 Informazioni sul Rigurgito Mitralico e sulla Terapia con Clip della Valvola Mitrale Supporto al medico per le informazioni al paziente. Informazioni sul Rigurgito Mitralico Il rigurgito mitralico - o RM
Informazioni sul Rigurgito Mitralico e sulla Terapia con Clip della Valvola Mitrale Supporto al medico per le informazioni al paziente. Informazioni sul Rigurgito Mitralico Il rigurgito mitralico - o RM
1. Obesità. Per valutare la distribuzione del grasso corporeo, si può utilizzare il rapporto vita.
 2%(6,7 1. Obesità L incidenza del sovrappeso e/o dell obesità è andata aumentando dal dopoguerra in tutti i paesi industrializzati per l abbondanza e la disponibilità di cibi raffinati da un lato e la
2%(6,7 1. Obesità L incidenza del sovrappeso e/o dell obesità è andata aumentando dal dopoguerra in tutti i paesi industrializzati per l abbondanza e la disponibilità di cibi raffinati da un lato e la
BORTEZOMIB (Velcade)
 BORTEZOMIB (Velcade) POTENZIALI EFFETTI COLLATERALI Le informazioni contenute in questo modello sono fornite in collaborazione con la Associazione Italiana Malati di Cancro, parenti ed amici ; per maggiori
BORTEZOMIB (Velcade) POTENZIALI EFFETTI COLLATERALI Le informazioni contenute in questo modello sono fornite in collaborazione con la Associazione Italiana Malati di Cancro, parenti ed amici ; per maggiori
www.printo.it/pediatric-rheumatology/it/intro
 www.printo.it/pediatric-rheumatology/it/intro Malattia di Behçet Versione 2016 2. DIAGNOSI E TERAPIA 2.1 Come viene diagnosticata? La diagnosi è principalmente clinica. Spesso sono necessari alcuni anni
www.printo.it/pediatric-rheumatology/it/intro Malattia di Behçet Versione 2016 2. DIAGNOSI E TERAPIA 2.1 Come viene diagnosticata? La diagnosi è principalmente clinica. Spesso sono necessari alcuni anni
L APPARATO CIRCOLATORIO
 L APPARATO CIRCOLATORIO Tutte le cellule del nostro corpo hanno bisogno di sostanze nutritive e di ossigeno per svolgere le loro funzioni vitali. Così, esiste il sangue, un tessuto fluido che porta in
L APPARATO CIRCOLATORIO Tutte le cellule del nostro corpo hanno bisogno di sostanze nutritive e di ossigeno per svolgere le loro funzioni vitali. Così, esiste il sangue, un tessuto fluido che porta in
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITA MEDICINALE:
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITA MEDICINALE: FLUAD, Sospensione iniettabile in siringa pre-riempita Vaccino influenzale inattivato, antigene di superficie,
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITA MEDICINALE: FLUAD, Sospensione iniettabile in siringa pre-riempita Vaccino influenzale inattivato, antigene di superficie,
IL MEDICO DI MEDICINA GENERALE E MEDICINA GENERALE L ALLARME EBOLA: CLINICA E MANAGEMENT DELLE EPIDEMIE DEL TERZO MILLENNIO NEL SETTING DELLA
 IL MEDICO DI MEDICINA GENERALE E L ALLARME EBOLA: CLINICA E MANAGEMENT DELLE EPIDEMIE DEL TERZO MILLENNIO NEL SETTING DELLA MEDICINA GENERALE CORSO DI FORMAZIONE A DISTANZA I CRITERI PER LA CLASSIFICAZIONE
IL MEDICO DI MEDICINA GENERALE E L ALLARME EBOLA: CLINICA E MANAGEMENT DELLE EPIDEMIE DEL TERZO MILLENNIO NEL SETTING DELLA MEDICINA GENERALE CORSO DI FORMAZIONE A DISTANZA I CRITERI PER LA CLASSIFICAZIONE
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. Impiegato ceppo equivalente a A/California/7/2009 (H1N1)pdm09 (NIB-74xp), derivato dal ceppo
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE FLUARIX sospensione iniettabile in siringa preriempita. Vaccino influenzale (virus frammentati, inattivati). 2. COMPOSIZIONE
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE FLUARIX sospensione iniettabile in siringa preriempita. Vaccino influenzale (virus frammentati, inattivati). 2. COMPOSIZIONE
STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE
 STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE Dott. ssa Annalisa Caravaggi Biologo Nutrizionista sabato 15 febbraio 14 STRESS: Forma di adattamento dell organismo a stimoli chiamati STRESSOR.
STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE Dott. ssa Annalisa Caravaggi Biologo Nutrizionista sabato 15 febbraio 14 STRESS: Forma di adattamento dell organismo a stimoli chiamati STRESSOR.
IPERTENSIONE IPERTENSIONE ARTERIOSA
 UNIVERSITA di FOGGIA C.D.L. in Dietistica AA. 2006-2007 IPERTENSIONE ARTERIOSA IPERTENSIONE L ipertensione è la più comune malattia cardiovascolare. Corso di Medicina Interna Docente: PROF. Gaetano Serviddio
UNIVERSITA di FOGGIA C.D.L. in Dietistica AA. 2006-2007 IPERTENSIONE ARTERIOSA IPERTENSIONE L ipertensione è la più comune malattia cardiovascolare. Corso di Medicina Interna Docente: PROF. Gaetano Serviddio
IL MEDICO DI MEDICINA GENERALE E LA NEFROPATIA DIABETICA: studio sui comportamenti prescrittivi diagnosticoterapeutici di un gruppo di medici genovesi
 Università degli Studi di Genova Facoltà di Medicina e Chirurgia IL MEDICO DI MEDICINA GENERALE E LA NEFROPATIA DIABETICA: studio sui comportamenti prescrittivi diagnosticoterapeutici di un gruppo di medici
Università degli Studi di Genova Facoltà di Medicina e Chirurgia IL MEDICO DI MEDICINA GENERALE E LA NEFROPATIA DIABETICA: studio sui comportamenti prescrittivi diagnosticoterapeutici di un gruppo di medici
Monitoraggio sulla conversione dei prezzi al consumo dalla Lira all Euro
 ISTAT 17 gennaio 2002 Monitoraggio sulla conversione dei prezzi al consumo dalla Lira all Euro Nell ambito dell iniziativa di monitoraggio, avviata dall Istat per analizzare le modalità di conversione
ISTAT 17 gennaio 2002 Monitoraggio sulla conversione dei prezzi al consumo dalla Lira all Euro Nell ambito dell iniziativa di monitoraggio, avviata dall Istat per analizzare le modalità di conversione
sembra una Anche qui sembra questione di sesso: Aspirina e donne
 sembra una Anche qui sembra questione di sesso: Aspirina e donne The Women s Health Study Razionale per l uso di bassi dosaggi di aspirina nella prevenzione primaria Nella prevenzione secondaria delle
sembra una Anche qui sembra questione di sesso: Aspirina e donne The Women s Health Study Razionale per l uso di bassi dosaggi di aspirina nella prevenzione primaria Nella prevenzione secondaria delle
Impara a riconoscere i segni e i fattori di rischio del diabete
 Diabete anche loro possono ammalarsi Impara a riconoscere i segni e i fattori di rischio del diabete Il diabete Il diabete mellito è una malattia caratterizzata da un aumento dei livelli di zucchero (glucosio)
Diabete anche loro possono ammalarsi Impara a riconoscere i segni e i fattori di rischio del diabete Il diabete Il diabete mellito è una malattia caratterizzata da un aumento dei livelli di zucchero (glucosio)
L Investigator s Brochure. Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari. Maglie 25 novembre 2004
 L Investigator s Brochure Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari Maglie 25 novembre 2004 Investigator s Brochure Good Clinical Practice DM 15/07/97 Cosa è? L IB è una raccolta
L Investigator s Brochure Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari Maglie 25 novembre 2004 Investigator s Brochure Good Clinical Practice DM 15/07/97 Cosa è? L IB è una raccolta
Le malattie cardiovascolari (MCV) sono la principale causa di morte nelle donne, responsabili del 54% dei decessi femminili in Europa
 Red Alert for Women s Heart Compendio DONNE E RICERCA CARDIOVASCOLARE Le malattie cardiovascolari (MCV) sono la principale causa di morte nelle donne, responsabili del 54% dei decessi femminili in Europa
Red Alert for Women s Heart Compendio DONNE E RICERCA CARDIOVASCOLARE Le malattie cardiovascolari (MCV) sono la principale causa di morte nelle donne, responsabili del 54% dei decessi femminili in Europa
Il programma si compone di due ricerche internazionali sulle valutazioni legate all assistenza degli individui affetti da tali patologie.
 Keeping Care Complete Sintesi dei risultati internazionali Keeping Care Complete ha l obiettivo di esaminare e creare consapevolezza circa le questioni emotive e sociali associate al trattamento e all
Keeping Care Complete Sintesi dei risultati internazionali Keeping Care Complete ha l obiettivo di esaminare e creare consapevolezza circa le questioni emotive e sociali associate al trattamento e all
La valutazione del rischio chimico
 La valutazione del rischio chimico Introduzione Per sua stessa definizione, l agente chimico è una sostanza o un preparato di natura chimica. L agente chimico può presentarsi sotto forma di gas, vapore,
La valutazione del rischio chimico Introduzione Per sua stessa definizione, l agente chimico è una sostanza o un preparato di natura chimica. L agente chimico può presentarsi sotto forma di gas, vapore,
COMUNE DI RAVENNA GUIDA ALLA VALUTAZIONE DELLE POSIZIONI (FAMIGLIE, FATTORI, LIVELLI)
 COMUNE DI RAVENNA Il sistema di valutazione delle posizioni del personale dirigente GUIDA ALLA VALUTAZIONE DELLE POSIZIONI (FAMIGLIE, FATTORI, LIVELLI) Ravenna, Settembre 2004 SCHEMA DI SINTESI PER LA
COMUNE DI RAVENNA Il sistema di valutazione delle posizioni del personale dirigente GUIDA ALLA VALUTAZIONE DELLE POSIZIONI (FAMIGLIE, FATTORI, LIVELLI) Ravenna, Settembre 2004 SCHEMA DI SINTESI PER LA
Espressione di geni specifici per un determinato tumore
 Espressione di geni specifici per un determinato tumore Paziente A: Non ha il cancro Espressione dei geni: Nessuna Biopsia Geni associati al cancro allo stomaco Paziente B: Ha un tumore allo stomaco Bassa
Espressione di geni specifici per un determinato tumore Paziente A: Non ha il cancro Espressione dei geni: Nessuna Biopsia Geni associati al cancro allo stomaco Paziente B: Ha un tumore allo stomaco Bassa
DISTURBI AFFETTIVI. Dr. Alessandro Bernardini
 HOME DISTURBI AFFETTIVI Dr. Alessandro Bernardini La caratteristica principale delle patologie emotive ed affettive è rappresentata dall'alterazione del tono dell'umore. La manifestazione più comune è
HOME DISTURBI AFFETTIVI Dr. Alessandro Bernardini La caratteristica principale delle patologie emotive ed affettive è rappresentata dall'alterazione del tono dell'umore. La manifestazione più comune è
Igiene. Dott. Pamela Di Giovanni. Definizione
 Igiene Dott. Pamela Di Giovanni Definizione Disciplina medica che ha come obiettivo la tutela e la promozione della salute umana, intendendo per salute umana un completo stato di benessere psichico, fisico
Igiene Dott. Pamela Di Giovanni Definizione Disciplina medica che ha come obiettivo la tutela e la promozione della salute umana, intendendo per salute umana un completo stato di benessere psichico, fisico
EVENTI AVVERSI ED INTERAZIONE TRA FARMACI
 Organizzatore: J&B S.R.L. Unipersonale Indirizzo: VIA PIEMONTE 12 Città: 87036 RENDE (CS) Telefono: 0984/837852 Fax: 0984/830987 Referente: Dott. DANIELE PERRELLI - WEB - www.jbprof.com info@jbprof.com
Organizzatore: J&B S.R.L. Unipersonale Indirizzo: VIA PIEMONTE 12 Città: 87036 RENDE (CS) Telefono: 0984/837852 Fax: 0984/830987 Referente: Dott. DANIELE PERRELLI - WEB - www.jbprof.com info@jbprof.com
Attività fisica_raccomandazioni progetto cuore
 Attività fisica_raccomandazioni progetto cuore Attività fisica_raccomandazioni progetto cuore Attività fisica_raccomandazioni progetto cuore Attività fisica_esercizio aerobico Aiuta mantenere peso ideale
Attività fisica_raccomandazioni progetto cuore Attività fisica_raccomandazioni progetto cuore Attività fisica_raccomandazioni progetto cuore Attività fisica_esercizio aerobico Aiuta mantenere peso ideale
La manutenzione come elemento di garanzia della sicurezza di macchine e impianti
 La manutenzione come elemento di garanzia della sicurezza di macchine e impianti Alessandro Mazzeranghi, Rossano Rossetti MECQ S.r.l. Quanto è importante la manutenzione negli ambienti di lavoro? E cosa
La manutenzione come elemento di garanzia della sicurezza di macchine e impianti Alessandro Mazzeranghi, Rossano Rossetti MECQ S.r.l. Quanto è importante la manutenzione negli ambienti di lavoro? E cosa
Trials clinici. Disegni di studio
 Trials Clinici Dott.ssa Pamela Di Giovanni Studi descrittivi Disegni di studio Popolazioni Individui Studi analitici Osservazionali Sperimentali Studi di correlazione o ecologici Case report - Case series
Trials Clinici Dott.ssa Pamela Di Giovanni Studi descrittivi Disegni di studio Popolazioni Individui Studi analitici Osservazionali Sperimentali Studi di correlazione o ecologici Case report - Case series
Azioni neuroendocrine Apparato riproduttivo Sistema nervoso centrale
 1 I progestinici sono composti con attività simile a quella del progesterone e includono il progesterone e agenti simili come il medrossiprogesterone acetato (pregnani), agenti simili al 19-nortestosterone
1 I progestinici sono composti con attività simile a quella del progesterone e includono il progesterone e agenti simili come il medrossiprogesterone acetato (pregnani), agenti simili al 19-nortestosterone
AIFA Agenzia Italiana del Farmaco Valproato
 AIFA - Valproato 18/12/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Valproato Rivalutazione CHMP file:///c /documenti/val9510.htm [18/12/2009 12.44.38] Domande e risposte sulla rivalutazione dei
AIFA - Valproato 18/12/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Valproato Rivalutazione CHMP file:///c /documenti/val9510.htm [18/12/2009 12.44.38] Domande e risposte sulla rivalutazione dei
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 Versione: 001392_005259_RCP.doc Documento reso disponibile da AIFA il 10/06/2016 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Calcium Sandoz 1000 mg granulato effervescente
Versione: 001392_005259_RCP.doc Documento reso disponibile da AIFA il 10/06/2016 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Calcium Sandoz 1000 mg granulato effervescente
I Papillomavirus sono tutti uguali?
 Cos è il Papillomavirus? Il Papillomavirus è un microscopico nemico della tua salute. Attento, però, a non sottovalutare la pericolosità di questo microrganismo lungo solo 55 milionesimi di millimetro.
Cos è il Papillomavirus? Il Papillomavirus è un microscopico nemico della tua salute. Attento, però, a non sottovalutare la pericolosità di questo microrganismo lungo solo 55 milionesimi di millimetro.
MALATTIE INFIAMMATORIE CRONICHE INTESTINALI (IBD) E GRAVIDANZA
 MALATTIE INFIAMMATORIE CRONICHE INTESTINALI (IBD) E GRAVIDANZA Di cosa parleremo? Potrò concepire e avere figli come tutte le altre persone? Influenza della gravidanza sul decorso della malattia e influenza
MALATTIE INFIAMMATORIE CRONICHE INTESTINALI (IBD) E GRAVIDANZA Di cosa parleremo? Potrò concepire e avere figli come tutte le altre persone? Influenza della gravidanza sul decorso della malattia e influenza
Lezione 1. Obiettivi prestazionali e normativa vigente. Laboratorio progettuale (Tecnica delle Costruzioni)
 Lezione 1 Obiettivi prestazionali e normativa vigente Laboratorio progettuale (Tecnica delle Costruzioni) Obiettivi prestazionali Obiettivi progettuali Sono definiti dall associazione associazione tra
Lezione 1 Obiettivi prestazionali e normativa vigente Laboratorio progettuale (Tecnica delle Costruzioni) Obiettivi prestazionali Obiettivi progettuali Sono definiti dall associazione associazione tra
REGOLAMENTO (UE) N. 1235/2011 DELLA COMMISSIONE
 30.11.2011 Gazzetta ufficiale dell Unione europea L 317/17 REGOLAMENTO (UE) N. 1235/2011 DELLA COMMISSIONE del 29 novembre 2011 recante modifica del regolamento (CE) n. 1222/2009 del Parlamento europeo
30.11.2011 Gazzetta ufficiale dell Unione europea L 317/17 REGOLAMENTO (UE) N. 1235/2011 DELLA COMMISSIONE del 29 novembre 2011 recante modifica del regolamento (CE) n. 1222/2009 del Parlamento europeo
Sistema Informativo per il monitoraggio dell Assistenza Domiciliare (SIAD)
 Sistema Informativo per il monitoraggio dell Assistenza Domiciliare (SIAD) INDICATORI SIAD - SISTEMA ASSISTENZA DOMICILIARE Schede descrittive degli Indicatori per la lettura integrata dei fenomeni sanitari
Sistema Informativo per il monitoraggio dell Assistenza Domiciliare (SIAD) INDICATORI SIAD - SISTEMA ASSISTENZA DOMICILIARE Schede descrittive degli Indicatori per la lettura integrata dei fenomeni sanitari
INFORMAZIONE AI LAVORATORI/ UTENTI DEL COLLEGIO. PROCEDURE DI SICUREZZA: RISCHIO CHIMICO dovuto all uso di stampanti e toner
 PROCEDURE DI SICUREZZA: RISCHIO CHIMICO dovuto all uso di stampanti e toner Procedure di sicurezza: RISCHIO CHIMICO DOVUTO ALL USO DI STAMPANTI E TONER Autore: IEC S.r.l. Revisione: settembre 2014 INDICE
PROCEDURE DI SICUREZZA: RISCHIO CHIMICO dovuto all uso di stampanti e toner Procedure di sicurezza: RISCHIO CHIMICO DOVUTO ALL USO DI STAMPANTI E TONER Autore: IEC S.r.l. Revisione: settembre 2014 INDICE
IL DIMENSIONAMENTO DEGLI IMPIANTI IDROSANITARI Miscelatori e riduttori di pressione
 FOCUS TECNICO IL DEGLI IMPIANTI IDROSANITARI Miscelatori e riduttori di pressione CRITERI DI CALCOLO DELLA PORTATA DI PROGETTO Lo scopo principale del dimensionamento di una rete idrica è quello di assicurare
FOCUS TECNICO IL DEGLI IMPIANTI IDROSANITARI Miscelatori e riduttori di pressione CRITERI DI CALCOLO DELLA PORTATA DI PROGETTO Lo scopo principale del dimensionamento di una rete idrica è quello di assicurare
Documento PTR n.212 relativo a:
 Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n.212 relativo a: PAZOPANIB Aprile 2014 Pazopanib Indicazioni registrate
Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n.212 relativo a: PAZOPANIB Aprile 2014 Pazopanib Indicazioni registrate
Diabete Mellito 'insulina pancreas un aumento dell appetito accompagnato da una perdita di peso corporeo aumentare la diuresi della sete
 Diabete Mellito Il Diabete mellito è una comune malattia endocrina causata da una carenza relativa o assoluta di insulina. L'insulina è un ormone prodotto da particolari cellule del pancreas (cellule beta)
Diabete Mellito Il Diabete mellito è una comune malattia endocrina causata da una carenza relativa o assoluta di insulina. L'insulina è un ormone prodotto da particolari cellule del pancreas (cellule beta)
Criteri di selezione del collettivo e definizioni
 Appendice A Criteri di selezione del collettivo e definizioni Introduzione L indagine sull integrazione sociale delle persone con disabilità è stata realizzata nell ambito del progetto Sistema di Informazione
Appendice A Criteri di selezione del collettivo e definizioni Introduzione L indagine sull integrazione sociale delle persone con disabilità è stata realizzata nell ambito del progetto Sistema di Informazione
IL COLLAUDO DI ACCETTAZIONE
 IL COLLAUDO DI ACCETTAZIONE Il collaudo di accettazione 1 Popolazione Campione Dati MISURA Processo Lotto Campione DATI CAMPIONAMENTO INTERVENTO MISURA Lotto Campione DATI CAMPIONAMENTO INTERVENTO Il collaudo
IL COLLAUDO DI ACCETTAZIONE Il collaudo di accettazione 1 Popolazione Campione Dati MISURA Processo Lotto Campione DATI CAMPIONAMENTO INTERVENTO MISURA Lotto Campione DATI CAMPIONAMENTO INTERVENTO Il collaudo
Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas
 1 Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas Capitolo 7 Enzimi, le macchine della vita Piccole macchine regolano la funzione del corpo umano in un orchestrazione perfetta e a velocità
1 Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas Capitolo 7 Enzimi, le macchine della vita Piccole macchine regolano la funzione del corpo umano in un orchestrazione perfetta e a velocità
Informazioni per potenziali partecipanti. Possiamo sciogliere l'amiloidosi AL?
 Informazioni per potenziali partecipanti Possiamo sciogliere l'amiloidosi AL? È ora di affrontare diversamente l amiloidosi AL? L amiloidosi AL è una malattia rara e spesso fatale causata dall accumulo
Informazioni per potenziali partecipanti Possiamo sciogliere l'amiloidosi AL? È ora di affrontare diversamente l amiloidosi AL? L amiloidosi AL è una malattia rara e spesso fatale causata dall accumulo
AIFA Agenzia Italiana del Farmaco Sirolimus (Rapamune)
 AIFA - Sirolimus (Rapamune) 08/02/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Sirolimus (Rapamune) Nota Informativa Importante (08 Febbraio 2010) file:///c /documenti/sir653.htm [08/02/2010 10.47.36]
AIFA - Sirolimus (Rapamune) 08/02/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Sirolimus (Rapamune) Nota Informativa Importante (08 Febbraio 2010) file:///c /documenti/sir653.htm [08/02/2010 10.47.36]
Le interazioni farmacologiche come causa di reazioni avverse da farmaci
 Le interazioni farmacologiche come causa di reazioni avverse da farmaci Corso per farmacisti operanti nei punti di erogazione diretta delle Aziende Sanitarie della Regione Emilia-Romagna AUSL Piacenza
Le interazioni farmacologiche come causa di reazioni avverse da farmaci Corso per farmacisti operanti nei punti di erogazione diretta delle Aziende Sanitarie della Regione Emilia-Romagna AUSL Piacenza
Soluzione Spot on per Cani e Gatti con FIPRONIL. Per il trattamento delle infestazioni da pulci e zecche
 Soluzione Spot on per Cani e Gatti con FIPRONIL Per il trattamento delle infestazioni da pulci e zecche Le PULCI possono rappresentare un vero disturbo per il tuo animale, tormentandolo senza tregua e
Soluzione Spot on per Cani e Gatti con FIPRONIL Per il trattamento delle infestazioni da pulci e zecche Le PULCI possono rappresentare un vero disturbo per il tuo animale, tormentandolo senza tregua e
