Isomerie. Isomeri sono composti (non elementi) aventi la stessa composizione stechiometrica e
|
|
|
- Cristoforo Valentini
- 5 anni fa
- Visualizzazioni
Transcript
1 Isomerie Isomeri sono composti (non elementi) aventi la stessa composizione stechiometrica e uguale massa molare. Isotopomeri sono composti (non elementi) aventi la stessa composizione stechiometrica ma diversa massa molare, poiché hanno una diversa composizione isotopica. 1. Isomeria strutturale o costituzionale (stessa formula empirica, ma diversa sequenza delle connessioni atomiche) C 4 H 8 : 1-butene 2-butene 2. Isomeria configurazionale o stereoisomeria (stessa formula empirica e stessa sequenza delle connessioni atomiche, ma diversa distribuzione spaziale) isomeri geometrici C 4 H 8 : cis-2-butene trans-2-butene isomeri conformazionali (conformeri) C 6 H 12 : cicloesano a sedia, twist, barca isomeri ottici (enantiomeri) C 6 H 13 Br : R-3-bromo-2-metilpentano S-3-bromo-2-metilpentano
2 Isomeria strutturale o costituzionale Isomeria di coordinazione si ha in sali in cui sia il catione che l anione sono complessi e deriva da una diversa distribuzione di leganti tra catione e anione uguale metallo nello stesso stato di ossidazione [Cr(NH 3 ) 6 ] 3+ [Cr(NCS) 6 ] 3- [Cr(NCS) 2 (NH 3 ) 4 ] + [Cr(NCS) 4 (NH 3 ) 2 ] - uguale metallo in diverso stato di ossidazione [Pt II (NH 3 ) 4 ] 2+ [Pt IV Cl 6 ] 2- [Pt IV Cl 2 (NH 3 ) 4 ] 2+ [Pt II Cl 4 ] 2- metalli diversi [Co(NH 3 ) 6 ] 3+ [Cr(CN) 6 ] 3- [Cr(NH 3 ) 6 ] 3+ [Co(CN) 6 ] 3-
3 Isomeria di polimerizzazione (caso particolare di isomeria di coordinazione) si ha in composti la cui formulazione può essere un multiplo di una certa formula minima [Co(NO 2 ) 3 (NH 3 ) 3 ] [Co(NH 3 ) 6 ] 3+ [Co(NO 2 ) 6 ] 3- [Co(NO 2 )(NH 3 ) 5 ] 2+ [Co(NO 2 ) 4 (NH 3 ) 2 ] 2 [PtCl 2 (NH 3 ) 2 ] [Pt(NH 3 ) 4 ] 2+ [PtCl 4 ] 2- [PtCl(NH 3 ) 3 ] + [PtCl 3 (NH 3 )] - [Pt(NH 3 ) 4 ] 2+ [PtCl 3 (NH 3 )] - 2 [PtCl(NH 3 ) 3 ] + 2[PtCl 4 ] 2-
4 Isomeria di posizione di coordinazione (caso particolare di isomeria di coordinazione) si ha in complessi bimetallici e deriva da una diversa distribuzione dei leganti tra i due centri metallici [Co(NH 3 ) 4 (μ 2 -OH) 2 CoCl 2 (NH 3 ) 2 ] 2+ [CoCl(NH 3 ) 3 (μ 2 -OH) 2 CoCl(NH 3 ) 3 ] 2+
5 Isomeria di ionizzazione si ha in sali in cui c è una diversa distribuzione dei leganti ionici tra quelli coordinati e quelli che fanno semplicemente da controione N.B. i diversi isomeri sono distinguibili mediante reazioni di precipitazione e/o mediante misure di conducibilità molare (Λ M ) [CoBr(NH 3 ) 5 ](SO 4 ) [CoCl 2 (en) 2 ](NO 2 ) [Co(SO 4 )(NH 3 ) 5 ]Br [CoCl(NO 2 )(en) 2 ]Cl [CoCl(NO 2 )(en) 2 ](NCS) [CoCl(NCS)(en) 2 ](NO 2 ) [Co(NCS)(NO 2 )(en) 2 ]Cl
6 Isomeria di idratazione (caso particolare di isomeria di ionizzazione) si ha in sali in cui c è una diversa distribuzione delle molecole di acqua tra quelle coordinate e quelle presenti semplicemente nel reticolo cristallino N.B. i diversi isomeri sono distinguibili mediante reazioni di precipitazione e/o mediante misure di conducibilità molare (Λ M ) [CrCl 2 (H 2 O) 4 ]Cl 2 H 2 O [CrCl(H 2 O) 5 ]Cl 2 H 2 O [Cr(H 2 O) 6 ]Cl 3 verde verde-blu violetto
7 Isomeria di legante : si ha in complessi in cui i leganti sono diversi (isomeri) e la composizione stechiometrica dei composti è la stessa, C 3 H 10 N 2 : NH 2 -CH 2 -CH(NH 2 )-CH 3 (1,2-diamminopropano) NH 2 -CH 2 -CH 2 -CH 2 -NH 2 (1,3-diamminopropano) [CoCl 2 (1,2-C 3 H 10 N 2 ) 2 ] + [CoCl 2 (1,3-C 3 H 10 N 2 ) 2 ] + Isomeria di legante : si ha in complessi in cui i leganti sono diversi (non isomeri) ma la composizione stechiometrica dei composti è la stessa, [Cr(η 6 -C 6 H 6 ) 2 ] [Cr(η 5 -C 5 H 5 )(η 7 -C 7 H 7 )]
8 Isomeria di legame : si ha in complessi in cui i leganti sono ambidentati (leganti che possiedono almeno due atomi donatori di elementi diversi), SCN - ; NO 2 - ; S 2 O 3 2- ; OCN - ; CN - [Co(NO 2 -O)(NH 3 ) 5 ] 2+ [Co(NO 2 -N)(NH 3 ) 5 ] 2+ [Co(NCS-N)(CN) 5 ] 3- [Co(SCN-S)(CN) 5 ] 3- Isomeria di legame (aptomeria) : si ha in complessi in cui i leganti sono composti aromatici policiclici (leganti che possiedono due o più apticità stereochimicamente diverse tra loro), C 9 H 8 (indene) [Cr(4,5,6,7,8,9-η 6 -C 9 H 8 )(CO) 3 ] [Cr(2,3,8,9-η 4 -C 9 H 8 )(CO) 3 ]
9 Controllo π nell isomeria di legame in complessi quadrato-planari (effetto antisimbiotico) [Pd((NCS-N)(SCN-S)(NMe 2 CH 2 CH 2 CH 2 PPh 2 )] NCS è lineare (N sp) con un interazione σ con il Pd, in trans all atomo donatore (P sp 3 ) che ha un interazione π (d π - d π ) con il Pd SCN è piegato (S sp 3 ) con un interazione π con il Pd, in trans all atomo donatore (N sp 3 ) che ha un interazione σ con il Pd Controllo σ + π nell isomeria di legame in complessi ottaedrici (effetto simbiotico) tutti i leganti hard in [Co(NCS)(NH 3 ) 5 ] 2+, [Fe(NCSe) 4 ] 2- tutti i leganti soft in [Co(SCN)(CN) 5 ] 3-, [Fe(SeCN)(η 5 -cp)(co) 2 ]
10 Controllo cinetico (K) -termodinamico (T) nella formazione di isomeri
Formula. nei composti ionici: prima la formula del catione, poi dell anione. (qualora venga indicato solamente il complesso e non tutto il composto)
 Formula nei composti ionici: prima la formula del catione, poi dell anione nei composti non ionici: formula unica formula del complesso tra parentesi [ ] con la carica in alto a destra, (qualora venga
Formula nei composti ionici: prima la formula del catione, poi dell anione nei composti non ionici: formula unica formula del complesso tra parentesi [ ] con la carica in alto a destra, (qualora venga
Esercizi sui Complessi Metallici
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Complessi Metallici Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizi
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Complessi Metallici Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizi
Anno Accademico
 Anno Accademico 2011-12 A. CERIOTTI Complesso Definizione: è una specie chimica (neutra o carica) in cui un atomo centrale (metallo di transizione o elemento non di transizione) è circondato da altri atomi
Anno Accademico 2011-12 A. CERIOTTI Complesso Definizione: è una specie chimica (neutra o carica) in cui un atomo centrale (metallo di transizione o elemento non di transizione) è circondato da altri atomi
Chimica Inorganica Biologica Composti di coordinazione
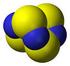 Nomenclatura Chimica Inorganica Biologica Si nomina prima il catione e poi l anione Si nominano i leganti in ordine alfabetico I nomi dei leganti anionici terminano in -o I leganti neutri mantengono il
Nomenclatura Chimica Inorganica Biologica Si nomina prima il catione e poi l anione Si nominano i leganti in ordine alfabetico I nomi dei leganti anionici terminano in -o I leganti neutri mantengono il
Chimica Inorganica Biologica Composti di coordinazione. Simmetria Ottaedrica
 Simmetria Ottaedrica Simmetria Ottaedrica Simmetria Ottaedrica L E media degli orbitali d rimane invariata Δ O = 10 Dq [Ti(H 2 O) 6 ] 3+ Ti 3+ d 1 Simmetria Ottaedrica Δ o Δ ο = hν 20300cm 1 Simmetria
Simmetria Ottaedrica Simmetria Ottaedrica Simmetria Ottaedrica L E media degli orbitali d rimane invariata Δ O = 10 Dq [Ti(H 2 O) 6 ] 3+ Ti 3+ d 1 Simmetria Ottaedrica Δ o Δ ο = hν 20300cm 1 Simmetria
Complessi con gruppi M-O 2
 Complessi con gruppi M-O 2 complessi in cui sono presenti formalmente, come leganti, le specie ridotte dell ossigeno molecolare O 2 (12e - ), ossia: O 2 - (13e - ) legante ione superossido ; O 2 2- (14e
Complessi con gruppi M-O 2 complessi in cui sono presenti formalmente, come leganti, le specie ridotte dell ossigeno molecolare O 2 (12e - ), ossia: O 2 - (13e - ) legante ione superossido ; O 2 2- (14e
Anno Accademico parte seconda A. CERIOTTI
 Anno Accademico 2011-12 parte seconda A. CERIOTTI CuCO 3 Cu(O) 2 + 2 Cu + 4 PF 6 + 16 C 3 C 4 [Cu(C 3 C) 4 ][PF 6 ] + 3 2 O + CO 2 Legante acetonitrile: C-C 3 Stato di ossidazione formale: Cu (+1) Configurazione
Anno Accademico 2011-12 parte seconda A. CERIOTTI CuCO 3 Cu(O) 2 + 2 Cu + 4 PF 6 + 16 C 3 C 4 [Cu(C 3 C) 4 ][PF 6 ] + 3 2 O + CO 2 Legante acetonitrile: C-C 3 Stato di ossidazione formale: Cu (+1) Configurazione
Teoria del campo cristallino corretta (ACFT) (Teoria del campo dei leganti)
 Teoria del campo cristallino corretta (ACFT) (Teoria del campo dei leganti) la teoria del campo cristallino (CFT) adotta un modello fisico irreale considerando i leganti come cariche puntiformi un modello
Teoria del campo cristallino corretta (ACFT) (Teoria del campo dei leganti) la teoria del campo cristallino (CFT) adotta un modello fisico irreale considerando i leganti come cariche puntiformi un modello
Complessi polienici. polieni non coniugati : coordinazione al metallo di parte o di tutti i. metallo secondo lo schema visto per le monoolefine.
 Complessi polienici polieni non coniugati : coordinazione al metallo di parte o di tutti i legami π dell olefina; ogni doppio legame è un interazione a sé con il metallo secondo lo schema visto per le
Complessi polienici polieni non coniugati : coordinazione al metallo di parte o di tutti i legami π dell olefina; ogni doppio legame è un interazione a sé con il metallo secondo lo schema visto per le
Complessi benzenici. difenile, presente anche in anelli condensati, es. naftalene, fenantrene.
 Complessi benzenici il legante è l anello benzenico [C 6 R 6 ], es. benzene, 1,3,5-trimetilbenzene, difenile, presente anche in anelli condensati, es. naftalene, fenantrene. i complessi benzenici possono
Complessi benzenici il legante è l anello benzenico [C 6 R 6 ], es. benzene, 1,3,5-trimetilbenzene, difenile, presente anche in anelli condensati, es. naftalene, fenantrene. i complessi benzenici possono
Ione cianuro, CN - monodentato, si coordina tramite l atomo di C (coppia elettronica più
 Ione cianuro, CN - come donatore (base) σ è più forte del CO; quando agisce da legante monodentato, si coordina tramite l atomo di C (coppia elettronica più disponibile); (donatore di 2e - come anione,
Ione cianuro, CN - come donatore (base) σ è più forte del CO; quando agisce da legante monodentato, si coordina tramite l atomo di C (coppia elettronica più disponibile); (donatore di 2e - come anione,
Complessi alcossidici e arilossidici
 Complessi alcossidici e arilossidici gli ioni metallici in alcool sono solvatati a dare complessi che possono esistere come alcosso-complessi secondo l equilibrio di dissociazione: M n+ (ROH) [M(OR)] (n-1)+
Complessi alcossidici e arilossidici gli ioni metallici in alcool sono solvatati a dare complessi che possono esistere come alcosso-complessi secondo l equilibrio di dissociazione: M n+ (ROH) [M(OR)] (n-1)+
Leganti. Un legante è una qualsiasi molecola o ione che abbia almeno un doppietto di
 Leganti Un legante è una qualsiasi molecola o ione che abbia almeno un doppietto di elettroni disponibile per una donazione. N.B. Il doppietto elettronico può essere già presente sull atomo donatore (es.
Leganti Un legante è una qualsiasi molecola o ione che abbia almeno un doppietto di elettroni disponibile per una donazione. N.B. Il doppietto elettronico può essere già presente sull atomo donatore (es.
Roberta Pierattelli. Metalli in Biologia. Qualche richiamo di chimica generale e inorganica
 Roberta Pierattelli Metalli in Biologia Qualche richiamo di chimica generale e inorganica Le proprietà periodiche n =1 n =2 n =3 n =4 n =5 n =6 n =7 Il numero del gruppo corrisponde alla somma degli elettroni
Roberta Pierattelli Metalli in Biologia Qualche richiamo di chimica generale e inorganica Le proprietà periodiche n =1 n =2 n =3 n =4 n =5 n =6 n =7 Il numero del gruppo corrisponde alla somma degli elettroni
I Composti di Coordinazione
 I Composti di Coordinazione COMPLESSI perché sembrano non ubbidire alle usuali regole di valenza Identificati dalla fine del XIX secolo da Alfred Werner (premio Nobel per la chimica nel 1913) Egli combinò
I Composti di Coordinazione COMPLESSI perché sembrano non ubbidire alle usuali regole di valenza Identificati dalla fine del XIX secolo da Alfred Werner (premio Nobel per la chimica nel 1913) Egli combinò
Stato di ossidazione formale del metallo
 Stato di ossidazione formale del metallo i metalli di transizione possono dare composti in cui il metallo si trova in stato di ossidazione formale variabile, da +8, [RuO 4 ], a 4, [Cr(CO) 4 ] 4- la carica
Stato di ossidazione formale del metallo i metalli di transizione possono dare composti in cui il metallo si trova in stato di ossidazione formale variabile, da +8, [RuO 4 ], a 4, [Cr(CO) 4 ] 4- la carica
Anno Accademico parte seconda A. CERIOTTI
 Anno Accademico 2011-12 parte seconda A. CERIOTTI CuCO 3 Cu(O) 2 + 2 Cu + 4 PF 6 + 16 C 3 C 4 [Cu(C 3 C) 4 ][PF 6 ] + 3 2 O + CO 2 Legante acetonitrile: C-C 3 Stato di ossidazione formale: Cu (+1) Configurazione
Anno Accademico 2011-12 parte seconda A. CERIOTTI CuCO 3 Cu(O) 2 + 2 Cu + 4 PF 6 + 16 C 3 C 4 [Cu(C 3 C) 4 ][PF 6 ] + 3 2 O + CO 2 Legante acetonitrile: C-C 3 Stato di ossidazione formale: Cu (+1) Configurazione
Complessi π. Complessi alchenici (monoolefine)
 Complessi π Sono complessi in cui molecole insature usano, per l interazione con il metallo, orbitali molecolari π-leganti per la donazione L M e π*- antileganti per la retrodonazione M L. Complessi alchenici
Complessi π Sono complessi in cui molecole insature usano, per l interazione con il metallo, orbitali molecolari π-leganti per la donazione L M e π*- antileganti per la retrodonazione M L. Complessi alchenici
Corso di Laurea in Chimica e Tecnologia Farmaceutiche Esame di Complementi di Chimica 23 Giugno nome e cognome... matricola...
 Esame di Complementi di Chimica 23 Giugno 211 1) Nei complessi ottaedrici di Pd(IV) (per il palladio Z = 46) la separazione energetica degli orbitali d (indicata con Δ o ) dovuta al campo cristallino è
Esame di Complementi di Chimica 23 Giugno 211 1) Nei complessi ottaedrici di Pd(IV) (per il palladio Z = 46) la separazione energetica degli orbitali d (indicata con Δ o ) dovuta al campo cristallino è
Cr Mn Fe Co Ni Cu Zn. Chimica Inorganica Biologica Vita ed Energia
 Vita ed Energia I processi chimici alla base della chimica della vita sono due: Uso dell E solare per produrre materia e O 2 da CO 2 e H 2 O Produzione di E mediante ossidazione di materia con formazione
Vita ed Energia I processi chimici alla base della chimica della vita sono due: Uso dell E solare per produrre materia e O 2 da CO 2 e H 2 O Produzione di E mediante ossidazione di materia con formazione
Corso di Laurea in Chimica e Tecnologia Farmaceutiche Esame di Complementi di Chimica 17 Giugno nome e cognome... matricola...
 Esame di Complementi di Chimica 17 Giugno 21 1) Si supponga che il coefficiente di ripartizione K D fra CCl 4 e H 2 O per una sostanza x abbia un valore di 5. Partendo da.1 L di fase acquosa, contenente
Esame di Complementi di Chimica 17 Giugno 21 1) Si supponga che il coefficiente di ripartizione K D fra CCl 4 e H 2 O per una sostanza x abbia un valore di 5. Partendo da.1 L di fase acquosa, contenente
Corso di Laurea in Chimica e Tecnologia Farmaceutiche Esame di Complementi di Chimica 18 Giugno nome e cognome... matricola...
 Esame di Complementi di Chimica 18 Giugno 28 3) E' consentito soltanto l'uso della calcolatrice e della tavola periodica. Appunti e testi vanno consegnati. 5) Firmare l'apposito foglio alla consegna del
Esame di Complementi di Chimica 18 Giugno 28 3) E' consentito soltanto l'uso della calcolatrice e della tavola periodica. Appunti e testi vanno consegnati. 5) Firmare l'apposito foglio alla consegna del
Corso di Laurea in Chimica e Tecnologia Farmaceutiche Esame di Complementi di Chimica 21 Giugno nome e cognome... matricola...
 Esame di Complementi di Chimica 21 Giugno 212 1) Fornire il nome e descrivere la configurazione elettronica dei complessi K 3 [Mn(CN) 6 ] e [Mn(H 2 O) 6 ]PO 4 (per Mn numero atomico = 25). Dire inoltre
Esame di Complementi di Chimica 21 Giugno 212 1) Fornire il nome e descrivere la configurazione elettronica dei complessi K 3 [Mn(CN) 6 ] e [Mn(H 2 O) 6 ]PO 4 (per Mn numero atomico = 25). Dire inoltre
Numeri di coordinazione e relative geometrie
 Numeri di coordinazione e relative geometrie Il numero di atomi legati direttamente ad un atomo è il numero di coordinazione di quell atomo, che può far parte di un complesso, di un composto oppure far
Numeri di coordinazione e relative geometrie Il numero di atomi legati direttamente ad un atomo è il numero di coordinazione di quell atomo, che può far parte di un complesso, di un composto oppure far
La isomeria in Chimica Organica
 La isomeria in himica Organica isomeri composti differenti con la stessa formula molecolare (bruta) costituzionali isomeri i cui atomi sono connessi in modi diversi stereoisomeri P.es.: butano, 2-metil-propano
La isomeria in himica Organica isomeri composti differenti con la stessa formula molecolare (bruta) costituzionali isomeri i cui atomi sono connessi in modi diversi stereoisomeri P.es.: butano, 2-metil-propano
Legami multipli M=L e M L
 Legami multipli M=L e M L con leganti carbonilici e nitrosilici (L = CO, NO) l ordine di legame formale M-C e M-N varia tra 1 e 2. con altri leganti (L = O, S, NR nitreni, N, CR 2 carbeni, CR carbini)
Legami multipli M=L e M L con leganti carbonilici e nitrosilici (L = CO, NO) l ordine di legame formale M-C e M-N varia tra 1 e 2. con altri leganti (L = O, S, NR nitreni, N, CR 2 carbeni, CR carbini)
COMPLESSI DEI METALLI DI TRANSIZIONE LEZIONE 7
 COMPLESSI DEI METALLI DI TRANSIZIONE LEZIONE 7 METALLI DI TRANSIZIONE Elementi che formano almeno uno ione con un sottoguscio d parzialmente riempito di elettroni Configurazione elettronica (n-1)d x ns
COMPLESSI DEI METALLI DI TRANSIZIONE LEZIONE 7 METALLI DI TRANSIZIONE Elementi che formano almeno uno ione con un sottoguscio d parzialmente riempito di elettroni Configurazione elettronica (n-1)d x ns
02/10/2018. di catena. di posizione. strutturali. di gruppo funzionale. isomeri. geometrici. stereoisomeri. ottici
 Quando due composti organici sono costituiti dagli stessi atomi ma possiedono una struttura differente si definiscono ISOMERI. Esistono diversi tipi di isomeria: di catena strutturali di posizione isomeri
Quando due composti organici sono costituiti dagli stessi atomi ma possiedono una struttura differente si definiscono ISOMERI. Esistono diversi tipi di isomeria: di catena strutturali di posizione isomeri
REAZIONI DEGLI ALCHENI
 REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
Chimica Inorganica Biologica I composti di coordinazione Richiami di Chimica - Acidi e Basi di Lewis
 I composti di coordinazione Richiami di Chimica - Acidi e Basi di Lewis Acido (LA) Base (LB) accettore di una coppia di elettroni donatore di una coppia di elettroni HOMO LUMO Highest Occupied Molecular
I composti di coordinazione Richiami di Chimica - Acidi e Basi di Lewis Acido (LA) Base (LB) accettore di una coppia di elettroni donatore di una coppia di elettroni HOMO LUMO Highest Occupied Molecular
Corso di Laurea in Chimica e Tecnologia Farmaceutiche Esame di Complementi di Chimica 21 Giugno 2013 COMPITO A. nome e cognome... matricola...
 Esame di Complementi di Chimica 21 Giugno 213 COMPITO A 1) Nei complessi ottaedrici di Pd(IV) (per il palladio Z = 46) la separazione energetica degli orbitali d (indicata con o ) dovuta al campo cristallino
Esame di Complementi di Chimica 21 Giugno 213 COMPITO A 1) Nei complessi ottaedrici di Pd(IV) (per il palladio Z = 46) la separazione energetica degli orbitali d (indicata con o ) dovuta al campo cristallino
Isomeria configurazionale o stereoisomeria
 Isomeria configurazionale o stereoisomeria Tale isomeria si ha in complessi che hanno la stessa formula empirica e la stessa sequenza delle connessioni atomiche, ma diversa distribuzione spaziale degli
Isomeria configurazionale o stereoisomeria Tale isomeria si ha in complessi che hanno la stessa formula empirica e la stessa sequenza delle connessioni atomiche, ma diversa distribuzione spaziale degli
Test di ingresso LM Scienze Chimiche A. A
 Università degli Studi di Cagliari Test di ingresso LM Scienze Chimiche A. A. 2009-2010 Test di ingresso alla LM in Scienze Chimiche A.A. 2009 2010 1 Chimica Analitica 1) Indicare, tra quelle riportate
Università degli Studi di Cagliari Test di ingresso LM Scienze Chimiche A. A. 2009-2010 Test di ingresso alla LM in Scienze Chimiche A.A. 2009 2010 1 Chimica Analitica 1) Indicare, tra quelle riportate
Composti di coordinazione
 Composti di coordinazione detti anche ioni complessi o complessi di coordinazione sono costituiti da un metallo (generalmente uno ione ione) di transizione coordinato (legato) da uno o più leganti (molecole
Composti di coordinazione detti anche ioni complessi o complessi di coordinazione sono costituiti da un metallo (generalmente uno ione ione) di transizione coordinato (legato) da uno o più leganti (molecole
*M I03* 3/20. perforiran list
 *M15143112I* 2/20 *M15143112I02* *M15143112I03* 3/20 P perforiran list 4/20 *M15143112I04* Pagina vuota *M15143112I05* 5/20 1. L'atomo di un certo elemento contiene 20 neutroni e 17 protoni. 1.1. Scrivete
*M15143112I* 2/20 *M15143112I02* *M15143112I03* 3/20 P perforiran list 4/20 *M15143112I04* Pagina vuota *M15143112I05* 5/20 1. L'atomo di un certo elemento contiene 20 neutroni e 17 protoni. 1.1. Scrivete
ALCHENI: Reazioni del doppio legame
 ALCENI: REATTIVITÀ ALCENI: Reazioni del doppio legame Reazione di addizione Addizioni ioniche Addizioni con meccanismo concertato ADDIZIONI IONICE ADDIZIONE DI ACIDI ALOGENIDRICI ADDIZIONE DI ACQUA ROTTURA
ALCENI: REATTIVITÀ ALCENI: Reazioni del doppio legame Reazione di addizione Addizioni ioniche Addizioni con meccanismo concertato ADDIZIONI IONICE ADDIZIONE DI ACIDI ALOGENIDRICI ADDIZIONE DI ACQUA ROTTURA
Corso di Laurea in Informazione Scientifica sul Farmaco a.a. 2010/2011. Esercitazione per la prima prova parziale di Chimica Organica.
 Corso di Laurea in Informazione Scientifica sul Farmaco a.a. 2010/2011. Esercitazione per la prima prova parziale di Chimica Organica. 1. Scrivere la formula condensata per la molecola seguente: Br e la
Corso di Laurea in Informazione Scientifica sul Farmaco a.a. 2010/2011. Esercitazione per la prima prova parziale di Chimica Organica. 1. Scrivere la formula condensata per la molecola seguente: Br e la
Isomeria Costituzionale. Isomeria Conformazionale
 Isomeria ostituzionale Isomeri ostituzionali: omposti con uguale formula molecolare ma con un diverso ordine con cui sono legati gli atomi tra loro. Isomeria onformazionale onformazione: ciascuna disposizione
Isomeria ostituzionale Isomeri ostituzionali: omposti con uguale formula molecolare ma con un diverso ordine con cui sono legati gli atomi tra loro. Isomeria onformazionale onformazione: ciascuna disposizione
Complessi con leganti enilici
 Complessi con leganti enilici i leganti enilici sono radicali a formula generale: [H-(CH=CH) x -CH 2 -] (x 1) il legante enilico può far parte di un ciclo: i leganti più comuni di questo tipo sono: il
Complessi con leganti enilici i leganti enilici sono radicali a formula generale: [H-(CH=CH) x -CH 2 -] (x 1) il legante enilico può far parte di un ciclo: i leganti più comuni di questo tipo sono: il
INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA
 INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA ai primi dell 800 Il chimico svedese Jacob Berzelius (1779-1848) indicava le sostanze con il termine organico se ottenute dagli organismi viventi (animali
INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA ai primi dell 800 Il chimico svedese Jacob Berzelius (1779-1848) indicava le sostanze con il termine organico se ottenute dagli organismi viventi (animali
Alcheni: struttura e reattività
 Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività
 Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Chimica Generale ed Inorganica
 Chimica Generale ed Inorganica Chimica Generale prof. Dario Duca Cristalli blu di solfato di rame CH 3 COOH composti molecolari coefficienti stechiometrici C 2 H 2 - CH C 2 H 4 - CH 2 C 2 H 6 - CH 3 CH
Chimica Generale ed Inorganica Chimica Generale prof. Dario Duca Cristalli blu di solfato di rame CH 3 COOH composti molecolari coefficienti stechiometrici C 2 H 2 - CH C 2 H 4 - CH 2 C 2 H 6 - CH 3 CH
Non rigidità che coinvolge la coordinazione del legante
 Non rigidità che coinvolge la coordinazione del legante Interconversione H ax H eq Nel cicloesano a conformazione a sedia, è stata evidenziata un interconversione H ax H eq mediante studi 1 H NMR a temperatura
Non rigidità che coinvolge la coordinazione del legante Interconversione H ax H eq Nel cicloesano a conformazione a sedia, è stata evidenziata un interconversione H ax H eq mediante studi 1 H NMR a temperatura
Geometria molecolare
 Geometria molecolare Le molecole possono essere rappresentate disponendo gli atomi in posizioni definite nello spazio in modo da costruire una figura geometrica Il modo più semplice per assegnare la geometria
Geometria molecolare Le molecole possono essere rappresentate disponendo gli atomi in posizioni definite nello spazio in modo da costruire una figura geometrica Il modo più semplice per assegnare la geometria
STEREOISOMERIA trans-1,4-dimetilcicloesano cis-1,4-dimetilcicloesano
 STEREOISOMERIA trans-1,4-dimetilcicloesano cis-1,4-dimetilcicloesano sono stereoisomeri Hanno la stessa formula molecolare, gli atomi legati con lo stesso ordine, ma con diversa orientazione nello spazio
STEREOISOMERIA trans-1,4-dimetilcicloesano cis-1,4-dimetilcicloesano sono stereoisomeri Hanno la stessa formula molecolare, gli atomi legati con lo stesso ordine, ma con diversa orientazione nello spazio
I - < Br - < S 2- < SCN - <Cl - < F - < UREA, OH - < ox, O 2- < H 2 O < NCS - < py < NH 3 < en < bpy, phen < NO 2- < CN - < CO.
 I - < Br - < S 2- < SCN -
I - < Br - < S 2- < SCN -
REGISTRO DELLE LEZIONI
 UNIVERSITÀ DEGLI STUDI DI GENOVA Dipartimento di Chimica e Chimica Industriale Corso di laurea in Chimica e Tecnologie Chimiche REGISTRO DELLE LEZIONI dell INSEGNAMENTO o MODULO UFFICIALE Nome: Laboratorio
UNIVERSITÀ DEGLI STUDI DI GENOVA Dipartimento di Chimica e Chimica Industriale Corso di laurea in Chimica e Tecnologie Chimiche REGISTRO DELLE LEZIONI dell INSEGNAMENTO o MODULO UFFICIALE Nome: Laboratorio
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 9 Il mondo del carbonio 3 Sommario 1. Esiste un enorme varietà di composti organici 2. Gli idrocarburi saturi: alcani e cicloalcani
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 9 Il mondo del carbonio 3 Sommario 1. Esiste un enorme varietà di composti organici 2. Gli idrocarburi saturi: alcani e cicloalcani
Tipologie di formule chimiche
 CHIMICA ORGANICA Tipologie di formule chimiche FORMULA RAZIONALE Tipo di formula che utilizza una rappresentazione analoga alla formula bruta per quei gruppi di atomi sulla cui disposizione non vi possono
CHIMICA ORGANICA Tipologie di formule chimiche FORMULA RAZIONALE Tipo di formula che utilizza una rappresentazione analoga alla formula bruta per quei gruppi di atomi sulla cui disposizione non vi possono
Chimica organica, biochimica e laboratorio
 Giuseppe Valitutti Gabriella Fornari Maria Teresa Gando Chimica organica, biochimica e laboratorio Soluzioni degli esercizi del testo Capitolo 1 1.1 Tutti gli ioni hanno l ottetto più esterno completo,
Giuseppe Valitutti Gabriella Fornari Maria Teresa Gando Chimica organica, biochimica e laboratorio Soluzioni degli esercizi del testo Capitolo 1 1.1 Tutti gli ioni hanno l ottetto più esterno completo,
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare
 Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
La formula chimica di una sostanza nota la sua composizione %
 La formula chimica di una sostanza nota la sua composizione % Si consideri la sostanza costituita dagli elementi A, B e C e sia nota la sua composizione %, che si ottiene sperimentalmente 1. Si divide
La formula chimica di una sostanza nota la sua composizione % Si consideri la sostanza costituita dagli elementi A, B e C e sia nota la sua composizione %, che si ottiene sperimentalmente 1. Si divide
Comportamento acido-base dei complessi
 Comportamento acido-base dei complessi un complesso, saturo elettronicamente, può comportarsi da base di Lewis: [Mn -I (CO) 5 ] - + H + [HMn +I (CO) 5 ] un complesso, insaturo elettronicamente, può comportarsi
Comportamento acido-base dei complessi un complesso, saturo elettronicamente, può comportarsi da base di Lewis: [Mn -I (CO) 5 ] - + H + [HMn +I (CO) 5 ] un complesso, insaturo elettronicamente, può comportarsi
Comportamento dei metalli alcalini in ammoniaca liquida (P.E. 33 C) i metalli alcalini sono molto solubili in ammoniaca liquida (130 g di Cs in 40
 Comportamento dei metalli alcalini in ammoniaca liquida (P.E. 33 C) i metalli alcalini sono molto solubili in ammoniaca liquida (130 g di Cs in 40 g di NH 3, ossia 2,34 molecole NH 3 / 1 atomo Cs), dando
Comportamento dei metalli alcalini in ammoniaca liquida (P.E. 33 C) i metalli alcalini sono molto solubili in ammoniaca liquida (130 g di Cs in 40 g di NH 3, ossia 2,34 molecole NH 3 / 1 atomo Cs), dando
Esercitazione sulle conformazioni di alcani e cicloesani
 Esercitazione sulle conformazioni di alcani e cicloesani 1. Disegnare la molecola completa del butano, nella conformazione più favorevole per tutti i legami - (usare i legami a cuneo e tratteggiati). 2.
Esercitazione sulle conformazioni di alcani e cicloesani 1. Disegnare la molecola completa del butano, nella conformazione più favorevole per tutti i legami - (usare i legami a cuneo e tratteggiati). 2.
Chimica Analitica con elementi di statistica Lezione n 3
 Chimica Analitica con elementi di statistica Lezione n 3 Christian Durante E-mail: christian.durante@unipd.it Tel. 049-8275112 Zona quadrilatero ufficio 00 215 02 142 (orario di ricevimento: tutti I giorni
Chimica Analitica con elementi di statistica Lezione n 3 Christian Durante E-mail: christian.durante@unipd.it Tel. 049-8275112 Zona quadrilatero ufficio 00 215 02 142 (orario di ricevimento: tutti I giorni
131,3 86 (222) 126,9 85 (210) 127,6 84 (209) 209,0 121, ,2 118, , ,4 200,6 112, , ,0 106, ,1 192,2 102,9 77
 *M16243112I* 2/20 *M16243112I02* *M16243112I03* 3/20 I 1 II 2 1 1,008 2 2 3 4 3 4 5 6 7 8 9 10 11 12 44,96 5 5 6 6 7 3 6,941 11 22,99 19 39,10 37 85,47 55 132,9 87 (223) 4 9,012 12 24,31 20 40,08 38 87,62
*M16243112I* 2/20 *M16243112I02* *M16243112I03* 3/20 I 1 II 2 1 1,008 2 2 3 4 3 4 5 6 7 8 9 10 11 12 44,96 5 5 6 6 7 3 6,941 11 22,99 19 39,10 37 85,47 55 132,9 87 (223) 4 9,012 12 24,31 20 40,08 38 87,62
Elettroni del metallo negli orbitali d
 Elettroni del metallo negli orbitali d Complessi ottaedrici i primi 3 elettroni entrano nei 3 orbitali t 2g, secondo la regola di Hund il quarto elettrone ha due possibilità: entrare in un orbitale e g,
Elettroni del metallo negli orbitali d Complessi ottaedrici i primi 3 elettroni entrano nei 3 orbitali t 2g, secondo la regola di Hund il quarto elettrone ha due possibilità: entrare in un orbitale e g,
Complessi ciclopentadienilici. il primo composto di questo tipo è stato il ferrocene, ossia il
 Complessi ciclopentadienilici il primo composto di questo tipo è stato il ferrocene, ossia il bis(ciclopentadienil)ferro(0) [Fe( 5 -C 5 H 5 ) 2 ] il legante è il radicale neutro ciclopentadienile [C 5
Complessi ciclopentadienilici il primo composto di questo tipo è stato il ferrocene, ossia il bis(ciclopentadienil)ferro(0) [Fe( 5 -C 5 H 5 ) 2 ] il legante è il radicale neutro ciclopentadienile [C 5
Gli elettroni della molecola sono quindi descritti da
 IL LEGAME COVALENTE: TEORIA DELL ORBITALE MOLECOLARE La molecola è considerata come un insieme di nuclei ed elettroni e, attraverso la valutazione delle reciproche interazioni, la teoria dell orbitale
IL LEGAME COVALENTE: TEORIA DELL ORBITALE MOLECOLARE La molecola è considerata come un insieme di nuclei ed elettroni e, attraverso la valutazione delle reciproche interazioni, la teoria dell orbitale
COMPOSTI DI COORDINAZIONE
 COMPOSTI DI COORDINAZIONE Teoria di Werner I metalli, specie quelli di transizione, presentano due tipi di valenza Valenza primaria: numero di elettroni che l atomo cede nella formazione dello ione metallico
COMPOSTI DI COORDINAZIONE Teoria di Werner I metalli, specie quelli di transizione, presentano due tipi di valenza Valenza primaria: numero di elettroni che l atomo cede nella formazione dello ione metallico
Il legame chimico ATOMI MOLECOLE
 Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Leganti π. Leganti π sono quelli che, oltre ad interazioni di tipo σ, possono dare, con il metallo, interazioni di tipo π:
 Leganti π Leganti π sono quelli che, oltre ad interazioni di tipo σ, possono dare, con il metallo, interazioni di tipo π: leganti π-donatori (basici nel senso di Lewis) leganti π-accettori (acidi nel senso
Leganti π Leganti π sono quelli che, oltre ad interazioni di tipo σ, possono dare, con il metallo, interazioni di tipo π: leganti π-donatori (basici nel senso di Lewis) leganti π-accettori (acidi nel senso
ISOMERIA. Isomeri di struttura O OH C 4 H 10 O C 4 H 10
 ISOMERIA O O C 4 10 O C 4 10 Isomeri di struttura Isomeri conformazionali conformazioni rotameri STEREOISOMERIA stereoisomeri o isomeri spaziali o isomeri costituzionali ( in greco vuol dire spazio) si
ISOMERIA O O C 4 10 O C 4 10 Isomeri di struttura Isomeri conformazionali conformazioni rotameri STEREOISOMERIA stereoisomeri o isomeri spaziali o isomeri costituzionali ( in greco vuol dire spazio) si
2) Scrivere il nome sistematico per i composti elencati di seguito:
 Chimica Organica Alcheni 1) Disegnare la struttura per le molecole elencate: a. 3,3- dimetilciclopentene c. etil vinil etere b. 6- bromo- 2,3- dimetil- 2- esene d. allil alcol 2) Scrivere il nome sistematico
Chimica Organica Alcheni 1) Disegnare la struttura per le molecole elencate: a. 3,3- dimetilciclopentene c. etil vinil etere b. 6- bromo- 2,3- dimetil- 2- esene d. allil alcol 2) Scrivere il nome sistematico
L Atomo di Carbonio Tetraedrico e la Rappresentazione di Fischer
 L Atomo di Carbonio Tetraedrico e la Rappresentazione di Fischer Un atomo di carbonio con almeno due sostituenti identici e la sua immagine speculare sono sovrapponibili e quindi eguali atomo1.c3d Un atomo
L Atomo di Carbonio Tetraedrico e la Rappresentazione di Fischer Un atomo di carbonio con almeno due sostituenti identici e la sua immagine speculare sono sovrapponibili e quindi eguali atomo1.c3d Un atomo
Esame di Fondamenti di Chimica - Meccanici/Energetici/Aerospaziali I verifica: 14/11/08 - A
 Esame di Fondamenti di Chimica - Meccanici/Energetici/Aerospaziali I verifica: 14/11/08 - A Avvertenze: scrivere le soluzioni sull apposito foglio che va completato con tutti i dati richiesti prima di
Esame di Fondamenti di Chimica - Meccanici/Energetici/Aerospaziali I verifica: 14/11/08 - A Avvertenze: scrivere le soluzioni sull apposito foglio che va completato con tutti i dati richiesti prima di
Atomi, molecole e ioni
 Atomi, molecole e ioni anione + - catione Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento
Atomi, molecole e ioni anione + - catione Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento
Leganti. Ossido di carbonio Fosfine, fosfiti Ossido di azoto Idruri Molecole organiche con sistemi Areni. Figura 5.1 Diversi tipi di leganti
 Leganti Ossido di carbonio Fosfine, fosfiti Ossido di azoto Idruri Molecole organiche con sistemi Areni Figura 5.1 Diversi tipi di leganti Leganti Figura 5.2 Le due componenti del legame metallo-carbonio
Leganti Ossido di carbonio Fosfine, fosfiti Ossido di azoto Idruri Molecole organiche con sistemi Areni Figura 5.1 Diversi tipi di leganti Leganti Figura 5.2 Le due componenti del legame metallo-carbonio
PIANO DI STUDIO DELLA DISCIPLINA
 ISIS C. Facchinetti Sede: via Azimonti, 5-21053 Castellanza Tel. 0331 635718 fax 0331 679586 info@isisfacchinetti.gov.it Rev. 1.1 del 26/07/17 https://isisfacchinetti.gov.it CHIMICA ORGANICA PIANO DELLE
ISIS C. Facchinetti Sede: via Azimonti, 5-21053 Castellanza Tel. 0331 635718 fax 0331 679586 info@isisfacchinetti.gov.it Rev. 1.1 del 26/07/17 https://isisfacchinetti.gov.it CHIMICA ORGANICA PIANO DELLE
Classificazione degli idrocarburi
 Classificazione degli idrocarburi ALCANI Alcani: idrocarburi saturi contenenti solo legami semplici carbonio-carbonio (tutti i carboni sono ibridati sp3). Modelli molecolari di etano, propano e butano.
Classificazione degli idrocarburi ALCANI Alcani: idrocarburi saturi contenenti solo legami semplici carbonio-carbonio (tutti i carboni sono ibridati sp3). Modelli molecolari di etano, propano e butano.
Molecole e legami. Chimica generale
 Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Alcheni: struttura e reattività
 Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Teoria degli orbitali. Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale.
 Teoria degli orbitali Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale. orbitale nucleo STPA-Chimica Organica 1 L orbitale 1s Gli
Teoria degli orbitali Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale. orbitale nucleo STPA-Chimica Organica 1 L orbitale 1s Gli
Primo presame di chimica
 1 1. Indicare quale tra le seguenti può essere la combinazione dei numeri quantici (n, l, m, s) di un elettrone in un atomo (0, -1, 1, +1/2) (2, -1, 1, +1/2) (4, 4, 1, -1/2) (5, 4, 1, -1/2) 2. Quale delle
1 1. Indicare quale tra le seguenti può essere la combinazione dei numeri quantici (n, l, m, s) di un elettrone in un atomo (0, -1, 1, +1/2) (2, -1, 1, +1/2) (4, 4, 1, -1/2) (5, 4, 1, -1/2) 2. Quale delle
Classificazione dei materiali solidi in base ai legami interatomici! Metalli Ceramici Polimeri
 Classificazione dei materiali solidi in base ai legami interatomici! Metalli Ceramici Polimeri (a) Legami atomici primari o forti legame ionico legame covalente legame metallico (b) Legami atomici e molecolari
Classificazione dei materiali solidi in base ai legami interatomici! Metalli Ceramici Polimeri (a) Legami atomici primari o forti legame ionico legame covalente legame metallico (b) Legami atomici e molecolari
Figura. Stereochimica
 Figura Stereochimica Stereochimica: enantiomeri Differenze apparentemente insignificanti nella struttura 3-D possono causare proprietà molto differenti. Si può osservare questo considerando amido e cellulosa,
Figura Stereochimica Stereochimica: enantiomeri Differenze apparentemente insignificanti nella struttura 3-D possono causare proprietà molto differenti. Si può osservare questo considerando amido e cellulosa,
Chimica Organica. Stereochimica ISOMERI ISOMERI DI STRUTTURA STEREOISOMERI DIASTEREOMERI ENANTIOMERI ISOMERI CIS-TRANS CONFORMERI ROTAMERI
 Chimica rganica Stereochimica ISMERI ISMERI DI STRUTTURA STEREISMERI DIASTEREMERI ENANTIMERI ISMERI CIS-TRANS CNFRMERI RTAMERI Stereoisomeri Composti con la stessa connessione tra gli atomi, ma con una
Chimica rganica Stereochimica ISMERI ISMERI DI STRUTTURA STEREISMERI DIASTEREMERI ENANTIMERI ISMERI CIS-TRANS CNFRMERI RTAMERI Stereoisomeri Composti con la stessa connessione tra gli atomi, ma con una
CHIMICA ORGANICA CHIMICA DEL CARBONIO
 CHIMICA ORGANICA CHIMICA DEL CARBONIO Fino al 1828 con il termine organico si indicavano le sostanze prodotte dagli organismi viventi, mentre si classificavano come inorganiche tutte le altre Dopo il 1828
CHIMICA ORGANICA CHIMICA DEL CARBONIO Fino al 1828 con il termine organico si indicavano le sostanze prodotte dagli organismi viventi, mentre si classificavano come inorganiche tutte le altre Dopo il 1828
Alcheni: : struttura e reattività. Alcheni. Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n. H 2n. Alcheni in biologia
 Alcheni: : struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: : struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
C 4 H 10 C 4 H 10. Hanno la stessa formula molecolare C 4 H 10.
 Isomeria costituzionale negli alcani Isomeri costituzionali (strutturali): composti con uguale formula molecolare ma diversa formula di struttura (con un diverso ordine con cui sono legati i loro atomi).
Isomeria costituzionale negli alcani Isomeri costituzionali (strutturali): composti con uguale formula molecolare ma diversa formula di struttura (con un diverso ordine con cui sono legati i loro atomi).
FASE. Diversi stati fisici della materia e forme alternative di un medesimo stato fisico.
 FASE Diversi stati fisici della materia e forme alternative di un medesimo stato fisico. Esempi di fase sono il ghiaccio e l acqua liquida. Il diamante e la grafite sono due fasi del carbonio allo stato
FASE Diversi stati fisici della materia e forme alternative di un medesimo stato fisico. Esempi di fase sono il ghiaccio e l acqua liquida. Il diamante e la grafite sono due fasi del carbonio allo stato
GENERALITA SUI LEGAMI CHIMICI
 GENERALITA SUI LEGAMI IMII Legame ionico Legami forti Legame covalente Legami Legame metallico Legami deboli 1 Regola dell ottetto (Lewis,, 1916) Lewis: rappresentazione elettroni di valenza con punti
GENERALITA SUI LEGAMI IMII Legame ionico Legami forti Legame covalente Legami Legame metallico Legami deboli 1 Regola dell ottetto (Lewis,, 1916) Lewis: rappresentazione elettroni di valenza con punti
Idrocarburi Al A ifatici Ar A oma m tici
 GLI IDROCARBURI Gli idrocarburi sono i più semplici composti del carbonio con l'idrogeno. Sono le molecole di base della chimica organica poiché, oltre ad essere molto numerosi, tutti gli altri composti
GLI IDROCARBURI Gli idrocarburi sono i più semplici composti del carbonio con l'idrogeno. Sono le molecole di base della chimica organica poiché, oltre ad essere molto numerosi, tutti gli altri composti
Formazione di complessi
 Formazione di complessi Struttura degli ioni complessi Gli ioni complessi sono formati da un catione metallico legato ad anioni come OH -, Cl -, CN -, SCN -, o a molecole neutre come H 2 O, NH 3., detti
Formazione di complessi Struttura degli ioni complessi Gli ioni complessi sono formati da un catione metallico legato ad anioni come OH -, Cl -, CN -, SCN -, o a molecole neutre come H 2 O, NH 3., detti
Introduzione alla Chimica Organica. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Introduzione alla Chimica Organica Copyright The McGraw-ill Companies, Inc. Permission required for reproduction or display. 1 Elementi Comuni nei Composti Organici 2 Classificazione degli idrocarburi
Introduzione alla Chimica Organica Copyright The McGraw-ill Companies, Inc. Permission required for reproduction or display. 1 Elementi Comuni nei Composti Organici 2 Classificazione degli idrocarburi
Coordinazione ottaedrica (interazioni di tipo )
 Coordinazione ottaedrica (interazioni di tipo ) Il metallo di transizione ha 6 orbitali atomici adatti a dare interazioni di tipo (d z2, d x2-y2, s, p x, p y, p z ) e 6 orbitali atomici adatti a dare interazioni
Coordinazione ottaedrica (interazioni di tipo ) Il metallo di transizione ha 6 orbitali atomici adatti a dare interazioni di tipo (d z2, d x2-y2, s, p x, p y, p z ) e 6 orbitali atomici adatti a dare interazioni
PIANO DI STUDIO DELLA DISCIPLINA CHIMICA ORGANICA
 CHIMICA ORGANICA PIANO DELLE 5 CHIMICA, MATERIALI E BIOTECNOLOGIE SETTORE TECNOLOGICO Anno 2018/2019 DA n. 1 L'atomo e le teorie di legame Periodo: Settembre -Ottobre Rappresentare una specie chimica organica
CHIMICA ORGANICA PIANO DELLE 5 CHIMICA, MATERIALI E BIOTECNOLOGIE SETTORE TECNOLOGICO Anno 2018/2019 DA n. 1 L'atomo e le teorie di legame Periodo: Settembre -Ottobre Rappresentare una specie chimica organica
Composti di coordinazione
 Composti di coordinazione Nelle molecole di un COMPOSTO DI COORDINAZIONE l atomo centrale e legato ad un numero di atomi superiore al suo numero di ossidazione. Lo studio dei composti di coordinazione
Composti di coordinazione Nelle molecole di un COMPOSTO DI COORDINAZIONE l atomo centrale e legato ad un numero di atomi superiore al suo numero di ossidazione. Lo studio dei composti di coordinazione
Unità didattica 7. Dieni coniugati, Benzene e aromaticità, reattività
 I dieni coniugati ci pongono qualche domanda in più rispetto agli alcheni più semplici Unità didattica 7 Dieni coniugati, Benzene e aromaticità, reattività Perché il legame 2-3 è più corto che in un alcano?
I dieni coniugati ci pongono qualche domanda in più rispetto agli alcheni più semplici Unità didattica 7 Dieni coniugati, Benzene e aromaticità, reattività Perché il legame 2-3 è più corto che in un alcano?
C x H y. C 3 H 2 (formula minima) C 21 H 14
 ESERCIZIO Un idrocarburo è costituito dal 94,74% in peso di C. La massa di una singola molecola di tale idrocarburo è 4,419 10-22 g. Stabilire la formula molecolare di tale composto. u.m.a.= 1,66 10-24
ESERCIZIO Un idrocarburo è costituito dal 94,74% in peso di C. La massa di una singola molecola di tale idrocarburo è 4,419 10-22 g. Stabilire la formula molecolare di tale composto. u.m.a.= 1,66 10-24
Alcani e cicloalcani. Nomenclatura e nomi comuni Struttura e proprietà Reazioni
 Alcani e cicloalcani Nomenclatura e nomi comuni Struttura e proprietà Reazioni Alcani Gli orbitali atomici hanno forme ben definite. Gli orbitali S sono sferici con gli e - confinati in una regione sferica
Alcani e cicloalcani Nomenclatura e nomi comuni Struttura e proprietà Reazioni Alcani Gli orbitali atomici hanno forme ben definite. Gli orbitali S sono sferici con gli e - confinati in una regione sferica
Idrocarburi Saturi. Cicloalcani
 Idrocarburi Saturi Cicloalcani Cicloalcani I cicloalcani sono idrocarburi i cui atomi di carbonio sono uniti per formare un anello In natura sono presenti cicloalcani con dimensioni dell anello che vanno
Idrocarburi Saturi Cicloalcani Cicloalcani I cicloalcani sono idrocarburi i cui atomi di carbonio sono uniti per formare un anello In natura sono presenti cicloalcani con dimensioni dell anello che vanno
AROMATICITA' Struttura? BENZENE (CH) x. Faraday (1825) (1834) C 6 H 6 CH 2 C CH CH C CH 2 CH 3 C C C C CH 3. Che cosa rende speciale il benzene?
 ? AROMATIITA' he cosa rende speciale il benzene? BENZENE () x Faraday (1825) Faraday, Michael (1791 1867) 6 6 (1834) Struttura? sulla carta sono possibili diverse strutture con formula molecolare 6 6 2
? AROMATIITA' he cosa rende speciale il benzene? BENZENE () x Faraday (1825) Faraday, Michael (1791 1867) 6 6 (1834) Struttura? sulla carta sono possibili diverse strutture con formula molecolare 6 6 2
Stabilità dei complessi
 Stabilità dei complessi v stabilità o instabilità termodinamica di un complesso è una misura del grado in cui un complesso è presente all equilibrio insieme alle sue specie costituenti, ossia allo ione
Stabilità dei complessi v stabilità o instabilità termodinamica di un complesso è una misura del grado in cui un complesso è presente all equilibrio insieme alle sue specie costituenti, ossia allo ione
Sommario della lezione 4. Proprietà periodiche. Massa atomica e massa molecolare. Concetto di mole. Prime esercitazioni
 Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
ESERCIZI ESERCIZI. il basso d. aumenta lungo un periodo da sinistra verso
 ESERCIZI 1) L elettronegatività di un elemento: a è l energia che esso libera acquistando un elettrone e trasformandosi in ione negativo b è l energia necessaria per trasformarlo in ione positivo c indica
ESERCIZI 1) L elettronegatività di un elemento: a è l energia che esso libera acquistando un elettrone e trasformandosi in ione negativo b è l energia necessaria per trasformarlo in ione positivo c indica
H 2 O 2 (aq) 2e - + O 2 (g) H + (aq) MnO 2 (s) +2e H + (aq Mn 2+ (aq) +2 H 2 O (l).
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico-elettronico: H 2 2 (aq) + Mn 2 (s) + H + (aq) Mn 2+ (aq) + 2 (g) + H 2 (l). Calcolare la massa di Mn 2 (s) necessaria per
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico-elettronico: H 2 2 (aq) + Mn 2 (s) + H + (aq) Mn 2+ (aq) + 2 (g) + H 2 (l). Calcolare la massa di Mn 2 (s) necessaria per
