Ruolo delle globine nel trasporto e nell immagazzinamento dell ossigeno
|
|
|
- Anna Maria Monti
- 5 anni fa
- Visualizzazioni
Transcript
1 Ruolo delle globine nel trasporto e nell immagazzinamento dell ossigeno
2 Eritrociti umani Ciascun eritrocita contiene circa 300 milioni di molecole di emoglobina
3 Possiedono un motivo strutturale comune. Gruppo prostetico è l eme a cui si lega l O 2
4 Struttura delle porfirine Fe 2+ ha 6 legami di coordinazione E legato non covalentemente alla parte proteica (interazioni idrofobiche).
5 Istidina distale o E7 Nell Ossiemoglobina il Fe lega l O 2, nella deossiemoglobina lega l H 2 O. La parte proteica serve per proteggere il Fe 2+ dall ossidazione dell aria (Fe 3+ ) Istidina F8 o Istidina prossimale Nell elica F.
6 Geometria di coordinazione del Fe dell ossiemoglobina Coordinazione ottaedrica Istidina prossimale Istidina distale
7 MIOGLOBINA Curva di legame dell O 2 alla Mioglobina P 50 = pressione parziale di ossigeno al 50% di saturazione (4 mmhg) Molto bassa, per cui la mioglobina ha un alta affinità per l ossigeno
8 Dinamica del rilascio dell ossigeno da parte della mioglobina La molecola di O 2 è stata rilasciata dal gruppo eme ma oscilla nella tasca di legame e potrebbe legarsi nuovamente L O 2 rilasciato sfugge all esterno se le fluttuazioni della struttura proteica determinano l apertura di un varco
9 EMOGLOBINA
10 Emoglobina Curve di legame richieste da proteine trasportatrici
11 Confronto sequenze mioglobina ed emoglobina Solo 18% dei residui sono identici, ma hanno una struttura terziaria straordinariamente simile. E un dimero di dimeri ab. Emoglobina è una proteina allosterica. La caratteristica delle proteine allosteriche consiste nel fatto che il comportamento di ogni subunità risente dell attività delle altre. Nel caso dell emoglobina ciò determina un progressivo aumento dell affinità per l O2.
12 EMOGLOBINA Struttura quaternaria a2b Perutz emoglobina di cavallo L ossigenazione determina un cambiamento nella struttura quaternaria: una coppia ab ruota e scivola rispetto all altra
13
14 Eme
15 Legame dell O2 al gruppo eme Eme Istidina prossimale F8
16 Meccanismo della transizione T R Stato deossi l eme è in una forma curvata. Il legame con O 2 attira il Fe all interno dell eme, appiattendo l eme e creando tensione Un alterazione della posizione HisF8 attenua tale tensione.
17 Modificazioni conformazionali dell emoglobina Il movimento dell a-elica che contiene l istidina prossimale modifica l interfaccia tra le coppie ab, inducendo altre modificazioni strutturali.
18 Movimenti all interfaccia ab durante la transizione T R His 97 è in una tasca vicino alla Thr 41 His 97 si trova in una scanalatura un giro di elica più indietro vicino alla Thr 38
19 Transizione stato T stato R
20 Cooperatività potenzia l erogazione dell O 2 L emoglobina puo trasportare una quantità di O 2 1,7 volte maggiore di quella che potrebbe essere trasportata se i siti fossero indipendenti.
21 Modello sequenziale Il comportamento allosterico dell Hb presenta caratteristiche sia del modello simmetrico (T e R) che del modello sequenziale
22
23 Quando emoglobina si trova nello stato T l ossigeno è accessibile solo all eme delle catene a. Perutz ha evidenziato che l ambiente delle catene b durante lo stato T è inaccessibile a causa dell ingombro sterico degli aa dell elica E. Questo ingombro scompare quando Hb è nello stato R. uindi il legame dell Ossigeno alla catena b dipende dalla transizione T a R. L insieme di queste osservazioni portano ad un modello che è parzialmente simmetrico e parzialmente sequenziale: Il legame dell ossigeno ad una catena porta a dei cambiamenti sequenziali seguiti da una trasformazione nella struttura quaternaria da T a R. (simmetrico)
24
25
26
27
28
29 Cooperatività positiva e cooperatività negativa
30 Alcune sostanze influiscono sulla capacità dell HB di legare l O2 Effettori allosterici negativi H+ CO2 Cl- 2,3-bifosfoglicerato (BPG) H+ promuove dissociazione ossigeno da Hb La deossiemoglobina ha un affinità maggiore per i protoni rispetto all ossiemoglobina Quindi con la diminuzione del ph è stimolata la dissociazione dell O2 HbO2 HbH+ + O2 H+ è un antagonista del legame con l O2 e la curva di saturazione si sposta Verso destra con l aumento dell acidità. Questo fenomeno è detto effetto Bohr
31 Effetto Bohr L effetto ha un significato biologico importante. I tessuti con metabolismo attivo producono Acidi, promuovendo così il rilascio di O2 dove è più necessario. Ogni molecola di deossiemoglobina si legano 2 protoni Alle estremità N-terminali delle 2 catene a e i residui di His b146 avviene la protonazione. Il gruppo carbossilico di Asp b94 aiuta a stabilizzare lo stato protonato. Quando l Hb lega O2 i cambiamenti conformazionali della catena b allontanano la carica negativa di Asp e si ha la dissociazione di protoni dall His
32 Reticolo di coppie ioniche e legami H nella deossiemoglobina
33
34
35 Effetti di CO2 sull'emoglobina La caduta del ph a livello tissutale è dovuta essenzialmente alla produzione metabolica di CO 2 che viene convertita in bicarbonato ed H + ad opera dell' anidrasi carbonica: CO 2 + H 2 O < > HCO 3- + H + L'abbassamento del ph produce un caduta dell'affinità dell'emoglobina per l'ossigeno, permettendo un rilascio efficiente dell'ossigeno legato. L'effetto dei protoni sull'affinità dell'emoglobina per l'ossigeno è detto effetto Bohr, ed è dovuto al legame dei protoni all'ossiemoglobina secondo la seguente reazione: (1)...Hb(O 2 ) 4 + nh + < >Hb(H + )n+ 4O 2...(n di poco > 2) Da questa reazione si deduce che i protoni spostando l'equilibrio verso destra promuovono il rilascio dell' O 2.
36 Trasporto anidride carbonica ed effetto Bohr
37
38 Reticolo di coppie ioniche e legami H nella deossiemoglobina Questi legami sono rotti durante la transizione T R Una parte di CO 2 si lega ai residui N-terminali formando carbammato che Forma legami salini con le catene laterali cationiche di Arg 141 stabilizzando lo stato deossi R-NH 2 + CO 2 R-NH-COO - + H +
39 Il Bifosfoglicerato Si lega saldamente alla deossiemoglobina. Questo composto tende a favorire la forma deossigenata. Il BPG svolge una funzione importante nell adattamento fisiologico a po2 basse che si trova in montagna ad es Ad elevate quote gli individui si adattano all elevata p di O 2 in parte per un aumento di produzione di emoglobina, ma un altra ragione è nei cambiamenti di concentrazione di un effettore allosterico come il BPG. Il sangue degli uccelli
40 Legame BPG alla deossiemoglobina Stabilizzazione favorendo la dissociazione dell O2 His N terminale Catena b Lys His E circondato da 8 gruppi cationici che appartengono alle subunità b
41 Nell ossiemoglobina questa cavità è troppo piccola per alloggiare il BPG BPG e O2 sono due effettori allosterici per Hb anche se i loro siti di legame sono diversi
42 Effetto del BPG e della CO 2 sulla curva di dissociazione dell O 2 dell emoglobina
43 Il legame di BPG ha un significato biologico importante Hb fetale deve assorbire l O2 meglio dell Hb materna perche i suoi scambi gassosi avvengono nella placenta Emoglobina fetale a2g2 His 143 è sostituita con un residuo di Ser (non carico) BPG si lega quindi meno bene Per cui ha una maggiore affinità per l O2 e gli scambi con il sangue materno Avvengono facilmente
44 Variazioni fisiologiche dell emoglobina Emoglobina embrionale HbE (a2e2) Emoglobina fetale HbF (a2g2) Emoglobina adulto HbA1 (a2b2) Hba2 2,5%
45 Veleni respiratori Fisiologicamente o per azione di determinate sostanze ossidanti (acqua ossigenata, permanganato di potassio, ecc.) o di certi farmaci e di alcune sostanze contenute nelle fave (vedi favismo), lo ione ferroso si trasforma in ione ferrico (Fe+++) e l'emoglobina si trasforma in metaemoglobina (MetHb), incapace di legare l'ossigeno. Nel sangue è normale una presenza del 2% di MetHb, se questa percentuale sale, la respirazione viene compromessa. La riconversione a ione ferroso avviene tramite un meccanismo enzimatico riducente basato su di una reazione a catena che comporta l'ossidazione dell NADPH per ridurre il glutatione che mantiene la cellula in uno stato riducente prevenendo la formazione di MetHb Un altro pericolo per la respirazione è il monossido di carbonio (CO): l'emoglobina ha una affinità 200 volte superiore per questo gas che per l'ossigeno. Se nell'aria è presente una percentuale di CO pari a 1/200 quella dell'ossigeno (una parte per mille di aria), la metà dell'emoglobina si combinerà con l'ossido di carbonio, dando luogo a carbossiemoglobina (HbCO), incapace di legare ossigeno. La carbossiemoglobina viene prodotta in quantità minime anche all'interno dei tessuti, in quanto il CO ha funzione di trasmettitore di segnali.
46
47
48 Tipi di mutazioni
49 Varianti dell emoglobina Distribuzione delle mutazioni nelle emoglobine umane. Sono state individuate 500 varianti. In rosso sono indicate le sostituzioni patologiche.
50 Mutazioni missense nelle emoglobine umane EFFETTO RESIDUO CAMBIATO CAMBIAMENTO NOME CONSEGUENZE SPIEGAZIONE Falcizzazione b6 (A3) Glu Val S Falcizzazione Val si adatta alla tasca EF della catena di un altra molecola di emoglobina Cambiamento affinità per l O 2 a87 (F8) His Tyr M Formazione di His che lega O 2 metemoglobina è sost da Tyr diminuisce affinità O 2 Perdita di eme b42 (CD1) Phe Ser Hammersmith Perde eme Phe idrofobica con Ser attira l acqua nella tasca dell eme Dissociazione del tetramero a95 (G2) Pro Arg St. Lukes Dissociazione Alterata geometria nella regione di contatto tra subunità
51 Eritrociti nell anemia falciforme Si ha polimerizzazione e la formazione di un Precipitato fibroso che induce la deformazione a falce del globulo rosso Eritrocita lacerato con fuoriuscita di emoglobina S Vita più breve Resistenza al Plasmodium falciparum
52
53 Emoglobina di cellule falciformi
54 Diffusione in Africa dell emoglobina tipo HbS: una resistenza a caro prezzo!.
55 Struttura della fibra di deossiemoglobina dovuta alla presenza di val
56 Talassemie Produzione sbilanciata delle catene emoglobiniche Varianti dell emoglobina in cui 1 o più catene mancano o sono prodotte in bassa quantità. Uno o più geni codificanti per l emoglobina possono aver subito una delezione completa. Possono essere presenti tutti i geni, ma uno o più possono aver subito una mutazione non-senso, che produce una catena accorciata, o una mutazione in fase di lettura, che produce una catena non funzionale. Può essere avvenuta una mutazione al di fuori delle regioni codificanti, ma che provoca un blocco della trascrizione, per cui la proteina o non viene prodotta o non è funzionale. b-talassemia è la forma più grave, la catena b è prodotta in scarsa quantità. Le catene a formano aggregati insolubili che precipitano nei globuli rossi portando ad anemia. a-talassemia, la catena è prodotta in scarsa quantità, per cui si formano tetrameri di catene b. (emoglobina H) legano l O2 con un alta affinità ed in modo non cooperativo.
57
58 La talassemia è una malattia ereditaria e per trasmetterla occorre essere microcitemici (portatori sani); ciò significa avere nel proprio codice genetico (DNA) una caratteristica particolare (tratto talassemico) che rende possibile la trasmissione della malattia. L arma più efficace per evitare che la talassemia continui a diffondersi è la PREVENZIONE. Le molecole alfa e beta, costituenti dell'emoglobina, nella talassemia presentano un difetto in una delle due catene; il risultato prodotto è uno scarso livello di emoglobina nel sangue ed il colorito dei globuli e rosso pallido.
Mioglobina ed emoglobina
 Mioglobina ed emoglobina α β Muscolo Deposito di O 2 Alta affinità per O 2 β α Globulo rosso Trasporto di O 2 Bassa affinità per O 2 Cooperativa ed allosterica Animali Mb-knockout (2003) : funzionalità
Mioglobina ed emoglobina α β Muscolo Deposito di O 2 Alta affinità per O 2 β α Globulo rosso Trasporto di O 2 Bassa affinità per O 2 Cooperativa ed allosterica Animali Mb-knockout (2003) : funzionalità
Ripiegamento e stabilità delle proteine
 Ripiegamento e stabilità delle proteine Ripiegamento e stabilità delle proteine La conformazione nativa di una proteina è quella a cui si associa la sua funzione biologica. Il termine stabilità può essere
Ripiegamento e stabilità delle proteine Ripiegamento e stabilità delle proteine La conformazione nativa di una proteina è quella a cui si associa la sua funzione biologica. Il termine stabilità può essere
Le proteine che legano l ossigenol
 Le proteine che legano l ossigenol Protoporfirina IX EME (Fe-protoporfirina IX) L atomo di ferro del gruppo eme può formare sei legami Struttura della mioglobina di capodoglio (J. Kendrew, anni 50)
Le proteine che legano l ossigenol Protoporfirina IX EME (Fe-protoporfirina IX) L atomo di ferro del gruppo eme può formare sei legami Struttura della mioglobina di capodoglio (J. Kendrew, anni 50)
Le proteine che legano ossigeno:
 Le proteine che legano ossigeno: . I cristalli si ottengono per precipitazione lenta della molecola da una soluzione, in condizioni che non dovrebbero alterare la sua struttura Un cristallo proteico È
Le proteine che legano ossigeno: . I cristalli si ottengono per precipitazione lenta della molecola da una soluzione, in condizioni che non dovrebbero alterare la sua struttura Un cristallo proteico È
Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro.
 Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
IL GRUPPO EME. PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici.
 IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
Nel corso dell evoluzione, con il passaggio dalla. progressivamente differenziati due meccanismi. un sistema circolatorio adeguato;
 PROTEINE RESPIRATORIE EMOGLOBINA & MIOGLOBINA Nel corso dell evoluzione, con il passaggio dalla vita anaerobia alla vita aerobia si sono progressivamente differenziati due meccanismi che sono in grado
PROTEINE RESPIRATORIE EMOGLOBINA & MIOGLOBINA Nel corso dell evoluzione, con il passaggio dalla vita anaerobia alla vita aerobia si sono progressivamente differenziati due meccanismi che sono in grado
Mioglobina Emoglobina
 Mioglobina Emoglobina RESPIRAZIONE : assunzione di O 2 dall ambiente e rilascio di CO 2 La RESPIRAZIONE CELLULARE è un processo redox attraverso il quale vengono trasferiti atomi di idrogeno da un composto
Mioglobina Emoglobina RESPIRAZIONE : assunzione di O 2 dall ambiente e rilascio di CO 2 La RESPIRAZIONE CELLULARE è un processo redox attraverso il quale vengono trasferiti atomi di idrogeno da un composto
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO
 EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Trasporto dell ossigeno In tutti gli animali superiori, il metabolismo è aerobico L energia che si può estrarre dal glucosio
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Trasporto dell ossigeno In tutti gli animali superiori, il metabolismo è aerobico L energia che si può estrarre dal glucosio
STRUTTURA E FUNZIONE
 STRUTTURA E FUNZIONE O 2 non solubile in acqua Esistono due proteine che permettono il trasporto di O 2 nel corpo emoglobina (Hb) si trova nei globuli rossi Trasporta anche CO 2 and H + Mioglobina (Mb)
STRUTTURA E FUNZIONE O 2 non solubile in acqua Esistono due proteine che permettono il trasporto di O 2 nel corpo emoglobina (Hb) si trova nei globuli rossi Trasporta anche CO 2 and H + Mioglobina (Mb)
Trasporto di CO 2. ed effetto Bohr. . La CO 2. nei tessuti produce CO 2. Il consumo di O 2. deve essere rimossa e portata ai polmoni (o alle branchie)
 Trasporto di CO 2 ed effetto Bohr Il consumo di O 2 nei tessuti produce CO 2. La CO 2 deve essere rimossa e portata ai polmoni (o alle branchie) Anidrasi carbonica POLMONI La CO 2 abbassa il ph negli eritrociti
Trasporto di CO 2 ed effetto Bohr Il consumo di O 2 nei tessuti produce CO 2. La CO 2 deve essere rimossa e portata ai polmoni (o alle branchie) Anidrasi carbonica POLMONI La CO 2 abbassa il ph negli eritrociti
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO
 L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
Modulo 4. Una proteina in azione
 Modulo 4 Una proteina in azione Mioglobina ed emoglobina: un esempio di funzionamento di una proteina La funzione della maggior parte della proteine globulari è mediata dall interazione reversibile con
Modulo 4 Una proteina in azione Mioglobina ed emoglobina: un esempio di funzionamento di una proteina La funzione della maggior parte della proteine globulari è mediata dall interazione reversibile con
FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE
 FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE Principi basilari: 1.Le funzioni di molte proteine richiedono il legame reversibile con altre molecole (LIGANDO) Un ligando può essere di natura diversa,
FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE Principi basilari: 1.Le funzioni di molte proteine richiedono il legame reversibile con altre molecole (LIGANDO) Un ligando può essere di natura diversa,
Mioglobina Emoglobina
 Mioglobina Emoglobina Eventi successivi i alla comparsa dell O 2 Possibilità di ottenere circa 20 volte più energia dalla combustione del glucosio Sviluppo di un sistema circolatorio per la distribuzione
Mioglobina Emoglobina Eventi successivi i alla comparsa dell O 2 Possibilità di ottenere circa 20 volte più energia dalla combustione del glucosio Sviluppo di un sistema circolatorio per la distribuzione
FUNZIONI delle PROTEINE
 FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
EME (Fe-PROTOPORFIRINA IX)
 EME (Fe-PROTOPORFIRINA IX) 1,3,5,8-tetrametil 2,4-divinil 6,7-dipropionil-porfirina 1 Il ferro può formare sei legami di coordinazione 4 con gli azoti dell anello tetrapirrolico 2 perpendicolari al piano
EME (Fe-PROTOPORFIRINA IX) 1,3,5,8-tetrametil 2,4-divinil 6,7-dipropionil-porfirina 1 Il ferro può formare sei legami di coordinazione 4 con gli azoti dell anello tetrapirrolico 2 perpendicolari al piano
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
LEZIONE 25: EMOGLOBINA L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO
 LEZIONE 25: EMOGLOBINA L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 25_emoglobina 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata
LEZIONE 25: EMOGLOBINA L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 25_emoglobina 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata
Esempi di proteine: Mioglobina ed Emoglobina
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Esempi di proteine: Mioglobina ed Emoglobina Mioglobina: caratteristiche generali, funzione
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Esempi di proteine: Mioglobina ed Emoglobina Mioglobina: caratteristiche generali, funzione
Il BPG è un importante modulatore dell affinità di Hb per l O 2. - curva iperbolica. - P50 = 1 mm Hg
 L Hb è una proteina allosterica che presenta: - regolazione omotropica O 2 è sia il normale ligando sia il modulatore omotropico - regolazione eterotropica H +, CO 2 e BPG sono modulatori eterotropici
L Hb è una proteina allosterica che presenta: - regolazione omotropica O 2 è sia il normale ligando sia il modulatore omotropico - regolazione eterotropica H +, CO 2 e BPG sono modulatori eterotropici
Emoglobina e mioglobina
 Emoglobina e mioglobina Per poter parlare in modo comprensibile dell emoglobina (Hb), è utile occuparsi prima della mioglobina (Mb) che è molto simile all emoglobina ma è molto più semplice. Tra emoglobina
Emoglobina e mioglobina Per poter parlare in modo comprensibile dell emoglobina (Hb), è utile occuparsi prima della mioglobina (Mb) che è molto simile all emoglobina ma è molto più semplice. Tra emoglobina
GLI ENZIMI ALLOSTERICI hanno più subunità che agiscono in maniera cooperativa. La cinetica enzimatica ha un andamento SIGMOIDE (non MM)
 Effetti allosterici - Modelli d azione GLI ENZIMI ALLOSEICI hanno più subunità che agiscono in maniera cooperativa. La cinetica enzimatica ha un andamento SIGMOIDE (non MM) Negli enzimi allosterici le
Effetti allosterici - Modelli d azione GLI ENZIMI ALLOSEICI hanno più subunità che agiscono in maniera cooperativa. La cinetica enzimatica ha un andamento SIGMOIDE (non MM) Negli enzimi allosterici le
Il metalloma Struttura e reattività di metalloproteine. Il trasporto dell O 2
 Il metalloma Struttura e reattività di metalloproteine Il trasporto dell O 2 Il trasporto dell ossigeno Nel sangue la solubilità dell O 2 è molto maggiore che in H 2 O In H 2 O la solubilità è 6.59 cm
Il metalloma Struttura e reattività di metalloproteine Il trasporto dell O 2 Il trasporto dell ossigeno Nel sangue la solubilità dell O 2 è molto maggiore che in H 2 O In H 2 O la solubilità è 6.59 cm
Esempi di proteine: Mioglobina ed Emoglobina
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica Organica e Biochimica Esempi di proteine: Mioglobina ed Emoglobina Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica Organica e Biochimica Esempi di proteine: Mioglobina ed Emoglobina Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA
 PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Legano reversibilmente l OSSIGENO. La mioglobina (monomerica) è presente nelle cellule muscolari. L emoglobina (tetramerica) è presente negli
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Legano reversibilmente l OSSIGENO. La mioglobina (monomerica) è presente nelle cellule muscolari. L emoglobina (tetramerica) è presente negli
Emoglobina e mioglobina
 Emoglobina e mioglobina Per molti organismi, l O 2 è una molecola di importanza vitale: l'ossigeno è infatti l'accettore finale degli elettroni, che "fluendo" attraverso i complessi della catena respiratoria,
Emoglobina e mioglobina Per molti organismi, l O 2 è una molecola di importanza vitale: l'ossigeno è infatti l'accettore finale degli elettroni, che "fluendo" attraverso i complessi della catena respiratoria,
EMOGLOBINA (Hb) nei globuli rossi e
 Nel metabolismo aerobio l O 2 è l accettore finale nel mitocondrio degli elettroni liberati dai composti carboniosi Proteine leganti l O 2 sono EMOGLOBINA (Hb) nei globuli rossi e MIOGLOBINA nelle fibre
Nel metabolismo aerobio l O 2 è l accettore finale nel mitocondrio degli elettroni liberati dai composti carboniosi Proteine leganti l O 2 sono EMOGLOBINA (Hb) nei globuli rossi e MIOGLOBINA nelle fibre
La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine:
 La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina
La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina
degli eritrociti è una proteina di trasporto indispensabile per veicolare l ossigeno l l anidride carbonica tra i polmoni e i tessuti
 l emoglobina degli eritrociti è una proteina di trasporto indispensabile per veicolare l ossigeno l e l anidride carbonica tra i polmoni e i tessuti Mioglobina, proteina di deposito,, presente nelle fibrocellule
l emoglobina degli eritrociti è una proteina di trasporto indispensabile per veicolare l ossigeno l e l anidride carbonica tra i polmoni e i tessuti Mioglobina, proteina di deposito,, presente nelle fibrocellule
Regolano il metabolismo, sia come enzimi, sia come ormoni (insulina, glucagone, ecc.)
 Grazie alla elevata dinamicità delle strutture proteiche (gli atomi sono in continuo movimento fluttuante) e per la capacità che hanno di legarsi in modo selettivo ad altre molecole, le proteine svolgono
Grazie alla elevata dinamicità delle strutture proteiche (gli atomi sono in continuo movimento fluttuante) e per la capacità che hanno di legarsi in modo selettivo ad altre molecole, le proteine svolgono
Eventi successivi alla comparsa dell O 2
 Eventi successivi alla comparsa dell O 2 Possibilità di ottenere circa 20 volte più energia dalla combustione del glucosio Sviluppo di un sistema circolatorio per la distribuzione dell ossigeno: infatti,
Eventi successivi alla comparsa dell O 2 Possibilità di ottenere circa 20 volte più energia dalla combustione del glucosio Sviluppo di un sistema circolatorio per la distribuzione dell ossigeno: infatti,
Trasporto di O 2 nel sangue
 Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Trasporto dei gas. Pressioni Volumi
 Trasporto dei gas Pressioni Volumi Il 97% dell O 2 trasportato nel plasma si trova chimicamente legato all Hb nei globuli rossi, solo lo 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O
Trasporto dei gas Pressioni Volumi Il 97% dell O 2 trasportato nel plasma si trova chimicamente legato all Hb nei globuli rossi, solo lo 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O
Trasporto gas nel sangue
 Trasporto gas nel sangue Trasporto O2 97% legato all Hb nei globuli rossi 3% fisicamente disciolto, determina il valore di po 2 97% 3% O 2 disciolto nel plasma O 2 legato ad Hb Saturazione Hb 97% 0.3 ml/100ml
Trasporto gas nel sangue Trasporto O2 97% legato all Hb nei globuli rossi 3% fisicamente disciolto, determina il valore di po 2 97% 3% O 2 disciolto nel plasma O 2 legato ad Hb Saturazione Hb 97% 0.3 ml/100ml
EMOGLOBINA (Hb) nei globuli rossi e
 Nel metabolismo aerobio l O 2 è l accettore finale nel mitocondrio degli elettroni liberati dai composti carboniosi Proteine leganti l O 2 sono EMOGLOBINA (Hb) nei globuli rossi e MIOGLOBINA nelle fibre
Nel metabolismo aerobio l O 2 è l accettore finale nel mitocondrio degli elettroni liberati dai composti carboniosi Proteine leganti l O 2 sono EMOGLOBINA (Hb) nei globuli rossi e MIOGLOBINA nelle fibre
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Fisiologia della Respirazione
 Fisiologia della Respirazione 8.Trasporto dei gas nel sangue FGE aa.2016-17 Obiettivi Necessità di un sistema di trasporto chimico ad alta capacità dell O 2 nel sangue: l emoglobina Curva di dissociazione
Fisiologia della Respirazione 8.Trasporto dei gas nel sangue FGE aa.2016-17 Obiettivi Necessità di un sistema di trasporto chimico ad alta capacità dell O 2 nel sangue: l emoglobina Curva di dissociazione
- natura riduttiva - richiede energia
 - natura ossidativa - produce energia - natura riduttiva - richiede energia 1 L O 2 è poco solubile in acqua (10 ml/l a 20 C): se esso fosse semplicemente disciolto, potrebbe diffondere efficacemente solo
- natura ossidativa - produce energia - natura riduttiva - richiede energia 1 L O 2 è poco solubile in acqua (10 ml/l a 20 C): se esso fosse semplicemente disciolto, potrebbe diffondere efficacemente solo
Ogni globina ha una tasca in cui lega un gruppo EME, quindi l Hb può legare e trasportare 4 molecole di O 2
 Emoglobina (Hb): tetramero (le globine si associano formando due copie di dimeri αβ (α 1 β 1 e α 2 β 2 ) che si associano a formare un tetramero attraverso interazioni idrofobiche, legami H e ponti salini
Emoglobina (Hb): tetramero (le globine si associano formando due copie di dimeri αβ (α 1 β 1 e α 2 β 2 ) che si associano a formare un tetramero attraverso interazioni idrofobiche, legami H e ponti salini
Emoglobina e mioglobina
 Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
Fisiologia della Respirazione 8.Trasporto dei gas nel sangue. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 Fisiologia della Respirazione 8.Trasporto dei gas nel sangue Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Obiettivi Necessità di un sistema di trasporto chimico ad alta capacità
Fisiologia della Respirazione 8.Trasporto dei gas nel sangue Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Obiettivi Necessità di un sistema di trasporto chimico ad alta capacità
Dipartimento di Biochimica e Biofisica F. Cedrangolo Emoglobina ed introduzione alle emoglobinopatie.
 Dipartimento di Biochimica e Biofisica F. Cedrangolo Emoglobina ed introduzione alle emoglobinopatie. Trasportatori di Ossigeno nei Vertebrati Mioglobina Emoglobina Muscoli Sangue L Emoglobina (Hb) Struttura
Dipartimento di Biochimica e Biofisica F. Cedrangolo Emoglobina ed introduzione alle emoglobinopatie. Trasportatori di Ossigeno nei Vertebrati Mioglobina Emoglobina Muscoli Sangue L Emoglobina (Hb) Struttura
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
CORSO MONODISCIPLINARE DI BIOCHIMICA (6 CFU)
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE DI BIOCHIMICA (6 CFU) Roberto Giacominelli Stuffler IL CORSO MONODISCIPLINARE DI BIOCHIMICA È SUDDIVISO IN DUE UNITÀ
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE DI BIOCHIMICA (6 CFU) Roberto Giacominelli Stuffler IL CORSO MONODISCIPLINARE DI BIOCHIMICA È SUDDIVISO IN DUE UNITÀ
θ = (siti occupati)/(siti disponibili totali) Al numeratore ritrovo solo la mioglobina che ha complessato l'ossigeno, solo l'ossigenata)
 LEZIONE DEL 03/04/2017 Emoglobina - complesso del metallo di transizione (ferro protoporfirina IX) complesso metallorganico. Derivazione della curva di legame iperbolica dell'ossigeno della mioglobina
LEZIONE DEL 03/04/2017 Emoglobina - complesso del metallo di transizione (ferro protoporfirina IX) complesso metallorganico. Derivazione della curva di legame iperbolica dell'ossigeno della mioglobina
Il legame dell O 2 con l eme di una subunità determina un cambio conformazionale che facilita l attacco dell O 2 agli altri gruppi eme.
 1 Forma T Forma R Il legame dell O 2 con l eme di una subunità determina un cambio conformazionale che facilita l attacco dell O 2 agli altri gruppi eme. 2 1 3 La forma sigmoide della curva indica che
1 Forma T Forma R Il legame dell O 2 con l eme di una subunità determina un cambio conformazionale che facilita l attacco dell O 2 agli altri gruppi eme. 2 1 3 La forma sigmoide della curva indica che
Gli Enzimi. catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche
 catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche Gli Enzimi Sono le proteine più importanti e più specializzate Presentano un elevato grado di specificità per
catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche Gli Enzimi Sono le proteine più importanti e più specializzate Presentano un elevato grado di specificità per
LA MIOGLOBINA e L EMOGLOBINA
 UNITÀ VET. DIDATTICA DI PROPEDEUTICA BIOCHIMICA LA MIOGLOBINA e L EMOGLOBINA Roberto Giacominelli Stuffler LA MIOGLOBINA E L EMOGLOBINAL I vertebrati hanno selezionato due meccanismi principali per rifornire
UNITÀ VET. DIDATTICA DI PROPEDEUTICA BIOCHIMICA LA MIOGLOBINA e L EMOGLOBINA Roberto Giacominelli Stuffler LA MIOGLOBINA E L EMOGLOBINAL I vertebrati hanno selezionato due meccanismi principali per rifornire
MIOGLOBINA ED EMOGLOBINA
 MIOGLOBINA ED EMOGLOBINA Il passaggio dalla vita anaerobia al metabolismo di tipo aerobico ha rappresentato un vantaggio energetico incredibile. L ossigeno è assolutamente indispensabile per il metabolismo,
MIOGLOBINA ED EMOGLOBINA Il passaggio dalla vita anaerobia al metabolismo di tipo aerobico ha rappresentato un vantaggio energetico incredibile. L ossigeno è assolutamente indispensabile per il metabolismo,
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 10
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 10 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 10 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. Prof. Augusto Parente. Lezione 7. DiSTABiF. Corso di Laurea in SCIENZE BIOLOGICHE
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in SCIENZE BIOLOGICHE Insegnamento di CHIMICA BIOLOGICA Prof. Augusto Parente Anno Accademico 2014-15 Lezione 7 Mioglobina Emoglobina po
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in SCIENZE BIOLOGICHE Insegnamento di CHIMICA BIOLOGICA Prof. Augusto Parente Anno Accademico 2014-15 Lezione 7 Mioglobina Emoglobina po
Emoglobina e mioglobina
 Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
Le proteine che legano ossigeno: 2) emoglobina. identità di sequenza: 18%
 Le proteine che legano ossigeno: 2) emoglobina identità di sequenza: 18% Il legame dell ossigeno all emoglobina Fisiologicamente (2%) o per effetto di sostanze ossidanti, lo ione Fe2+ si trasforma in
Le proteine che legano ossigeno: 2) emoglobina identità di sequenza: 18% Il legame dell ossigeno all emoglobina Fisiologicamente (2%) o per effetto di sostanze ossidanti, lo ione Fe2+ si trasforma in
Lo scambio gassoso negli animali
 Lo scambio gassoso negli animali Durante la RESPIRAZIONE CELLULARE (mitocondri) le cellule consumano O2 e producono CO2 L approvvigionamento di O2 e la rimozione della CO2 avvengono tramite SCAMBI GASSOSI
Lo scambio gassoso negli animali Durante la RESPIRAZIONE CELLULARE (mitocondri) le cellule consumano O2 e producono CO2 L approvvigionamento di O2 e la rimozione della CO2 avvengono tramite SCAMBI GASSOSI
Gli Enzimi. catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche
 catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche Gli Enzimi Sono le proteine più importanti e più specializzate Presentano un elevato grado di specificità per
catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche Gli Enzimi Sono le proteine più importanti e più specializzate Presentano un elevato grado di specificità per
Riabilitativa 2015/2016
 Emoglobina e collageno Spina Riabilitativa 2015/2016 WWW.SUNHOPE.IT Alla grande varietà di strutture tridimensionali corrisponde una grande varietà di funzioni Ogni proteina presenta diversi livelli di
Emoglobina e collageno Spina Riabilitativa 2015/2016 WWW.SUNHOPE.IT Alla grande varietà di strutture tridimensionali corrisponde una grande varietà di funzioni Ogni proteina presenta diversi livelli di
Trasporto O 2 nel sangue
 Trasporto O 2 nel sangue 97% legato all Hb nei globuli rossi 3% fisicamente disciolto (determina il valore di po 2 ) Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb Saturazione Hb 97% 0.3 ml/100ml
Trasporto O 2 nel sangue 97% legato all Hb nei globuli rossi 3% fisicamente disciolto (determina il valore di po 2 ) Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb Saturazione Hb 97% 0.3 ml/100ml
IL TRASPORTO DELL O2
 IL TRASPORTO DELL O2 Trasporto dell ossigeno nel sangue Nel sangue arterioso, alla P O2 di 97mmHg: Fisicamente disciolto nel plasma (0,3ml/100ml sangue) Legato all emoglobina dei globuli rossi (20,1 ml/100ml
IL TRASPORTO DELL O2 Trasporto dell ossigeno nel sangue Nel sangue arterioso, alla P O2 di 97mmHg: Fisicamente disciolto nel plasma (0,3ml/100ml sangue) Legato all emoglobina dei globuli rossi (20,1 ml/100ml
Foto funzioni apparato respiratorio
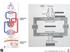 RESPIRAZIONE ESTERNA Foto funzioni apparato respiratorio RESPIRAZIONE INTERNA GLI SCAMBI GASSOSI QUOZIENTE RESPIRATORIO = CO 2 PRODOTTA O 2 CONSUMATO A riposo: Epitelio alveolare 200 ml/min 250 ml/min
RESPIRAZIONE ESTERNA Foto funzioni apparato respiratorio RESPIRAZIONE INTERNA GLI SCAMBI GASSOSI QUOZIENTE RESPIRATORIO = CO 2 PRODOTTA O 2 CONSUMATO A riposo: Epitelio alveolare 200 ml/min 250 ml/min
PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA
 PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA PROTEINE Una proteina è basilarmente una catena polipeptidica (che in termini chimici può anche essere definita
PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA PROTEINE Una proteina è basilarmente una catena polipeptidica (che in termini chimici può anche essere definita
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O2 dagli alveoli al sangue e della
 Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O2 dagli alveoli al sangue e della CO2 in direzione opposta. R = quoziente respiratorio,
Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O2 dagli alveoli al sangue e della CO2 in direzione opposta. R = quoziente respiratorio,
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
Le proteine III. Corso di Biochimica 1. Prof. Giuseppina Pitari
 Le proteine III Corso di Biochimica 1 Prof. Giuseppina Pitari Ossi-mioglobina legame idrogeno lato distale La mioglobina L eme quindi consiste di una struttura organica alla quale è legato un atomo di
Le proteine III Corso di Biochimica 1 Prof. Giuseppina Pitari Ossi-mioglobina legame idrogeno lato distale La mioglobina L eme quindi consiste di una struttura organica alla quale è legato un atomo di
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Il trasporto dell ossigeno
 Prof. Giorgio Sartor Il trasporto dell ossigeno Copyright 2001-2016 by Giorgio Sartor. All rights reserved. Versione 1.9.2 mar 2016 Trasporto dell ossigeno egli organismi aerobi il trasporto dell ossigeno
Prof. Giorgio Sartor Il trasporto dell ossigeno Copyright 2001-2016 by Giorgio Sartor. All rights reserved. Versione 1.9.2 mar 2016 Trasporto dell ossigeno egli organismi aerobi il trasporto dell ossigeno
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
Trasporto dei gas respiratori nel sangue
 Trasporto dei gas respiratori nel sangue La soluzione dei gas nei liquidi C Legge di Henry acq P gas S gas C acq = quantità di gas disciolta nella fase acquosa P gas = pressione parziale del gas nella
Trasporto dei gas respiratori nel sangue La soluzione dei gas nei liquidi C Legge di Henry acq P gas S gas C acq = quantità di gas disciolta nella fase acquosa P gas = pressione parziale del gas nella
20/12/ tipi di amino acidi: parecchie combinazioni
 20 tipi di amino acidi: parecchie combinazioni Le proteine sono polimeri di amino acidi 1 SEMPLICI : costituite solo da amino acidi PROTEINE CONIUGATE Apoproteina = parte proteica Gruppo prostetico = parte
20 tipi di amino acidi: parecchie combinazioni Le proteine sono polimeri di amino acidi 1 SEMPLICI : costituite solo da amino acidi PROTEINE CONIUGATE Apoproteina = parte proteica Gruppo prostetico = parte
end-on (h 1 ) L = NH 3, CN - L Chimica Inorganica Biologica Il diossigeno O 2 Reazioni tra O 2 e metalli: ossidoriduzioni e complessi
 Il diossigeno O 2 Reazioni tra O 2 e metalli: ossidoriduzioni e complessi 4Fe 2+ + O 2 + 2H 2 O + 8 OH - 4(FeOH) 3 2Fe 2 O 3 + H 2 O O 2 interagisce con i metalli ossidandoli e passando allo stato di ox
Il diossigeno O 2 Reazioni tra O 2 e metalli: ossidoriduzioni e complessi 4Fe 2+ + O 2 + 2H 2 O + 8 OH - 4(FeOH) 3 2Fe 2 O 3 + H 2 O O 2 interagisce con i metalli ossidandoli e passando allo stato di ox
 Trigliceridi Colesterolo Esteri del Colesterolo Fosfolipidi Trasporti attraverso le membrane Diffusione facilitata: Scambio dei cloruri o Scambio Cl - /HCO - 3 Cl - HCO3
Trigliceridi Colesterolo Esteri del Colesterolo Fosfolipidi Trasporti attraverso le membrane Diffusione facilitata: Scambio dei cloruri o Scambio Cl - /HCO - 3 Cl - HCO3
ACQUISIZIONE SPERIMENTALE DELLA CONOSCENZA NELLE SCIENZE DELLA NATURA.
 CLM C IN MEDICINA E CHIRURGIA C.I. Metodologia medico-scientifica di base II (Scienze umane 2 Epistemologia) A.A. 2013-2014 I anno, 2 semestre ACQUISIZIONE SPERIMENTALE DELLA CONOSCENZA NELLE SCIENZE DELLA
CLM C IN MEDICINA E CHIRURGIA C.I. Metodologia medico-scientifica di base II (Scienze umane 2 Epistemologia) A.A. 2013-2014 I anno, 2 semestre ACQUISIZIONE SPERIMENTALE DELLA CONOSCENZA NELLE SCIENZE DELLA
Principali meccanismi attraverso i quali una mutazione provoca una patologia
 Principali meccanismi attraverso i quali una mutazione provoca una patologia v Perdita di funzione v Acquisizione di funzione v Produzione di un peptide che, oltre a non svolgere la normale funzione, interferisce
Principali meccanismi attraverso i quali una mutazione provoca una patologia v Perdita di funzione v Acquisizione di funzione v Produzione di un peptide che, oltre a non svolgere la normale funzione, interferisce
CARBOIDRATI C H O ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO
 CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
Scambi gassosi e regolazione del respiro
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ventilazione polmonare Ruolo del Sistema Respiratorio: 1 2 - fornire O 2 - rimuovere
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ventilazione polmonare Ruolo del Sistema Respiratorio: 1 2 - fornire O 2 - rimuovere
Trasporto dell ossigeno
 Prof. Giorgio Sartor Trasporto dell ossigeno Copyright 2001-2011 by Giorgio Sartor. All rights reserved. Versione 0.1 oct 2011 Trasporto dell ossigeno egli organismi aerobi il trasporto dell ossigeno avviene
Prof. Giorgio Sartor Trasporto dell ossigeno Copyright 2001-2011 by Giorgio Sartor. All rights reserved. Versione 0.1 oct 2011 Trasporto dell ossigeno egli organismi aerobi il trasporto dell ossigeno avviene
ammoniaca ammina primaria ammina terziaria ammina secondaria R N H 2
 gruppo funzionale amminico N ammoniaca R N R N R R N R R ammina primaria ammina secondaria ammina terziaria R N 2 Le ammine, come l ammoniaca, hanno carattere basico ed in soluzione acquosa accettano un
gruppo funzionale amminico N ammoniaca R N R N R R N R R ammina primaria ammina secondaria ammina terziaria R N 2 Le ammine, come l ammoniaca, hanno carattere basico ed in soluzione acquosa accettano un
Amminoacidi/peptidi/proteine. Chimica Organica II
 Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE
 VOLUMI POLMONARI DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE DEFINIRE LE RESISTENZE POLMONARI DEFINIRE IL LAVORO POLMONARE Equazione
VOLUMI POLMONARI DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE DEFINIRE LE RESISTENZE POLMONARI DEFINIRE IL LAVORO POLMONARE Equazione
Scambi gassosi e regolazione del respiro
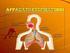 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ruolo del Sistema Respiratorio: - fornire O 2 - rimuovere CO 2 Scaricato da www.sunhope.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ruolo del Sistema Respiratorio: - fornire O 2 - rimuovere CO 2 Scaricato da www.sunhope.it
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
PORTA AGLI ORGANI E AI TESSUTI: RIMUOVE: OMEOTERMI INTERVIENE NELLA TERMOREGOLAZIONE FUNZIONI DELLA CIRCOLAZIONE SANGUIGNA IL GLOBULO ROSSO
 FUNZIONI DELLA CIRCOLAZIONE SANGUIGNA IL GLOBULO ROSSO PORTA AGLI ORGANI E AI TESSUTI: a. L OSSIGENO (O 2 ), b. LE SOSTANZE NUTRITIZIE ASSORBITE, c. I SECRETI DELLE GHIANDOLE ENDOCRINE. RIMUOVE: a. L ANIDRIDE
FUNZIONI DELLA CIRCOLAZIONE SANGUIGNA IL GLOBULO ROSSO PORTA AGLI ORGANI E AI TESSUTI: a. L OSSIGENO (O 2 ), b. LE SOSTANZE NUTRITIZIE ASSORBITE, c. I SECRETI DELLE GHIANDOLE ENDOCRINE. RIMUOVE: a. L ANIDRIDE
LE PROTEINE -struttura tridimensionale-
 LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
Proteine strutturali Sostegno meccanico Cheratina: costituisce i capelli Collagene: costituisce le cartilagini Proteine di immagazzinamento
 Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
CATENA RESPIRATORIA (CR) FOSFORILAZIONE OSSIDATIVA (FO)
 CATENA RESPIRATORIA (CR) FOSFORILAZIONE OSSIDATIVA (FO) - Decarb. ossid. piruvato - -Ossidazione acidi grassi - Vie ossidative aa -Ciclo di Krebs avvengono tutte nella matrice mitocondriale In tutte queste
CATENA RESPIRATORIA (CR) FOSFORILAZIONE OSSIDATIVA (FO) - Decarb. ossid. piruvato - -Ossidazione acidi grassi - Vie ossidative aa -Ciclo di Krebs avvengono tutte nella matrice mitocondriale In tutte queste
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Regolazione allosterica
 Macromolecole Biologiche Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Regolazione allosterica Marco Nardini Dipartimento
Macromolecole Biologiche Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Regolazione allosterica Marco Nardini Dipartimento
Ruolo chiave nella Protein Science Cristallizzata nel 1840 Handbook of Hb crystals 1909 (Reichert & Brown)
 Mb & Hb EMOGLOBINA Ruolo chiave nella Protein Science Cristallizzata nel 1840 Handbook of Hb crystals 1909 (Reichert & Brown) 1 proteina caratterizzata t in ultracentrifuga t 1 proteina a funzione fisiologica
Mb & Hb EMOGLOBINA Ruolo chiave nella Protein Science Cristallizzata nel 1840 Handbook of Hb crystals 1909 (Reichert & Brown) 1 proteina caratterizzata t in ultracentrifuga t 1 proteina a funzione fisiologica
Scaricato da 1
 A AB B Scaricato da www.sunhope.it 1 1 1 1 2 2 2 3 45 5 5 4 20 20 5 40 40 6 40 20 23 7 5 12 8 35 2 6 9 1 1 Numero di mole ecole 30 25 20 15 10 5 0 0 2 4 6 8 10 Energia Scaricato da www.sunhope.it 2 Scaricato
A AB B Scaricato da www.sunhope.it 1 1 1 1 2 2 2 3 45 5 5 4 20 20 5 40 40 6 40 20 23 7 5 12 8 35 2 6 9 1 1 Numero di mole ecole 30 25 20 15 10 5 0 0 2 4 6 8 10 Energia Scaricato da www.sunhope.it 2 Scaricato
Aminoacidi. Struttura generale Sono 20 e formano le
 Aminoacidi Struttura generale Sono 20 e formano le proteine. Oltre a questi ne esistono altri meno comuni Alcuni subiscono modificazioni dopo essere stati inseriti nelle proteine Altri stanno nell organismo
Aminoacidi Struttura generale Sono 20 e formano le proteine. Oltre a questi ne esistono altri meno comuni Alcuni subiscono modificazioni dopo essere stati inseriti nelle proteine Altri stanno nell organismo
LEZIONE DEL 27/03/2017
 LEZIONE DEL 27/03/2017 Struttura primaria sequenze amminoacidiche --> ponti disolfuro; Strutture secondarie (stabilizzate dai legami idrogeno intercatena): dipendono dal legame peptidico; Strutture terziarie
LEZIONE DEL 27/03/2017 Struttura primaria sequenze amminoacidiche --> ponti disolfuro; Strutture secondarie (stabilizzate dai legami idrogeno intercatena): dipendono dal legame peptidico; Strutture terziarie
Proteine: struttura e funzione
 Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA
 PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
Trasporto O 2 nel sangue
 Trasporto O 2 nel sangue 97% legato all Hb nei globuli rossi 3% fisicamente disciolto, determina il valore di po 2 Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb SaturazioneHb 97% 0.3 ml/100ml 19.4
Trasporto O 2 nel sangue 97% legato all Hb nei globuli rossi 3% fisicamente disciolto, determina il valore di po 2 Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb SaturazioneHb 97% 0.3 ml/100ml 19.4
