REAZIONI DI OSSIDORIDUZIONE. Rivista: «Didattica delle Scienze» 5/1991
|
|
|
- Luigi Contini
- 5 anni fa
- Visualizzazioni
Transcript
1 REAZIONI DI OSSIDORIDUZIONE G. Giacomo Guilizzoni Rivista: «Didattica delle Scienze» 5/1991 L Autore illustra un metodo che può essere impiegato con buoni risultati per introdurre gli allievi delle scuole medie superiori allo studio delle reazioni di ossidoriduzione (Nota redazionale). Quasi tutti gli studenti delle medie superiori, e anche universitari, incontrano difficoltà quando affrontano per la prima volta lo studio delle reazioni di ossidoriduzione. Si osservi la seguente reazione, scritta con disinvolta sicurezza da un liceale: 3Cu + 2AlCl 3 (aq) 3CuCl 2 (aq) + 2Al, ineccepibile sulla carta. Il numero di ossidazione del rame passa da 0 a +2? Moltiplichiamo per due l «alluminio cloruro». Quello dell alluminio passa da + 3 a 0? Moltiplichiamo il «rame» per tre, è così semplice! Tuttavia, un piccolo particolare sfugge al ragazzo: la reazione non è attuabile. L alluminio, come è noto, si produce industrialmente per elettrolisi dell allumina fusa ed è stato ottenuto per la prima volta da H.C. Oersted nel 1825, riducendo con potassio, per via secca, l alluminio cloruro. Ancora una volta, ha trovato applicazione una delle divertenti leggi di Edsel Murphy: «Prima tracciate la curva e poi metteteci i vostri punti». Quando si considerano le reazioni di ossidoriduzione come un semplice gioco di coefficienti, magari pretendendo si è verificato anche questo che gli studenti imparino a memoria un certo numero di reazioni già confezionate e prezzate come al supermercato, bastano un ora di lezione e due di esercizi. Le cose cambiano quando si deve insegnare non soltanto come si imposta una reazione di ossidoriduzione ma anche prevedere quando la differenza tra i potenziali redox delle coppie in gioco è sensibile se essa è realizzabile o meno, e anche come calcolare senza tentennamenti la massa equivalente di un ossidante e di un riducente. Le presenti note propongono la scaletta adottata, con buoni risultati, in lunghi anni di pratica negli ITI e nei Corsi professionali per chimici analisti e cercano di essere un aiuto didattico per i colleghi. Va precisato che, per semplificare, le ossidoriduzioni scelte come esempi, in cui le 1
2 differenze tra i potenziali redox delle coppie in gioco sono marcate, non sono considerate reazioni di equilibrio. Parliamo soltanto dell azione Avviene una ossidazione quando il numero di ossidazione di un elemento aumenta. Fe Fe 2+ Fe 2+ Fe 3+ 2Cl - Cl 2 NH 3 NO (0) (+2) (+2) (+3) (-1) (0) (-3) (+2) Avviene una riduzione quando il numero di ossidazione di un elemento diminuisce. Sn 4+ Sn 2+ Sn 2+ Sn H 2 SO 4 SO 2 (+4) (+2) (+2) (0) (+6) (+4) Altri esempi. Nella reazione 3Cu + 8HNO 3 3Cu(NO 3 ) 2 + 4H 2 O + 2NO si verificano una ossidazione, poiché il numero di ossidazione del rame aumenta da 0 a +2, e una riduzione, in quanto il numero di ossidazione dell azoto diminuisce da + 5 a + 2. Nella reazione 2CrO H + Cr 2 O H 2 O il cromo non si ossida né si riduce in quanto il suo numero di ossidazione è + 6 tanto nello ione cromato quanto nello ione dicromato. Parliamo ora anche degli agenti Un ossidante è una sostanza capace di acquistare elettroni da un riducente. Un riducente è una sostanza capace di donare elettroni a un ossidante. Quando un ossidante ossida, si riduce; quando un riducente riduce, si ossida. 2
3 Esempi per gli studenti che all inizio fanno un poco di confusione. Un macellaio macella? Sì, fa il suo mestiere come un ossidante ossida e un riducente riduce. Un macellaio si macella? No, come un ossidante non si ossida e un riducente non si riduce. Rappresentiamo il dare e il ricevere elettroni Per indicare quando una sostanza riducente RED cede elettroni si scrive la semireazione RED altra sostanza + e Per indicare quando una sostanza ossidante OX acquista elettroni si scrive la semireazione OX + e altra sostanza Per il momento, non interessano a chi il riducente cede elettroni e da chi l ossidante li riceve, nè la natura di quelle indicate come «altra sostanza». Lo ione solfuro può cedere due elettroni trasformandosi in zolfo S 2- S + 2e. Avviene una ossidazione, lo ione solfuro agisce da riducente e si ossida a zolfo. Proviamo ora con sostanze probabilmente sconosciute agli studenti, per verificare se hanno capito il concetto. Lo ione esacianoferrato(iii) Fe(CN) 6 3-, quando diventa ione esacianoferrato(ii), Fe(CN) 6 4-, acquista un elettrone Fe(CN) e Fe(CN) 6 4- Avviene una riduzione, lo ione esacianoferrato(iii) agisce da ricucente e si riduce a ione esacianoferrato(ii). 3
4 Risulta un poco più disagevole, per gli studenti alle prime armi, scrivere le semireazioni relative a cationi, magari non ricordando che i segni (+), per un catione, indicano elettroni in meno mentre in un anione i segni (-) indicano elettroni in più. Esempio. Quando il catione stagno(ii) diventa catione stagno(iv), il primo perde due elettroni Sn 2+ Sn e Avviene una ossidazione, lo ione stagno(ii) agisce da riducente e si ossida ad ione stagno(iv). Abbiamo incontrato delle coppie redox Leggiamo ora le semireazioni soprascritte in senso contrario: si nota subito che, quando alla sinistra della freccia vi è un ossidante, alla destra vi è un riducente, e viceversa. L ossidante e il riducente di una semireazione di ossidazione o di riduzione costituiscono una coppia redox OX + e RED Ogni coppia è caratterizzata da un potenziale redox i cui valori, positivi o negativi, sono stati misurati per confronto con la coppia standard 2H + 2e H 2 avente per convenzione potenziale redox zero. Esempi di coppie redox. Br 2 + 2e 2Br - Pb Pb e (ox) (red) (red) (ox) 4
5 Un ossidante e un riducente sono forti quando posseggono grande tendenza rispettivamente ad acquistare e a cedere elettroni; sono deboli nel caso contrario. In una coppia redox, quando l ossidante è forte il riducente è debole, e viceversa. Per convenzione, le tabelle riportate dai Manuali riportano le coppie redox con l ossidante a sinistra della doppia freccia e il riducente a destra; di solito, le coppie sono elencate in ordine decrescente di forza ossidante e quindi in ordine crescente di forza riducente. Nella tabella la prima posizione della coppia (F 2 + 2e 2F - ) ci informa che il fluoro è un fortissimo ossidante, avendo grande tendenza ad acquistare elettroni diventando ione fluoruro, riducente debolissimo. L ultima posizione della coppia (Li + + e Li) ci informa che il litio è un riducente molto forte, avendo grande tendenza a cedere elettroni diventando ione litio, ossidante molto debole. Alcune coppie redox. V + 2,87 F 2 + 2e 2F - + 1,49 MnO e + 8H + Mn H 2 O + 1,36 Cl 2 + 2e 2Cl - + 1,33 Cr 2 O e + 14H + 2Cr H 2 O + 1,20 Pt e Pt + 0,90 ClO - + 2e + H 2 O Cl - + 2OH - + 0,53 I 2 + 2e 2I - + 0,40 O 2 + 4e + H 2 O 4OH - + 0,34 Cu e Cu 0 2H + + 2e H 2-0,41 Fe e Fe - 0,51 S + 2e S ,76 Zn e Zn - 1,71 Al e Al - 2,71 Na + + e Na - 3,04 Li + + e Li L ossidoriduzione come un gioco di coppie 5
6 L ossidoriduzione è una reazione chimica in cui si ha trasferimento di elettroni da un riducente RED ad un ossidante OX, con formazione di un altro riducente red e un altro ossidante ox. Si può considerare come la somma di due semireazioni, una scritta nella direzione in cui il primo riducente cede elettroni e l altra nella direzione in cui il primo ossidante li acquista RED ox + e OX + e red RED + OX red + ox Esempio (attacco dell alluminio da parte di un acido). 2 (Al Al e) - 1,71 V 3 (2H + + 2e H 2 ) 0 V 2Al + 6H + 2Al H 2 (RED) (OX) (ox) (red) Qualunque riducente reagisce con qualunque ossidante? Una reazione di ossidoriduzione avviene quando il potenziale redox della coppia a cui appartiene il riducente RED è inferiore al potenziale redox della coppia cui appartiene l ossidante OX. Consideriamo le due coppie Zn 2+ /Cu e Zn 2+ /Zn. I due ossidanti sono lo ione rame e lo ione zinco; i due riducenti il rame e lo zinco. Immergendo un granello di zinco nella soluzione acquosa di un sale di rame, la superficie del granello diventa rossastra perché lo zinco, appartenente alla coppia avente potenziale redox più basso, si ricopre di rame poiché agisce da riducente cedendo elettroni allo ione rame, l ossidante della coppia con potenziale redox più alto Zn Zn e - 0,76 V 6
7 Cu e Cu + 0,34 V Zn + Cu 2+ Zn 2+ + Cu (RED) (OX) (ox) (red) Immergendo una lastrina di rame nella soluzione di un sale di zinco non avviene nessuna reazione. La reazione tra iodio e sodio cloruro (I 2 + 2NaCl 2NaI + Cl 2 ) ineccepibile sulla carta, non può avvenire perché sarebbe lo iodio ad agire da ossidante acquistando elettroni dallo ione cloruro, cosa impossibile essendo il potenziale redox della coppia I 2 /2I - (+ 0,53 V) inferiore a quello della coppia Cl 2 /2Cl - (1,36 V). Le soluzioni acquose diluite degli acidi contengono lo ione idronio H 3 O + ma possono considerarsi, per semplificare, soluzioni dello ione H +. I metalli delle coppie avente potenziale redox positivo sono attaccati dagli acidi comuni diluiti; i metalli nobili (Au, Pt, Hg, Pd, Ag, Cu), appartenenti a coppie aventi potenziali redox positivi sono inattaccabili dagli acidi comuni ma soltanto dall acido nitrico conc. e dall acido solforico conc., agenti con meccanismi diversi da semplici produttori di H +. Per attaccare oro e platino è necessario ricorrere all acqua regia. Affrontiamo le reazioni più «difficili» Molte molecole e ioni ossidanti e riducenti contengono ossigeno ed operano quasi sempre in soluzione acida o basica; le coppie redox risultano in questo caso «appesantite» dalle formule H +, OH -, H 2 O. La semireazione ox + e red diventa * In soluzione acida: ox + e + H + red + H 2 O * In soluzione basica: ox + e + H 2 O red + OH - Si ricordi quindi che, in soluzione acida l acqua è con il riducente e in soluzione basica con l ossidante. 7
8 L anione bromato BrO 3 - (n.o. di Br = + 5), in soluzione acida, ossida riducendosi a ione bromuro Br - (n.o. di Br = - 1). Ovviamente non è sufficiente scrivere BrO e Br - ma occorre inserire H + con ox e H 2 O con red BrO e + H + Br - + H 2 O Lo ione ipoclorito ClO - (n.o. di Cl = + 1) ossida, in soluzione basica, riducendosi a ione cloruro Cl - (n.o. di Cl = - 1). Si inserisce H 2 O con ox e OH - con red ClO - + e + H 2 O Cl - + OH - Ora bilanciamo le semireazioni In una semireazione devono essere bilanciati tanto gli atomi quanto le cariche elettriche. Si possono seguire due metodi. Il primo, consigliabile per le semireazioni in soluzione acida, non richiede la conoscenza dei numeri di ossidazione degli elementi in gioco. Si bilanciano prima gli atomi e poi le cariche elettriche, trovando alla fine il numero degli elettroni ceduti o acquistati. Esempio. Per bilanciare la riduzione dello ione bromato a ione bromuro scritta sopra si moltiplica per 3 la formula dell acqua e quindi per 6 quella dello ione idrogeno; poichè a sinistra della freccia vi sono 6 1 = 5 cariche positive e a destra 1 carica negativa, gli elettroni in gioco devono essere 6, per cui BrO e + 6H + Br - + 3H 2 O Il secondo metodo, consigliabile per le semireazioni in soluzione basica, richiede anzitutto la conoscenza dei numeri di ossidazione degli elementi in gioco; per differenza si calcola il numero degli elettroni 8
9 acquistati o ceduti e infine si bilanciano prima le cariche elettriche e poi gli atomi. Esempio Per bilanciare la riduzione dello ione ipoclorito a ione cloruro scritta sopra, poichè il numero di ossidazione del cloro passa da + 1 a -1 gli elettroni in gioco sono 2; a sinistra della freccia si trovano 3 cariche negative e a destra 2. Moltiplicando per 2 la formula dello ione OH - tanto le cariche elettriche quanto gli atomi risultano bilanciati ClO - + 2e + H 2 O Cl - + 2OH - Siamo ora in grado di impostare qualunque reazione di ossidoriduzione Ricevuto il tema da svolgere, è consigliabile scrivere la reazione indicando gli ioni quando intervengono acidi, sali o idrossidi solubili e ignorare, in un primo tempo, tutte quelle sostanze in cui non si verificano variazioni del numero di ossidazione (molecole o ioni «spettatori»). a) Il potassio dicromato K 2 Cr 2 O 7, in soluzione acida per acido cloridrico, reagisce con potassio ioduro KI liberando iodio e riducendosi a ione cromo(iii). Gli ioni potassio e cloruro sono quindi soltanto spettatori per cui Cr 2 O H + + 6e 2Cr H 2 O + 1,33 V 3 (I - I 2 + 2e) + 0,53 V Cr 2 O H + + 6I - 2Cr H 2 O + I 2 ovvero K 2 Cr 2 O HCl + 6KI 2CrCl 3 + 8KCl + 7H 2 O + I 2 9
10 b) L idrossido di cromo, in soluzione basica per idrossido di sodio, viene ossidato, dal sodio ipoclorito (che si riduce a cloruro) a ione cromato. Lo ione sodio è quindi soltanto spettatore 2 (Cr(OH) 3 + 5OH - CrO H 2 O + 3e ) 3 (ClO - + H 2 O + 2e Cl - + 2OH - ) 2Cr(OH) 3 + 3ClO - + 4OH - CrO H 2 O + 3Cl - ovvero 2Cr(OH) 3 + 3NaClO + 4NaOH 2Na 2 CrO 4 + 5H 2 O + 3NaCl. 10
Esempi di calcolo del numero di ossidazione
 ESERCITAZIONE 3 1 Esempi di calcolo del numero di ossidazione 1) Calcolare il numero di ossidazione del Mn nel KMnO 4. K n.o. +1 O n.o. 2 La molecola è neutra per cui: n.o. Mn + n.o. K + 4 n.o. O = 0 Mn
ESERCITAZIONE 3 1 Esempi di calcolo del numero di ossidazione 1) Calcolare il numero di ossidazione del Mn nel KMnO 4. K n.o. +1 O n.o. 2 La molecola è neutra per cui: n.o. Mn + n.o. K + 4 n.o. O = 0 Mn
LE REAZIONI DI OSSIDORIDUZIONE
 LE REAZIONI DI OSSIDORIDUZIONE Immergiamo una lamina di zinco metallico in una soluzione di solfato rameico : si osserva immediatamente la formazione di una sostanza solida che nel tempo diventa di color
LE REAZIONI DI OSSIDORIDUZIONE Immergiamo una lamina di zinco metallico in una soluzione di solfato rameico : si osserva immediatamente la formazione di una sostanza solida che nel tempo diventa di color
Bilanciamento delle reazioni chimiche
 Bilanciamento delle reazioni chimiche Con reazioni di ossido riduzione si intende una vasta classe di reazioni che implicano un trasferimento elettronico più o meno evidente. Ad esempio il trasferimento
Bilanciamento delle reazioni chimiche Con reazioni di ossido riduzione si intende una vasta classe di reazioni che implicano un trasferimento elettronico più o meno evidente. Ad esempio il trasferimento
REAZIONI DI OSSIDO-RIDUZIONE: ESERCIZI RISOLTI. Dr. Francesco Musiani
 REAZIONI DI OSSIDO-RIDUZIONE: ESERCIZI RISOLTI Dr. Francesco Musiani Versione aggiornata al 20.12.2011 Zn (s) + NO 3 - Zn 2+ + NH 4 + Zn (s) Ý Zn 2+ (1) NO - + 3 Ý NH 4 (2) - Bilanciamento di (1): In questa
REAZIONI DI OSSIDO-RIDUZIONE: ESERCIZI RISOLTI Dr. Francesco Musiani Versione aggiornata al 20.12.2011 Zn (s) + NO 3 - Zn 2+ + NH 4 + Zn (s) Ý Zn 2+ (1) NO - + 3 Ý NH 4 (2) - Bilanciamento di (1): In questa
Le reazioni di ossido-riduzione
 Le reazioni di ossido-riduzione Con reazioni di ossido riduzione si intende una vasta classe di reazioni che implicano un trasferimento elettronico più o meno evidente da un elemento all altro. Ossidante:
Le reazioni di ossido-riduzione Con reazioni di ossido riduzione si intende una vasta classe di reazioni che implicano un trasferimento elettronico più o meno evidente da un elemento all altro. Ossidante:
REAZIONI CHIMICHE. Idrogeno + ossigeno acqua
 REAZIONI CHIMICHE Reagenti Prodotti L unità che si conserva è l atomo, durante una reazione cambia solo la disposizione relative degli atomi. Si rompono i legami chimici tra le molecole dei reagenti e
REAZIONI CHIMICHE Reagenti Prodotti L unità che si conserva è l atomo, durante una reazione cambia solo la disposizione relative degli atomi. Si rompono i legami chimici tra le molecole dei reagenti e
Reazioni di ossido-riduzione
 Reazioni di ossido-riduzione Con reazioni di ossido riduzione si intende una vasta classe di reazioni che implicano un trasferimento elettronico più o meno evidente. Ad esempio il trasferimento elettronico
Reazioni di ossido-riduzione Con reazioni di ossido riduzione si intende una vasta classe di reazioni che implicano un trasferimento elettronico più o meno evidente. Ad esempio il trasferimento elettronico
Reazioni redox. Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new. University of Camerino, ITALY
 Reazioni redox Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Con reazioni di ossido-riduzione
Reazioni redox Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Con reazioni di ossido-riduzione
Numero o stato di ossidazione. n. ox. (O) = -2 n. ox. (H) = +1
 Si definisce numero o stato di ossidazione l ipotetica carica elettrica che un atomo, facente parte di una molecola, assumerebbe se tutti gli elettroni di legame fossero attribuiti all atomo più elettronegativo.
Si definisce numero o stato di ossidazione l ipotetica carica elettrica che un atomo, facente parte di una molecola, assumerebbe se tutti gli elettroni di legame fossero attribuiti all atomo più elettronegativo.
Osservazioni su alcuni ossidanti comuni che agiscono in soluzione acquosa
 Osservazioni su alcuni ossidanti comuni che agiscono in soluzione acquosa Esercizio: scrivere la reazione corrispondente ad ogni asterisco e bilanciare. PERMANGANATO Il permanganato di potassio K è un
Osservazioni su alcuni ossidanti comuni che agiscono in soluzione acquosa Esercizio: scrivere la reazione corrispondente ad ogni asterisco e bilanciare. PERMANGANATO Il permanganato di potassio K è un
BILANCIAMENTO DELLE REAZIONI REDOX
 BILANCIAMENTO DELLE REAZIONI REDOX NUMERO DI OSSIDAZIONE Per descrivere lo stato di combinazione di un atomo, oltre alla valenza, si può usare il numero di ossidazione. La valenza indica il numero di atomi
BILANCIAMENTO DELLE REAZIONI REDOX NUMERO DI OSSIDAZIONE Per descrivere lo stato di combinazione di un atomo, oltre alla valenza, si può usare il numero di ossidazione. La valenza indica il numero di atomi
Le reazioni di ossido-riduzione Bilanciamento
 Le reazioni di ossidoriduzione Bilanciamento BILANCIAMENTO DELLE REAZIONI REDOX La determinazione degli esatti coefficienti stechiometrici delle reazioni redox è spesso oltremodo difficoltosa da eseguirsi
Le reazioni di ossidoriduzione Bilanciamento BILANCIAMENTO DELLE REAZIONI REDOX La determinazione degli esatti coefficienti stechiometrici delle reazioni redox è spesso oltremodo difficoltosa da eseguirsi
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
Ossidazione. 4 Fe + 3 O 2 2 Fe 2 O 3
 Reazioni redox Ossidazione Nel linguaggio comune, con il termine di "ossidazione" si intende indicare le trasformazioni che subiscono i metalli (o anche altre sostanze) quando sono esposti all'aria per
Reazioni redox Ossidazione Nel linguaggio comune, con il termine di "ossidazione" si intende indicare le trasformazioni che subiscono i metalli (o anche altre sostanze) quando sono esposti all'aria per
3. Le Reazioni Chimiche
 . Le Reazioni Chimiche Equazioni Chimiche e Reazioni Chimiche il simbolismo delle reazioni chimiche il bilanciamento delle equazioni chimiche Reazioni di Precipitazione le soluzioni acquose le reazioni
. Le Reazioni Chimiche Equazioni Chimiche e Reazioni Chimiche il simbolismo delle reazioni chimiche il bilanciamento delle equazioni chimiche Reazioni di Precipitazione le soluzioni acquose le reazioni
Reazioni ed Equazioni Chimiche. Coefficienti stechiometrici :
 Reazioni ed Equazioni Chimiche Reazione chimica Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI) Equazioni chimiche Traduzione scritta delle reazioni chimiche Per scrivere
Reazioni ed Equazioni Chimiche Reazione chimica Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI) Equazioni chimiche Traduzione scritta delle reazioni chimiche Per scrivere
La reazione da bilanciare è quindi: Cu + HNO 3 CuNO 3 + NO. Le due semireazioni da bilanciare saranno: HNO 3 NO (1) Cu CuNO 3 (2)
 Introducendo rame metallico (Cu) in acido nitrico diluito (HNO 3 ) si forma nitrato di rame (CuNO 3 ) e gas ossido nitrico (NO). Scrivere l equazione chimica bilanciata della reazione. La reazione da bilanciare
Introducendo rame metallico (Cu) in acido nitrico diluito (HNO 3 ) si forma nitrato di rame (CuNO 3 ) e gas ossido nitrico (NO). Scrivere l equazione chimica bilanciata della reazione. La reazione da bilanciare
Le reazioni di ossidoriduzione
 Le reazioni di ossidoriduzione Le reazioni di ossidoriduzioni o redox sono reazioni nelle quali si ha variazione del numero di ossidazione ( n. o. ) di ioni o atomi. La specie chimica che si ossida cede
Le reazioni di ossidoriduzione Le reazioni di ossidoriduzioni o redox sono reazioni nelle quali si ha variazione del numero di ossidazione ( n. o. ) di ioni o atomi. La specie chimica che si ossida cede
1 Me Me (s) Me + (aq) + e -
 ELETTROCHIMICA 1 Me Me (s) Me + (aq) + e - Me + DOPPIO STRATO (+) (-) all interfaccia elettrodo-soluzione 2 Se inizialmente prevale la reazione 1, la lamina metallica si carica negativamente (eccesso di
ELETTROCHIMICA 1 Me Me (s) Me + (aq) + e - Me + DOPPIO STRATO (+) (-) all interfaccia elettrodo-soluzione 2 Se inizialmente prevale la reazione 1, la lamina metallica si carica negativamente (eccesso di
Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI)
 Reazioni ed Equazioni Chimiche Reazione chimica Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI) Equazioni chimiche Traduzione scritta delle reazioni chimiche Per scrivere
Reazioni ed Equazioni Chimiche Reazione chimica Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI) Equazioni chimiche Traduzione scritta delle reazioni chimiche Per scrivere
COME CALCOLARE I NUMERI DI OSSIDAZIONE
 COME CALCOLARE I NUMERI DI OSSIDAZIONE 1. Il numero di ossidazione (N.O.) degli atomi nelle sostanze elementari è zero 2. I seguenti elementi hanno sempre, nei loro composti, il N.O. indicato: Elemento
COME CALCOLARE I NUMERI DI OSSIDAZIONE 1. Il numero di ossidazione (N.O.) degli atomi nelle sostanze elementari è zero 2. I seguenti elementi hanno sempre, nei loro composti, il N.O. indicato: Elemento
LE REAZIONI CHIMICHE
 LE REAZIONI CHIMICHE Ossido di magnesio Ossigeno Magnesio Magnesio Una reazione chimica è il processo mediante il quale una o più sostanze si trasformano in altre. I materiali di partenza sono detti reagenti,
LE REAZIONI CHIMICHE Ossido di magnesio Ossigeno Magnesio Magnesio Una reazione chimica è il processo mediante il quale una o più sostanze si trasformano in altre. I materiali di partenza sono detti reagenti,
Reazioni di ossido-riduzione (red-ox)
 Reazioni di ossido-riduzione (red-ox) numero di ossidazione (n.ox.) : la carica formale fittizia che un elemento o un composto assumono ipotizzando una completa separazione delle cariche di legame es.
Reazioni di ossido-riduzione (red-ox) numero di ossidazione (n.ox.) : la carica formale fittizia che un elemento o un composto assumono ipotizzando una completa separazione delle cariche di legame es.
Una reazione chimica rappresenta un processo di trasformaczioni in cui si rompono e si formano legami chimici. γc + δd
 Una reazione chimica rappresenta un processo di trasformaczioni in cui si rompono e si formano legami chimici αa + βb γc + δd - A e B: reagenti - C e D: prodotti - α,β,γ e δ: coefficienti stechiometrici
Una reazione chimica rappresenta un processo di trasformaczioni in cui si rompono e si formano legami chimici αa + βb γc + δd - A e B: reagenti - C e D: prodotti - α,β,γ e δ: coefficienti stechiometrici
NOMENCLATURA E REAZIONI
 NOMENCLATURA E REAZIONI Gli elementi chimici si dividono in: METALLI e NON METALLI I METALLI, perdendo elettroni, originano IONI POSITIVI (o CATIONI) I NON METALLI, acquistando elettroni, originano IONI
NOMENCLATURA E REAZIONI Gli elementi chimici si dividono in: METALLI e NON METALLI I METALLI, perdendo elettroni, originano IONI POSITIVI (o CATIONI) I NON METALLI, acquistando elettroni, originano IONI
Reazioni di ossido-riduzione
 Reazioni di ossido-riduzione Secondo la teoria di Bronsted-Lowry le reazioni acido-base possono essere considerate processi di scambio protonico HCl + H 2 O Cl - + H 3 O + Cl H O H H Cl H O H H In questi
Reazioni di ossido-riduzione Secondo la teoria di Bronsted-Lowry le reazioni acido-base possono essere considerate processi di scambio protonico HCl + H 2 O Cl - + H 3 O + Cl H O H H Cl H O H H In questi
DELLE REAZIONI DI OSSIDORIDUZIONE
 Chimica Silvia LICOCCIA Professore Ordinario di Fondamenti Chimici per le Tecnologie Dipartimento di Scienze e Tecnologie Chimiche Università di Roma Tor Vergata BILANCIAMENTO DELLE REAZIONI DI OSSIDORIDUZIONE
Chimica Silvia LICOCCIA Professore Ordinario di Fondamenti Chimici per le Tecnologie Dipartimento di Scienze e Tecnologie Chimiche Università di Roma Tor Vergata BILANCIAMENTO DELLE REAZIONI DI OSSIDORIDUZIONE
Brady Senese Pignocchino Chimica.blu Zanichelli 2014 Soluzione degli esercizi Capitolo 17
 Brady Senese Pignocchino Chimica.blu Zanichelli 2014 Soluzione degli esercizi Capitolo 17 Esercizio Risposta PAG 387 ES 1 In una ossidazione il reagente perde elettroni e aumenta il proprio numero di ossidazione.
Brady Senese Pignocchino Chimica.blu Zanichelli 2014 Soluzione degli esercizi Capitolo 17 Esercizio Risposta PAG 387 ES 1 In una ossidazione il reagente perde elettroni e aumenta il proprio numero di ossidazione.
Elettrochimica unità 2 e 3, modulo G del libro
 Elettrochimica unità 2 e 3, modulo G del libro Data una reazione chimica in cui si verifica uno scambio di elettroni, ci sarà una specie che si ossida, e cioè cede elettroni, ed una specie che si riduce
Elettrochimica unità 2 e 3, modulo G del libro Data una reazione chimica in cui si verifica uno scambio di elettroni, ci sarà una specie che si ossida, e cioè cede elettroni, ed una specie che si riduce
Argomenti 2 lezione. Bilanciamento delle reazioni chimiche. Resa teorica e resa effettiva. Esercitazioni di Chimica Generale ed Inorganica 2
 Un composto contenente sodio, cloro e ossigeno ha una percentuale in massa di sodio del 25.42. Se 3.25 g di tale composto forniscono 4.33 x 10 22 atomi di ossigeno, calcolare la formula minima. Na: 25.42
Un composto contenente sodio, cloro e ossigeno ha una percentuale in massa di sodio del 25.42. Se 3.25 g di tale composto forniscono 4.33 x 10 22 atomi di ossigeno, calcolare la formula minima. Na: 25.42
ESERCIZI DI RIEPILOGO GENERALE
 ESERCIZI DI RIEPILOGO GENERALE 1) Scrivere le formule brute e le formule di Lewis per: ammoniaca; ione ammonio; ione solfato; ione bicarbonato; acido acetico; anidride solforosa. Dove necessario, indicare
ESERCIZI DI RIEPILOGO GENERALE 1) Scrivere le formule brute e le formule di Lewis per: ammoniaca; ione ammonio; ione solfato; ione bicarbonato; acido acetico; anidride solforosa. Dove necessario, indicare
PROCEDURA PER REAZIONE REDOX. 1) scrivo la reazione come presentata ( cioè non completa e non bilanciata) AB A + B AX + BZ AY + BK.
 PROCEDURA PER REAZIONE REDOX 1) scrivo la reazione come presentata ( cioè non completa e non bilanciata).... 2) verifico quale è l'ossidante e il riducente ( sapendo che ossidante + e riducente) dai numeri
PROCEDURA PER REAZIONE REDOX 1) scrivo la reazione come presentata ( cioè non completa e non bilanciata).... 2) verifico quale è l'ossidante e il riducente ( sapendo che ossidante + e riducente) dai numeri
NUMERO DI OSSIDAZIONE Es. HCl H + Cl - H = +1 Cl = -1 H 2. O 2 H + O 2- H = +1 O = -2 Es. NaCl Na + Cl - Na = +1 Cl = -1
 NUMERO DI OSSIDAZIONE Es. HCl H + Cl - H = +1 Cl = -1 H 2 O 2 H + O 2- H = +1 O = -2 Es. NaCl Na + Cl - Na = +1 Cl = -1 Es. H-H, O=O, Cu, Fe N OX = 0 H: +1, (tranne che negli idruri metallici es. NaH:
NUMERO DI OSSIDAZIONE Es. HCl H + Cl - H = +1 Cl = -1 H 2 O 2 H + O 2- H = +1 O = -2 Es. NaCl Na + Cl - Na = +1 Cl = -1 Es. H-H, O=O, Cu, Fe N OX = 0 H: +1, (tranne che negli idruri metallici es. NaH:
LE REAZIONI DI OSSIDO-RIDUZIONE O REAZIONI REDOX
 LE REAZIONI DI OSSIDO-RIDUZIONE O REAZIONI REDOX Sono delle reazioni chimiche in cui si ha trasferimento di elettroni da una specie riducente che si ossida ad un altra specie ossidante, che si riduce:
LE REAZIONI DI OSSIDO-RIDUZIONE O REAZIONI REDOX Sono delle reazioni chimiche in cui si ha trasferimento di elettroni da una specie riducente che si ossida ad un altra specie ossidante, che si riduce:
Esercizi di stechiometria
 Esercizi di stechiometria La reazione globale da bilanciare) per ottenere il carbonato di sodio secondo il processo di Solvay è la seguente: Calcolare quanto cloruro di sodio NaCl) occorre per ottenere
Esercizi di stechiometria La reazione globale da bilanciare) per ottenere il carbonato di sodio secondo il processo di Solvay è la seguente: Calcolare quanto cloruro di sodio NaCl) occorre per ottenere
Numero di ossidazione
 Numero di ossidazione Si definisce numero di ossidazione la carica elettrica che l elemento assume in un composto se si pensa di associare gli elettroni di ciascun legame all atomo considerato più elettronegativo
Numero di ossidazione Si definisce numero di ossidazione la carica elettrica che l elemento assume in un composto se si pensa di associare gli elettroni di ciascun legame all atomo considerato più elettronegativo
Appunti di Stechiometria per Chimica Numero d ossidazione
 Appunti di Stechiometria per Chimica Numero d ossidazione Si definisce numero d ossidazione la carica complessiva di un atomo (differenza tra protoni ed elettroni dell atomo), ottenuta assegnando, solo
Appunti di Stechiometria per Chimica Numero d ossidazione Si definisce numero d ossidazione la carica complessiva di un atomo (differenza tra protoni ed elettroni dell atomo), ottenuta assegnando, solo
Olimpiadi di Chimica
 Olimpiadi di Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Massa atomica è la massa di un atomo espressa in unità di massa atomica (uma) Per definizione: 1 atomo 12 C pesa 12 uma
Olimpiadi di Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Massa atomica è la massa di un atomo espressa in unità di massa atomica (uma) Per definizione: 1 atomo 12 C pesa 12 uma
SOLUBILITA EQUILIBRI ETEROGENEI
 SOLUBILITA EQUILIBRI ETEROGENEI Cosa succede quando si scioglie un sale (NaCl) in acqua Cl - LEGAME IONE DIPOLO Se sciogliamo in un solvente polare (tipo H 2 O) una sostanza ionica(tipo NaCl) questa si
SOLUBILITA EQUILIBRI ETEROGENEI Cosa succede quando si scioglie un sale (NaCl) in acqua Cl - LEGAME IONE DIPOLO Se sciogliamo in un solvente polare (tipo H 2 O) una sostanza ionica(tipo NaCl) questa si
1) Bilanciare la seguente reazione redox con il metodo ionico-elettronico Ag (s) + H + (aq) + NO 3
 A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
ossidazione/riduzione, ossidante/riducente
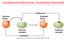 ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox 0 +5 +2 +4 Cu(s) + HNO 3 (aq) Cu(NO 3 ) 2 + NO 2 (g) + H 2 O(l) Determinazione dei numeri di ossidazione Cu(s) + 2HNO 3 (aq)
ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox 0 +5 +2 +4 Cu(s) + HNO 3 (aq) Cu(NO 3 ) 2 + NO 2 (g) + H 2 O(l) Determinazione dei numeri di ossidazione Cu(s) + 2HNO 3 (aq)
NUMERI DI OSSIDAZIONE
 NUMERI DI SSIDAZINE Il numero di ossidazione degli elementi allo stato libero è ZER La somma algebrica dei numeri di ossidazione di tutti gli atomi di una molecola neutra è ZER La somma algebrica dei numeri
NUMERI DI SSIDAZINE Il numero di ossidazione degli elementi allo stato libero è ZER La somma algebrica dei numeri di ossidazione di tutti gli atomi di una molecola neutra è ZER La somma algebrica dei numeri
Coefficienti stechiometrici: sono di norma i numeri interi più piccoli possibili Indicare lo stato di aggregazione delle sostanze
 REAZIONI CHIMICHE 2A+B î 3C + D reagenti prodotti Equazione chimica Coefficienti stechiometrici: sono di norma i numeri interi più piccoli possibili Indicare lo stato di aggregazione delle sostanze Na
REAZIONI CHIMICHE 2A+B î 3C + D reagenti prodotti Equazione chimica Coefficienti stechiometrici: sono di norma i numeri interi più piccoli possibili Indicare lo stato di aggregazione delle sostanze Na
Soluzioni. B è spontanea nel senso opposto alla freccia. 12 Soluzione di HF in un contenitore di rame: C La soluzione rimane inalterata.
 Soluzioni capitolo 23 VERIFICA LE TUE CONOSCENZE LA PILA O CELLA GALVANICA 1 Una cella galvanica trasforma energia chimica in energia elettrica, utilizzando una redox spontanea. Una cella galvanica è formata
Soluzioni capitolo 23 VERIFICA LE TUE CONOSCENZE LA PILA O CELLA GALVANICA 1 Una cella galvanica trasforma energia chimica in energia elettrica, utilizzando una redox spontanea. Una cella galvanica è formata
ossidazione/riduzione, ossidante/riducente
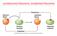 ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox +6-1 -1 +3-1 K 2 Cr 2 O 7 (aq) + HI(aq) KI(aq) + CrI 3 (aq) + I 2 (s) + H 2 O(l) 0 K 2 Cr 2 O 7 (aq) + 6HI(aq) KI(aq) + 2CrI
ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox +6-1 -1 +3-1 K 2 Cr 2 O 7 (aq) + HI(aq) KI(aq) + CrI 3 (aq) + I 2 (s) + H 2 O(l) 0 K 2 Cr 2 O 7 (aq) + 6HI(aq) KI(aq) + 2CrI
EQUILIBRI IN SOLUZIONE
 EQUILIBRI IN SOLUZIONE Tra tutti i solventi l acqua è quello che maggiormente favorisce la dissociazione elettrolitica. Gli equilibri in soluzione costituiscono quindi una classe di reazioni molto importanti.
EQUILIBRI IN SOLUZIONE Tra tutti i solventi l acqua è quello che maggiormente favorisce la dissociazione elettrolitica. Gli equilibri in soluzione costituiscono quindi una classe di reazioni molto importanti.
4 Fe + 3 O2 ---> 2 Fe2O3
 Reazioni redox Ossidazione Nel linguaggio comune, con il termine di "ossidazione" si intende indicare le trasformazioni che subiscono i metalli (o anche altre sostanze) quando sono esposti all'aria per
Reazioni redox Ossidazione Nel linguaggio comune, con il termine di "ossidazione" si intende indicare le trasformazioni che subiscono i metalli (o anche altre sostanze) quando sono esposti all'aria per
Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio:
 Reazioni chimiche Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio: CH 4 + 2O 2 CO 2 + 2H 2 O La reazione chimica è formata da reagenti
Reazioni chimiche Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio: CH 4 + 2O 2 CO 2 + 2H 2 O La reazione chimica è formata da reagenti
Chimica Generale. Reazioni Chimiche. Reazioni Chimiche
 Una reazione chimica è un processo in cui avviene un cambiamento chimico di uno o più composti, detti reagenti, che vengono convertiti in una nuova serie di composti detti prodotti. Spesso le reazioni
Una reazione chimica è un processo in cui avviene un cambiamento chimico di uno o più composti, detti reagenti, che vengono convertiti in una nuova serie di composti detti prodotti. Spesso le reazioni
2- (aq) + Zn (s) Zn 2+ (aq) + SO 4. Semi-reazione di ossidazione: in cui una specie chimica perde elettroni
 Reazioni con trasferimento di elettroni Modifica della struttura elettronica attraverso uno scambio di elettroni: Una ossidazione può avvenire soltanto se avviene contemporaneamente una riduzione (reazioni
Reazioni con trasferimento di elettroni Modifica della struttura elettronica attraverso uno scambio di elettroni: Una ossidazione può avvenire soltanto se avviene contemporaneamente una riduzione (reazioni
Reazioni di ossido-riduzione
 Reazioni di ossido-riduzione Secondo la teoria di Bronsted-Lowry le reazioni acido-base possono essere considerate processi di scambio protonico HCl + H 2 O Cl - + H 3 O + H Cl H O H Cl H O H H In questi
Reazioni di ossido-riduzione Secondo la teoria di Bronsted-Lowry le reazioni acido-base possono essere considerate processi di scambio protonico HCl + H 2 O Cl - + H 3 O + H Cl H O H Cl H O H H In questi
BILANCIAMENTO REAZIONE DI OSSIDO-RIDUZIONE
 http://aliceappunti.altervista.org BILANCIAMENTO REAZIONE DI OSSIDO-RIDUZIONE TESTO: Il permanganato di potassio viene aggiunto ad una soluzione acida contenente perossido di idrogeno (acqua ossigenata).
http://aliceappunti.altervista.org BILANCIAMENTO REAZIONE DI OSSIDO-RIDUZIONE TESTO: Il permanganato di potassio viene aggiunto ad una soluzione acida contenente perossido di idrogeno (acqua ossigenata).
Chimica generale. Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari PARTE 2-2
 Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari PARTE 2-2 1 Molecole, moli, equazioni chimiche, bilanciamento delle
Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari PARTE 2-2 1 Molecole, moli, equazioni chimiche, bilanciamento delle
Le reazioni chimiche 2
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Reazioni in Soluzioni Acquose. Capitolo 4
 Reazioni in Soluzioni Acquose Capitolo 4 Una soluzione è una miscela omogenea di 2 o più sostanze Il soluto è(sono) la(le) sostanza(e) presente(i) in minore quantità Il solvente è la sostanza presente
Reazioni in Soluzioni Acquose Capitolo 4 Una soluzione è una miscela omogenea di 2 o più sostanze Il soluto è(sono) la(le) sostanza(e) presente(i) in minore quantità Il solvente è la sostanza presente
NOMENCLATURA DEI COMPOSTI CHIMICI
 NOMENCLATURA DEI COMPOSTI CHIMICI Agli albori della chimica non c erano regole di nomenclatura; per individuare i composti si usavano dei nomi comuni che generalmente derivavano da loro proprietà organolettiche
NOMENCLATURA DEI COMPOSTI CHIMICI Agli albori della chimica non c erano regole di nomenclatura; per individuare i composti si usavano dei nomi comuni che generalmente derivavano da loro proprietà organolettiche
La formula chimica di una sostanza nota la sua composizione %
 La formula chimica di una sostanza nota la sua composizione % Si consideri la sostanza costituita dagli elementi A, B e C e sia nota la sua composizione %, che si ottiene sperimentalmente 1. Si divide
La formula chimica di una sostanza nota la sua composizione % Si consideri la sostanza costituita dagli elementi A, B e C e sia nota la sua composizione %, che si ottiene sperimentalmente 1. Si divide
Il numero di ossidazione
 Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
Nomenclatura delle sostanze chimiche
 Nomenclatura delle sostanze chimiche SOSTANZE CHIMICHE!1 ELEMENTI Metalli Non metalli COMPOSTI Ossidi Anidridi Idrossidi Acidi Sali Idruri - ossiacidi - idracidi METALLI!2 Duttili Malleabili Buoni conduttori
Nomenclatura delle sostanze chimiche SOSTANZE CHIMICHE!1 ELEMENTI Metalli Non metalli COMPOSTI Ossidi Anidridi Idrossidi Acidi Sali Idruri - ossiacidi - idracidi METALLI!2 Duttili Malleabili Buoni conduttori
Il numero di ossidazione
 Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
Elettrochimica. Studia la relazione fra variazione di energia libera e flussi di cariche in una reazione chimica.
 Elettrochimica Studia la relazione fra variazione di energia libera e flussi di cariche in una reazione chimica. Fornisce il modo per ricavare lavoro elettrico da una reazione spontanea = cella galvanica
Elettrochimica Studia la relazione fra variazione di energia libera e flussi di cariche in una reazione chimica. Fornisce il modo per ricavare lavoro elettrico da una reazione spontanea = cella galvanica
Il numero di ossidazione
 Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
NOMENCLATURA CHIMICA. NOMENCLATURA COMPOSTI ORGANICI Rimandata al corso di. (prossimo semestre) Nomi sistematici Nomi comuni
 NOMENCLATURA CHIMICA NOMENCLATURA COMPOSTI ORGANICI Rimandata al corso di NOMENCLATURA COMPOSTI INORGANICI Chimica Organica (prossimo semestre) Nomi sistematici Nomi comuni IONI Cationi Nei casi più semplici,
NOMENCLATURA CHIMICA NOMENCLATURA COMPOSTI ORGANICI Rimandata al corso di NOMENCLATURA COMPOSTI INORGANICI Chimica Organica (prossimo semestre) Nomi sistematici Nomi comuni IONI Cationi Nei casi più semplici,
2 H 2 + O 2 2 H 2 O 2 Na + 2 H 2 O 2 Na + + H OH
 Le equazioni chimiche devono essere BILANCIATE, cioè devono indicare le quantità di sostanze che partecipano alla reazione: 1) Legge di conservazione della massa: in una reazione chimica non si creano
Le equazioni chimiche devono essere BILANCIATE, cioè devono indicare le quantità di sostanze che partecipano alla reazione: 1) Legge di conservazione della massa: in una reazione chimica non si creano
Reazioni Redox. Riferimento Elemento libero, cioè singolo atomo, o combinato con se stesso (Na, O 2, Cl 2, O 3 ) Ossigeno -2.
 Reazioni Redox Ad ogni elemento di un dato composto si attribuisce un numero di ossidazione, N.O., corrispondente ad una carica elettrica fittizia, multiplo, positivo o negativo, della carica elettronica.
Reazioni Redox Ad ogni elemento di un dato composto si attribuisce un numero di ossidazione, N.O., corrispondente ad una carica elettrica fittizia, multiplo, positivo o negativo, della carica elettronica.
Dai coefficienti stechiometrici si deduce che 4 atomi K reagiscono con 1 molecola O 2 la
 REAZIONI DI OSSIDO-RIDUZIONE o REDOX. Sono reazioni nelle quali uno o più elementi subiscono una variazione del numero di ossidazione. Se una specie chimica subisce un aumento del numero di ossidazione
REAZIONI DI OSSIDO-RIDUZIONE o REDOX. Sono reazioni nelle quali uno o più elementi subiscono una variazione del numero di ossidazione. Se una specie chimica subisce un aumento del numero di ossidazione
Università di Catania Facoltà di Ingegneria CdL Ingegneria Recupero Edilizio Ambientale ESERCIZI DI CHIMICA. Prof. Antonino Mamo
 Università di Catania Facoltà di Ingegneria CdL Ingegneria Recupero Edilizio Ambientale ESERCIZI DI CHIMICA Prof. Antonino Mamo 1) Scrivere le formule di struttura dei seguenti sali: a) permanganato di
Università di Catania Facoltà di Ingegneria CdL Ingegneria Recupero Edilizio Ambientale ESERCIZI DI CHIMICA Prof. Antonino Mamo 1) Scrivere le formule di struttura dei seguenti sali: a) permanganato di
CorsI di Laurea in Ingegneria Aereospaziale-Meccanica-Energetica. FONDAMENTI DI CHIMICA Docente: Cristian Gambarotti. Esercitazione del 22/12/2010
 CorsI di Laurea in Ingegneria Aereospaziale-Meccanica-Energetica FNDAMENTI DI CIMICA Docente: Cristian Gambarotti Esercitazione del /1/010 ARGMENTI TRATTATI DURANTE LA LEZINE Numeri di ossidazione Bilanciamento
CorsI di Laurea in Ingegneria Aereospaziale-Meccanica-Energetica FNDAMENTI DI CIMICA Docente: Cristian Gambarotti Esercitazione del /1/010 ARGMENTI TRATTATI DURANTE LA LEZINE Numeri di ossidazione Bilanciamento
BaSO. BaSO 4 è una costante quindi: K ps = prodotto di solubilità
 Gli equilibri di solubilità sono equilibri eterogenei in quanto si stabiliscono tra due fasi: un solido e la soluzione satura dei suoi ioni. Sono gli equilibri che coinvolgono le reazioni di dissoluzione
Gli equilibri di solubilità sono equilibri eterogenei in quanto si stabiliscono tra due fasi: un solido e la soluzione satura dei suoi ioni. Sono gli equilibri che coinvolgono le reazioni di dissoluzione
9065X Chimica. Modello esame svolto. Esempio di compito scritto di Chimica. Politecnico di Torino CeTeM
 svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
CCS Biologia CCS Scienze Geologiche
 2016 2017 http://192.146.242.139/biologia/it/docenti/francesco-isaia CCS Biologia CCS Scienze Geologiche Le reazioni chimiche Esercizi di preparazione all'esame: (dal testo consigliato Chimica di Kotz
2016 2017 http://192.146.242.139/biologia/it/docenti/francesco-isaia CCS Biologia CCS Scienze Geologiche Le reazioni chimiche Esercizi di preparazione all'esame: (dal testo consigliato Chimica di Kotz
Aspetti quali-quantitativi delle reazioni chimiche unità 1, modulo B del libro unità 2, modulo E del libro
 Aspetti quali-quantitativi delle reazioni chimiche unità 1, modulo B del libro unità 2, modulo E del libro Trovare una bilancia che possa pesare un atomo è un sogno irrealizzabile. Non potendo determinare
Aspetti quali-quantitativi delle reazioni chimiche unità 1, modulo B del libro unità 2, modulo E del libro Trovare una bilancia che possa pesare un atomo è un sogno irrealizzabile. Non potendo determinare
Problema 1 Mg + 2HCl H 2 + MgCl 2. di Mg 1 Mg 1 H 2 quindi 0,823 moli di H 2 di H 2
 REAZIONI CHIMICHE 1. Con riferimento alla seguente reazione (da bilanciare): Mg + HCl H 2 + MgCl 2 calcolare i grammi di H 2 che si ottengono facendo reagire completamente 20 g di magnesio. utilizzando
REAZIONI CHIMICHE 1. Con riferimento alla seguente reazione (da bilanciare): Mg + HCl H 2 + MgCl 2 calcolare i grammi di H 2 che si ottengono facendo reagire completamente 20 g di magnesio. utilizzando
ESERCIZI POTENZIOMETRIA
 ESERCIZI POTENZIOMETRIA A. SPUNTI DI RIFLESSIONE 1. Quali sono i probabili fenomeni che permettono a un elettrodo al platino di assumere il potenziale di una soluzione contenente la coppia Fe 3+ /Fe 2+?
ESERCIZI POTENZIOMETRIA A. SPUNTI DI RIFLESSIONE 1. Quali sono i probabili fenomeni che permettono a un elettrodo al platino di assumere il potenziale di una soluzione contenente la coppia Fe 3+ /Fe 2+?
Classificazione e nomenclatura dei composti
 Classificazione e nomenclatura dei composti I nomi delle sostanze La nomenclatura chimica è regolamentata da un associazione internazionale: la IUPAC (International Union of Pure and Applied Chemistry):
Classificazione e nomenclatura dei composti I nomi delle sostanze La nomenclatura chimica è regolamentata da un associazione internazionale: la IUPAC (International Union of Pure and Applied Chemistry):
Sommario della lezione 7. Misure di concentrazione. Nomenclatura
 Sommario della lezione 7 Misure di concentrazione Nomenclatura Concentrazioni e Omeopatia Diluizione centesimale Uno dei rimedi omeopatici per l asma è il Natrium muriaticum
Sommario della lezione 7 Misure di concentrazione Nomenclatura Concentrazioni e Omeopatia Diluizione centesimale Uno dei rimedi omeopatici per l asma è il Natrium muriaticum
26. OSSIDAZIONE E RIDUZIONE Ossidazione. D. L ossidazione è'una reazione chimica in cui il numero di ossidazione di un elemento aumenta.
 26. OSSIDAZIONE E RIDUZIONE 26.1. Ossidazione D. L ossidazione è'una reazione chimica in cui il numero di ossidazione di un elemento aumenta. Esempi di ossidazioni. a) Il ferro, Fe, passa in soluzione
26. OSSIDAZIONE E RIDUZIONE 26.1. Ossidazione D. L ossidazione è'una reazione chimica in cui il numero di ossidazione di un elemento aumenta. Esempi di ossidazioni. a) Il ferro, Fe, passa in soluzione
Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici.
 LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
ELETTROCHIMICA 16/12/2015
 ELETTROCHIMICA Tratta delle trasformazioni tra energia chimica ed energia elettrica Alla base ci sono reazioni di ossidoriduzione, cioè con scambio di elettroni tra reagenti e prodotti della reazione Fe
ELETTROCHIMICA Tratta delle trasformazioni tra energia chimica ed energia elettrica Alla base ci sono reazioni di ossidoriduzione, cioè con scambio di elettroni tra reagenti e prodotti della reazione Fe
Studio delle trasformazioni dell energia chimica e dell energia elettrica
 ELETTROCHIMICA Studio delle trasformazioni dell energia chimica e dell energia elettrica Conduttori elettrolitici: soluzioni di acidi, di basi e di sali, nonché sali fusi. Ioni che partecipano alle reazioni
ELETTROCHIMICA Studio delle trasformazioni dell energia chimica e dell energia elettrica Conduttori elettrolitici: soluzioni di acidi, di basi e di sali, nonché sali fusi. Ioni che partecipano alle reazioni
Sommario della lezione 24. Equilibri di solubilità. Chimica Organica. Elettrochimica
 Sommario della lezione 24 Equilibri di solubilità Chimica Organica Elettrochimica EQUILIBRI DI SOLUBILITA Solubilità È la concentrazione del soluto in una soluzione satura (dove è presente il corpo di
Sommario della lezione 24 Equilibri di solubilità Chimica Organica Elettrochimica EQUILIBRI DI SOLUBILITA Solubilità È la concentrazione del soluto in una soluzione satura (dove è presente il corpo di
Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z)
 Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z) Corso di Laurea in Chimica e Tecnologia Farmaceutiche Facoltà di Farmacia e Medicina Anno Accademico 2013/2014 Dott. Giuseppe La Regina Tu,
Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z) Corso di Laurea in Chimica e Tecnologia Farmaceutiche Facoltà di Farmacia e Medicina Anno Accademico 2013/2014 Dott. Giuseppe La Regina Tu,
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 23 Le reazioni di ossido-riduzione 3 Sommario 1. L importanza delle reazioni di ossido-riduzione 2. Ossidazione e riduzione:
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 23 Le reazioni di ossido-riduzione 3 Sommario 1. L importanza delle reazioni di ossido-riduzione 2. Ossidazione e riduzione:
Relazioni Ponderali. Es. 1 Data la reazione da bilanciare: Al H Es. 2 Data la reazione da bilanciare: C 3 CO 2 + H 2 + O 2
 Relazioni Ponderali Es. 1 Data la reazione da bilanciare: 0 +1-1 0 +3-1 Al + HCl H 2 + AlCl 3 calcolare quanti grammi di H 2 si ottengono da 235g di Al con eccesso di HCl. Al 0 +3 +3 H 0-1 -1 1 3 2Al +
Relazioni Ponderali Es. 1 Data la reazione da bilanciare: 0 +1-1 0 +3-1 Al + HCl H 2 + AlCl 3 calcolare quanti grammi di H 2 si ottengono da 235g di Al con eccesso di HCl. Al 0 +3 +3 H 0-1 -1 1 3 2Al +
ESERCIZI Tabella dei potenziali
 ESERCIZI 1) Una pila chimica è un dispositivo in cui si ha trasformazione di: a. energia elettrica in energia chimica b. energia chimica in energia elettrica c. entalpia in energia elettrica d. entropia
ESERCIZI 1) Una pila chimica è un dispositivo in cui si ha trasformazione di: a. energia elettrica in energia chimica b. energia chimica in energia elettrica c. entalpia in energia elettrica d. entropia
Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z)
 Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z) Corso di Laurea in Chimica e Tecnologia Farmaceutiche Facoltà di Farmacia e Medicina Anno Accademico 2013/2014 Dott. Giuseppe La Regina Tu,
Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z) Corso di Laurea in Chimica e Tecnologia Farmaceutiche Facoltà di Farmacia e Medicina Anno Accademico 2013/2014 Dott. Giuseppe La Regina Tu,
Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezione 29-30 2010 Programma: a che punto siamo? Elettrochimica Elettrochimica è lo studio delle reazioni chimiche che producono
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezione 29-30 2010 Programma: a che punto siamo? Elettrochimica Elettrochimica è lo studio delle reazioni chimiche che producono
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 14. Le trasformazioni elettrochimiche SEGUI LA MAPPA Reazioni di ossidoriduzione
Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 14. Le trasformazioni elettrochimiche SEGUI LA MAPPA Reazioni di ossidoriduzione
NUMERO DI OSSIDAZIONE NOMENCLATURA CHIMICA
 NUMERO DI OSSIDAZIONE Il numero di ossidazione di un atomo corrisponde al numero di valenza preceduto da un segno + oppure -. Il segno negativo si assegna all atomo più elettronegativo e il segno + si
NUMERO DI OSSIDAZIONE Il numero di ossidazione di un atomo corrisponde al numero di valenza preceduto da un segno + oppure -. Il segno negativo si assegna all atomo più elettronegativo e il segno + si
Lezione 4. Le soluzioni Acidi e Basi Reazioni Chimiche La Concentrazione delle Soluzioni
 2018 Lezione 4. Le soluzioni Acidi e Basi Reazioni Chimiche La Concentrazione delle Soluzioni Una soluzione è una miscela omogenea di 2 o più sostanze Il soluto è la sostanza (o sostanze) presente/i in
2018 Lezione 4. Le soluzioni Acidi e Basi Reazioni Chimiche La Concentrazione delle Soluzioni Una soluzione è una miscela omogenea di 2 o più sostanze Il soluto è la sostanza (o sostanze) presente/i in
C.I. CHIMICA-TECNOLOGIA DEI MATERIALI Modulo di Chimica. Lezione del 23 Maggio 2016
 C.I. CHIMICA-TECNOLOGIA DEI MATERIALI Modulo di Chimica Lezione del 23 Maggio 2016 IL ph DELLE SOLUZIONI ACQUOSE Le soluzioni acide sono quelle con ph compreso fra 0 e 7. Le soluzioni basiche sono quelle
C.I. CHIMICA-TECNOLOGIA DEI MATERIALI Modulo di Chimica Lezione del 23 Maggio 2016 IL ph DELLE SOLUZIONI ACQUOSE Le soluzioni acide sono quelle con ph compreso fra 0 e 7. Le soluzioni basiche sono quelle
CALCOLO DEL ph. ph = - log [1,0x10-3 ] = 3,00
![CALCOLO DEL ph. ph = - log [1,0x10-3 ] = 3,00 CALCOLO DEL ph. ph = - log [1,0x10-3 ] = 3,00](/thumbs/68/59131328.jpg) CALCOLO DEL ph Calcolare il ph di una soluzione di HCl 1,0x10-3 M HCl acido forte che si dissocia completamente HCl H + + Cl - 1 mol di HCl produce 1 mol di H + ph = - log [1,0x10-3 ] = 3,00 Tipici acidi
CALCOLO DEL ph Calcolare il ph di una soluzione di HCl 1,0x10-3 M HCl acido forte che si dissocia completamente HCl H + + Cl - 1 mol di HCl produce 1 mol di H + ph = - log [1,0x10-3 ] = 3,00 Tipici acidi
Le Reazioni redox. combustioni. corrosioni. fotosintesi. lo scambio di elettroni. metabolismo alimentare. preparazione dei metalli ...
 Le Reazioni redox Le Reazioni redox combustioni corrosioni fotosintesi metabolismo alimentare cosa hanno in comune? lo scambio di elettroni preparazione dei metalli... Ossidazione originariamente: reazione
Le Reazioni redox Le Reazioni redox combustioni corrosioni fotosintesi metabolismo alimentare cosa hanno in comune? lo scambio di elettroni preparazione dei metalli... Ossidazione originariamente: reazione
Reazioni di Ossido-Riduzione ed Elettrochimica
 Reazioni di Ossido-Riduzione ed Elettrochimica Reazione di trasferimento elettronico: + + Riducente: donatore di elettroni. Ossidante: accettore di elettroni. Uno o più elettronivengono trasferiti dalla
Reazioni di Ossido-Riduzione ed Elettrochimica Reazione di trasferimento elettronico: + + Riducente: donatore di elettroni. Ossidante: accettore di elettroni. Uno o più elettronivengono trasferiti dalla
27/04/2017 ELETTROCHIMICA REAZIONI REDOX SCHEMA REAZIONE REDOX
 ELETTROCHIMICA Tratta delle trasformazioni tra energia chimica ed energia elettrica Alla base ci sono reazioni di ossidoriduzione, cioè con scambio di elettroni tra reagenti e prodotti della reazione REAZIONI
ELETTROCHIMICA Tratta delle trasformazioni tra energia chimica ed energia elettrica Alla base ci sono reazioni di ossidoriduzione, cioè con scambio di elettroni tra reagenti e prodotti della reazione REAZIONI
131,3 86 (222) 126,9 85 (210) 127,6 84 (209) 209,0 121, ,2 118, , ,4 200,6 112, , ,0 106, ,1 192,2 102,9 77
 *M16243112I* 2/20 *M16243112I02* *M16243112I03* 3/20 I 1 II 2 1 1,008 2 2 3 4 3 4 5 6 7 8 9 10 11 12 44,96 5 5 6 6 7 3 6,941 11 22,99 19 39,10 37 85,47 55 132,9 87 (223) 4 9,012 12 24,31 20 40,08 38 87,62
*M16243112I* 2/20 *M16243112I02* *M16243112I03* 3/20 I 1 II 2 1 1,008 2 2 3 4 3 4 5 6 7 8 9 10 11 12 44,96 5 5 6 6 7 3 6,941 11 22,99 19 39,10 37 85,47 55 132,9 87 (223) 4 9,012 12 24,31 20 40,08 38 87,62
Agente ossidante è la specie chimica che acquistando elettroni passa ad uno stato di ossidazione inferiore: Es. Ce +4 + e - Ce +3
 OSSIDIMETRIA Titolazioni di ossidoriduzione. Principi: Ossidazione = perdita di elettroni Riduzione = acquisto di elettroni Reazione redox in generale Oss 1 + Rid 2 Rid 1 + Oss 2 Agente ossidante è la
OSSIDIMETRIA Titolazioni di ossidoriduzione. Principi: Ossidazione = perdita di elettroni Riduzione = acquisto di elettroni Reazione redox in generale Oss 1 + Rid 2 Rid 1 + Oss 2 Agente ossidante è la
Lezione 7. Riconoscere i principali tipi di reazioni chimiche in soluzione. Predire i prodotti delle reazioni
 Laboratorio di Chimica Generale ed Inorganica Lezione 7 Riconoscere i principali tipi di reazioni chimiche in soluzione Predire i prodotti delle reazioni Dott.ssa Lorenza Marvelli Dipartimento di Scienze
Laboratorio di Chimica Generale ed Inorganica Lezione 7 Riconoscere i principali tipi di reazioni chimiche in soluzione Predire i prodotti delle reazioni Dott.ssa Lorenza Marvelli Dipartimento di Scienze
