meccanica quantistica Esercizi
|
|
|
- Giulia Grosso
- 5 anni fa
- Visualizzazioni
Transcript
1 Esercizi Meccanica quantistica
2 Perché in fisica classica non è possibile pensare a una particella come un onda? L onda è un fenomeno collettivo, che coinvolge un insieme di particelle (le molecole di una fune che oscilla, gli atomi dell aria attraversata da un suono, ecc.) e non una singola particella. Molte grandezze fisiche che descrivono un onda (frequenza, ampiezza, velocità di propagazione) non sono adatte a descrivere una particella, e, viceversa, le grandezze adatte per descrivere una particella (massa, carica elettrica, posizione, velocità, accelerazione, temperatura, ecc.) non sono adatte a descrivere un onda. Anche in fisica classica le misure delle grandezze sono accompagnate da incertezze dovute a varie cause (sensibilità di uno strumento di misura, errori casuali e sistematici, ecc.). Per quale motivo allora il principio di indeterminazione rappresenta una novità rispetto alla fisica classica? In linea di principio, in fisica classica non vi è nessun limite al grado di accuratezza delle misure. In altre parole, si è sempre assunto che sia possibile trovare accorgimenti sperimentali tali da ridurre le incertezze a quantità arbitrariamente piccole. Invece, in, l indeterminazione è insita nello stato fisico del sistema, ossia è legge di natura. Supponi che Ψ1=(Ψ1,1; Ψ1,) e Ψ=(Ψ,1; Ψ,) siano due possibili funzioni d onda per una particella (per esempio, l elettrone dell atomo di idrogeno). Come si sommano queste due funzioni d onda? Qual è il risultato di Ψ1+Ψ? Le due componenti della funzione d onda sono, dal punto di vista matematico, come le componenti di un vettore. Infatti, dati due vettori a=(a x ;a y ) e b=(b x +b y ), la loro somma vettoriale c è: c! = a! + b! = (a x ;a y )+ (b x ;b y ) = (a x + b x ;a y + b y )
3 Per analogia, la somma delle due funzioni d onda è Ψ = Ψ 1 + Ψ = (Ψ 1,1 ;Ψ 1, )+ (Ψ,1 ;Ψ, ) = (Ψ 1,1 + Ψ,1 ;Ψ 1, + Ψ, ) vale a dire, la funzione d onda risultante dalla somma ha due componenti, ciascuna delle quali è la somma delle corrispondenti componenti delle due funzioni d onda. La funzione d onda di una particella ha la forma indicata nella figura a lato. In quale zona (AB, BC o CD) è maggiore la probabilità di trovare la particella? La funzione d onda è una ampiezza di probabilità. Questo significa che, se stiamo studiando il comportamento di un elettrone, la quantità: Ψ(x, y, z,t) ΔV densità di probabilità fornisce la probabilità che l elettrone si trovi, a un istante di tempo t, in un volume ΔV il cui centro è posto nel punto di coordinate (x, y, z). La densità di probabilità, così definita, possiede un preciso significato fisico: non dice dove una particella è in un dato istante, ma semplicemente dove è probabile che sia. In sintesi: Nelle zone in cui Ψ oscilla, la probabilità di trovarvi una particella è diversa da zero. Non si trova mai la particella fuori da questa regione, dove Ψ è nulla. Da queste considerazioni, possiamo dunque concludere che: la zona tra B e C è quella in cui è maggiore la probabilità di trovare la particella. Poniamo un atomo di idrogeno in un campo magnetico: il suo spettro di emissione cambia? Ci troviamo di fronte all effetto Zeeman, secondo il quale posto un atomo di idrogeno in un campo magnetico esterno, le righe spettrali si scindono in un certo numero di
4 componenti molto vicine fra loro. Questo effetto dimostra sperimentalmente come le orbite elettroniche, oltre che essere quantizzate nel momento angolare L, devono essere quantizzate anche nell orientazione. Ecco il motivo dell introduzione del numero quantico magnetico m l. Pertanto, in presenza del campo magnetico esterno, i livelli energetici non dipendono solo dal numero quantico principale n, ma anche dal numero quantico magnetico m l. Questo comporta che lo spettro di emissione cambia in quanto si devono apportare delle correzione, che dipendono proprio da m l, ai livelli energetici E n calcolati secondo il modello di Bohr. Questo nuovo contributo ΔE m all energia dell elettrone, per via della relazione E=hf, corrisponde una modificazione delle frequenze dello spettro di emissione: E = hf f = E h Δf = ΔE m h Il primo esperimento che ha mostrato l esistenza dello spin è stato condotto da due fisici tedeschi, Stern e Gerlach. I due volevano mostrare la quantizzazione del momento angolare Lz lungo una direzione z dell elettrone di un atomo. A questo scopo, predisposero un campo magnetico fortemente non omogeneo e lo fecero attraversare da un fascio di atomi. Atomi con diversi valori di Lz subiscono forze differenti dal campo magnetico e si separano. Stern e Gerlach rilevarono nel loro esperimento fasci separati. Spiega perché questi due fasci sono dovuti allo spin dell elettrone e non al suo momento angolare Lz. Il momento angolare lungo una direzione L z =mh/π è quantizzato e i valori possibili sono in quantità dispari, m = l, l + 1, 1,0,1... l 1 l in quanto l è intero. Per avere un numero pari di fasci l dovrebbe essere semi-intero, per esempio l=1/, ma questo è possibile solo per lo spin. Un laser è un generatore di luce, ma la luce che produce è diversa da quella di una lampadina qualsiasi. Quali sono le caratteristiche che distinguono la luce prodotta da un laser rispetto a quella di una lampadina a incandescenza?
5 A differenza delle normali sorgenti luminose come una lampadina a incandescenza, la luce laser ha determinate caratteristiche: 1) è estremamente monocromatica: cioè caratterizzata da una lunghezza d onda precisa di circa 1 parte per ; b) è notevolmente coerente: la fase iniziale dell onda emessa è costante su distanze di centinaia di chilometri (la luce di una normale lampadina perde la coerenza dopo circa 1 metro); c) è fortemente direzionale: il fascio laser, essendo fatto di bosoni, ha un parallelismo che non si riesce ad ottenere con i sistemi di focalizzazione della luce; d) può essere focalizzata in modo netto: come conseguenza del parallelismo, si possono ottenere intensità di luce laser focalizzata dell ordine di W/cm. Un modellino di automobile, la cui massa è 30 g, si muove in linea retta e percorre una distanza di 1,8 m in un intervallo di tempo di 4,5 s. Quanto vale la sua lunghezza d onda di de Broglie? Il modulo medio della quantità di moto del modellino è: p = mv = m Δs 1,8 kg m = 0, 30 = 0, 09 Δt 4, 5 s Quindi la sua lunghezza d onda di de Broglie risulta: λ = h p = 6, , 09 = 7, m La lunghezza d onda trovata è 31 ordini di grandezza più piccola dell estensione dell oggetto a cui si riferisce: essa non può avere alcun effetto fisico apprezzabile sul comportamento dell automobilina che, quindi, segue le leggi della fisica classica. Una palla ha una massa di 00 g ed una energia cinetica di 100 J. Quanto vale la lunghezza d onda di de Broglie della palla? Da questo risultato, puoi dire perché non è possibile osservare le proprietà ondulatorie degli oggetti del mondo macroscopico?
6 La velocità della palla vale: K = 1 mv v = K m = 100 0, =100 m / s e, quindi, la sua lunghezza d onda di de Broglie risulta: λ = h p = 6, , 100 = 0, m Poichè la lunghezza d onda di de Broglie della palla è più piccola di qualunque fenditura attraverso cui la palla potrebbe passare, allora non è possibile osservare effetti di diffrazione, tipici delle onde. La palla segue le leggi della fisica classica. Un elettrone è confinato a muoversi in uno spazio delle dimensioni di,5x10-10 m. Calcola l energia cinetica di un protone che ha una quantità di moto uguale all incertezza sulla quantità di moto dell elettrone. Se l elettrone è costretto a muoversi su una retta entro un intervallo di ampiezza Δx, la sua posizione lungo tale coordinata è nota appunto con un indeterminazione Δx. Per il principio di Heinseberg possiamo scrivere: Δx Δp x! L indeterminazione minima sulla componente x della quantità di moto risulta perciò: Δp x =! Δx = 6, / π, = 4, 10 5 kg m / s Poiché l energia cinetica del protone possiamo esprimerla in funzione della sua quantità di moto, che è pari all incertezza sulla quantità di moto dell elettrone, abbiamo: K protone = 1 mv = p m = Δp elettr 4, 10 5 = m prot 1, = 7 5, J = 5, = 3, ev 1,
7 La vita media di un elettrone in uno stato eccitato di un atomo è di circa 10 ns e, quando ritorna allo stato fondamentale, l atomo emette un fotone. Calcola: a) il minimo valore teorico dell incertezza con cui si può conoscere l energia del fotone emesso; b) il corrispondente allargamento della riga spettrale, cioè l intervallo di frequenza nel quale può essere emesso il fotone. a) Usiamo la seconda relazione d indeterminazione di Heinsenberg: ΔE Δt! ΔE! Δt = 6, / π J = , = 0, ev b) Dalla relazione E=hf, ricaviamo l intervallo di frequenza (allargamento della riga spettrale) nel quale può essere emesso il fotone: E = hf f = E h Δf = ΔE h = , Hz Una particella di massa m=8x10-5 kg si trova in una «scatola unidimensionale» di lunghezza L=x10-6 m ed è costretta cioè a muoversi lungo una linea, la cui posizione x è limitata dalla condizione 0<x<L. a) Discuti il problema classicamente; b) Discuti il problema quantisticamente e determina la probabilità di trovare la particella in un intervallo Δl=10-8 m intorno al centro, x=l/, per ogni valore di n; c) Disegna in un grafico la quantità Ψ n(x) per n=1 e n= e indica la probabilità di trovare la particella nella regione 0<x<L/ nei due casi. Analizziamo il problema. La particella è confinata in una regione limitata di spazio unidimensionale:
8 ossia si tratta di un tipico esempio di particella costretta a muoversi in una buca di potenziale infinita: V(x) = 0 per 0 < x < L per x < 0 e x > L a) Dal punto di vista della fisica classica, il problema è equivalente a quello del moto di un corpo tra due pareti perfettamente riflettenti, che avviene con energia totale, pari a quella cinetica E=p /m. L energia può assumere qualunque valore e la densità di probabilità di trovare la particella, misurandola a caso, in un punto qualsiasi 0<x<L è uniforme in quanto il moto avviene a velocità costante v =cost. b) Quantisticamente, come conseguenza del confinamento della particella, nascono delle condizioni di quantizzazione. Ossia, l equazione di Schrodinger non dipendente dal tempo (stiamo considerando stati stazionari), in seguito alle condizioni al contorno (confinamento della particella), ammette i seguenti valori di energia degli stati stazionari: E n =! π 8mL n n =1,,3,... Quantisticamente, oltre ad aversi uno spettro discreto dei livelli energetici (livelli permessi), è proibito anche il valore E=0. Ossia esiste una energia minima (minimo livello permesso) per la particella: E 1 =! π 10 ev 8mL Questo fatto è intuitivamente comprensibile come conseguenza del principio d indeterminazione. Infatti, se fosse possibile E=p /m=0 all interno della buca, allora avremmo p=0, e quindi: Δx Δp! Δx! Δp Δp=0 Δx Ma ciò non può essere perché la buca ha larghezza finita L. Conclusione: i sistemi confinati devono avere E>0.
9 Agli stati stazionari caratterizzati dai valori E n, corrispondono le seguenti funzioni d onda: Ψ n = L sin nπ L x n =1,,3,... La probabilità di trovare la particella nella regione richiesta (Δl=10-8 m intorno al centro x=l/) è espressa dalla densità di probabilità (dove a ΔV abbiamo sostituito Δl): Ψ n ΔL = ΔL nπ L sin L L = ΔL Ψ nπ n ΔL = 0 n pari L sin Ψ n ΔL = ΔL L =10 8 = 0, 01=1% n dispari 6 10 c) I grafici richiesti sono: Poiché i due grafici sono simmetrici rispetto alla posizione centrale x 0 =10-6 m, la probabilità di trovare la particella in una metà della scatola è del 50% per entrambi i casi. Un elettrone che passa attraverso uno schermo con due fenditure è descritto dallo stato: Ψ = 1 Ψ a + 3 Ψ b dove Ψa è la funzione d onda dell elettrone quando sullo schermo è aperta solo la fenditura A e Ψb è la funzione d onda dell elettrone quando sullo schermo è aperta solo la fenditura B. Qual è la probabilità che l elettrone passi da ciascuna fenditura quando sono entrambe aperte?
10 Per il principio di sovrapposizione, lo stato di un elettrone che passa attraveso uno schermo con due fenditure, è dato da: Ψ = aψ a + bψ b dove i coefficienti a e b sono legati alle probabilità p A (elettrone che passa attraverso la fenditura A) e p B (elettrone che passa attraverso la fenditura B): p A = a a + b p B = b a + b Poiché: a + b = =1 le probabilità richieste sono: p A = a = 1 4 = 0, 5 = 5% p B = b = 0, 75 = 75% Un milione di elettroni viene inviato contro uno schermo che contiene duefenditure A e B. Gli elettroni sono inviati uno alla volta. Ogni elettrone è descritto dalla funzione d onda: Ψ = 5 Ψ a Ψ b dove Ψa e Ψb sono la funzione d onda che descrivono l elettrone che passa, rispettivamente, dalla fenditura A o dalla fenditura B. Un rilevatore è posto dietro ciascuna fenditura. Dai una stima di quanti elettroni vengono rilevati dietro la fenditura A e quanti dietro la fenditura B. La probabilità p A (elettrone che passa attraverso la fenditura A) e p B (elettrone che passa attraverso la fenditura B), sono date da:
11 p A = a a + b p B = b a + b Poiché: le probabilità richieste sono: a + b = =1 p A = a = 5 = 0, 40 = 40% p B = b = 3 = 0, 60 = 60% 5 Pertanto, circa il 40% degli elettroni, cioè circa , vengono rilevati dietro la fenditura A e circa (il 60%) dietro la fenditura B. Un atomo di idrogeno il cui elettrone ha numero quantico magnetico ml= è posto in una regione in cui è presente un campo magnetico di intensità 1,8 T diretto lungo z. Calcola la variazione dell energia dell elettrone in J e in ev. Quanto differisce, in ordini di grandezza, dall energia dello stato con n=1? In presenza del campo magnetico esterno (effetto Zeeman), i livelli energetici non dipendono solo dal numero quantico principale n, ma anche dal numero quantico magnetico m l. Questo comporta che ai livelli energetici E n bisogna apportare delle correzione che dipendono proprio da m l. Questo nuovo contributo ΔE m all energia dell elettrone è dato da: ΔE ml = ehb m l = 1, , ,8 4πm e 4π 9, = 0,33 10 J = 0, , = 10 4 ev Senza la correzione, il livello energetico n=1 (stato fondamentale) ha energia E 1 =- 13,6 ev, quindi la variazione dovuta al campo magnetico è di 5 ordini di grandezza inferiore. Il momento magnetico orbitale di un elettrone è diretto lungo z e ha modulo 1,0x10 - m A. Determina il momento angolare dell elettrone e il numero quantico magnetico ml.
12 In base al modello di Bohr, l elettrone dell atomo d idrogeno, che percorre l orbita chiusa, può essere assimilato a una spira percorsa da corrente. Si dimostra che il momento magnetico di tale spira, ossia dell elettrone, è dato da: µ!" m = e m e L!" Anche se nella meccanica ondulatoria abbiamo abbandonato l idea dell elettrone che ruota, e quindi il modello di Bohr, quello che interessa è che il momento magnetico µ associato all elettrone è quantizzato come il momento angolare L: il suo modulo è individuato dal numero quantico l e la sua componente lungo una data direzione z (scelta parallela al campo magnetico esterno) è individuata dal numero quantico magnetico m l (quantizzazione spaziale): µ m = e m e L Z Pertanto, il momento angolare dell elettrone vale: L Z = m e e µ m = 9, , , 0 10 =1, J s Per la condizione di quantizzazione spaziale del momento angolare, ossia per un dato numero quantico orbitale l, i valori permessi per L z sono multipli interi della costante di Planck, si ottiene il numero quantico magnetico m l : L Z = m l! m l = L Z! = π L Z h = π 1, , L elettrone dell atomo di idrogeno si trova in uno stato che è la sovrapposizione di tre funzioni d onda: Ψ(x, y, z) = 1 4 Ψ,1,1(x, y, z)+ 1 4 Ψ,1,0(x, y, z)+ 1 Ψ,1, 1(x, y, z) dove gli indici delle funzioni d onda sono, nell ordine, il numero quantico principale n, il numero quantico orbitale l e il numero quantico magnetico ml. a) Qual è la probabilità che la misurazione del modulo del momento angolare
13 dell elettrone dia h/π? b) Quali sono i possibili risultati della misurazione di Lz, la componente lungo z del momento angolare? a) La condizione di quantizzazione del momento angolare modello ci dice che: L = l(l +1) l = 0,1,,..., n 1 numero quantico orbitale Poiché gli stati della sovrapposizione hanno tutti numero quantico orbitale l=1, il modulo del momento angolare è: L =! e la probabilità che la sua misurazione abbia questo valore è del 100%. b) L'insieme dei tre numeri quantici (n,l,m) individua una particolare funzione d'onda, risultante dall'equazione di Schrodinger. A ciascuna terna corrisponde una diversa distribuzione dell'elettrone nello spazio. La nostra funzione d onda è la sovrapposizione di 3 stati con numero quantico magnetico m l =-1,0,1, e quindi una misurazione del momento angolare lungo la direzione z può dare tre esiti: L Z = m l! L Z =! L Z = 0 L Z =! Un elettrone è costretto a muoversi in uno spazio unidimensionale lungo 0,1nm. Calcola, in ev, la minima energia cinetica che l elettrone può possedere. Se l elettrone è costretto a muoversi su una retta entro un intervallo di ampiezza x, la sua posizione lungo tale coordinata è nota appunto con un indeterminazione x. In base alle relazioni di indeterminazione di Heisenberg possiamo scrivere: Δx Δp x! L indeterminazione minima sulla componente x della quantità di moto risulta perciò:
14 Δp x =! Δx = 6, / π =10 4 kg m / s Poiché l energia cinetica vale: K = 1 m e v = p m e la minima energia cinetica che l elettrone può possedere si ha per p x = p x, quindi: K min = Δp x (10 4 ) = m e 9,11 10 = 0, 066 0, J = = 4 ev 1, Considera le righe della serie di Lyman, dovute all emissione di radiazione da parte dell atomo di idrogeno quando l elettrone passa dallo stato con numero quantico principale n<1 allo stato con numero quantico principale n=1. a) Spiega per quale motivo, in presenza di un campo magnetico B uniforme, ogni riga di emissione si suddivide in più righe. b) Esamina ora l emissione di radiazione da parte dell atomo di idrogeno quando l elettrone passa dallo stato con numero quantico principale n= e numero quantico orbitale l=1 allo stato con numero quantico principale n=1. Quante righe vengono rilevate sperimentalmente? c) Calcola la differenza delle lunghezze d onda tra le righe adiacenti quando il campo magnetico ha intensità 3 T. a) Ci troviamo di fronte all effetto Zeeman, secondo il quale posto un atomo di idrogeno in un campo magnetico esterno, le righe spettrali si scindono in un certo numero di componenti molto vicine fra loro. Questo effetto dimostra sperimentalmente come le orbite elettroniche, oltre che essere quantizzate nel momento angolare L, devono essere quantizzate anche nell orientazione. Ecco il motivo dell introduzione del numero quantico magnetico m l. Pertanto, in presenza del campo magnetico esterno, i livelli energetici non dipendono solo dal numero quantico principale n, ma anche dal numero quantico magnetico m l. Questo comporta che lo spettro di emissione cambia in quanto si devono apportare delle correzione, che dipendono proprio da m l, ai livelli energetici E n calcolati secondo il modello di Bohr. Questo nuovo contributo ΔE m all energia dell elettrone, per via della relazione E=hf, corrisponde una modificazione delle frequenze dello spettro di emissione:
15 E = hf f = E h Δf = ΔE m h b) Lo stato con numero quantico n=1 ha numero quantico orbitale l=0 e quindi anche m l =0. Invece gli stati con n= e l=1 sono 3 e hanno numeri quantici magnetici m l = 1,0,1. c) Lo stato con m l =0 mantiene la sua energia: ΔE ml = ehb 4πm e m l m l =0 ΔE ml = 0 gli altri con m l =1 e m l =-1 la variano di una quantità, in più o in meno, pari a: ΔE ml ΔE ml = ehb 4πm e m l = ehb 4πm e m l m l =1 ΔE ml = 1, , ,8 1=, J 4π 9, m l = 11 ΔE ml = 1, , ,8 ( 1) =, J 4π 9, d) Questa variazione di energia produce una variazione di frequenze in modulo pari a: Δf = ΔE h e una corrispondente variazione di lunghezza d onda pari a: Δλ = λ λ 0 = c f c = c f 0 f 0 f f f 0 = c f f 0 ( f 0 f ) = λ λ 0 c ( f 0 f ) λ 0 c Δf tenendo conto della relazione precedente per f, si ottiene: Δλ cδe f 0 h dove f 0 è la frequenza di emissione quando il campo magnetico è assente. In termini delle energie di Bohr E n : f 0 = E E 1 h In definitiva, il modulo della variazione della lunghezza d onda delle due nuove righe è:
16 chδe Δλ = ( E E 1 ) = , , =, m =,1 pm ( ) dove: E n = 13, 6 n E 1 = 13, 6 ev E = 3, 4 ev E E 1 10 ev =10 1, = J Un pennello di luce monocromatica emessa da un laser illumina perpendicolarmente una doppia fenditura praticata in uno schermo A. Le due fenditure distano fra loro 0,10 mm. Al di là della doppia fenditura, a una distanza di,00 m dallo schermo A e parallelamente allo stesso schermo, è disposto uno schermo B su cui si raccoglie la luce proveniente dalle due fenditure. Il primo massimo laterale è situato a una distanza di 10,0 mm dal massimo centrale. La luce emessa dallo stesso laser colpisce, successivamente, una placca di rame, la cui minima frequenza per produrre l effetto fotoelettrico vale f0=1,08x10 15 Hz, e poi una di cesio con f0= 4,34x10 14 Hz. a) Calcola la lunghezza d onda della luce emessa dal laser. b) Determina se dalla placca di rame (e di cesio) ci sarà emissione di elettroni. a) La situazione può essere così schematizzata: I due cammini ottici S 1 P e S P differiscono esattamente di una lunghezza d onda, dato che P è la prima frangia laterale luminosa, cioè è un massimo di interferenza. Se L>>d, dalla formula dell interferenza si ottiene: λ = dy L = 0, = 0, m = 500 nm
17 Si tratta di luce blu-verde. b) La frequenza del laser in esame risulta: c = λ f f = c λ = = Hz rame f < f 0 non c'è emissione di elettroni cesio f > f 0 c'è emissione di elettroni
LA FISICA QUANTISTICA
 CAPITOLO 45 LA FISICA QUANTISTICA 1 LE PROPRIETÀ ONDULATORIE DELLA MATERIA 1 L onda è un fenomeno collettivo, che coinvolge un insieme di particelle (le molecole di una fune che oscilla, gli atomi dell
CAPITOLO 45 LA FISICA QUANTISTICA 1 LE PROPRIETÀ ONDULATORIE DELLA MATERIA 1 L onda è un fenomeno collettivo, che coinvolge un insieme di particelle (le molecole di una fune che oscilla, gli atomi dell
1 3 STRUTTURA ATOMICA
 1 3 STRUTTURA ATOMICA COME SI SPIEGA LA STRUTTURA DELL ATOMO? Secondo il modello atomico di Rutherford e sulla base della fisica classica, gli elettroni dovrebbero collassare sul nucleo per effetto delle
1 3 STRUTTURA ATOMICA COME SI SPIEGA LA STRUTTURA DELL ATOMO? Secondo il modello atomico di Rutherford e sulla base della fisica classica, gli elettroni dovrebbero collassare sul nucleo per effetto delle
Modelli atomici Modello atomico di Rutheford Per t s d u i diare la t s rutt ttura t a omica Ruth th f or (
 Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford (1871-1937) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio) Rutherford suppose che gli atomi
Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford (1871-1937) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio) Rutherford suppose che gli atomi
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
Capitolo 8 La struttura dell atomo
 Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Università degli Studi dell Aquila Corso di Laurea in Scienze e Tecnologie Chimiche e dei Materiali Corso di Fisica della Materia Prof. L.
 Università degli Studi dell Aquila Corso di Laurea in Scienze e Tecnologie Chimiche e dei Materiali Corso di Fisica della Materia Prof. L. Lozzi Testi degli esercizi svolti in aula Corpo Nero 1. Il corpo
Università degli Studi dell Aquila Corso di Laurea in Scienze e Tecnologie Chimiche e dei Materiali Corso di Fisica della Materia Prof. L. Lozzi Testi degli esercizi svolti in aula Corpo Nero 1. Il corpo
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA. (Plank Einstein)
 L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
Teoria Atomica Moderna. Chimica generale ed Inorganica: Chimica Generale. sorgenti di emissione di luce. E = hν. νλ = c. E = mc 2
 sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
Rappresentazione dell atomo. Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano.
 Rappresentazione dell atomo Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano. Informazioni importanti circa la dimensione dell atomo e la distribuzione della massa
Rappresentazione dell atomo Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano. Informazioni importanti circa la dimensione dell atomo e la distribuzione della massa
Generalità delle onde elettromagnetiche
 Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
La struttura dell atomo
 La Teoria Atomica La struttura dell atomo 10-10 m 10-14 m Proprietà delle tre particelle subatomiche fondamentali Carica Massa Nome (simbolo) relativa assoluta (C) relativa (uma)* Assoluta (g) Posizione
La Teoria Atomica La struttura dell atomo 10-10 m 10-14 m Proprietà delle tre particelle subatomiche fondamentali Carica Massa Nome (simbolo) relativa assoluta (C) relativa (uma)* Assoluta (g) Posizione
Introduzione alla meccanica quantistica. Vincenzo Barone
 Accademia delle Scienze di Torino 9 novembre 2017 Introduzione alla meccanica quantistica Vincenzo Barone barone@to.infn.it Parte I: Le basi della meccanica quantistica (questioni didattiche) Parte II:
Accademia delle Scienze di Torino 9 novembre 2017 Introduzione alla meccanica quantistica Vincenzo Barone barone@to.infn.it Parte I: Le basi della meccanica quantistica (questioni didattiche) Parte II:
CORSO DI LAUREA IN OTTICA E OPTOMETRIA
 CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
Comune ordine di riempimento degli orbitali di un atomo
 Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica
 ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
La natura ondulatoria della materia
 La natura ondulatoria della materia 1. Dualismo onda-particella 2. Principio di indeterminazione di Heisemberg 3. Struttura del nucleo XV - 0 Dualismo onda-particella Come la radiazione presenta una doppia
La natura ondulatoria della materia 1. Dualismo onda-particella 2. Principio di indeterminazione di Heisemberg 3. Struttura del nucleo XV - 0 Dualismo onda-particella Come la radiazione presenta una doppia
STRUTTURA ATOMICA. Per lo studio della struttura dell atomo ci si avvale della Spettroscopia.
 STRUTTURA ATOMICA Il modello planetario dell atomo secondo Rutherford si appoggia sulla meccanica classica. Il modello non può essere corretto visto che per descrivere il comportamento delle particelle
STRUTTURA ATOMICA Il modello planetario dell atomo secondo Rutherford si appoggia sulla meccanica classica. Il modello non può essere corretto visto che per descrivere il comportamento delle particelle
Il modello di Bohr. Lezioni d'autore di Giorgio Benedetti
 Il modello di Bohr Lezioni d'autore di Giorgio Benedetti VIDEO Gli spettri di emissione Nel 1859 il fisico G.R. Kirchoff scoprì che ogni elemento chimico presenta uno spettro di emissione caratteristico,
Il modello di Bohr Lezioni d'autore di Giorgio Benedetti VIDEO Gli spettri di emissione Nel 1859 il fisico G.R. Kirchoff scoprì che ogni elemento chimico presenta uno spettro di emissione caratteristico,
L atomo di Bohr. Argomenti. Al tempo di Bohr. Spettri atomici 19/03/2010
 Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
mvr = n h e 2 r = m v 2 e m r v = La configurazione elettronica r = e 2 m v 2 (1) Quantizzazione del momento angolare (2) 4 πε.
 La configurazione elettronica Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica F = m a. F Coulomb = 1 4 πε. q q ' F r centrifuga = m v r ε =8.85*10-1 Fm-1 (costante
La configurazione elettronica Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica F = m a. F Coulomb = 1 4 πε. q q ' F r centrifuga = m v r ε =8.85*10-1 Fm-1 (costante
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE
 LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
Enrico Silva - diritti riservati - Non è permessa, fra l altro, l inclusione anche parziale in altre opere senza il consenso scritto dell autore
 Indeterminazione Finora si sono considerate le proprietà ondulatorie, lavorando sulla fase di una (per ora non meglio specificata) funzione. Si sono ricavate o ipotizzate relazioni per: - lunghezza d onda
Indeterminazione Finora si sono considerate le proprietà ondulatorie, lavorando sulla fase di una (per ora non meglio specificata) funzione. Si sono ricavate o ipotizzate relazioni per: - lunghezza d onda
Meccanica quantistica Mathesis 2016 Prof. S. Savarino
 Meccanica quantistica Mathesis 2016 Prof. S. Savarino Quanti Corpo nero: è un oggetto che assorbe tutta la radiazione senza rifletterla. Come una corda legata agli estremi può produrre onde stazionarie
Meccanica quantistica Mathesis 2016 Prof. S. Savarino Quanti Corpo nero: è un oggetto che assorbe tutta la radiazione senza rifletterla. Come una corda legata agli estremi può produrre onde stazionarie
Laurea Magistrale di INGEGNERIA ELETTRONICA (LM-29) a.a , I semestre! Programma del corso di FISICA SUPERIORE! Docente: MAURO PAPINUTTO!
 Laurea Magistrale di INGEGNERIA ELETTRONICA (LM-29) a.a. 2013-14, I semestre Programma del corso di FISICA SUPERIORE Docente: MAURO PAPINUTTO Dipartimento di Fisica Phone: +39 06 4991 4376 Universita`
Laurea Magistrale di INGEGNERIA ELETTRONICA (LM-29) a.a. 2013-14, I semestre Programma del corso di FISICA SUPERIORE Docente: MAURO PAPINUTTO Dipartimento di Fisica Phone: +39 06 4991 4376 Universita`
Struttura Elettronica degli Atomi Meccanica quantistica
 Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Teoria Atomica di Dalton
 Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
STRUTTURA DELL'ATOMO
 STRUTTURA DELL'ATOMO IDROGENO 1 H ELIO He 1 2 4 Modello planetario di Rutherford -protoni e neutroni costituiscono il nucleo in cui è concentrata tutta la massa - gli elettroni ruotano attorno al nucleo
STRUTTURA DELL'ATOMO IDROGENO 1 H ELIO He 1 2 4 Modello planetario di Rutherford -protoni e neutroni costituiscono il nucleo in cui è concentrata tutta la massa - gli elettroni ruotano attorno al nucleo
Lezione n. 19. L equazione. di Schrodinger L atomo. di idrogeno Orbitali atomici. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
p e c = ev Å
 Corso di Introduzione alla Fisica Quantistica (f) Soluzioni Esercizi: Giugno 006 * Quale la lunghezza d onda di de Broglie di un elettrone che ha energia cinetica E 1 = KeV e massa a riposo m 0 = 9.11
Corso di Introduzione alla Fisica Quantistica (f) Soluzioni Esercizi: Giugno 006 * Quale la lunghezza d onda di de Broglie di un elettrone che ha energia cinetica E 1 = KeV e massa a riposo m 0 = 9.11
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA
 LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
Le Caratteristiche della Luce
 7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
A Z. L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone. +1e e.
 L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone +1e 0-1e e = Carica elettrica elementare 1.60 10-19 u.m.a.= Unità di Massa Atomica 1.6605 10-4 Il Nuclide A Z Nu Coulomb
L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone +1e 0-1e e = Carica elettrica elementare 1.60 10-19 u.m.a.= Unità di Massa Atomica 1.6605 10-4 Il Nuclide A Z Nu Coulomb
Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton)
 Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
1. Scrivere l equazione di Schrödinger unidimensionale per una particella di massa m con energia potenziale V (x) = mω2
 1 Teoria Una particella di massa m = 1 g e carica elettrica q = 1 c viene accelerata per un tratto pari a l = m da una differenza di potenziale pari av = 0 volt Determinare la lunghezza d onda di De Broglie
1 Teoria Una particella di massa m = 1 g e carica elettrica q = 1 c viene accelerata per un tratto pari a l = m da una differenza di potenziale pari av = 0 volt Determinare la lunghezza d onda di De Broglie
Metalli come gas di elettroni liberi
 Metalli come gas di elettroni liberi I metalli sono caratterizzati da elevata conducibilità elettrica e termica. La conducibilità elettrica in particolare (o il suo inverso, la resistività) è una delle
Metalli come gas di elettroni liberi I metalli sono caratterizzati da elevata conducibilità elettrica e termica. La conducibilità elettrica in particolare (o il suo inverso, la resistività) è una delle
Unità 2. La teoria quantistica
 Unità 2 La teoria quantistica L'effetto fotoelettrico Nel 1902 il fisico P. Lenard studiò l'effetto fotoelettrico. Esso è l'emissione di elettroni da parte di un metallo su cui incide un'onda elettromagnetica.
Unità 2 La teoria quantistica L'effetto fotoelettrico Nel 1902 il fisico P. Lenard studiò l'effetto fotoelettrico. Esso è l'emissione di elettroni da parte di un metallo su cui incide un'onda elettromagnetica.
Incontriamo la Fisica: la Meccanica Quantistica. Stefano Spagocci, GACB
 Incontriamo la Fisica: la Meccanica Quantistica Stefano Spagocci, GACB Newton e Laplace Secondo la concezione di Newton e Laplace, specificate le condizioni iniziali (posizioni e velocità), il moto di
Incontriamo la Fisica: la Meccanica Quantistica Stefano Spagocci, GACB Newton e Laplace Secondo la concezione di Newton e Laplace, specificate le condizioni iniziali (posizioni e velocità), il moto di
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
Meccanica quantistica (5)
 Meccanica quantistica (5) 0/7/14 1-MQ-5.doc 0 Oscillatore armonico Se una massa è sottoposta ad una forza di richiamo proporzionale allo spostamento da un posizione di equilibrio F = kx il potenziale (
Meccanica quantistica (5) 0/7/14 1-MQ-5.doc 0 Oscillatore armonico Se una massa è sottoposta ad una forza di richiamo proporzionale allo spostamento da un posizione di equilibrio F = kx il potenziale (
Raccolta di esercizi di fisica moderna
 Raccolta di esercizi di fisica moderna M. Quaglia IIS Avogadro Torino M. Quaglia (IIS Avogadro Torino) Raccolta di esercizi di fisica moderna Torino, 20/11/2014 1 / 30 Prova AIF e Sillabo http://www.aif.it/archivioa/aif_seconda_prova_di_fisica.pdf
Raccolta di esercizi di fisica moderna M. Quaglia IIS Avogadro Torino M. Quaglia (IIS Avogadro Torino) Raccolta di esercizi di fisica moderna Torino, 20/11/2014 1 / 30 Prova AIF e Sillabo http://www.aif.it/archivioa/aif_seconda_prova_di_fisica.pdf
La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno:
 La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno: Vedi documento Atomo di Bohr.pdf sul materiale didattico per la derivazione di queste equazioni Livelli Energetici dell Atomo di Idrogeno
La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno: Vedi documento Atomo di Bohr.pdf sul materiale didattico per la derivazione di queste equazioni Livelli Energetici dell Atomo di Idrogeno
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO
 La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
specchio concavo Immagine diffusa da una sorgente S
 specchio concavo 1 Immagine diffusa da una sorgente S S C I specchio concavo 2 immagine I della sorgente S S C I propagazione delle onde 3 principio di Huygens S 4 interferenza sovrapposizione di onde
specchio concavo 1 Immagine diffusa da una sorgente S S C I specchio concavo 2 immagine I della sorgente S S C I propagazione delle onde 3 principio di Huygens S 4 interferenza sovrapposizione di onde
FISICA QUANTISTICA LIMITI AL MODELLO ATOMICO DI RUTHERFORD. e - Per spiegare la disposizione degli elettroni nell atomo (STRUTTURA ELETTRONICA)
 LIMITI AL MODELLO ATOMICO DI RUTHERFORD e - + nucleo In base alle leggi della FISICA CLASSICA, una particella carica dotata di un movimento circolare libera energia. Di conseguenza, gli elettroni che,
LIMITI AL MODELLO ATOMICO DI RUTHERFORD e - + nucleo In base alle leggi della FISICA CLASSICA, una particella carica dotata di un movimento circolare libera energia. Di conseguenza, gli elettroni che,
Carlo Cosmelli. La visione del mondo della Relatività e della Meccanica Quantistica. Settimana 4. Lezione 4.1 La Meccanica Quantistica Gli inizi
 La visione del mondo della Relatività e della Meccanica Quantistica Settimana 4 Lezione 4.1 La Meccanica Quantistica Gli inizi Carlo Cosmelli 1 Anno 1900: fatti che non tornano, che non si spiegano Il
La visione del mondo della Relatività e della Meccanica Quantistica Settimana 4 Lezione 4.1 La Meccanica Quantistica Gli inizi Carlo Cosmelli 1 Anno 1900: fatti che non tornano, che non si spiegano Il
ATOMI E PARTICELLE SUBATOMICHE
 ATOMI E PARTICELLE SUBATOMICHE ELETTRICITÀ DELL ATOMO ESISTONO DUE TIPI DI CARICHE ELETTRICHE, DENOMINATE CONVENZIONALMENTE NEGATIVA E POSITIVA CARICHE DI SEGNO UGUALE SI RESPINGONO, MENTRE CARICHE DI
ATOMI E PARTICELLE SUBATOMICHE ELETTRICITÀ DELL ATOMO ESISTONO DUE TIPI DI CARICHE ELETTRICHE, DENOMINATE CONVENZIONALMENTE NEGATIVA E POSITIVA CARICHE DI SEGNO UGUALE SI RESPINGONO, MENTRE CARICHE DI
L energia assorbita dall atomo durante l urto iniziale è la stessa del fotone che sarebbe emesso nel passaggio inverso, e quindi vale: m
 QUESITI 1 Quesito Nell esperimento di Rutherford, una sottile lamina d oro fu bombardata con particelle alfa (positive) emesse da una sorgente radioattiva. Secondo il modello atomico di Thompson le particelle
QUESITI 1 Quesito Nell esperimento di Rutherford, una sottile lamina d oro fu bombardata con particelle alfa (positive) emesse da una sorgente radioattiva. Secondo il modello atomico di Thompson le particelle
specchio concavo Immagine diffusa da una sorgente S
 specchio concavo 1 Immagine diffusa da una sorgente S S C I specchio concavo 2 immagine I della sorgente S S C I propagazione delle onde 3 principio di Huygens S 4 interferenza La radiazione incidente
specchio concavo 1 Immagine diffusa da una sorgente S S C I specchio concavo 2 immagine I della sorgente S S C I propagazione delle onde 3 principio di Huygens S 4 interferenza La radiazione incidente
5.4 Larghezza naturale di una riga
 5.4 Larghezza naturale di una riga Un modello classico più soddisfacente del processo di emissione è il seguente. Si considera una carica elettrica puntiforme in moto armonico di pulsazione ω 0 ; la carica,
5.4 Larghezza naturale di una riga Un modello classico più soddisfacente del processo di emissione è il seguente. Si considera una carica elettrica puntiforme in moto armonico di pulsazione ω 0 ; la carica,
suono alcuni suoni balenottera capodoglio delfino orca nave passeggeri megattera terremoto
 la luce La luce del Sole è assorbita in funzione della frequenza; quella corrispondente al colore blu è assorbita meno. Da 100-200 metri di profondità esiste solo una tenue presenza del blu per poi sparire
la luce La luce del Sole è assorbita in funzione della frequenza; quella corrispondente al colore blu è assorbita meno. Da 100-200 metri di profondità esiste solo una tenue presenza del blu per poi sparire
La struttura dell atomo
 La struttura dell atomo raggi catodici (elettroni) raggi canale (ioni positivi) Modello di Thomson Atomo come una piccola sfera omogenea carica di elettricità positiva, nella quale sono dispersi gli elettroni,
La struttura dell atomo raggi catodici (elettroni) raggi canale (ioni positivi) Modello di Thomson Atomo come una piccola sfera omogenea carica di elettricità positiva, nella quale sono dispersi gli elettroni,
the power of ten Prof.ssa Patrizia Gallucci
 https://www.youtube.com/watch?v=5ckd0apswe8 the power of ten Prof.ssa Patrizia Gallucci ESPERIMENTO DI RUTHEFORD Dopo l esperimento Rutheford ipotizzò un atomo con un nucleo centrale,formato da neutroni
https://www.youtube.com/watch?v=5ckd0apswe8 the power of ten Prof.ssa Patrizia Gallucci ESPERIMENTO DI RUTHEFORD Dopo l esperimento Rutheford ipotizzò un atomo con un nucleo centrale,formato da neutroni
Soluzioni Esame di Fisica Corso di laurea in Biotecnologie Linea II (gruppi E-H)
 Soluzioni Esame di Fisica Corso di laurea in Biotecnologie Linea II (gruppi E-H) 16 luglio 2001 Teoria 1. La posizione del centro di massa di un sistema di N particelle puntiformi è data da Ni r i m i
Soluzioni Esame di Fisica Corso di laurea in Biotecnologie Linea II (gruppi E-H) 16 luglio 2001 Teoria 1. La posizione del centro di massa di un sistema di N particelle puntiformi è data da Ni r i m i
ATOMO. Avogadro (1811) Volumi uguali di gas diversi contengono un ugual numero di MOLECOLE (N A =6,022*10 23 )
 ATOMO Democrito IV secolo A.C. (atomos = indivisibile) Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811)
ATOMO Democrito IV secolo A.C. (atomos = indivisibile) Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811)
Nell'atomo l'energia dell'elettrone varia per quantità discrete (quanti).
 4. ORBITALI ATOMICI Energia degli orbitali atomici Nell'atomo l'energia dell'elettrone varia per quantità discrete (quanti). Il diagramma energetico dell'atomo di idrogeno: i livelli (individuati da n)
4. ORBITALI ATOMICI Energia degli orbitali atomici Nell'atomo l'energia dell'elettrone varia per quantità discrete (quanti). Il diagramma energetico dell'atomo di idrogeno: i livelli (individuati da n)
Corso di Laurea in Scienze Ambientali Corso di Fisica Generale II a.a. 2010/11. Prova di esame del 13/6/ NOME
 Corso di Laurea in Scienze Ambientali Corso di Fisica Generale II a.a. 2010/11 Prova di esame del 13/6/2011 - NOME 1) Un gas perfetto monoatomico con n= 2 moli viene utilizzato in una macchina termica
Corso di Laurea in Scienze Ambientali Corso di Fisica Generale II a.a. 2010/11 Prova di esame del 13/6/2011 - NOME 1) Un gas perfetto monoatomico con n= 2 moli viene utilizzato in una macchina termica
Lezione n. 13. Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo. di idrogeno. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 13 Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo di idrogeno Antonino Polimeno 1 Radiazione elettromagnetica (1) - Rappresentazione
Chimica Fisica Biotecnologie sanitarie Lezione n. 13 Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo di idrogeno Antonino Polimeno 1 Radiazione elettromagnetica (1) - Rappresentazione
Come superare le critiche al modello di Bohr? 1 1
 Comportamento corpuscolare degli elettroni Parecchi dati sperimentali avevano già evidenziato come gli elettroni fossero delle particelle cariche negativamente Come superare le critiche al modello di Bohr?
Comportamento corpuscolare degli elettroni Parecchi dati sperimentali avevano già evidenziato come gli elettroni fossero delle particelle cariche negativamente Come superare le critiche al modello di Bohr?
LIBRETTO DELLE LEZIONI DEL CORSO DI. Fisica quantistica e dello stato solido IMPARTITE DAL PROF. Antonio Polimeni NELL'ANNO ACCADEMICO 2017/2018
 1 UNIVERSITA DEGLI STUDI DI ROMA LA SAPIENZA FACOLTA DI INGEGNERIA LIBRETTO DELLE LEZIONI DEL CORSO DI Fisica quantistica e dello stato solido IMPARTITE DAL PROF. Antonio Polimeni NELL'ANNO ACCADEMICO
1 UNIVERSITA DEGLI STUDI DI ROMA LA SAPIENZA FACOLTA DI INGEGNERIA LIBRETTO DELLE LEZIONI DEL CORSO DI Fisica quantistica e dello stato solido IMPARTITE DAL PROF. Antonio Polimeni NELL'ANNO ACCADEMICO
Introduzione ai fenomeni quantistici
 Introduzione ai fenomeni quantistici Tratto da: The Feynman lectures on physics, vol. 3 Marco Bonvini Nicodemo Magnoli Meccanica: Keplero (1608-1619) Galilei (1630) Newton (1687) Termodinamica: Kelvin
Introduzione ai fenomeni quantistici Tratto da: The Feynman lectures on physics, vol. 3 Marco Bonvini Nicodemo Magnoli Meccanica: Keplero (1608-1619) Galilei (1630) Newton (1687) Termodinamica: Kelvin
raggio atomico: raggio del nucleo: cm cm
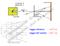 raggio atomico: raggio del nucleo: 10 10 8 1 cm cm Modello di Rutherford: contrasto con la fisica classica perché prima o poi l elettrone avrebbe dovuto cadere sul nucleo irradiando Energia. Le leggi valide
raggio atomico: raggio del nucleo: 10 10 8 1 cm cm Modello di Rutherford: contrasto con la fisica classica perché prima o poi l elettrone avrebbe dovuto cadere sul nucleo irradiando Energia. Le leggi valide
L atomo di Bohr e i raggi X
 L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
Il principio di indeterminazione di Heisenberg
 Il principio di indeterminazione di Heisenberg Il prodotto degli errori nella determinazione contemporanea della quantità di moto (q = mv) e della posizione di un corpo in movimento è almeno uguale a h
Il principio di indeterminazione di Heisenberg Il prodotto degli errori nella determinazione contemporanea della quantità di moto (q = mv) e della posizione di un corpo in movimento è almeno uguale a h
3. Struttura dell atomo
 Di cosa parleremo L organizzazione interna delle particelle che costituiscono gli atomi è stata oggetto di studio per lungo tempo e le ipotesi sulla struttura atomica si sono evolute nel tempo in base
Di cosa parleremo L organizzazione interna delle particelle che costituiscono gli atomi è stata oggetto di studio per lungo tempo e le ipotesi sulla struttura atomica si sono evolute nel tempo in base
Atomo. Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale)
 Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano
Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano
La teoria atomistica
 La teoria atomistica Joseph John Thomson Fisico britannico È noto per aver scoperto nel 1897 la particella di carica negativa: l'elettrone Ebbe come studente Rutherford Vinse il Nobel per la fisica nel
La teoria atomistica Joseph John Thomson Fisico britannico È noto per aver scoperto nel 1897 la particella di carica negativa: l'elettrone Ebbe come studente Rutherford Vinse il Nobel per la fisica nel
Fisica Moderna e contemporanea
 Fisica Moderna e contemporanea SSIS Puglia Prof. Luigi Schiavulli luigi.schiavulli@ba.infn.it Dipartimento Interateneo di Fisica Michelangelo Merlin 02/02/2006 1 Sommario Quadro riassuntivo sulla Fisica
Fisica Moderna e contemporanea SSIS Puglia Prof. Luigi Schiavulli luigi.schiavulli@ba.infn.it Dipartimento Interateneo di Fisica Michelangelo Merlin 02/02/2006 1 Sommario Quadro riassuntivo sulla Fisica
Fenomeni quantistici
 Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Settimana 4 La Meccanica Quantistica Gli inizi Planck, Einstein, Bohr De Broglie: le particelle sono anche onde
 Relatività e Meccanica Quantistica: concetti e idee Relativity and Quantum Mechanics: concepts and ideas Settimana 4 La Meccanica Quantistica Gli inizi Planck, Einstein, Bohr De Broglie: le particelle
Relatività e Meccanica Quantistica: concetti e idee Relativity and Quantum Mechanics: concepts and ideas Settimana 4 La Meccanica Quantistica Gli inizi Planck, Einstein, Bohr De Broglie: le particelle
Prerequisiti Lezione 1. Ripasso
 Prerequisiti Lezione 1 Ripasso Misura di angoli Nel sistema sessagesimale l'angolo completo o angolo giro è suddiviso in 360 spicchi, equivalenti all'unità di misura convenzionale denominata grado sessagesimale,
Prerequisiti Lezione 1 Ripasso Misura di angoli Nel sistema sessagesimale l'angolo completo o angolo giro è suddiviso in 360 spicchi, equivalenti all'unità di misura convenzionale denominata grado sessagesimale,
Università Primo Levi
 Università Primo Levi Primo Levi 2013 Le forze fondamentali e la fisica dei quanta INAF Osservatorio Astronomico di Bologna via Ranzani, 1 40127 - Bologna - Italia Tel, 051-2095721 Fax, 051-2095700 http://www.bo.astro.it/~bedogni/primolevi
Università Primo Levi Primo Levi 2013 Le forze fondamentali e la fisica dei quanta INAF Osservatorio Astronomico di Bologna via Ranzani, 1 40127 - Bologna - Italia Tel, 051-2095721 Fax, 051-2095700 http://www.bo.astro.it/~bedogni/primolevi
INTERFERENZA - DIFFRAZIONE
 INTERFERENZA - F. Due onde luminose in aria, di lunghezza d onda = 600 nm, sono inizialmente in fase. Si muovono poi attraverso degli strati di plastica trasparente di lunghezza L = 4 m, ma indice di rifrazione
INTERFERENZA - F. Due onde luminose in aria, di lunghezza d onda = 600 nm, sono inizialmente in fase. Si muovono poi attraverso degli strati di plastica trasparente di lunghezza L = 4 m, ma indice di rifrazione
L atomo. Il neutrone ha una massa 1839 volte superiore a quella dell elettrone. 3. Le particelle fondamentali dell atomo
 L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
Programma della I parte
 Programma della I parte Cenni alla meccanica quantistica: il modello dell atomo Dall atomo ai cristalli: statistica di Fermi-Dirac il modello a bande di energia popolazione delle bande livello di Fermi
Programma della I parte Cenni alla meccanica quantistica: il modello dell atomo Dall atomo ai cristalli: statistica di Fermi-Dirac il modello a bande di energia popolazione delle bande livello di Fermi
Tabella periodica degli elementi
 Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
crisi della fisica classica Esercizi
 Esercizi Crisi della fisica classica Se un elettrone viene colpito da un fotone, può assorbirlo senza emetterne un altro? Nell urto, l elettrone cambia velocità, quindi ha un accelerazione. Le equazioni
Esercizi Crisi della fisica classica Se un elettrone viene colpito da un fotone, può assorbirlo senza emetterne un altro? Nell urto, l elettrone cambia velocità, quindi ha un accelerazione. Le equazioni
LO SPAZIO DELLE FASI. Lezioni d'autore
 LO SPAZIO DELLE FASI Lezioni d'autore Un video : Clic Lo spazio delle fasi in meccanica classica (I) La descrizione dinamica di un punto materiale con un solo grado di libertà soggetto a forze avviene
LO SPAZIO DELLE FASI Lezioni d'autore Un video : Clic Lo spazio delle fasi in meccanica classica (I) La descrizione dinamica di un punto materiale con un solo grado di libertà soggetto a forze avviene
FAM. 2. A che cosa corrisponde l intersezione delle iperboli con la retta y = 2? Rappresenta graficamente la situazione.
 FAM Serie 6: Fenomeni ondulatori VI C. Ferrari Esercizio 1 Equazione dell iperbole ed interferenza Considera due sorgenti S 1 e S 2 poste sull asse Ox in x = d 2 e x = d 2. 1. Nel piano Oxy determina le
FAM Serie 6: Fenomeni ondulatori VI C. Ferrari Esercizio 1 Equazione dell iperbole ed interferenza Considera due sorgenti S 1 e S 2 poste sull asse Ox in x = d 2 e x = d 2. 1. Nel piano Oxy determina le
catastrofe ultravioletta
 Fisica moderna Radiazione termica La radiazione termica è l insieme di onde elettromagnetiche che ogni corpo emette per effetto della sua temperatura Un corpo nero è un corpo che assorbe completamente
Fisica moderna Radiazione termica La radiazione termica è l insieme di onde elettromagnetiche che ogni corpo emette per effetto della sua temperatura Un corpo nero è un corpo che assorbe completamente
Struttura della materia
 Struttura della materia 1. L elettrone 2. Effetto Compton 3. Struttura dell atomo XIV - 0 Rapporto carica/massa dell elettrone Esperimento di Thomson: raggi catodici. Fascio non deflesso: Quando B=0: con
Struttura della materia 1. L elettrone 2. Effetto Compton 3. Struttura dell atomo XIV - 0 Rapporto carica/massa dell elettrone Esperimento di Thomson: raggi catodici. Fascio non deflesso: Quando B=0: con
Ma se dobbiamo trattare l elettrone come un onda occorre una funzione (che dobbiamo trovare) che ne descriva esaurientemente queste proprietà.
 Ma se dobbiamo trattare l elettrone come un onda occorre una funzione (che dobbiamo trovare) che ne descriva esaurientemente queste proprietà. Nell atomo l energia associata ad un elettrone (trascurando
Ma se dobbiamo trattare l elettrone come un onda occorre una funzione (che dobbiamo trovare) che ne descriva esaurientemente queste proprietà. Nell atomo l energia associata ad un elettrone (trascurando
n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]
![n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm] n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]](/thumbs/92/108343390.jpg) Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
Lucegrafo. IV a Esperienza del Laboratorio di Fisica Generale II. Teoria. Principio di Huygens
 IV a Esperienza del Laboratorio di Fisica Generale II Lucegrafo Teoria Principio di Huygens La propagazione della luce è descritta con un semplificato modello ondulatorio, una costruzione geometrica per
IV a Esperienza del Laboratorio di Fisica Generale II Lucegrafo Teoria Principio di Huygens La propagazione della luce è descritta con un semplificato modello ondulatorio, una costruzione geometrica per
LASER PRINCIPI FISICI
 Corso di Tecnologie Speciali I LASER PRINCIPI FISICI Università degli Studi di Napoli Federico II Dipartimento di Ingegneria Chimica, dei Materiali e della Produzione Industriale LASER Light Amplification
Corso di Tecnologie Speciali I LASER PRINCIPI FISICI Università degli Studi di Napoli Federico II Dipartimento di Ingegneria Chimica, dei Materiali e della Produzione Industriale LASER Light Amplification
Lezioni di Meccanica Quantistica
 Luigi E. Picasso Lezioni di Meccanica Quantistica seconda edizione Edizioni ETS www.edizioniets.com Copyright 2015 EDIZIONI ETS Piazza Carrara, 16-19, I-56126 Pisa info@edizioniets.com www.edizioniets.com
Luigi E. Picasso Lezioni di Meccanica Quantistica seconda edizione Edizioni ETS www.edizioniets.com Copyright 2015 EDIZIONI ETS Piazza Carrara, 16-19, I-56126 Pisa info@edizioniets.com www.edizioniets.com
La struttura degli atomi
 1 La struttura degli atomi pg. 298 27-28 31-37 43 47 51-53 55-57 61-62 67(a/h) 68(a/i) La struttura degli atomi e gli andamenti periodici pg.332 1-7 11-15 17-18 27-30 37 40-42 51 Solvay conference, 1927
1 La struttura degli atomi pg. 298 27-28 31-37 43 47 51-53 55-57 61-62 67(a/h) 68(a/i) La struttura degli atomi e gli andamenti periodici pg.332 1-7 11-15 17-18 27-30 37 40-42 51 Solvay conference, 1927
COMPETENZE ABILITÀ CONOSCENZE. descrivere la. Comprendere ed applicare analogie relative ai concetti presi in analisi. struttura.
 ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
La Struttura degli Atomi
 La Struttura degli Atomi!!!!! Perché gli atomi si combinano per formare composti? Perché differenti elementi presentano differenti proprietà? Perché possono essere gassosi, liquidi, solidi, metalli o non-metalli?
La Struttura degli Atomi!!!!! Perché gli atomi si combinano per formare composti? Perché differenti elementi presentano differenti proprietà? Perché possono essere gassosi, liquidi, solidi, metalli o non-metalli?
Corso di Fisica Quantistica Dip.to di Fisica, Università di Pavia
 Corso di Fisica Quantistica Dip.to di Fisica, Università di Pavia Ultimi esercizi e sorprese 28 febbraio 2018 Lucio Claudio Andreani Web: http://fisica.unipv.it/dida/corso-fisica-quantistica.htm Eventuali
Corso di Fisica Quantistica Dip.to di Fisica, Università di Pavia Ultimi esercizi e sorprese 28 febbraio 2018 Lucio Claudio Andreani Web: http://fisica.unipv.it/dida/corso-fisica-quantistica.htm Eventuali
Esercizi di Fisica Matematica 3, anno , parte di meccanica hamiltoniana e quantistica
 Esercizi di Fisica Matematica 3, anno 014-015, parte di meccanica hamiltoniana e quantistica Dario Bambusi 09.06.015 Abstract Gli esercizi dei compiti saranno varianti dei seguenti esercizi. Nei compiti
Esercizi di Fisica Matematica 3, anno 014-015, parte di meccanica hamiltoniana e quantistica Dario Bambusi 09.06.015 Abstract Gli esercizi dei compiti saranno varianti dei seguenti esercizi. Nei compiti
Particelle Subatomiche
 GLI ATOMI Particelle Subatomiche ELEMENTI I diversi atomi sono caratterizzati da un diverso numero di protoni e neutroni; il numero di elettroni è sempre uguale al numero dei protoni (negli atomi neutri)
GLI ATOMI Particelle Subatomiche ELEMENTI I diversi atomi sono caratterizzati da un diverso numero di protoni e neutroni; il numero di elettroni è sempre uguale al numero dei protoni (negli atomi neutri)
Programma della I parte
 Programma della I parte Cenni alla meccanica quantistica: il modello dell atomo Dall atomo ai cristalli: statistica di Fermi-Dirac, il modello a bande di energia, popolazione delle bande, livello di Fermi
Programma della I parte Cenni alla meccanica quantistica: il modello dell atomo Dall atomo ai cristalli: statistica di Fermi-Dirac, il modello a bande di energia, popolazione delle bande, livello di Fermi
Spettro delle onde elettromagnetiche. Ottica: luce visibile leggi della riflessione e rifrazione
 Spettro delle onde elettromagnetiche Ottica: luce visibile leggi della riflessione e rifrazione Introduzione Abbiamo visto che la propagazione della radiazione elettromagnetica nel vuoto è regolata dalle
Spettro delle onde elettromagnetiche Ottica: luce visibile leggi della riflessione e rifrazione Introduzione Abbiamo visto che la propagazione della radiazione elettromagnetica nel vuoto è regolata dalle
La radiazione elettromagnetica. aumento della frequenza n della radiazione aumento dell energia E della radiazione
 La radiazione elettromagnetica aumento della frequenza n della radiazione aumento dell energia E della radiazione La radiazione elettromagnetica Un onda elettromagnetica è caratterizzata dalla lunghezza
La radiazione elettromagnetica aumento della frequenza n della radiazione aumento dell energia E della radiazione La radiazione elettromagnetica Un onda elettromagnetica è caratterizzata dalla lunghezza
NATURA DELLA LUCE. 1/4 - NATURA DELLA LUCE - C. Calì - DIEET-UNIPA (2007-rev_10/11) Pubblicato in
 NATURA DELLA LUCE Nel corso del tempo diverse sono state le teorie formulate per spiegare la luce ed il suo comportamento. La teoria corpuscolare, messa a punto da Newton, è basata sull'ipotesi che la
NATURA DELLA LUCE Nel corso del tempo diverse sono state le teorie formulate per spiegare la luce ed il suo comportamento. La teoria corpuscolare, messa a punto da Newton, è basata sull'ipotesi che la
