GLI ENZIMI. Quasi tutti gli enzimi sono proteine (alcuni RNA hanno attività catalitica).
|
|
|
- Sara Roberti
- 8 anni fa
- Visualizzazioni
Transcript
1 GLI ENZIMI 1. Definizione. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Un catalizzatore è una sostanza che è in grado di accelerare lo svolgimento di una reazione chimica diminuendo l'energia richiesta per farla iniziare (energia di attivazione) aumentando, in ultima analisi, la velocità della reazione in oggetto. Il catalizzatore partecipa alla reazione, ma non venendo consumato ne esce inalterato e quindi può essere riutilizzato. Nel caso di reazioni all equilibrio, l enzima accelera il raggiungimento dell equilibrio* di una reazione chimica (spontanea!) senza spostarlo. Quindi accelera (da 10 7 a volte!) della stessa entità sia la reazione in un senso che quella in senso opposto: A + B C + D Quasi tutti gli enzimi sono proteine (alcuni RNA hanno attività catalitica). *L equilibrio (dinamico) di reazione è raggiunto quando le concentrazioni relative di reagenti e prodotti non cambiano più nel tempo. 2. Meccanismo d azione. Quando un substrato S viene convertito in prodotto P (a minore contenuto energetico rispetto a S, altrimenti la reazione sarebbe termodinamicamente impossibile e nessun enzima sarebbe in grado di farla avvenire!) le molecole di S passano attraverso uno stato intermedio tra S e P (lo stato di transizione, S*) caratterizzato da un contenuto energetico maggiore di S. La differenza tra il contenuto energetico di S e quello di S* è detta energia di attivazione di S. L enzima è in grado di legare S* (ha maggiore affinità per S* che per S) e il legame E-S* abbassa l energia di attivazione: la formazione di legami tra E ed S* libera energia (energia di legame E-S*) e abbassa il contenuto energetico di E-S*. Quindi statisticamente, nell unità di tempo, più molecole di S riusciranno a superare la barriera di attivazione e procedere lungo la direzione di reazione. L enzima lega S* a livello di un sito preciso sulla superficie della proteina che si chiama sito attivo: questa tasca, di solito superficiale, corrisponde esattamente per forma e disposizione di cariche elettriche e/o residui idrofobici (dei gruppi R degli amminoacidi che foderano il sito attivo) a S*. Si può immaginare che S* sia la chiave e il sito attivo sia la serratura specifica per quella chiave. I legami che si formano tra S* e il sito attivo sono di solito legami deboli (ponti H, legami ionici e idrofobici) anche se in alcuni enzimi si tratta di legami covalenti.
2 L esistenza di un sito attivo dove si lega il substrato e dove avviene la sua trasformazione in prodotto determina alcune proprietà comuni a tutti gli enzimi: specificità, saturabilità e inibibilità. Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili a S. Saturabilità: quando tutti i siti attivi di tutte le molecole enzimatiche presenti sono legate al substrato (saturate) la velocità di catalisi è massima e non può aumentare ulteriormente, anche aggiungendo altro substrato. Inibibilità: una molecola che assomigli moltissimo al substrato (per forma, distribuzione di cariche, ecc.) e che si leghi al sito attivo può spiazzare il vero substrato dal legame con il sito attivo e inibire l attività enzimatica (inibizione competitiva). L aggiunta di un eccesso di substrato, però, rende reversibile l inibizione. Molti farmaci agiscono per inibizione enzimatica. 3. Cinetica enzimatica. L attività catalitica degli enzimi è caratterizzata da due parametri cinetici che consentono di confrontare l azione di enzimi diversi e la loro affinità per il substrato. Questi due parametri sono la costante di Michaelis-Menten (Km) e la velocità massima (Vmax). Con l aumentare della concentrazione di S ([S]) la velocità di catalisi (prodotto/tempo) aumenta secondo una funzione iperbolica fino a un valore massimo (Vmax), raggiunto quando tutti i siti attivi disponibili sono saturati da S. Cinetica enzimatica degli enzimi a singola subunità Da questo grafico si può derivare il valore di Km, cioè la [S] alla quale V = ½ Vmax. Dato che né il valore di Vmax né quello di Km possono essere calcolati in modo preciso da una curva iperbolica, si preferisce trasformare questa curva in una retta (prendendo il reciproco di ogni valore), dall equazione della quale si possono calcolare precisamente -1/Km e 1/Vmax. Vmax = velocità massima di catalisi, in condizioni di saturazione dell enzima (dipende dalla [E]) Km = concentrazione di S a cui la velocità di catalisi è metà della massima (non dipende dalla [E]). Km è una misura dell affinità dell enzima per S: maggiore la Km (che si misura in molarità), minore l affinità. Un inibitore competitivo (si lega al sito attivo al posto di S) aumenta la Km e lascia invariata la Vmax (un eccesso di S spiazza l inibitore e l enzima raggiunge comunque la sua Vmax, anche se ad una [S] maggiore rispetto alla condizione senza inibitore).
3 Un inibitore non competitivo (si lega all enzima in un punto diverso dal sito attivo, ma induce una modifica conformazionale della proteina enzimatica tale per cui S non si può più legare al sito attivo) abbassa Vmax ma lascia invariata Km (affinità dell enzima per S). Enzimi allosterici. Allosterico significa altro sito (oltre al sito attivo): gli enzimi allosterici, oltre al sito attivo dove si lega il substrato, possiedono un altro sito dove si lega il regolatore (attivatore o inibitore). Il legame del regolatore modifica la conformazione del sito attivo e quindi modifica l attività catalitica dell enzima. Quasi tutti gli enzimi allosterici sono formati da più di una subunità proteica: in questi casi può verificarsi un effetto cooperativo tra i siti attivi presenti sulle diverse subunità. La cooperatività di legame con il substrato si ha quando una subunità proteica dell enzima lega S e induce una modifica conformazionale nelle altre subunità che ne aumenta l affinità per S. La conseguenza è che piccole variazioni della [S] inducono grandi variazioni della velocità di catalisi. La cinetica enzimatica è descritta allora da una curva sigmoide anziché iperbolica. Cinetica enzimatica degli enzimi allosterici che mostrano cooperatività di legame E-S La cooperatività è un meccanismo per regolare l attività enzimatica sulla base della disponibilità di S, ma gli enzimi hanno anche altri meccanismi di regolazione, come descritto sotto. 4. Classi di enzimi. Gli enzimi vengono suddivisi in 6 classi sulla base del tipo di reazione che catalizzano. Classe 1: ossido-reduttasi o deidrogenasi. Catalizzano reazioni di ossido-riduzione, con l aiuto di specifici coenzimi vitaminici (NAD+, NADP + o FAD) che fungono da trasportatori di elettroni. Classe 2: transferasi. Catalizzano reazioni di trasferimento di gruppo. Ad esempio, le cinasi trasferiscono un fosfato dall ATP ad una molecola accettrice (o viceversa): X + ATP XP + ADP ; possono essere reazioni reversibili o irreversibili a seconda del G di idrolisi del legame X-P confrontato con il legame ADP-P (il potenziale di trasferimento del fosfato ). Classe 3: idrolasi. Catalizzano la rottura di un legame per introduzione di una molecola d acqua: XY + H 2 O X-H + Y-OH ; sono sempre reazioni irreversibili. Classe 4: liasi. Catalizzano reazioni di addizione a doppi legami, del tipo: X + Y XY (NON richiede energia!) ; sono reazioni reversibili. Classe 5: isomerasi. Catalizzano reazioni (reversibili) di isomerizzazione. Classe 6: ligasi o sintetasi. Catalizzano la formazione di nuovi legami chimici con dispendio di energia (ATP): X + Y + ATP XY + ADP + P i ; sono sempre reazioni irreversibili.
4 Gli enzimi più importanti per lo studio del metabolismo energetico sono le ossidoreduttasi e le cinasi. Attraverso reazioni di ossidazione dei substrati metabolici (glucoso, fruttoso, acidi grassi) si formano i coenzimi ridotti (NADH e FADH 2 ) che, nella catena respiratoria mitocondriale, saranno utilizzati per generare il gradiente protonico necessario alla sintesi dell ATP. Le cinasi catalizzano le reazioni di trasferimento del fosfato dall ATP su glucoso e fruttoso (che servono ad attivare questi zuccheri e ne consentono l utilizzazione metabolica) e catalizzano reazioni di trasferimento del fosfato da molecole fosforilate sull ADP, con formazione di ATP, nelle cosiddette reazioni di fosforilazione a livello del substrato nella glicolisi. 5. Meccanismi catalitici. Gli enzimi agiscono attraverso uno o più dei seguenti meccanismi: distorsione del substrato: per legarsi al sito attivo il substrato deve essere leggermente distorto (S*) e questo favorisce la successiva trasformazione in prodotto; riduzione entropica: diminuzione dei moti molecolari relativi dei due substrati che devono reagire, perché legati entrambi nel sito attivo; desolvatazione: aumento della forza delle interazioni deboli (legami ionici, idrofobici, ponti H) tra 2 substrati per allontanamento delle molecole d acqua intorno a loro; riduzione della diffusione dei prodotti intermedi: nei complessi multienzimatici, i prodotti intermedi non abbandonano il complesso proteico (aumenta la velocità e l efficienza catalitica). Molti enzimi richiedono cofattori per funzionare: ad es. ioni metallici o coenzimi. Se legati covalentemente i cofattori sono detti gruppi prostetici. Tutti i coenzimi (molecole non proteiche necessarie alla funzione dell enzima) contengono nella loro molecola una parte vitaminica: il nostro organismo non è in grado di sintetizzare le vitamine, che devono essere assunte con l alimentazione. Una volta assorbite, le nostre cellule sono in grado di trasformarle nei corrispondenti coenzimi. Data la fondamentale importanza degli enzimi nel consentire il metabolismo si capisce perché la carenza di vitamine sia una condizione incompatibile con la vita. Coenzimi vitaminici VITAMINA COENZIMA ENZIMA/FUNZIONE Tiamina (B1) TPP Piruvato deidrogenasi Acido pantotenico (B5) Coenzima A (CoA) Trasportatore di acili Piridossina (B6) Piridossalfosfato (PLP) Transaminasi Biotina (H) Biocitina Carbossilasi Acido Folico (B9) Acido tetraidrofolico (THF) Trasferimento unità monocarboniose Acido nicotinico (B3) Nicotinamide adenina dinucleotide (NAD) Deidrogenasi (trasferimento di elettroni) Riboflavina (B2) Flavin adenina dinucleotide Deidrogenasi (trasferimento di elettroni)
5 Struttura di NADH/NAD + (1) NADPH/NADP + 6. Meccanismi di regolazione dell attività enzimatica. Gli enzimi sono i semafori che regolano il traffico di metaboliti lungo le vie metaboliche. L attività degli enzimi deve essere regolata, in modo da rispondere alle diverse esigenze metaboliche (per es. stato alimentato-digiuno). I meccanismi di regolazione dell attività enzimatica sono: Regolazione covalente. Il legame covalente tra enzima e regolatore (tipicamente un fosfato donato dall ATP) modifica (stimola o inibisce) l attività enzimatica. Il fosfato è trasferito dall ATP sull enzima ad opera di un altro enzima (cinasi, classe transferasi). L idrolisi del legame enzimafosfato avviene ad opera di una fosfatasi (classe idrolasi), che ripristina l attività enzimatica nativa. Cinasi e fosfatasi sono controllate da ormoni: il glucagone stimola le cinasi e l insulina stimola le fosfatasi. GLUCAGONE ATP ADP ENZIMA (inattivo) CINASI FOSFATASI ENZIMA-FOSFATO (attivo) Fosfato H 2 O INSULINA Regolazione allosterica. Il regolatore (attivatore o inibitore), di solito un metabolita oppure ATP o AMP, si lega all enzima con legami deboli, non covalenti (ponti H, legami ionici) e modifica l attività enzimatica. Regolazione ormonale. Gli ormoni possono modificare l attività degli enzimi sia attraverso meccanismi di regolazione covalente (regolando l attività di cinasi o fosfatasi che controllano lo stato di fosforilazione degli enzimi) che modificando la velocità di trascrizione dei geni che codificano per alcuni enzimi (induzione o repressione enzimatica).
6 Isoenzimi. Gli isoenzimi sono enzimi che catalizzano la stessa reazione, ma che hanno una diversa affinità per il substrato (Km) e si trovano in tessuti diversi. La diversa Km fa si che la stessa reazione (A B) proceda a velocità diverse (o addirittura in direzione opposta) in tessuti diversi, a parità di concentrazione del substrato (A). Alcuni isoenzimi vengono dosati nel plasma come enzimi di sortita per fare diagnosi di danno tessuto-specifico (AST, ALT, LDH, CPK). Le transaminasi AST e ALT sono particolarmente abbondanti nel fegato (aumentano nel sangue in corso di epatite acuta e cronica); LDH e CPK sono abbondanti nel muscolo (aumentano nel sangue dopo infarto del miocardio). Pro-enzimi. Alcuni enzimi vengono sintetizzati come pro-enzimi inattivi e vengono attivati (per taglio proteolitico) solo nei distretti o nelle condizioni che ne richiedono l attività. Gli enzimi digestivi, prodotti dal pancreas esocrino, vengono attivati solo nel lume intestinale; i fattori della coagulazione, sempre presenti nel plasma, vengono attivati solo quando si verifica un danno tissutale. EMOGLOBINA E MIOGLOBINA Emoglobina e mioglobina sono proteine di trasporto dell ossigeno, presenti rispettivamente nei globuli rossi (eritrociti) e nelle cellule muscolari. Anche se NON sono enzimi, vengono trattate dopo gli enzimi perché il loro comportamento rispetto all ossigeno è simile a quello degli enzimi allosterici (emoglobina) e non allosterici (mioglobina) rispetto al loro substrato. EMOGLOBINA 1-Struttura L emoglobina è formata da 4 subunità proteiche: l emoglobina A1, la principale emoglobina dell adulto (98%) ha formula peptidica α 2 β 2. L emoglobina fetale (emoglobina F), la principale emoglobina durante la vita fetale, al posto delle catene β presenta due catene γ. Formula peptidica delle emoglobine dell adulto, del feto e dell embrione: Adulto: A1 α 2 β 2 97% (due catene alfa e due beta) A2 α 2 δ 2 2-3% (due catene alfa e due delta) Feto: F α 2 γ 2 0,5% (due catene alfa e due gamma) F α 2 γ 2 70% alla nascita (e 30% di A1) Embrione: Gower 1 ζ 2 ε 2 (due catene zeta e due epsilon) Gower 2 α 2 ε 2 (due catene alfa e due epsilon) Portland ζ 2 γ 2 (due catene zeta e due gamma) Alfa e beta non si riferiscono al tipo di struttura secondaria, ma danno il nome alla catena proteica!
7 Ogni subunità lega un gruppo prostetico (parte non proteica necessaria alla funzione): il gruppo eme. Il gruppo eme è un tetrapirrolo che lega al centro uno ione ferroso (Fe 2+ ). Il ferro è legato ai quattro atomi di azoto del tetrapirrolo (che giacciono su un piano), e altri due legami, ortogonali al piano dell eme, legano il ferro alla catena proteica (α o β) e all ossigeno. Struttura del gruppo Eme, il gruppo prostetico dell emoglobina Durante l ossigenazione il ferro compie un piccolo movimento verso il centro del piano dell eme. Per farlo, si trascina dietro la catena peptidica, rompendo alcuni dei legami deboli che tengono unite le une alle altre le catene α e β del tetramero di emoglobina. Gli altri 3 atomi di ferro degli altri gruppi eme saranno quindi più liberi di muoversi durante la loro ossigenazione (cooperatività del legame eme-o 2 ). Quando il ferro (Fe 2+ ) dell eme viene ossidato a Fe 3+ l eme non può più legare l ossigeno: l emoglobina si chiama allora metaemoglobina. Un po di metaemoglobina si forma continuamente negli eritrociti perché piccoli movimenti della tasca proteica dove è contenuto l eme lasciano entrare acqua a contatto del ferro, che si ossida (perde un elettrone). L enzima metaemoglobina reduttasi continuamente rigenera il Fe 2+ utilizzando NADH come donatore di elettroni. Lo ione superossido (O - 2 ) che si forma dall ossigeno ridotto dall elettrone perduto dal ferro si combina con H + per dare H 2 O 2 (acqua ossigenata), fortemente ossidante, che viene ridotta ad H 2 0 dal glutatione ridotto (GSH) in una reazione catalizzata dall enzima glutatione perossidasi. 2-Funzione Il legame dell emoglobina con l ossigeno è cooperativo: quando il primo gruppo eme lega l ossigeno, l affinità per l ossigeno degli altri 3 gruppi eme di una molecola di emoglobina aumenta. La cooperatività di legame con l ossigeno si manifesta nella curva di saturazione dell emoglobina, che è sigmoide. La parte ripida della curva, dove piccole variazioni della po 2 inducono grandi variazioni della saturazione, coincide con i valori di po 2 che si trovano nei tessuti.
8 Oltre a trasportare l ossigeno, l emoglobina trasporta anche CO 2. La CO 2 è trasportata sotto forma di CO 2 o sotto forma di H + : in entrambi i casi viene legata ai gruppi amminici terminali delle catene proteiche. L emoglobina trasporta ossigeno dai polmoni ai tessuti e CO 2 dai tessuti ai polmoni. Nei tessuti, la CO 2 prodotta dal ciclo di Krebs esce dalle cellule, si scioglie nel sangue e spinge l equilibrio della reazione CO 2 + H 2 O H 2 CO 3 negli eritrociti verso l acido, che si dissocia in H + e HCO3 -. Gli ioni H + acidificano l ambiente e, insieme alla bassa po 2, determinano il rilascio di O 2 dall Hb e la protonazione dell emoglobina. Nei polmoni la CO 2 è continuamente espirata e quindi la sua pressione parziale è bassa: quando gli eritrociti raggiungono i polmoni, l equilibrio della reazione CO 2 + H 2 O H 2 CO 3 negli eritrociti è spostato verso sinistra. La bassa [H + ] nel sangue determina il rilascio degli ioni H + dall emoglobina che si carica di O 2 (grazie all alta po 2 ). Gli ioni H + si ricombinano con HCO 3 - per dare CO 2, che viene espirata, e H 2 O. 3-Effetto Bohr Con effetto Bohr si intende la diminuzione dell affinità dell emoglobina per l ossigeno indotta da una diminuzione del ph (acidità). Questo meccanismo contribuisce a indurre il rilascio di ossigeno da parte dell emoglobina quando i globuli rossi raggiungono i tessuti, dove l attività metabolica accumula CO 2. La CO 2 sciogliendosi nell acqua forma acido carbonico (H 2 CO 3 ) che acidifica l ambiente. Curve di ossigenazione di mioglobina ed emoglobina
9 Il ph acido sposta a destra la curva di saturazione dell emoglobina. Il motivo è che la protonazione delle catene globiniche aggiunge cariche positive che formano legami ionici con cariche negative situate sulle catene globiniche vicine: questi legami ionici contribuiscono a legare una all altra le catene globiniche e rendono più difficile il movimento degli atomi di ferro di ogni gruppo eme durante l ossigenazione. 4-Il 2,3 bisfosfoglicerato (2,3BPG) Il 2,3BPG è un importante modulatore dell affinità dell emoglobina per l ossigeno: legandosi in una tasca tra le due catene β dell emoglobina (foderata di aa. carichi positivamente) riduce l affinità dell emoglobina per l ossigeno (cioè sposta a destra la curva di saturazione). La formazione di legami ionici addizionali tra le catene β (mediati dal 2,3BPG) contribuisce a rendere più difficile il movimento che il ferro deve fare dentro il piano dell eme per legare l ossigeno. Il 2,3BPG è prodotto a partire da 1,3BPG (un intermedio della glicolisi) dentro gli eritrociti (è circa equimolare con l emoglobina) e assicura il rilascio dell ossigeno da parte dell emoglobina alle pressioni parziali di ossigeno che si trovano nei tessuti. L emoglobina fetale ha maggiore affinità per l ossigeno dell emoglobina A1 perché lega meno saldamente il 2,3BPG (le catene β sono sostituite da catene γ). L importanza dell effetto cooperativo nel legame all ossigeno e del 2,3BPG nel consentire il rilascio graduale dell ossigeno da parte dell emoglobina alle pressioni parziali di ossigeno riscontrate nei tessuti è evidente confrontando la curva di saturazione dell emoglobina con quella della mioglobina. MIOGLOBINA 1-Struttura. La mioglobina è formata da una sola subunità proteica e si trova dentro le cellule muscolari, dove funziona come una riserva di ossigeno. Il gruppo prostetico della mioglobina è ancora il gruppo eme: una molecola di mioglobina lega un solo gruppo eme. 2-Funzione. Non c è effetto cooperativo nel legame con l ossigeno e la curva di saturazione è iperbolica. Il legame della mioglobina con l ossigeno è del tipo tutto-o-nulla: la mioglobina è completamente saturata dall ossigeno alla po 2 alla quale la emoglobina cede l ossigeno ai tessuti (e quindi anche al muscolo a riposo). La mioglobina si satura con l ossigeno ceduto dalla emoglobina e cede l ossigeno solo quando la po 2 scende molto al di sotto dei valori normali per un tessuto qualunque,
10 cioè quando il muscolo si contrae attivamente (e le cellule muscolari consumano rapidamente ossigeno per produrre ATP). La mioglobina è una riserva di ossigeno per il muscolo in contrazione. EMOGLOBINOPATIE E TALASSEMIE Le malattie a carico dell emoglobina sono tutte malattie congenite (ereditarie) e si dividono in emoglobinopatie (difetto qualitativo) e talassemie (difetto quantitativo). La diagnosi si fa con l elettroforesi dell emoglobina e/o con l analisi della mutazione genica. 1- Emoglobinopatie. Anemia falciforme. L amminoacido n 6 sulle catene β è mutato (Glu Val): l emoglobina mutata si chiama emoglobina S. Per effetto di questa sostituzione le molecole di deossi-emoglobina tendono a polimerizzare facendo assumere ai globuli rossi una forma a falce. Questi eritrociti tendono ad intasare i piccoli capillari formando trombi: la trombosi a sua volta rallenta l afflusso di sangue, diminuisce la po 2 e questo provoca la falcizzazione di altri globuli rossi con un meccanismo a catena. L esito è la formazione di una zona infartuale a valle del trombo. In Sardegna e nella zona del delta del Po (ex zone malariche) l incidenza dell eterozigosi (portatori sani) arriva a 1/10! E possibile la diagnosi prenatale del difetto omozigote. Metaemoglobinemia congenita. L amminoacido al quale è legato il ferro dell eme è mutato (His Tyr): l emoglobina mutata si chiama emoglobina M. Per effetto di questa sostituzione un amminoacido polare, la tirosina, si viene a trovare vicino al ferro dell'eme e rende più polare la tasca dell eme. L acqua entra così più facilmente e ossida il ferro a Fe 3+, che non può più legare l ossigeno. Allo stato omozigote la mutazione è letale. Allo stato eterozigote è presente una alta percentuale di metaemoglobina e l ossigenazione dei tessuti è ridotta (mucose blu). 2- Talassemie. Le talassemie sono malattie caratterizzate da un difetto quantitativo nella sintesi di catene α (α talassemie) o β (β talassemie). α talassemie. I geni per le catene α sono 4. La mutazione (delezione o interruzione precoce della sequenza codificante) di tutti e 4 è incompatibile con la vita: la mutazione di 1-2-o 3 geni porta alla presenza, in quantità crescente, di emoglobina H (4 catene β) che non mostra cooperatività di legame con l ossigeno (cattiva ossigenazione dei tessuti) e tende a precipitare dentro i globuli rossi (emolisi). β talassemie. I geni per le catene β sono 2. A seconda del tipo di deficit genetico (ridotta o assente trascrizione genica a carico di uno o entrambi i geni) il quadro clinico varia da quello asintomatico della tal. minor (aumentata % di HbA2) alla tal. major (anemia; eritropoiesi inefficace con morte intramidollare dei precursori degli eritrociti per accumulo di catene α; espansione del midollo emopoietico, deformità ossee, splenomegalia ed epatomegalia; sovraccarico di ferro: emosiderosi). Malattia molto invalidante allo stato omozigote: è possibile la diagnosi prenatale. In alcune regioni (delta padano e Sardegna) l incidenza dell eterozigosi arriva al 30% della popolazione!
11 Produzione di energia metabolica Il meccanismo generale di produzione di lavoro dall energia derivante da un flusso elettronico è simile per un motore elettrico e per il nostro organismo. I coenzimi ridotti trasportano gli elettroni dai metaboliti, che vengono ossidati, alla catena respiratoria mitocondriale. Qui gli elettroni vengono trasportati all ossigeno, con produzione di ATP. 1- Catabolismo e anabolismo. Il metabolismo è l insieme delle reazioni chimiche che si svolgono nell organismo. Si divide in catabolismo (reazioni di demolizione, producono energia) e anabolismo (reazioni di sintesi, consumano energia). L energia prodotta o consumata è sotto forma di coenzimi ridotti (NADH, NADPH e FADH 2 ) e ATP.
12 ttraverso le reazioni del catabolismo si produce energia, sotto forma di ATP e coenzimi ridotti (NADH, NADPH e FADH 2 ), che viene utilizzata nelle reazioni di biosintesi, per sintetizzare molecole complesse a partire da precursori semplici. 2- Molecole energetiche nella cellula. L ATP (adenosine triphosphate) è la moneta corrente per tutte le attività cellulari che producono o consumano energia: ATP viene prodotto nel catabolismo ossidativo e ATP viene speso nelle reazioni biosintetiche o nelle attività cellulari (trasporto di metaboliti e ioni attraverso la membrana, contrazione muscolare, produzione di calore). L ATP è energia pronta per tutte le esigenze energetiche della cellula. I coenzimi ridotti NADH e FADH 2 che si producono nelle reazioni di ossidazione dei substrati catalizzate dalle ossidoreduttasi sono energia potenziale, che sarà trasformata in ATP nella catena respiratoria mitocondriale (3 ATP/NADH e 2 ATP/FADH 2 ). Il coenzima ridotto NADPH invece è utilizzato come potere riducente nelle biosintesi e NON per la produzione di ATP nella catena respiratoria. 3- Strategie per la produzione di ATP nelle cellule. Ci sono due modi per produrre ATP attraverso reazioni del catabolismo ossidativo: 1) Reazioni di fosforilazione a livello del substrato. In queste reazioni, catalizzate da cinasi, un intermedio metabolico fosforilato cede il fosfato all ADP con formazione di ATP secondo lo schema generale: XP + ADP X + ATP Es. 1,3 bisfosfoglicerato e fosfoenolpiruvato nella glicolisi; creatina fosfato ( riserva di ATP nel muscolo). Il potenziale di trasferimento del fosfato di questi composti fosforilati è maggiore di quello dell ATP. 2) La fosforilazione ossidativa. Nel processo della fosforilazione ossidativa (che avviene nei mitocondri) l energia potenziale dei coenzimi ridotti (NADH e FADH 2 ) è trasformata nell energia pronta dell ATP attraverso un complesso meccanismo. I coenzimi ridotti sono stati prodotti in reazioni di ossidazione dei substrati (glucoso, fruttoso, acidi grassi) nelle varie vie metaboliche del catabolismo (glicolisi, ciclo di Krebs, ossidazione degli acidi grassi). Pertanto il processo di produzione dell ATP via fosforilazione ossidativa si può dividere in 2 fasi: Fase 1 : riduzione dei coenzimi nelle reazioni di ossidazione dei substrati metabolici X rid + NAD/FAD X ox + NADH/FADH 2 Fase 2 : ri-ossidazione dei coenzimi ridotti accoppiata alla produzione di ATP nella fosforilazione ossidativa nei mitocondri NADH/FADH 2 + O 2 NAD/FAD + H 2 O ADP + P i ATP + H 2 O La fosforilazione ossidativa è la principale fonte di ATP per la maggior parte delle cellule del nostro organismo.
13 4- La fosforilazione ossidativa. Nel processo della fosforilazione ossidativa, che si svolge sulla membrana mitocondriale interna, la riossidazione dei coenzimi ridotti NADH e FADH 2 (prodotti nelle reazioni di ossidazione dei substrati durante il catabolismo ossidativo) è accoppiata alla fosforilazione dell ADP ad ATP. Si possono identificare le seguenti fasi: 1. una serie di proteine trasportatrici di elettroni (la catena respiratoria ) consente il flusso degli elettroni dai coenzimi ridotti (che vengono ossidati) all ossigeno, che viene ridotto ad acqua. Il flusso elettronico è una forma di energia che i complessi sono in grado di sfruttare per pompare protoni nello spazio intermembrana: si genera così un gradiente protonico ai due lati della membrana mitocondriale interna. 2. I protoni concentrati nello spazio intermembrana rientrano spontaneamente nella matrice mitocondriale, spinti dal gradiente elettrochimico, passando attraverso l ATP sintetasi. Questo complesso proteico è in grado di sfruttare l energia del flusso protonico per fosforilare l ADP ad ATP secondo la reazione: ADP + P i ATP + H 2 O Ogni mole di ATP formato richiede 7,5 kcal di energia. Per ogni NADH riossidato si producono 3 ATP; per ogni FADH 2 riossidato si producono 2 ATP (perché gli elettroni donati dal FADH 2 entrano nella catena respiratoria a livello della seconda pompa protonica e quindi si produce un gradiente protonico minore rispetto a quello generato dal NADH). In definitiva, il processo della fosforilazione ossidativa: - rigenera i coenzimi ossidati (NAD e FAD) necessari nelle reazioni di ossidazione dei substrati metabolici nelle varie vie metaboliche del catabolismo ossidativo - produce ATP - produce acqua (l acqua metabolica, una parte importante del nostro fabbisogno idrico giornaliero) - produce calore (la proteina termogenina dissipa in parte il gradiente protonico generando calore) Regolazione. La velocità di trasporto degli elettroni è controllata dalla [ADP], quindi dalla carica energetica cellulare. Un aumento della [ADP] aumenta l attività della ATP sintetasi, che dissipa in parte il
14 gradiente protonico. Questo diminuisce il G per il trasporto dei protoni e più protoni vengono trasportati nello spazio intermembrana: a sua volta ciò fa diminuire il G per il trasporto degli elettroni: quindi, più elettroni vengono trasportati dai complessi ed i coenzimi ridotti vengono ossidati più rapidamente. Rendimento. Il G della catena respiratoria si calcola secondo la formula: G = 2 N e E Dove: N e è la carica di una mole di elettroni (moltiplicata per 2 perché due moli di elettroni riducono una mole di ossigeno atomico per dare una mole d acqua) E è la differenza di potenziale redox ai due estremi della catena respiratoria E = 0,82 ( 0,32) V = 1,14 V La forza traente gli elettroni lungo la catena respiratoria è il potenziale redox: coppia O 2 /H 2 O + 0,82V coppia NAD/NADH 0,32V Differenza di potenziale redox tra fine ed inizio della catena resp. + 0,82 ( 0,32) V Il G in condizioni standard è 56 kcal/mole di NADH riossidato a NAD. Per ogni mole di NADH riossidato si producono 3 moli di ATP: ogni mole di ATP vale 7,5 kcal, quindi si produce ATP per circa 23 kcal. Il rendimento della fosforilazione ossidativa si può calcolare dal rapporto tra energia conservata (sotto forma di ATP) e energia totale liberata: rendimento della f.o. = 23/56 = circa 40% Il resto dell energia liberata nel processo della fosforilazione ossidativa, ma non conservata sotto forma di ATP, è dissipata sotto forma di calore. Una proteina (termogenina) funziona da canale protonico e dissipa in parte il gradiente protonico, aumentando la quota di energia dissipata come calore. La sintesi della termogenina è controllata dagli ormoni tiroidei. SCHEMA GENERALE DEL CATABOLISMO Le principali vie cataboliche che prenderemo in esame saranno le seguenti: Glicogenolisi: demolizione del glicogeno con produzione di glucoso 6-fosfato (G6P). Glicolisi: ossidazione del G6P a 2 molecole di piruvato con produzione netta di 2 molecole di ATP. Glicolisi anaerobia: riduzione del piruvato a lattato per rigenerare il NAD (ossidato) che serve nella glicolisi; quando non ci sono mitocondri oppure l apporto di ossigeno è insufficiente. Decarbossilazione ossidativa del piruvato ad acetato (acetil coenzima A, acetil CoA): consente l ingresso del piruvato nel ciclo di Krebs. Ciclo di Krebs : la principale via ossidativa sulla quale convergono tutti i substrati ossidabili (zuccheri, amminoacidi e acidi grassi); acetato e ossalacetato si uniscono a formare citrato, che subisce una serie di reazioni di decarbossilazione ossidativa e di ossidazione con produzione di 3 NADH, 1 FADH 2 e 1 ATP per ogni giro del ciclo. Corpi chetonici: si formano dall acetato, quando la mancanza di ossalacetato ne impedisce l ingresso nel ciclo di Krebs (digiuno o diabete). Ossidazione degli acidi grassi: produce acetil CoA, NADH e FADH 2. Transamminazione e deamminazione ossidativa del glutammato: la somma delle due reazioni serve a rimuovere il gruppo amminico dagli amminoacidi, producendo ammoniaca (NH 3 ) e lo scheletro carbonioso dell amminoacido. L ammoniaca verrà trasformata in urea nel ciclo dell urea,
15 mentre lo scheletro carbonioso degli amminoacidi entrerà nel ciclo di Krebs o nella gluconeogenesi (a seconda dell aa.). Tutti i coenzimi ridotti (NADH e FADH 2 ) che si producono nelle reazioni di ossidazione dei vari substrati metabolici (glucoso, acidi grassi, acetato) cedono iloro elettroni alla catena di trasporto mitocondriale: al termine del processo della fosforilazione ossidativa, l ossigeno (trasportato dall emoglobina a tutti i tessuti) viene ridotto ad acqua e si produce ATP (3 ATP per ogni NADH e 2 ATP per ogni FADH 2 ). GLICOGENO-LISI E GLICOGENO-SINTESI Il glicogeno (polimero di glucosio) è presente solo nel fegato e nel muscolo. Il glicogeno epatico è a disposizione di tutti i tessuti, grazie alla presenza nel fegato di un enzima (glucosio 6-fosfatasi) che consente al glucosio di uscire dalle cellule epatiche e raggiungere il sangue. Invece il glicogeno muscolare è solo ad uso e consumo del muscolo perché il glucoso 6-fosfato che si produce non può uscire dal muscolo e viene ossidato nella glicolisi per produrre ATP. La glicogenolisi è la demolizione del glicogeno con produzione di glucoso 6-fosfato, secondo le reazioni:
16 glicogeno (n residui) + fosfato glicogeno (n-1) + glucoso-1-fosfato Glicogeno fosforilasi glucoso-1-fosfato glucoso-6-fosfato Fosfoglucoisomerasi glucoso-6-fosfato + H 2 O glucoso + fosfato Glucoso 6-fosfato fosfatasi La glucoso 6-fosfatasi è un enzima presente solo nel fegato. Il glucoso defosforilato può uscire dalle cellule epatiche e attraverso il sangue raggiunge tutti i tessuti. La glicogeno sintesi avviene attraverso le seguenti reazioni: glucoso 6-fosfato glucoso 1-fosfato Fosfoglucoisomerasi glucoso 1-fosfato + UTP UDP-glucoso + PPi UDP glucoso pirofosforilasi glicogeno (n) + UDP-glucoso glicogeno (n +1) + UDP Glicogeno sintasi Regolazione. La glicogeno fosforilasi epatica è attivata per fosforilazione (regolazione covalente) da una cinasi (PKA), a sua volta attivata dall'ormone pancreatico glucagone, attraverso un complesso meccanismo di trasduzione del segnale (ormonale) che utilizza AMP ciclico (camp) come secondo messaggero intracellulare (il 1 messaggero è l'ormone). La stessa cinasi che fosforila, attivandola, la glicogeno fosforilasi, fosforila anche la glicogeno sintasi (l'enzima che sintetizza glicogeno), che però viene inibita. Glucagone recettore attivato camp PKA attiva fosforilasi attiva e glicogeno sintasi inattiva. L'ormone pancreatico insulina, invece, attiva una fosfatasi che defosforila la glicogeno fosforilasi (inattivandola) e la glicogeno sintasi (attivandola). Il glucagone attiva nel fegato la demolizione del glicogeno e inibisce la sintesi. L insulina attiva la sintesi del glicogeno e inibisce la demolizione. Il rapporto glucagone/insulina nel sangue è controllato dalla glicemia: glicemia elevata basso rapporto glucagone/insulina glicemia bassa alto rapporto glucagone/insulina Insulina e glucagone sono due ormoni proteici prodotti dalle cellule β (insulina) e α (glucagone) del pancreas endocrino.
17 GLICOLISI La glicolisi è la via metabolica che ossida il glucoso a piruvato (2 molecole) con produzione di 2 molecole di ATP e 2 molecole di NADH. Presente in tutti i tessuti, può funzionare anche in assenza (o carenza) di ossigeno: glicolisi anaerobia (eritrociti, muscolo in contrazione). Il glucoso (concentrazione nel sangue mg/100ml) entra nelle cellule grazie ad un trasportatore proteico situato sulla membrana di tutte le cellule. L'insulina stimola il trasporto del glucoso in tutti i tessuti, tranne fegato, cervello e globuli rossi. Una volta entrato nelle cellule il glucoso viene subito fosforilato a spese di ATP: il glucoso 6- fosfato non può più uscire dalle cellule e viene ossidato nella glicolisi con le seguenti reazioni: glucoso + ATP glucoso 6-fosfato + ADP Esocinasi/Glucocinasi glucoso 6-fosfato fruttoso 6-fosfato fruttoso 6-fosfato + ATP fruttoso 1,6-difosfato + ADP Fosfofruttocinasi fruttoso 1,6-difosfato gliceraldeide 3-fosfato + diidrossiacetone fosfato diidrossiacetone fosfato gliceraldeide 3-fosfato l equilibrio di questa reazione è spostato verso la gliceraldeide, perché questa è continuamente sottratta all equilibrio dalle reazioni successive; quindi da una molecola di fruttoso 1,6-difosfato si formano 2 molecole di gliceraldeide 3-fosfato gliceraldeide 3-fosfato + NAD + fosfato 1,3BPG + NADH + H + 1,3 BPG + ADP 3-fosfoglicerato + ATP 3-fosfoglicerato 2-fosfoglicerato 2-fosfoglicerato fosfoenolpiruvato + H 2 O fosfoenolpiruvato + ADP piruvato + ATP Piruvato cinasi Regolazione. Le reazioni irreversibili sono catalizzate da enzimi regolati (glucocinasi/esocinasi, fosfofruttocinasi e piruvato cinasi). Il glucoso è fosforilato dalla glucocinasi nel fegato e dalla esocinasi in tutti gli altri tessuti. La glucocinasi ha una alta Km per il glucoso (bassa affinità) ed è indotta dall'insulina. La esocinasi ha una bassa Km per il glucoso (alta affinità) ed è inibita dal glucoso 6-fosfato (inibizione da prodotto). Quindi l'enzima epatico (glucocinasi) funziona solo se la concentrazione di glucoso nel sangue è elevata (dopo il pasto): il glucoso 6-fosfato viene trasformato in glicogeno nel fegato per essere utilizzato quando la glicemia scende. La fosfofrutto cinasi è stimolata allostericamente da AMP (bassa carica energetica della cellula) e inibita allostericamente da ATP (alta carica energetica). Inoltre è attivata dall'insulina e inibita dal glucagone.
18 La piruvato cinasi è inibita allostericamente da ATP ed è inibita dal glucagone, via una fosforilazione (mediata da una proteina cinasi). Invece, la piruvato cinasi è indotta (aumentata sintesi di enzima) dall'insulina. In definitiva, la glicolisi è attivata da una bassa carica energetica e dall'insulina; è inibita da una alta carica energetica e dal glucagone. Glicolisi anaerobia. In presenza di mitocondri (e di ossigeno) il piruvato viene ossidato nel ciclo di Krebs con produzione di ATP e coenzimi ridotti e il NADH (2 molecole/glucoso) viene riossidato nella catena respiratoria. In mancanza di mitocondri (negli eritrociti) o quando l'apporto di ossigeno col sangue è insufficiente alle necessità metaboliche (muscolo in prolungata contrazione) il NADH non può essere riossidato nella catena respiratoria alla stessa velocità alla quale è prodotto nella glicolisi. Perché la glicolisi possa continuare è necessario rigenerare il NAD (ossidato) attraverso la reazione di riduzione del piruvato a lattato: piruvato + NADH + H + lattato + NAD + Lattico deidrogenasi Il lattato è un prodotto di scarto della glicolisi, che esce dalle cellule che lo hanno prodotto (eritrociti, muscolo in contrazione) e raggiunge con il sangue il fegato, dove verrà trasformato in nuovo glucoso con la gluconeogenesi (ciclo di Cori anche detto ciclo del lattato).
19 GLUCONEOGENESI La gluconeogenesi è la sintesi di nuovo glucoso a partire da precursori non carboidrati (lattato, piruvato, amminoacidi). Avviene solo nel fegato. Le reazioni irreversibili nella glicolisi (indicate sopra dalle frecce rosse) sono sostituite dalle seguenti reazioni: piruvato + ATP + CO 2 ossalacetato + ADP + Pi Piruvato carbossilasi Questa reazione avviene nei mitocondri: l ossalacetato (OAA) viene ridotto a malato ed esce dal mitocondrio: nel citoplasma viene nuovamente ossidato ad OAA. Ossalacetato + GTP fosfoenolpiruvato + GDP + CO 2 Le reazioni successive sono le stesse della glicolisi (stessi enzimi) fino al fruttoso 1,6 difosfato: fruttoso 1,6-difosfato + H 2 O fruttoso 6-fosfato + fosfato Fruttoso 1,6-difosfatasi dopo isomerizzazione a glucoso 6-fosfato, questo viene defosforilato a glucoso: glucoso 6-fosfato + H 2 O glucoso + fosfato Glucoso 6-fosfato fosfatasi La sintesi di una molecola di glucoso a partire da 2 molecole di piruvato costa 6 ATP (compresa la reazione reversibile della glicolisi 3-fosfoglicerato + ATP 1,3 BPG + ADP). Regolazione. La piruvato carbossilasi è stimolata allostericamente da acetil coenzima A: un accumulo di acetil CoA stimola la produzione di OAA che ne aiuta lo smaltimento nel ciclo di Krebs (la piruvato carbossilasi è mitocondriale!). La piruvato carbossilasi è anche stimolata con meccanismo covalente da una cinasi stimolata dal glucagone. Anche fruttoso difosfato fosfatasi e glucoso 6-fosfato fosfatasi sono stimolate dal glucagone.
20 VIA DELL ESOSO MONOFOSFATO (via dei pentosi fosfati) Questa via metabolica si compone di una parte ossidativa e di una parte non ossidativa. 1. La parte ossidativa avviene nel citoplasma e converte il glucoso 6-fosfato a riboso 5-fosfato con produzione di 2 molecole di NADPH e una molecola di CO 2. Le reazioni sono le seguenti: glucoso 6-fosfato + NADP «6-fosfoglucono d -lattone + NADPH + H + Glucoso 6-fosfato deidrogenasi 6-fosfoglucono δ-lattone + H 2 O 6-fosfo gluconato lattonasi 6-fosfogluconato + NADP fi ribuloso 5-fosfato + NADPH + H + + CO 2 6-fosfogluconato deidrogenasi ribuloso 5-fosfato riboso 5-fosfato isomerasi La principale funzione della via ossidativa è la produzione di NADPH, perché la produzione di riboso 5-fosfato, che serve per la sintesi dei nucleotidi (DNA e RNA, coenzimi), avviene soprattutto nella via non ossidativa (vedi sotto). Il NADPH è il coenzima ridotto che dona il suo potere riducente (elettroni) nelle biosintesi degli acidi grassi, del colesterolo, dei desossiribonucleotidi e nella reazione di rigenerazione del glutatione ridotto (GSH). Il GSH rappresenta la più importante difesa degli eritrociti (e anche delle altre cellule) nei confronti di stress ossidativi (vedi sotto). Nota bene : mentre il NADH dona i suoi elettroni alla catena respiratoria, con produzione di ATP, il NADPH serve come donatore di elettroni nelle reazioni di riduzione di biomolecole! Regolazione. Il primo enzima della via ossidativa, la glucoso 6-fosfato deidrogenasi, è stimolato da NADP (forma ossidata) e inibito da NADPH (forma ridotta) e da ATP. Inoltre è indotto (aumentata sintesi) dall ormone insulina. Deficit di G6PD. Questo enzima è mutato nella malattia genetica chiamata deficit di G6PD o anemia mediterranea : il difetto a carico dell enzima riguarda particolarmente gli eritrociti, ed è un difetto sia quantitativo (meno enzima del normale) sia qualitativo (enzima meno attivo). Le forme cliniche della malattia possono essere diverse: - anemia emolitica cronica - anemia emolitica da farmaci (crisi emolitica scatenata dall assunzione di farmaci) - favismo (crisi emolitica scatenata dall assunzione di fave o piselli) In alcune zone (delta padano, Sardegna) l incidenza della mutazione è molto elevata. Insieme all eterozigosi per l anemia falciforme, il deficit di G6PD conferisce una parziale resistenza alla malaria: questo spiega la elevata incidenza di queste mutazioni in queste zone, un tempo malariche. Il deficit di G6PD rende gli eritrociti più sensibili allo stress ossidativo, causato da H 2 O 2 o da perossidi organici (che si formano per ossidazione di alcuni farmaci o biomolecole assunte con l alimentazione).
21 H 2 O 2 si forma continuamente negli eritrociti, in piccola quantità, dall ossidazione del Fe 2+ dell emoglobina e contemporanea riduzione dell ossigeno a ione superossido, O 2 -, che combinandosi con H + produce H 2 O 2 Il glutatione ridotto (GSH) è un tripeptide formato da glutammato, cisteina e glicina. Due molecole di GSH possono ossidarsi, formando un ponte disolfuro tra le due cisteine, e contemporaneamente ridurre un perossido, per es. l acqua ossigenata (H 2 O 2 ). Questa reazione è catalizzata dall enzima glutatione perossidasi. Il glutatione ossidato (GSSG) viene a sua volta ridotto di nuovo a 2 molecole di GSH dall enzima glutatione reduttasi, che usa NADPH come donatore di due elettroni e due protoni (cioè due atomi di idrogeno). 2. La parte non ossidativa della via dell esoso monofosfato, anch essa nel citoplasma, consiste nell interconversione di zuccheri fosforilati a 3, 6 e 5 atomi di carbonio, secondo lo schema seguente: C5 + C5 C3 + C7 transchetolasi C7 + C3 C4 + C6 transaldolasi C5 + C4 C3 + C6 transchetolasi Nella prima reazione, l enzima transchetolasi trasferisce una unità bicarboniosa da un pentoso sull altro, formando uno zucchero a 7 atomi di carbonio ed un trioso. Nella seconda reazione, l enzima transaldolasi trasferisce una unità tricarboniosa dallo zucchero a 7 atomi di carbonio sul trioso, formano un esoso ed un tetroso. Nella terza reazione, di nuovo la transchetolasi trasferisce su questo tetroso una unità bicarboniosa, ceduta da una nuova molecola di pentoso, formando un trioso ed un esoso. Quindi, attraverso le reazioni della via non ossidativa (tutte reversibili) 3 pentosi (riboso 5-fosfato) possono essere convertiti in 1 trioso (gliceraldeide 3-fosfato), e 2 esosi (fruttoso 6-fosfato, tutti intermedi della glicolisi!) oppure, viceversa, 1 molecola di gliceraldeide 3-fosfato e 2 di fruttoso 6- fosfato possono essere convertite in 3 molecole di riboso 5-fosfato. Il bilancio dei carboni rimane invariato (15 C totali nei 3 C5 e nei 2 C6 + 1 C3), perché non ci sono reazioni di decarbossilazione. La funzione della via non ossidativa è di permettere la produzione di riboso 5-fosfato (che serve per la sintesi dei nucleotidi) a partire da intermedi della glicolisi, oppure, viceversa, di far entrare nella glicolisi dei pentosi (derivanti dalla parte ossidativa della via oppure dalla demolizione dei nucleotidi). La direzione delle reazioni dipende dalla necessità/disponibilità di pentosi: ad esempio, durante la sintesi del DNA (grande consumo di pentosi), le reazioni sopra indicate procederanno verso sinistra; al contrario, durante la demolizione dei nucleotidi (che produce grandi quantità di
22 riboso fosfato), o quando c è grande necessità di NADPH (e quindi la via ossidativa produce molto riboso 5-fosfato) l equilibrio delle reazioni sarà spostato verso destra: il riboso fosfato verrà trasformato in intermedi della glicolisi e potrà essere utilizzato per produrre energia nella glicolisi o per produrre nuovo glucoso 6-fosfato (con le reazioni della gluconeogenesi). CICLO DI KREBS Il ciclo di Krebs è la via finale comune del catabolismo glucidico (via acetil CoA), proteico (via intermedi del ciclo) e lipidico (via acetil CoA). Per ogni acetil CoA ossidato nel ciclo di Krebs si producono 3 NADH, 1 FADH 2 e 1 GTP: nella fosforilazione ossidativa ogni NADH consente la produzione di 3 ATP e ogni FADH 2 consente la produzione di 2 ATP. Quindi un giro del ciclo di Krebs rende 12 ATP. Infine, si producono anche 3 molecole di CO 2 attraverso altrettante reazioni di decarbossilazione ossidativa: è questa la CO 2 che espiriamo! Il ciclo avviene nei mitocondri: il piruvato prodotto dalla glicolisi (nel citosol) entra nel mitocondrio con un simporto con H +, che sfrutta il gradiente protonico ai due lati della membrana mitocondriale interna per concentrare il piruvato all interno del mitosol. Piruvato + NAD + coenzima A acetil CoA + NADH + H + + CO 2 Piruvato deidrogenasi Acetil CoA + OAA + H 2 O citrato + CoA Citrato sinteasi Citrato isocitrato Aconitasi Isocitrato + NAD α-chetoglutarato + NADH + H + + CO 2 Isocitrato deidrogenasi α-kga + NAD + CoA succinil CoA + NADH + H + + CO 2 α-kga deidrogenasi Succinil CoA + GDP + fosfato succinato + GTP + CoA Succinil CoA sintetasi Succinato + E-FAD fumarato + E-FADH 2 Fumarasi Malato + NAD OAA + NADH + H + Malico deidrogenasi Regolazione. Le deidrogenasi che catalizzano le reazioni di decarbossilazione ossidativa (piruvato deidrogenasi, isocitrato deidrogenasi e a-chetoglutarato deidrogenasi) sono inibite allostericamente da ATP e da NADH (alta carica energetica). Il ciclo di Krebs ha anche una funzione anabolica, oltre che catabolica: alcuni intermedi del ciclo sono utilizzati in vie biosintetiche: OAA glucoso Citrato acidi grassi α-kga e OAA amminoacidi, purine e pirimidine succinil CoA eme Rendimento energetico del ciclo di Krebs. Per ogni giro del ciclo di Krebs si producono 3 NADH, 1 FADH 2 e 1 GTP. I coenzimi ridotti scaricano i loro elettroni sulla catena respiratoria e
23 per ogni NADH si producono 3 ATP, mentre per ogni FADH 2 se ne producono 2. Il GTP vale 1 ATP, perché il suo fosfato terminale può essere trasferito sull ADP per produrre ATP, nella reazione: GTP + ADP GDP + ATP Quindi, per ogni acetil CoA che entra nel ciclo di Krebs si producono 12 ATP.
24 Corpi chetonici. Il ciclo di Krebs gira finchè c è tanto OAA quanto acetil CoA: se la [acetil CoA] è maggiore della [OAA], l acetato in eccesso viene utilizzato nel fegato per la sintesi dei corpi chetonici (acetoacetato, idrossibutirrato e acetone). Questa situazione si verifica nell ipoglicemia intracellulare (causata da digiuno prolungato o da diabete di tipo I). In queste condizioni l OAA viene dirottato verso la gluconeogenesi, stimolata dal glucagone, e contemporaneamente aumenta la produzione di acetil CoA dalla demolizione degli acidi grassi, che viene stimolata dal glucagone per far fronte alla carenza energetica. OSSIDAZIONE DEGLI ACIDI GRASSI I trigliceridi (glicerolo esterificato con 3 acidi carbossilici a lunga catena, detti acidi grassi) sono la principale scorta energetica del nostro organismo depositata nel tessuto adiposo: trigliceridi kcal proteine mobilizzabili kcal glicogeno (fegato) 600 kcal glucoso (sangue) 40 kcal Gli acidi grassi sono idrolizzati (staccati) dal glicerolo tramite idrolasi chiamate lipasi. Questi enzimi sono attivati per fosforilazione da una cinasi (PKA) a sua volta attivata dal glucagone. Gli acidi grassi liberati entrano nel torrente circolatorio. L ossidazione degli acidi grassi avviene nei mitocondri di tutti i tessuti. Una molecola di palmitato (C16, saturo) viene dapprima attivata a palmitoil CoA con dispendio di ATP (2 legami fosforici!): palmitato + coenzima A + ATP palmitoil-coa + AMP + PPi
25 Il palmitoil CoA viene ossidato con una serie di reazioni di ossidazione, idratazione, ossidazione che si ripetono per cicli successivi fino alla completa ossidazione della molecola ad acetil CoA con produzione di 8 molecole di acetil CoA, 7 NADH e 7 FADH 2. Acil CoA + E-FAD trans-enoil CoA + E-FADH 2 Acil CoA deidrogenasi Trans-enoil CoA + H 2 O idrossiacil CoA Idratasi Idrossiacil CoA + NAD 3-chetoacil CoA + NADH + H + Idrossiacil CoA deidrogenasi 3-chetoacil CoA + CoA acil CoA accorciato di 2 C + acetil CoA Tiolasi Il bilancio energetico è di 2 legami fosforici consumati (per l attivazione) e 131 ATP prodotti per ogni palmitato. Ogni acetil CoA rende 12 ATP nel ciclo di Krebs: 8 acetil CoA = 96 ATP Ci vogliono 7 cicli di β-ossidazione per ossidare completamente un palmitato: quindi si produrranno 7 NADH e 7 FADH 2 ; ogni NADH vale 3 ATP e ogni FADH 2 vale 2 ATP nella catena respiratoria. Totale ATP dai coenzimi ridotti = 35 ATP Regolazione. L unico punto di regolazione è l ingresso degli acidi grassi nei mitocondri, mediato dalla carnitina. L enzima che lega l acido grasso alla carnitina, la carnitina acil transferasi, è attivata per fosforilazione da una cinasi, a sua volta attivata dal glucagone: il glucagone stimola il trasporto degli acidi grassi dentro i mitocondri e quindi la loro ossidazione.
GLUCONEOGENESI. Sintesi (GENESI) di nuove (NEO) molecole di glucosio
 GLUCONEOGENESI Sintesi (GENESI) di nuove (NEO) molecole di glucosio CATABOLISMO ANABOLISMO OSSIDAZIONI Produzione di ATP RIDUZIONI Consumo di ATP La GLUCONEOGENESI è un PROCESSO ANABOLICO La gluconeogenesi
GLUCONEOGENESI Sintesi (GENESI) di nuove (NEO) molecole di glucosio CATABOLISMO ANABOLISMO OSSIDAZIONI Produzione di ATP RIDUZIONI Consumo di ATP La GLUCONEOGENESI è un PROCESSO ANABOLICO La gluconeogenesi
Metabolismo: Introduzione
 Metabolismo: Introduzione METABOLISMO Insieme delle reazioni chimiche coordinate e integrate che hanno luogo in tutte le cellule C A T A B O L I S M O Ossidazioni esoergoniche Alimenti: Carboidrati Lipidi
Metabolismo: Introduzione METABOLISMO Insieme delle reazioni chimiche coordinate e integrate che hanno luogo in tutte le cellule C A T A B O L I S M O Ossidazioni esoergoniche Alimenti: Carboidrati Lipidi
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 26 La gluconeogenesi Concetti chiave: Il fegato e il rene possono sintetizzare glucosio da lattato, piruvato e amminoacidi.
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 26 La gluconeogenesi Concetti chiave: Il fegato e il rene possono sintetizzare glucosio da lattato, piruvato e amminoacidi.
GLICOGENOLISI & GLICOGENOSINTESI
 GLICOGENOLISI & GLICOGENOSINTESI ALIMENTARE Glucosio GLUCONEOGENESI GLICOGENOLISI (epatica) Glicemia: 70-90 mg/100ml ~ 5 mm GLICOGENO Nel fegato fino al 6-10% della massa epatica (~100 grammi) Nel muscolo
GLICOGENOLISI & GLICOGENOSINTESI ALIMENTARE Glucosio GLUCONEOGENESI GLICOGENOLISI (epatica) Glicemia: 70-90 mg/100ml ~ 5 mm GLICOGENO Nel fegato fino al 6-10% della massa epatica (~100 grammi) Nel muscolo
GLUCONEOGENESI SINTESI DI NUOVO GLUCOSIO A PARTIRE DA FONTI NON GLUCIDICHE. L UOMO CONSUMA QUASI 160 g DI GLUCOSIO AL GIORNO
 GLUCONEOGENESI SINTESI DI NUOVO GLUCOSIO A PARTIRE DA FONTI NON GLUCIDICHE L UOMO CONSUMA QUASI 160 g DI GLUCOSIO AL GIORNO 75% DI TALE GLUCOSIO E NEL CERVELLO I FLUIDI CORPOREI CONTENGONO SOLO 20 g DI
GLUCONEOGENESI SINTESI DI NUOVO GLUCOSIO A PARTIRE DA FONTI NON GLUCIDICHE L UOMO CONSUMA QUASI 160 g DI GLUCOSIO AL GIORNO 75% DI TALE GLUCOSIO E NEL CERVELLO I FLUIDI CORPOREI CONTENGONO SOLO 20 g DI
Helena Curtis N. Sue Barnes
 Helena Curtis N. Sue Barnes LA RESPIRAZIONE CELLULARE INDICE Demolizione del glucosio Glicolisi Fermentazione lattica Fermentazione alcolica Respirazione cellulare Ciclo di Krebs Catena di trasporto degli
Helena Curtis N. Sue Barnes LA RESPIRAZIONE CELLULARE INDICE Demolizione del glucosio Glicolisi Fermentazione lattica Fermentazione alcolica Respirazione cellulare Ciclo di Krebs Catena di trasporto degli
SISTEMI ENERGETICI. L ATP privato di uno dei suoi 3 radicali fosforici diventa ADP (adenosindifosfato).
 SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
Respirazione cellulare
 Respirazione cellulare L equazione generale della respirazione C 6 H 12 O 6 + 6 O 2! 6 CO 2 + 6 H 2 O + 36 ATP 1 molec zucchero 6 molec ossigeno 6 molec anidride carbonica 6 molec acqua + = + + 36 molecole
Respirazione cellulare L equazione generale della respirazione C 6 H 12 O 6 + 6 O 2! 6 CO 2 + 6 H 2 O + 36 ATP 1 molec zucchero 6 molec ossigeno 6 molec anidride carbonica 6 molec acqua + = + + 36 molecole
Il ciclo dell acido citrico
 Il ciclo dell acido citrico Il catabolismo di proteine, grassi e carboidrati avviene nelle tre fasi della respirazione cellulare Il piruvato viene ossidato ad acetil-coa e CO 2 La decarbossilazione
Il ciclo dell acido citrico Il catabolismo di proteine, grassi e carboidrati avviene nelle tre fasi della respirazione cellulare Il piruvato viene ossidato ad acetil-coa e CO 2 La decarbossilazione
METABOLISMO DEL Glucosio
 METABLISM DEL Glucosio Il metabolismo del glucosio può essere suddiviso nelle seguenti vie metaboliche: Glicolisi ssidazione del glucosio in acido piruvico e acido lattico. Via del pentoso fosfato Via
METABLISM DEL Glucosio Il metabolismo del glucosio può essere suddiviso nelle seguenti vie metaboliche: Glicolisi ssidazione del glucosio in acido piruvico e acido lattico. Via del pentoso fosfato Via
Metabolismo degli aminoacidi
 Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Regolazione del metabolismo del glucosio
 Regolazione del metabolismo del glucosio Regolazione coordinata di glicolisi e gluconeogenesi Glicolisi e gluconeogenesi sono regolate in modo reciproco La regolazione è a livello dei punti di deviazione
Regolazione del metabolismo del glucosio Regolazione coordinata di glicolisi e gluconeogenesi Glicolisi e gluconeogenesi sono regolate in modo reciproco La regolazione è a livello dei punti di deviazione
Da dove prendono energia le cellule animali?
 Da dove prendono energia le cellule animali? La cellula trae energia dai legami chimici contenuti nelle molecole nutritive Probabilmente le più importanti sono gli zuccheri, che le piante sintetizzano
Da dove prendono energia le cellule animali? La cellula trae energia dai legami chimici contenuti nelle molecole nutritive Probabilmente le più importanti sono gli zuccheri, che le piante sintetizzano
ENZIMI CINETICA ENZIMATICA
 ENZIMI PERCHE UNA REAZIONE AVVENGA, SI DEVONO SODDISFARE TRE CONDIZIONI I SUBSTRATI DEVONO ENTRARE IN COLLISIONE LA COLLISIONE DEVE AVVENIRE CON ORIENTAMENTO CORRETTO I REAGENTI DEVONO AVERE ENERGIA SUFFICIENTE
ENZIMI PERCHE UNA REAZIONE AVVENGA, SI DEVONO SODDISFARE TRE CONDIZIONI I SUBSTRATI DEVONO ENTRARE IN COLLISIONE LA COLLISIONE DEVE AVVENIRE CON ORIENTAMENTO CORRETTO I REAGENTI DEVONO AVERE ENERGIA SUFFICIENTE
Il metabolismo del glicogeno e la gluconeogenesi. Copyright 2013 Zanichelli editore S.p.A.
 Il metabolismo del glicogeno e la gluconeogenesi Copyright 2013 Zanichelli editore S.p.A. Capitolo 16 La demolizione del glicogeno Concetti chiave 16.1 Il glicogeno, la forma di immagazzinamento del glucosio,
Il metabolismo del glicogeno e la gluconeogenesi Copyright 2013 Zanichelli editore S.p.A. Capitolo 16 La demolizione del glicogeno Concetti chiave 16.1 Il glicogeno, la forma di immagazzinamento del glucosio,
CONTROLLO ORMONALE DEL METABOLISMO GLUCIDICO DA PARTE DI GLUCAGONE, ADRENALINA E INSULINA
 CONTROLLO ORMONALE DEL METABOLISMO GLUCIDICO DA PARTE DI GLUCAGONE, ADRENALINA E INSULINA QUESTI ORMONI REGOLANO IL FLUSSO DEI METABOLITI NELLA GLICOLISI, NELLA GLICOGENO-SINTESI, NELLA GLIGENO-LISI E
CONTROLLO ORMONALE DEL METABOLISMO GLUCIDICO DA PARTE DI GLUCAGONE, ADRENALINA E INSULINA QUESTI ORMONI REGOLANO IL FLUSSO DEI METABOLITI NELLA GLICOLISI, NELLA GLICOGENO-SINTESI, NELLA GLIGENO-LISI E
Il glicogeno (riserva di glucosio) è immagazzinato nel fegato e nei muscoli (con finalità diverse )
 Glicogeno Glicogeno...1 Glicogenolisi...3 Glicogenosintesi...7 Regolazione ormonale della glicogenolisi e delle glicogenosintesi...13 Il recettore del glucagone e quello dell adrenalina sono 2 GPCR (G-Protein
Glicogeno Glicogeno...1 Glicogenolisi...3 Glicogenosintesi...7 Regolazione ormonale della glicogenolisi e delle glicogenosintesi...13 Il recettore del glucagone e quello dell adrenalina sono 2 GPCR (G-Protein
METABOLISMO DEL GLICOGENO
 METABOLISMO DEL GLICOGENO Struttura del glicogeno DEMOLIZIONE DEL GLICOGENO: GLICOGENOLISI 1) distacco progressivo di unità glucosidiche con formazione di glucosio-1- fosfato: enzima: glicogeno fosforilasi
METABOLISMO DEL GLICOGENO Struttura del glicogeno DEMOLIZIONE DEL GLICOGENO: GLICOGENOLISI 1) distacco progressivo di unità glucosidiche con formazione di glucosio-1- fosfato: enzima: glicogeno fosforilasi
BIOLOGIA GENERALE 22-24 ottobre 2007
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 22-24 ottobre 2007 Facoltà di Psicologia Tecniche di Psicologia Generale e Sperimentale Alessandro Massolo Dip.
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 22-24 ottobre 2007 Facoltà di Psicologia Tecniche di Psicologia Generale e Sperimentale Alessandro Massolo Dip.
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio. GLUCONEOGENESI (sintesi da precursori non glucidici)
 DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) Metabolismo del glucosio La gluconeogenesi epatica è regolata
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) Metabolismo del glucosio La gluconeogenesi epatica è regolata
METABOLISMO E SISTEMI ENERGETICI
 METABOLISMO E SISTEMI ENERGETICI 1 Obiettivi della lezione 1) Capire come l organismo converta il cibo che ingeriamo in ATP per fornire ai muscoli l energia che essi necessitano per contrarsi. 2) Esaminare
METABOLISMO E SISTEMI ENERGETICI 1 Obiettivi della lezione 1) Capire come l organismo converta il cibo che ingeriamo in ATP per fornire ai muscoli l energia che essi necessitano per contrarsi. 2) Esaminare
N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi
 Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
glicogeno Glucosio 6-P Piruvato Acetil CoA Intermedi del ciclo di Krebs
 PIRUVAT glicogeno Glicogeno sintesi glicogenolisi Glucosio Glucosio 6-P Ribosio 5-P glicolisi Gluconeogenesi Amino acidi Piruvato Acetil CoA lattato Intermedi del ciclo di Krebs Concentrazione di glicogeno
PIRUVAT glicogeno Glicogeno sintesi glicogenolisi Glucosio Glucosio 6-P Ribosio 5-P glicolisi Gluconeogenesi Amino acidi Piruvato Acetil CoA lattato Intermedi del ciclo di Krebs Concentrazione di glicogeno
Metabolismo degli amminoacidi. Ciclo dell urea
 Metabolismo degli amminoacidi Ciclo dell urea Biosintesi di amminoacidiporfirine, creatina, carnitina, ormoni, nucleotidi Gli amminoacidi possono subire una degradazione ossidativa in 3 diverse situazioni
Metabolismo degli amminoacidi Ciclo dell urea Biosintesi di amminoacidiporfirine, creatina, carnitina, ormoni, nucleotidi Gli amminoacidi possono subire una degradazione ossidativa in 3 diverse situazioni
Esempio di domande possibili alla prova orale di Biochimica Generale ed Applicata AA 2009-10 Farmacia - FERIOTTO
 Esempio di domande possibili alla prova orale di Biochimica Generale ed Applicata AA 2009-10 Farmacia - FERIOTTO Lo studente spieghi: - Geometria dei legami del carbonio. - Principali gruppi funzionali
Esempio di domande possibili alla prova orale di Biochimica Generale ed Applicata AA 2009-10 Farmacia - FERIOTTO Lo studente spieghi: - Geometria dei legami del carbonio. - Principali gruppi funzionali
FUNZIONI DEI MITOCONDRI
 FUNZIONI DEI MITOCONDRI La funzione principale dei mitocondri è di compiere le trasformazioni energetiche indispensabili per le funzioni cellulari. Metabolismo energetico: insieme delle reazioni chimiche
FUNZIONI DEI MITOCONDRI La funzione principale dei mitocondri è di compiere le trasformazioni energetiche indispensabili per le funzioni cellulari. Metabolismo energetico: insieme delle reazioni chimiche
Esempio di domande possibili alla prova orale di Biochimica AA 2011-12 Farmacia1 - FERIOTTO
 Esempio di domande possibili alla prova orale di Biochimica AA 2011-12 Farmacia1 - FERIOTTO Lo studente spieghi: - Geometria dei legami del carbonio. - Principali gruppi funzionali delle biomolecole. -
Esempio di domande possibili alla prova orale di Biochimica AA 2011-12 Farmacia1 - FERIOTTO Lo studente spieghi: - Geometria dei legami del carbonio. - Principali gruppi funzionali delle biomolecole. -
- CINETICA ENZIMATICA
 - CINETICA ENZIMATICA ENZIMI: - CATALIZZATORI aumenta la V di una reazione chimica senza subire trasformazioni durante l intero processo - PROTEINE gli enzimi sono proteine di struttura 3 o talora 4 -
- CINETICA ENZIMATICA ENZIMI: - CATALIZZATORI aumenta la V di una reazione chimica senza subire trasformazioni durante l intero processo - PROTEINE gli enzimi sono proteine di struttura 3 o talora 4 -
Βeta ossidazione degli acidi grassi BETA OSSIDAZIONE DEGLI ACIDI GRASSI 13/12/2013 SEMINARIO. Acidi grassi (2)
 Acidi grassi (1) Mitocondri SEMINARIO BETA OSSIDAZIONE DEGLI ACIDI GRASSI Sono le principali fonti di energia per alcuni tessuti (es. muscolo cardiaco). Si genera molto più energia dall ossidazione degli
Acidi grassi (1) Mitocondri SEMINARIO BETA OSSIDAZIONE DEGLI ACIDI GRASSI Sono le principali fonti di energia per alcuni tessuti (es. muscolo cardiaco). Si genera molto più energia dall ossidazione degli
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA
 PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
Nota dell editore Presentazione
 00PrPag 3-08-2007 11:42 Pagina V Autori Nota dell editore Presentazione XI XIII XV Parte I Chimica 1 Struttura dell atomo 3 Teorie atomiche 3 Costituenti dell atomo 4 Numeri quantici 5 Tipi di orbitali
00PrPag 3-08-2007 11:42 Pagina V Autori Nota dell editore Presentazione XI XIII XV Parte I Chimica 1 Struttura dell atomo 3 Teorie atomiche 3 Costituenti dell atomo 4 Numeri quantici 5 Tipi di orbitali
Si possono suddividere in:
 Si possono suddividere in: LIPIDI DI DEPOSITO: si accumulano nelle cellule del tessuto adiposo, sono una riserva energetica, mantengono costante la temperatura del corpo (termogenesi) LIPIDI STRUTTURALI:
Si possono suddividere in: LIPIDI DI DEPOSITO: si accumulano nelle cellule del tessuto adiposo, sono una riserva energetica, mantengono costante la temperatura del corpo (termogenesi) LIPIDI STRUTTURALI:
dieta vengono convertiti in composti dei corpi chetonici.
 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
 forme diabetiche Diabete di tipo I o magro o giovanile (IDDM): carenza primaria di insulina, più frequente nei giovani e nei bambini. Il deficit insulinico consegue (per predisposizione ereditaria o per
forme diabetiche Diabete di tipo I o magro o giovanile (IDDM): carenza primaria di insulina, più frequente nei giovani e nei bambini. Il deficit insulinico consegue (per predisposizione ereditaria o per
Niccolò Taddei Biochimica
 Niccolò Taddei Biochimica VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni sono
Niccolò Taddei Biochimica VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni sono
Attenzione : lunedì 29 aprile NON ci sarà lezione
 Attenzione : lunedì 29 aprile NON ci sarà lezione Metabolismo dei lipidi a) Ossidazione degli acidi grassi Triacilgliceroli (90% del totale) Gruppi metilenici o metilici Richiedono molto O 2 per essere
Attenzione : lunedì 29 aprile NON ci sarà lezione Metabolismo dei lipidi a) Ossidazione degli acidi grassi Triacilgliceroli (90% del totale) Gruppi metilenici o metilici Richiedono molto O 2 per essere
Fosforilazione ossidativa
 Fosforilazione ossidativa La fosforilazione ossidativa rappresenta il culmine del metabolismo energetico negli organismi aerobi E costituita da due fenomeni strettamente accoppiati: 1. I coenzimi ridotti
Fosforilazione ossidativa La fosforilazione ossidativa rappresenta il culmine del metabolismo energetico negli organismi aerobi E costituita da due fenomeni strettamente accoppiati: 1. I coenzimi ridotti
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi Gli amminoacidi derivati in gran parte dalla degradazione delle proteine della dieta o intracellulari possono essere ossidati per generare e energia. La quantità di energia
Metabolismo degli amminoacidi Gli amminoacidi derivati in gran parte dalla degradazione delle proteine della dieta o intracellulari possono essere ossidati per generare e energia. La quantità di energia
Valitutti, Taddei, Kreuzer, Massey, Sadava, Hills, Heller, Berenbaum
 Dal carbonio agli OGM VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni sono evidenziate
Dal carbonio agli OGM VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni sono evidenziate
Il ciclo nutrizione / digiuno
 Il ciclo nutrizione / digiuno Aspetti generali La fase di assorbimento è il periodo che va dalle 2 alle 4 ore successive all assunzione di un pasto. Durante questo intervallo si verifica un transitorio
Il ciclo nutrizione / digiuno Aspetti generali La fase di assorbimento è il periodo che va dalle 2 alle 4 ore successive all assunzione di un pasto. Durante questo intervallo si verifica un transitorio
http://sds.coniliguria.it 1
 Aspetti metabolici dell esercizio fisico Genova 22 gennaio 2011 A cura di Attilio TRAVERSO http://sds.coniliguria.it 1 L allenamento produce modificazioni fisiologiche (adattamenti) in quasi tutti i sistemi
Aspetti metabolici dell esercizio fisico Genova 22 gennaio 2011 A cura di Attilio TRAVERSO http://sds.coniliguria.it 1 L allenamento produce modificazioni fisiologiche (adattamenti) in quasi tutti i sistemi
Domande relative alla specializzazione in: Biochimica clinica
 Domande relative alla specializzazione in: Biochimica clinica Domanda #1 (codice domanda: n.403) : Nell'ibridazione fluorescente in situ (Fluorescent in situ hybridization "FISH"), che tipo di sonde fluorescenti
Domande relative alla specializzazione in: Biochimica clinica Domanda #1 (codice domanda: n.403) : Nell'ibridazione fluorescente in situ (Fluorescent in situ hybridization "FISH"), che tipo di sonde fluorescenti
Giovanni Di Bonaventura, Ph.D., B.Sc. Università di Chieti-Pescara
 Giovanni Di Bonaventura, Ph.D., B.Sc. Università di Chieti-Pescara Richieste metaboliche: elementi essenziali In generale, i batteri per la loro crescita hanno bisogno di elementi essenziali. In particolare
Giovanni Di Bonaventura, Ph.D., B.Sc. Università di Chieti-Pescara Richieste metaboliche: elementi essenziali In generale, i batteri per la loro crescita hanno bisogno di elementi essenziali. In particolare
Le Biomolecole I parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
scaricato da www.sunhope.it
 Recettori a tirosina chinasi I recettori a tirosina chinasi presentano vari domini Una regione di legame (extracellulare) Una regione transmembrana Una coda intracellulare con numerose tirosine scaricato
Recettori a tirosina chinasi I recettori a tirosina chinasi presentano vari domini Una regione di legame (extracellulare) Una regione transmembrana Una coda intracellulare con numerose tirosine scaricato
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
LIPIDI e METABOLISMO DEGLI ACIDI GRASSI
 LIPIDI e METABOLISMO DEGLI ACIDI GRASSI Lipidi I lipidi sono i principali costituenti delle membrane biologiche. Sono biomolecole insolubile in acqua ma solubili in solventi organici. La loro idrofobicità
LIPIDI e METABOLISMO DEGLI ACIDI GRASSI Lipidi I lipidi sono i principali costituenti delle membrane biologiche. Sono biomolecole insolubile in acqua ma solubili in solventi organici. La loro idrofobicità
Mediatore chimico. Recettore. Trasduzione del segnale. Risposta della cellula
 Mediatore chimico Recettore Trasduzione del segnale Risposta della cellula I mediatori chimici sono prodotti da cellule specializzate e sono diffusi nell organismo da apparati di distribuzione Sistemi
Mediatore chimico Recettore Trasduzione del segnale Risposta della cellula I mediatori chimici sono prodotti da cellule specializzate e sono diffusi nell organismo da apparati di distribuzione Sistemi
unità C2. Le trasformazioni energetiche nelle cellule
 unità 2. Le trasformazioni energetiche nelle cellule Il trasporto nelle cellule avviene senza consumo di energia con consumo di energia trasporto passivo trasporto attivo attraverso il doppio strato fosfolipidico
unità 2. Le trasformazioni energetiche nelle cellule Il trasporto nelle cellule avviene senza consumo di energia con consumo di energia trasporto passivo trasporto attivo attraverso il doppio strato fosfolipidico
CELLULE EUCARIOTICHE
 CELLULE EUCARIOTICHE Le cellule eucariotiche sono di maggiori dimensioni, rispetto a quelle procariotiche (almeno 10 volte più grandi) Oltre a: membrana plasmatica, citoplasma, DNA e ribosomi (comuni a
CELLULE EUCARIOTICHE Le cellule eucariotiche sono di maggiori dimensioni, rispetto a quelle procariotiche (almeno 10 volte più grandi) Oltre a: membrana plasmatica, citoplasma, DNA e ribosomi (comuni a
Metabolismo dei composti azotati: aminoacidi e nucleotidi
 Metabolismo dei composti azotati: aminoacidi e nucleotidi Metabolismo degli aminoacidi I composti azotati L azoto contenuto nella cellula è presente soprattutto negli AMINOACIDI delle proteine e nelle
Metabolismo dei composti azotati: aminoacidi e nucleotidi Metabolismo degli aminoacidi I composti azotati L azoto contenuto nella cellula è presente soprattutto negli AMINOACIDI delle proteine e nelle
Ogni globina ha una tasca in cui lega un gruppo EME, quindi l Hb può legare e trasportare 4 molecole di O 2
 Emoglobina (Hb): tetramero (le globine si associano formando due copie di dimeri αβ (α 1 β 1 e α 2 β 2 ) che si associano a formare un tetramero attraverso interazioni idrofobiche, legami H e ponti salini
Emoglobina (Hb): tetramero (le globine si associano formando due copie di dimeri αβ (α 1 β 1 e α 2 β 2 ) che si associano a formare un tetramero attraverso interazioni idrofobiche, legami H e ponti salini
Mais, riso, patate, granozucchero di canna o barbabietola Latte da zucchero Polisaccaride Amido - - Disaccaride Maltosio Saccarosio Lattosio
 Abbiamo visto che i carboidrati sono la principale fonte di energia nell'alimentazione umana. Nella nostra dieta, sono sopratutto presenti nella forma di amido, ma anche il saccarosio è presente in una
Abbiamo visto che i carboidrati sono la principale fonte di energia nell'alimentazione umana. Nella nostra dieta, sono sopratutto presenti nella forma di amido, ma anche il saccarosio è presente in una
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici
 I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
METABOLISMO DEI LIPIDI
 METABOLISMO DEI LIPIDI Generalità I lipidi alimentari, per poter essere assorbiti dall organismo umano, devono essere preventivamente digeriti (ad eccezione del colesterolo), cioè, trasformati in molecole
METABOLISMO DEI LIPIDI Generalità I lipidi alimentari, per poter essere assorbiti dall organismo umano, devono essere preventivamente digeriti (ad eccezione del colesterolo), cioè, trasformati in molecole
SINTESI PROTEICA. Replicazione. Trascrizione. Traduzione
 Replicazione SINTESI PROTEICA Trascrizione Traduzione 61 codoni codificanti 3 triplette non senso (STOP) AUG codone di inizio codone per Met Caratteristiche del codice genetico Specificità Il codice genetico
Replicazione SINTESI PROTEICA Trascrizione Traduzione 61 codoni codificanti 3 triplette non senso (STOP) AUG codone di inizio codone per Met Caratteristiche del codice genetico Specificità Il codice genetico
Degradazione delle proteine della dieta. Catabolismo degli aminoacidi
 Degradazione delle proteine della dieta Catabolismo degli aminoacidi LE PROTEINE DELLA DIETA SONO DEGRADATE ENZIMATICAMENTE AD AMINOACIDI LIBERI L ingresso di una proteina nello stomaco stimola la mucosa
Degradazione delle proteine della dieta Catabolismo degli aminoacidi LE PROTEINE DELLA DIETA SONO DEGRADATE ENZIMATICAMENTE AD AMINOACIDI LIBERI L ingresso di una proteina nello stomaco stimola la mucosa
EMOGLOBINA ... www.pianetachimica.it
 EMGLBIA www.pianetachimica.it L'emoglobina è una proteina specializzata nel trasporto di ossigeno, si trova all interno dei globuli rossi del sangue ai quali conferisce il caratteristico colore rosso intenso.
EMGLBIA www.pianetachimica.it L'emoglobina è una proteina specializzata nel trasporto di ossigeno, si trova all interno dei globuli rossi del sangue ai quali conferisce il caratteristico colore rosso intenso.
GLICOLISI e CATABOLISMO degli ESOSI
 GLICOLISI e CATABOLISMO degli ESOSI 1 ph= 7.0 2 Digestione dei polisaccaridi Amilasi salivare e pancreatica = endoglucosidasi 3 Digestione degli oligosaccaridi maltosio, maltotriosio, destrine, Saccarosio,
GLICOLISI e CATABOLISMO degli ESOSI 1 ph= 7.0 2 Digestione dei polisaccaridi Amilasi salivare e pancreatica = endoglucosidasi 3 Digestione degli oligosaccaridi maltosio, maltotriosio, destrine, Saccarosio,
di glucosio da parte di tutte le cellule, facilitandone il trasporto transmembranario 2. aumenta l utilizzazione
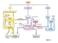 non c Ormone ipoglicemizzante, causa un forte abbassamento della glicemia (70-100 mg/100 ml) perché esalta i processi responsabili della sottrazione di glucosio dal sangue e inibisce i processi responsabili
non c Ormone ipoglicemizzante, causa un forte abbassamento della glicemia (70-100 mg/100 ml) perché esalta i processi responsabili della sottrazione di glucosio dal sangue e inibisce i processi responsabili
Gli enzimi. L azione degli enzimi è caratterizzata da alcune proprietà fondamentali:
 Gli enzimi Nel metabolismo energetico le cellule producono notevoli quantità di CO 2 che deve essere eliminata con l apparato respiratorio. Il trasferimento della CO 2 dalle cellule al sangue e da esso
Gli enzimi Nel metabolismo energetico le cellule producono notevoli quantità di CO 2 che deve essere eliminata con l apparato respiratorio. Il trasferimento della CO 2 dalle cellule al sangue e da esso
Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido
 Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido extracellulare e dalla loro regolazione. Membrana cellulare Ogni cellula presenta
Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido extracellulare e dalla loro regolazione. Membrana cellulare Ogni cellula presenta
Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica.
 Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
GLUCOSIO GLUCOSIO-6-FOSFATO ISOMERASI FRUTTOSIO-6-FOSFATO ATP FRUTTOSIO-1,6-DIFOSFATO ALDOLASI ISOMERASI
 GLUCOSIO ESOCHINASI (costitutivo) inibizione feed-back GLUCOCHINASI (induttivo) GLUCOSIO-6-FOSFATO ISOMERASI - 2 FRUTTOSIO-6-FOSFATO FOSFOFRUTTOCINASI allosterico reg +: e Fr-2,6-dP reg -:, citrato FRUTTOSIO-1,6-DIFOSFATO
GLUCOSIO ESOCHINASI (costitutivo) inibizione feed-back GLUCOCHINASI (induttivo) GLUCOSIO-6-FOSFATO ISOMERASI - 2 FRUTTOSIO-6-FOSFATO FOSFOFRUTTOCINASI allosterico reg +: e Fr-2,6-dP reg -:, citrato FRUTTOSIO-1,6-DIFOSFATO
Lezione di oggi (Lunedì 19 Novembre)
 Lezione di oggi (Lunedì 19 Novembre) ADATTAMENTI METABOLICI INDOTTI DALL ALLENAMENTO Obiettivi della lezione Scoprire come l allenamento possa ottimizzare il rendimento dei sistemi energetici e sviluppare
Lezione di oggi (Lunedì 19 Novembre) ADATTAMENTI METABOLICI INDOTTI DALL ALLENAMENTO Obiettivi della lezione Scoprire come l allenamento possa ottimizzare il rendimento dei sistemi energetici e sviluppare
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI PROTEINE. sono ACIDI NUCLEICI. molecole complesse = POLIMERI. formate dall'unione di
 LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
TIAMINA (vitamina B1, aneurina)
 TIAMINA (vitamina B1, aneurina) Fonti alimentari: cereali integrali (germe e crusca), carne (maiale), lievito di birra, legumi Abbondanza nell organismo umano : 30-100 mg RDA (assunzione giornaliera di
TIAMINA (vitamina B1, aneurina) Fonti alimentari: cereali integrali (germe e crusca), carne (maiale), lievito di birra, legumi Abbondanza nell organismo umano : 30-100 mg RDA (assunzione giornaliera di
Macromolecole Biologiche. I domini (III)
 I domini (III) Domini α/β La cross over connection è l unità costitutiva su cui si basa la topologia di 3 tipi di domini α/β osservati nelle proteine: - α/β barrel - motivi ricchi di Leu (fold a ferro
I domini (III) Domini α/β La cross over connection è l unità costitutiva su cui si basa la topologia di 3 tipi di domini α/β osservati nelle proteine: - α/β barrel - motivi ricchi di Leu (fold a ferro
Ruolo metabolico delle flavine
 Ruolo metabolico delle flavine Deidrogenasi flaviniche che trasferiscono 2 elettroni Acil CoA deidrogenasi (beta ossidazione acidi grassi) Diidrolipoildeidrogenasi (complessi piruvato dh etc.) Glutatione
Ruolo metabolico delle flavine Deidrogenasi flaviniche che trasferiscono 2 elettroni Acil CoA deidrogenasi (beta ossidazione acidi grassi) Diidrolipoildeidrogenasi (complessi piruvato dh etc.) Glutatione
Biologia Molecolare della Cellula 08 7: Regolazione ormonale del metabolismo del glicogeno e della glicolisi Desensitizzazione
 Biologia Molecolare della Cellula 08 7: Regolazione ormonale del metabolismo del glicogeno e della glicolisi Desensitizzazione camp Proteina-CHINASI camp DIPENDENTE (PKA) Proteine target : ε metabolici
Biologia Molecolare della Cellula 08 7: Regolazione ormonale del metabolismo del glicogeno e della glicolisi Desensitizzazione camp Proteina-CHINASI camp DIPENDENTE (PKA) Proteine target : ε metabolici
-uno o più IONI INORGANICI
 Coenzimi e vitamine Alcuni enzimi, per svolgere la loro funzione, hanno bisogno di componenti chimici addizionali, i COFATTORI APOENZIMA + COFATTORE = OLOENZIMA = enzima cataliticamente attivo Il cofattore
Coenzimi e vitamine Alcuni enzimi, per svolgere la loro funzione, hanno bisogno di componenti chimici addizionali, i COFATTORI APOENZIMA + COFATTORE = OLOENZIMA = enzima cataliticamente attivo Il cofattore
Gli enzimi sono catalizzatori nelle reazioni dei sistemi biologici Essi non sono gli unici catalizzatori biologici, esistono infatti:
 Cinetica enzimatica Gli enzimi sono catalizzatori nelle reazioni dei sistemi biologici Essi non sono gli unici catalizzatori biologici, esistono infatti: ribozimi e abzimi Quasi tutti gli enzimi sono proteine
Cinetica enzimatica Gli enzimi sono catalizzatori nelle reazioni dei sistemi biologici Essi non sono gli unici catalizzatori biologici, esistono infatti: ribozimi e abzimi Quasi tutti gli enzimi sono proteine
Bioenergetica e fisiologia dell esercizio 8. Risposte all allenamento: adattamenti biochimici e effetti sulla resistenza
 Bioenergetica e fisiologia dell esercizio 8. Risposte all allenamento: adattamenti biochimici e effetti sulla resistenza Prof. Carlo Capelli, Fisiologia Generale e dell Esercizio, Facoltà di Scienze Motorie,
Bioenergetica e fisiologia dell esercizio 8. Risposte all allenamento: adattamenti biochimici e effetti sulla resistenza Prof. Carlo Capelli, Fisiologia Generale e dell Esercizio, Facoltà di Scienze Motorie,
PROTEINE. sono COMPOSTI ORGANICI QUATERNARI
 PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
SOLUZIONI DEGLI ESERCIZI
 Niccolò Taddei - Biochimica Capitolo 9 METABOLISMO TERMINALE E PRODUZIONE DI ENERGIA 1 Il ciclo dell acido citrico è definito anche ciclo di Krebs, dal nome di uno dei suoi scopritori, o ciclo degli acidi
Niccolò Taddei - Biochimica Capitolo 9 METABOLISMO TERMINALE E PRODUZIONE DI ENERGIA 1 Il ciclo dell acido citrico è definito anche ciclo di Krebs, dal nome di uno dei suoi scopritori, o ciclo degli acidi
CORRENTE E TENSIONE ELETTRICA LA CORRENTE ELETTRICA
 CORRENTE E TENSIONE ELETTRICA La conoscenza delle grandezze elettriche fondamentali (corrente e tensione) è indispensabile per definire lo stato di un circuito elettrico. LA CORRENTE ELETTRICA DEFINIZIONE:
CORRENTE E TENSIONE ELETTRICA La conoscenza delle grandezze elettriche fondamentali (corrente e tensione) è indispensabile per definire lo stato di un circuito elettrico. LA CORRENTE ELETTRICA DEFINIZIONE:
digestione dei lipidi alimentari duodeno digiuno sali biliari fosfolipidi bile specifiche idrolasi pancreatiche colecistochinina
 La digestione dei lipidi alimentari, in prevalenza trigliceridi, avviene nel duodeno e nel digiuno per azione combinata dei sali biliari e dei fosfolipidi della bile e delle specifiche idrolasi pancreatiche
La digestione dei lipidi alimentari, in prevalenza trigliceridi, avviene nel duodeno e nel digiuno per azione combinata dei sali biliari e dei fosfolipidi della bile e delle specifiche idrolasi pancreatiche
ESERCITAZIONI DI BIOCHIMICA
 ESERCITAZIONI DI BIOCHIMICA La denaturazione delle proteine riguarda la struttura terziaria. La proteina attiva di solito è in forma globulare. La sequenza amminoacidica è responsabile dell assetto tridimensionale
ESERCITAZIONI DI BIOCHIMICA La denaturazione delle proteine riguarda la struttura terziaria. La proteina attiva di solito è in forma globulare. La sequenza amminoacidica è responsabile dell assetto tridimensionale
Prof. Maria Nicola GADALETA DISPENSA N. 19
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Farmaci del sistema nervoso autonomo
 Farmaci del sistema nervoso autonomo Farmaci colinergici Esercitano i loro effetti farmacologici sul sistema nervoso parasimpatico che utilizza Acetilcolina come mediatore chimico L acetilcolina (Ach)
Farmaci del sistema nervoso autonomo Farmaci colinergici Esercitano i loro effetti farmacologici sul sistema nervoso parasimpatico che utilizza Acetilcolina come mediatore chimico L acetilcolina (Ach)
ALIMENTAZIONE NELL UOMO
 ALIMENTAZIONE NELL UOMO Alimentazione e Nutrizione Corpo umano come macchina chimica che utilizza l energia chimica degli alimenti (quando si spezzano i legami chimici tra gli atomi che formano le macromolecole
ALIMENTAZIONE NELL UOMO Alimentazione e Nutrizione Corpo umano come macchina chimica che utilizza l energia chimica degli alimenti (quando si spezzano i legami chimici tra gli atomi che formano le macromolecole
Metabolismo degli Ammino Acidi
 Metabolismo degli Ammino Acidi (La proteina stimola la secrezione della gastrina che stimola la secrezione di l e pepsinogeno) R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi)
Metabolismo degli Ammino Acidi (La proteina stimola la secrezione della gastrina che stimola la secrezione di l e pepsinogeno) R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi)
CATENA RESPIRATORIA (CR) FOSFORILAZIONE OSSIDATIVA (FO) scaricato da www.sunhope.it
 CATENA RESPIRATORIA (CR) FOSFORILAZIONE OSSIDATIVA (FO) - Decarb. ossid. piruvato - β-ossidazione acidi grassi - Vie ossidative aa - Ciclo di Krebs avvengono tutte nella matrice mitocondriale In tutte
CATENA RESPIRATORIA (CR) FOSFORILAZIONE OSSIDATIVA (FO) - Decarb. ossid. piruvato - β-ossidazione acidi grassi - Vie ossidative aa - Ciclo di Krebs avvengono tutte nella matrice mitocondriale In tutte
Biosintesi non ribosomiale di metaboliti peptidici bioattivi
 Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
ogni anno 200 miliardi di tonnellate di CO 2 vengono convertite in biomassa
 ogni anno 200 miliardi di tonnellate di CO 2 vengono convertite in biomassa La maggior parte di questo carbonio viene incorporato in composti organici attraverso le reazioni di riduzione del carbonio associate
ogni anno 200 miliardi di tonnellate di CO 2 vengono convertite in biomassa La maggior parte di questo carbonio viene incorporato in composti organici attraverso le reazioni di riduzione del carbonio associate
dotto di Wirsung che si riversa nella papilla maggiore del duodeno;
 Metabolismo dei lipidi Abbiamo già visto che il metabolismo energetico con produzione di ATP, avviene in seguito alla demolizione di zuccheri (glicolisi), lipidi, e in piccolissima percentuale delle proteine.
Metabolismo dei lipidi Abbiamo già visto che il metabolismo energetico con produzione di ATP, avviene in seguito alla demolizione di zuccheri (glicolisi), lipidi, e in piccolissima percentuale delle proteine.
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 24
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 24 Una panoramica del metabolismo Concetti chiave: Organismi diversi utilizzano strategie differenti per catturare l'energia
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 24 Una panoramica del metabolismo Concetti chiave: Organismi diversi utilizzano strategie differenti per catturare l'energia
Catena di Trasporto degli elettroni
 Chimica Biologica A.A. 2010-2011 Catena di Trasporto degli elettroni Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Respirazione - il catabolismo di tutti i combustibili
Chimica Biologica A.A. 2010-2011 Catena di Trasporto degli elettroni Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Respirazione - il catabolismo di tutti i combustibili
I RECETTORI ACCOPPIATI A PROTEINE G
 I RECETTORI ACCOPPIATI A PROTEINE G I recettori accoppiati a proteine G sono costituiti da un unica subunità formata da un filamento di aminoacidi che attraversa 7 volte la membrana plasmatica Il sito
I RECETTORI ACCOPPIATI A PROTEINE G I recettori accoppiati a proteine G sono costituiti da un unica subunità formata da un filamento di aminoacidi che attraversa 7 volte la membrana plasmatica Il sito
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I I TRASPORTI ATTRAVERSO MEMBRANE BIOLOGICHE Movimenti di piccoli soluti attraverso le membrane 2 categorie generali Trasporto
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I I TRASPORTI ATTRAVERSO MEMBRANE BIOLOGICHE Movimenti di piccoli soluti attraverso le membrane 2 categorie generali Trasporto
4) PROTEINE FERRO ZOLFO. Contengono Fe e S in quantità equimolecolari; fanno parte dei complessi respiratori. La NADH DH contiene diversi centri Fe-S.
 4) PROTEINE FERRO ZOLFO Contengono Fe e S in quantità equimolecolari; fanno parte dei complessi respiratori. La NADH DH contiene diversi centri Fe-S. Trasportano elettroni attraverso le transizioni Fe
4) PROTEINE FERRO ZOLFO Contengono Fe e S in quantità equimolecolari; fanno parte dei complessi respiratori. La NADH DH contiene diversi centri Fe-S. Trasportano elettroni attraverso le transizioni Fe
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B
 Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Biosintesi dei triacilgliceroli
 Biosintesi dei triacilgliceroli Destino della maggior parte degli acidi grassi sintetizzati o ingeriti: Ø triacilgliceroli (riserva) Ø fosfolipidi (membrane) in base alle necessità metaboliche I triacilgliceroli
Biosintesi dei triacilgliceroli Destino della maggior parte degli acidi grassi sintetizzati o ingeriti: Ø triacilgliceroli (riserva) Ø fosfolipidi (membrane) in base alle necessità metaboliche I triacilgliceroli
Il Metabolismo Energetico 1. Bilancio Quantitativo tra Apporto di Energia e Dispendio Energetico
 Il Metabolismo Energetico 1. Bilancio Quantitativo tra Apporto di Energia e Dispendio Energetico Prof. Carlo Capelli Fisiologia Facoltà di Scienze Motorie, Università degli Studi Verona Obiettivi Energia
Il Metabolismo Energetico 1. Bilancio Quantitativo tra Apporto di Energia e Dispendio Energetico Prof. Carlo Capelli Fisiologia Facoltà di Scienze Motorie, Università degli Studi Verona Obiettivi Energia
Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas
 1 Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas Capitolo 7 Enzimi, le macchine della vita Piccole macchine regolano la funzione del corpo umano in un orchestrazione perfetta e a velocità
1 Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas Capitolo 7 Enzimi, le macchine della vita Piccole macchine regolano la funzione del corpo umano in un orchestrazione perfetta e a velocità
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
BIOLOGIA GENERALE. Alessandro Massolo Dip. Biologia Animale e Genetica c/o Prof. F. Dessì-Fulgheri (Via Romana 17) massolo@unifi.
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
METABOLISMO DEL GLICOGENO
 METABOLISMO DEL GLICOGENO 1 2 DESTINI DEL GLUCOSIO 6-FOSFATO 3 RAPPRESENTAZIONE SCHEMATICA DEL METABOLISMO DEL GLUCOSIO 4 Glucosio-6-fosfatasi Omeostasi del glicogeno Nell'organismo animale, il glicogeno
METABOLISMO DEL GLICOGENO 1 2 DESTINI DEL GLUCOSIO 6-FOSFATO 3 RAPPRESENTAZIONE SCHEMATICA DEL METABOLISMO DEL GLUCOSIO 4 Glucosio-6-fosfatasi Omeostasi del glicogeno Nell'organismo animale, il glicogeno
