Struttura atomica, configurazione elettronica e periodicità chimica
|
|
|
- Demetrio Landi
- 5 anni fa
- Visualizzazioni
Transcript
1 Struttura atomica, configurazione elettronica e periodicità chimica
2 Dualismo onda-particella (V. de Broglie) Principio di indeterminazione (W. Heisenberg)
3 Equazione di Shrodinger(1925) Modello quantomeccanico dell atomo di idrogeno Il modello descrive un atomo che ha determinate quantità permesse di energia in virtù del moto ondulatorio permesso di un elettrone di cui non è possibile conoscere esattamente la posizione.
4 La funzione d onda (Ψ) (orbitale atomico) Ogni soluzione dell equazione, cioè ogni stato energetico dell atomo, è associata ad una specifica funzione d onda Ψ (orbitale atomico.) La funzione d onda Ψ (psi) è una funzione matematica, priva di significato fisico, del moto dell elettrone (materia-onda) in termini di tempo e di posizione.
5 Erwin Schrödinger, basandosi proprio sulla natura ondulatoria dell elettrone, formulo'una teoria nota comemeccanica Ondulatoriache permetteva di descrivere matematicamente le proprietà ondulatorie di particelle microscopicheed in particolare dell'elettrone. Schrödinger dimostro' che, nel caso di particelle vincolate, cioè soggette a forze come gli elettroni in un atomo costretti ad orbitare intorno ad un nucleo, l equazione ammetteva soluzioni solo nel caso in cui l'energia delle particelle assumeva dei valori ben precisi. Fu Schrödinger ad introdurre quello che fu poi considerato il principale concetto della Teoria Quantistica, ossia il concetto di funzione d onda Ψ di una particella che sostituì quello di traiettoria precisa. La funzione d'onda consisteva in una funzione matematica contenente tutte le informazioni riguardanti l'evoluzione nello spazio e nel tempo di un'onda-particella quantistica entro un campo di forza conservativo. Il nome funzione d'onda derivo' dal fatto cheunatalefunzioneeraingradodidescriveil comportamento di un corpuscolo materiale considerato pero' come un'onda.
6 Densità di probabilità elettronica (nuvola elettronica) Alquadratodellafunzioned ondaψ 2 (psi)siattribuisceinvece significato fisico ed esprime la probabilità che l elettrone (materia-onda) si trovi in una determinata porzione di volume all interno dell atomo. Per un dato livello energetico, si rappresentaψ 2 con un diagramma della densità di probabilità elettronica (densità elettronica) nota anche come rappresentazione della nuvola elettronica.
7 Ogni orbitale atomico ha una caratteristicadistribuzionedi probabilità radiale ed una superficie di contorno a probabilità costante. Nel caso dell onda associata all elettrone nell atomo, sebbene Ψ non abbia significato fisico, il suo quadrato Ψ 2 rappresenta la probabilità di trovare l elettrone in una determinata posizione.
8 Numeri quantici Un orbitale atomico, i.e. la sua distribuzione di probabilità radiale, è individuato da tre numeri quantici in relazione gerarchica che ne definiscono: dimensione (n) forma (l) orientamento (m l )
9 Numero quantico principale (n) assume valori interi positivi n=1,2,3, uninsiemediorbitaliconlostessovaloredinèchiamatolivello definisce la dimensione dell orbitale maggiore il valore di n maggiore dimensione dell orbitale e la distanza dal nucleo definisce livello energetico dell atomo di idrogeno
10 Numero quantico del momento angolare (l) assume valori interi compresi tra 0 ed n-1 definisce la forma degli orbitali un insieme di orbitalicon lo stesso valore dinedlè denominato sottolivello, ciascuno dei quali è denominato con una lettera: l=0 sottolivello s l=1 sottolivello p l=2 sottolivello d l=3 sottolivello f
11
12 Numero quantico magnetico (m l ) assume valori interi compresi tra -le +l numero di valori possibili è pari a 2l+ 1 per ogni valore di l definisce l orientamentodell orbitale nellospazio attorno al nucleo
13 Geometria degli orbitali atomici l=0 l=1 l=2 l=3 2l + 1 orbitali
14
15 sottolivelli livello
16 Atomi polielettronici Equazione di S. non fornisce soluzioni esatte per atomi polielettronicima fornisce ottime soluzioni approssimate che mostrano che gli orbitali di atomi polielettronici sono idrogenoidi, simili cioè a quelli dell atomo di idrogeno. La presenza di più elettroni impone tuttavia: quarto numero quantico limite numero di elettroni per orbitale insieme complesso di livelli energetici degli orbitali
17 Numero quantico di spindell elettrone (m s ) verso di rotazione dell elettrone attorno al proprio asse valori ammessi sono +1/2 oppure -1/2
18 Ciascun elettrone in un atomo polielettronicoè descritto completamente da 4 numeri quantici
19 Principio di esclusione (W. Pauli1945, premio Nobel) In un atomo non possono coesistere due o più elettroni con i quattro numeri quantici uguali Quindi un orbitale atomico può contenere al massimo due elettroni con spin antiparalleli
20 Numero massimo di elettroni per livello
21 Configurazione elettronica di un elemento allo stato fondamentale (Aufbau) Distribuzione degli elettroni negli orbitali atomici a partire dall orbitale ad energia minore, rispettando il principio di Hunddella massima molteplicità ed il principio di esclusione di Pauli
22 Principio della massima molteplicità (F. Hund1925) Se più elettroni occupano orbitali degeneri, essi si distribuiscono con spinparalleli ad occupare il numero massimo di essi.
23 Livelli energetici degli orbitali in atomi polielettronici Lo stato energetico di un atomo di idrogeno dipende esclusivamente dal numero quantico n. Tutti i sottolivelli di un determinato livello hanno la stessa energia poiché l unica interazione presente è tra nucleo ed elettrone. Nel caso di atomi polielettronici subentrano interazioni elettrone elettrone ed interazione tra nucleo e diversi elettroni. Questo genera lo separazione (splitting) dei livelli energetici in sottolivelli di differente enrgia. L energia di un orbitale di un atomo polielettronicodipende principalmente dal valore del numero quantico principale n, associato alla dimensione dell orbitale, ed in parte dal valore del numero quantico di momento angolare l, associato alla forma dell orbitale.
24 Livelli energetici degli orbitali in atomi polielettronici
25 Configurazione elettronica (Aufbau) numero quantico pricipale n 1s 1 numerodielettroninell orbitale o sottolivello numero quantico angolare l H, Z=1 1s 2 He, Z=2 1s 2 2s 1 [He]2s 1 Li, Z=3
26 Configurazione elettronica condensata dello stato fondamentale dei primi 18 elementi da H ad Ar
27 Qual è la configurazione elettronica di Mg? Mg 12 elettroni Esempi 1s < 2s < 2p < 3s < 3p < 4s 1s 2 2s 2 2p 6 3s 2 (verifica: = 12 elettroni) [Ne]3s 2 [Ne] 1s 2 2s 2 2p 6 Quali sono i possibili numeri quantici per l ultimo elettrone(il più esterno) di Cl? Cl 17 elettroni 1s < 2s < 2p < 3s < 3p < 4s 1s 2 2s 2 2p 6 3s 2 3p 5 (verifica: = 17 elettroni) L ultimo elettroni è addizionato all orbitale 3p n = 3 l= 1 m l = -1, 0, or +1 m s = ½ or -½
28 Diagrammaverticalead orbitali(aufbau) Litio, Li Z=3
29
30
31
32
33 Tavola periodica e configurazione elettronica Elementi disposti in blocchi di sottolivelli che si presentano in ordine di energia crescente.
34 Livelli energetici degli orbitali in atomi polielettronici
35 Livelli energetici degli orbitali in atomi polielettronici
36 Tavola periodica e configurazione elettronica
37 Tavola periodica e configurazione elettronica
38 Elettroni interni Categorie di elettroni elettroni del gas nobile che precede l elemento nella tavola periodica, riempiono tutti i livelli energetici inferiori di un atomo. Elettroni esterni elettroni presenti nel livello energetico più elevato, quindi si trovano ad elevata distanza dal nucleo Elettroni di valenza elettroni coinvolti nella formazione di composti (legame chimico). per elementi dei gruppi principali elettroni valenza sono gli elettroni esterni.
39 Tavola periodica ed elettroni esterni Per gli elementi dei gruppi principali, il numero del gruppo è pari al numero di elettroni esterni. Il numero del periodo corrisponde al valore di ndel livello energetico maggiore. Numero totale di orbitali per un dato livello (o guscio) è pari ad n 2 Numero totale di elettroni per un dato livello è pari a 2n 2
40 Tavola periodica e configurazione elettronica Elementi disposti in blocchi di sottolivelli che si presentano in ordine di energia crescente.
41 Elettronidi valenzaper igruppiprincipali Elettroni esterni coinvolti nella formazione di composti Gruppo Config. Elettronica Numero e divalenza 1A ns 1 1 2A ns 2 2 3A ns 2 np 1 3 4A ns 2 np 2 4 5A ns 2 np 3 5 6A ns 2 np 4 6 7A ns 2 np 5 7
42 SimbologiadiLewis
43 Configurazione elettronica e periodicità chimica Il comportamento chimico e fisico degli elementi si basa sulla configurazione elettronica (proprietà periodiche). raggio atomico raggio ionico energia di ionizzazione affinità per l elettrone reattività
44 Raggio atomico (pm)
45
46
47 Raggi ionici (pm)
48 Raggi ionici (pm) vsraggi atomici (pm)
49 Raggi ionici (pm) vsraggi atomici (pm)
50 Energia di ionizzazione (I) L energiadi ionizzazioneè l energiaminima (kj/mol) richiestaper rimuovereunamole di elettronidaunamole di atominelsuo statofondamentaleallostatogassoso. I 1 + X (g) X + (g)+ e - I 1 Energiadiprima ionizzazione I + X + X 2 + (g)+ e - 2 (g) I 3 + X 2+ (g) X 3 + (g)+ e - I 2 Energiadisecondaionizzazione 2 I 3 Energiaditerzaionizzazione I 1 < I 2 < I 3 8.4
51 Andamento dell energia di prima ionizzazione ia di prima ionizzazione Aumento dell energi Aumento dell energia di prima ionizzazione
52 Andamento dell energia di prima ionizzazione
53 Configurazione elettronica e periodicità chimica: affinità elettronica Variazione di energia che accompagna l aggiunta di mole di elettroni ad una mole di atomi nello stato fondamentale allo stato gassoso. Atomo (g) + e - ione - (g) E=E ael
54 In sintesi
55 Elementidel Gruppo1A (ns 1, n 2)
56 Elementidel Gruppo1A (ns 1, n 2) M M e - 2M (s) + 2H 2 O (l) 4M (s) + O 2(g) 2MOH (aq) + H 2(g) 2M 2 O (s) à Aumento della reattivvità
57
58 Elementidel Gruppo2A (ns 2, n 2)
59 Marie Curie Premio Nobel per la Chimica nel 1911 per l isolamento di Radio (Ra) e Polonio (Po)!
60 Elementidel Gruppo2A (ns 2, n 2) M M e - Be (s) + 2H 2 O (l) Mg (s) + 2H 2 O (g) NessunaReazione Mg(OH) 2(aq) + H 2(g) M (s) + 2H 2 O (l) M(OH) 2(aq) + H 2(g) M = Ca, Sr, or Ba Aumento della reattività
61
62 Elementidel Gruppo3A (ns 2 np 1, n 2)
63 Elementidel Gruppo3A (ns 2 np 1, n 2) 4Al (s) + 3O 2(g) 2Al (s) + 6H + (aq) 2Al 2 O 3(s) 2Al 3+ (aq)+ 3H 2(g)
64 Elementidel Gruppo4A (ns 2 np 2, n 2)
65 Elementidel Gruppo4A (ns 2 np 2, n 2) Sn (s) + 2H + (aq) Pb (s) + 2H + (aq) Sn 2+ (aq)+ H 2 (g) Pb 2+ (aq)+ H 2 (g)
66 Elementidel Gruppo5A (ns 2 np 3, n 2)
67 Elementidel Gruppo5A (ns 2 np 3, n 2) N 2 O 5(s) + H 2 O (l) P 4 O 10(s) + 6H 2 O (l) 2HNO 3(aq) 4H 3 PO 4(aq)
68 Elementidel Gruppo6A (ns 2 np 4, n 2)
69 Elementi del gruppo 16!
70 Elementidel Gruppo6A (ns 2 np 4, n 2) SO 3(g) + H 2 O (l) H 2 SO 4(aq)
71 Elementidel Gruppo7A (ns 2 np 5, n 2)
72 Elementidel Gruppo7A (ns 2 np 5, n 2) X + 1e - X -1 X 2(g) + H 2(g) 2HX (g) tà Aumento di reattivit
73 Elementidel Gruppo8A (ns 2 np 6, n 2) sottolivelli ns e np completi energie di ionizzazione elevate nessuna tendenza ad accettare o cedere elettroni
La Teoria dei Quanti e la Struttura Elettronica degli Atomi. Capitolo 7
 La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
TEORIA QUANTISTICA E STRUTTURA ATOMICA
 TEORIA QUANTISTICA E STRUTTURA ATOMICA Gli argomenti di queste lezioni sono trattati nel Capitolo 7 del testo e nei paragrafi 1, e 3 del Capitolo 8. Non ci sono parti da non considerare. La moderna definizione
TEORIA QUANTISTICA E STRUTTURA ATOMICA Gli argomenti di queste lezioni sono trattati nel Capitolo 7 del testo e nei paragrafi 1, e 3 del Capitolo 8. Non ci sono parti da non considerare. La moderna definizione
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
Tabella periodica degli elementi
 Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
S P E T T R O S C O P I A. Dispense di Chimica Fisica per Biotecnologie Dr.ssa Rosa Terracciano
 S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
Le particelle elementari di interesse in Chimica sono: Particella simbolo massa carica spin
 Le particelle elementari di interesse in Chimica sono: Particella simbolo massa carica spin Elettrone e - 9.11x10-31 kg -1 ½ 5.486x10-4 u Protone p 1.67x10-27 kg +1 ½ 1.0073 u Neutrone n 1.67x10-27 kg
Le particelle elementari di interesse in Chimica sono: Particella simbolo massa carica spin Elettrone e - 9.11x10-31 kg -1 ½ 5.486x10-4 u Protone p 1.67x10-27 kg +1 ½ 1.0073 u Neutrone n 1.67x10-27 kg
Recenti Scoperte Scientifiche in Ottica
 Recenti Scoperte Scientifiche in Ottica Luca Salasnich Dipartimento di Fisica e Astronomia Galileo Galilei, Università di Padova, Italy Padova, 26 Maggio 2014 Secondo Meeting di Ottica e Optometria a Padova
Recenti Scoperte Scientifiche in Ottica Luca Salasnich Dipartimento di Fisica e Astronomia Galileo Galilei, Università di Padova, Italy Padova, 26 Maggio 2014 Secondo Meeting di Ottica e Optometria a Padova
LE PARTICELLE ELEMENTARI: loro scoperta
 LE PARTICELLE ELEMENTARI: loro scoperta Atomo: composto da particelle elementari più piccole (protoni, neutroni, elettroni) Atomi di elementi diversi contengono le STESSE particelle, ma in numero diverso
LE PARTICELLE ELEMENTARI: loro scoperta Atomo: composto da particelle elementari più piccole (protoni, neutroni, elettroni) Atomi di elementi diversi contengono le STESSE particelle, ma in numero diverso
Com è fatto l atomo ATOMO. UNA VOLTA si pensava che l atomo fosse indivisibile. OGGI si pensa che l atomo è costituito da tre particelle
 STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
LA MOLE LA MOLE 2.A PRE-REQUISITI 2.3 FORMULE E COMPOSIZIONE 2.B PRE-TEST
 LA MOLE 2.A PRE-REQUISITI 2.B PRE-TEST 2.C OBIETTIVI 2.1 QUANTO PESA UN ATOMO? 2.1.1 L IDEA DI MASSA RELATIVA 2.1.2 MASSA ATOMICA RELATIVA 2.2.4 ESERCIZI SVOLTI 2.3 FORMULE E COMPOSIZIONE 2.4 DETERMINAZIONE
LA MOLE 2.A PRE-REQUISITI 2.B PRE-TEST 2.C OBIETTIVI 2.1 QUANTO PESA UN ATOMO? 2.1.1 L IDEA DI MASSA RELATIVA 2.1.2 MASSA ATOMICA RELATIVA 2.2.4 ESERCIZI SVOLTI 2.3 FORMULE E COMPOSIZIONE 2.4 DETERMINAZIONE
LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.6 ENERGIE DI IONIZZAZIONE E DISTRIBUZIONE DEGLI ELETTRONI 4.C OBIETTIVI
 LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.C OBIETTIVI 4.1 UNO SGUARDO ALLA STORIA 4.2 L ATOMO DI BOHR (1913) 4.5.2 PRINCIPIO DELLA MASSIMA MOLTEPLICITA (REGOLA DI HUND) 4.5.3 ESERCIZI SVOLTI
LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.C OBIETTIVI 4.1 UNO SGUARDO ALLA STORIA 4.2 L ATOMO DI BOHR (1913) 4.5.2 PRINCIPIO DELLA MASSIMA MOLTEPLICITA (REGOLA DI HUND) 4.5.3 ESERCIZI SVOLTI
INTERAZIONI DELLE RADIAZIONI CON LA MATERIA
 M. Marengo INTERAZIONI DELLE RADIAZIONI CON LA MATERIA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna mario.marengo@unibo.it Si definiscono radiazioni ionizzanti tutte le
M. Marengo INTERAZIONI DELLE RADIAZIONI CON LA MATERIA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna mario.marengo@unibo.it Si definiscono radiazioni ionizzanti tutte le
ELETTROCHIMICA. Uso di reazioni chimiche per produrre corrente elettrica (Pile)
 ELETTROCHIMICA Uso di reazioni chimiche per produrre corrente elettrica (Pile) Uso di forza elettromotrice (fem) esterna per forzare reazioni chimiche non spontanee (Elettrolisi) Coppia redox: Ossidazione
ELETTROCHIMICA Uso di reazioni chimiche per produrre corrente elettrica (Pile) Uso di forza elettromotrice (fem) esterna per forzare reazioni chimiche non spontanee (Elettrolisi) Coppia redox: Ossidazione
PERCHÉ STUDIARE LA CHIMICA. La chimica studia la composizione e le proprietà della materia e i cambiamenti cui quest ultima va incontro.
 1 PERCHÉ STUDIARE LA CHIMICA La chimica studia la composizione e le proprietà della materia e i cambiamenti cui quest ultima va incontro. Cucinare Digestione Chimica: scienza centrale Respirazione Combustione
1 PERCHÉ STUDIARE LA CHIMICA La chimica studia la composizione e le proprietà della materia e i cambiamenti cui quest ultima va incontro. Cucinare Digestione Chimica: scienza centrale Respirazione Combustione
Indice generale. Prefazione
 26-10-2009 10:41 Pagina VI Prefazione Ringraziamenti dell Editore Guida alla lettura XIII XV XVII Capitolo 0 Lessico della chimica 1 0.1 La chimica 1 0.1.1 Classificazioni della materia 2 0.1.2 Proprietà
26-10-2009 10:41 Pagina VI Prefazione Ringraziamenti dell Editore Guida alla lettura XIII XV XVII Capitolo 0 Lessico della chimica 1 0.1 La chimica 1 0.1.1 Classificazioni della materia 2 0.1.2 Proprietà
COMPOSTI DI COORDINAZIONE (complessi)
 Gli ioni dei metalli di transizione nei sistemi biologici non si presentano come acquoioni [M(H 2 O) n ] x+ ma come. COMPOSTI DI COORDINAZIONE (complessi) derivano dall interazione (coordinazione) tra
Gli ioni dei metalli di transizione nei sistemi biologici non si presentano come acquoioni [M(H 2 O) n ] x+ ma come. COMPOSTI DI COORDINAZIONE (complessi) derivano dall interazione (coordinazione) tra
Scritto Chimica generale 13.02.2012 Gruppo A
 Scritto Chimica generale 13.02.2012 Gruppo A 1. Calcolare il ph di una soluzione ottenuta mescolando 12.0 ml di una soluzione 1.00 M di nitrato di calcio, 150 ml di una soluzione 1.00 M di acido cloridrico,
Scritto Chimica generale 13.02.2012 Gruppo A 1. Calcolare il ph di una soluzione ottenuta mescolando 12.0 ml di una soluzione 1.00 M di nitrato di calcio, 150 ml di una soluzione 1.00 M di acido cloridrico,
Indice. 1 La materia e la sua struttura. 2 La radioattività ed i processi nucleari
 Indice PREFAZIONE ALLA SECONDA EDIZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi
Indice PREFAZIONE ALLA SECONDA EDIZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi
La Meccanica Quantistica
 Alunno: Giovannangelo Dante Liceo Scientifico Tecnologico L. Da Vinci, Lanciano La Meccanica Quantistica La realtà così come non la vediamo Il percorso 1. Storia 2. Fisica 3. Matematica La Meccanica Quantistica
Alunno: Giovannangelo Dante Liceo Scientifico Tecnologico L. Da Vinci, Lanciano La Meccanica Quantistica La realtà così come non la vediamo Il percorso 1. Storia 2. Fisica 3. Matematica La Meccanica Quantistica
Gli orbitali: modello atomico probabilistico
 1 Approfondimento 2.1 Gli orbitali: modello atomico probabilistico Modello atomico planetario (o a gusci): gli elettroni ruotano intorno al nucleo percorrendo orbite prefissate. Il modello atomico planetario
1 Approfondimento 2.1 Gli orbitali: modello atomico probabilistico Modello atomico planetario (o a gusci): gli elettroni ruotano intorno al nucleo percorrendo orbite prefissate. Il modello atomico planetario
Le proprietà periodiche degli elementi LA LEZIONE
 Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
MASSE ATOMICHE. 1,000 g di idrogeno reagiscono con 7,9367 g di ossigeno massa atomica ossigeno=2 x 7,9367=15,873 g (relativa all'idrogeno)
 MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
Natura della luce. Qualsiasi tipo di onda è caratterizzato da:
 Natura della luce James C. Maxwell (1831-79) dimostrò che tutte le proprietà note della luce erano spiegabili attraverso un insieme di equazioni basate sull ipotesi che la luce fosse un onda elettromagnetica
Natura della luce James C. Maxwell (1831-79) dimostrò che tutte le proprietà note della luce erano spiegabili attraverso un insieme di equazioni basate sull ipotesi che la luce fosse un onda elettromagnetica
Indice. 1 La materia e la sua struttura. 2 La radioattività ed i processi nucleari
 Indice PREFAZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi 5 1.3. L unità di
Indice PREFAZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi 5 1.3. L unità di
Introduzione alle tecniche spettroscopiche e all interazione radiazione/materia. Francesco Nobili
 Introduzione alle tecniche spettroscopiche e all interazione radiazione/materia Francesco Nobili TECNICHE SPETTROSCOPICHE Le tecniche spettroscopiche sono tecniche analitiche basate sull interazione tra
Introduzione alle tecniche spettroscopiche e all interazione radiazione/materia Francesco Nobili TECNICHE SPETTROSCOPICHE Le tecniche spettroscopiche sono tecniche analitiche basate sull interazione tra
Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici.
 LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO: CHIMICA, MATERIALI E BIOTECNOLOGIE
 RE P U B B L I C A I T A L I A N A ISTITUTO DI ISTRUZIONE SECONDARIA SUPERIORE MINERARIO G. ASPRONI E. FERMI DI IGLESIAS PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO:
RE P U B B L I C A I T A L I A N A ISTITUTO DI ISTRUZIONE SECONDARIA SUPERIORE MINERARIO G. ASPRONI E. FERMI DI IGLESIAS PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO:
Il Metodo Scientifico
 Unita Naturali Il Metodo Scientifico La Fisica si occupa di descrivere ed interpretare i fenomeni naturali usando il metodo scientifico. Passi del metodo scientifico: Schematizzazione: modello semplificato
Unita Naturali Il Metodo Scientifico La Fisica si occupa di descrivere ed interpretare i fenomeni naturali usando il metodo scientifico. Passi del metodo scientifico: Schematizzazione: modello semplificato
Teoria del campo cristallino (CFT)
 Teoria del campo cristallino (CFT) Interazione elettrostatica (non covalente) tra: - leganti anionici cariche elettriche puntiformi - leganti neutri dipoli elettrici con la parte negativa verso il centro
Teoria del campo cristallino (CFT) Interazione elettrostatica (non covalente) tra: - leganti anionici cariche elettriche puntiformi - leganti neutri dipoli elettrici con la parte negativa verso il centro
MODELLI ATOMICI. Modello Atomico di Dalton
 MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
La teoria del legame di valenza
 La teoria del legame di valenza La teoria di Lewis (postulata prima dell'avvento della meccanica quantistica) considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente
La teoria del legame di valenza La teoria di Lewis (postulata prima dell'avvento della meccanica quantistica) considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente
STRUTTURA DELL'ATOMO
 STRUTTURA DELL'ATOMO Vari esperimenti condotti fra la fine del 1800 e l inizio del 1900 dimostrarono che gli atomi non sono indivisibili, ma costituiti da particelle più piccole (elementari). PARTICELLE
STRUTTURA DELL'ATOMO Vari esperimenti condotti fra la fine del 1800 e l inizio del 1900 dimostrarono che gli atomi non sono indivisibili, ma costituiti da particelle più piccole (elementari). PARTICELLE
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Chimica. Ingegneria Meccanica, Elettrica e Civile Simulazione d'esame
 Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
SOLUZIONE ESERCIZIO 1.1
 SOLUZIONE ESERCIZIO 1.1 La temperatura di fusione ed il coefficiente di espansione termica di alcuni metalli sono riportati nella tabella e nel diagramma sottostante: Metallo Temperatura di fusione [ C]
SOLUZIONE ESERCIZIO 1.1 La temperatura di fusione ed il coefficiente di espansione termica di alcuni metalli sono riportati nella tabella e nel diagramma sottostante: Metallo Temperatura di fusione [ C]
Struttura elettronica delle molecole. Teoria quantistica del legame chimico
 Strttra elettronica delle molecole. Teoria qantistica del legame chimico Lo ione idrogeno molecolare H 2 + Eq. Schroedinger singolo elettrone La fnzione d onda φ b soddisfa na eqazione analoga. Gli atovalori
Strttra elettronica delle molecole. Teoria qantistica del legame chimico Lo ione idrogeno molecolare H 2 + Eq. Schroedinger singolo elettrone La fnzione d onda φ b soddisfa na eqazione analoga. Gli atovalori
Prova scritta intercorso 2 31/5/2002
 Prova scritta intercorso 3/5/ Diploma in Scienza e Ingegneria dei Materiali anno accademico - Istituzioni di Fisica della Materia - Prof. Lorenzo Marrucci Tempo a disposizione ora e 45 minuti ) Un elettrone
Prova scritta intercorso 3/5/ Diploma in Scienza e Ingegneria dei Materiali anno accademico - Istituzioni di Fisica della Materia - Prof. Lorenzo Marrucci Tempo a disposizione ora e 45 minuti ) Un elettrone
Quesiti e problemi (sul libro da pag. 189)
 Quesiti e problemi (sul libro da pag. 189) 1 La doppia natura della luce 1 Qual è la prova più evidente della natura ondulatoria della luce? la diffrazione 2 Come sono chiamate le particelle che costituiscono
Quesiti e problemi (sul libro da pag. 189) 1 La doppia natura della luce 1 Qual è la prova più evidente della natura ondulatoria della luce? la diffrazione 2 Come sono chiamate le particelle che costituiscono
I modelli atomici da Dalton a Bohr
 1 Espansione 2.1 I modelli atomici da Dalton a Bohr Modello atomico di Dalton: l atomo è una particella indivisibile. Modello atomico di Dalton Nel 1808 John Dalton (Eaglesfield, 1766 Manchester, 1844)
1 Espansione 2.1 I modelli atomici da Dalton a Bohr Modello atomico di Dalton: l atomo è una particella indivisibile. Modello atomico di Dalton Nel 1808 John Dalton (Eaglesfield, 1766 Manchester, 1844)
2 R = mgr + 1 2 mv2 0 = E f
 Esercizio 1 Un corpo puntiforme di massa m scivola lungo la pista liscia di raggio R partendo da fermo da un altezza h rispetto al fondo della pista come rappresentato in figura. Calcolare: a) Il valore
Esercizio 1 Un corpo puntiforme di massa m scivola lungo la pista liscia di raggio R partendo da fermo da un altezza h rispetto al fondo della pista come rappresentato in figura. Calcolare: a) Il valore
APPUNTI DI RISONANZA MAGNETICA NUCLEARE Dr. Claudio Santi. CAPITOLO 1 NMR Risonanza Magnetica Nucleare
 APPUNTI DI RISONANZA MAGNETICA NUCLEARE Dr. Claudio Santi CAPITOLO 1 NMR Risonanza Magnetica Nucleare INTRODUZIONE Nel 1946 due ricercatori, F. Block ed E.M.Purcell, hanno indipendentemente osservato per
APPUNTI DI RISONANZA MAGNETICA NUCLEARE Dr. Claudio Santi CAPITOLO 1 NMR Risonanza Magnetica Nucleare INTRODUZIONE Nel 1946 due ricercatori, F. Block ed E.M.Purcell, hanno indipendentemente osservato per
LICEO SCIENTIFICO VITO VOLTERRA
 LICEO SCIENTIFICO VITO VOLTERRA DIPARTIMENTO DI FISICA ORIETTA DI BIAGIO Penso si possa tranquillamente affermare che nessuno capisce la meccanica quantistica Richard P. Feynman Premio Nobel nel 1963 Quelli
LICEO SCIENTIFICO VITO VOLTERRA DIPARTIMENTO DI FISICA ORIETTA DI BIAGIO Penso si possa tranquillamente affermare che nessuno capisce la meccanica quantistica Richard P. Feynman Premio Nobel nel 1963 Quelli
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
I S T I T U T O T E C N I C O I N D U S T R I A L E S T A T A L E V E R O N A
 I S T I T U T O T E C N I C O I N D U S T R I A L E S T A T A L E G U G L I E L M O M A R C O N I V E R O N A PROGRAMMA PREVENTIVO A.S. 2015/2016 CLASSE 4Ac MATERIA: Elettrotecnica, elettronica e automazione
I S T I T U T O T E C N I C O I N D U S T R I A L E S T A T A L E G U G L I E L M O M A R C O N I V E R O N A PROGRAMMA PREVENTIVO A.S. 2015/2016 CLASSE 4Ac MATERIA: Elettrotecnica, elettronica e automazione
Istituto di Istruzione Superiore L. da Vinci Civitanova Marche. Anno scolastico 2014-2015. Programma svolto. Docente: Silvana Venditti
 Anno scolastico 2014-2015 Programma svolto Docente: Silvana Venditti Disciplina: Scienze Naturali Classe : IV sez. E - Indirizzo Linguistico ARTICOLAZIONE DEI CONTENUTI E DEGLI OBIETTIVI SECONDO UNITA
Anno scolastico 2014-2015 Programma svolto Docente: Silvana Venditti Disciplina: Scienze Naturali Classe : IV sez. E - Indirizzo Linguistico ARTICOLAZIONE DEI CONTENUTI E DEGLI OBIETTIVI SECONDO UNITA
ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016. CLASSI SECONDE ITI, SEZ. H,G, Disciplina:CHIMICA E LABORATORIO
 ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016 CLASSI SECONDE ITI, SEZ. H,G, Disciplina:CHIMICA E LABORATORIO PROGETTAZIONE DIDATTICA ANNUALE Elaborata conformemente alle linee
ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016 CLASSI SECONDE ITI, SEZ. H,G, Disciplina:CHIMICA E LABORATORIO PROGETTAZIONE DIDATTICA ANNUALE Elaborata conformemente alle linee
TRAVE SU SUOLO ELASTICO
 Capitolo 3 TRAVE SU SUOLO ELASTICO (3.1) Combinando la (3.1) con la (3.2) si ottiene: (3.2) L equazione differenziale può essere così riscritta: (3.3) La soluzione dell equazione differenziale di ordine
Capitolo 3 TRAVE SU SUOLO ELASTICO (3.1) Combinando la (3.1) con la (3.2) si ottiene: (3.2) L equazione differenziale può essere così riscritta: (3.3) La soluzione dell equazione differenziale di ordine
Misureremo e analizzeremo la distribuzione di intensità luminosa di diverse figure di diffrazione in funzione della posizione acquisite on- line.
 4 IV Giornata Oggi termineremo questo percorso sulla luce misurando l intensità luminosa della distribuzione di massimi e minimi delle figure di diffrazione e di interferenza. In particolare confronteremo
4 IV Giornata Oggi termineremo questo percorso sulla luce misurando l intensità luminosa della distribuzione di massimi e minimi delle figure di diffrazione e di interferenza. In particolare confronteremo
SISTEMI MICROSCOPICI meccanica quantistica e spettroscopia
 SISTEMI MICROSCOPICI meccanica quantistica e spettroscopia Le proprietà fisiche e chimiche degli elementi e dei composti dipendono dal comportamento degli elettroni negli atomi e nelle molecole. La meccanica
SISTEMI MICROSCOPICI meccanica quantistica e spettroscopia Le proprietà fisiche e chimiche degli elementi e dei composti dipendono dal comportamento degli elettroni negli atomi e nelle molecole. La meccanica
LICEO SCIENTIFICO LEONARDO da VINCI REGGIO CALABRIA PROGRAMMA DI SCIENZE NATURALI CLASSE 2 a SEZ. Q A.S. 2012/2013
 LICEO SCIENTIFICO LEONARDO da VINCI REGGIO CALABRIA PROGRAMMA DI SCIENZE NATURALI CLASSE 2 a SEZ. Q A.S. 2012/2013 CHIMICA NUCLEO FONDANTE A : MISURE E GRANDEZZE TRASFORMAZIONI CHIMICO-FISICHE DELLA MATERIA
LICEO SCIENTIFICO LEONARDO da VINCI REGGIO CALABRIA PROGRAMMA DI SCIENZE NATURALI CLASSE 2 a SEZ. Q A.S. 2012/2013 CHIMICA NUCLEO FONDANTE A : MISURE E GRANDEZZE TRASFORMAZIONI CHIMICO-FISICHE DELLA MATERIA
 LEGAME CHIMICO In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE
LEGAME CHIMICO In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE
Il metodo scientifico
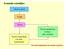 Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
LE COMPETENZE ESSENZIALI DI FISICA
 LE COMPETENZE ESSENZIALI DI FISICA classe prima Liceo scientifico COMPETENZE raccogliere dati attraverso l osservazione diretta dei fenomeni naturali fisici e attraverso l attività di laboratorio OSA comprendere
LE COMPETENZE ESSENZIALI DI FISICA classe prima Liceo scientifico COMPETENZE raccogliere dati attraverso l osservazione diretta dei fenomeni naturali fisici e attraverso l attività di laboratorio OSA comprendere
ISTITUTO DI ISTRUZIONE SUPERIORE J.C. MAXWELL Data: 09/09 /2013 Pag. _1_ di _5 PROGRAMMAZIONE ANNUALE A.S. 2013_ / 2014_
 ISTITUTO DI ISTRUZIONE SUPERIORE J.C. MAXWELL Data: 09/09 /2013 Pag. _1_ di _5 INDIRIZZO SCOLASTICO DISCIPLINA DOCENTE / I CLASSE / I X MECCANICA e MECCATRONICA X ELETTRONICA X LOGISTICA e TRASPORTI LICEO
ISTITUTO DI ISTRUZIONE SUPERIORE J.C. MAXWELL Data: 09/09 /2013 Pag. _1_ di _5 INDIRIZZO SCOLASTICO DISCIPLINA DOCENTE / I CLASSE / I X MECCANICA e MECCATRONICA X ELETTRONICA X LOGISTICA e TRASPORTI LICEO
Spettrofotometria. Le onde luminose consistono in campi magnetici e campi elettrici oscillanti, fra loro perpendicolari.
 Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
GAS IDEALI E MACCHINE TERMICHE. G. Pugliese 1
 GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
NUMERI DI OSSIDAZIONE
 NUMERI DI OSSIDAZIONE Numeri in caratteri romani dotati di segno Tengono conto di uno squilibrio di cariche nelle specie poliatomiche Si ottengono, formalmente, attribuendo tutti gli elettroni di valenza
NUMERI DI OSSIDAZIONE Numeri in caratteri romani dotati di segno Tengono conto di uno squilibrio di cariche nelle specie poliatomiche Si ottengono, formalmente, attribuendo tutti gli elettroni di valenza
LICEO SCIENTIFICO STATALE G. BANZI BAZOLI LECCE P R O G R A M M A Z I O NE DI DIPARTIMENTO
 LICEO SCIENTIFICO STATALE G. BANZI BAZOLI LECCE P R O G R A M M A Z I O NE DI DIPARTIMENTO F I S I C A CLASSI NUOVO ORDINAMENTO A. S. 2014/2015 COMPETENZE PRIMO BIENNIO: SC1 SC2 Osservare descrivere ed
LICEO SCIENTIFICO STATALE G. BANZI BAZOLI LECCE P R O G R A M M A Z I O NE DI DIPARTIMENTO F I S I C A CLASSI NUOVO ORDINAMENTO A. S. 2014/2015 COMPETENZE PRIMO BIENNIO: SC1 SC2 Osservare descrivere ed
Indice PREFAZIONE. Capitolo 5 LE LEGGI DEL MOTO DI NEWTON 58 5.1 La terza legge di Newton 58
 Indice PREFAZIONE XV Capitolo 1 RICHIAMI DI MATEMATICA 1 1.1 Simboli, notazione scientifica e cifre significative 1 1.2 Algebra 3 1.3 Geometria e trigonometria 5 1.4 Vettori 7 1.5 Sviluppi in serie e approssimazioni
Indice PREFAZIONE XV Capitolo 1 RICHIAMI DI MATEMATICA 1 1.1 Simboli, notazione scientifica e cifre significative 1 1.2 Algebra 3 1.3 Geometria e trigonometria 5 1.4 Vettori 7 1.5 Sviluppi in serie e approssimazioni
Struttura Elettronica degli Atomi
 Prof. A. Martinelli Struttura Elettronica degli Atomi Dipartimento di Farmacia 1 La Natura ondulatoria della luce - La luce visibile è una piccola parte dello spettro delle onde elettromagnetiche. 1 La
Prof. A. Martinelli Struttura Elettronica degli Atomi Dipartimento di Farmacia 1 La Natura ondulatoria della luce - La luce visibile è una piccola parte dello spettro delle onde elettromagnetiche. 1 La
GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato gassoso
 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
Da Newton a Planck. La struttura dell atomo. Da Newton a Planck. Da Newton a Planck. Meccanica classica (Newton): insieme
 Da Newton a Planck Meccanica classica (Newton): insieme La struttura dell atomo di leggi che spiegano il mondo fisico fino alla fine del XIX secolo Prof.ssa Silvia Recchia Quantomeccanica (Planck): insieme
Da Newton a Planck Meccanica classica (Newton): insieme La struttura dell atomo di leggi che spiegano il mondo fisico fino alla fine del XIX secolo Prof.ssa Silvia Recchia Quantomeccanica (Planck): insieme
Corrente elettrica F i s i c a s p e r i m e n t a l e I I
 Corrente elettrica F i s i c a s p e r i m e n t a l e I I Per descrivere il moto di una singola carica introdurremo il vettore velocità Se, come in un metallo, abbiamo un numero enorme di cariche libere
Corrente elettrica F i s i c a s p e r i m e n t a l e I I Per descrivere il moto di una singola carica introdurremo il vettore velocità Se, come in un metallo, abbiamo un numero enorme di cariche libere
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
ESERCIZI DI CHIMICA. 5. Calcolare le masse in grammi di: a) 0,30 moli di HNO 3 ; b) 2,50 moli di Na 2 SO 4. [19 g di HNO 3 ; 355 g di Na 2 SO 4 ]
![ESERCIZI DI CHIMICA. 5. Calcolare le masse in grammi di: a) 0,30 moli di HNO 3 ; b) 2,50 moli di Na 2 SO 4. [19 g di HNO 3 ; 355 g di Na 2 SO 4 ] ESERCIZI DI CHIMICA. 5. Calcolare le masse in grammi di: a) 0,30 moli di HNO 3 ; b) 2,50 moli di Na 2 SO 4. [19 g di HNO 3 ; 355 g di Na 2 SO 4 ]](/thumbs/19/303703.jpg) ESERCIZI DI CHIMICA 1. Calcolare:a) le moli di H 2 O e le moli di atomi d idrogeno ed ossigeno contenuti in 10g di H 2 O; b) il numero di molecole di H 2 O e di atomi di idrogeno e di ossigeno. [0,55 moli;
ESERCIZI DI CHIMICA 1. Calcolare:a) le moli di H 2 O e le moli di atomi d idrogeno ed ossigeno contenuti in 10g di H 2 O; b) il numero di molecole di H 2 O e di atomi di idrogeno e di ossigeno. [0,55 moli;
PRINCIPIO DI SOVRAPPOSIZIONE
 Capitolo 1 PRNCP D VRAPPZNE 1.1 Principio di sovrapposizione in ottica ondulatoria: esperimento di Young Una sorgente emette un onda luminosa monocromatica di lunghezza d onda λ, come illustrato in Fig.1.1.
Capitolo 1 PRNCP D VRAPPZNE 1.1 Principio di sovrapposizione in ottica ondulatoria: esperimento di Young Una sorgente emette un onda luminosa monocromatica di lunghezza d onda λ, come illustrato in Fig.1.1.
CORSO DI LAUREA IN SCIENZE FISICHE A.A. 2010/2011
 MANIFESTO DEGLI STUDI CORSO DI LAUREA IN SCIENZE FISICHE A.A. 2010/2011 1. Denominazione - Laurea in SCIENZE FISICHE 2. Classe Il Corso di laurea in Scienze Fisiche appartiene alla classe L-30 - Scienze
MANIFESTO DEGLI STUDI CORSO DI LAUREA IN SCIENZE FISICHE A.A. 2010/2011 1. Denominazione - Laurea in SCIENZE FISICHE 2. Classe Il Corso di laurea in Scienze Fisiche appartiene alla classe L-30 - Scienze
Istituto S. Giuliana Falconieri Classe IIIB Liceo Linguistico-Europeo Programmazione di Scienze A.S. 2013-2014
 Istituto S. Giuliana Falconieri Classe IIIB Liceo Linguistico-Europeo Le trasformazioni fisiche della materia Gli stati fisici della materia I sistemi omogenei ed eterogenei Le sostanze pure ed i miscugli
Istituto S. Giuliana Falconieri Classe IIIB Liceo Linguistico-Europeo Le trasformazioni fisiche della materia Gli stati fisici della materia I sistemi omogenei ed eterogenei Le sostanze pure ed i miscugli
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05
 I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
Corso di Laurea in FARMACIA
 Corso di Laurea in FARMACIA 2015 simulazione 1 FISICA Cognome nome matricola a.a. immatric. firma N Evidenziare le risposte esatte Una sferetta è appesa con una cordicella al soffitto di un ascensore fermo.
Corso di Laurea in FARMACIA 2015 simulazione 1 FISICA Cognome nome matricola a.a. immatric. firma N Evidenziare le risposte esatte Una sferetta è appesa con una cordicella al soffitto di un ascensore fermo.
Come costruire un computer quantistico
 Come costruire un computer quantistico Oliver Morsch CNR-INFM, Dipartimento di Fisica, Università di Pisa Introduzione: Fisica quantistica La fisica del c.q.: La sovrapposizione e gli stati entangled Problemi
Come costruire un computer quantistico Oliver Morsch CNR-INFM, Dipartimento di Fisica, Università di Pisa Introduzione: Fisica quantistica La fisica del c.q.: La sovrapposizione e gli stati entangled Problemi
Unità di misura. Perché servono le unità di misura nella pratica di laboratorio e in corsia? Le unità di misura sono molto importanti
 Unità di misura Le unità di misura sono molto importanti 1000 è solo un numero 1000 lire unità di misura monetaria 1000 unità di misura monetaria ma il valore di acquisto è molto diverso 1000/mese unità
Unità di misura Le unità di misura sono molto importanti 1000 è solo un numero 1000 lire unità di misura monetaria 1000 unità di misura monetaria ma il valore di acquisto è molto diverso 1000/mese unità
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Cenni di Teoria Cinetica dei Gas
 Cenni di Teoria Cinetica dei Gas Introduzione La termodinamica descrive i sistemi termodinamici tramite i parametri di stato (p, T,...) Sufficiente per le applicazioni: impostazione e progettazione di
Cenni di Teoria Cinetica dei Gas Introduzione La termodinamica descrive i sistemi termodinamici tramite i parametri di stato (p, T,...) Sufficiente per le applicazioni: impostazione e progettazione di
1 atm = 760 mm Hg = 760 torr = 101300 N/m 2 =101300 Pa. Anodo = Polo Positivo Anione = Ione Negativo. Catodo = Polo Negativo Catione = Ione Positivo
 1) Concetti Generali 1. Unità di Misura: A. Pressione 1 atm = 760 mm Hg = 760 torr = 101300 N/m 2 =101300 Pa. B. Calore 1 joule = 10 7 Erg. 1 caloria = 4,185 joule. Anodo = Polo Positivo Anione = Ione
1) Concetti Generali 1. Unità di Misura: A. Pressione 1 atm = 760 mm Hg = 760 torr = 101300 N/m 2 =101300 Pa. B. Calore 1 joule = 10 7 Erg. 1 caloria = 4,185 joule. Anodo = Polo Positivo Anione = Ione
Esercizi di Chimica (2 a prova in itinere)
 Esercizi di Chimica (2 a prova in itinere) 3) Calcolare la normalità (N) di una soluzione ottenuta sciogliendo 3,5 g di H 3 PO 4 in 900 ml di acqua [0,119 N] 4) Quanti grammi di soluto sono contenuti in
Esercizi di Chimica (2 a prova in itinere) 3) Calcolare la normalità (N) di una soluzione ottenuta sciogliendo 3,5 g di H 3 PO 4 in 900 ml di acqua [0,119 N] 4) Quanti grammi di soluto sono contenuti in
Università degli Studi di Pavia Facoltà di Medicina e Chirurgia
 Università degli Studi di Pavia Facoltà di Medicina e Chirurgia CORSO DI LAUREA TRIENNALE CLASSE DELLLE LAUREE DELLE PROFESSIONI SANITARIE DELLA RIABILITAZIONE CLASSE 2 Corso Integrato di Fisica, Statistica,
Università degli Studi di Pavia Facoltà di Medicina e Chirurgia CORSO DI LAUREA TRIENNALE CLASSE DELLLE LAUREE DELLE PROFESSIONI SANITARIE DELLA RIABILITAZIONE CLASSE 2 Corso Integrato di Fisica, Statistica,
Inquinamento da Campi Elettromagnetici
 Inquinamento da Campi Elettromagnetici Aspetti Tecnici, Sanitari, Normativi A cura di ECORICERCHE s.r.l. Lo Spettro Elettromagnetico ECORICERCHE s.r.l. 2 Elettrosmog: che cos è? E un termine entrato nell
Inquinamento da Campi Elettromagnetici Aspetti Tecnici, Sanitari, Normativi A cura di ECORICERCHE s.r.l. Lo Spettro Elettromagnetico ECORICERCHE s.r.l. 2 Elettrosmog: che cos è? E un termine entrato nell
DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto:
 Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
1 INCONTRO CHIMICA (PROF.SSA PAOLA BURANI) Ogni sostanza chimica è costituita dalla combinazione, in diverse proporzioni, di 92 tipi di atomi.
 1 INCONTRO CHIMICA (PROF.SSA PAOLA BURANI) 1 Atomi e Legami Ogni sostanza chimica è costituita dalla combinazione, in diverse proporzioni, di 92 tipi di atomi. Il termine atomo significa indivisibile e
1 INCONTRO CHIMICA (PROF.SSA PAOLA BURANI) 1 Atomi e Legami Ogni sostanza chimica è costituita dalla combinazione, in diverse proporzioni, di 92 tipi di atomi. Il termine atomo significa indivisibile e
Fluorescenza IR di eccimeri Xe 2 in gas denso
 Fluorescenza IR di eccimeri Xe 2 in gas denso A. F. Borghesani *,+ and G. Carugno + * Dipartimento di Fisica, Unità CNISM, Università di Padova + Istituto Nazionale di Fisica Nucleare, Sezione di Padova
Fluorescenza IR di eccimeri Xe 2 in gas denso A. F. Borghesani *,+ and G. Carugno + * Dipartimento di Fisica, Unità CNISM, Università di Padova + Istituto Nazionale di Fisica Nucleare, Sezione di Padova
Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia.
 G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
1.11.3 Distribuzione di carica piana ed uniforme... 32
 Indice 1 Campo elettrico nel vuoto 1 1.1 Forza elettromagnetica............ 2 1.2 Carica elettrica................ 3 1.3 Fenomeni elettrostatici............ 6 1.4 Legge di Coulomb.............. 9 1.5 Campo
Indice 1 Campo elettrico nel vuoto 1 1.1 Forza elettromagnetica............ 2 1.2 Carica elettrica................ 3 1.3 Fenomeni elettrostatici............ 6 1.4 Legge di Coulomb.............. 9 1.5 Campo
La barriera di potenziale: effetto tunnel
 La barriera di potenziale: effetto tunnel 1 Barriera di potenziale: caso classico V v V v 0 per a Enrico > x > a Silva - proprietà intellettuale v non ceduta V(x) = 0 Non per x è permessa, > a in particolare,
La barriera di potenziale: effetto tunnel 1 Barriera di potenziale: caso classico V v V v 0 per a Enrico > x > a Silva - proprietà intellettuale v non ceduta V(x) = 0 Non per x è permessa, > a in particolare,
Dai primi modelli atomici alla teoria moderna
 Dai primi modelli atomici alla teoria moderna 1 Se numerose evidenze sperimentali avevano permesso di trovare l'esistenza delle particelle subatomiche, le loro dimensioni, così infinitamente piccole, non
Dai primi modelli atomici alla teoria moderna 1 Se numerose evidenze sperimentali avevano permesso di trovare l'esistenza delle particelle subatomiche, le loro dimensioni, così infinitamente piccole, non
Definiamo Entalpia la funzione: DH = DU + PDV. Variando lo stato del sistema possiamo misurare la variazione di entalpia: DU = Q - PDV.
 Problemi Una mole di molecole di gas ideale a 292 K e 3 atm si espandono da 8 a 20 L e a una pressione finale di 1,20 atm seguendo 2 percorsi differenti. Il percorso A è un espansione isotermica e reversibile;
Problemi Una mole di molecole di gas ideale a 292 K e 3 atm si espandono da 8 a 20 L e a una pressione finale di 1,20 atm seguendo 2 percorsi differenti. Il percorso A è un espansione isotermica e reversibile;
Lezione 6: Numeri quantici
 Corso di Fisica moderna di base Modulo 1: Elementi di Struttura della Materia Anna M. Lombardi ATTENZIONE: LE SEGUENTI PAGINE SONO INTESE COME UNO SCHEMATICO RIASSUNTO DI QUANTO TRATTATO IN AULA, NON PRETENDONO
Corso di Fisica moderna di base Modulo 1: Elementi di Struttura della Materia Anna M. Lombardi ATTENZIONE: LE SEGUENTI PAGINE SONO INTESE COME UNO SCHEMATICO RIASSUNTO DI QUANTO TRATTATO IN AULA, NON PRETENDONO
UNIVERSITÀ DEGLI STUDI DI CATANIA
 UNIVERSITÀ DEGLI STUDI DI CATANIA Struttura didattica di Dipartimento di Scienze chimiche - Dipartimento di Matematica e Informatica - Dipartimento di Fisica ed Astronomia A.A. 2013-2014 - Prova di ammissione
UNIVERSITÀ DEGLI STUDI DI CATANIA Struttura didattica di Dipartimento di Scienze chimiche - Dipartimento di Matematica e Informatica - Dipartimento di Fisica ed Astronomia A.A. 2013-2014 - Prova di ammissione
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
Quali conoscenze di base per comprendere l'innovazione?
 Quali conoscenze di base per comprendere l'innovazione? 2006-2015: dieci anni di SPAIS 2015 Anno internazionale della luce e delle tecnologie basate sulla luce IX Edizione Il Sole. La nostra stella e/è
Quali conoscenze di base per comprendere l'innovazione? 2006-2015: dieci anni di SPAIS 2015 Anno internazionale della luce e delle tecnologie basate sulla luce IX Edizione Il Sole. La nostra stella e/è
MATERIALI MAGNETICI. Il campo magnetico è prodotto anche da conduttori in cui circola corrente. 15/12/2011 Chimica Applicata 1
 MATERIALI MAGNETICI Metalli magnetici: Fe, Co, Ni. Ago magnetico si allinea con il campo magnetico terrestre; calamita esercita un campo magnetico visualizzabile con della limatura di ferro Il campo magnetico
MATERIALI MAGNETICI Metalli magnetici: Fe, Co, Ni. Ago magnetico si allinea con il campo magnetico terrestre; calamita esercita un campo magnetico visualizzabile con della limatura di ferro Il campo magnetico
2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà. I liquidi e loro proprietà
 2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà 1 I liquidi e loro proprietà 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito. I gas occupano i loro contenitori uniformemente
2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà 1 I liquidi e loro proprietà 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito. I gas occupano i loro contenitori uniformemente
Esempio prova di esonero Fisica Generale I C.d.L. ed.u. Informatica
 Esempio prova di esonero Fisica Generale I C.d.L. ed.u. Informatica Nome: N.M.: 1. Se il caffè costa 4000 /kg (lire al chilogrammo), quanto costa all incirca alla libbra? (a) 1800 ; (b) 8700 ; (c) 18000
Esempio prova di esonero Fisica Generale I C.d.L. ed.u. Informatica Nome: N.M.: 1. Se il caffè costa 4000 /kg (lire al chilogrammo), quanto costa all incirca alla libbra? (a) 1800 ; (b) 8700 ; (c) 18000
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE. un atomo compie all atto di formazione di un composto al fine di formare un maggior
 CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
Giochi della Chimica
 Divisione di Didattica Chimica per incarico del MIUR Giochi della Chimica 2015 Finale Nazionale Classi di Concorso A e B Silvana Saiello (Coordinatore Nazionale dei Giochi e delle Olimpiadi della Chimica)
Divisione di Didattica Chimica per incarico del MIUR Giochi della Chimica 2015 Finale Nazionale Classi di Concorso A e B Silvana Saiello (Coordinatore Nazionale dei Giochi e delle Olimpiadi della Chimica)
1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3.
 Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero Il numero atomico, il numero di massa e gli isotopi numero atomico (Z) = numero di protoni nel nucleo numero di massa (A) = numero di protoni + numero
La Vita è una Reazione Chimica Acqua Oro Zucchero Il numero atomico, il numero di massa e gli isotopi numero atomico (Z) = numero di protoni nel nucleo numero di massa (A) = numero di protoni + numero
VSEPR Polarità Ibridizzazione
 VSEPR Polarità Ibridizzazione VSEPR VSEPR = Valance-Shell electron-pair repulsion Principio fondamentale: ciascun gruppo di elettroni di valenza attorno ad un atomo centrale è situato il più lontano possibile
VSEPR Polarità Ibridizzazione VSEPR VSEPR = Valance-Shell electron-pair repulsion Principio fondamentale: ciascun gruppo di elettroni di valenza attorno ad un atomo centrale è situato il più lontano possibile
INDICE CARICA ELETTRICA E LEGGE DI COULOMB 591 ENERGIA POTENZIALE E POTENZIALI ELETTRICI 663 CAMPO ELETTRICO 613 PROPRIETÀ ELETTRICHE DELLA MATERIA 93
 INDICE CAPITOLO 25 CARICA ELETTRICA E LEGGE DI COULOMB 591 25.1 Elettromagnetismo: presentazione 591 25.2 Carica elettrica 592 25.3 Conduttori e isolanti 595 25.4 Legge di Coulomb 597 25.5 Distribuzioni
INDICE CAPITOLO 25 CARICA ELETTRICA E LEGGE DI COULOMB 591 25.1 Elettromagnetismo: presentazione 591 25.2 Carica elettrica 592 25.3 Conduttori e isolanti 595 25.4 Legge di Coulomb 597 25.5 Distribuzioni
Richiami. Esercizio 1.1. La radiazione elettromagnetica del corpo nero ha la seguente densità di energia per unità di frequenza
 Parte I Problemi Richiami Esercizio 1.1. La radiazione elettromagnetica del corpo nero ha la seguente densità di energia per unità di frequenza u ν = 8π hν c 3 ν e βhν 1, dove c è la velocità della luce
Parte I Problemi Richiami Esercizio 1.1. La radiazione elettromagnetica del corpo nero ha la seguente densità di energia per unità di frequenza u ν = 8π hν c 3 ν e βhν 1, dove c è la velocità della luce
