Leganti π. Leganti π sono quelli che, oltre ad interazioni di tipo σ, possono dare, con il metallo, interazioni di tipo π:
|
|
|
- Lucia Ferretti
- 5 anni fa
- Visualizzazioni
Transcript
1 Leganti π Leganti π sono quelli che, oltre ad interazioni di tipo σ, possono dare, con il metallo, interazioni di tipo π: leganti π-donatori (basici nel senso di Lewis) leganti π-accettori (acidi nel senso di Lewis) N.B. Complessi π sono quelli in cui molecole insature usano, per l interazione con il metallo, doppietti elettronici provenienti da orbitali molecolari di tipo π. legami σ (simmetria cilindrica rispetto all asse di legame M-L) donazione di elettroni L M (L pieni ; M vuoti) legami π (asse di legame M-L nel piano nodale degli orbitali interessati) donazione di elettroni L M (L pieni ; M vuoti) retrodonazione di elettroni M L (M pieni ; L vuoti) legami δ (asse di legame M-L nei due piani nodali degli orbitali interessati)
2 Donazione π (L M) si verifica quando il metallo si trova in alto stato di ossidazione formale (primi metalli delle serie di transizione) i leganti adatti ad agire da donatori π sono leganti anionici ad alta carica (O 2-, N 3- ) Retrodonazione π (M L) si verifica quando il metallo si trova in basso stato di ossidazione formale (ultimi metalli delle serie di transizione), in cui il metallo delocalizza sul legante un eventuale eccesso di densità elettronica i leganti adatti ad agire da accettori π sono: CO, NO, PR 3 (fosfine), AsR 3 (arsine), CNR (isocianuri o isonitrili) (nitrili), N 2 molecole organiche insature con sistemi π delocalizzati (alcheni, alchini, areni, ciclopentadienili) (piridina, 2,2 dipiridile, 1,10 fenantrolina)
3 Monossido di carbonio, CO base di Lewis molto debole; si lega con acidi di Lewis grazie all effetto sinergico del processo donazione retrodonazione N.B. il sinergismo della donazione-retrodonazione non è necessario quando l acido di Lewis è molto forte, es. H 3 B CO quando agisce da legante monodentato, si coordina tramite l atomo di C (coppia elettronica più disponibile) (donatore di 2e - ) dando i complessi metallo-carbonilici: quando agisce da legante monodentato, raramente si coordina tramite l atomo di O (coppia elettronica meno disponibile) (donatore di 2e - ) dando i complessi isocarbonilici:
4 Schema degli orbitali molecolari del CO (senza mescolamento s-p y, asse di legame y) CO (3σ) 2 (4σ) 2 (1π) 4 (5σ) 2 d C-O (A ) = 1,13 ν C-O (cm -1 ) = 2143 [CO] + (3σ) 2 (4σ) 2 (1π) 4 (5σ) 1 d C-O (A ) = 1,11 ν C-O (cm -1 ) = 2184 Schema dell interazione di legame M - CO lineare (terminale) sono possibili due interazioni π in piani perpendicolari tra loro.
5 Modi di coordinazione del CO terminale (end on), tramite la coppia elettronica 5σ, donatore di 2e - terminale (side on), tramite le coppie 1π, donatore di 4e - o 6e - a ponte doppio o triplo (end on), tramite la coppia 5σ, donatore di 2e - a ponte doppio o triplo (end on + side on), tramite le coppie elettroniche 5σ + 1π, donatore di 4e - o (più raramente) 6e - μ 2 -(η 1,η 2 ) μ 3 -(μ 2 -η 1,η 2 ) μ 3 -(η 1,μ 2 -η 2 )
6 Legami M C e C O aumento di donazione σ [M(σ) CO(5σ)] 1. ordine di legame M C cresce 2. ordine di legame C O cresce poco (si toglie densità elettronica da un orbitale leggermente antilegante) N.B. ν C-O (cm -1 ) cresce poco aumento di retrodonazione π [M(π) CO(2π * )] 1. ordine di legame M C cresce 2. ordine di legame C O decresce molto (si mette densità elettronica in un orbitale fortemente antilegante) N.B. ν C-O (cm -1 ) decresce molto
7 Effetto sinergico delle interazioni σ e π la donazione σ toglie densità elettronica dalla molecola di CO rendendola miglior accettrice π, mentre la retrodonazione π aumenta la densità elettronica sulla molecola di CO rendendola miglior donatrice σ. l entità delle due interazioni si stabilizza su valori che rendono ottimale la distribuzione della densità elettronica nel complesso (il legame M-CO è quasi apolare (μ calcolato. 0,5 D M + CO), ossia è a bassa ionicità). l entità della retrodonazione π è influenzata dai seguenti fattori: natura degli altri leganti presenti quando sono buoni donatori σ e cattivi accettori π, la retrodonazione aumenta stato di ossidazione formale del metallo quando il metallo è in basso stato di ossidazione la retrodonazione aumenta I metodi sperimentali per valutare l entità delle interazioni M-C e C-O sono: a) analisi delle distanze M-C e C-O (diffrattometria di raggi x) b) analisi delle frequenze di stiramento del legame C-O (spettroscopia IR) c) analisi degli spettri di fotoionizzazione (spettroscopia PES)
8 Legame M-C Dati strutturali del complesso: fac-[mo(co) 3 (NMe 3 ) 3 ] : (d Mo-N = 2,31 Å ; d Mo-C = 1,93 Å) (in trans al CO, sono presenti leganti amminici che non danno interazioni di tipo π) 1) si ricava dapprima il r cov Mo, sottraendo, dalla distanza d Mo-N, il r cov N (0,70 Å, sp 3 ), ossia r cov Mo = d Mo-N - r cov N = 2,31 0,70 = 1,61 Å 2) al raggio r cov Mo, si aggiunge il r cov C (0,72 Å, sp), ottenendo quella che dovrebbe essere la distanza del legame singolo d Mo-C, ossia d Mo-C = r cov Mo + r cov C = 1,61 + 0,72 = 2,33 Å 3) poiché la distanza è maggiore di quella trovata d Mo-C = 1,93 Å, allora vuol dire che nel composto esaminato l ordine di legame Mo-C è maggiore di 1, ossia è presente la retrodonazione N.B. le frequenze di stiramento ν M-C sono poco utili perché sono nella zona di altri tipi di vibrazioni (es. M-CO bends)
9 Legame C-O N.B. la distanza d (C-O) varia di poco nel passare da triplo a doppio a singolo legame, pertanto è poco utile per valutare l entità della retrodonazione N.B. il numero d onda di stiramento ν C-O decresce molto all aumentare dell entità della retrodonazione perché diminuisce l ordine di legame C-O es. (serie isoelettroniche, 18 e - )(d 10, d 6 ), ν C-O decresce al diminuire dello stato di ossidazione formale del metallo: Ni(0)>Co(-1)>Fe(-2) ; Mn(+1)>Cr(0)>V(-1) N.B. l ordine di legame C-O varia anche al variare del modo di coordinazione del CO (terminale, a ponte doppio, a ponte triplo)
10 la dipendenza del numero d onda di stiramento (ν C-O ) dall entità della retrodonazione permette di usare il legante CO come molecola sonda per valutare la capacità π accettrice di altri leganti coordinati in trans al CO (fac-[mo(co) 3 L 3 ]), poiché tali leganti competono con il CO nella retrodonazione da parte del metallo: N.B. quanto minore è la retrodonazione sulla molecola di CO, tanto maggiore è la retrodonazione sul legante in trans dalla diminuzione dei numeri d onda di stiramento ν C-O si ricava che la capacità π accettrice varia nell ordine: PF 3 > PCl 3 > P(OMe) 3 > PPh 3 > CH 3 CN > dien > py e che l ordine di basicità è l inverso: PF 3 < PCl 3 < P(OMe) 3 < PPh 3 < CH 3 CN < dien < py
11 Sintesi dei complessi carbonilici 1) carbonilazione diretta con CO (g) su metallo in basso stato di ossidazione, es. Ni (s) + 4 CO (g) Ni(CO) 4 (g) (l) 2) carbonilazione riduttiva con CO (g) e OH - su metallo in medio-alto stato di ossidazione, es. CO + 4 OH - CO e H 2 O Pt e - Pt Pt 2+ + (x +1) CO + 4 OH - Pt(CO) x + CO H 2 O Reattività del legante carbonilico L atomo di C del CO coordinato è soggetto più facilmente ad attacco nucleofilo, es. [L n M-CO] + OH - [L n M-C(OH)O] - CO + OH - [C(OH)=O] - legante carbonilico legante carbossilico CO + H - [C(H)=O] - legante carbonilico legante formilico
Ione cianuro, CN - monodentato, si coordina tramite l atomo di C (coppia elettronica più
 Ione cianuro, CN - come donatore (base) σ è più forte del CO; quando agisce da legante monodentato, si coordina tramite l atomo di C (coppia elettronica più disponibile); (donatore di 2e - come anione,
Ione cianuro, CN - come donatore (base) σ è più forte del CO; quando agisce da legante monodentato, si coordina tramite l atomo di C (coppia elettronica più disponibile); (donatore di 2e - come anione,
Complessi π. Complessi alchenici (monoolefine)
 Complessi π Sono complessi in cui molecole insature usano, per l interazione con il metallo, orbitali molecolari π-leganti per la donazione L M e π*- antileganti per la retrodonazione M L. Complessi alchenici
Complessi π Sono complessi in cui molecole insature usano, per l interazione con il metallo, orbitali molecolari π-leganti per la donazione L M e π*- antileganti per la retrodonazione M L. Complessi alchenici
Leganti. Ossido di carbonio Fosfine, fosfiti Ossido di azoto Idruri Molecole organiche con sistemi Areni. Figura 5.1 Diversi tipi di leganti
 Leganti Ossido di carbonio Fosfine, fosfiti Ossido di azoto Idruri Molecole organiche con sistemi Areni Figura 5.1 Diversi tipi di leganti Leganti Figura 5.2 Le due componenti del legame metallo-carbonio
Leganti Ossido di carbonio Fosfine, fosfiti Ossido di azoto Idruri Molecole organiche con sistemi Areni Figura 5.1 Diversi tipi di leganti Leganti Figura 5.2 Le due componenti del legame metallo-carbonio
Legami multipli M=L e M L
 Legami multipli M=L e M L con leganti carbonilici e nitrosilici (L = CO, NO) l ordine di legame formale M-C e M-N varia tra 1 e 2. con altri leganti (L = O, S, NR nitreni, N, CR 2 carbeni, CR carbini)
Legami multipli M=L e M L con leganti carbonilici e nitrosilici (L = CO, NO) l ordine di legame formale M-C e M-N varia tra 1 e 2. con altri leganti (L = O, S, NR nitreni, N, CR 2 carbeni, CR carbini)
Complessi con gruppi M-O 2
 Complessi con gruppi M-O 2 complessi in cui sono presenti formalmente, come leganti, le specie ridotte dell ossigeno molecolare O 2 (12e - ), ossia: O 2 - (13e - ) legante ione superossido ; O 2 2- (14e
Complessi con gruppi M-O 2 complessi in cui sono presenti formalmente, come leganti, le specie ridotte dell ossigeno molecolare O 2 (12e - ), ossia: O 2 - (13e - ) legante ione superossido ; O 2 2- (14e
Complessi polienici. polieni non coniugati : coordinazione al metallo di parte o di tutti i. metallo secondo lo schema visto per le monoolefine.
 Complessi polienici polieni non coniugati : coordinazione al metallo di parte o di tutti i legami π dell olefina; ogni doppio legame è un interazione a sé con il metallo secondo lo schema visto per le
Complessi polienici polieni non coniugati : coordinazione al metallo di parte o di tutti i legami π dell olefina; ogni doppio legame è un interazione a sé con il metallo secondo lo schema visto per le
Caratteristiche del CO
 Metallo Carbonili Metallo carbonile omoleptico è un composto contenente solamente leganti CO Sono noti quasi tutti i metallo carbonili degli elementi del blocco d Non si conoscono quelli di Pd e Pt, stabili
Metallo Carbonili Metallo carbonile omoleptico è un composto contenente solamente leganti CO Sono noti quasi tutti i metallo carbonili degli elementi del blocco d Non si conoscono quelli di Pd e Pt, stabili
Complessi carbenici. i complessi carbenici sono complessi in cui un gruppo :CR 2 è coordinato
 Complessi carbenici i complessi carbenici sono complessi in cui un gruppo :CR 2 è coordinato ad un metallo. la reattività dei complessi carbenici, L n MCR 2, dipende dalla natura del legame M-C, che a
Complessi carbenici i complessi carbenici sono complessi in cui un gruppo :CR 2 è coordinato ad un metallo. la reattività dei complessi carbenici, L n MCR 2, dipende dalla natura del legame M-C, che a
Coordinazione ottaedrica (interazioni di tipo )
 Coordinazione ottaedrica (interazioni di tipo ) Il metallo di transizione ha 6 orbitali atomici adatti a dare interazioni di tipo (d z2, d x2-y2, s, p x, p y, p z ) e 6 orbitali atomici adatti a dare interazioni
Coordinazione ottaedrica (interazioni di tipo ) Il metallo di transizione ha 6 orbitali atomici adatti a dare interazioni di tipo (d z2, d x2-y2, s, p x, p y, p z ) e 6 orbitali atomici adatti a dare interazioni
Leganti. Un legante è una qualsiasi molecola o ione che abbia almeno un doppietto di
 Leganti Un legante è una qualsiasi molecola o ione che abbia almeno un doppietto di elettroni disponibile per una donazione. N.B. Il doppietto elettronico può essere già presente sull atomo donatore (es.
Leganti Un legante è una qualsiasi molecola o ione che abbia almeno un doppietto di elettroni disponibile per una donazione. N.B. Il doppietto elettronico può essere già presente sull atomo donatore (es.
Composti Metallorganici
 omposti etallorganici Fe 1952: risoluzione della struttura del Ferrocene (diciclopentadienilferro) 1 monoapto, 2 diapto, 3 triapto, etc.., fino a 8 octoapto Indeterminazione della classificazione basata
omposti etallorganici Fe 1952: risoluzione della struttura del Ferrocene (diciclopentadienilferro) 1 monoapto, 2 diapto, 3 triapto, etc.., fino a 8 octoapto Indeterminazione della classificazione basata
Comportamento acido-base dei complessi
 Comportamento acido-base dei complessi un complesso, saturo elettronicamente, può comportarsi da base di Lewis: [Mn -I (CO) 5 ] - + H + [HMn +I (CO) 5 ] un complesso, insaturo elettronicamente, può comportarsi
Comportamento acido-base dei complessi un complesso, saturo elettronicamente, può comportarsi da base di Lewis: [Mn -I (CO) 5 ] - + H + [HMn +I (CO) 5 ] un complesso, insaturo elettronicamente, può comportarsi
Stato di ossidazione formale del metallo
 Stato di ossidazione formale del metallo i metalli di transizione possono dare composti in cui il metallo si trova in stato di ossidazione formale variabile, da +8, [RuO 4 ], a 4, [Cr(CO) 4 ] 4- la carica
Stato di ossidazione formale del metallo i metalli di transizione possono dare composti in cui il metallo si trova in stato di ossidazione formale variabile, da +8, [RuO 4 ], a 4, [Cr(CO) 4 ] 4- la carica
ESERCIZI ESERCIZI. il basso d. aumenta lungo un periodo da sinistra verso
 ESERCIZI 1) L elettronegatività di un elemento: a è l energia che esso libera acquistando un elettrone e trasformandosi in ione negativo b è l energia necessaria per trasformarlo in ione positivo c indica
ESERCIZI 1) L elettronegatività di un elemento: a è l energia che esso libera acquistando un elettrone e trasformandosi in ione negativo b è l energia necessaria per trasformarlo in ione positivo c indica
ORBITA ORBIT LI ALI MOLECOLARI
 ORBITALI MOLECOLARI Una molecola è dotata di una serie di orbitali detti orbitali molecolari Gli elettroni risiedono negli orbitali molecolari che, in molti casi, sono distribuiti (delocalizzati) su tutta
ORBITALI MOLECOLARI Una molecola è dotata di una serie di orbitali detti orbitali molecolari Gli elettroni risiedono negli orbitali molecolari che, in molti casi, sono distribuiti (delocalizzati) su tutta
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici. Capitolo 10
 Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Anno Accademico
 Anno Accademico 2011-12 A. CERIOTTI Complesso Definizione: è una specie chimica (neutra o carica) in cui un atomo centrale (metallo di transizione o elemento non di transizione) è circondato da altri atomi
Anno Accademico 2011-12 A. CERIOTTI Complesso Definizione: è una specie chimica (neutra o carica) in cui un atomo centrale (metallo di transizione o elemento non di transizione) è circondato da altri atomi
Anno Accademico parte seconda A. CERIOTTI
 Anno Accademico 2011-12 parte seconda A. CERIOTTI CuCO 3 Cu(O) 2 + 2 Cu + 4 PF 6 + 16 C 3 C 4 [Cu(C 3 C) 4 ][PF 6 ] + 3 2 O + CO 2 Legante acetonitrile: C-C 3 Stato di ossidazione formale: Cu (+1) Configurazione
Anno Accademico 2011-12 parte seconda A. CERIOTTI CuCO 3 Cu(O) 2 + 2 Cu + 4 PF 6 + 16 C 3 C 4 [Cu(C 3 C) 4 ][PF 6 ] + 3 2 O + CO 2 Legante acetonitrile: C-C 3 Stato di ossidazione formale: Cu (+1) Configurazione
Complessi con leganti enilici
 Complessi con leganti enilici i leganti enilici sono radicali a formula generale: [H-(CH=CH) x -CH 2 -] (x 1) il legante enilico può far parte di un ciclo: i leganti più comuni di questo tipo sono: il
Complessi con leganti enilici i leganti enilici sono radicali a formula generale: [H-(CH=CH) x -CH 2 -] (x 1) il legante enilico può far parte di un ciclo: i leganti più comuni di questo tipo sono: il
Classi di composti: derivati carbonilici
 Classi di composti: derivati carbonilici Bande di controllo/conferma zona di stiramento del carbonile 59 Tabella sinottica della posizione della banda di stiramento del carbonile e della posizione delle
Classi di composti: derivati carbonilici Bande di controllo/conferma zona di stiramento del carbonile 59 Tabella sinottica della posizione della banda di stiramento del carbonile e della posizione delle
Classi di composti: derivati carbonilici
 Classi di composti: derivati carbonilici Bande di controllo/conferma zona di stiramento del carbonile 62 Tabella sinottica della posizione della banda di stiramento del carbonile e della posizione delle
Classi di composti: derivati carbonilici Bande di controllo/conferma zona di stiramento del carbonile 62 Tabella sinottica della posizione della banda di stiramento del carbonile e della posizione delle
Teoria del campo cristallino corretta (ACFT) (Teoria del campo dei leganti)
 Teoria del campo cristallino corretta (ACFT) (Teoria del campo dei leganti) la teoria del campo cristallino (CFT) adotta un modello fisico irreale considerando i leganti come cariche puntiformi un modello
Teoria del campo cristallino corretta (ACFT) (Teoria del campo dei leganti) la teoria del campo cristallino (CFT) adotta un modello fisico irreale considerando i leganti come cariche puntiformi un modello
Chimica Inorganica Biologica I composti di coordinazione Richiami di Chimica - Acidi e Basi di Lewis
 I composti di coordinazione Richiami di Chimica - Acidi e Basi di Lewis Acido (LA) Base (LB) accettore di una coppia di elettroni donatore di una coppia di elettroni HOMO LUMO Highest Occupied Molecular
I composti di coordinazione Richiami di Chimica - Acidi e Basi di Lewis Acido (LA) Base (LB) accettore di una coppia di elettroni donatore di una coppia di elettroni HOMO LUMO Highest Occupied Molecular
Teoria dell Orbitale Molecolare
 Teoria dell Orbitale Molecolare Un orbitale molecolare è il risultato della combinazione lineare degli orbitali atomici appartenenti agli atomi che costituiscono la molecola; questi orbitali molecolari
Teoria dell Orbitale Molecolare Un orbitale molecolare è il risultato della combinazione lineare degli orbitali atomici appartenenti agli atomi che costituiscono la molecola; questi orbitali molecolari
un legame covalente due legami covalenti? tre legami covalenti due legami covalenti un legame covalente
 e C N un legame covalente due legami covalenti? tre legami covalenti O F Ne 1s 2s 2p due legami covalenti un legame covalente C 1s 2s 2p ibridazione quattro legami covalenti Cariche Formali Usando le strutture
e C N un legame covalente due legami covalenti? tre legami covalenti O F Ne 1s 2s 2p due legami covalenti un legame covalente C 1s 2s 2p ibridazione quattro legami covalenti Cariche Formali Usando le strutture
Corso di Laurea in CHIMICA (L.T.) Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule
 orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
DEL LEGAME DI VALENZA
 Chimica Silvia LICOCCIA Professore Ordinario di Fondamenti Chimici per le Tecnologie Dipartimento di Scienze e Tecnologie Chimiche Università di Roma Tor Vergata TEORIA DEL LEGAME DI VALENZA Teoria del
Chimica Silvia LICOCCIA Professore Ordinario di Fondamenti Chimici per le Tecnologie Dipartimento di Scienze e Tecnologie Chimiche Università di Roma Tor Vergata TEORIA DEL LEGAME DI VALENZA Teoria del
Complessi benzenici. difenile, presente anche in anelli condensati, es. naftalene, fenantrene.
 Complessi benzenici il legante è l anello benzenico [C 6 R 6 ], es. benzene, 1,3,5-trimetilbenzene, difenile, presente anche in anelli condensati, es. naftalene, fenantrene. i complessi benzenici possono
Complessi benzenici il legante è l anello benzenico [C 6 R 6 ], es. benzene, 1,3,5-trimetilbenzene, difenile, presente anche in anelli condensati, es. naftalene, fenantrene. i complessi benzenici possono
INTERPRETAZIONE DEGLI SPETTRI IR
 INTERPRETAZIONE DEGLI SPETTRI IR Anche se non esistono gruppi di regole per la interpretazione completa degli spettri infrarossi, si è trovato che possono essere utili alcune linee-guida generali. 1. Cominciare
INTERPRETAZIONE DEGLI SPETTRI IR Anche se non esistono gruppi di regole per la interpretazione completa degli spettri infrarossi, si è trovato che possono essere utili alcune linee-guida generali. 1. Cominciare
LA STRUTTURA DELLE MOLECOLE. Le Molecole Poliatomiche
 LA STRUTTURA DELLE MOLECOLE Le Molecole Poliatomiche LE MOLECOLE POLIATOMICE Le molecole poliatomiche sono quelle molecole che sono composte da più di due atomi e contengono nella maggior parte dei casi
LA STRUTTURA DELLE MOLECOLE Le Molecole Poliatomiche LE MOLECOLE POLIATOMICE Le molecole poliatomiche sono quelle molecole che sono composte da più di due atomi e contengono nella maggior parte dei casi
REAZIONI DEGLI ALCHENI
 REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Complessi alchilici e arilici
 Complessi alchilici e arilici Composti organometallici con legami singoli M-C. E M-C = 125-270 KJ/mole in un generico complesso L x M-CR y (M metallo di transizione) E E-C = 140-360 KJ/mole in un generico
Complessi alchilici e arilici Composti organometallici con legami singoli M-C. E M-C = 125-270 KJ/mole in un generico complesso L x M-CR y (M metallo di transizione) E E-C = 140-360 KJ/mole in un generico
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L
 IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA L elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il di Lewis LEGAME DI VALENZA (VB) Sviluppo quantomeccanico
Spettri IR. Spettri IR: come si interpretano gli spettri IR. Linee guida per interpretare gli spettri IR
 Spettri IR Spettri IR: come si interpretano gli spettri IR Linee guida per interpretare gli spettri IR Anche se non esistono gruppi di regole per la interpretazione completa degli spettri infrarossi, si
Spettri IR Spettri IR: come si interpretano gli spettri IR Linee guida per interpretare gli spettri IR Anche se non esistono gruppi di regole per la interpretazione completa degli spettri infrarossi, si
SPETTROMETRIA di ASSORBIMENTO
 SPETTROMETRIA di ASSORBIMENTO Premesse 1) L energia è quantizzata: E = h 2) L assorbimento della radiazione incidente (onde elettromagnetiche) da parte del sistema è quindi un processo quantizzato: ΔE
SPETTROMETRIA di ASSORBIMENTO Premesse 1) L energia è quantizzata: E = h 2) L assorbimento della radiazione incidente (onde elettromagnetiche) da parte del sistema è quindi un processo quantizzato: ΔE
Elettroni del metallo negli orbitali d
 Elettroni del metallo negli orbitali d Complessi ottaedrici i primi 3 elettroni entrano nei 3 orbitali t 2g, secondo la regola di Hund il quarto elettrone ha due possibilità: entrare in un orbitale e g,
Elettroni del metallo negli orbitali d Complessi ottaedrici i primi 3 elettroni entrano nei 3 orbitali t 2g, secondo la regola di Hund il quarto elettrone ha due possibilità: entrare in un orbitale e g,
Anno Accademico parte seconda A. CERIOTTI
 Anno Accademico 2011-12 parte seconda A. CERIOTTI CuCO 3 Cu(O) 2 + 2 Cu + 4 PF 6 + 16 C 3 C 4 [Cu(C 3 C) 4 ][PF 6 ] + 3 2 O + CO 2 Legante acetonitrile: C-C 3 Stato di ossidazione formale: Cu (+1) Configurazione
Anno Accademico 2011-12 parte seconda A. CERIOTTI CuCO 3 Cu(O) 2 + 2 Cu + 4 PF 6 + 16 C 3 C 4 [Cu(C 3 C) 4 ][PF 6 ] + 3 2 O + CO 2 Legante acetonitrile: C-C 3 Stato di ossidazione formale: Cu (+1) Configurazione
La Teoria del Legame di Valenza
 La Teoria del Legame di Valenza Un legame covalente tra due atomi A e B viene spiegato in termini di sovrapposizione tra due orbitali atomici appartenenti ai due atomi e descrittivi dei due elettroni di
La Teoria del Legame di Valenza Un legame covalente tra due atomi A e B viene spiegato in termini di sovrapposizione tra due orbitali atomici appartenenti ai due atomi e descrittivi dei due elettroni di
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Il Legame Chimico e la Struttura Molecolare
 A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
COMPLESSI DEI METALLI DI TRANSIZIONE LEZIONE 7
 COMPLESSI DEI METALLI DI TRANSIZIONE LEZIONE 7 METALLI DI TRANSIZIONE Elementi che formano almeno uno ione con un sottoguscio d parzialmente riempito di elettroni Configurazione elettronica (n-1)d x ns
COMPLESSI DEI METALLI DI TRANSIZIONE LEZIONE 7 METALLI DI TRANSIZIONE Elementi che formano almeno uno ione con un sottoguscio d parzialmente riempito di elettroni Configurazione elettronica (n-1)d x ns
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 14 Le nuove teorie di legame 3 Sommario 1. I limiti della teoria di Lewis 2. Il legame chimico secondo la meccanica quantistica
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 14 Le nuove teorie di legame 3 Sommario 1. I limiti della teoria di Lewis 2. Il legame chimico secondo la meccanica quantistica
STRUTTURA DEGLI OSSIACIDI
 Chimica Silvia LICOCCIA Professore Ordinario di Fondamenti Chimici per le Tecnologie Dipartimento di Scienze e Tecnologie Chimiche Università di Roma Tor Vergata STRUTTURA DEGLI OSSIACIDI Orbitali ibridi
Chimica Silvia LICOCCIA Professore Ordinario di Fondamenti Chimici per le Tecnologie Dipartimento di Scienze e Tecnologie Chimiche Università di Roma Tor Vergata STRUTTURA DEGLI OSSIACIDI Orbitali ibridi
CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1
 CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1 ACIDITÀ Ragionare sulla base coniugata: quanto più la base coniugata è stabilizzata (è debole) tanto più l'acido sarà forte. ASPETTI CHE DETERMINANO LA STABILITA
CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1 ACIDITÀ Ragionare sulla base coniugata: quanto più la base coniugata è stabilizzata (è debole) tanto più l'acido sarà forte. ASPETTI CHE DETERMINANO LA STABILITA
Benzene e Composti Aromatici
 Benzene e Composti Aromatici Contenuti della lezione: Il benzene e i requisiti per l aromaticità Nomenclatura di benzeni mono- e di-sostituiti Composti aromatici diversi dal benzene: IPA e eteroaromatici
Benzene e Composti Aromatici Contenuti della lezione: Il benzene e i requisiti per l aromaticità Nomenclatura di benzeni mono- e di-sostituiti Composti aromatici diversi dal benzene: IPA e eteroaromatici
I - < Br - < S 2- < SCN - <Cl - < F - < UREA, OH - < ox, O 2- < H 2 O < NCS - < py < NH 3 < en < bpy, phen < NO 2- < CN - < CO.
 I - < Br - < S 2- < SCN -
I - < Br - < S 2- < SCN -
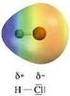
I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo
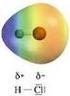 La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
Anno Accademico parte prima A. CERIOTTI
 Anno Accademico 2011-12 parte prima A. CERIOTTI Figura 1 - Struttura di H3B-P(C6H5)3 H H B base (L) H B L H H H sp 2 trigonale planare sp 3 tetraedro Figura 2 - BH 3 come acido di Lewis P Figura 3 - PPh
Anno Accademico 2011-12 parte prima A. CERIOTTI Figura 1 - Struttura di H3B-P(C6H5)3 H H B base (L) H B L H H H sp 2 trigonale planare sp 3 tetraedro Figura 2 - BH 3 come acido di Lewis P Figura 3 - PPh
6. I gruppi funzionali
 6. I gruppi funzionali Si definisce GRUPP FUZIALE (W) un eteroatomo (o un aggruppamento di atomi) che, sostituito ad un idrogeno (o a un legame -) di un alcano, ne modifica la caratteristiche chimicofisiche
6. I gruppi funzionali Si definisce GRUPP FUZIALE (W) un eteroatomo (o un aggruppamento di atomi) che, sostituito ad un idrogeno (o a un legame -) di un alcano, ne modifica la caratteristiche chimicofisiche
Complessi alcossidici e arilossidici
 Complessi alcossidici e arilossidici gli ioni metallici in alcool sono solvatati a dare complessi che possono esistere come alcosso-complessi secondo l equilibrio di dissociazione: M n+ (ROH) [M(OR)] (n-1)+
Complessi alcossidici e arilossidici gli ioni metallici in alcool sono solvatati a dare complessi che possono esistere come alcosso-complessi secondo l equilibrio di dissociazione: M n+ (ROH) [M(OR)] (n-1)+
Formazione di complessi
 Formazione di complessi Struttura degli ioni complessi Gli ioni complessi sono formati da un catione metallico legato ad anioni come OH -, Cl -, CN -, SCN -, o a molecole neutre come H 2 O, NH 3., detti
Formazione di complessi Struttura degli ioni complessi Gli ioni complessi sono formati da un catione metallico legato ad anioni come OH -, Cl -, CN -, SCN -, o a molecole neutre come H 2 O, NH 3., detti
Carbeni. :CH 2 :CR 2 = alchilideni
 Carbeni :CH 2 :CR 2 = alchilideni Sostituenti p-donatori stabilizzano lo stato di singoletto 1964: primo complesso metallo-carbene (Fischer) metossifenilmetilene tungsteno(0) pentacarbonile 1974: primo
Carbeni :CH 2 :CR 2 = alchilideni Sostituenti p-donatori stabilizzano lo stato di singoletto 1964: primo complesso metallo-carbene (Fischer) metossifenilmetilene tungsteno(0) pentacarbonile 1974: primo
Introduzione alla Chimica Organica V Ed.
 William H. Brown - Thomas Poon Introduzione alla Chimica Organica V Ed. Capitolo 2 2.1 Cosa sono gli acidi e le basi secondo Arrhenius? Un Acido di Arrhenius è una sostanze che sciolta in acqua produce
William H. Brown - Thomas Poon Introduzione alla Chimica Organica V Ed. Capitolo 2 2.1 Cosa sono gli acidi e le basi secondo Arrhenius? Un Acido di Arrhenius è una sostanze che sciolta in acqua produce
Alcheni. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcheni Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcheni Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Il Legame Chimico e la Struttura Molecolare
 A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
Stabilità dei complessi
 Stabilità dei complessi v stabilità o instabilità termodinamica di un complesso è una misura del grado in cui un complesso è presente all equilibrio insieme alle sue specie costituenti, ossia allo ione
Stabilità dei complessi v stabilità o instabilità termodinamica di un complesso è una misura del grado in cui un complesso è presente all equilibrio insieme alle sue specie costituenti, ossia allo ione
Complementi di Chimica Organica. Composti Aromatici: Benzene C 6 H 6 (1825) (1865) Friedrich August Kekulé
 Composti Aromatici: Benzene C 6 6 (1825) (1865) Friedrich August Kekulé Composti Aromatici: Benzene, energia di coniugazione = -119.5 KJ/mol (-119.2 x 3 = -357.6) = -208.2 KJ/mol -357.6 KJ/mol (-208.2
Composti Aromatici: Benzene C 6 6 (1825) (1865) Friedrich August Kekulé Composti Aromatici: Benzene, energia di coniugazione = -119.5 KJ/mol (-119.2 x 3 = -357.6) = -208.2 KJ/mol -357.6 KJ/mol (-208.2
Composti carbonilici. Chimica Organica II
 Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Chimica organica Chimica dei composti del carbonio. Nelle molecole organiche oltre al carbonio sono presenti pochi altri elementi: H, O, N, P,
 himica organica himica dei composti del carbonio. Nelle molecole organiche oltre al carbonio sono presenti pochi altri elementi:,, N, P, S, alogeni. Le molecole organiche presentano particolari raggruppamenti
himica organica himica dei composti del carbonio. Nelle molecole organiche oltre al carbonio sono presenti pochi altri elementi:,, N, P, S, alogeni. Le molecole organiche presentano particolari raggruppamenti
PROPRIETA FISICHE DEI COMPOSTI ORGANICI
 PRPRIETA FISICE DEI CMPSTI RGAICI I composti organici sono molto numerosi a causa del fatto che il legame σ tra due atomi di carbonio è particolarmente forte, a causa delle piccole dimensioni e del valore
PRPRIETA FISICE DEI CMPSTI RGAICI I composti organici sono molto numerosi a causa del fatto che il legame σ tra due atomi di carbonio è particolarmente forte, a causa delle piccole dimensioni e del valore
delle interazioni accoppiate dell intorno dei due atomi nell ambito della molecola.
 FATTORI CHE INFLUENZANO LA FREQUANZA DI ASSORBIMENTO Torniamo ora alla legge di Hooke: : abbiamo detto che questa relazione ci permette di conoscere la frequenza alla quale assorbirà un oscillatore di
FATTORI CHE INFLUENZANO LA FREQUANZA DI ASSORBIMENTO Torniamo ora alla legge di Hooke: : abbiamo detto che questa relazione ci permette di conoscere la frequenza alla quale assorbirà un oscillatore di
Cr Mn Fe Co Ni Cu Zn. Chimica Inorganica Biologica Vita ed Energia
 Vita ed Energia I processi chimici alla base della chimica della vita sono due: Uso dell E solare per produrre materia e O 2 da CO 2 e H 2 O Produzione di E mediante ossidazione di materia con formazione
Vita ed Energia I processi chimici alla base della chimica della vita sono due: Uso dell E solare per produrre materia e O 2 da CO 2 e H 2 O Produzione di E mediante ossidazione di materia con formazione
Roberta Pierattelli. Metalli in Biologia. Qualche richiamo di chimica generale e inorganica
 Roberta Pierattelli Metalli in Biologia Qualche richiamo di chimica generale e inorganica Le proprietà periodiche n =1 n =2 n =3 n =4 n =5 n =6 n =7 Il numero del gruppo corrisponde alla somma degli elettroni
Roberta Pierattelli Metalli in Biologia Qualche richiamo di chimica generale e inorganica Le proprietà periodiche n =1 n =2 n =3 n =4 n =5 n =6 n =7 Il numero del gruppo corrisponde alla somma degli elettroni
Gli Alcheni. Ibridazione sp 2. I legami chimici degli alcheni
 Gli Alcheni 2p Energia Ibridazione sp 2 sp 2 1s I tre orbitali ibridi sono disposti su un piano secondo una geometria trigonaleplanare con angoli di 120. L'orbitale 2p che non partecipa all'ibridazione
Gli Alcheni 2p Energia Ibridazione sp 2 sp 2 1s I tre orbitali ibridi sono disposti su un piano secondo una geometria trigonaleplanare con angoli di 120. L'orbitale 2p che non partecipa all'ibridazione
Bassa Energia Alta Energia
 L assorbimento di fotoni causa variazioni nelle vibrazioni molecolari hν Bassa Energia Alta Energia Vibrazioni Molecolari Atomi legati si muovono nello spazio Un ciclo vibrazionale ogni ~10-15 secondi
L assorbimento di fotoni causa variazioni nelle vibrazioni molecolari hν Bassa Energia Alta Energia Vibrazioni Molecolari Atomi legati si muovono nello spazio Un ciclo vibrazionale ogni ~10-15 secondi
COMPOSTI AROMATICI. Formula C 6 H 6
 COMPOSTI AROMATICI Gli alcani ed alcheni hanno diversa reattività chimica. Vi è un altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni Sono i composti
COMPOSTI AROMATICI Gli alcani ed alcheni hanno diversa reattività chimica. Vi è un altra classe di idrocarburi che pur essendo insaturi hanno un comportamento chimico diverso dagli alcheni Sono i composti
Lezione n. 26. Principi generali della spettroscopia IR. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 26 Principi generali della spettroscopia IR 02/03/2008 Antonino Polimeno 1 Spettroscopia infrarossa (1) - La spettroscopia infrarossa studia
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 26 Principi generali della spettroscopia IR 02/03/2008 Antonino Polimeno 1 Spettroscopia infrarossa (1) - La spettroscopia infrarossa studia
La teoria del legame di valenza
 La teoria del legame di valena 1 Limiti della teoria di Lewis Nessuna informaione quantitativa: Energia di legame; Lunghea del legame; Geometria molecolare. Informaioni quantitative MECCNIC ONDULTORI La
La teoria del legame di valena 1 Limiti della teoria di Lewis Nessuna informaione quantitativa: Energia di legame; Lunghea del legame; Geometria molecolare. Informaioni quantitative MECCNIC ONDULTORI La
Riassunto delle lezioni precedenti..
 Riassunto delle lezioni precedenti.. Chimica del Carbonio L atomo di Carbonio può formare legami singoli, legami doppi e legami tripli IDROCARBURI formati solo da carbonio e idrogeno Si dividono in 3 classi:
Riassunto delle lezioni precedenti.. Chimica del Carbonio L atomo di Carbonio può formare legami singoli, legami doppi e legami tripli IDROCARBURI formati solo da carbonio e idrogeno Si dividono in 3 classi:
2. LA STRUTTURA DEI COMPOSTI ORGANICI E LE CARATTERISTICHE CHIMICO- FISICHE
 Università degli Studi di Bari Facoltà di Farmacia Corso di Laurea in Tecniche Erboristiche A.A. 2011-2012 Chimica Organica Prof. Giuseppe Gerardo Carbonara Finalità. Scopo del corso è quello di evidenziare
Università degli Studi di Bari Facoltà di Farmacia Corso di Laurea in Tecniche Erboristiche A.A. 2011-2012 Chimica Organica Prof. Giuseppe Gerardo Carbonara Finalità. Scopo del corso è quello di evidenziare
LA CHIMICA DEL CARBONIO
 LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
Le molecole ed il legame chimico
 TEORIA DELL ORBITALE MOLECOLARE PER MOLECOLE COMPLESSE Per predire molte delle proprietà delle molecole biatomiche si può eleborare una teoria semplice che ricalca il modello della teoria dell elettrone
TEORIA DELL ORBITALE MOLECOLARE PER MOLECOLE COMPLESSE Per predire molte delle proprietà delle molecole biatomiche si può eleborare una teoria semplice che ricalca il modello della teoria dell elettrone
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
L ONDA ELETTROMAGNETICA UNITA DI MISURA E DEFINIZIONI. ν ν. λ =
 IR: Teoria Campo elettrico L ONDA ELETTROMAGNETICA Lunghezza d onda Direzione di propagazione Campo magnetico Lunghezza d onda (cm) Numero d onda (cm -1 ) UNITA DI MISURA E DEFINIZIONI c λ = ν ν ν = =
IR: Teoria Campo elettrico L ONDA ELETTROMAGNETICA Lunghezza d onda Direzione di propagazione Campo magnetico Lunghezza d onda (cm) Numero d onda (cm -1 ) UNITA DI MISURA E DEFINIZIONI c λ = ν ν ν = =
GENERALITA SUI LEGAMI CHIMICI
 GENERALITA SUI LEGAMI IMII Legame ionico Legami forti Legame covalente Legami Legame metallico Legami deboli 1 Regola dell ottetto (Lewis,, 1916) Lewis: rappresentazione elettroni di valenza con punti
GENERALITA SUI LEGAMI IMII Legame ionico Legami forti Legame covalente Legami Legame metallico Legami deboli 1 Regola dell ottetto (Lewis,, 1916) Lewis: rappresentazione elettroni di valenza con punti
LO SPETTRO ELETTROMAGNETICO
 LO SPETTRO ELETTROMAGNETICO cresce cresce Raggi γ Raggi X UV IR Micio onde Onde radio Medio corte medie lunghe Processo: Eccitazione dei nuclei atomici Lontano Vicino Lontano Transizione degli e-interni
LO SPETTRO ELETTROMAGNETICO cresce cresce Raggi γ Raggi X UV IR Micio onde Onde radio Medio corte medie lunghe Processo: Eccitazione dei nuclei atomici Lontano Vicino Lontano Transizione degli e-interni
Legame e struttura molecolare
 2016 2017 CCS Biologia CCS-Scienze Geologiche 1 Legame e struttura molecolare Orbitali atomici Molecole Cap 9. 1-3, 15-16, 18, 21-23, 40 CONSIDERAZIONI PRELIMINARI 2 Le strutture di Lewis e la teoria VSEPR
2016 2017 CCS Biologia CCS-Scienze Geologiche 1 Legame e struttura molecolare Orbitali atomici Molecole Cap 9. 1-3, 15-16, 18, 21-23, 40 CONSIDERAZIONI PRELIMINARI 2 Le strutture di Lewis e la teoria VSEPR
1. COS È LA CHIMICA ORGANICA?
 Università degli Studi di Bari Dipartimento di Farmacia Scienze del Farmaco Corso di Laurea in Tecniche Erboristiche A.A. 2013-2014 Chimica Organica Prof. Giuseppe Gerardo Carbonara Finalità. Scopo del
Università degli Studi di Bari Dipartimento di Farmacia Scienze del Farmaco Corso di Laurea in Tecniche Erboristiche A.A. 2013-2014 Chimica Organica Prof. Giuseppe Gerardo Carbonara Finalità. Scopo del
Isomerie. Isomeri sono composti (non elementi) aventi la stessa composizione stechiometrica e
 Isomerie Isomeri sono composti (non elementi) aventi la stessa composizione stechiometrica e uguale massa molare. Isotopomeri sono composti (non elementi) aventi la stessa composizione stechiometrica ma
Isomerie Isomeri sono composti (non elementi) aventi la stessa composizione stechiometrica e uguale massa molare. Isotopomeri sono composti (non elementi) aventi la stessa composizione stechiometrica ma
TEORIA DEGLI ORBITALI MOLECOLARI (MO).
 TEORIA DEGLI ORBITALI MOLECOLARI (MO). La teoria MO rappresenta l approccio quantomeccanico alle molecole in maniera analoga a quanto visto per la teoria atomica. Gli MO si considerano derivati da combinazioni
TEORIA DEGLI ORBITALI MOLECOLARI (MO). La teoria MO rappresenta l approccio quantomeccanico alle molecole in maniera analoga a quanto visto per la teoria atomica. Gli MO si considerano derivati da combinazioni
LA CHIMICA DEL CARBONIO
 LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) colesterolo
LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) colesterolo
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
I composti organici. Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H)
 I composti organici Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H) Gli idrocarburi Gli Alcani Costituiti da uno o più atomi di carbonio legati tra
I composti organici Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H) Gli idrocarburi Gli Alcani Costituiti da uno o più atomi di carbonio legati tra
Esercizi sui Complessi Metallici
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Complessi Metallici Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizi
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Complessi Metallici Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizi
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta della struttura elettronica delle molecole, come quella
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta della struttura elettronica delle molecole, come quella
Contenuti della lezione:
 Alcheni e Alchini Contenuti della lezione: Aspetti generali e nomenclatura di alcheni e alchini Uso delle nomenclature cis/trans e E/Z per gli alcheni di-sostituiti e tri- o tetrasostituiti rispetivamente
Alcheni e Alchini Contenuti della lezione: Aspetti generali e nomenclatura di alcheni e alchini Uso delle nomenclature cis/trans e E/Z per gli alcheni di-sostituiti e tri- o tetrasostituiti rispetivamente
Complessi ciclopentadienilici. il primo composto di questo tipo è stato il ferrocene, ossia il
 Complessi ciclopentadienilici il primo composto di questo tipo è stato il ferrocene, ossia il bis(ciclopentadienil)ferro(0) [Fe( 5 -C 5 H 5 ) 2 ] il legante è il radicale neutro ciclopentadienile [C 5
Complessi ciclopentadienilici il primo composto di questo tipo è stato il ferrocene, ossia il bis(ciclopentadienil)ferro(0) [Fe( 5 -C 5 H 5 ) 2 ] il legante è il radicale neutro ciclopentadienile [C 5
ASSORBIMENTO UV-VIS. Atomo
 ASSRBIMET UV-VIS 1 Atomo Molecola E 3 E 2 Livelli elettronici (interazioni UV) A Tipi di vibrazione molecolare: E 1 E 0 sottolivelli vibrazionali (interazioni IR) sottolivelli rotazionali (interazioni
ASSRBIMET UV-VIS 1 Atomo Molecola E 3 E 2 Livelli elettronici (interazioni UV) A Tipi di vibrazione molecolare: E 1 E 0 sottolivelli vibrazionali (interazioni IR) sottolivelli rotazionali (interazioni
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
COMPOSTI AROMATICI POLICICLICI
 CHIMICA DEI COMPOSTI AROMATICI POLICICLICI CHIMICA DI PIRROLO, FURANO E TIOFENE CHIMICA DI IMIDAZOLI, OSSAZOLI E TIAZOLI CHIMICA DI ISOSSAZOLI, PIRAZOLI, ISOTIAZOLI LEZIONE 5 COMPOSTI AROMATICI POLICICLICI
CHIMICA DEI COMPOSTI AROMATICI POLICICLICI CHIMICA DI PIRROLO, FURANO E TIOFENE CHIMICA DI IMIDAZOLI, OSSAZOLI E TIAZOLI CHIMICA DI ISOSSAZOLI, PIRAZOLI, ISOTIAZOLI LEZIONE 5 COMPOSTI AROMATICI POLICICLICI
Tabella 1.3 Raggi delle cavità (unità r) dove le distanze M-M sono 2r
 Tabella 1.3 Raggi delle cavità (unità r) dove le distanze M-M sono 2r Geometria Rapporto Tetraedro 0,225 Ottaedro 0,414 Prisma trigonale 0,528 Ottaedro cappato 0,592 Antiprisma quadrato 0,645 Dodecaedro
Tabella 1.3 Raggi delle cavità (unità r) dove le distanze M-M sono 2r Geometria Rapporto Tetraedro 0,225 Ottaedro 0,414 Prisma trigonale 0,528 Ottaedro cappato 0,592 Antiprisma quadrato 0,645 Dodecaedro
Teoria degli orbitali. Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale.
 Teoria degli orbitali Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale. orbitale nucleo STPA-Chimica Organica 1 L orbitale 1s Gli
Teoria degli orbitali Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale. orbitale nucleo STPA-Chimica Organica 1 L orbitale 1s Gli
Alcoli e Tioli. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcoli e Tioli Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcoli e Tioli Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Metodi basati sulla meccanica quantistica
 Metodi basati sulla meccanica quantistica La descrizione più corretta della struttura elettronica delle molecole, come quella degli atomi, è basata sulla meccanica quantistica. Esistono due principali
Metodi basati sulla meccanica quantistica La descrizione più corretta della struttura elettronica delle molecole, come quella degli atomi, è basata sulla meccanica quantistica. Esistono due principali
