UNITA DI MISURA DEL CALORE
|
|
|
- Ippolito Guglielmi
- 5 anni fa
- Visualizzazioni
Transcript
1 UNITA DI MISURA DEL CALORE S.I >>> Unita pratica: caloria Esercizio Trasformare 2500 cal in J
2 CAMBIAMENTI DI STATO I cambiamenti di stato avvengono a temperatura costante!
3 CALORE LATENTE Il calore fornito durante fusione/evaporazione/sublimazione non produce un aumento di temperatura ma e utilizzato per spezzare il legami che tengono unite le molecole (cambia l energia potenziale delle molecole, non la loro energia cinetica). Nei passaggi inversi (condenzazione/solidificazione/brinamento) il sistema ricede la enegia acquisita in precedenza. Non si ha pero una diminuzione della temperatura ma il rafforzamento delle frze di coesione tra le molecole del materiale.
4 CALORE LATENTE La quantita di calore ceduta o assorbita durante un cambiamento di stato si chiama calore latente Q = k dipende dalla sostanza e dalla trasformazione. ESERCIZIO Calcolare la quantita di calore per fondere 3 kg di ghiaccio (k f = 80 cal/g)
5 EVAPORAZIONE E CONDENSAZIONE A pressione atmosferica avvengono ad una temperatura caratteristica (100 C per l acqua) quando la transizione coinvolge tutto il volume di sostanza. Possono avvenire anche a temperature inferiori ma coinvolgono solo le molecole sulla superficie del liquido
6 METABOLISMO
7 METABOLISMO Insieme delle reazioni biochimiche all interno dell organismo necessarie per il sostentamento delle funzioni vitali e per l attuazione di lavoro meccanico verso l esterno Alimenti Ossidazione L uomo e omeotermo ALIMENTAZIONE TERMOREGOLAZIONE
8 METABOLISMO BASALE Minimo consumo energetico richiesto dai processi vitali: funzione cardiaca, respiratoria, ghiandolare e nervosa tono muscolare mantenimento temperatura corporea
9 METABOLISMO ADDIZIONALE Lavoro muscolare Lavoro mentale Digestione TOTALE = BASALE + ADDIZIONALE ~ 2500 kcal/die
10 ALIMENTAZIONE L ossidazione delle sostanze organiche (carboidrati, proteine e grassi) libera energia Es. C 6 H 12 O 6 + 6O 2 6 CO H 2 O kcal
11 POTERE CALORICO Proteine/zuccheri: 4.1 kcal/g Grassi: 9.3 kcal/g Quanti grammi di zucchero soddisfano il fabbisogno metabolico totale di 2500 kcal?
12 Esercizio Una persona a dieta svolge un attivita fisica normale consumando 2500 kcal/die mentre il suo regime alimentare e di sole 1500 kcal. Se la differenza e compensata dai soli grassi di riserva (1 g di grasso fornisce 9.3 kcal), di quanti kg calera in un mese?
13 POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita di tempo necessaria per il mantenimento dei processi vitali e detta potenza metabolica basale (BMR). Il suo valore in media per una persona adulta e 1.2 W/kg.
14 RENDIMENTO Per compiere un lavoro meccanico L il nostro organismo consuma un energia E CONS > L. Definiamo rendimento: La potenza metabolica sviluppata durante un attivita motoria si determina come:
15 ESERCIZIO Si calcoli la potenza metabolica di una donna di massa 50 kg che scala una montagna alta 1000 m in 4 h supponendo un rendimento del suo corpo pari al 25%.
16 TERMOREGOLAZIONE Perdita di calore dall epidermide Perdita di calore con vapore acqueo e aria espirata Evaporazione del sudore Bassa temperatura ambiente: vasocostrizione, pelle d oca, brividi Alta temperatura ambiente: vasodilatazione, sudore
17 Esercizio Il calore latente di evaporazione dell acqua a 37 o C vale 580 cal/g. Si determini quante kcal vengono smaltite attraverso 10 g di sudore.
18 DIFFUSIONE E OSMOSI
19 PESO MOLECOLARE e MOLE Le masse di atomi e molecole sono misurate in uma 1 uma = kg (massa di un atomo di 12 C = 12 uma) Il peso molecolare di una molecola e la somma delle masse degli atomi che la compongono. Es: CO 2 m(c)= 12 uma M(O)= uma Una mole di una sostanza indica la quantita di quella sostanza che, espressa in grammi, e numericamente uguale al suo peso molecolare. Una mole di sostanza contiene un numero di Avogadro di molecole (N A = )
20 ESEMPIO Si calcoli la massa (in kg) corrispondente ad una mole di acqua (H 2 O) glucosio (C 6 H 12 O 6 ) m[h] = 1,008 uma m[o] = 15,999 uma m[c] = 12 uma
21 SOLUZIONI Sono miscele omogenee di due o più sostanze; quella presente in quantità maggiore è definita solvente, le altre soluti. Si definisce concentrazione molare (o molarita ) n = numero di moli di soluto V = volume della soluzione
22 MECCANISMI DI TRASPORTO PASSIVO Gli organismi viventi esplicano le loro funzioni biologiche regolando l assorbimento e l eliminazione di sostanze attraverso membrane che separano soluzioni di diversa composizione. I meccanismi di trasporto attraverso le membrane possono essere di tipo: Attivo coinvolgono processi biochimici (es. membrane renali) Passivo coinvolgono processi fisici: diffusione, filtrazione, osmosi
23 DIFFUSIONE LIBERA Trasporto di materia tra punti di un sistema liquido o gassoso i cui componenti sono presenti in concentrazioni diverse Stato iniziale: C A > C B A B Soluto: A B Solvente: B A All equilibrio: C uniforme Il moto di agitazione termica ( le molecole si muovono in ogni direzione in modo casuale) e il principale responsabile della diffusione. I processi di diffusione si verificano anche attraverso membrane permeabili
24 FILTRAZIONE Se ai lati di una membrana c e una differenza di pressione, si ha un flusso di solvente (ed eventualmente di soluto) dalla soluzione a pressione maggiore verso quella a pressione minore P 1 P 2 < P 1 Il flusso e tanto maggiore quanto maggiore e la differenza di pressione P 1 P 2 La presenza di una differenza di pressione si puo incrementare o diminuire il flusso di soluto dovuto alla differenza di concentrazione
25 OSMOSI Diffusione selettiva attraverso una membrana semipermeabile (permeabile al solvente ma non al soluto) Il solvente si muove dal compartimento a concentrazione minore verso quello a concentrazione maggiore La pressione efficace con cui la soluzione di sinistra richiama solvente attraverso la membrana e detta pressione osmotica
26 LEGGE DI VAN T OFF PER LE SOLUZIONI DILUITE La pressione osmotica di una soluzione diluita si calcola come: R= l atm/(mole K) = 8.31 J/(mole K) Unita di misura in S.I. >>>>
27 OSMOSI NEI SISTEMI BIOLOGICI Molte membrane biologiche sono selettive pareti capillari e intestinali membrane alveolare membrana cellulare tubuli renali La diffusione di sostanze dipende dalla differenza di pressione idraulica e osmotica tra i due lati della parete
28 FLUSSI ATTRAVERSO I CAPILLARI La differenza di pressione idraulica varia da 40-2=38 mmhg all estremita arteriosa del capillare a 15-2 = 13mmHg, all estremita venosa mentre quella di pressione osmotica e circa costante e dell ordine di mmhg lungo il capillare in media non vi e flusso netto di acqua e cristalloidi (sali, acidi, basi) in entrata e in uscita, ma vi e un flusso localizzato di fluidi in uscita dal capillare all estremita arteriosa e in ingresso al capillare all estremita venosa. Questa microcircolazione attorno al capillare consente il trasferimento di sostanze nutritive verso i tessuti e il richiamo di sostanze di scarto dai tessuti al sangue.
29 PLASMA FLUSSI ATTRAVERSO I CAPILLARI Le proteine del plasma non possono attraversare l endotelio capillare, permeabile solo ai cristalloidi (acidi, sali, basi) osmosi Tra plasma e liquido interstiziale c e una differenza di pressione filtrazione ARTERIOLA VENULA p 1 pressione idraulica nei capillari lato arteriola 40 mmhg π 1 pressione osmotica nei capillari 25 mmhg cost lungo il capillare p 1 pressione idraulica nei capillari lato venula 15 mmhg ENDOTELIO CAPILLARE p 2 pressione idraulica nei tessuti 2 mmhg π 2 pressione osmotica nei tessuti 0 p 2 pressione idraulica nei tessuti 2 mmhg LIQUIDO INTERSTIZIALE
30 PLASMA FLUSSI ATTRAVERSO I CAPILLARI p 1 pressione idraulica nei capillari lato arteriola 40 mmhg π 1 pressione osmotica nei capillari 25 mmhg p 1 pressione idraulica nei capillari lato venula 15 mmhg ENDOTELIO CAPILLARE p 2 pressione idraulica nei tessuti 2 mmhg π 2 pressione osmotica nei tessuti 0 p 2 pressione idraulica nei tessuti 2 mmhg LIQUIDO INTERSTIZIALE Flusso dovuto alla diff. di π cost. lungo il capillare Flusso dovuto alla diff. di p decrescente lungo il capillare
31 ARTERIOLA FLUSS0 TOTALE ATTRAVERSO I CAPILLARI PLASMA Flusso netto di acqua e prodotti di scarto in entrata nel capillare ENDOTELIO CAPILLARE Flusso netto di acqua e cristalloidi in uscita dal capillare LIQUIDO INTERSTIZIALE VENULA
32 SOLUZIONI ISOTONICHE Due soluzioni sono isotoniche se hanno la stessa pressione osmotica π 1 = π 2 Se le soluzioni hanno la stessa temperatura cio equivale a due soluzioni con la stessa concentrazione La soluzione 1 e ipertonica rispetto alla soluzione 2 se π 1 > π 2 La soluzione 1 e ipotonica rispetto alla soluzione 2 se π 1 < π 2
33 SOLUZIONI ISOTONICHE Due soluzioni sono isotoniche se hanno la stessa pressione osmotica π 1 = π 2 Se le soluzioni hanno la stessa temperatura cio equivale a due soluzioni con la stessa concentrazione La soluzione 1 e ipertonica rispetto alla soluzione 2 se π 1 > π 2 La soluzione 1 e ipotonica rispetto alla soluzione 2 se π 1 < π 2
34 SOLUZIONI ISOTONICHE Le soluzioni iniettate per via endovenosa devono essere isotoniche al plasma! SOLUZIONE ipertonica π soluzione > π plasma avvizimento globuli rossi ipotonica π soluzione < π plasma rigonfiamento globuli rossi
35 Esercizio La concentrazione di soluti nel plasma è pari a 0,31 moli/litro. Si calcoli la pressione osmotica del plasma. Si calcoli la concentrazione di soluto (in g/l) di una soluzione isotonica al plasma nel caso in cui il soluto sia glucosio (C 6 H 12 O 6 ).
POTENZA METABOLICA. Fisica Applicata, Area Infermieristica, M. Ruspa
 POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
LEGGE DI STOKES. Fisica Applicata, Area Infermieristica, M. Ruspa
 LEGGE DI STOKES La forza di attrito viscoso che agisce su un corpo sfrerico di raggio r che si muove con velocita v non elevata in un fluido di viscosita η in quite si puo calcolare come: SEDIMENTAZIONE
LEGGE DI STOKES La forza di attrito viscoso che agisce su un corpo sfrerico di raggio r che si muove con velocita v non elevata in un fluido di viscosita η in quite si puo calcolare come: SEDIMENTAZIONE
Fisicaa Applicata, Area Infermieristica, M. Ruspa. Esercizio. Si trasformino 20 o Faranheit in gradi centigradi e Kelvin.
 Esercizio Si trasformino 20 o Faranheit in gradi centigradi e Kelvin 124 EQUILIBRIO TERMICO Due corpi a temperature t 1 e t 2 (t 2 > t 1 ) sono posti in contatto termico, isolati dall ambiente circostante
Esercizio Si trasformino 20 o Faranheit in gradi centigradi e Kelvin 124 EQUILIBRIO TERMICO Due corpi a temperature t 1 e t 2 (t 2 > t 1 ) sono posti in contatto termico, isolati dall ambiente circostante
Fisicaa Applicata, Area Infermieristica, M. Ruspa CALORE E TEMPERATURA. Lezione VI
 CALORE E TEMPERATURA 163 Gli scambi di energia non necessariamente implicano lavoro meccanico contatto tra corpi a temperatura diversa attrito corrente elettrica attraverso una resistenza reazioni chimiche
CALORE E TEMPERATURA 163 Gli scambi di energia non necessariamente implicano lavoro meccanico contatto tra corpi a temperatura diversa attrito corrente elettrica attraverso una resistenza reazioni chimiche
Esercitazioni Infermieristica
 Esercitazioni Infermieristica Novara: Gruppo A 28/1 9-13 29/1 14-18 Gruppo B 28/1 14-18 29/1 9-13 Alba 7/12/2012 11-13 14-17 25/01/2013 15-18 a Novara Alessandria 18/12/2012 10-13 14-16 14/01/2013 10-13
Esercitazioni Infermieristica Novara: Gruppo A 28/1 9-13 29/1 14-18 Gruppo B 28/1 14-18 29/1 9-13 Alba 7/12/2012 11-13 14-17 25/01/2013 15-18 a Novara Alessandria 18/12/2012 10-13 14-16 14/01/2013 10-13
Temperatura. Il legame con le grandezze microscopiche è di tipo statistico. Pressione Volume Temperatura
 Temperatura La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero di particelle):
Temperatura La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero di particelle):
SOLUZIONI. Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto).
 SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
Fisicaa Applicata, Area Tecnica, M. Ruspa Esercizio. Data una massa m = 8,8 mg di CO 2, calcolare: 1) il numero di moli. 2) il numero di molecole
 Esercizio Data una massa m = 8,8 mg di CO 2, calcolare: 1) il numero di moli 2) il numero di molecole 1 GAS PERFETTO volume occupato dalle molecole è trascurabile; forze di attrazione tra molecole sono
Esercizio Data una massa m = 8,8 mg di CO 2, calcolare: 1) il numero di moli 2) il numero di molecole 1 GAS PERFETTO volume occupato dalle molecole è trascurabile; forze di attrazione tra molecole sono
SUISM Fisiologia Modulo di Fisica. Lezione 6
 SUISM Fisiologia Modulo di Fisica a.a. 2017-2018 Lezione 6 Suism 17-18 - Fluidi AA 1 Metabolismo corporeo DEFINIZIONE: Complesso di reazioni biochimiche di sintesi e di degradazione che si svolgono in
SUISM Fisiologia Modulo di Fisica a.a. 2017-2018 Lezione 6 Suism 17-18 - Fluidi AA 1 Metabolismo corporeo DEFINIZIONE: Complesso di reazioni biochimiche di sintesi e di degradazione che si svolgono in
CdL Professioni Sanitarie A.A. 2012/2013. Unità 9: Gas e processi di diffusione
 L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
Diffusione e osmosi. Roberto Cirio. Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico Corso di Fisica
 Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
Lezione 11 Soluzioni. Diffusione ed osmosi.
 Lezione 11 Soluzioni. Diffusione ed osmosi. Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici
Lezione 11 Soluzioni. Diffusione ed osmosi. Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici
Scaricato da
 -Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
-Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
Calore. Il calore (Q)
 Due corpi messi a contatto si portano alla stessa temperatura Il calore (Q) Calore Trasferimento di energia interna dal corpo più caldo a quello più freddo. Si dice che tra i due sistemi vi è stato scambio
Due corpi messi a contatto si portano alla stessa temperatura Il calore (Q) Calore Trasferimento di energia interna dal corpo più caldo a quello più freddo. Si dice che tra i due sistemi vi è stato scambio
Si definisce soluzione un sistema omogeneo (costituito da una sola fase) con più di un componente
 Lezione 14 1.Soluzioni 2.Concentrazione 3.Proprietà colligative 1.Legge di Raoult 2.Abbassamento crioscopico 3.Innalzamento ebullioscopico 4.Pressione osmotica Le Soluzioni Si definisce soluzione un sistema
Lezione 14 1.Soluzioni 2.Concentrazione 3.Proprietà colligative 1.Legge di Raoult 2.Abbassamento crioscopico 3.Innalzamento ebullioscopico 4.Pressione osmotica Le Soluzioni Si definisce soluzione un sistema
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
GAIALAB:INCONTRIAMO L AMBIENTE IN LABORATORIO
 LABORATORIO DI SCIENZE NATURALI L acqua come componente degli organismi viventi: osserviamo la cellula 1 1 L acqua è fondamentale per tutti gli organismi viventi, molte cellule si muovono in ambiente acquatico
LABORATORIO DI SCIENZE NATURALI L acqua come componente degli organismi viventi: osserviamo la cellula 1 1 L acqua è fondamentale per tutti gli organismi viventi, molte cellule si muovono in ambiente acquatico
Capitolo 14 Le proprietà delle soluzioni
 Capitolo 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Capitolo 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costante il volume dei liquidi corporei attraverso il bilancio tra assunzione ed eliminazione di H 2 O. I reni giocano
Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costante il volume dei liquidi corporei attraverso il bilancio tra assunzione ed eliminazione di H 2 O. I reni giocano
Pagine sul libro. da pag. 364 a pag. 367
 Acqua Pagine sul libro da pag. 364 a pag. 367 Acqua L acqua è un nutriente essenziale non calorico, che garantisce la realizzazione dei processi indispensabili per la vita: è il solvente in cui avvengono
Acqua Pagine sul libro da pag. 364 a pag. 367 Acqua L acqua è un nutriente essenziale non calorico, che garantisce la realizzazione dei processi indispensabili per la vita: è il solvente in cui avvengono
METABOLISMO CELLULARE
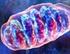 METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
Il livello cellulare di organizzazione: la struttura cellulare. Cattedra di Fisiologia Umana
 Il livello cellulare di organizzazione: la struttura cellulare Cattedra di Fisiologia Umana 1. La diversità delle cellule nel corpo umano Le cellule del corpo hanno molte differenti forme ed una varietà
Il livello cellulare di organizzazione: la struttura cellulare Cattedra di Fisiologia Umana 1. La diversità delle cellule nel corpo umano Le cellule del corpo hanno molte differenti forme ed una varietà
PROPRIETA DELLE SOLUZIONI ACQUOSE. Prof.ssa Patrizia Gallucci
 PROPRIETA DELLE SOLUZIONI ACQUOSE Prof.ssa Patrizia Gallucci L'acqua è un composto chimicamente semplice, formato da due atomi di idrogeno e uno di ossigeno (H2O), che riveste fondamentale importanza in
PROPRIETA DELLE SOLUZIONI ACQUOSE Prof.ssa Patrizia Gallucci L'acqua è un composto chimicamente semplice, formato da due atomi di idrogeno e uno di ossigeno (H2O), che riveste fondamentale importanza in
Movimenti dell acqua e dei soluti nella cellula vegetale
 Movimenti dell acqua e dei soluti nella cellula vegetale L acqua si sposta in funzione dell energia potenziale in essa contenuta o Potenziale idrico Si sposta da una regione dove il potenziale idrico è
Movimenti dell acqua e dei soluti nella cellula vegetale L acqua si sposta in funzione dell energia potenziale in essa contenuta o Potenziale idrico Si sposta da una regione dove il potenziale idrico è
Le soluzioni e il loro comportamento
 2017 Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli soluto / volume soluzione MOLALITA (m) moli soluto
2017 Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli soluto / volume soluzione MOLALITA (m) moli soluto
Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
1. Perché le sostanze si sciolgono?
 1. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
1. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia Medica A.A
 Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia Medica A.A. 2017-18 Osmosi Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unicampania.it Equilibrio
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia Medica A.A. 2017-18 Osmosi Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unicampania.it Equilibrio
STATO LIQUIDO. Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso
 STATO LIQUIDO Caratteristiche: Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso intermolecolare I legami intermolecolari sono responsabili
STATO LIQUIDO Caratteristiche: Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso intermolecolare I legami intermolecolari sono responsabili
FISIOLOGIA VEGETALE. I movimenti dell acqua e dei soluti
 FISIOLOGIA VEGETALE I movimenti dell acqua e dei soluti MOVIMENTI DELL ACQUA E DEI SOLUTI L acqua si muove seguente delle differenze di potenziali di energia Il potenziale di energia è l energia che viene
FISIOLOGIA VEGETALE I movimenti dell acqua e dei soluti MOVIMENTI DELL ACQUA E DEI SOLUTI L acqua si muove seguente delle differenze di potenziali di energia Il potenziale di energia è l energia che viene
Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea.
 Le Miscele Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea. Se le proprietà sono uniformi, la miscela è una miscela omogenea
Le Miscele Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea. Se le proprietà sono uniformi, la miscela è una miscela omogenea
1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le
 Unità n 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Unità n 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
MEMBRANE osmosi. MEMBRANE osmosi. elio giroletti
 UNIVERSITÀ DEGLI STUDI DI PAVIA dip. fisica nucleare e teorica via bassi 6, 27100 pavia, italy tel. 038298.7905 - girolett@unipv.it - www.unipv.it/webgiro webgiro 1 elio giroletti EBRANE osmosi FISICA
UNIVERSITÀ DEGLI STUDI DI PAVIA dip. fisica nucleare e teorica via bassi 6, 27100 pavia, italy tel. 038298.7905 - girolett@unipv.it - www.unipv.it/webgiro webgiro 1 elio giroletti EBRANE osmosi FISICA
GLI STATI DELLA MATERIA
 GLI STATI DELLA MATERIA E LE SOLUZIONI Stati di aggregazione della materia Cambiamenti di stato La temperatura del cubetto di ghiaccio aumenta fino a raggiungere un valore detto PUNTO (O TEMPERATURA) DI
GLI STATI DELLA MATERIA E LE SOLUZIONI Stati di aggregazione della materia Cambiamenti di stato La temperatura del cubetto di ghiaccio aumenta fino a raggiungere un valore detto PUNTO (O TEMPERATURA) DI
Proprietà colligative
 Proprietà colligative Le proprietà che dipendono dalla proporzione tra le molecole del soluto e quelle del solvente ma non dall identità chimica del soluto si dicono proprietà colligative. Le proprietà
Proprietà colligative Le proprietà che dipendono dalla proporzione tra le molecole del soluto e quelle del solvente ma non dall identità chimica del soluto si dicono proprietà colligative. Le proprietà
Il binomio di van t Hoff Le proprietà colligative dipendono dal numero di particelle effettivamente presenti nella soluzione. Nel caso in cui il solut
 Proprietà colligative di soluzioni ideali Si definiscono proprietà colligative alcune proprietà delle soluzioni indipendenti dalla natura del soluto ma che dipendono soltanto dal numero delle particelle
Proprietà colligative di soluzioni ideali Si definiscono proprietà colligative alcune proprietà delle soluzioni indipendenti dalla natura del soluto ma che dipendono soltanto dal numero delle particelle
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei Mantenere costanti volume ed osmolarità dei liquidi corporei è essenziale per l omeostasi. Questo è possibile solo se assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei Mantenere costanti volume ed osmolarità dei liquidi corporei è essenziale per l omeostasi. Questo è possibile solo se assunzione ed eliminazione di H 2
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
Acqua: nutriente essenziale
 Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Alcuni esempi di ruoli fisiologici. Effetto di trascinamento nei capillari arteriosi e venosi Effetto di trascinamento nel glomerulo renale
 Alcuni esempi di ruoli fisiologici Effetto di trascinamento nei capillari arteriosi e venosi Effetto di trascinamento nel glomerulo renale Formazione e riassorbimento del liquido interstiziale Cellule
Alcuni esempi di ruoli fisiologici Effetto di trascinamento nei capillari arteriosi e venosi Effetto di trascinamento nel glomerulo renale Formazione e riassorbimento del liquido interstiziale Cellule
Introduzione alla biofisica Cenni storici e concetti fondamentali. Corso di Biofisica, Università di Cagliari 1
 Introduzione alla biofisica Cenni storici e concetti fondamentali 1 Riferimenti Books and others Nelson, chap. 1 http://www.life.illinois.edu/crofts/bioph354/ http://www.fisicamente.net/didattica/index-1350.htm
Introduzione alla biofisica Cenni storici e concetti fondamentali 1 Riferimenti Books and others Nelson, chap. 1 http://www.life.illinois.edu/crofts/bioph354/ http://www.fisicamente.net/didattica/index-1350.htm
Corso di Laurea Magistrale in Medicina e Chirurgia. Biofisica e Fisiologia I A.A ESERCITAZIONE. Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 ESERCITAZIONE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 ESERCITAZIONE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Caratteristiche delle membrane biologiche
 Membrane Biologiche Caratteristiche delle membrane biologiche 1. Le membrane sono strutture a foglio che formano setti di separazione tra compartimenti con composizione diversa tra loro. 2. Sono costituite
Membrane Biologiche Caratteristiche delle membrane biologiche 1. Le membrane sono strutture a foglio che formano setti di separazione tra compartimenti con composizione diversa tra loro. 2. Sono costituite
La misura della temperatura
 Calore e temperatura 1. La misura della temperatura 2. La dilatazione termica 3. La legge fondamentale della termologia 4. Il calore latente 5. La propagazione del calore La misura della temperatura La
Calore e temperatura 1. La misura della temperatura 2. La dilatazione termica 3. La legge fondamentale della termologia 4. Il calore latente 5. La propagazione del calore La misura della temperatura La
Lo stato liquido. i liquidi molecolari con legami a idrogeno: le interazioni tra le molecole si stabiliscono soprattutto attraverso legami a idrogeno
 Lo stato liquido Le particelle sono in continuo movimento, anche se questo risulta più limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle particelle è chiamato moto Browniano.
Lo stato liquido Le particelle sono in continuo movimento, anche se questo risulta più limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle particelle è chiamato moto Browniano.
Dinamica dei fluidi viscosi
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Dinamica dei fluidi viscosi 14/3/2006 Ripartizione del sangue portata totale NQ diametro iniziale D diametro d dei rami secondari
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Dinamica dei fluidi viscosi 14/3/2006 Ripartizione del sangue portata totale NQ diametro iniziale D diametro d dei rami secondari
Scambi di sostanze tra cellule e ambiente
 Scambi di sostanze tra cellule e ambiente Il trasporto attraverso la membrana Diffusione attraverso una membrana semipermeabile Le membrane cellulari si lasciano attraversare da alcune sostanze in maniera
Scambi di sostanze tra cellule e ambiente Il trasporto attraverso la membrana Diffusione attraverso una membrana semipermeabile Le membrane cellulari si lasciano attraversare da alcune sostanze in maniera
Fisica Applicata, Area Tecnica, M. Ruspa MECCANICA. Cinematica: moto dei corpi Dinamica: cause del moto Statica: equilibrio dei corpi
 MECCANICA Cinematica: moto dei corpi Dinamica: cause del moto Statica: equilibrio dei corpi CORPO: MASSA: CORPI: MASSA E DENSITA >> Unita di misura nel S.I. DENSITA : >> Unita di misura nel S.I. Considereremo
MECCANICA Cinematica: moto dei corpi Dinamica: cause del moto Statica: equilibrio dei corpi CORPO: MASSA: CORPI: MASSA E DENSITA >> Unita di misura nel S.I. DENSITA : >> Unita di misura nel S.I. Considereremo
Termodinamica Chimica
 Universita degli Studi dell Insubria Corsi di Laurea in Scienze Chimiche e Chimica Industriale Termodinamica Chimica Miscele e Soluzioni dario.bressanini@uninsubria.it http://scienze-como.uninsubria.it/bressanini
Universita degli Studi dell Insubria Corsi di Laurea in Scienze Chimiche e Chimica Industriale Termodinamica Chimica Miscele e Soluzioni dario.bressanini@uninsubria.it http://scienze-como.uninsubria.it/bressanini
Corso di Medicina del Lavoro. Malattie muscoloscheletriche e da agenti fisici La fisiologia del lavoro
 Corso di Medicina del Lavoro Malattie muscoloscheletriche e da agenti fisici La fisiologia del lavoro L organismo animale è sede di trasformazioni energetiche costanti I processi vitali trasformano l energia
Corso di Medicina del Lavoro Malattie muscoloscheletriche e da agenti fisici La fisiologia del lavoro L organismo animale è sede di trasformazioni energetiche costanti I processi vitali trasformano l energia
I compartimenti liquidi corporei
 I compartimenti liquidi corporei Il mantenimento di un volume relativamente costante e di una composizione stabile dei liquidi corporei è essenziale per l omeostasi. In condizioni di equilibrio, l assunzione
I compartimenti liquidi corporei Il mantenimento di un volume relativamente costante e di una composizione stabile dei liquidi corporei è essenziale per l omeostasi. In condizioni di equilibrio, l assunzione
Le proprietà colligative
 Le proprietà colligative Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Abbassamento
Le proprietà colligative Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Abbassamento
Lezione n. 12. Proprietà colligative Variazione del punto crioscopico. Pressione osmotica. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 12 Proprietà colligative Variazione del punto ebullioscopico Variazione del punto crioscopico Pressione osmotica 02/03/2008 Antonino Polimeno
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 12 Proprietà colligative Variazione del punto ebullioscopico Variazione del punto crioscopico Pressione osmotica 02/03/2008 Antonino Polimeno
GAS. H 2 N 2 O 2 F 2 Cl 2 CO CO 2 NO 2 SO 2 CH 4
 GAS Non hanno né forma né volume propri. Sono facilmente comprimibili. Sono in genere gassose le sostanze costituite da molecole piccole e di basso peso molecolare. H 2 N 2 O 2 F 2 Cl 2 He Ne Ar CO CO
GAS Non hanno né forma né volume propri. Sono facilmente comprimibili. Sono in genere gassose le sostanze costituite da molecole piccole e di basso peso molecolare. H 2 N 2 O 2 F 2 Cl 2 He Ne Ar CO CO
BIOFISICA DELLE MEMBRANE
 BIOFISICA DELLE MEMBRANE Le funzioni biologiche di tutti gli organismi viventi si svolgono mediante scambio di sostanze ed informazioni attraverso membrane. Membrana = struttura che separa due mezzi diversi
BIOFISICA DELLE MEMBRANE Le funzioni biologiche di tutti gli organismi viventi si svolgono mediante scambio di sostanze ed informazioni attraverso membrane. Membrana = struttura che separa due mezzi diversi
Sommario. Capitolo 1 La struttura della materia: miscugli e sostanze. Capitolo 2 Dalle sostanze all atomo
 Introduzione La Chimica e il metodo scientifico 1. La Chimica pag. 9 2. Il metodo scientifico pag. 10 3. Grandezze fondamentali e grandezze derivate pag. 11 3.1 Il Sistema Internazionale di unità di misura
Introduzione La Chimica e il metodo scientifico 1. La Chimica pag. 9 2. Il metodo scientifico pag. 10 3. Grandezze fondamentali e grandezze derivate pag. 11 3.1 Il Sistema Internazionale di unità di misura
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
pressione esercitata dalle molecole di gas in equilibrio con Si consideri una soluzione di B in A. Per una soluzione ideale
 PROPRIETA COLLIGATIVE Proprietà che dipendono solo dal numero di particelle presenti in soluzione 1. TENSIONE DI VAPORE 2. INNALZAMENTO EBULLIOSCOPICO 3. ABBASSAMENTO CRIOSCOPICO 4. PRESSIONE OSMOTICA
PROPRIETA COLLIGATIVE Proprietà che dipendono solo dal numero di particelle presenti in soluzione 1. TENSIONE DI VAPORE 2. INNALZAMENTO EBULLIOSCOPICO 3. ABBASSAMENTO CRIOSCOPICO 4. PRESSIONE OSMOTICA
Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Fisica per scienze ed ingegneria
 Serway, Jewett Fisica per scienze ed ingegneria Capitolo 20 Fino a circa il 1850 su riteneva che la meccanica e la termodinamica fossero due scienze completamente distinte. La legge di conservazione dell
Serway, Jewett Fisica per scienze ed ingegneria Capitolo 20 Fino a circa il 1850 su riteneva che la meccanica e la termodinamica fossero due scienze completamente distinte. La legge di conservazione dell
La T corporea dipende dal bilancio tra produzione, guadagno e perdita di calore. METABOLISMO
 TERMOREGOLAZIONE BILANCIO ENERGETICO La T corporea dipende dal bilancio tra produzione, guadagno e perdita di calore. METABOLISMO Gli animali si dividono in: Pecilotermi (invertebrati, pesci, anfibi, rettili):
TERMOREGOLAZIONE BILANCIO ENERGETICO La T corporea dipende dal bilancio tra produzione, guadagno e perdita di calore. METABOLISMO Gli animali si dividono in: Pecilotermi (invertebrati, pesci, anfibi, rettili):
Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio
 Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Fisica per scienze ed ingegneria
 Serway, Jewett Fisica per scienze ed ingegneria Capitolo 20 Fino a circa il 1850 su riteneva che la meccanica e la termodinamica fossero due scienze completamente distinte. La legge di conservazione dell
Serway, Jewett Fisica per scienze ed ingegneria Capitolo 20 Fino a circa il 1850 su riteneva che la meccanica e la termodinamica fossero due scienze completamente distinte. La legge di conservazione dell
 FABBISOGNO ENERGETICO Il fabbisogno energetico di un individuo è il livello di introduzione di energia, con gli alimenti, necessario a bilanciare la spesa energetica in un soggetto con struttura, composizione
FABBISOGNO ENERGETICO Il fabbisogno energetico di un individuo è il livello di introduzione di energia, con gli alimenti, necessario a bilanciare la spesa energetica in un soggetto con struttura, composizione
Trasporto epiteliale
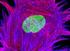 Trasporto epiteliale Rivestono le cavità e le superfici corporee: interfaccia tra gli spazi interni dell organismo e l ambiente Semplice rivestimento o funzione di regolazione (es:osmoregolazione) Trasporto
Trasporto epiteliale Rivestono le cavità e le superfici corporee: interfaccia tra gli spazi interni dell organismo e l ambiente Semplice rivestimento o funzione di regolazione (es:osmoregolazione) Trasporto
I cambiamenti di stato
 I cambiamenti di stato 1. I passaggi tra stati di aggregazione Le sostanze possono passare dall'uno all'altro dei tre stati di aggregazione mediante scambi di calore. La freccia rossa indica assorbimento
I cambiamenti di stato 1. I passaggi tra stati di aggregazione Le sostanze possono passare dall'uno all'altro dei tre stati di aggregazione mediante scambi di calore. La freccia rossa indica assorbimento
Soluzioni e miscugli eterogenei. Soluzioni e miscugli eterogenei. Soluzioni e miscugli eterogenei
 Le soluzioni Soluzioni e miscugli eterogenei Un sistema formato da due o più componenti è chiamato miscuglio. I miscugli possono essere : miscugli eterogenei; miscugli omogenei o soluzioni. 2 4 Soluzioni
Le soluzioni Soluzioni e miscugli eterogenei Un sistema formato da due o più componenti è chiamato miscuglio. I miscugli possono essere : miscugli eterogenei; miscugli omogenei o soluzioni. 2 4 Soluzioni
Soluzioni unità 3, modulo D del libro
 Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente
 Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente Soluzioni Sistema Omogeneo (presenta le stesse proprietà in qualsiasi sua porzione) Monofasico Nella fase omogenea
Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente Soluzioni Sistema Omogeneo (presenta le stesse proprietà in qualsiasi sua porzione) Monofasico Nella fase omogenea
i tre stati di aggregazione
 Temperatura e Calore -temperatura -calore e calore specifico -lavoro in termodinamica -trasformazioni termodinamiche -trasformazioni di stato -energia interna 1 i tre stati di aggregazione solido Ordine
Temperatura e Calore -temperatura -calore e calore specifico -lavoro in termodinamica -trasformazioni termodinamiche -trasformazioni di stato -energia interna 1 i tre stati di aggregazione solido Ordine
Rapporti tra malnutrizione e salute
 La nutrizione Rapporti tra malnutrizione e salute La nutrizione è uno dei più importanti determinanti della salute. Esiste una stretta correlazione tra alimentazione non corretta e insorgenza di numerose
La nutrizione Rapporti tra malnutrizione e salute La nutrizione è uno dei più importanti determinanti della salute. Esiste una stretta correlazione tra alimentazione non corretta e insorgenza di numerose
Temperatura Calore Trasformazioni termodinamiche
 I FENOMENI TERMICI Temperatura Calore Trasformazioni termodinamiche Gas perfetti Temperatura assoluta Gas reali Principi della Termodinamica Trasmissione i del calore Termoregolazione del corpo umano pag.1
I FENOMENI TERMICI Temperatura Calore Trasformazioni termodinamiche Gas perfetti Temperatura assoluta Gas reali Principi della Termodinamica Trasmissione i del calore Termoregolazione del corpo umano pag.1
FENOMENI DI TRASPORTO DELLA MATERIA
 FENOMENI DI TRASPORTO DELLA MATERIA MOTI BROWNIANI Gli atomi e le molecole che costituiscono la materia non sono mai fermi, se non alla temperatura dello zero assoluto (T 0 K -273 C) In particolare, mentre
FENOMENI DI TRASPORTO DELLA MATERIA MOTI BROWNIANI Gli atomi e le molecole che costituiscono la materia non sono mai fermi, se non alla temperatura dello zero assoluto (T 0 K -273 C) In particolare, mentre
Le proprietà colligative delle soluzioni
 1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
Stati della materia. Esempio. Fusione e solidificazione. Esempio. Stati di aggregazione della materia
 Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Programma di SCIENZE DELLA TERRA
 Istituto di Istruzione Secondaria Superiore Statale «Via Silvestri 301» Plesso «ALBERTO CECCHERELLI» Programma di SCIENZE DELLA TERRA Classe 1 a F Indirizzo COSTRUZIONI, AMBIENTE E TERRITORIO Anno Scolastico
Istituto di Istruzione Secondaria Superiore Statale «Via Silvestri 301» Plesso «ALBERTO CECCHERELLI» Programma di SCIENZE DELLA TERRA Classe 1 a F Indirizzo COSTRUZIONI, AMBIENTE E TERRITORIO Anno Scolastico
In un vaso sanguigno si forma un aneurisma dove la sezione aumenta del 15%. Si calcoli la conseguente variazione percentuale della velocita del sangue
 Esercizio In un vaso sanguigno si forma un aneurisma dove la sezione aumenta del 15%. Si calcoli la conseguente variazione percentuale della velocita del sangue 1 MOTO DI FLUIDI REALI 2 MOTO DI UN FLUIDO
Esercizio In un vaso sanguigno si forma un aneurisma dove la sezione aumenta del 15%. Si calcoli la conseguente variazione percentuale della velocita del sangue 1 MOTO DI FLUIDI REALI 2 MOTO DI UN FLUIDO
PROPRIETA DELLE SOLUZIONI
 1 11 PROPRIETA DELLE SOLUZIONI 2 SOLUZIONI IDEALI H mix = 0 le interazioni fra le molecole di soluto e di solvente puri sono paragonabili a quelle fra soluto e solvente; durante il processo di dissoluzione
1 11 PROPRIETA DELLE SOLUZIONI 2 SOLUZIONI IDEALI H mix = 0 le interazioni fra le molecole di soluto e di solvente puri sono paragonabili a quelle fra soluto e solvente; durante il processo di dissoluzione
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro.
 Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
FISIOLOGIA dell ALLENAMENTO. dai processi fisiologici alle metodiche di allenamento
 FISIOLOGIA dell ALLENAMENTO dai processi fisiologici alle metodiche di allenamento Introduzione alla fisiologia Metabolismo cellulare Il sistema cardiovascolare: funzione cardiaca vasi, flusso, pressione
FISIOLOGIA dell ALLENAMENTO dai processi fisiologici alle metodiche di allenamento Introduzione alla fisiologia Metabolismo cellulare Il sistema cardiovascolare: funzione cardiaca vasi, flusso, pressione
Struttura del territorio circolatorio terminale
 Struttura del territorio circolatorio terminale Canale preferenziale passaggio principale Numero complessivo capillari nell uomo 30 40.10 9 Superficie di scambio 1000 m 2. Densità capillare funzionale
Struttura del territorio circolatorio terminale Canale preferenziale passaggio principale Numero complessivo capillari nell uomo 30 40.10 9 Superficie di scambio 1000 m 2. Densità capillare funzionale
Le membrane cellulari
 Le membrane cellulari La struttura delle membrane biologiche Le membrane cellulari sono formate da un doppio strato fosfolipidico dove si trovano varie proteine, che possono essere: periferiche: si trovano
Le membrane cellulari La struttura delle membrane biologiche Le membrane cellulari sono formate da un doppio strato fosfolipidico dove si trovano varie proteine, che possono essere: periferiche: si trovano
Sommario. Introduzione
 Introduzione La Chimica e il metodo scientifico 1. La Chimica pag. 9 2. Il metodo scientifico pag. 10 3. Grandezze fondamentali e grandezze derivate pag. 11 3.1 Il Sistema Internazionale di unità di misura
Introduzione La Chimica e il metodo scientifico 1. La Chimica pag. 9 2. Il metodo scientifico pag. 10 3. Grandezze fondamentali e grandezze derivate pag. 11 3.1 Il Sistema Internazionale di unità di misura
Organizzazione della materia
 Organizzazione della materia Elementi: sostanze che non possono essere scisse in altre più semplici mediante reazioni chimiche ordinarie. Atomo: è la porzione più piccola di un elemento, formato da 3 particelle
Organizzazione della materia Elementi: sostanze che non possono essere scisse in altre più semplici mediante reazioni chimiche ordinarie. Atomo: è la porzione più piccola di un elemento, formato da 3 particelle
PERMEABILITA DI UN DOPPIO STRATO FOSFOLIPIDICO ARTIFICIALE (PRIVO DI PROTEINE)
 PERMEABILITA DI UN DOPPIO STRATO FOSFOLIPIDICO ARTIFICIALE (PRIVO DI PROTEINE) NELLE MEMBRANE CELLULARI IL COMPORTAMENTO PUÒ ESSERE MOLTO DIVERSO (GRAZIE ALLA PRESENZA DELLE PROTEINE) PICCOLE MOLECOLE
PERMEABILITA DI UN DOPPIO STRATO FOSFOLIPIDICO ARTIFICIALE (PRIVO DI PROTEINE) NELLE MEMBRANE CELLULARI IL COMPORTAMENTO PUÒ ESSERE MOLTO DIVERSO (GRAZIE ALLA PRESENZA DELLE PROTEINE) PICCOLE MOLECOLE
OVERVIEW. Teoria atomica e tavola periodica. Legami e interazioni degli atomi
 OVERVIEW Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso
OVERVIEW Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso
STRUTTURA e FUNZIONE
 STRUTTURA e FUNZIONE LA FUNZIONE DIPENDE DALLA STRUTTURA ossia LA FISIOLOGIA SI BASA SULL'ANATOMIA (e sull'istologia) Esempi sono: la miosina (testa e coda) lo pneumocita di I ordine: perché è così piatto?
STRUTTURA e FUNZIONE LA FUNZIONE DIPENDE DALLA STRUTTURA ossia LA FISIOLOGIA SI BASA SULL'ANATOMIA (e sull'istologia) Esempi sono: la miosina (testa e coda) lo pneumocita di I ordine: perché è così piatto?
Capitolo 16 L energia si trasferisce
 Capitolo 16 L energia si trasferisce 1. L «ABC» dei trasferimenti energetici 2. Le reazioni scambiano energia con l ambiente 3. Durante le reazioni varia l energia chimica del sistema 4. L energia chimica
Capitolo 16 L energia si trasferisce 1. L «ABC» dei trasferimenti energetici 2. Le reazioni scambiano energia con l ambiente 3. Durante le reazioni varia l energia chimica del sistema 4. L energia chimica
L ALIMENTAZIONE IL NOSTRO CORPO È UNA MACCHINA CHE HA BISOGNO CONTINUAMENTE DI ENERGIA ANCHE QUANDO È A RIPOSO.
 L ALIMENTAZIONE IL NOSTRO CORPO È UNA MACCHINA CHE HA BISOGNO CONTINUAMENTE DI ENERGIA ANCHE QUANDO È A RIPOSO. L ENERGIA VIENE RICAVATA DAI PRINCIPI NUTRITIVI O NUTRIENTI ALIMENTARSI VUOL DIRE SODDISFARE
L ALIMENTAZIONE IL NOSTRO CORPO È UNA MACCHINA CHE HA BISOGNO CONTINUAMENTE DI ENERGIA ANCHE QUANDO È A RIPOSO. L ENERGIA VIENE RICAVATA DAI PRINCIPI NUTRITIVI O NUTRIENTI ALIMENTARSI VUOL DIRE SODDISFARE
Esercizi Concentrazioni e diluizioni
 Esercizi Concentrazioni e diluizioni Una soluzione 0.300 m di acido fosforico ha densità 1.010 g/ml. Calcolare la frazione molare, la percentuale in peso, la molarità. Molalità 0.300 m 0.300 moli di acido
Esercizi Concentrazioni e diluizioni Una soluzione 0.300 m di acido fosforico ha densità 1.010 g/ml. Calcolare la frazione molare, la percentuale in peso, la molarità. Molalità 0.300 m 0.300 moli di acido
Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana
 Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana Le proteine diffondono nel piano della membrana per diffusione rotazionale e laterale Le membrane cellulari La componente
Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana Le proteine diffondono nel piano della membrana per diffusione rotazionale e laterale Le membrane cellulari La componente
COMPARTIMENTI IDRICI AMBIENTE ESTERNO AMBIENTE INTERNO
 COMPARTIMENTI IDRICI AMBIENTE ESTERNO AMBIENTE INTERNO OMEOSTASI Stato di stabilità locale che tende a mantenersi lontano dallo stato di equilibrio EQUILIBRIO Stato di stabilità energetica, massima entropia
COMPARTIMENTI IDRICI AMBIENTE ESTERNO AMBIENTE INTERNO OMEOSTASI Stato di stabilità locale che tende a mantenersi lontano dallo stato di equilibrio EQUILIBRIO Stato di stabilità energetica, massima entropia
Importanza della pressione osmotica. Turgore delle cellule e dei tessuti Volume del sangue Scambio di liquidi tra il sangue e i tessuti Rene
 Importanza della pressione osmotica Turgore delle cellule e dei tessuti Volume del sangue Scambio di liquidi tra il sangue e i tessuti Rene Quali sono le forze che spingono le sostanze a spostarsi? Lo
Importanza della pressione osmotica Turgore delle cellule e dei tessuti Volume del sangue Scambio di liquidi tra il sangue e i tessuti Rene Quali sono le forze che spingono le sostanze a spostarsi? Lo
Proprietà colligative
 roprietà colligative Fra i sistemi reali è utile esaminare il comportamento di soluzioni diluite ottenuti da solidi o liquidi poco volatili rispetto al solvente. Le proprietà di tali soluzioni dipendono
roprietà colligative Fra i sistemi reali è utile esaminare il comportamento di soluzioni diluite ottenuti da solidi o liquidi poco volatili rispetto al solvente. Le proprietà di tali soluzioni dipendono
Rapporto tra soluto e solvente o soluzione
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
SISTEMA TERMODINAMICO STATO TERMODINAMICO
 SISTEMA TERMODINAMICO Sistema macroscopico (gas, liquido, solido) chimicamente definito, composto da un grande numero di atomi o molecole. In una mole di sostanza: N 6,02 10 23 Isolato: non scambia né
SISTEMA TERMODINAMICO Sistema macroscopico (gas, liquido, solido) chimicamente definito, composto da un grande numero di atomi o molecole. In una mole di sostanza: N 6,02 10 23 Isolato: non scambia né
Richiami alle conoscenze fondamentali
 Richiami alle conoscenze fondamentali 1 INTRODUZIONE Molte persone sono consapevoli del fatto che, intervenendo sui fattori ambientali e sullo stile di vita, tra cui anche le abitudini alimentari, è possibile
Richiami alle conoscenze fondamentali 1 INTRODUZIONE Molte persone sono consapevoli del fatto che, intervenendo sui fattori ambientali e sullo stile di vita, tra cui anche le abitudini alimentari, è possibile
