dualismo onda corpuscolo
|
|
|
- Corrado Pasini
- 5 anni fa
- Visualizzazioni
Transcript
1 dualismo onda corpuscolo Gli effetti che abbiamo visto finora sono manifestazioni della natura corpuscolare della radiazione elettromagnetica (e quindi della luce) Naturalmente la natura corpuscolare non spiega le innumerevoli prove a favore della natura ondulatoria della luce La nuova fisica quantistica ci abituerà a questo dualismo onda-corpuscolo, anche per le particelle Per comprendere la natura ondulatoria delle particelle, dovranno essere state trattate in precedenza alcune cruciali manifestazioni della natura ondulatoria della luce!198
2 Teorie della luce Ottica geometrica raggi di luce riflessione rifrazione dispersione (dipendenza dell indice di rifrazione dalla frequenza) Ottica fisica o ondulatoria fronte d onda determinato dal principio di Huygens interferenza diffrazione da doppia fenditura diffrazione da singola fenditura (di Fraunhofer) reticolo di diffrazione!199
3 spettroscopi per l analisi in frequenza Prisma: legge di Snell Reticolo di diffrazione Differenze tra uno spettroscopio a prisma o a reticolo effetto su un laser rosso!200
4 diffrazione dei raggi X In un reticolo di diffrazione d sinϑ = nλ per osservare la diffrazione d λ per la luce visibile λ 500 nm = 0.5 µm facilmente realizzabile con tecniche fotografiche per i raggi X frazione di nm! Struttura cristallina legge di Bragg 2d sinϑ = nλ ma anche: La diffrazione di Bragg ci permette di studiare la struttura cristallina (schemi di Laue)!201
5 diffrazione di Bragg e schemi di Laue!202
6 Spettroscopia atomica Abbiamo già parlato dello spettro a righe dei raggi X Spettri di emissione dei gas eccitati da scariche elettriche serie di Balmer dell idrogeno (1885) λ = m nm con m 3 m serie di Paschen, Lyman: formula di Rydberg-Ritz (1888) 1 λ = RZ n n 1 con R = µm 1 modellizzazione atomica per spiegare le serie spettroscopiche osservate modello di Thomson vs modello di Rutherford!203
7 modello atomico di Bohr Instabilità classica del modello di Rutherford: l elettrone in orbita circolare deve emettere onde e.m. e perde energia fino a collassare sul nucleo Bohr (1913) postula che l elettrone può muoversi solo su determinate orbite circolari, stati stazionari, sotto l effetto della attrazione Coulombiana e secondo le leggi della meccanica classica. Ciononostante l elettrone non irraggia (?!). I momenti angolari permessi sono solo i multipli di! = h 2π Le transizioni tra stati stazionari sono possibili solo con assorbimento o emissione di fotoni secondo la relazione di Planck E i E f = hν!204
8 livelli energetici del modello di Bohr energia totale dell elettrone orbita circolare k Ze2 r 2 = m v2 r k Ze2 r energia cinetica per orbita circolare energia totale per orbita circolare E = 1 2 mv2 k Ze2 r = mv 2 quantizzazione del momento angolare v 2 = n 2! 2 m 2 r = kze2 2 mr r n = n 2! 2 mkze mv2 = 1 2 k Ze2 r E = 1 2 k Ze2 r mvr = n!, da cui si ricava v = n! mr E n = 1 2 k Ze2 r = kze2 2 ( ) 2 mkze 2 1! 2 n = m kze ! 2 n 2!205
9 transizioni tra orbite stazionarie calcolando la frequenza emessa o assorbita in una transizione ν = E i E f h ( ) 2 = m e kze 2 1 4π! 3 n f n i si ritrova la formula di Rydberg-Ritz ottenendo il valore numerico di R determinato sperimentalmente! Il valore che si ottiene per n=1 e Z=1 (idrogeno) è il cosiddetto raggio di Bohr per l idrogeno: r B =!2 m e ke 2 = 0, m = 0,053 nm a cui corrisponde una energia di legame pari a ev. Il secondo livello energetico ha una energia di -3.4 ev, per cui la prima riga di assorbimento corrisponde a fotoni di energia hv = 10.2 ev Spettri di emissione e spettri di assorbimento. Solo la serie di Lyman si trova in entrambi!206
10 Importanza della spettroscopia nell interpretazione dell universo L analisi spettrale della luce proveniente da qualunque oggetto cosmico ci permette di identificare gli elementi presenti nell oggetto cosmico. In effetti si ritrovano gli stessi pattern spettrali osservati sulla Terra, ma con lunghezze d onda allungate (spostate verso il rosso, red-shift ) in funzione della velocità con cui l oggetto si sposta (si allontana) da noi. Si tratta dell effetto Doppler, che dimostra che tutti gli oggetti lontani si allontanano da noi, ed è alla base dell ipotesi dell esapansione dell Universo.!207
11 Limiti del modello di Bohr Il modello di Bohr funzionava bene per l idrogeno e per gli atomi idrogenoidi, ma non per gli altri elementi Non dava alcuna spiegazione di come avvenissero effettivamente le transizioni (per esempio non permetteva di calcolare la diversa intensità delle varie righe) Non rendeva conto di tutte le righe osservate (spesso si osservano doppietti o multipletti di righe) Inoltre i postulati di Bohr non avevano nessuna giustificazione nella fisica classica, benché la loro assunzione permetteva poi un trattamento puramente classico!208
12 Onde associate agli elettroni De Broglie (1924): ipotesi ondulatoria per gli elettroni: ν = E h λ = h p analoga alla relazione di Einstein-Planck per i fotoni: E = pc νλ = c λ = c ν = hc E = hc pc = h p Su queste basi, la quantizzazione di Bohr si traduce in una quantizzazione della lunghezza dell orbita in termini di lunghezza d onda dell elettrone: pr = h λ r = n h 2π onde stazionarie su una circonferenza nλ = 2πr!209
13 onde stazionarie su un anello!210
14 le orbite stazionarie secondo de Broglie r 7 r 8 r r a)!211
15 Diffrazione di elettroni Una conseguenza dell ipotesi ondulatoria per gli elettroni che poteva essere verificata sperimentalmente è la possibilità di osservare fenomeni di diffrazione Esperimenti di Davisson-Germer (1927), ripetuti successivamente da G.P. Thomson, che confrontando con i raggi X ottiene lunghezze d onda di m per elettroni di energia cinetica di kev) 1 λ = n 2d sinϑ = p h = 2mE h = 2meV h!212
16 Diffrazione da singola fenditura diffrazione ottica alla Fraunhofer: d d se 2 sinϑ = n λ le due metà del fronte sono in opposizione di fase ϑ0 primo angolo per cui l intensità si annulla sinϑ 0 = λ d minore è d, maggiore è ϑ0 da un apertura puntiforme esce un onda sferica!213
17 Diffrazione di elettroni e principio di indeterminazione L impulso iniziale degli elettroni è orizzontale L impulso finale avrà una direzione diversa sinϑ 0 = λ d Ad una indeterminazione in posizione Δy = d una indeterminazione in impulso: usando la relazione di de Broglie per l impulso sinϑ 0 = λ d = λ Δy = p max y p ΔyΔp = h sinϑ = p y p = Δp h λ sinϑ 0 = p max y p = Δp p Δp = p y max corrisponde λ = h p!214
18 un altro aspetto dell indeterminazione di un onda Supponiamo di avere un pacchetto d onde, localizzato in una regione Δx = Nλ Se Δx è molto piccolo rispetto a λ, non è possibile determinare λ! Se Δx è dell ordine di λ, l errore su λ è dell ordine di λ, per cui ΔxΔλ λ 2 Se N è grande, posso determinare λ contando N: λ = Δx N Δλ λ 1 N Δλ λ N ΔxΔλ λ 2 ΔxΔλ Per un pacchetto d onde quindi è sempre 1 λ 2 tanto meglio conosco la posizione, tanto peggio conosco la lunghezza d onda. La relazione può essere resa rigorosa ricorrendo alla trasformata di Fourier.!215
19 Il principio di indeterminazione di Heisenberg Se partiamo dalla ultima relazione e la combiniamo con l ipotesi ondulatoria di de Broglie otteniamo: ΔxΔλ 1 hδxδλ h λ 2 λ 2 p = h λ Δp = h ΔxΔp h λ Δλ 2 Heisenberg (1927) dimostra che, quali che siano i metodi di misura dell impulso e della posizione, deve sempre essere: ΔxΔp h 4π =! 2 Principio di indeterminazione della meccanica quantistica!216
20 meccanica quantistica Equazione di Schroedinger Soluzione: funzione d onda Interpretazione del quadrato della funzione d onda come densità di probabilità di trovare la particella in una determinata posizione Applicazioni alla fisica atomica: gli orbitali elettronici Il processo di misura e il collasso della funzione d onda in che stato si trova la particella prima di essere misurata? dove si trova la particella prima di incontrare il rivelatore? Interpretazione di Copenaghen e eventuali alternative Indeterminazione ontologica (Bohr) vs. indeterminazione epistemologica (realismo) (Einstein) Il paradosso EPR La meccanica quantistica per particelle relativistiche (La meccanica quantistica e la relatività generale)!217
21 Equazione di Schroedinger La ricetta: equazione matematicamente coerente con le leggi fisiche, continua ed a singolo valore equazione lineare, per garantire il principio di sovrapposizione conservazione dell energia consistenza con l ipotesi di de Broglie!218
22 Equazione di Schroedinger eq. di D Alembert soluzione di onda piana energia per un fotone energia per un elettrone onda piana per elettrone relazione Ψ(x,t) classica = e tra energia! l equazione 2 ed 2 impulso riproduce la relazione corretta 2 f (x,t) = 1 2 f (x,t) x 2 υ 2 t 2 f (x,t) = Ae i(kx ωt ) con ω = 2πν = υk = υ 2π λ E(= hν =!ω ) = pc(= hc / λ =!ck) ck = ω E =!ω = p2 2m ω =!k 2 2m!k i(kx 2m t ) 2m x Ψ(x,t) = i! 2 t Ψ(x,t)! 2 2m ( k 2 ) = i! i!k 2 2m equazione per l energia di una! 2 2 particella libera 2m x Ψ(x,t) =!2 k 2 2 2m onda piana:! eq. di Schroedinger completa (1926) 2 2 particella 2m x + V(x) libera che si propaga 2 nello spazio 2 Ψ(x,t) = EΨ(x,t) Ψ(x,t) = i! t Ψ(x,t)!219
23 Equazione di Schroedinger indipendente dal tempo per evitare le complicazioni dell equazione alle derivate parziali si può assumere una situazione unidimensionale indipendente dal tempo e ricercare in analogia con le onde classiche una soluzione sinusoidale: ψ (x) = Asin kx d 2 dx 2 ψ (x) = k 2 Asin kx = k 2 ψ (x)! 2 2m! 2 2m d 2 dx ψ (x) =!2 k 2 2 2m ψ (x) d 2 ψ (x) = Eψ (x) 2 dx e introducendo una energia potenziale V(x)! 2 2m d 2 ψ (x) = (E V(x))ψ (x) 2 dx!220
24 Equazione di Schroedinger eq. di Schroedinger completa! 2 2m 2 x + V(x) 2 Ψ(x,t) = i! t Ψ(x,t) Si noti che nell eq. di Schroedinger l interazione della particella è rappresentata da un potenziale, non da una forza! Si noti anche che per soddisfare l eq. di Schroedinger la funzione d onda non può essere reale!!221
25 Il significato della funzione d onda Interpretazione di Max Born (1926): il modulo quadro della funzione d onda rappresenta la probabilità di trovare la particella in una determinata posizione dello spazio Funzione d onda, c x 1 x 2 x 3 Posizione, x Probabilità, c 2 La probabilità di trovare la particella è massima nella posizione x 2. La probabilità di trovare la particella è nulla nelle posizioni x 1 e x 3. x 1 x 2 x 3 Posizione, x a) b)!222
1 3 STRUTTURA ATOMICA
 1 3 STRUTTURA ATOMICA COME SI SPIEGA LA STRUTTURA DELL ATOMO? Secondo il modello atomico di Rutherford e sulla base della fisica classica, gli elettroni dovrebbero collassare sul nucleo per effetto delle
1 3 STRUTTURA ATOMICA COME SI SPIEGA LA STRUTTURA DELL ATOMO? Secondo il modello atomico di Rutherford e sulla base della fisica classica, gli elettroni dovrebbero collassare sul nucleo per effetto delle
Generalità delle onde elettromagnetiche
 Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
L atomo di Bohr e i raggi X
 L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
STRUTTURA ATOMICA. Per lo studio della struttura dell atomo ci si avvale della Spettroscopia.
 STRUTTURA ATOMICA Il modello planetario dell atomo secondo Rutherford si appoggia sulla meccanica classica. Il modello non può essere corretto visto che per descrivere il comportamento delle particelle
STRUTTURA ATOMICA Il modello planetario dell atomo secondo Rutherford si appoggia sulla meccanica classica. Il modello non può essere corretto visto che per descrivere il comportamento delle particelle
Teoria Atomica Moderna. Chimica generale ed Inorganica: Chimica Generale. sorgenti di emissione di luce. E = hν. νλ = c. E = mc 2
 sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
Modelli atomici Modello atomico di Rutheford Per t s d u i diare la t s rutt ttura t a omica Ruth th f or (
 Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford (1871-1937) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio) Rutherford suppose che gli atomi
Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford (1871-1937) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio) Rutherford suppose che gli atomi
Appunti di Meccanica Quantistica prima parte
 Appunti di Meccanica Quantistica prima parte Paolo Cavallo 4 marzo 2004 Sommario Le idee principali della Meccanica Quantistica sono presentate in maniera elementare nel contesto dell ultimo anno della
Appunti di Meccanica Quantistica prima parte Paolo Cavallo 4 marzo 2004 Sommario Le idee principali della Meccanica Quantistica sono presentate in maniera elementare nel contesto dell ultimo anno della
Il modello di Bohr. Lezioni d'autore di Giorgio Benedetti
 Il modello di Bohr Lezioni d'autore di Giorgio Benedetti VIDEO Gli spettri di emissione Nel 1859 il fisico G.R. Kirchoff scoprì che ogni elemento chimico presenta uno spettro di emissione caratteristico,
Il modello di Bohr Lezioni d'autore di Giorgio Benedetti VIDEO Gli spettri di emissione Nel 1859 il fisico G.R. Kirchoff scoprì che ogni elemento chimico presenta uno spettro di emissione caratteristico,
Il metodo scientifico
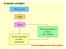 Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica
 ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
mvr = n h e 2 r = m v 2 e m r v = La configurazione elettronica r = e 2 m v 2 (1) Quantizzazione del momento angolare (2) 4 πε.
 La configurazione elettronica Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica F = m a. F Coulomb = 1 4 πε. q q ' F r centrifuga = m v r ε =8.85*10-1 Fm-1 (costante
La configurazione elettronica Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica F = m a. F Coulomb = 1 4 πε. q q ' F r centrifuga = m v r ε =8.85*10-1 Fm-1 (costante
Introduzione alla meccanica quantistica. Vincenzo Barone
 Accademia delle Scienze di Torino 9 novembre 2017 Introduzione alla meccanica quantistica Vincenzo Barone barone@to.infn.it Parte I: Le basi della meccanica quantistica (questioni didattiche) Parte II:
Accademia delle Scienze di Torino 9 novembre 2017 Introduzione alla meccanica quantistica Vincenzo Barone barone@to.infn.it Parte I: Le basi della meccanica quantistica (questioni didattiche) Parte II:
Le Caratteristiche della Luce
 7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
Capitolo 8 La struttura dell atomo
 Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Crisi della Fisica Classica & Fisica Quantistica
 Crisi della Fisica Classica & Fisica Quantistica Guido Montagna Dipartimento di Fisica, Università di Pavia & INFN, Sezione di Pavia February 11, 2018 G. Montagna, Università di Pavia & INFN (Dipartimento
Crisi della Fisica Classica & Fisica Quantistica Guido Montagna Dipartimento di Fisica, Università di Pavia & INFN, Sezione di Pavia February 11, 2018 G. Montagna, Università di Pavia & INFN (Dipartimento
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Tabella periodica degli elementi
 Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
p e c = ev Å
 Corso di Introduzione alla Fisica Quantistica (f) Soluzioni Esercizi: Giugno 006 * Quale la lunghezza d onda di de Broglie di un elettrone che ha energia cinetica E 1 = KeV e massa a riposo m 0 = 9.11
Corso di Introduzione alla Fisica Quantistica (f) Soluzioni Esercizi: Giugno 006 * Quale la lunghezza d onda di de Broglie di un elettrone che ha energia cinetica E 1 = KeV e massa a riposo m 0 = 9.11
La natura ondulatoria della materia
 La natura ondulatoria della materia 1. Dualismo onda-particella 2. Principio di indeterminazione di Heisemberg 3. Struttura del nucleo XV - 0 Dualismo onda-particella Come la radiazione presenta una doppia
La natura ondulatoria della materia 1. Dualismo onda-particella 2. Principio di indeterminazione di Heisemberg 3. Struttura del nucleo XV - 0 Dualismo onda-particella Come la radiazione presenta una doppia
Programma della I parte
 Programma della I parte Cenni alla meccanica quantistica: il modello dell atomo Dall atomo ai cristalli: statistica di Fermi-Dirac, il modello a bande di energia, popolazione delle bande, livello di Fermi
Programma della I parte Cenni alla meccanica quantistica: il modello dell atomo Dall atomo ai cristalli: statistica di Fermi-Dirac, il modello a bande di energia, popolazione delle bande, livello di Fermi
Unità Didattica 3. L atomo di idrogeno
 Diapositiva 1 Unità Didattica 3 L atomo di idrogeno Questa unità contiene informazioni sull atomo di idrogeno, i modelli di Tomson, Ruterford e Bor, l esperimento di Frank-Hertz e infine la formula di
Diapositiva 1 Unità Didattica 3 L atomo di idrogeno Questa unità contiene informazioni sull atomo di idrogeno, i modelli di Tomson, Ruterford e Bor, l esperimento di Frank-Hertz e infine la formula di
A Z. L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone. +1e e.
 L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone +1e 0-1e e = Carica elettrica elementare 1.60 10-19 u.m.a.= Unità di Massa Atomica 1.6605 10-4 Il Nuclide A Z Nu Coulomb
L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone +1e 0-1e e = Carica elettrica elementare 1.60 10-19 u.m.a.= Unità di Massa Atomica 1.6605 10-4 Il Nuclide A Z Nu Coulomb
L atomo di Bohr. Argomenti. Al tempo di Bohr. Spettri atomici 19/03/2010
 Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
Introduzione alla Meccanica Quantistica (MQ):
 Introduzione alla Meccanica Quantistica (MQ): 1 MECCANICA QUANTISTICA ELETTRONI MATERIA MOLECOLE ATOMI NUCLEI La nostra attuale comprensione della struttura atomica e molecolare si basa sui principi della
Introduzione alla Meccanica Quantistica (MQ): 1 MECCANICA QUANTISTICA ELETTRONI MATERIA MOLECOLE ATOMI NUCLEI La nostra attuale comprensione della struttura atomica e molecolare si basa sui principi della
Struttura della materia
 Struttura della materia 1. L elettrone 2. Effetto Compton 3. Struttura dell atomo XIV - 0 Rapporto carica/massa dell elettrone Esperimento di Thomson: raggi catodici. Fascio non deflesso: Quando B=0: con
Struttura della materia 1. L elettrone 2. Effetto Compton 3. Struttura dell atomo XIV - 0 Rapporto carica/massa dell elettrone Esperimento di Thomson: raggi catodici. Fascio non deflesso: Quando B=0: con
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
Fisica Quantistica. 1. Comportamento quantistico. 2. Effetto fotoelettrico. 3. Dualismo onda-corpuscolo. 4. Principio di indeterminazione
 Fisica Quantistica by Prof.ssa Paola Giacconi 1. Comportamento quantistico 2. Effetto fotoelettrico 3. Dualismo onda-corpuscolo 4. Principio di indeterminazione 1. COMPORTAMENTO QUANTISTICO La meccanica
Fisica Quantistica by Prof.ssa Paola Giacconi 1. Comportamento quantistico 2. Effetto fotoelettrico 3. Dualismo onda-corpuscolo 4. Principio di indeterminazione 1. COMPORTAMENTO QUANTISTICO La meccanica
La struttura dell atomo
 La Teoria Atomica La struttura dell atomo 10-10 m 10-14 m Proprietà delle tre particelle subatomiche fondamentali Carica Massa Nome (simbolo) relativa assoluta (C) relativa (uma)* Assoluta (g) Posizione
La Teoria Atomica La struttura dell atomo 10-10 m 10-14 m Proprietà delle tre particelle subatomiche fondamentali Carica Massa Nome (simbolo) relativa assoluta (C) relativa (uma)* Assoluta (g) Posizione
Enrico Silva - diritti riservati - Non è permessa, fra l altro, l inclusione anche parziale in altre opere senza il consenso scritto dell autore
 Indeterminazione Finora si sono considerate le proprietà ondulatorie, lavorando sulla fase di una (per ora non meglio specificata) funzione. Si sono ricavate o ipotizzate relazioni per: - lunghezza d onda
Indeterminazione Finora si sono considerate le proprietà ondulatorie, lavorando sulla fase di una (per ora non meglio specificata) funzione. Si sono ricavate o ipotizzate relazioni per: - lunghezza d onda
ATOMO. Avogadro (1811) Volumi uguali di gas diversi contengono un ugual numero di MOLECOLE (N A =6,022*10 23 )
 ATOMO Democrito IV secolo A.C. (atomos = indivisibile) Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811)
ATOMO Democrito IV secolo A.C. (atomos = indivisibile) Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811)
LA CRISI DELLA FISICA CLASSICA
 LA CRISI DELLA FISICA CLASSICA I a Parte: - Comportamento corpuscolare della luce II a Parte: - Il modello atomico - Comportamento ondulatorio della materia III a Parte: - Dualità onda-particella: esperimento
LA CRISI DELLA FISICA CLASSICA I a Parte: - Comportamento corpuscolare della luce II a Parte: - Il modello atomico - Comportamento ondulatorio della materia III a Parte: - Dualità onda-particella: esperimento
LE ORIGINI DELLA TEORIA QUANTISTICA
 LE ORIGINI DELLA TEORIA QUANTISTICA LEZIONE N.4 CONDUZIONE NEI SOLIDI L. Palumbo - Fisica Moderna - 2017-18 1 MODELLO ATOMICO DI BOHR Sono ammesse solo le orbite stazionarie, l energia può essere assorbita
LE ORIGINI DELLA TEORIA QUANTISTICA LEZIONE N.4 CONDUZIONE NEI SOLIDI L. Palumbo - Fisica Moderna - 2017-18 1 MODELLO ATOMICO DI BOHR Sono ammesse solo le orbite stazionarie, l energia può essere assorbita
Fisica Moderna e contemporanea
 Fisica Moderna e contemporanea SSIS Puglia Prof. Luigi Schiavulli luigi.schiavulli@ba.infn.it Dipartimento Interateneo di Fisica Michelangelo Merlin 02/02/2006 1 Sommario Quadro riassuntivo sulla Fisica
Fisica Moderna e contemporanea SSIS Puglia Prof. Luigi Schiavulli luigi.schiavulli@ba.infn.it Dipartimento Interateneo di Fisica Michelangelo Merlin 02/02/2006 1 Sommario Quadro riassuntivo sulla Fisica
Raccolta di esercizi di fisica moderna
 Raccolta di esercizi di fisica moderna M. Quaglia IIS Avogadro Torino M. Quaglia (IIS Avogadro Torino) Raccolta di esercizi di fisica moderna Torino, 20/11/2014 1 / 30 Prova AIF e Sillabo http://www.aif.it/archivioa/aif_seconda_prova_di_fisica.pdf
Raccolta di esercizi di fisica moderna M. Quaglia IIS Avogadro Torino M. Quaglia (IIS Avogadro Torino) Raccolta di esercizi di fisica moderna Torino, 20/11/2014 1 / 30 Prova AIF e Sillabo http://www.aif.it/archivioa/aif_seconda_prova_di_fisica.pdf
L'effetto Compton (1923)
 L'effetto Compton (1923) Conferma la natura quantizzata della radiazione elettromagnetica (raggi X) Conferma la natura corpuscolare dei quanti di radiazione che si comportano come particelle dotate di
L'effetto Compton (1923) Conferma la natura quantizzata della radiazione elettromagnetica (raggi X) Conferma la natura corpuscolare dei quanti di radiazione che si comportano come particelle dotate di
Rappresentazione dell atomo. Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano.
 Rappresentazione dell atomo Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano. Informazioni importanti circa la dimensione dell atomo e la distribuzione della massa
Rappresentazione dell atomo Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano. Informazioni importanti circa la dimensione dell atomo e la distribuzione della massa
La radiazione elettromagnetica. aumento della frequenza n della radiazione aumento dell energia E della radiazione
 La radiazione elettromagnetica aumento della frequenza n della radiazione aumento dell energia E della radiazione La radiazione elettromagnetica Un onda elettromagnetica è caratterizzata dalla lunghezza
La radiazione elettromagnetica aumento della frequenza n della radiazione aumento dell energia E della radiazione La radiazione elettromagnetica Un onda elettromagnetica è caratterizzata dalla lunghezza
Lezioni di Meccanica Quantistica
 Luigi E. Picasso Lezioni di Meccanica Quantistica seconda edizione Edizioni ETS www.edizioniets.com Copyright 2015 EDIZIONI ETS Piazza Carrara, 16-19, I-56126 Pisa info@edizioniets.com www.edizioniets.com
Luigi E. Picasso Lezioni di Meccanica Quantistica seconda edizione Edizioni ETS www.edizioniets.com Copyright 2015 EDIZIONI ETS Piazza Carrara, 16-19, I-56126 Pisa info@edizioniets.com www.edizioniets.com
La nascita della fisica moderna. (un racconto di inizio 900)
 La nascita della fisica moderna (un racconto di inizio 900) Sviluppo storico della fisica tra fine 800 e il 1927 Fisica sperimentale fine 800 Fisica teorica fine 800 1900 1905 1911 1913 1916 1924 1925-1927
La nascita della fisica moderna (un racconto di inizio 900) Sviluppo storico della fisica tra fine 800 e il 1927 Fisica sperimentale fine 800 Fisica teorica fine 800 1900 1905 1911 1913 1916 1924 1925-1927
Università degli Studi dell Aquila Corso di Laurea in Scienze e Tecnologie Chimiche e dei Materiali Corso di Fisica della Materia Prof. L.
 Università degli Studi dell Aquila Corso di Laurea in Scienze e Tecnologie Chimiche e dei Materiali Corso di Fisica della Materia Prof. L. Lozzi Testi degli esercizi svolti in aula Corpo Nero 1. Il corpo
Università degli Studi dell Aquila Corso di Laurea in Scienze e Tecnologie Chimiche e dei Materiali Corso di Fisica della Materia Prof. L. Lozzi Testi degli esercizi svolti in aula Corpo Nero 1. Il corpo
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Elettronica dello Stato Solido Lezione 4: L effetto fotoelettrico e il. Daniele Ielmini DEI Politecnico di Milano
 Elettronica dello Stato Solido Lezione 4: L effetto fotoelettrico e il dualismo onda-particella Daniele Ielmini DEI Politecnico di Milano ielmini@elet.polimi.it Outline Crisi della meccanica classica Radiazione
Elettronica dello Stato Solido Lezione 4: L effetto fotoelettrico e il dualismo onda-particella Daniele Ielmini DEI Politecnico di Milano ielmini@elet.polimi.it Outline Crisi della meccanica classica Radiazione
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA
 LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
STRUTTURA DELL'ATOMO
 STRUTTURA DELL'ATOMO IDROGENO 1 H ELIO He 1 2 4 Modello planetario di Rutherford -protoni e neutroni costituiscono il nucleo in cui è concentrata tutta la massa - gli elettroni ruotano attorno al nucleo
STRUTTURA DELL'ATOMO IDROGENO 1 H ELIO He 1 2 4 Modello planetario di Rutherford -protoni e neutroni costituiscono il nucleo in cui è concentrata tutta la massa - gli elettroni ruotano attorno al nucleo
Teoria Atomica di Dalton
 Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
LIBRETTO DELLE LEZIONI DEL CORSO DI. Fisica quantistica e dello stato solido IMPARTITE DAL PROF. Antonio Polimeni NELL'ANNO ACCADEMICO 2017/2018
 1 UNIVERSITA DEGLI STUDI DI ROMA LA SAPIENZA FACOLTA DI INGEGNERIA LIBRETTO DELLE LEZIONI DEL CORSO DI Fisica quantistica e dello stato solido IMPARTITE DAL PROF. Antonio Polimeni NELL'ANNO ACCADEMICO
1 UNIVERSITA DEGLI STUDI DI ROMA LA SAPIENZA FACOLTA DI INGEGNERIA LIBRETTO DELLE LEZIONI DEL CORSO DI Fisica quantistica e dello stato solido IMPARTITE DAL PROF. Antonio Polimeni NELL'ANNO ACCADEMICO
Spettro elettromagnetico
 Spettro elettromagnetico Sorgenti Finestre Tipo Oggetti rilevabili Raggi γ ev Raggi X Lunghezza d onda E hc = hν = = λ 12. 39 λ( A o ) Visibile Infrarosso icro onde Onde-radio Dimensione degli oggetti
Spettro elettromagnetico Sorgenti Finestre Tipo Oggetti rilevabili Raggi γ ev Raggi X Lunghezza d onda E hc = hν = = λ 12. 39 λ( A o ) Visibile Infrarosso icro onde Onde-radio Dimensione degli oggetti
La Crisi della Fisica Classica
 La Crisi della Fisica Classica F. Borgonovi (Dipartimento di Matematica e Fisica) Interdisciplinary Laboratories for Advanced Materials Physics (i-lamp) Department of Mathematics and Physics, Catholic
La Crisi della Fisica Classica F. Borgonovi (Dipartimento di Matematica e Fisica) Interdisciplinary Laboratories for Advanced Materials Physics (i-lamp) Department of Mathematics and Physics, Catholic
Equazioni di Maxwell. (legge di Gauss per il campo elettrico) (legge di Gauss per il campo magnetico) C (legge di Faraday)
 Equazioni di Maxwell Φ S ( r E ) = Q ε 0 (legge di Gauss per il campo elettrico) Φ S ( r B ) = 0 (legge di Gauss per il campo magnetico) C l ( r Φ B ) = µ 0 ε S ( E r ) 0 + µ (legge di Ampère - Maxwell)
Equazioni di Maxwell Φ S ( r E ) = Q ε 0 (legge di Gauss per il campo elettrico) Φ S ( r B ) = 0 (legge di Gauss per il campo magnetico) C l ( r Φ B ) = µ 0 ε S ( E r ) 0 + µ (legge di Ampère - Maxwell)
Atomo. Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale)
 Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano
Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano
Introduzione alla Meccanica Quantistica - II. Fausto Borgonovi Dipartimento di Matematica e Fisica Universitá Cattolica via Musei 41, BRESCIA
 Introduzione alla Meccanica Quantistica - II Fausto Borgonovi Dipartimento di Matematica e Fisica Universitá Cattolica via Musei 41, BRESCIA Riassunto delle puntate precedenti Doppia natura onda corpuscolo
Introduzione alla Meccanica Quantistica - II Fausto Borgonovi Dipartimento di Matematica e Fisica Universitá Cattolica via Musei 41, BRESCIA Riassunto delle puntate precedenti Doppia natura onda corpuscolo
Unità 2. La teoria quantistica
 Unità 2 La teoria quantistica L'effetto fotoelettrico Nel 1902 il fisico P. Lenard studiò l'effetto fotoelettrico. Esso è l'emissione di elettroni da parte di un metallo su cui incide un'onda elettromagnetica.
Unità 2 La teoria quantistica L'effetto fotoelettrico Nel 1902 il fisico P. Lenard studiò l'effetto fotoelettrico. Esso è l'emissione di elettroni da parte di un metallo su cui incide un'onda elettromagnetica.
La Meccanica Quantistica
 La Meccanica Quantistica Se quando pensiamo a un atomo ci immaginiamo qualcosa di questo tipo Dobbiamo rivedere le nostre idee LA CRISI DELLA FISICA CLASSICA La crisi della fisica classica Un secolo fa
La Meccanica Quantistica Se quando pensiamo a un atomo ci immaginiamo qualcosa di questo tipo Dobbiamo rivedere le nostre idee LA CRISI DELLA FISICA CLASSICA La crisi della fisica classica Un secolo fa
n(z) = n(0) e m gz/k B T ; (1)
 Corso di Introduzione alla Fisica Quantistica (f) Prova scritta 4 Luglio 008 - (tre ore a disposizione) [sufficienza con punti 8 circa di cui almeno 4 dagli esercizi nn. 3 e/o 4] [i bonus possono essere
Corso di Introduzione alla Fisica Quantistica (f) Prova scritta 4 Luglio 008 - (tre ore a disposizione) [sufficienza con punti 8 circa di cui almeno 4 dagli esercizi nn. 3 e/o 4] [i bonus possono essere
Ne esistono due formulazioni (entrambe sviluppate fra il 1925 ed il 1930 ) ed usate in particolare modo per i sistemi chimici
 MECCANICA QUANTISTICA IN1 Ne esistono due formulazioni (entrambe sviluppate fra il 195 ed il 1930 ) ed usate in particolare modo per i sistemi chimici - Meccanica Matriciale :essenzialmente dovuta ad Heisenberg
MECCANICA QUANTISTICA IN1 Ne esistono due formulazioni (entrambe sviluppate fra il 195 ed il 1930 ) ed usate in particolare modo per i sistemi chimici - Meccanica Matriciale :essenzialmente dovuta ad Heisenberg
Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton)
 Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Laurea Magistrale di INGEGNERIA ELETTRONICA (LM-29) a.a , I semestre! Programma del corso di FISICA SUPERIORE! Docente: MAURO PAPINUTTO!
 Laurea Magistrale di INGEGNERIA ELETTRONICA (LM-29) a.a. 2013-14, I semestre Programma del corso di FISICA SUPERIORE Docente: MAURO PAPINUTTO Dipartimento di Fisica Phone: +39 06 4991 4376 Universita`
Laurea Magistrale di INGEGNERIA ELETTRONICA (LM-29) a.a. 2013-14, I semestre Programma del corso di FISICA SUPERIORE Docente: MAURO PAPINUTTO Dipartimento di Fisica Phone: +39 06 4991 4376 Universita`
LE ORIGINI DELLA TEORIA QUANTISTICA
 LE ORIGINI DELLA TEORIA QUANTISTICA LEZIONE N.3 DUALISMO ONDA-PARTICELLA L. Palumbo - Fisica Moderna - 2017-18 1 Legge di Wien (1893) T λ Μ = b L. Palumbo - Fisica Moderna - 2017-18 2 POSTULATO DI PLANCK
LE ORIGINI DELLA TEORIA QUANTISTICA LEZIONE N.3 DUALISMO ONDA-PARTICELLA L. Palumbo - Fisica Moderna - 2017-18 1 Legge di Wien (1893) T λ Μ = b L. Palumbo - Fisica Moderna - 2017-18 2 POSTULATO DI PLANCK
Elettroni luce e quanti
 Elettroni luce e quanti con visita ai Laboratori Nazionali di Frascati del INFN dedicati agli acceleratori d elettroni e positroni per studiarne le interazioni e per farne sorgenti ultrabrillanti di luce
Elettroni luce e quanti con visita ai Laboratori Nazionali di Frascati del INFN dedicati agli acceleratori d elettroni e positroni per studiarne le interazioni e per farne sorgenti ultrabrillanti di luce
CORSO DI LAUREA IN OTTICA E OPTOMETRIA
 CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
specchio concavo Immagine diffusa da una sorgente S
 specchio concavo 1 Immagine diffusa da una sorgente S S C I specchio concavo 2 immagine I della sorgente S S C I propagazione delle onde 3 principio di Huygens S 4 interferenza sovrapposizione di onde
specchio concavo 1 Immagine diffusa da una sorgente S S C I specchio concavo 2 immagine I della sorgente S S C I propagazione delle onde 3 principio di Huygens S 4 interferenza sovrapposizione di onde
Problemi con l'atomo. Significato delle righe spettrali. Modello dell'atomo
 Problemi con l'atomo Significato delle righe spettrali Modello dell'atomo Righe spettrali della luce emissione e assorbimento Posizione delle righe spettrali Dipende dall'elemento considerato Per l'idrogeno
Problemi con l'atomo Significato delle righe spettrali Modello dell'atomo Righe spettrali della luce emissione e assorbimento Posizione delle righe spettrali Dipende dall'elemento considerato Per l'idrogeno
LUCE E ONDE ELETTROMAGNETICHE
 LUCE E ONDE ELETTROMAGNETICHE QUASI TUTTO QUELLO CHE SAPPIAMO SULLA STRUTTURA DELL ATOMO DERIVA DALL ANALISI DELLA LUCE EMESSA O ASSORBITA DALLE SOSTANZE CHI FU IL PRIMO AD ACCORGERSI CHE I SINGOLI ELEMENTI
LUCE E ONDE ELETTROMAGNETICHE QUASI TUTTO QUELLO CHE SAPPIAMO SULLA STRUTTURA DELL ATOMO DERIVA DALL ANALISI DELLA LUCE EMESSA O ASSORBITA DALLE SOSTANZE CHI FU IL PRIMO AD ACCORGERSI CHE I SINGOLI ELEMENTI
Meccanica quantistica Mathesis 2016 Prof. S. Savarino
 Meccanica quantistica Mathesis 2016 Prof. S. Savarino Quanti Corpo nero: è un oggetto che assorbe tutta la radiazione senza rifletterla. Come una corda legata agli estremi può produrre onde stazionarie
Meccanica quantistica Mathesis 2016 Prof. S. Savarino Quanti Corpo nero: è un oggetto che assorbe tutta la radiazione senza rifletterla. Come una corda legata agli estremi può produrre onde stazionarie
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA. (Plank Einstein)
 L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
catastrofe ultravioletta
 Fisica moderna Radiazione termica La radiazione termica è l insieme di onde elettromagnetiche che ogni corpo emette per effetto della sua temperatura Un corpo nero è un corpo che assorbe completamente
Fisica moderna Radiazione termica La radiazione termica è l insieme di onde elettromagnetiche che ogni corpo emette per effetto della sua temperatura Un corpo nero è un corpo che assorbe completamente
Introduzione ai fenomeni quantistici
 Introduzione ai fenomeni quantistici Tratto da: The Feynman lectures on physics, vol. 3 Marco Bonvini Nicodemo Magnoli Meccanica: Keplero (1608-1619) Galilei (1630) Newton (1687) Termodinamica: Kelvin
Introduzione ai fenomeni quantistici Tratto da: The Feynman lectures on physics, vol. 3 Marco Bonvini Nicodemo Magnoli Meccanica: Keplero (1608-1619) Galilei (1630) Newton (1687) Termodinamica: Kelvin
La Matematica del Mondo dei Quanti
 La Matematica del Mondo dei Quanti Gerardo Morsella Dipartimento di Matematica Scienza Orienta 2017 Università di Roma Tor Vergata 13 febbraio 2017 Gerardo Morsella (Mat) La Matematica del Mondo dei Quanti
La Matematica del Mondo dei Quanti Gerardo Morsella Dipartimento di Matematica Scienza Orienta 2017 Università di Roma Tor Vergata 13 febbraio 2017 Gerardo Morsella (Mat) La Matematica del Mondo dei Quanti
Comune ordine di riempimento degli orbitali di un atomo
 Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
Fisica Moderna Torino, 31/01/2013. Dott. Morrone Davide Scienze M.F.N. - Unito
 Fisica Moderna Torino, 31/01/2013 Dott. Morrone Davide Scienze M.F.N. - Unito Diffrazione 1 FENDITURA 2 FENDITURE RETICOLO = N fenditure regolarmente spaziate Le curve dei massimi si stringono e diventano
Fisica Moderna Torino, 31/01/2013 Dott. Morrone Davide Scienze M.F.N. - Unito Diffrazione 1 FENDITURA 2 FENDITURE RETICOLO = N fenditure regolarmente spaziate Le curve dei massimi si stringono e diventano
Quadro di Riferimento della II prova di Fisica dell esame di Stato per i Licei Scientifici
 Quadro di Riferimento della II prova di Fisica dell esame di Stato per i Licei Scientifici Il presente documento individua le conoscenze, abilità e competenze che lo studente dovrà aver acquisito al termine
Quadro di Riferimento della II prova di Fisica dell esame di Stato per i Licei Scientifici Il presente documento individua le conoscenze, abilità e competenze che lo studente dovrà aver acquisito al termine
La teoria atomistica
 La teoria atomistica Joseph John Thomson Fisico britannico È noto per aver scoperto nel 1897 la particella di carica negativa: l'elettrone Ebbe come studente Rutherford Vinse il Nobel per la fisica nel
La teoria atomistica Joseph John Thomson Fisico britannico È noto per aver scoperto nel 1897 la particella di carica negativa: l'elettrone Ebbe come studente Rutherford Vinse il Nobel per la fisica nel
MODELLO ATOMICO DI BOHR - ULTERIORI APPROFONDIMENTI
 MODELLO ATOMICO DI BOHR - ULTERIORI APPROFONDIMENTI Se riscaldiamo un qualsiasi elemento chimico ponendolo ad esempio su una fiamma, notiamo che esso emette un colore caratteristico. Ad esempio riscaldando
MODELLO ATOMICO DI BOHR - ULTERIORI APPROFONDIMENTI Se riscaldiamo un qualsiasi elemento chimico ponendolo ad esempio su una fiamma, notiamo che esso emette un colore caratteristico. Ad esempio riscaldando
the power of ten Prof.ssa Patrizia Gallucci
 https://www.youtube.com/watch?v=5ckd0apswe8 the power of ten Prof.ssa Patrizia Gallucci ESPERIMENTO DI RUTHEFORD Dopo l esperimento Rutheford ipotizzò un atomo con un nucleo centrale,formato da neutroni
https://www.youtube.com/watch?v=5ckd0apswe8 the power of ten Prof.ssa Patrizia Gallucci ESPERIMENTO DI RUTHEFORD Dopo l esperimento Rutheford ipotizzò un atomo con un nucleo centrale,formato da neutroni
Atomi a più elettroni
 Atomi a più elettroni L atomo di elio è il più semplice sistema di atomo a più elettroni. Due sistemi di livelli tra i quali non si osservano transizioni Sistema di singoletto->paraelio Righe singole,
Atomi a più elettroni L atomo di elio è il più semplice sistema di atomo a più elettroni. Due sistemi di livelli tra i quali non si osservano transizioni Sistema di singoletto->paraelio Righe singole,
La complessa semplicità dell'atomo di idrogeno!
 La complessa semplicità dell'atomo di idrogeno Bergamo, venerdì 1 Febbraio 2013 Stefano Covino INAF - Osservatorio Astronomico di Brera Un po di terminologia Atomo (dal greco, indivisibile): atomismo (Leucippo,
La complessa semplicità dell'atomo di idrogeno Bergamo, venerdì 1 Febbraio 2013 Stefano Covino INAF - Osservatorio Astronomico di Brera Un po di terminologia Atomo (dal greco, indivisibile): atomismo (Leucippo,
Fenomeni quantistici
 Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
FISICA QUANTISTICA LIMITI AL MODELLO ATOMICO DI RUTHERFORD. e - Per spiegare la disposizione degli elettroni nell atomo (STRUTTURA ELETTRONICA)
 LIMITI AL MODELLO ATOMICO DI RUTHERFORD e - + nucleo In base alle leggi della FISICA CLASSICA, una particella carica dotata di un movimento circolare libera energia. Di conseguenza, gli elettroni che,
LIMITI AL MODELLO ATOMICO DI RUTHERFORD e - + nucleo In base alle leggi della FISICA CLASSICA, una particella carica dotata di un movimento circolare libera energia. Di conseguenza, gli elettroni che,
S.I.C.S.I. Scuola Interuniversitaria Campana di Specializzazione all Insegnamento VIII ciclo - a.a. 2008/2009
 S.I.C.S.I. Scuola Interuniversitaria Campana di Specializzazione all Insegnamento VIII ciclo - a.a. 008/009 L ATOMO Corso di Laboratorio di Didattica della Fisica III Arturo Stabile Baronissi Dicembre
S.I.C.S.I. Scuola Interuniversitaria Campana di Specializzazione all Insegnamento VIII ciclo - a.a. 008/009 L ATOMO Corso di Laboratorio di Didattica della Fisica III Arturo Stabile Baronissi Dicembre
Prova scritta finale 9 giugno 2005
 Prova scritta finale 9 giugno 5 Istituzioni di Fisica della Materia Prof. orenzo Marrucci anno accademico 4-5 Tempo a disposizione: 3 ore Uso degli appunti o di libri: NON AMMESSO uso della calcolatrice:
Prova scritta finale 9 giugno 5 Istituzioni di Fisica della Materia Prof. orenzo Marrucci anno accademico 4-5 Tempo a disposizione: 3 ore Uso degli appunti o di libri: NON AMMESSO uso della calcolatrice:
LA FISICA QUANTISTICA
 CAPITOLO 45 LA FISICA QUANTISTICA 1 LE PROPRIETÀ ONDULATORIE DELLA MATERIA 1 L onda è un fenomeno collettivo, che coinvolge un insieme di particelle (le molecole di una fune che oscilla, gli atomi dell
CAPITOLO 45 LA FISICA QUANTISTICA 1 LE PROPRIETÀ ONDULATORIE DELLA MATERIA 1 L onda è un fenomeno collettivo, che coinvolge un insieme di particelle (le molecole di una fune che oscilla, gli atomi dell
P. Sapia Università della Calabria. a.a. 2009/10
 FISICA PER I BENI CULTURALI Ii MATERIA E INTERAZIONE CON LA RADIAZIONE P. Sapia Università della Calabria a.a. 2009/10 Interazioni fondamentali Gravitazionale Debolmente attrattiva, tra tutte le particelle
FISICA PER I BENI CULTURALI Ii MATERIA E INTERAZIONE CON LA RADIAZIONE P. Sapia Università della Calabria a.a. 2009/10 Interazioni fondamentali Gravitazionale Debolmente attrattiva, tra tutte le particelle
4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi stato fondamentale stati eccitati
 4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi Accanto allo spettro continuo che i corpi emettono in ragione del loro stato termico, si osservano spettri discreti che sono caratteristici
4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi Accanto allo spettro continuo che i corpi emettono in ragione del loro stato termico, si osservano spettri discreti che sono caratteristici
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE
 LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
Onde elettromagnetiche
 Onde elettromagnetiche c = λν Le onde elettromagnetiche hanno la stessa velocità nel vuoto: la velocità della luce. c = 2.998 10 8 m/s Relazione tra energia e frequenza (Planck - Einstein): E = hν c ν
Onde elettromagnetiche c = λν Le onde elettromagnetiche hanno la stessa velocità nel vuoto: la velocità della luce. c = 2.998 10 8 m/s Relazione tra energia e frequenza (Planck - Einstein): E = hν c ν
L energia assorbita dall atomo durante l urto iniziale è la stessa del fotone che sarebbe emesso nel passaggio inverso, e quindi vale: m
 QUESITI 1 Quesito Nell esperimento di Rutherford, una sottile lamina d oro fu bombardata con particelle alfa (positive) emesse da una sorgente radioattiva. Secondo il modello atomico di Thompson le particelle
QUESITI 1 Quesito Nell esperimento di Rutherford, una sottile lamina d oro fu bombardata con particelle alfa (positive) emesse da una sorgente radioattiva. Secondo il modello atomico di Thompson le particelle
FAM. T 1) α ν. (e α ν T 1) 2. (con l ipotesi ν > 0) si ottiene
 Serie 42: Soluzioni FAM C. Ferrari Esercizio 1 Corpo nero 1. Abbiamo: Sole λ max = 500nm - spettro visibile (giallo); Sirio B λ max = 290nm - ultravioletto; corpo umano λ max = 9300nm - infrarosso. 2.
Serie 42: Soluzioni FAM C. Ferrari Esercizio 1 Corpo nero 1. Abbiamo: Sole λ max = 500nm - spettro visibile (giallo); Sirio B λ max = 290nm - ultravioletto; corpo umano λ max = 9300nm - infrarosso. 2.
Un introduzione alla meccanica quantistica per le secondarie
 1 / 252 Un introduzione alla meccanica quantistica per le secondarie Camillo Imbimbo Genova, Gen-Feb, 2016 Progetto Lauree Scientifiche Dipartimento di Fisica dell Università di Genova https://www.ge.infn.it/
1 / 252 Un introduzione alla meccanica quantistica per le secondarie Camillo Imbimbo Genova, Gen-Feb, 2016 Progetto Lauree Scientifiche Dipartimento di Fisica dell Università di Genova https://www.ge.infn.it/
Lezione n. 13. Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo. di idrogeno. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 13 Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo di idrogeno Antonino Polimeno 1 Radiazione elettromagnetica (1) - Rappresentazione
Chimica Fisica Biotecnologie sanitarie Lezione n. 13 Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo di idrogeno Antonino Polimeno 1 Radiazione elettromagnetica (1) - Rappresentazione
Lezioni LINCEI per la Scuola La Spettroscopia
 Lezioni LINCEI per la Scuola La Spettroscopia Roberto Casalbuoni Dipartimento di Fisica e Astronomia, Sezione INFN Istituto G. Galilei per la Fisica Teorica (GGI), Terza Cultura Firenze - casalbuoni@fi.infn.it
Lezioni LINCEI per la Scuola La Spettroscopia Roberto Casalbuoni Dipartimento di Fisica e Astronomia, Sezione INFN Istituto G. Galilei per la Fisica Teorica (GGI), Terza Cultura Firenze - casalbuoni@fi.infn.it
LA RIVOLUZIONE QUANTISTICA
 LA RIVOLUZIONE QUANTISTICA Franco Prati Università dell Insubria - Como NINDA URUK Il pane dei Sumeri Ricerca scientifica ed epistemologia 5 dicembre 2012 Congresso Internazionale dei Fisici in onore di
LA RIVOLUZIONE QUANTISTICA Franco Prati Università dell Insubria - Como NINDA URUK Il pane dei Sumeri Ricerca scientifica ed epistemologia 5 dicembre 2012 Congresso Internazionale dei Fisici in onore di
1. Scrivere l equazione di Schrödinger unidimensionale per una particella di massa m con energia potenziale V (x) = mω2
 1 Teoria Una particella di massa m = 1 g e carica elettrica q = 1 c viene accelerata per un tratto pari a l = m da una differenza di potenziale pari av = 0 volt Determinare la lunghezza d onda di De Broglie
1 Teoria Una particella di massa m = 1 g e carica elettrica q = 1 c viene accelerata per un tratto pari a l = m da una differenza di potenziale pari av = 0 volt Determinare la lunghezza d onda di De Broglie
TERMODINAMICA CLASSICA E LE ORIGINI DELLA TEORIA QUANTISTICA
 TERMODINAMICA CLASSICA E LE ORIGINI DELLA TEORIA QUANTISTICA (SISTEMI IN EQUILIBRIO TERMICO) LEZIONE N.2 Fisica moderna 1 SPETTRO CORPO NERO Legge di Stefan (1879)-Boltzmann Intensità di potenza totale
TERMODINAMICA CLASSICA E LE ORIGINI DELLA TEORIA QUANTISTICA (SISTEMI IN EQUILIBRIO TERMICO) LEZIONE N.2 Fisica moderna 1 SPETTRO CORPO NERO Legge di Stefan (1879)-Boltzmann Intensità di potenza totale
n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]
![n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm] n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]](/thumbs/92/108343390.jpg) Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
FISICA delle APPARECCHIATURE per RADIOTERAPIA
 Anno Accademico 2012-2013 Corso di Laurea in Tecniche Sanitarie di Radiologia Medica per Immagini e Radioterapia FISICA delle APPARECCHIATURE per RADIOTERAPIA Marta Ruspa 20.01.13 M. Ruspa 1 ONDE ELETTROMAGNETICHE
Anno Accademico 2012-2013 Corso di Laurea in Tecniche Sanitarie di Radiologia Medica per Immagini e Radioterapia FISICA delle APPARECCHIATURE per RADIOTERAPIA Marta Ruspa 20.01.13 M. Ruspa 1 ONDE ELETTROMAGNETICHE
