J Acidi e basi F79 J.1 Gli acidi e le basi in soluzione acquosa F80 J.2 Acidi e basi forti e deboli F81 J.3 La neutralizzazione F83 Esercizi
|
|
|
- Norma Rinaldi
- 5 anni fa
- Visualizzazioni
Transcript
1 Indice generale Prefazione Tavola periodica IX XVI FONDAMENTI Introduzione e orientamento F1 La chimica e la società F1 La chimica: una scienza a tre livelli F2 Come si fa scienza F2 Le branche della chimica F4 Padroneggiare la chimica F4 A Materia ed energia F5 A.1 Simboli e unità F6 A.2 Accuratezza e precisione F9 A.3 La forza F10 A.4 L energia F11 F15 B Elementi e atomi F16 B.1 Gli atomi F17 B.2 Il modello nucleare F18 B.3 Gli isotopi F19 B.4 L organizzazione degli elementi F21 F23 C I composti F24 C.1 Che cosa sono i composti? F24 C.2 Le molecole e i composti molecolari F25 C.3 Gli ioni e i composti ionici F26 F30 D La nomenclatura dei composti F32 D.1 La denominazione dei cationi F32 D.2 La denominazione degli anioni F32 D.3 La denominazione dei composti ionici F33 IN PRATICA D.1 Come denominare i composti ionici F34 D.4 La denominazione dei composti molecolari inorganici F35 IN PRATICA D.2 Come denominare i composti molecolari inorganici semplici F36 D.5 Il nome di alcuni composti organici comuni F38 F40 E Mole e massa molare F41 E.1 La mole F41 E.2 La massa molare F43 F49 F La determinazione della formula chimica F51 F.1 La composizione percentuale in massa F51 F.2 La determinazione della formula empirica F52 F.3 La determinazione della formula molecolare F54 F55 G Miscugli e soluzioni F57 G.1 La classificazione dei miscugli F57 G.2 Le tecniche di separazione F58 G.3 La concentrazione F59 G.4 La diluizione F62 IN PRATICA G.1 Come calcolare il volume di soluzione madre necessario per realizzare una determinata diluizione F62 F64 H Le equazioni chimiche F66 H.1 I simboli nelle reazioni chimiche F66 H.2 Il bilanciamento delle equazioni chimiche F68 F70 I Le reazioni di precipitazione F72 I.1 Gli elettroliti F72 I.2 I precipitati F74 I.3 Equazioni ioniche ed equazioni ioniche nette F74 I.4 Mettiamo all opera la precipitazione F76 F77 J Acidi e basi F79 J.1 Gli acidi e le basi in soluzione acquosa F80 J.2 Acidi e basi forti e deboli F81 J.3 La neutralizzazione F83 F84 K Le reazioni redox F86 K.1 L ossidazione e la riduzione F86 K.2 l numeri di ossidazione F87 IN PRATICA K.1 Come assegnare il numero di ossidazione F88 K.3 Agenti ossidanti e riducenti F90 K.4 Il bilanciamento delle equazioni redox semplici F92 F93 L La stechiometria delle reazioni F95 L.1 La previsione da mole a mole F95 L.2 La previsione da massa a massa F96 IN PRATICA L.1 Come effettuare i calcoli da massa a massa F96 L.3 L analisi volumetrica F98 IN PRATICA L.2 Come interpretare una titolazione F99 F102 M I reagenti limitanti F105 M.1 La resa delle reazioni F105 M.2 I limiti di una reazione F107 IN PRATICA M.1 Come identificare il reagente limitante F107 M.3 L analisi per combustione F111 F114 FOCUS 1 Gli atomi 1 capitolo 1A L osservazione degli atomi 1A.1 Il modello nucleare dell atomo 2 1A.2 La radiazione elettromagnetica 4 1A.3 Gli spettri atomici 6 9 capitolo 1B La teoria quantistica 1B.1 Radiazione, quanti e fotoni 11 1B.2 Il dualismo onda-particella della materia 17 1B.3 Il principio di indeterminazione capitolo 1C Funzioni d onda e livelli energetici 1C.1 La funzione d onda e la sua interpretazione 24 1C.2 La quantizzazione dell energia 25 SCHEDA 1C.1 I nanocristalli capitolo 1D L atomo di idrogeno 1D.1 I livelli energetici 31 1D.2 Gli orbitali atomici 32 1D.3 Numeri quantici, gusci e sottogusci 34 1D.4 La forma degli orbitali 36 1D.5 Lo spin elettronico 40 1D.6 La struttura elettronica dell idrogeno 40 SCHEDA 1D.1 Come facciamo a sapere che l elettrone possiede uno spin? 41 42
2 IV Indice generale capitolo 1E Gli atomi multielettronici 1E.1 L energia degli orbitali 44 1E.2 Il principio di Aufbau 46 IN PRATICA 1E.1 Come prevedere la configurazione elettronica dello stato fondamentale degli atomi capitolo 1F La periodicità 1F.1 La struttura generale della tavola periodica 53 1F.2 Il raggio atomico 55 1F.3 Il raggio ionico 57 1F.4 L energia di ionizzazione 59 1F.5 L affinità elettronica 61 1F.6 L effetto della coppia inerte 63 1F.7 Le relazioni diagonali 63 1F.8 Le proprietà generali degli elementi FOCUS 1 Esempio integrato online 67 FOCUS 1 67 FOCUS 2 Le molecole 71 capitolo 2A I legami ionici 2A.1 Gli ioni formati dagli elementi 72 2A.2 I simboli di Lewis 74 2A.3 Aspetti energetici della formazione dei legami ionici 75 2A.4 Le interazioni tra ioni capitolo 2B I legami covalenti 2B.1 Le strutture di Lewis 82 IN PRATICA 2B.1 Come scrivere la struttura di Lewis delle specie poliatomiche 84 2B.2 La risonanza 87 2B.3 La carica formale 90 IN PRATICA 2B.2 Come utilizzare la carica formale per stabilire qual è la struttura di Lewis più probabile capitolo 2C Le eccezioni alla regola dell ottetto 2C.1 Radicali e biradicali 94 SCHEDA 2C.1 Che cosa ha a che fare questo con la sopravvivenza? L autoconservazione chimica 95 2C.2 I gusci di valenza espansi 95 2C.3 Ottetti incompleti capitolo 2D Le proprietà dei legami 2D.1 Correggiamo il modello covalente: l elettronegatività 101 2D.2 Correggiamo il modello ionico: la polarizzabilità 103 2D.3 La forza dei legami 104 2D.4 La lunghezza dei legami capitolo 2E Il modello VSEPR 2E.1 Il modello VSEPR elementare 110 SCHEDA 2E.1 Le frontiere della chimica I farmaci scoperti e i farmaci progettati 111 2E.2 Molecole che presentano coppie solitarie sull atomo centrale 115 IN PRATICA 2E.1 Come applicare il modello VSEPR 118 2E.3 Le molecole polari capitolo 2F La teoria del legame di valenza 2F.1 I legami sigma e pi greco 125 2F.2 La promozione elettronica e l ibridizzazione degli orbitali 127 2F.3 Altri tipi di ibridizzazioni comuni 129 2F.4 Le caratteristiche dei legami multipli capitolo 2G La teoria degli orbitali molecolari 2G.1 Gli orbitali molecolari 137 2G.2 La configurazione elettronica delle molecole biatomiche 138 SCHEDA 2G.1 Come facciamo a sapere qual è l energia degli orbitali molecolari? 140 IN PRATICA 2G.1 Come determinare la configurazione elettronica e l ordine di legame di una specie biatomica omonucleare 141 SCHEDA 2G.2 Come facciamo a sapere che gli elettroni non sono appaiati? 143 2G.3 Il legame nelle molecole biatomiche eteronucleari 144 2G.4 Gli orbitali nelle molecole poliatomiche FOCUS 2 Esempio integrato online 149 FOCUS FOCUS 3 Gli stati della materia 155 capitolo 3A La natura dei gas 157 3A.1 L osservazione dei gas 157 3A.2 La pressione 158 3A.3 Le unità di misura alternative della pressione capitolo 3B Le leggi dei gas 3B.1 Le osservazioni sperimentali 163 3B.2 Le applicazioni della legge dei gas ideali 166 3B.3 Il volume molare e la densità dei gas capitolo 3C Miscugli gassosi e reazioni 3C.1 I miscugli gassosi 174 3C.2 La stechiometria delle reazioni tra gas capitolo 3D Il moto molecolare 3D.1 Diffusione ed effusione 182 3D.2 Il modello cinetico dei gas 184 3D.3 La distribuzione di Maxwell delle velocità 188 SCHEDA 3D.1 Come facciamo a sapere qual è la distribuzione delle velocità molecolari? capitolo 3E I gas reali 3E.1 Le deviazioni dal comportamento ideale 192 3E.2 Le equazioni di stato dei gas reali 193 3E.3 La liquefazione dei gas capitolo 3F Le forze intermolecolari 3F.1 Le origini delle forze intermolecolari 198 3F.2 Le forze ione-dipolo 199 3F.3 Le forze dipolo-dipolo 200 3F.4 Le forze di London 202 3F.5 Il legame a idrogeno 205 3F.6 Le repulsioni capitolo 3G La struttura dei liquidi 3G.1 L ordine nei liquidi 209 3G.2 Viscosità e tensione superficiale 209 3G.3 I cristalli liquidi 211 3G.4 I liquidi ionici
3 Indice generale V capitolo 3H I solidi 3H.1 La classificazione dei solidi 215 SCHEDA 3H.1 Come facciamo a sapere qual è l aspetto di una superficie? 216 3H.2 I solidi molecolari 218 3H.3 I solidi reticolari 218 3H.4 I solidi metallici 220 3H.5 Le celle elementari 223 3H.6 I solidi ionici capitolo 3I I materiali inorganici 3I.1 Le leghe 233 3I.2 I silicati 235 3I.3 Il carbonato di calcio 236 3I.4 Il cemento e il calcestruzzo capitolo 3J I materiali per le nuove tecnologie 3J.1 La conduzione dell elettricità nei solidi 240 3J.2 I semiconduttori 242 3J.3 I superconduttori 243 3J.4 I materiali luminescenti 244 3J.5 I materiali magnetici 245 3J.6 I nanomateriali 246 3J.7 I nanotubi FOCUS 3 Esempio integrato online 250 FOCUS INTERLUDIO Le ceramiche e i vetri 257 FOCUS 4 La termodinamica 259 capitolo 4A Lavoro e calore 4A.1 I sistemi e l ambiente 261 4A.2 Il lavoro 262 4A.3 Il lavoro di espansione 263 4A.4 Il calore 268 4A.5 La misura del calore capitolo 4B L energia interna 4B.1 La prima legge 275 4B.2 Le funzioni di stato 276 4B.3 Interludio molecolare capitolo 4C L entalpia 4C.1 Il trasferimento del calore a pressione costante 283 4C.2 La capacità termica a volume o a pressione costante 284 4C.3 L origine molecolare della capacità termica dei gas 285 4C.4 L entalpia dei cambiamenti fisici 288 4C.5 Le curve di riscaldamento 290 SCHEDA 4C.1 Come facciamo a sapere la forma della curva di riscaldamento? capitolo 4D La termochimica 4D.1 L entalpia di reazione 294 4D.2 La relazione tra DH e DU 295 4D.3 L entalpia standard di reazione 297 SCHEDA 4D.1 Che cosa ha a che fare questo con l ambiente I combustibili alternativi 298 4D.4 La combinazione delle entalpie di reazione: la legge di Hess 301 IN PRATICA 4D.1 Come utilizzare la legge di Hess 302 4D.5 L entalpia standard di formazione 303 4D.6 La variazione dell entalpia di reazione con la temperatura capitolo 4E I diversi contributi all entalpia 4E.1 La formazione degli ioni 311 4E.2 Il ciclo di Born-Haber 311 4E.3 L entalpia di legame capitolo 4F L entropia 4F.1 Le trasformazioni spontanee 317 4F.2 Entropia e disordine 318 4F.3 Entropia e volume 319 4F.4 Entropia e temperatura 321 4F.5 Entropia e stato fisico capitolo 4G L interpretazione molecolare dell entropia 4G.1 La formula di Boltzmann 330 4G.2 L equivalenza tra entropia statistica ed entropia termodinamica capitolo 4H Le entropie assolute 4H.1 L entropia standard molare 336 SCHEDA 4H.1 Le frontiere della chimica La ricerca dello zero assoluto 337 4H.2 L entropia standard di reazione capitolo 4I I cambiamenti di entropia globali 4I.1 L ambiente 343 4I.2 La variazione complessiva dell entropia 345 4I.3 L equilibrio capitolo 4J L energia libera di Gibbs 4J.1 Concentriamoci sul sistema 352 4J.2 L energia libera di reazione 355 4J.3 L energia libera e il lavoro non espansivo 358 4J.4 L effetto della temperatura FOCUS 4 Esempio integrato online 364 FOCUS INTERLUDIO Energia libera e vita 370 FOCUS 5 L equilibrio 371 capitolo 5A La pressione di vapore 5A.1 L origine della pressione di vapore 373 5A.2 Volatilità e forze intermolecolari 374 5A.3 La variazione della pressione di vapore con la temperatura 375 5A.4 L ebollizione capitolo 5B Gli equilibri di fase nei sistemi a un solo componente 5B.1 I diagrammi di stato a un solo componente 381 5B.2 Le proprietà critiche capitolo 5C Gli equilibri di fase nei sistemi a due componenti 5C.1 La pressione di vapore dei miscugli 388 5C.2 I miscugli liquidi binari 391 5C.3 La distillazione 393
4 VI Indice generale 5C.4 Gli azeotropi capitolo 5D La solubilità 5D.1 I limiti della solubilità 398 5D.2 La regola del «simile scioglie simile» 399 5D.3 Pressione e solubilità dei gas 401 5D.4 La temperatura e la solubilità 402 5D.5 La termodinamica della dissoluzione 402 5D.6 I colloidi capitolo 5E La molalità IN PRATICA 5E.1 Come si utilizza la molalità capitolo 5F Le proprietà colligative 5F.1 Innalzamento ebullioscopico e abbassamento crioscopico 414 5F.2 L osmosi 416 SCHEDA 5F.1 Le frontiere della chimica La somministrazione guidata dei farmaci 418 IN PRATICA 5F.1 Come impiegare le proprietà colligative per la determinazione della massa molare capitolo 5G L equilibrio chimico 5G.1 La reversibilità delle reazioni 424 5G.2 L equilibrio e la legge dell azione di massa 426 5G.3 L origine delle costanti di equilibrio 429 5G.4 La descrizione termodinamica dell equilibrio capitolo 5H Forme alternative della costante di equilibrio 5H.1 Multipli dell equazione chimica 437 5H.2 Equazioni composite 438 5H.3 La costante di equilibrio in funzione della concentrazione molare dei gas capitolo 5I Calcoli relativi agli equilibri 5I.1 Il grado di avanzamento della reazione 442 5I.2 Il verso di svolgimento della reazione 443 5I.3 Calcoli con le costanti di equilibrio 445 IN PRATICA 5I.1 Come costruire e utilizzare una tabella di equilibrio capitolo 5J La risposta dei sistemi all equilibrio alla variazione delle condizioni 5J.1 L aggiunta e la sottrazione di reagenti 453 5J.2 La compressione della miscela di reazione 457 5J.3 La temperatura e l equilibrio FOCUS 5 Esempio integrato online 464 FOCUS INTERLUDIO L omeostasi 470 FOCUS 6 Le reazioni 471 capitolo 6A La natura degli acidi e delle basi 6A.1 Gli acidi e le basi di Brønsted-Lowry 473 6A.2 Gli acidi e le basi di Lewis 476 6A.3 Ossidi acidi, basici e anfoteri 478 6A.4 Lo scambio di protoni tra molecole di acqua capitolo 6B La scala del ph 6B.1 L interpretazione del ph 484 6B.2 Il poh delle soluzioni capitolo 6C Gli acidi e le basi deboli 6C.1 Le costanti di acidità e di basicità 489 6C.2 L altalena coniugata 492 6C.3 La struttura molecolare e la forza acida 494 6C.4 La forza degli ossiacidi e degli acidi carbossilici capitolo 6D Il ph delle soluzioni acquose 6D.1 Le soluzioni di acidi deboli 501 IN PRATICA 6D.1 Come calcolare il ph della soluzione di un acido debole 502 6D.2 Le soluzioni di basi deboli 504 IN PRATICA 6D.2 Come calcolare il ph della soluzione di una base debole 505 6D.3 Il ph di soluzioni saline capitolo 6E Gli acidi e le basi poliprotici 6E.1 Il ph di una soluzione di acido poliprotico 513 6E.2 Le soluzioni di sali degli acidi poliprotici 514 6E.3 La concentrazione delle specie solute 516 IN PRATICA 6E.1 Come calcolare la concentrazione di tutte le specie nella soluzione di un acido poliprotico 516 6E.4 La composizione e il ph 519 SCHEDA 6E.1 Che cosa ha a che fare questo con l ambiente? Le piogge acide e il patrimonio genetico capitolo 6F L autoprotolisi e il ph 6F.1 Le soluzioni molto diluite di acidi e di basi forti 524 6F.2 Le soluzioni molto diluite di acidi deboli capitolo 6G I tamponi 6G.1 L azione tampone 530 6G.2 La costruzione di un tampone 531 6G.3 La capacità tamponante 537 SCHEDA 6G.1 Che cosa ha a che fare questo con la sopravvivenza? I tamponi fisiologici capitolo 6H Le titolazioni acido-base 6H.1 Le titolazioni acido forte-base forte 541 IN PRATICA 6H.1 Come calcolare il ph durante la titolazione acido forte-base forte 542 6H.2 Le titolazioni acido forte-base debole e acido debole-base forte 544 IN PRATICA 6H.2 Come calcolare il ph durante la titolazione di un acido debole o di una base debole 547 6H.3 Gli indicatori acido-base 549 6H.4 La stechiometria delle titolazioni degli acidi poliprotici capitolo 6I Gli equilibri di solubilità 6I.1 Il prodotto di solubilità 557 6I.2 L effetto dello ione in comune 559 6I.3 La formazione di ioni complessi capitolo 6J La precipitazione 6J.1 Prevedere la precipitazione 564 6J.2 La precipitazione selettiva 565 6J.3 La dissoluzione dei precipitati 567 6J.4 L analisi qualitativa
5 Indice generale VII capitolo 6K La rappresentazione delle reazioni redox 6K.1 Le semireazioni 571 6K.2 Il bilanciamento delle equazioni redox 572 IN PRATICA 6K.1 Come bilanciare le equazioni redox complicate capitolo 6L Le celle galvaniche 6L.1 La struttura delle celle galvaniche 579 6L.2 Il potenziale di cella e l energia libera di reazione 581 6L.3 La notazione delle celle 584 IN PRATICA 6L.1 Come formulare la reazione di cella corrispondente a un certo diagramma di cella capitolo 6M I potenziali standard 6M.1 La definizione di potenziale standard 589 6M.2 La serie elettrochimica capitolo 6N Le applicazioni dei potenziali standard 6N.1 I potenziali standard e le costanti di equilibrio 596 IN PRATICA 6N.1 Come calcolare le costanti di equilibrio dai dati elettrochimici 596 6N.2 L equazione di Nernst 598 6N.3 Gli elettrodi ione-selettivi 601 6N.4 La corrosione capitolo 6O L elettrolisi 607 6O.1 Le celle elettrolitiche 607 6O.2 I prodotti dell elettrolisi 609 IN PRATICA 6O.1 Come prevedere il risultato dell elettrolisi 610 6O.3 Le applicazioni dell elettrolisi FOCUS 6 Esempio integrato online 614 FOCUS INTERLUDIO Le celle di impiego pratico 620 FOCUS 7 La cinetica 623 capitolo 7A La velocità di reazione 7A.1 La concentrazione e la velocità di reazione 625 SCHEDA 7A.1 Come facciamo a sapere che cosa accade agli atomi durante la reazione? 628 7A.2 La velocità istantanea di reazione 628 7A.3 Le leggi cinetiche e l ordine di reazione capitolo 7B Le leggi cinetiche integrate 7B.1 Le leggi cinetiche integrate del primo ordine 638 7B.2 Il tempo di dimezzamento delle reazioni del primo ordine 642 7B.3 Le leggi cinetiche integrate del secondo ordine capitolo 7C I meccanismi di reazione 7C.1 Le reazioni elementari 649 7C.2 Le leggi cinetiche delle reazioni elementari 650 7C.3 Combinare le leggi cinetiche elementari 652 7C.4 Velocità ed equilibrio 655 7C.5 Le reazioni a catena capitolo 7D I modelli di reazione 7D.1 L effetto della temperatura 660 7D.2 La teoria degli urti 663 SCHEDA 7D.1 Come facciamo a sapere che cosa succede durante l urto tra le molecole? 666 7D.3 La teoria dello stato di transizione capitolo 7E La catalisi 670 7E.1 Come funzionano i catalizzatori 670 SCHEDA 7E.1 Che cosa ha a che fare questo con l ambiente La protezione dello strato di ozono 671 7E.2 I catalizzatori industriali 674 7E.3 I catalizzatori viventi: gli enzimi FOCUS 7 Esempio integrato online 679 FOCUS FOCUS 8 Gli elementi dei gruppi principali 683 capitolo 8A Il carattere periodico 8A.1 Le proprietà atomiche 685 8A.2 L andamento di legame 686 8A.3 L andamento di idruri e ossidi capitolo 8B L idrogeno 8B.1 L elemento 690 SCHEDA 8B.1 Che cosa ha a che fare questo con l ambiente L effetto serra 691 8B.2 I composti dell idrogeno capitolo 8C Il gruppo 1: i metalli alcalini 8C.1 Gli elementi del gruppo C.2 I composti di litio, sodio e potassio capitolo 8D Il gruppo 2: i metalli alcalino-terrosi 8D.1 Gli elementi del gruppo D.2 I composti di berillio, magnesio e calcio capitolo 8E Il gruppo 13: la famiglia del boro 8E.1 Gli elementi del gruppo E.2 Ossidi, alogenuri e nitruri del gruppo E.3 Borani, boroidruri e boruri capitolo 8F Il gruppo 14: la famiglia del carbonio 8F.1 Gli elementi del gruppo SCHEDA 8F.1 Le frontiere della chimica I materiali autoassemblanti 713 8F.2 Ossidi del carbonio e del silicio 715 8F.3 Altri importanti composti del gruppo capitolo 8G Il gruppo 15: la famiglia dell azoto 8G.1 Gli elementi del gruppo G.2 Composti con l idrogeno e gli alogeni 721 8G.3 Ossidi e ossiacidi dell azoto 723 8G.4 Ossidi e ossiacidi del fosforo capitolo 8H Il gruppo 16: la famiglia dell ossigeno 8H.1 Gli elementi del gruppo H.2 I composti con l idrogeno 731 8H.3 Ossidi e ossiacidi dello zolfo
6 VIII Indice generale capitolo 8I Il gruppo 17: gli alogeni 8I.1 Gli elementi del gruppo I.2 I composti degli alogeni capitolo 8J Il gruppo 18: i gas nobili 8J.1 Gli elementi del gruppo J.2 I composti dei gas nobili FOCUS 8 Esempio integrato online 746 FOCUS FOCUS 9 Gli elementi del blocco d 749 capitolo 9A Andamenti periodici degli elementi del blocco d 9A.1 L andamento delle proprietà fisiche 750 9A.2 L andamento delle proprietà chimiche capitolo 9B Alcuni elementi del blocco d in rassegna 9B.1 Dallo scandio al nichel 755 9B.2 I gruppi 11 e capitolo 9C I composti di coordinazione SCHEDA 9C.1 Che cosa ha a che fare questo con la sopravvivenza? Perché dobbiamo mangiare i metalli del blocco d? 765 9C.1 I complessi di coordinazione 766 IN PRATICA 9C.1 La nomenclatura dei complessi dei metalli del blocco d e dei composti di coordinazione 768 9C.2 La forma dei complessi 770 9C.3 Gli isomeri 772 SCHEDA 9C.2 Come facciamo a sapere se una sostanza è otticamente attiva? capitolo 9D La struttura elettronica dei complessi dei metalli del blocco d 9D.1 La teoria del campo cristallino 778 9D.2 La serie spettrochimica 780 9D.3 Il colore dei complessi 783 9D.4 Le proprietà magnetiche dei complessi 785 9D.5 La teoria del campo dei ligandi FOCUS 9 Esempio integrato online 791 FOCUS FOCUS 10 La chimica nucleare 795 capitolo 10A Il decadimento radioattivo 10A.1 Le prove del decadimento radioattivo spontaneo A.2 Le reazioni nucleari A.3 L andamento della stabilità nucleare A.4 La previsione del tipo di decadimento nucleare A.5 La nucleosintesi 803 SCHEDA 10A.1 Che cosa ha a che fare questo con la sopravvivenza La medicina nucleare capitolo 10B La radioattività 10B.1 Gli effetti biologici della radiazione B.2 La misura della velocità del decadimento nucleare 809 SCHEDA 10B.1 Come facciamo a sapere quando è radioattivo un materiale? B.3 Gli impieghi dei radioisotopi capitolo 10C L energia nucleare 10C.1 Le trasformazioni massa-energia C.2 La produzione dell energia nucleare C.3 La chimica dell energia nucleare FOCUS 10 Esempio integrato online 823 FOCUS FOCUS 11 La chimica organica 825 capitolo 11A Le strutture degli idrocarburi alifatici 11A.1 I tipi di idrocarburi alifatici 826 IN PRATICA 11A.1 La nomenclatura degli idrocarburi alifatici A.2 Gli isomeri A.3 Le proprietà fisiche degli alcani e degli alcheni capitolo 11B Le reazioni degli idrocarburi alifatici 11B.1 Le reazioni di sostituzione degli alcani B.2 Sintesi degli alcani e degli alcheni B.3 L addizione elettrofila capitolo 11C Gli idrocarburi aromatici 11C.1 La nomenclatura C.2 La sostituzione elettrofila capitolo 11D I gruppi funzionali comuni 11D.1 Gli aloalcani D.2 Gli alcoli D.3 Gli eteri D.4 I fenoli D.5 Le aldeidi e i chetoni D.6 Gli acidi carbossilici D.7 Gli esteri D.8 Le ammine, gli amminoacidi e le ammidi 853 IN PRATICA 11D.1 Come denominare i composti semplici in possesso di gruppi funzionali capitolo 11E Polimeri e macromolecole biologiche 11E.1 La polimerizzazione per addizione E.2 La polimerizzazione per condensazione E.3 I copolimeri e i materiali compositi E.4 Le proprietà fisiche dei polimeri 865 SCHEDA 11E.1 Le frontiere della chimica I polimeri conduttori E.5 Le proteine E.6 I carboidrati E.7 Gli acidi nucleici FOCUS 11 Esempio integrato online 876 FOCUS INTERLUDIO I combustibili 881 Indice analitico 882 I prefissi SI 892 Costanti fondamentali 892 Relazioni tra unità 892
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
Indice. 1 La materia e la sua struttura. 2 La radioattività ed i processi nucleari
 Indice PREFAZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi 5 1.3. L unità di
Indice PREFAZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi 5 1.3. L unità di
Indice. 1 La materia e la sua struttura. 2 La radioattività ed i processi nucleari
 Indice PREFAZIONE ALLA SECONDA EDIZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi
Indice PREFAZIONE ALLA SECONDA EDIZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi
Indice generale. Prefazione
 26-10-2009 10:41 Pagina VI Prefazione Ringraziamenti dell Editore Guida alla lettura XIII XV XVII Capitolo 0 Lessico della chimica 1 0.1 La chimica 1 0.1.1 Classificazioni della materia 2 0.1.2 Proprietà
26-10-2009 10:41 Pagina VI Prefazione Ringraziamenti dell Editore Guida alla lettura XIII XV XVII Capitolo 0 Lessico della chimica 1 0.1 La chimica 1 0.1.1 Classificazioni della materia 2 0.1.2 Proprietà
CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA. L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
 COMPITI PER LE VACANZE E ATTIVITA PER IL RECUPERO a.s. 2014/2015 SECONDA E ITIS CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
COMPITI PER LE VACANZE E ATTIVITA PER IL RECUPERO a.s. 2014/2015 SECONDA E ITIS CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO: CHIMICA, MATERIALI E BIOTECNOLOGIE
 RE P U B B L I C A I T A L I A N A ISTITUTO DI ISTRUZIONE SECONDARIA SUPERIORE MINERARIO G. ASPRONI E. FERMI DI IGLESIAS PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO:
RE P U B B L I C A I T A L I A N A ISTITUTO DI ISTRUZIONE SECONDARIA SUPERIORE MINERARIO G. ASPRONI E. FERMI DI IGLESIAS PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO:
ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016. CLASSI SECONDE ITI, SEZ. H,G, Disciplina:CHIMICA E LABORATORIO
 ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016 CLASSI SECONDE ITI, SEZ. H,G, Disciplina:CHIMICA E LABORATORIO PROGETTAZIONE DIDATTICA ANNUALE Elaborata conformemente alle linee
ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016 CLASSI SECONDE ITI, SEZ. H,G, Disciplina:CHIMICA E LABORATORIO PROGETTAZIONE DIDATTICA ANNUALE Elaborata conformemente alle linee
Programmi relativi ai quesiti delle prove di ammissione ai corsi di. Odontoiatria e Protesi Dentaria, in Medicina Veterinaria e ai corsi di
 Programmi relativi ai quesiti delle prove di ammissione ai corsi di Odontoiatria e Protesi Dentaria, in Medicina Veterinaria e ai corsi di laurea delle professioni sanitarie Per l ammissione ai corsi è
Programmi relativi ai quesiti delle prove di ammissione ai corsi di Odontoiatria e Protesi Dentaria, in Medicina Veterinaria e ai corsi di laurea delle professioni sanitarie Per l ammissione ai corsi è
TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI
 TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI MATERIA: CHIMICA CLASSI: PRIME I II QUADRIMESTRE Competenze Abilità/Capacità Conoscenze* Attività didattica Strumenti Tipologia verifiche Osservare, descrivere
TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI MATERIA: CHIMICA CLASSI: PRIME I II QUADRIMESTRE Competenze Abilità/Capacità Conoscenze* Attività didattica Strumenti Tipologia verifiche Osservare, descrivere
indice breve 1 Chimica, la scienza centrale 2 Appendici
 indice breve 1 Chimica, la scienza centrale 2 2 Atomi, Molecole e Ioni 32 3 Stechiometria: Rapporti di combinazione 72 4 Reazioni in soluzioni acquose 110 5 Termochimica 158 6 Teoria quantistica e struttura
indice breve 1 Chimica, la scienza centrale 2 2 Atomi, Molecole e Ioni 32 3 Stechiometria: Rapporti di combinazione 72 4 Reazioni in soluzioni acquose 110 5 Termochimica 158 6 Teoria quantistica e struttura
Državni izpitni center. Prova d esame 1. Giovedì, 29 agosto 2013 / 90 minuti
 odice del candidato: ržavni izpitni center *M13243121I* SESSIONE UTUNNLE Prova d esame 1 Giovedì, 29 agosto 2013 / 90 minuti l candidato sono consentiti l'uso della penna stilografica o a sfera, matita
odice del candidato: ržavni izpitni center *M13243121I* SESSIONE UTUNNLE Prova d esame 1 Giovedì, 29 agosto 2013 / 90 minuti l candidato sono consentiti l'uso della penna stilografica o a sfera, matita
Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici.
 LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
Nota dell editore Presentazione
 00PrPag 3-08-2007 11:42 Pagina V Autori Nota dell editore Presentazione XI XIII XV Parte I Chimica 1 Struttura dell atomo 3 Teorie atomiche 3 Costituenti dell atomo 4 Numeri quantici 5 Tipi di orbitali
00PrPag 3-08-2007 11:42 Pagina V Autori Nota dell editore Presentazione XI XIII XV Parte I Chimica 1 Struttura dell atomo 3 Teorie atomiche 3 Costituenti dell atomo 4 Numeri quantici 5 Tipi di orbitali
PIANO DI LAVORO ANNUALE
 Docenti Materia Classi Alessandra Cattaneo Erminia Palma Scienze Integrate (Chimica) biennio PIANO DI LAVORO ANNUALE 1. Finalità Promuovere negli allievi lo sviluppo e il perfezionamento delle capacità
Docenti Materia Classi Alessandra Cattaneo Erminia Palma Scienze Integrate (Chimica) biennio PIANO DI LAVORO ANNUALE 1. Finalità Promuovere negli allievi lo sviluppo e il perfezionamento delle capacità
Programmazione di CHIMICA ANALITICA E STRUMENTALE. Classe: 4 a A CHIMICI
 R E P U B B L I C A I T A L I A N A I.T.I. MINERARIO G. ASPRONI - IGLESIAS A.S. 2014-2015 Programmazione di CHIMICA ANALITICA E STRUMENTALE Classe: 4 a A CHIMICI INSEGNANTE TEORICO Silvia Chinedda INSEGNANTE
R E P U B B L I C A I T A L I A N A I.T.I. MINERARIO G. ASPRONI - IGLESIAS A.S. 2014-2015 Programmazione di CHIMICA ANALITICA E STRUMENTALE Classe: 4 a A CHIMICI INSEGNANTE TEORICO Silvia Chinedda INSEGNANTE
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He. 2) L'acqua è:
 1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
PROGRAMMA DI SCIENZE NATURALI CLASSE 1 a SEZ. A. Prof.ssa Maria Luisa Smorto
 PROGRAMMA DI SCIENZE NATURALI CLASSE 1 a SEZ. A A.S. 2014/2015 Prof.ssa Maria Luisa Smorto Conoscenze chimiche e fisiche di base per le Scienze della Terra - Le unità di misura nel Sistema Internazionale
PROGRAMMA DI SCIENZE NATURALI CLASSE 1 a SEZ. A A.S. 2014/2015 Prof.ssa Maria Luisa Smorto Conoscenze chimiche e fisiche di base per le Scienze della Terra - Le unità di misura nel Sistema Internazionale
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
Istituto di Istruzione Superiore L. da Vinci Civitanova Marche. Anno scolastico 2014-2015. Programma svolto. Docente: Silvana Venditti
 Anno scolastico 2014-2015 Programma svolto Docente: Silvana Venditti Disciplina: Scienze Naturali Classe : IV sez. E - Indirizzo Linguistico ARTICOLAZIONE DEI CONTENUTI E DEGLI OBIETTIVI SECONDO UNITA
Anno scolastico 2014-2015 Programma svolto Docente: Silvana Venditti Disciplina: Scienze Naturali Classe : IV sez. E - Indirizzo Linguistico ARTICOLAZIONE DEI CONTENUTI E DEGLI OBIETTIVI SECONDO UNITA
ALCOLI, ETERI, TIOLI. Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3
 ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Programmazione individuale di Laboratorio Materia : Chimica e Laboratorio. Docenti : Giancarlo Cardone Classe : 2 CAT a.s.
 Programmazione individuale di Laboratorio Materia : Chimica e Laboratorio. Docenti : Giancarlo Cardone Classe : 2 CAT a.s. 2015-2016 Mondovi 05/11/2015 Prof. Giancarlo Cardone PROGRAMMAZIONE DELL ATTIVITA
Programmazione individuale di Laboratorio Materia : Chimica e Laboratorio. Docenti : Giancarlo Cardone Classe : 2 CAT a.s. 2015-2016 Mondovi 05/11/2015 Prof. Giancarlo Cardone PROGRAMMAZIONE DELL ATTIVITA
L equilibrio dei gas. Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura
 Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Istituto S. Giuliana Falconieri Classe IIIB Liceo Linguistico-Europeo Programmazione di Scienze A.S. 2013-2014
 Istituto S. Giuliana Falconieri Classe IIIB Liceo Linguistico-Europeo Le trasformazioni fisiche della materia Gli stati fisici della materia I sistemi omogenei ed eterogenei Le sostanze pure ed i miscugli
Istituto S. Giuliana Falconieri Classe IIIB Liceo Linguistico-Europeo Le trasformazioni fisiche della materia Gli stati fisici della materia I sistemi omogenei ed eterogenei Le sostanze pure ed i miscugli
I termini e i concetti fondamentali
 unità Elementi di chimica I termini e i concetti fondamentali 1 la materia e le sue proprietà Le caratteristiche fondamentali della materia sono tre: la massa (m) o quantità di materia di cui sono formati
unità Elementi di chimica I termini e i concetti fondamentali 1 la materia e le sue proprietà Le caratteristiche fondamentali della materia sono tre: la massa (m) o quantità di materia di cui sono formati
DIPARTIMENTO DI SCIENZE INTEGRATE CHIMICA FISICA SCIENZE DELLA TERRA - BIOLOGIA
 IISS A. De Pace Lecce A.S. 2012-2013 DIPARTIMENTO DI SCIENZE INTEGRATE FISICA SCIENZE DELLA TERRA - BIOLOGIA PIANI DI STUDIO DELLE DISCIPLINE SECONDO ANNO Piano di studi della disciplina DESCRIZIONE Lo
IISS A. De Pace Lecce A.S. 2012-2013 DIPARTIMENTO DI SCIENZE INTEGRATE FISICA SCIENZE DELLA TERRA - BIOLOGIA PIANI DI STUDIO DELLE DISCIPLINE SECONDO ANNO Piano di studi della disciplina DESCRIZIONE Lo
1.11.3 Distribuzione di carica piana ed uniforme... 32
 Indice 1 Campo elettrico nel vuoto 1 1.1 Forza elettromagnetica............ 2 1.2 Carica elettrica................ 3 1.3 Fenomeni elettrostatici............ 6 1.4 Legge di Coulomb.............. 9 1.5 Campo
Indice 1 Campo elettrico nel vuoto 1 1.1 Forza elettromagnetica............ 2 1.2 Carica elettrica................ 3 1.3 Fenomeni elettrostatici............ 6 1.4 Legge di Coulomb.............. 9 1.5 Campo
Gruppo 10 Nickel Ni (1751)
 Gruppo 10 ickel i (1751) Proprietà i Pd Pt Z 28 46 78 umero di isotopi 5 6 6 naturali Massa atomica 58.69 106.42 195.08 onfigurazione [Ar]3d 8 4s 2 [Kr]4d 10 [Xe]4f 14 5d 9 6s 1 elettronica Aspetto Metallo
Gruppo 10 ickel i (1751) Proprietà i Pd Pt Z 28 46 78 umero di isotopi 5 6 6 naturali Massa atomica 58.69 106.42 195.08 onfigurazione [Ar]3d 8 4s 2 [Kr]4d 10 [Xe]4f 14 5d 9 6s 1 elettronica Aspetto Metallo
Catalogo d esame per la maturità di stato anno scolastico 2009/2010. Chimica
 Catalogo d esame per la maturità di stato anno scolastico 2009/2010 Chimica Membri della commissione tecnica per la realizzazione del materiale d esame di chimica: dr. sc. Nenad Judaš, Facoltà di Scienze
Catalogo d esame per la maturità di stato anno scolastico 2009/2010 Chimica Membri della commissione tecnica per la realizzazione del materiale d esame di chimica: dr. sc. Nenad Judaš, Facoltà di Scienze
GIOCHI DELLA CHIMICA
 GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
Lezione di Combustione
 Lezione di Combustione Introduzione Da un punto di vista chimico-fisico la combustione è un processo reattivo fortemente esotermico Generalmente le temperature in gioco sono particolarmente elevate e dipendono
Lezione di Combustione Introduzione Da un punto di vista chimico-fisico la combustione è un processo reattivo fortemente esotermico Generalmente le temperature in gioco sono particolarmente elevate e dipendono
ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016
 ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016 Classe II^ D COSTRUZIONI AMBIENTE E TERRITORIO Disciplina : SCIENZE INTEGRATE CHIMICA E LABORATORIO PROGETTAZIONE DIDATTICA ANNUALE
ISTITUTO ISTRUZIONE SUPERIORE "L. EINAUDI" ALBA ANNO SCOLASTICO 2015/2016 Classe II^ D COSTRUZIONI AMBIENTE E TERRITORIO Disciplina : SCIENZE INTEGRATE CHIMICA E LABORATORIO PROGETTAZIONE DIDATTICA ANNUALE
LA MOLE LA MOLE 2.A PRE-REQUISITI 2.3 FORMULE E COMPOSIZIONE 2.B PRE-TEST
 LA MOLE 2.A PRE-REQUISITI 2.B PRE-TEST 2.C OBIETTIVI 2.1 QUANTO PESA UN ATOMO? 2.1.1 L IDEA DI MASSA RELATIVA 2.1.2 MASSA ATOMICA RELATIVA 2.2.4 ESERCIZI SVOLTI 2.3 FORMULE E COMPOSIZIONE 2.4 DETERMINAZIONE
LA MOLE 2.A PRE-REQUISITI 2.B PRE-TEST 2.C OBIETTIVI 2.1 QUANTO PESA UN ATOMO? 2.1.1 L IDEA DI MASSA RELATIVA 2.1.2 MASSA ATOMICA RELATIVA 2.2.4 ESERCIZI SVOLTI 2.3 FORMULE E COMPOSIZIONE 2.4 DETERMINAZIONE
DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto:
 Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Programmazione individuale per competenze CLASSE 3^B LSA. Materia: CHIMICA
 Programmazione individuale per competenze CLASSE 3^B LSA Materia: CHIMICA Situazione della classe Accordi con la classe Accordi con le altre discipline Correlazione con i progetti proposti alla classe
Programmazione individuale per competenze CLASSE 3^B LSA Materia: CHIMICA Situazione della classe Accordi con la classe Accordi con le altre discipline Correlazione con i progetti proposti alla classe
Le barriere a lama d acqua. Fabio Alaimo Ponziani. Alberto Tinaburri
 DIPARTIMENTO DEI VIGILI DEL FUOCO, DEL SOCCORSO PUBBLICO E DELLA DIFESA CIVILE Direzione Centrale per la Prevenzione e la Sicurezza Tecnica Le barriere a lama d acqua Fabio Alaimo Ponziani Alberto Tinaburri
DIPARTIMENTO DEI VIGILI DEL FUOCO, DEL SOCCORSO PUBBLICO E DELLA DIFESA CIVILE Direzione Centrale per la Prevenzione e la Sicurezza Tecnica Le barriere a lama d acqua Fabio Alaimo Ponziani Alberto Tinaburri
Corso di Pianificazione Energetica prof. ing. Francesco Asdrubali a.a. 2013-14
 Università degli Studi di Perugia Facoltà di Ingegneria Corso di Pianificazione Energetica prof. ing. Francesco Asdrubali a.a. 2013-14 Le interazioni tra i sistemi energetici e l ambiente Le interazioni
Università degli Studi di Perugia Facoltà di Ingegneria Corso di Pianificazione Energetica prof. ing. Francesco Asdrubali a.a. 2013-14 Le interazioni tra i sistemi energetici e l ambiente Le interazioni
Chimica. Ingegneria Meccanica, Elettrica e Civile Simulazione d'esame
 Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
Energia elettrica. L atomo nel suo complesso è neutro perché ha l equilibrio tra protoni ed elettroni presenti nello stesso numero.
 Energia elettrica Si fonda sulla costituzione dell atomo che è costituito da particelle più piccole : neutroni (carica neutra) e protoni (carica +) che costituiscono il nucleo ed elettroni (carica negativa)
Energia elettrica Si fonda sulla costituzione dell atomo che è costituito da particelle più piccole : neutroni (carica neutra) e protoni (carica +) che costituiscono il nucleo ed elettroni (carica negativa)
FONDAZIONE MALAVASI ISTITUTO TECNICO DEI TRASPORTI E DELLA LOGISTICA
 FONDAZIONE MALAVASI ISTITUTO TECNICO DEI TRASPORTI E DELLA LOGISTICA PIANO DI LAVORO E PROGRAMMAZIONE DIDATTICA DISCIPLINA: SCIENZE INTEGRATE (CHIMICA) DOCENTE: Luca Grillini CLASSE II SEZ.A A.S.2014/2015
FONDAZIONE MALAVASI ISTITUTO TECNICO DEI TRASPORTI E DELLA LOGISTICA PIANO DI LAVORO E PROGRAMMAZIONE DIDATTICA DISCIPLINA: SCIENZE INTEGRATE (CHIMICA) DOCENTE: Luca Grillini CLASSE II SEZ.A A.S.2014/2015
SOLUZIONE ESERCIZIO 1.1
 SOLUZIONE ESERCIZIO 1.1 La temperatura di fusione ed il coefficiente di espansione termica di alcuni metalli sono riportati nella tabella e nel diagramma sottostante: Metallo Temperatura di fusione [ C]
SOLUZIONE ESERCIZIO 1.1 La temperatura di fusione ed il coefficiente di espansione termica di alcuni metalli sono riportati nella tabella e nel diagramma sottostante: Metallo Temperatura di fusione [ C]
ISTITUTO DI ISTRUZIONE SUPERIORE J.C. MAXWELL Data: 09/09 /2013 Pag. _1_ di _5 PROGRAMMAZIONE ANNUALE A.S. 2013_ / 2014_
 ISTITUTO DI ISTRUZIONE SUPERIORE J.C. MAXWELL Data: 09/09 /2013 Pag. _1_ di _5 INDIRIZZO SCOLASTICO DISCIPLINA DOCENTE / I CLASSE / I X MECCANICA e MECCATRONICA X ELETTRONICA X LOGISTICA e TRASPORTI LICEO
ISTITUTO DI ISTRUZIONE SUPERIORE J.C. MAXWELL Data: 09/09 /2013 Pag. _1_ di _5 INDIRIZZO SCOLASTICO DISCIPLINA DOCENTE / I CLASSE / I X MECCANICA e MECCATRONICA X ELETTRONICA X LOGISTICA e TRASPORTI LICEO
PROVA STRUTTURATA DI CHIMICA ORGANICA
 1. Una delle seguenti definizioni di gruppo funzionale è errata. Quale? "In chimica organica, i gruppi funzionali sono gruppi di atomi presenti in ogni molecola A. dai quali dipendono le caratteristiche
1. Una delle seguenti definizioni di gruppo funzionale è errata. Quale? "In chimica organica, i gruppi funzionali sono gruppi di atomi presenti in ogni molecola A. dai quali dipendono le caratteristiche
Celle a combustibile Fuel cells (FC)
 Celle a combustibile Fuel cells (FC) Celle a combustibile Sono dispositivi di conversione elettrochimica ad alto rendimento energetico. Esse trasformano in potenza elettrica l energia chimica contenuta
Celle a combustibile Fuel cells (FC) Celle a combustibile Sono dispositivi di conversione elettrochimica ad alto rendimento energetico. Esse trasformano in potenza elettrica l energia chimica contenuta
Chimica Kotz, Treichel, Townsend
 Chimica Kotz, Treichel, Townsend SITO DEDICATO integra e completa questo testo con: Filmati e Animazioni Simulazioni e Tutorial per i principali argomenti di ogni capitolo Link utili Tavola periodica interattiva
Chimica Kotz, Treichel, Townsend SITO DEDICATO integra e completa questo testo con: Filmati e Animazioni Simulazioni e Tutorial per i principali argomenti di ogni capitolo Link utili Tavola periodica interattiva
PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI
 PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI DEFINIZIONE DI VETRO LO STATO VETROSO È QUELLO DI UN SOLIDO BLOCCATO NELLA STRUTTURA DISORDINATA DI UN LIQUIDO (FASE AMORFA) SOLIDO:ORDINE A LUNGO RAGGIO
PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI DEFINIZIONE DI VETRO LO STATO VETROSO È QUELLO DI UN SOLIDO BLOCCATO NELLA STRUTTURA DISORDINATA DI UN LIQUIDO (FASE AMORFA) SOLIDO:ORDINE A LUNGO RAGGIO
Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA
 Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
LICEO SCIENTIFICO LEONARDO da VINCI REGGIO CALABRIA PROGRAMMA DI SCIENZE NATURALI CLASSE 2 a SEZ. Q A.S. 2012/2013
 LICEO SCIENTIFICO LEONARDO da VINCI REGGIO CALABRIA PROGRAMMA DI SCIENZE NATURALI CLASSE 2 a SEZ. Q A.S. 2012/2013 CHIMICA NUCLEO FONDANTE A : MISURE E GRANDEZZE TRASFORMAZIONI CHIMICO-FISICHE DELLA MATERIA
LICEO SCIENTIFICO LEONARDO da VINCI REGGIO CALABRIA PROGRAMMA DI SCIENZE NATURALI CLASSE 2 a SEZ. Q A.S. 2012/2013 CHIMICA NUCLEO FONDANTE A : MISURE E GRANDEZZE TRASFORMAZIONI CHIMICO-FISICHE DELLA MATERIA
PARTE PRIMA ASPETTI GENERALI Capitolo 1 STRUTTURA E PROPRIET DEI MATERIALI 1. STRUTTURA DEI MATERIALI 1.1. Macrostruttura 1.2. Microstruttura 1.3.
 PARTE PRIMA ASPETTI GENERALI Capitolo 1 STRUTTURA E PROPRIET DEI MATERIALI 1. STRUTTURA DEI MATERIALI 1.1. Macrostruttura 1.2. Microstruttura 1.3. Struttura atomica o molecolare 1.4. Complementarita degli
PARTE PRIMA ASPETTI GENERALI Capitolo 1 STRUTTURA E PROPRIET DEI MATERIALI 1. STRUTTURA DEI MATERIALI 1.1. Macrostruttura 1.2. Microstruttura 1.3. Struttura atomica o molecolare 1.4. Complementarita degli
Lipidi: funzioni. Strutturale. Riserva energetica. Segnale.
 Lipidi: funzioni. Strutturale. Riserva energetica. Segnale. Lipidi:classificazione. Saponificabili Non saponificabili Semplici Complessi Prostaglandine Steroidi Cere Trigliceridi Fosfogliceridi Sfingolipidi
Lipidi: funzioni. Strutturale. Riserva energetica. Segnale. Lipidi:classificazione. Saponificabili Non saponificabili Semplici Complessi Prostaglandine Steroidi Cere Trigliceridi Fosfogliceridi Sfingolipidi
Le reazioni di ossidoriduzione
 I.S. G. TASSINARI PROGRAMMAZIONE di CHIMICA ANALITICA E STUMENTALE Classe 4L - A.S. 2015-16 Docenti: prof.ssa Stefania Comes- prof.ssa Anna Alfano ANALISI INIZIALE DELLA CLASSE: La classe risulta composta
I.S. G. TASSINARI PROGRAMMAZIONE di CHIMICA ANALITICA E STUMENTALE Classe 4L - A.S. 2015-16 Docenti: prof.ssa Stefania Comes- prof.ssa Anna Alfano ANALISI INIZIALE DELLA CLASSE: La classe risulta composta
LIPIDI. I lipidi sono suddivisi in due gruppi principali.
 LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
PIANO DI LAVORO DEL PROFESSORE
 ISTITUTO DI ISTRUZIONE SUPERIORE STATALE IRIS VERSARI - Cesano Maderno (MB) PIANO DI LAVORO DEL PROFESSORE Indirizzo: LICEO SCIENTIFICO LICEO SCIENTIFICO Scienze Applicate LICEO TECNICO ISTITUTO TECNICO
ISTITUTO DI ISTRUZIONE SUPERIORE STATALE IRIS VERSARI - Cesano Maderno (MB) PIANO DI LAVORO DEL PROFESSORE Indirizzo: LICEO SCIENTIFICO LICEO SCIENTIFICO Scienze Applicate LICEO TECNICO ISTITUTO TECNICO
PROGRAMMAZIONE DI MATERIA
 MATERIA PROGRAMMAZIONE DI MATERIA SINTESI CLASSI QUARTE LICEO LINGUISTICO E DELLE UMANE COMPETENZE ATTESE AL TERMINE DEL PERCORSO DI STUDIO DELLA DISCIPLINA 1 sapere effettuare connessioni logiche, riconoscere
MATERIA PROGRAMMAZIONE DI MATERIA SINTESI CLASSI QUARTE LICEO LINGUISTICO E DELLE UMANE COMPETENZE ATTESE AL TERMINE DEL PERCORSO DI STUDIO DELLA DISCIPLINA 1 sapere effettuare connessioni logiche, riconoscere
CHIMICA ORGANICA. Gli alcoli
 1 E1-ALCOLI CIMICA OGANICA ALCOLI Formula generale Desinenza -olo Gli alcoli Gli alcoli sono, dopo gli idrocarburi, i composti organici più comuni, che è possibile considerare come derivati dagli alcani
1 E1-ALCOLI CIMICA OGANICA ALCOLI Formula generale Desinenza -olo Gli alcoli Gli alcoli sono, dopo gli idrocarburi, i composti organici più comuni, che è possibile considerare come derivati dagli alcani
Università degli Studi di Pavia Facoltà di Medicina e Chirurgia
 Università degli Studi di Pavia Facoltà di Medicina e Chirurgia CORSO DI LAUREA TRIENNALE CLASSE DELLLE LAUREE DELLE PROFESSIONI SANITARIE DELLA RIABILITAZIONE CLASSE 2 Corso Integrato di Fisica, Statistica,
Università degli Studi di Pavia Facoltà di Medicina e Chirurgia CORSO DI LAUREA TRIENNALE CLASSE DELLLE LAUREE DELLE PROFESSIONI SANITARIE DELLA RIABILITAZIONE CLASSE 2 Corso Integrato di Fisica, Statistica,
Il ruolo del T.S.R.M. nella U.O. Ciclotrone
 Il ruolo del T.S.R.M. nella U.O. Ciclotrone TSRM G.Bigi- CTSRM P.Sangalli- TSRM S.Cola Dott. D.Salvo- Dott. A.Versari- Dott. D.Serafini Dott. M.Asti-Dott. F.Fioroni*- Dott. E.Grassi* Arcispedale Santa
Il ruolo del T.S.R.M. nella U.O. Ciclotrone TSRM G.Bigi- CTSRM P.Sangalli- TSRM S.Cola Dott. D.Salvo- Dott. A.Versari- Dott. D.Serafini Dott. M.Asti-Dott. F.Fioroni*- Dott. E.Grassi* Arcispedale Santa
MATERIALE O PRODOTTO DA PROVARE
 Acido Acetico campionamento per adsorbimento su substrato solido alcalino (CROMOSORB P 20/40 MESH 5% NA2CO3). Dosaggio HPLC- UV vis Acido cianidrico campionamento: gorgogliamento dell aria ambiente in
Acido Acetico campionamento per adsorbimento su substrato solido alcalino (CROMOSORB P 20/40 MESH 5% NA2CO3). Dosaggio HPLC- UV vis Acido cianidrico campionamento: gorgogliamento dell aria ambiente in
Aspetti tecnologici innovativi per il recupero di scarti derivanti dal processo produttivo della pasta per carta
 Università degli Studi di Parma DIPARTIMENTO DIINGEGNERIA CIVILE, DELL AMBIENTE, DEL TERRITORIO E ARCHITETTURA Corso di Laurea Magistrale in Ingegneria per l Ambiente e il Territorio Aspetti tecnologici
Università degli Studi di Parma DIPARTIMENTO DIINGEGNERIA CIVILE, DELL AMBIENTE, DEL TERRITORIO E ARCHITETTURA Corso di Laurea Magistrale in Ingegneria per l Ambiente e il Territorio Aspetti tecnologici
Indice. Nota del autore... III
 Nota del autore... III Capitolo 1 Introduzione al metodo scientifico... 1 1.1 Le scienze naturali e la fisica... 1 1.2 Metodo scientifico... 2 1.3 Il tacchino (induttivista) di Russel... 3 1.4 Sul significato
Nota del autore... III Capitolo 1 Introduzione al metodo scientifico... 1 1.1 Le scienze naturali e la fisica... 1 1.2 Metodo scientifico... 2 1.3 Il tacchino (induttivista) di Russel... 3 1.4 Sul significato
È stimato che oggi sulla terra sono presenti da 10*10 6 a 100*10 6 specie viventi
 È stimato che oggi sulla terra sono presenti da 10*10 6 a 100*10 6 specie viventi Enorme diversità di forme Costanza di struttura interna La cellula è l unità fondamentale di tutti gli organismi viventi
È stimato che oggi sulla terra sono presenti da 10*10 6 a 100*10 6 specie viventi Enorme diversità di forme Costanza di struttura interna La cellula è l unità fondamentale di tutti gli organismi viventi
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
INDICAZIONI ED ESERCIZI PER LA PREPARAZIONE ALLA PROVA DI VERIFICA DI SETTEMBRE SCIENZE INTEGRATE (CHIMICA)
 ISTITUTO DI ISTRUZIONE SUPERIORE CHINO CHINI Via Pietro Caiani 68-50032 Borgo San Lorenzo (Fi) Tel. 055.8459.268 - Fax 055.8495.131 Sito Web: www.chinochini.it - E-mail: chinochini@tin.it - PEC FIIS02300N@PEC.ISTRUZIONE.IT
ISTITUTO DI ISTRUZIONE SUPERIORE CHINO CHINI Via Pietro Caiani 68-50032 Borgo San Lorenzo (Fi) Tel. 055.8459.268 - Fax 055.8495.131 Sito Web: www.chinochini.it - E-mail: chinochini@tin.it - PEC FIIS02300N@PEC.ISTRUZIONE.IT
LEZIONE 1. Materia: Proprietà e Misura
 LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
Indice Proprietà dell acqua e del vapore La termodinamica
 Capitolo 1 Proprietà dell acqua e del vapore... 1 1.1 Generalità... 1 1.2 Massa... 2 1.3 Densità e volume specifico... 2 1.4 Spazio, tempo, velocità, accelerazione... 3 1.5 Forza e peso... 3 1.6 Pressione...
Capitolo 1 Proprietà dell acqua e del vapore... 1 1.1 Generalità... 1 1.2 Massa... 2 1.3 Densità e volume specifico... 2 1.4 Spazio, tempo, velocità, accelerazione... 3 1.5 Forza e peso... 3 1.6 Pressione...
Prova di ammissione al corso di laurea in Medicina e Chirurgia 2013
 Francesco Ranaldi Chimica organica VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni
Francesco Ranaldi Chimica organica VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni
Leggi dei gas. PV = n RT SISTEMI DI PARTICELLE NON INTERAGENTI. perché le forze tra le molecole sono differenti. Gas perfetti o gas ideali
 Perché nelle stesse condizioni di temperatura e pressione sostanze differenti possono trovarsi in stati di aggregazione differenti? perché le forze tra le molecole sono differenti Da che cosa hanno origine
Perché nelle stesse condizioni di temperatura e pressione sostanze differenti possono trovarsi in stati di aggregazione differenti? perché le forze tra le molecole sono differenti Da che cosa hanno origine
CdS Ingegneria Industriale: Corso di Chimica
 CdS Ingegneria Industriale: Corso di Chimica Docente : Informazioni generali Candida MILONE cmilone@ingegneria.unime.it Ricevimento Mar e Gio 15:00-17:00 Struttura del corso: Verifiche: 54 ore di lezioni
CdS Ingegneria Industriale: Corso di Chimica Docente : Informazioni generali Candida MILONE cmilone@ingegneria.unime.it Ricevimento Mar e Gio 15:00-17:00 Struttura del corso: Verifiche: 54 ore di lezioni
di questi il SECONDO PRINCIPIO ΔU sistema isolato= 0
 L entropia e il secondo principio della termodinamica La maggior parte delle reazioni esotermiche risulta spontanea ma esistono numerose eccezioni. In laboratorio, ad esempio, si osserva come la dissoluzione
L entropia e il secondo principio della termodinamica La maggior parte delle reazioni esotermiche risulta spontanea ma esistono numerose eccezioni. In laboratorio, ad esempio, si osserva come la dissoluzione
CHIMICA GENERALE E PROPEDEUTICA BIOCHIMICA
 1 CHIMICA GENERALE E PROPEDEUTICA BIOCHIMICA CHIMICA GENERALE Materia La materia può avere: - Proprietà fisiche: se studiate non comportano trasformazione della materia (es.: temperatura di ebollizione,
1 CHIMICA GENERALE E PROPEDEUTICA BIOCHIMICA CHIMICA GENERALE Materia La materia può avere: - Proprietà fisiche: se studiate non comportano trasformazione della materia (es.: temperatura di ebollizione,
PROGRAMMAZIONE DELLE DISCIPLINE CHIMICHE
 I. I. S. S. A. DE PACE - LECCE TECNICO CHIMICO BIOLOGICO ANNO SCOLASTICO 2012 2013 CLASSE 4 TCB sez. A PROGRAMMAZIONE DELLE DISCIPLINE CHIMICHE Prof. Giovanni Sgueglia PROFILO PROFESSIONALE DEL TECNICO
I. I. S. S. A. DE PACE - LECCE TECNICO CHIMICO BIOLOGICO ANNO SCOLASTICO 2012 2013 CLASSE 4 TCB sez. A PROGRAMMAZIONE DELLE DISCIPLINE CHIMICHE Prof. Giovanni Sgueglia PROFILO PROFESSIONALE DEL TECNICO
ELETTROCHIMICA. Uso di reazioni chimiche per produrre corrente elettrica (Pile)
 ELETTROCHIMICA Uso di reazioni chimiche per produrre corrente elettrica (Pile) Uso di forza elettromotrice (fem) esterna per forzare reazioni chimiche non spontanee (Elettrolisi) Coppia redox: Ossidazione
ELETTROCHIMICA Uso di reazioni chimiche per produrre corrente elettrica (Pile) Uso di forza elettromotrice (fem) esterna per forzare reazioni chimiche non spontanee (Elettrolisi) Coppia redox: Ossidazione
 LEGAME CHIMICO In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE
LEGAME CHIMICO In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Liquidi, Solidi e Forze Intermolecolari
 Liquidi, Solidi e Forze Intermolecolari Distanze tra molecole Stati Fisici (Fase) Comportamento atipico La maggiore differenza tra liquidi e solidi consiste nella libertà di movimento delle loro molecole
Liquidi, Solidi e Forze Intermolecolari Distanze tra molecole Stati Fisici (Fase) Comportamento atipico La maggiore differenza tra liquidi e solidi consiste nella libertà di movimento delle loro molecole
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05
 I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3.
 Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
MATERIALI CERAMICI Classificazione e caratteristiche generali
 MATERIALI CERAMICI Classificazione e caratteristiche generali I materiali ceramici sono materiali inorganici non metallici, costituiti da elementi metallici e non metalici legati fra loro prevalentemente
MATERIALI CERAMICI Classificazione e caratteristiche generali I materiali ceramici sono materiali inorganici non metallici, costituiti da elementi metallici e non metalici legati fra loro prevalentemente
MURST - PROVA AMMISSIONE 2000 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA
 MURST - PROVA AMMISSIONE 2000 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA 21) La legge di Henry, che stabilisce una relazione tra pressione gassosa e solubilità
MURST - PROVA AMMISSIONE 2000 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA 21) La legge di Henry, che stabilisce una relazione tra pressione gassosa e solubilità
1 atm = 760 mm Hg = 760 torr = 101300 N/m 2 =101300 Pa. Anodo = Polo Positivo Anione = Ione Negativo. Catodo = Polo Negativo Catione = Ione Positivo
 1) Concetti Generali 1. Unità di Misura: A. Pressione 1 atm = 760 mm Hg = 760 torr = 101300 N/m 2 =101300 Pa. B. Calore 1 joule = 10 7 Erg. 1 caloria = 4,185 joule. Anodo = Polo Positivo Anione = Ione
1) Concetti Generali 1. Unità di Misura: A. Pressione 1 atm = 760 mm Hg = 760 torr = 101300 N/m 2 =101300 Pa. B. Calore 1 joule = 10 7 Erg. 1 caloria = 4,185 joule. Anodo = Polo Positivo Anione = Ione
modulo: CHIMICA DEI POLIMERI
 CORSO PON Esperto nella progettazione, caratterizzazione e lavorazione di termoplastici modulo: CHIMICA DEI POLIMERI Vincenzo Venditto influenza delle caratteristiche strutturali, microstrutturali e morfologiche
CORSO PON Esperto nella progettazione, caratterizzazione e lavorazione di termoplastici modulo: CHIMICA DEI POLIMERI Vincenzo Venditto influenza delle caratteristiche strutturali, microstrutturali e morfologiche
Quando un composto ionico viene immesso in acqua si dissocia formando uno ione negativo ed uno positivo.
 I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
STATO LIQUIDO. Si definisce tensione superficiale (γ) il lavoro che bisogna fare per aumentare di 1 cm 2 la superficie del liquido.
 STTO LIQUIDO Una sostanza liquida è formata da particelle in continuo movimento casuale, come in un gas, tuttavia le particelle restano a contatto le une alle altre e risentono sempre delle notevoli forze
STTO LIQUIDO Una sostanza liquida è formata da particelle in continuo movimento casuale, come in un gas, tuttavia le particelle restano a contatto le une alle altre e risentono sempre delle notevoli forze
Programmazione annuale docente classi 2^A AM 2^B AM 2^C AM
 Programmazione annuale docente classi 2^A AM 2^B AM 2^C AM Docente : Macaluso Maria Annunziata Classe : 2^ sez.a B - C Indirizzo AM Materia di insegnamento : Scienze Integrate (CHIMICA) Libro di testo
Programmazione annuale docente classi 2^A AM 2^B AM 2^C AM Docente : Macaluso Maria Annunziata Classe : 2^ sez.a B - C Indirizzo AM Materia di insegnamento : Scienze Integrate (CHIMICA) Libro di testo
La mobilità degli elementi chimici
 La mobilità degli elementi chimici Gli ioni contenuti nella parte sinistra del diagramma sono quelli che in soluzione si presentano sotto forma di cationi semplici. Gli ioni nella parte centrale del diagramma
La mobilità degli elementi chimici Gli ioni contenuti nella parte sinistra del diagramma sono quelli che in soluzione si presentano sotto forma di cationi semplici. Gli ioni nella parte centrale del diagramma
Lezione del 24 Ottobre 2014
 MECCANISMI MOLECOLARI DEGLI STATI PATOLOGICI MECCANISMI MOLECOLARI DELLE MALATTIE METABOLICHE Lezione del 24 Ottobre 2014 EZIOLOGIA Studia le cause che inducono un turbamento persistente dell omeostasi
MECCANISMI MOLECOLARI DEGLI STATI PATOLOGICI MECCANISMI MOLECOLARI DELLE MALATTIE METABOLICHE Lezione del 24 Ottobre 2014 EZIOLOGIA Studia le cause che inducono un turbamento persistente dell omeostasi
STRUTTURA E GEOMETRIA CRISTALLINA
 STRUTTURA E GEOMETRIA CRISTALLINA La struttura fisica dei materiali solidi dipende dalla disposizione degli atomi, ioni o molecole che compongono il solido e dalle forze che li legano fra loro. Quando
STRUTTURA E GEOMETRIA CRISTALLINA La struttura fisica dei materiali solidi dipende dalla disposizione degli atomi, ioni o molecole che compongono il solido e dalle forze che li legano fra loro. Quando
Unità di misura. Perché servono le unità di misura nella pratica di laboratorio e in corsia? Le unità di misura sono molto importanti
 Unità di misura Le unità di misura sono molto importanti 1000 è solo un numero 1000 lire unità di misura monetaria 1000 unità di misura monetaria ma il valore di acquisto è molto diverso 1000/mese unità
Unità di misura Le unità di misura sono molto importanti 1000 è solo un numero 1000 lire unità di misura monetaria 1000 unità di misura monetaria ma il valore di acquisto è molto diverso 1000/mese unità
MASSE ATOMICHE. 1,000 g di idrogeno reagiscono con 7,9367 g di ossigeno massa atomica ossigeno=2 x 7,9367=15,873 g (relativa all'idrogeno)
 MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
La Teoria dei Quanti e la Struttura Elettronica degli Atomi. Capitolo 7
 La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
ISTITUTO TECNICO INDUSTRIALE STATALE. B.Pascal Roma
 Ministero dell Istruzione, dell Università e della Ricerca ISTITUTO TECNICO INDUSTRIALE STATALE B.Pascal Roma Anno Scolastico 2012-201 PIANO DI LAVORO DELLE CLASSI PRIME MATERIA: Scienze Integrate CHIMICA
Ministero dell Istruzione, dell Università e della Ricerca ISTITUTO TECNICO INDUSTRIALE STATALE B.Pascal Roma Anno Scolastico 2012-201 PIANO DI LAVORO DELLE CLASSI PRIME MATERIA: Scienze Integrate CHIMICA
ENERGIA NELLE REAZIONI CHIMICHE
 ENERGIA NELLE REAZIONI CHIMICHE Nelle trasformazioni chimiche e fisiche della materia avvengono modifiche nelle interazioni tra le particelle che comportano sempre variazioni di energia "C è un fatto,
ENERGIA NELLE REAZIONI CHIMICHE Nelle trasformazioni chimiche e fisiche della materia avvengono modifiche nelle interazioni tra le particelle che comportano sempre variazioni di energia "C è un fatto,
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 3 Le proprietà fisiche dell acqua Concetti chiave: Le molecole d'acqua, che sono polari, possono formare legami idrogeno
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 3 Le proprietà fisiche dell acqua Concetti chiave: Le molecole d'acqua, che sono polari, possono formare legami idrogeno
PROGRAMMA DI BIOLOGIA. CLASSE 2^ F a. s. 2014 2015. Prof.ssa RUBINO ALESSANDRA
 ISTITUTO TECNICO INDUSTRIALE DI STATO "ENRICO FERMI" Via Luosi n. 23-41124 Modena Tel. 059211092 059236398 - (Fax): 059226478 E-mail: info@fermi.mo.it Pagina web: www.fermi.mo.it PROGRAMMA DI BIOLOGIA
ISTITUTO TECNICO INDUSTRIALE DI STATO "ENRICO FERMI" Via Luosi n. 23-41124 Modena Tel. 059211092 059236398 - (Fax): 059226478 E-mail: info@fermi.mo.it Pagina web: www.fermi.mo.it PROGRAMMA DI BIOLOGIA
4b. STATI DI AGGREGAZIONE DELLA MATERIA (parte seconda)
 4b. STATI DI AGGREGAZIONE DELLA MATERIA (parte seconda) La maggior parte delle sostanze che sono liquide a STP sono costituite da molecole (liquidi molecolari). I composti ionici e metallici sono generalmente
4b. STATI DI AGGREGAZIONE DELLA MATERIA (parte seconda) La maggior parte delle sostanze che sono liquide a STP sono costituite da molecole (liquidi molecolari). I composti ionici e metallici sono generalmente
2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà. I liquidi e loro proprietà
 2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà 1 I liquidi e loro proprietà 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito. I gas occupano i loro contenitori uniformemente
2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà 1 I liquidi e loro proprietà 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito. I gas occupano i loro contenitori uniformemente
MISURE DI POTERE CALORIFICO E COMPOSIZIONE
 MISURE DI POTERE CALORIFICO E COMPOSIZIONE Potere calorifico dei combustibili: bomba calorimetrica e calorimetro di Junkers Composizione: gascromatografia Composizione dei gas combusti: o Sonda λ o Strumenti
MISURE DI POTERE CALORIFICO E COMPOSIZIONE Potere calorifico dei combustibili: bomba calorimetrica e calorimetro di Junkers Composizione: gascromatografia Composizione dei gas combusti: o Sonda λ o Strumenti
MEMBRANE. struttura: fosfolipidi e proteine
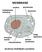 MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
ITT BUONARROTI MATERIA: S.I. FISICA E LABORATORIO
 ITT BUONARROTI MATERIA: S.I. FISICA E LABORATORIO Programmazione 2013-2014 Quella che viene qui presentato è la programmazione per moduli disciplinari, nel quale vengono evidenziati: l idea stimolo; i
ITT BUONARROTI MATERIA: S.I. FISICA E LABORATORIO Programmazione 2013-2014 Quella che viene qui presentato è la programmazione per moduli disciplinari, nel quale vengono evidenziati: l idea stimolo; i
