Previsione delle geometrie molecolari (Cap. 8)
|
|
|
- Michele Pagani
- 5 anni fa
- Visualizzazioni
Transcript
1 Previsione delle geometrie molecolari (Cap. 8) La forma delle molecole La teoria VSEPR Previsione della geometria molecolare Momento di dipolo di molecole poliatomiche Isomeria Ordine di legame 6 0
2 La forma delle molecole Molte proprietà chimiche delle sostanze inclusa la reattività chimica, dipendono dalla forma delle loro molecole. I moderni mezzi di indagine hanno messo in evidenza che in una molecola gli atomi sono disposti in rapporti geometrici particolari che conferiscono alle sostanze le loro proprietà peculiari. Ciò che definisce la geometria di una molecola è l angolo di legame, ovvero l angolo formato dagli assi congiungenti i nuclei degli atomi che si legano. 6 1
3 La forma delle molecole Le formule di Lewis suggeriscono solo quali atomi della molecola sono legati tra loro, non la disposizione spaziale degli atomi. Es. molecola di CH 2 Cl 2 : se fosse planare esisterebbero due formule distinte, aventi stessi legami atomo-atomo ma diverse disposizioni spaziali degli atomi (stereoisomeri). Gli stereoisomeri sono specie molecolari diverse, con diverse proprietà chimiche e fisiche. Per il diclorometano c è un solo tipo di molecola: una spiegazione del fatto che non esistono stereoisomeri della molecola di CH 2 Cl 2,fu trovata indipendentemente da J. H. van t Hoff e J. Le Bel nel Essi proposero che i quattro legami intorno all atomo di carbonio centrale in una molecola come CH 4 o CH 2 Cl 2, fossero diretti secondo Donald A. McQuarrie i vertici et al., CHIMICA GENERALE, di un 2/E, tetraedro. Zanichelli editore S.p.A. Copyright
4 Modello molecolare a palline e bastoncini di CH 4 (a) e CH 2 Cl 2. Il tetraedro regolare è un solido con quattro spigoli uguali che ha quattro vertici equivalenti e quattro facce identiche, ciascuna delle quali è un triangolo equilatero. Una molecola che ha la simmetria tridimensionale di un tetraedro è detta di forma tetraedrica. 6 3
5 a) Tetraedro regolare; b) Il tetraedro si può immaginare come derivato da un cubo, mettendo gli atomi in quattro degli otto vertici, e mettendo poi un atomo al centro del cubo. Modelli in cartoncino di molecole tetraedriche, costruiti originariamente da J. H. van t Hoff. 6 4
6 Il modello tetraedrico della molecola di CH 2 Cl 2 è in accordo con il fatto sperimentale che il diclorometano non ha isomeri. In una molecola tetraedrica come il metano, CH 4, tutti gli angoli di legame H-C-H sono uguali a 109,5. L angolo di legame tetraedrico è l angolo tra due vertici qualsiasi del tetraedro ed un punto posto esattamente al centro del tetraedro. Modelli molecolari a riempimento di spazio: danno rappresentazioni abbastanza accurate degli angoli di legame e delle dimensioni relative degli atomi nella molecola. 6 5
7 L ipotesi di van t Hoff e Le Bel che i legami di un atomo di carbonio tetravalente siano orientati tetraedricamente fu l inizio di quella che è chiamata chimica strutturale, l area della chimica che studia la forma e le dimensioni delle molecole. I metodi sperimentali per determinare le geometrie molecolari si basano sull interazione di radiazione elettromagnetica o elettroni con le molecole. Con questi metodi si possono misurare le lunghezze e gli angoli di legame delle molecole e da questi determinare la geometria molecolare. 6 6
8 Esempi di geometrie molecolari osservate sperimentalmente 6 7
9 La teoria VSEPR Nel 1957 Ronald J. Gillespie e Sir Ronald S. Nyholm proposero una semplice teoria per prevedere la forma delle molecole, la teoria VSEPR. La teoria VSEPR o teoria della repulsione tra coppie di elettroni nel guscio di valenza (Valence Shell Electron Pair Repulsion) è un metodo semplice e affidabile per prevedere le forme di molecole e ioni poliatomici covalenti. Il metodo di previsione di questa teoria è basato sul numero totale di legami e di coppie di elettroni solitarie nel guscio di valenza dell atomo centrale della molecola. Il postulato centrale della teoria è che la forma della molecola è determinata dalla minimizzazione delle mutue repulsioni tra coppie di elettroni nel guscio di valenza dell atomo centrale. 6 8
10 La teoria VSEPR Principi fondamentali della teoria VSEPR: 1) la disposizione degli atomi in una molecola dipende dal numero totale di coppie elettroniche di valenza che circondano l atomo centrale; 2) le coppie di elettroni leganti e non leganti nel guscio di valenza di un atomo si respingono le une con le altre e minimizzano le mutue repulsioni disponendosi alla massima distanza possibile. 6 9
11 La teoria VSEPR La forma della molecola è determinata dal numero di coppie di elettroni di legame nel guscio di valenza dell atomo centrale: due coppie determinano una geometria lineare con angoli di 180 ; tre coppie determinano una geometria trigonale planare con angoli di 120 ; quattro coppie individuano una geometria tetraedrica con angoli di 109,5; cinque coppie individuano una geometria bipiramidale trigonale; sei coppie individuano una geometria ottaedrica. 6 10
12 Disposizione delle coppie di elettroni su una superficie di una sfera, che minimizza la repulsione reciproca. 6 11
13 Gli angoli Cl-P-Cl equatoriali sono di 120 ; gli angoli assiale-equatoriale sono di 90. Geometria a bipiramide trigonale della molecola di PCl 5. I cinque vertici della bipiramide trigonale non sono equivalenti: i tre vertici che stanno sull equatore sono equivalenti e si chiamano vertici equatoriali; i due vertici posti sull asse polare sono equivalenti e sono chiamati vertici assiali. Vertici equatoriali ed assiali non sono equivalenti tra di loro e questo ha importanti conseguenze strutturali. 6 12
14 Ottaedro regolare: figura geometrica con sei vertici e otto facce. Tutte le otto facce sono triangoli equilateri identici. I sei vertici sono tutti equivalenti. Gli angoli di legame sono di
15 La teoria VSEPR 6 14
16 La teoria VSEPR Le coppie di elettroni solitarie nel guscio di valenza influenzano la forma delle molecole. Esse hanno un comportamento simile a quello delle coppie di legame ma la repulsione tra coppie di elettroni solitarie è maggiore di quella tra coppie elettroniche condivise, in quanto le coppie solitarie sono più voluminose rispetto alle coppie di elettroni di legame e occupano più spazio di un legame covalente intorno all atomo centrale. Quindi la repulsione tra una coppia solitaria di elettroni e la coppia di elettroni di un legame covalente è maggiore della repulsione tra le coppie di elettroni di due legami covalenti adiacenti. 6 15
17 La teoria VSEPR E bene tener presente che la forma delle molecole o geometria molecolare è definita dalla posizione dei nuclei nella molecola, ed è il numero totale di coppie di elettroni nel guscio di valenza dell atomo centrale che determina la geometria dei nuclei della molecola. Ruolo delle coppie di elettroni di legame e delle coppie solitarie nel determinare la geometria molecolare (definita dalla posizione Donald A. McQuarrie dei et al., CHIMICA nuclei GENERALE, nella 2/E, Zanichelli molecola). editore S.p.A. Copyright
18 Ognuna delle molecole CH 4, NH 3 e H 2 O ha quattro coppie di elettroni nel guscio di valenza dell atomo centrale. Le quattro coppie di elettroni sono dirette verso i vertici di un tetraedro. La forma della molecola è descritta dalla posizione dei nuclei. Quindi la molecola CH 4 è tetraedrica, NH 3 è piramidale a base triangolare e H 2 O è angolare. 6 17
19 Modello molecolare a riempimento di spazio della molecola NH 3 Molecola di NH 3 : una coppia solitaria di elettroni è più distribuita e quindi più ingombrante, di una coppia di elettroni di legame, e questo fa diminuire leggermente gli angoli di legame H-N-H dall angolo tetraedrico regolare di 109,5 a 107,3 6 18
20 Terminologia AX m E n per classificare le molecole A = atomo centrale X = atomo legato all atomo centrale (ligando) E = coppia solitaria di elettroni sull atomo centrale m = numero di ligandi n = numero di coppie di elettroni solitarie m + n = numero sterico = somma del numero di ligandi e di coppie solitarie legati all atomo centrale 6 19
21 6 20
22 Riepilogo delle varie geometrie molecolari AX m E n 6 21
23 La teoria VSEPR I legami covalenti doppi e tripli valgono come un legame singolo ai fini della geometria molecolare. Questa regola deriva dal fatto che tutti gli elettroni di legame tra due atomi devono essere condivisi tra questi stessi due atomi. In termini di esigenze di spazio i legami multipli somigliano alle coppie di elettroni solitarie. Infatti un legame multiplo coinvolge più di due elettroni ed è quindi più ampio (più ingombrante) di un legame covalente singolo. Di conseguenza i legami multipli respingono i legami singoli più fortemente di quanto i legami singoli respingano altri legami singoli. 6 22
24 La teoria VSEPR AX 5, bipiramide trigonale: i 5 vertici non sono equivalenti si no In una molecola della classe AX 4 E sono possibili due posizioni non equivalenti per la coppia di elettroni solitaria. Le repulsioni tra elettroni dovute alla coppia di elettroni solitaria sono minimizzate mettendo questa coppia su un vertice equatoriale piuttosto che assiale (ad altalena). 6 23
25 In tutti i casi le coppie solitarie occupano posizioni equatoriali 6 24
26 Geometria della molecola SF 4 (geometria AX 4 E) a) Geometria ideale (ad altalena). b) La coppia di elettroni solitaria in posizione equatoriale respinge i quattro legami covalenti S-F e distorce la molecola dalla geometria ideale. Ciò conferma la regola che le coppie solitarie occupano più spazio dei legami Donald covalenti A. McQuarrie et al., CHIMICA singoli. GENERALE, 2/E, Zanichelli editore S.p.A. Copyright
27 Geometria della molecola ClF 3 (geometria AX 3 E 2 ) a) Geometria ideale (forma di T); b) le due coppie di elettroni solitarie in posizioni equatoriali respingono i tre legami covalenti Cl-F e distorcono la molecola dalla geometria ideale. 6 26
28 Composti tra alogeni AXE 3 AX 3 E 2 AX 5 E IF IF 3 IF 5 BrF BrF 3 BrF 5 ClF ClF 3 ClF 5 ICl BrCl IBr Un atomo di alogeno centrale meno elettronegativo è legato ad altri atomi di alogeni più elettronegativi. Tutte le molecole AXE n sono lineari perché contengono solo due nuclei 6 27
29 Geometria della molecola I 3- (geometria AX 2 E 3 ) Struttura geometrica dello ione I 3- : le tre coppie solitarie occupano i vertici equatoriali di una bipiramide trigonale. I due atomi di iodio occupano le posizioni assiali; lo ione I 3 - è lineare. 6 28
30 Composti dei gas nobili Uno dei successi della teoria VSEPR è la corretta previsione delle strutture dei composti dei gas nobili. Composti di gas nobili che sono stati sintetizzati: fluoruri di xenon: XeF 2 (s), XeF 4 (s) ossifluoruri di xenon: XeOF 4 (l), XeO 2 F 2 (s) ossido di xenon: XeO 3 (s) fluoruri di kripton: KrF 2 (s), KrF 4 (s) 6 29
31 AX 6, ottaedro: i sei vertici sono equivalenti Geometrie associate alle diverse classi. In c) e d) due delle coppie di elettroni solitarie occupano vertici opposti perché questa posizione minimizza la repulsione tra coppie solitarie di elettroni. (Non sono note molecole AX 3 E 3 ) 6 30
32 Geometria della molecola BrF 5 (geometria AX 5 E) La coppia di elettroni solitaria respinge i legami Br-F, costringendo l atomo di Br a stare leggermente al di sotto del piano formato da quattro atomi di fluoro (Piramidale quadrata). 6 31
33 Geometria della molecola XeF 4 (geometria AX 4 E 2 ) Le due coppie di elettroni solitarie occupano i vertici opposti dell ottaedro, quindi XeF 4 ha una geometria quadrata planare. 6 32
34 Momento di dipolo di molecole poliatomiche Per avere un momento dipolare netto, una molecola deve soddisfare due requisiti: 1) deve avere legami polari (cioè ci deve essere differenza di elettronegatività tra due o più atomi della molecola) 2) i legami polari devono essere asimmetrici (cioè i loro momenti dipolari non si devono cancellare). Molecole che non hanno un momento dipolare sono dette molecole non polari; molecole che hanno un momento dipolare netto sono dette molecole polari. 6 33
35 Momento di dipolo di molecole poliatomiche Cancellazione dei momenti dipolari dei legami nella molecola BF 3. Freccia blu = momento risultante dei due momenti dei legami B-F che puntano dai lati verso l interno (si ottiene dalla diagonale del parallelogramma formato dai due momenti di legame e dalle loro corrispondenti parallele); esso è uguale in valore assoluto ed opposto in direzione al momento del legame B-F che punta verso il basso. 6 34
36 Momento di dipolo di molecole poliatomiche 6 35
37 Momento di dipolo di molecole poliatomiche Molecole apolari Molecole polari 6 36
38 Isomeri strutturali (lettura) Gli isomeri strutturali sono molecole che hanno la stessa formula chimica ma differenti legami tra gli atomi. Gli isomeri strutturali sono specie chimicamente distinte, ognuna con le sue specifiche proprietà fisiche e chimiche. (Es. 1-propanolo e 2-propanolo) Stereoisomeri (lettura) Gli stereoisomeri sono molecole che hanno gli stessi legami atomo-atomo ma diverse disposizioni spaziali degli atomi. Una classe di stereoisomeri è costituita dagli isomeri geometrici, che differiscono per la disposizione degli atomi intorno ad un atomo centrale, es. SF 4 Cl 2 : 6 37
39 Isomeri ottici (lettura) Un altra classe di stereoisomeri è costituita dagli isomeri ottici, che sono isomeri non sovrapponibili in quanto sono l uno l immagine speculare dell altro. Gli isomeri ottici si riscontrano quando abbiamo un atomo centrale legato a quattro atomi o gruppi di atomi diversi disposti con geometria tetraedrica. I due isomeri ottici della molecola tetraedrica CHFBrI. Molecole che presentano isomeria ottica sono dette chirali. 6 38
40 Proprietà del legame: ordine di legame L ordine di legame è il numero di coppie di elettroni di legame condivisi da due atomi in una molecola. Esistono ordini di legame pari a 1, 2, 3, e anche ordini di legame frazionari. Ordini di legame frazionari si possono avere in molecole e ioni che hanno strutture di risonanza. (Es. O 3, ione carbonato). 6 39
41 L ordine di legame tra una coppia di atomi X e Y è definito come: Ordine di legame = numero di coppie di elettroni condivisi tra X e Y numero di legami X-Y nella molecola o ione 6 40
42 Proprietà del legame: distanza di legame La distanza di legame è la distanza tra i nuclei di due atomi legati. Le lunghezze di legame sono legate alle dimensioni degli atomi, ma per una data coppia di atomi, l ordine di legame determina il valore finale della distanza. Poiché la dimensione degli atomi varia in modo regolare spostandoci lungo la tavola periodica, si possono fare previsioni sugli andamenti delle distanze di legame. Es. H-X negli alogenuri: H-F < H-Cl < H-Br < H-I Es. La lunghezza dei legami tra il carbonio e un altro elemento in un dato periodo diminuisce andando da sinistra a destra: C-C > C-N > C-O > C-F 6 41
43 Proprietà del legame: distanza di legame 6 42
GEOMETRIA MOLECOLARE
 GEOMETRIA MOLECOLARE Le molecole hanno geometrie spaziali ben definite caratterizzate da distanze di legame ed angoli di legame. Questi possono essere determinati sperimentalmente (es. raggi X). Si vede
GEOMETRIA MOLECOLARE Le molecole hanno geometrie spaziali ben definite caratterizzate da distanze di legame ed angoli di legame. Questi possono essere determinati sperimentalmente (es. raggi X). Si vede
VSEPR Polarità Ibridizzazione
 VSEPR Polarità Ibridizzazione VSEPR VSEPR = Valance-Shell electron-pair repulsion Principio fondamentale: ciascun gruppo di elettroni di valenza attorno ad un atomo centrale è situato il più lontano possibile
VSEPR Polarità Ibridizzazione VSEPR VSEPR = Valance-Shell electron-pair repulsion Principio fondamentale: ciascun gruppo di elettroni di valenza attorno ad un atomo centrale è situato il più lontano possibile
Poniamo il carbonio al centro, tre idrogeni sono legati al carbonio direttamente e uno attraverso l ossigeno
 Strutture di Lewis E un metodo semplice per ottenere le formule di struttura di composti covalenti nota la formula molecolare, la configurazione elettronica del livello di valenza degli atomi e la connettività
Strutture di Lewis E un metodo semplice per ottenere le formule di struttura di composti covalenti nota la formula molecolare, la configurazione elettronica del livello di valenza degli atomi e la connettività
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE. un atomo compie all atto di formazione di un composto al fine di formare un maggior
 CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
La teoria del legame di valenza
 La teoria del legame di valenza La teoria di Lewis (postulata prima dell'avvento della meccanica quantistica) considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente
La teoria del legame di valenza La teoria di Lewis (postulata prima dell'avvento della meccanica quantistica) considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente
 LEGAME CHIMICO In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE
LEGAME CHIMICO In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE
Serie completa di Modelli Molecolari per la Chimica Organica
 EdiSES Istruzioni per l utilizzo dei modelli molecolari Serie completa di Modelli Molecolari per la Chimica Organica allegati ai seguenti volumi: Chimica Organica - Paula Y. Bruice Elementi di Chimica
EdiSES Istruzioni per l utilizzo dei modelli molecolari Serie completa di Modelli Molecolari per la Chimica Organica allegati ai seguenti volumi: Chimica Organica - Paula Y. Bruice Elementi di Chimica
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 2
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
Dalla Chimica Generale
 RISNANZA RISNANZA Vi sono molecole le cui proprietà non sono ben spiegate da una singola struttura di Lewis che tenga conto cioé delle proprietà osservate (contenuto energetico, lunghezza dei legami, comportamento
RISNANZA RISNANZA Vi sono molecole le cui proprietà non sono ben spiegate da una singola struttura di Lewis che tenga conto cioé delle proprietà osservate (contenuto energetico, lunghezza dei legami, comportamento
Teoria del campo cristallino (CFT)
 Teoria del campo cristallino (CFT) Interazione elettrostatica (non covalente) tra: - leganti anionici cariche elettriche puntiformi - leganti neutri dipoli elettrici con la parte negativa verso il centro
Teoria del campo cristallino (CFT) Interazione elettrostatica (non covalente) tra: - leganti anionici cariche elettriche puntiformi - leganti neutri dipoli elettrici con la parte negativa verso il centro
Formule di Struttura delle Molecole Organiche
 Formule di Struttura delle Molecole Organiche Costituzione L ordine in cui gli atomi di una molecola sono connessi è chiamata costituzione o connettività. La costituzione di una molecola deve essere determinata
Formule di Struttura delle Molecole Organiche Costituzione L ordine in cui gli atomi di una molecola sono connessi è chiamata costituzione o connettività. La costituzione di una molecola deve essere determinata
I MINERALI DELLA CROSTA TERRESTRE
 I MINERALI DELLA CROSTA TERRESTRE Sono solidi cristallini, di origine inorganica, caratterizzati da una precisa formula chimica. Una sostanza è un minerale se: si presenta come solido cristallino, cioè
I MINERALI DELLA CROSTA TERRESTRE Sono solidi cristallini, di origine inorganica, caratterizzati da una precisa formula chimica. Una sostanza è un minerale se: si presenta come solido cristallino, cioè
Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici.
 LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
CHIMICA ORGANICA. L isomeria
 1 B-ISOMERIA IMIA ORGANIA L isomeria Gli isomeri sono composti diversi (ciascuno con proprietà fisiche e chimiche proprie) che hanno tuttavia la stessa composizione chimica e quindi la stessa formula chimica
1 B-ISOMERIA IMIA ORGANIA L isomeria Gli isomeri sono composti diversi (ciascuno con proprietà fisiche e chimiche proprie) che hanno tuttavia la stessa composizione chimica e quindi la stessa formula chimica
Il Metodo Scientifico
 Unita Naturali Il Metodo Scientifico La Fisica si occupa di descrivere ed interpretare i fenomeni naturali usando il metodo scientifico. Passi del metodo scientifico: Schematizzazione: modello semplificato
Unita Naturali Il Metodo Scientifico La Fisica si occupa di descrivere ed interpretare i fenomeni naturali usando il metodo scientifico. Passi del metodo scientifico: Schematizzazione: modello semplificato
Le Biomolecole I parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
isomeria di struttura isomeria di posizione isomeria di catena stereoisomeria isomeria di conformazione isomeria di configurazione 'isomeria ottica
 ISOMERIA L'isomeria di struttura è connessa al diverso modo in cui gli atomi di due o più composti si legano tra loro in sequenza. Ci sono due forme: isomeria di posizione e isomeria di catena. La stereoisomeria
ISOMERIA L'isomeria di struttura è connessa al diverso modo in cui gli atomi di due o più composti si legano tra loro in sequenza. Ci sono due forme: isomeria di posizione e isomeria di catena. La stereoisomeria
Gli alogeni e i gas nobili
 Gli alogeni e i gas nobili Gli alogeni, gruppo 17/VII, sono fra gli elementi non metallici maggiormente reattivi. I gas nobili, loro vicini del gruppo 18/VIII, sono i meno reattivi. Questo contrasto non
Gli alogeni e i gas nobili Gli alogeni, gruppo 17/VII, sono fra gli elementi non metallici maggiormente reattivi. I gas nobili, loro vicini del gruppo 18/VIII, sono i meno reattivi. Questo contrasto non
ESPERIENZE CON GLI SPECCHI PIANI
 1. Qual è la posizione dell immagine fornita da uno specchio piano? Di che tipo di immagine si tratta? Disponi il cilindro giallo dietro lo specchio, in modo che coincida con l immagine riflessa del cilindro
1. Qual è la posizione dell immagine fornita da uno specchio piano? Di che tipo di immagine si tratta? Disponi il cilindro giallo dietro lo specchio, in modo che coincida con l immagine riflessa del cilindro
ELASTOMERI ELASTOMERI
 ELASTOMERI Gli elastomeri o gomme, sono materiali polimerici le cui dimensioni possono variare enormemente so
ELASTOMERI Gli elastomeri o gomme, sono materiali polimerici le cui dimensioni possono variare enormemente so
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
SOLUZIONE ESERCIZIO 1.1
 SOLUZIONE ESERCIZIO 1.1 La temperatura di fusione ed il coefficiente di espansione termica di alcuni metalli sono riportati nella tabella e nel diagramma sottostante: Metallo Temperatura di fusione [ C]
SOLUZIONE ESERCIZIO 1.1 La temperatura di fusione ed il coefficiente di espansione termica di alcuni metalli sono riportati nella tabella e nel diagramma sottostante: Metallo Temperatura di fusione [ C]
ESAME DI STATO DI LICEO SCIENTIFICO CORSO SPERIMENTALE P.N.I. 2004
 ESAME DI STAT DI LICE SCIENTIFIC CRS SPERIMENTALE P.N.I. 004 Il candidato risolva uno dei due problemi e 5 dei 0 quesiti in cui si articola il questionario. PRBLEMA Sia la curva d equazione: ke ove k e
ESAME DI STAT DI LICE SCIENTIFIC CRS SPERIMENTALE P.N.I. 004 Il candidato risolva uno dei due problemi e 5 dei 0 quesiti in cui si articola il questionario. PRBLEMA Sia la curva d equazione: ke ove k e
La Teoria dei Quanti e la Struttura Elettronica degli Atomi. Capitolo 7
 La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
Matematica Livello secondario I Indice del Quaderno d'accompagnamento 1
 Matematica Livello secondario I Indice del Quaderno d'accompagnamento 1 Indice / Terminologia addendo x L'addizione, la somma, l'addendo, più 1 2a 24 addizionare x L'addizione, la somma, l'addendo, più
Matematica Livello secondario I Indice del Quaderno d'accompagnamento 1 Indice / Terminologia addendo x L'addizione, la somma, l'addendo, più 1 2a 24 addizionare x L'addizione, la somma, l'addendo, più
STRUTTURA E GEOMETRIA CRISTALLINA
 STRUTTURA E GEOMETRIA CRISTALLINA La struttura fisica dei materiali solidi dipende dalla disposizione degli atomi, ioni o molecole che compongono il solido e dalle forze che li legano fra loro. Quando
STRUTTURA E GEOMETRIA CRISTALLINA La struttura fisica dei materiali solidi dipende dalla disposizione degli atomi, ioni o molecole che compongono il solido e dalle forze che li legano fra loro. Quando
Degrado dei materiali non-metallici 1 materiali polimerici. Contenuto
 Contenuto o legame chimico C C - legame covalente, energia di legame - struttura tetragonale dei quattro legami del carbonio reazioni di polimerizzazione - poliaddizione, esempi - policondensazione, esempi
Contenuto o legame chimico C C - legame covalente, energia di legame - struttura tetragonale dei quattro legami del carbonio reazioni di polimerizzazione - poliaddizione, esempi - policondensazione, esempi
Com è fatto l atomo ATOMO. UNA VOLTA si pensava che l atomo fosse indivisibile. OGGI si pensa che l atomo è costituito da tre particelle
 STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
Chimica organica. Biomolecole. Tessuti biologici. Polimeri proprietà funzioni
 Chimica organica Biomolecole Tessuti biologici Polimeri proprietà funzioni 1 Chimica organica Biomolecole Tessuti biologici Polimeri proprietà funzioni C O N 1 Chimica organica Biomolecole Tessuti biologici
Chimica organica Biomolecole Tessuti biologici Polimeri proprietà funzioni 1 Chimica organica Biomolecole Tessuti biologici Polimeri proprietà funzioni C O N 1 Chimica organica Biomolecole Tessuti biologici
1 INCONTRO CHIMICA (PROF.SSA PAOLA BURANI) Ogni sostanza chimica è costituita dalla combinazione, in diverse proporzioni, di 92 tipi di atomi.
 1 INCONTRO CHIMICA (PROF.SSA PAOLA BURANI) 1 Atomi e Legami Ogni sostanza chimica è costituita dalla combinazione, in diverse proporzioni, di 92 tipi di atomi. Il termine atomo significa indivisibile e
1 INCONTRO CHIMICA (PROF.SSA PAOLA BURANI) 1 Atomi e Legami Ogni sostanza chimica è costituita dalla combinazione, in diverse proporzioni, di 92 tipi di atomi. Il termine atomo significa indivisibile e
LEGAME CHIMICO. H + H H 2 cioè H-H
 LEGAME CIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
LEGAME CIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
Le proprietà periodiche degli elementi LA LEZIONE
 Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
MASSE ATOMICHE. 1,000 g di idrogeno reagiscono con 7,9367 g di ossigeno massa atomica ossigeno=2 x 7,9367=15,873 g (relativa all'idrogeno)
 MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
Che tipo di linee riconosci in questi quadri? Ripassale con una matita colorata e, con la stessa tinta, colora il pallino corrispondente.
 Linee Che tipo di linee riconosci in questi quadri? Ripassale con una matita colorata e, con la stessa tinta, colora il pallino corrispondente. a. curva spezzata retta mista aperta chiusa b. curva spezzata
Linee Che tipo di linee riconosci in questi quadri? Ripassale con una matita colorata e, con la stessa tinta, colora il pallino corrispondente. a. curva spezzata retta mista aperta chiusa b. curva spezzata
Struttura molecolare
 Struttura molecolare Molecole Gruppi discreti di atomi legati in modo stabile Caratterizzate da distanze, angoli e torsioni ben definite Esempio: Metano, CH 4 Distanze C-H 1.10 Å; Angoli H-C-H 109.5 Connettività:
Struttura molecolare Molecole Gruppi discreti di atomi legati in modo stabile Caratterizzate da distanze, angoli e torsioni ben definite Esempio: Metano, CH 4 Distanze C-H 1.10 Å; Angoli H-C-H 109.5 Connettività:
MEMBRANE. struttura: fosfolipidi e proteine
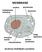 MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
STEREOISOMERIA carbonio ibridizzato sp3 è legato a quattro atomi o gruppi tutti diversi fra loro
 STEREOISOMERIA i sono oggetti che sono sovrapponibili alla loro immagine speculare: tutti gli oggetti di forma piana, ad esempio. osì, se prendo un alchene e lo confronto con la sua immagine allo specchio:
STEREOISOMERIA i sono oggetti che sono sovrapponibili alla loro immagine speculare: tutti gli oggetti di forma piana, ad esempio. osì, se prendo un alchene e lo confronto con la sua immagine allo specchio:
geometriche. Parte Sesta Trasformazioni isometriche
 Parte Sesta Trasformazioni isometriche In questa sezione di programma di matematica parliamo della geometria delle trasformazioni che studia le figure geometriche soggette a movimenti. Tali movimenti,
Parte Sesta Trasformazioni isometriche In questa sezione di programma di matematica parliamo della geometria delle trasformazioni che studia le figure geometriche soggette a movimenti. Tali movimenti,
Esempi di funzione. Scheda Tre
 Scheda Tre Funzioni Consideriamo una legge f che associa ad un elemento di un insieme X al più un elemento di un insieme Y; diciamo che f è una funzione, X è l insieme di partenza e X l insieme di arrivo.
Scheda Tre Funzioni Consideriamo una legge f che associa ad un elemento di un insieme X al più un elemento di un insieme Y; diciamo che f è una funzione, X è l insieme di partenza e X l insieme di arrivo.
COMPOSTI DI COORDINAZIONE (complessi)
 Gli ioni dei metalli di transizione nei sistemi biologici non si presentano come acquoioni [M(H 2 O) n ] x+ ma come. COMPOSTI DI COORDINAZIONE (complessi) derivano dall interazione (coordinazione) tra
Gli ioni dei metalli di transizione nei sistemi biologici non si presentano come acquoioni [M(H 2 O) n ] x+ ma come. COMPOSTI DI COORDINAZIONE (complessi) derivano dall interazione (coordinazione) tra
Rilevazione degli apprendimenti. Anno Scolastico 2006 2007 PROVA DI MATEMATICA. Scuola Secondaria di II grado. Classe Terza Tipo A. Codici. Scuola:...
 Ministero della Pubblica Istruzione Rilevazione degli apprendimenti Anno Scolastico 2006 2007 PROVA DI MATEMATICA Scuola Secondaria di II grado Classe Terza Tipo A Codici Scuola:..... Classe:.. Studente:.
Ministero della Pubblica Istruzione Rilevazione degli apprendimenti Anno Scolastico 2006 2007 PROVA DI MATEMATICA Scuola Secondaria di II grado Classe Terza Tipo A Codici Scuola:..... Classe:.. Studente:.
BIOLOGIA GENERALE. Alessandro Massolo Dip. Biologia Animale e Genetica c/o Prof. F. Dessì-Fulgheri (Via Romana 17) massolo@unifi.
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
1 - LA MOLECOLA D ACQUA. 1.1 - L atomo di idrogeno
 1 - LA MOLECOLA D ACQUA I greci antichi, con ARISTOTELE (384-322 a.c.), consideravano l acqua uno dei quattro elementi fondamentali della materia, insieme all aria, alla terra ed al fuoco, caratterizzati
1 - LA MOLECOLA D ACQUA I greci antichi, con ARISTOTELE (384-322 a.c.), consideravano l acqua uno dei quattro elementi fondamentali della materia, insieme all aria, alla terra ed al fuoco, caratterizzati
LA MOLE LA MOLE 2.A PRE-REQUISITI 2.3 FORMULE E COMPOSIZIONE 2.B PRE-TEST
 LA MOLE 2.A PRE-REQUISITI 2.B PRE-TEST 2.C OBIETTIVI 2.1 QUANTO PESA UN ATOMO? 2.1.1 L IDEA DI MASSA RELATIVA 2.1.2 MASSA ATOMICA RELATIVA 2.2.4 ESERCIZI SVOLTI 2.3 FORMULE E COMPOSIZIONE 2.4 DETERMINAZIONE
LA MOLE 2.A PRE-REQUISITI 2.B PRE-TEST 2.C OBIETTIVI 2.1 QUANTO PESA UN ATOMO? 2.1.1 L IDEA DI MASSA RELATIVA 2.1.2 MASSA ATOMICA RELATIVA 2.2.4 ESERCIZI SVOLTI 2.3 FORMULE E COMPOSIZIONE 2.4 DETERMINAZIONE
Illustrazione 1: Telaio. Piantanida Simone 1 G Scopo dell'esperienza: Misura di grandezze vettoriali
 Piantanida Simone 1 G Scopo dell'esperienza: Misura di grandezze vettoriali Materiale utilizzato: Telaio (carrucole,supporto,filo), pesi, goniometro o foglio con goniometro stampato, righello Premessa
Piantanida Simone 1 G Scopo dell'esperienza: Misura di grandezze vettoriali Materiale utilizzato: Telaio (carrucole,supporto,filo), pesi, goniometro o foglio con goniometro stampato, righello Premessa
I legami. 1) Rappresenta la struttura della molecola di idrogeno (numero atomico ZH = 1):
 Percorso 3 I legami E S E R C I Z I A Legame covalente omeopolare 1) Rappresenta la struttura della molecola di idrogeno (numero atomico ZH = 1): 2) Rappresenta la struttura della molecola di ossigeno
Percorso 3 I legami E S E R C I Z I A Legame covalente omeopolare 1) Rappresenta la struttura della molecola di idrogeno (numero atomico ZH = 1): 2) Rappresenta la struttura della molecola di ossigeno
Vertici opposti. Fig. C6.1 Definizioni relative ai quadrilateri.
 6. Quadrilateri 6.1 efinizioni Un poligono di 4 lati è detto quadrilatero. I lati di un quadrilatero che hanno un vertice in comune sono detti consecutivi. I lati di un quadrilatero non consecutivi tra
6. Quadrilateri 6.1 efinizioni Un poligono di 4 lati è detto quadrilatero. I lati di un quadrilatero che hanno un vertice in comune sono detti consecutivi. I lati di un quadrilatero non consecutivi tra
Quesiti e problemi. 10 Rappresenta la struttura di Lewis delle seguenti. 11 Perché gli angoli di legame nella molecola BH 3
 SUL LIBR DA PAG 206 A PAG 210 apitolo 11 Le forze intermolecolari e gli stati condensati della materia Quesiti e problemi ESERIZI 1 La forma delle molecole 1 Dai una definizione di angolo di legame. 2
SUL LIBR DA PAG 206 A PAG 210 apitolo 11 Le forze intermolecolari e gli stati condensati della materia Quesiti e problemi ESERIZI 1 La forma delle molecole 1 Dai una definizione di angolo di legame. 2
Modulo 1. Il legame chimico
 Modulo 1 Il legame chimico Caratteristiche di un legame Il legame covalente Il legame ionico Il legame metallico Strutture di Lewis Strutture di Lewis nei composti a carattere ionico La risonanza La geometria
Modulo 1 Il legame chimico Caratteristiche di un legame Il legame covalente Il legame ionico Il legame metallico Strutture di Lewis Strutture di Lewis nei composti a carattere ionico La risonanza La geometria
Argomento interdisciplinare
 1 Argomento interdisciplinare Tecnologia-Matematica Libro consigliato: Disegno Laboratorio - IL MANUALE DI TECNOLOGIA _G.ARDUINO_LATTES studiare da pag.19.da 154 a 162 Unità aggiornata: 7/2012 2 Sono corpi
1 Argomento interdisciplinare Tecnologia-Matematica Libro consigliato: Disegno Laboratorio - IL MANUALE DI TECNOLOGIA _G.ARDUINO_LATTES studiare da pag.19.da 154 a 162 Unità aggiornata: 7/2012 2 Sono corpi
Lipidi: funzioni. Strutturale. Riserva energetica. Segnale.
 Lipidi: funzioni. Strutturale. Riserva energetica. Segnale. Lipidi:classificazione. Saponificabili Non saponificabili Semplici Complessi Prostaglandine Steroidi Cere Trigliceridi Fosfogliceridi Sfingolipidi
Lipidi: funzioni. Strutturale. Riserva energetica. Segnale. Lipidi:classificazione. Saponificabili Non saponificabili Semplici Complessi Prostaglandine Steroidi Cere Trigliceridi Fosfogliceridi Sfingolipidi
LE FORZE INTERMOLECOLARI
 LE FORZE INTERMOLECOLARI Le forze intermolecolari sono forze che si instaurano tra le molecole e sono decisive nel determinarne le proprietà chimico fisiche Non c è alcun dubbio che il nome di Van der
LE FORZE INTERMOLECOLARI Le forze intermolecolari sono forze che si instaurano tra le molecole e sono decisive nel determinarne le proprietà chimico fisiche Non c è alcun dubbio che il nome di Van der
Quesiti e problemi. 12 Individua l elemento del terzo periodo che appartiene. 13 Completa la parte evidenziata del sistema periodico,
 SUL LIBR DA PAG 184 A PAG 18 Quesiti e problemi 1 L energia di legame 1 Definisci l energia di legame. L energia di legame è la quantità di energia che è necessario fornire a una mole di sostanza per rompere
SUL LIBR DA PAG 184 A PAG 18 Quesiti e problemi 1 L energia di legame 1 Definisci l energia di legame. L energia di legame è la quantità di energia che è necessario fornire a una mole di sostanza per rompere
CAPITOLO V. DATABASE: Il modello relazionale
 CAPITOLO V DATABASE: Il modello relazionale Il modello relazionale offre una rappresentazione matematica dei dati basata sul concetto di relazione normalizzata. I principi del modello relazionale furono
CAPITOLO V DATABASE: Il modello relazionale Il modello relazionale offre una rappresentazione matematica dei dati basata sul concetto di relazione normalizzata. I principi del modello relazionale furono
Organic Chemistry. 4 th Edition Paula Yurkanis Bruice. Delocalizzazione degli elettroni e risonanza
 Organic Chemistry 4 th Edition Paula Yurkanis Bruice Delocalizzazione degli elettroni e risonanza 1 Elettroni Localizzati contro elettroni delocalizzati localized electrons localized electrons delocalized
Organic Chemistry 4 th Edition Paula Yurkanis Bruice Delocalizzazione degli elettroni e risonanza 1 Elettroni Localizzati contro elettroni delocalizzati localized electrons localized electrons delocalized
Come costruire un computer quantistico
 Come costruire un computer quantistico Oliver Morsch CNR-INFM, Dipartimento di Fisica, Università di Pisa Introduzione: Fisica quantistica La fisica del c.q.: La sovrapposizione e gli stati entangled Problemi
Come costruire un computer quantistico Oliver Morsch CNR-INFM, Dipartimento di Fisica, Università di Pisa Introduzione: Fisica quantistica La fisica del c.q.: La sovrapposizione e gli stati entangled Problemi
GENETICA. La mappatura dei cromosomi eucariotici mediante la ricombinazione
 GENETICA La mappatura dei cromosomi eucariotici mediante la ricombinazione Mappatura: : domande Se 2 geni sono localizzati sullo stesso cromosoma (linked)) si possono scoprire nuove combinazioni di alleli
GENETICA La mappatura dei cromosomi eucariotici mediante la ricombinazione Mappatura: : domande Se 2 geni sono localizzati sullo stesso cromosoma (linked)) si possono scoprire nuove combinazioni di alleli
NUMERI DI OSSIDAZIONE
 NUMERI DI OSSIDAZIONE Numeri in caratteri romani dotati di segno Tengono conto di uno squilibrio di cariche nelle specie poliatomiche Si ottengono, formalmente, attribuendo tutti gli elettroni di valenza
NUMERI DI OSSIDAZIONE Numeri in caratteri romani dotati di segno Tengono conto di uno squilibrio di cariche nelle specie poliatomiche Si ottengono, formalmente, attribuendo tutti gli elettroni di valenza
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He. 2) L'acqua è:
 1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
INTRODUZIONE ALLA GEOMETRIA ANALITICA LA RETTA E LA PARABOLA
 INTRODUZIONE ALLA GEOMETRIA ANALITICA LA RETTA E LA PARABOLA Una Geometria non può essere più vera di un altra; può essere solamente più comoda. Ora la Geometria Euclidea è e resterà più comoda H. Poincaré
INTRODUZIONE ALLA GEOMETRIA ANALITICA LA RETTA E LA PARABOLA Una Geometria non può essere più vera di un altra; può essere solamente più comoda. Ora la Geometria Euclidea è e resterà più comoda H. Poincaré
ELEMENTI DI GEOMETRIA ANALITICA: LA RETTA.
 ELEMENTI DI GEOMETRIA ANALITICA: LA RETTA. Prerequisiti I radicali Risoluzione di sistemi di equazioni di primo e secondo grado. Classificazione e dominio delle funzioni algebriche Obiettivi minimi Saper
ELEMENTI DI GEOMETRIA ANALITICA: LA RETTA. Prerequisiti I radicali Risoluzione di sistemi di equazioni di primo e secondo grado. Classificazione e dominio delle funzioni algebriche Obiettivi minimi Saper
L equilibrio dei gas. Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura
 Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO: CHIMICA, MATERIALI E BIOTECNOLOGIE
 RE P U B B L I C A I T A L I A N A ISTITUTO DI ISTRUZIONE SECONDARIA SUPERIORE MINERARIO G. ASPRONI E. FERMI DI IGLESIAS PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO:
RE P U B B L I C A I T A L I A N A ISTITUTO DI ISTRUZIONE SECONDARIA SUPERIORE MINERARIO G. ASPRONI E. FERMI DI IGLESIAS PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO:
Grazie ai Colleghi di Geometria del Dipartimento di Matematica dell Università degli Studi di Torino per il loro prezioso contributo. Grazie al Prof.
 A01 178 Grazie ai Colleghi di Geometria del Dipartimento di Matematica dell Università degli Studi di Torino per il loro prezioso contributo. Grazie al Prof. S.M. Salamon per tanti utili suggerimenti e
A01 178 Grazie ai Colleghi di Geometria del Dipartimento di Matematica dell Università degli Studi di Torino per il loro prezioso contributo. Grazie al Prof. S.M. Salamon per tanti utili suggerimenti e
Studio di funzione. Tutti i diritti sono riservati. E vietata la riproduzione, anche parziale, senza il consenso dell autore. Funzioni elementari 2
 Studio di funzione Copyright c 2009 Pasquale Terrecuso Tutti i diritti sono riservati. E vietata la riproduzione, anche parziale, senza il consenso dell autore. Funzioni elementari 2 Studio di funzione
Studio di funzione Copyright c 2009 Pasquale Terrecuso Tutti i diritti sono riservati. E vietata la riproduzione, anche parziale, senza il consenso dell autore. Funzioni elementari 2 Studio di funzione
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Docente: DI LISCIA F. CLASSE 1T MODULO 1: GLI INSIEMI NUMERICI
 Docente: DI LISCIA F. Materia: MATEMATICA CLASSE 1T MODULO 1: GLI INSIEMI NUMERICI Insiemi numerici: numeri naturali, proprietà delle operazioni aritmetiche; Potenze e loro proprietà; Criteri di divisibilità;
Docente: DI LISCIA F. Materia: MATEMATICA CLASSE 1T MODULO 1: GLI INSIEMI NUMERICI Insiemi numerici: numeri naturali, proprietà delle operazioni aritmetiche; Potenze e loro proprietà; Criteri di divisibilità;
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Utilizzo ECG
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Utilizzo ECG 27/4/2006 Cuore come dipolo elettrico Il cuore considerato come un generatore elettrico complesso, in cui sono presenti
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Utilizzo ECG 27/4/2006 Cuore come dipolo elettrico Il cuore considerato come un generatore elettrico complesso, in cui sono presenti
I LIPIDI (GRASSI) Cosa sono
 I LIPIDI (GRASSI) Cosa sono Comunemente chiamati "grassi", i lipidi comprendono una grande varietà di molecole, accomunate dalla caratteristica di essere insolubili in acqua. I lipidi più importanti dal
I LIPIDI (GRASSI) Cosa sono Comunemente chiamati "grassi", i lipidi comprendono una grande varietà di molecole, accomunate dalla caratteristica di essere insolubili in acqua. I lipidi più importanti dal
UNIVERSITÀ DEGLI STUDI DI PADOVA Facoltà di Ingegneria A.A. 2009/10
 UNIVERSITÀ DEGLI STUDI DI PADOVA Facoltà di Ingegneria A.A. 2009/10 Corso di Disegno Tecnico Industriale per i Corsi di Laurea triennale in Ingegneria Meccanica e in Ingegneria dell Energia Sistemi di
UNIVERSITÀ DEGLI STUDI DI PADOVA Facoltà di Ingegneria A.A. 2009/10 Corso di Disegno Tecnico Industriale per i Corsi di Laurea triennale in Ingegneria Meccanica e in Ingegneria dell Energia Sistemi di
Liceo Scientifico Statale. Leonardo da Vinci. Fisica. Programma svolto durante l anno scolastico 2012/13 CLASSE I B. DOCENTE Elda Chirico
 Liceo Scientifico Statale Leonardo da Vinci Fisica Programma svolto durante l anno scolastico 2012/13 CLASSE I B DOCENTE Elda Chirico Le Grandezze. Introduzione alla fisica. Metodo sperimentale. Grandezze
Liceo Scientifico Statale Leonardo da Vinci Fisica Programma svolto durante l anno scolastico 2012/13 CLASSE I B DOCENTE Elda Chirico Le Grandezze. Introduzione alla fisica. Metodo sperimentale. Grandezze
ANALISI MULTIVARIATA
 ANALISI MULTIVARIATA Marcella Montico Servizio di epidemiologia e biostatistica... ancora sulla relazione tra due variabili: la regressione lineare semplice VD: quantitativa VI: quantitativa Misura la
ANALISI MULTIVARIATA Marcella Montico Servizio di epidemiologia e biostatistica... ancora sulla relazione tra due variabili: la regressione lineare semplice VD: quantitativa VI: quantitativa Misura la
CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA. L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
 COMPITI PER LE VACANZE E ATTIVITA PER IL RECUPERO a.s. 2014/2015 SECONDA E ITIS CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
COMPITI PER LE VACANZE E ATTIVITA PER IL RECUPERO a.s. 2014/2015 SECONDA E ITIS CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
Quando un composto ionico viene immesso in acqua si dissocia formando uno ione negativo ed uno positivo.
 I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
Con carta e forbici alla scoperta del paese Geometria
 Con carta e forbici alla scoperta del paese Geometria Anna Asti Enrica Ventura La parola non serve a nulla, il disegno non basta, è necessaria l azione perché il bambino giunga a combinare delle operazioni
Con carta e forbici alla scoperta del paese Geometria Anna Asti Enrica Ventura La parola non serve a nulla, il disegno non basta, è necessaria l azione perché il bambino giunga a combinare delle operazioni
Rilevazione degli apprendimenti. Anno Scolastico 2006 2007 PROVA DI MATEMATICA. Scuola Secondaria di II grado. Classe Terza Tipo A. Codici. Scuola:...
 Ministero della Pubblica Istruzione Rilevazione degli apprendimenti Anno Scolastico 2006 2007 PROVA DI MATEMATICA Scuola Secondaria di II grado Classe Terza Tipo A Codici Scuola:..... Classe:.. Studente:.
Ministero della Pubblica Istruzione Rilevazione degli apprendimenti Anno Scolastico 2006 2007 PROVA DI MATEMATICA Scuola Secondaria di II grado Classe Terza Tipo A Codici Scuola:..... Classe:.. Studente:.
Gli Alcheni : struttura e nomenclatura
 Gli Alcheni : struttura e nomenclatura Alcheni Gli alcheni sono idrocarburi che contengono un doppio legame carbonio-carbonio sono anche detti olefine o idrocarburi insaturi La formula molecolare è C n
Gli Alcheni : struttura e nomenclatura Alcheni Gli alcheni sono idrocarburi che contengono un doppio legame carbonio-carbonio sono anche detti olefine o idrocarburi insaturi La formula molecolare è C n
Trasformazioni Geometriche 1 Roberto Petroni, 2011
 1 Trasformazioni Geometriche 1 Roberto etroni, 2011 Trasformazioni Geometriche sul piano euclideo 1) Introduzione Def: si dice trasformazione geometrica una corrispondenza biunivoca che associa ad ogni
1 Trasformazioni Geometriche 1 Roberto etroni, 2011 Trasformazioni Geometriche sul piano euclideo 1) Introduzione Def: si dice trasformazione geometrica una corrispondenza biunivoca che associa ad ogni
GEOLOGIA (studio della litosfera) Essa si divide in MINERALOGIA (studio dei minerali) e PETROGRAFIA ( studio delle rocce)
 GEOLOGIA (studio della litosfera) Essa si divide in MINERALOGIA (studio dei minerali) e PETROGRAFIA ( studio delle rocce) I MINERALI I minerali sono sostanze solide omogenee, inorganiche, esprimibili mediante
GEOLOGIA (studio della litosfera) Essa si divide in MINERALOGIA (studio dei minerali) e PETROGRAFIA ( studio delle rocce) I MINERALI I minerali sono sostanze solide omogenee, inorganiche, esprimibili mediante
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05
 I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
ISTITUTO ISTRUZIONE SUPERIORE
 ISTITUTO ISTRUZIONE SUPERIORE Federico II di Svevia Indirizzi: Liceo Scientifico Classico Linguistico Artistico e Scienze Applicate Via G. Verdi, 1 85025 MELFI (PZ) Tel. 097224434/35 Cod. Min.: PZIS02700B
ISTITUTO ISTRUZIONE SUPERIORE Federico II di Svevia Indirizzi: Liceo Scientifico Classico Linguistico Artistico e Scienze Applicate Via G. Verdi, 1 85025 MELFI (PZ) Tel. 097224434/35 Cod. Min.: PZIS02700B
MICROSCOPIA A FORZA ATOMICA (AFM)
 MICROSCOPIA A FORZA ATOMICA (AFM) Binnig and Rohrer (1982, STM, Nobel prize in 1986) Binnig, Quate and Gerber (1986, AFM) Anno 2001-2002 1 Principio di funzionamento di un AFM A B C D Rivelatore Specchio
MICROSCOPIA A FORZA ATOMICA (AFM) Binnig and Rohrer (1982, STM, Nobel prize in 1986) Binnig, Quate and Gerber (1986, AFM) Anno 2001-2002 1 Principio di funzionamento di un AFM A B C D Rivelatore Specchio
1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3.
 Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Recenti Scoperte Scientifiche in Ottica
 Recenti Scoperte Scientifiche in Ottica Luca Salasnich Dipartimento di Fisica e Astronomia Galileo Galilei, Università di Padova, Italy Padova, 26 Maggio 2014 Secondo Meeting di Ottica e Optometria a Padova
Recenti Scoperte Scientifiche in Ottica Luca Salasnich Dipartimento di Fisica e Astronomia Galileo Galilei, Università di Padova, Italy Padova, 26 Maggio 2014 Secondo Meeting di Ottica e Optometria a Padova
Nuclei concettuali fondamentali di chimica organica
 Nuclei concettuali fondamentali di chimica organica Istruzioni per l uso La seguente dispensa raccoglie e tratta sommariamente i principali nuclei concettuali della chimica organica, la cui conoscenza
Nuclei concettuali fondamentali di chimica organica Istruzioni per l uso La seguente dispensa raccoglie e tratta sommariamente i principali nuclei concettuali della chimica organica, la cui conoscenza
PROGRAMMA CONSUNTIVO
 PAGINA: 1 PROGRAMMA CONSUNTIVO A.S.2014-15 SCUOLA: Liceo Linguistico Teatro alla Scala DOCENTE: BASSO RICCI MARIA MATERIA: MATEMATICA- INFORMATICA Classe 2 Sezione A CONTENUTI Sistemi lineari numerici
PAGINA: 1 PROGRAMMA CONSUNTIVO A.S.2014-15 SCUOLA: Liceo Linguistico Teatro alla Scala DOCENTE: BASSO RICCI MARIA MATERIA: MATEMATICA- INFORMATICA Classe 2 Sezione A CONTENUTI Sistemi lineari numerici
SCHEDA DI PROGRAMMAZIONE PER COMPETENZE DISCIPLINARI CURRICOLO DI MATEMATICA CLASSE PRIMA SCUOLA PRIMARIA
 Competenza 1 SCHEDA DI PROGRAMMAZIONE PER COMPETENZE DISCIPLINARI CURRICOLO DI MATEMATICA CLASSE PRIMA SCUOLA PRIMARIA AREA MATEMATICO SCIENTIFICO - TECNOLOGICA Competenze Abilità specifiche Nuclei Utilizzare
Competenza 1 SCHEDA DI PROGRAMMAZIONE PER COMPETENZE DISCIPLINARI CURRICOLO DI MATEMATICA CLASSE PRIMA SCUOLA PRIMARIA AREA MATEMATICO SCIENTIFICO - TECNOLOGICA Competenze Abilità specifiche Nuclei Utilizzare
Prova in itinere di Chimica Generale 1 Giugno 2011
 Prova in itinere di Chimica Generale 1 Giugno 2011 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Prova in itinere di Chimica Generale 1 Giugno 2011 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
I Solidi Regolari??-??- 2001
 I Solidi Regolari??-??- 2001 Cosa sono i Solidi Platonici 1 I Solidi Platonici sono solidi convessi delimitati da facce costitute da poligoni regolari tutti uguali tra loro. Un Solido di questo genere
I Solidi Regolari??-??- 2001 Cosa sono i Solidi Platonici 1 I Solidi Platonici sono solidi convessi delimitati da facce costitute da poligoni regolari tutti uguali tra loro. Un Solido di questo genere
Il campo magnetico. 1. Fenomeni magnetici 2. Calcolo del campo magnetico 3. Forze su conduttori percorsi da corrente 4. La forza di Lorentz
 Il capo agnetico 1. Fenoeni agnetici 2. Calcolo del capo agnetico 3. Forze su conduttori percorsi da corrente 4. La forza di Lorentz Prof. Giovanni Ianne 1/21 Fenoeni agnetici La agnetite è un inerale
Il capo agnetico 1. Fenoeni agnetici 2. Calcolo del capo agnetico 3. Forze su conduttori percorsi da corrente 4. La forza di Lorentz Prof. Giovanni Ianne 1/21 Fenoeni agnetici La agnetite è un inerale
LICEO SCIENTIFICO LEONARDO da VINCI REGGIO CALABRIA PROGRAMMA DI SCIENZE NATURALI CLASSE 2 a SEZ. Q A.S. 2012/2013
 LICEO SCIENTIFICO LEONARDO da VINCI REGGIO CALABRIA PROGRAMMA DI SCIENZE NATURALI CLASSE 2 a SEZ. Q A.S. 2012/2013 CHIMICA NUCLEO FONDANTE A : MISURE E GRANDEZZE TRASFORMAZIONI CHIMICO-FISICHE DELLA MATERIA
LICEO SCIENTIFICO LEONARDO da VINCI REGGIO CALABRIA PROGRAMMA DI SCIENZE NATURALI CLASSE 2 a SEZ. Q A.S. 2012/2013 CHIMICA NUCLEO FONDANTE A : MISURE E GRANDEZZE TRASFORMAZIONI CHIMICO-FISICHE DELLA MATERIA
Parte Seconda. Geometria
 Parte Seconda Geometria Geometria piana 99 CAPITOLO I GEOMETRIA PIANA Geometria: scienza che studia le proprietà delle figure geometriche piane e solide, cioè la forma, l estensione e la posizione dei
Parte Seconda Geometria Geometria piana 99 CAPITOLO I GEOMETRIA PIANA Geometria: scienza che studia le proprietà delle figure geometriche piane e solide, cioè la forma, l estensione e la posizione dei
Indice generale. Prefazione
 26-10-2009 10:41 Pagina VI Prefazione Ringraziamenti dell Editore Guida alla lettura XIII XV XVII Capitolo 0 Lessico della chimica 1 0.1 La chimica 1 0.1.1 Classificazioni della materia 2 0.1.2 Proprietà
26-10-2009 10:41 Pagina VI Prefazione Ringraziamenti dell Editore Guida alla lettura XIII XV XVII Capitolo 0 Lessico della chimica 1 0.1 La chimica 1 0.1.1 Classificazioni della materia 2 0.1.2 Proprietà
1 atm = 760 mm Hg = 760 torr = 101300 N/m 2 =101300 Pa. Anodo = Polo Positivo Anione = Ione Negativo. Catodo = Polo Negativo Catione = Ione Positivo
 1) Concetti Generali 1. Unità di Misura: A. Pressione 1 atm = 760 mm Hg = 760 torr = 101300 N/m 2 =101300 Pa. B. Calore 1 joule = 10 7 Erg. 1 caloria = 4,185 joule. Anodo = Polo Positivo Anione = Ione
1) Concetti Generali 1. Unità di Misura: A. Pressione 1 atm = 760 mm Hg = 760 torr = 101300 N/m 2 =101300 Pa. B. Calore 1 joule = 10 7 Erg. 1 caloria = 4,185 joule. Anodo = Polo Positivo Anione = Ione
ESERCITAZIONI PROPEDEUTICHE DI MATEMATICA. A. Concetti e proprietà di base del sistema dei numeri della matematica ( ) + 64 7 10 :5
 ESERCITAZIONI PROPEDEUTICHE DI MATEMATICA PER IL CORSO DI LAUREA IN SCIENZE DELLA FORMAZIONE PRIMARIA Ana Millán Gasca Luigi Regoliosi La lettura e lo studio del libro Pensare in matematica da parte degli
ESERCITAZIONI PROPEDEUTICHE DI MATEMATICA PER IL CORSO DI LAUREA IN SCIENZE DELLA FORMAZIONE PRIMARIA Ana Millán Gasca Luigi Regoliosi La lettura e lo studio del libro Pensare in matematica da parte degli
I.R.A.S.E. Nazionale Ente qualificato per la Formazione del Personale della Scuola (Decreto MIUR prot. n. 1222 del 5 luglio 2005 D.M.
 CLASSE A059 n.2 1. I fari delle automobili sono fatti con specchi concavi di forma parabolica perché a) perché i raggi devono convergere in un punto fisso detto fuoco b) proiettano verso esterno un fascio
CLASSE A059 n.2 1. I fari delle automobili sono fatti con specchi concavi di forma parabolica perché a) perché i raggi devono convergere in un punto fisso detto fuoco b) proiettano verso esterno un fascio
Gruppo 10 Nickel Ni (1751)
 Gruppo 10 ickel i (1751) Proprietà i Pd Pt Z 28 46 78 umero di isotopi 5 6 6 naturali Massa atomica 58.69 106.42 195.08 onfigurazione [Ar]3d 8 4s 2 [Kr]4d 10 [Xe]4f 14 5d 9 6s 1 elettronica Aspetto Metallo
Gruppo 10 ickel i (1751) Proprietà i Pd Pt Z 28 46 78 umero di isotopi 5 6 6 naturali Massa atomica 58.69 106.42 195.08 onfigurazione [Ar]3d 8 4s 2 [Kr]4d 10 [Xe]4f 14 5d 9 6s 1 elettronica Aspetto Metallo
COMUNICAZIONE N.10 DEL 26.01.2011 1
 COMUNICAZIONE N.10 DEL 26.01.2011 1 1 - SECONDO MODULO - APPLICAZIONI DI GEOMETRIA DESCRITTIVA (10): ESEMPI 73-96 2 - TERZO MODULO - DISEGNI A MANO LIBERA (8): DISEGNI h71-h80 3 - QUARTO MODULO - CLASSICI
COMUNICAZIONE N.10 DEL 26.01.2011 1 1 - SECONDO MODULO - APPLICAZIONI DI GEOMETRIA DESCRITTIVA (10): ESEMPI 73-96 2 - TERZO MODULO - DISEGNI A MANO LIBERA (8): DISEGNI h71-h80 3 - QUARTO MODULO - CLASSICI
