CHIMICA ANALITICA II CON LABORATORIO. (AA ) 8 C.F.U. - Laurea triennale in Chimica
|
|
|
- Carlotta Di Matteo
- 5 anni fa
- Visualizzazioni
Transcript
1 CHIMICA ANALITICA II CON LABORATORIO (AA ) 8 C.F.U. - Laurea triennale in Chimica 15
2
3 Il cromatogramma Principalmente per le cromatografie su colonna si usa la tecnica dell'eluizione (eluente è sinonimo di fase mobile). - Il campione viene disciolto nella fase mobile (f.m.) e introdotto alla testa alla colonna; - Una volta che il campione è iniettato, i costituenti si distribuiscono tra la f.m. e la fase stazionaria (f.s.). Se la f.m. è continuamente fornita come eluente, le sostanze si distribuiscono lungo la colonna tra nuova f.m. e la f.s.; - Continuando ad aggiungere f.m. si procede all eluizione finché le sostanze sono separate e rilevate alla fine della colonna; - Composti trattenuti in modo più forte dalla f.s. impiegano più tempo a essere separati di sostanze che interagiscono poco con la f.s.. - Idealmente, le sostanze sono separate dopo un certo tempo di eluizione e rilevate individualmente alla fine della colonna. - Il segnale viene registrato come funzione del tempo di eluizione o del volume di eluizione (di f.m.), il grafico che si ottiene viene chiamato cromatogramma. Flusso o portata = volume/ tempo Introduzione alla cromatografia: il cromatogramma 3
4 Se si seguono nel tempo le zone (bande) occupate dalle sostanze lungo la colonna si notano due effetti: a) la distanza tra le bande delle sostanze aumenta nel tempo (ovverocon conilil volumedi di eluente aggiunto), quindi aumenta la la separazione temporale temporale del del "cammino" "cammino" delle delle diverse diverse sostanze; sostanze; b) allo stesso tempo i picchi rilevati nel cromatogramma si allargano, causando possibili sovrapposizioni tra i picchi, b) allo stesso tempo i picchi rilevati nel cromatogramma si allargano, causando possibili sovrapposizioni tra i quindi peggiore separazione. picchi, quindi peggiore separazione. Quindi si può migliorare in via di principio una separazione se: i. Le velocità di migrazione delle sostanze viene alterata in maniera selettiva; ii. L allargamento dei picchi viene minimizzato il più possibile (scelta di f.s., f.m., u) Introduzione alla cromatografia: il cromatogramma 4
5 Parametri caratteristici del Cromatogramma Velocità di migrazione La velocità di migrazione è la velocità con cui le particelle/molecole viaggiano lungo la colonna. Nel caso più semplice, il passaggio delle sostanze tra le fasi mobile (M) e stazionaria (s) è governato da un equilibrio di partizione. Il coefficiente (o rapporto) di partizione K per una sostanza è: K = c s cm K non può esser dedotto direttamente dal cromatogramma. Tuttavia si può mettere in relazione il parametro t R tempo di ritenzione totale (che è ricavabile direttamente dal cromatogramma) con K. Introduzione alla cromatografia: il cromatogramma 5
6 Tempi di ritenzione Il picco t M è denominato tempo morto. Viene generato da un composto per nulla trattenuto, cioè il tempo che le molecole della fase mobile impiegano per attraversare la colonna. Il tempo morto è l'intervallo di tempo che intercorre tra l effettivo momento dell' iniezione e l effettivo momento della rivelazione. Il picco t R è denominato tempo di ritenzione totale (di una sostanza eluita). La velocità lineare media dell'analita è: v = L tr La velocità lineare media della fase mobile è: u = L tm dove L è la lunghezza della colonna Introduzione alla cromatografia: il cromatogramma 6
7 Relazione tra t R e K Dal momento che la fase mobile è l'unica in movimento, la ritenzione di una sostanza corrisponde al suo tempo di residenza nella fase mobile. Sostanze non trattenute permangono per tutto il tempo nella f.m., mentre sostanze che interagiscono con la fase stazionaria rimangono solo per una frazione del tempo nella fase mobile, in paragone alle sostanze non trattenute. Questa porzione di tempo può essere descritta usando la relazione tra massa di analita nella f.m. e massa totale dell analita nella colonna (cioè esprimendo la velocità di migrazione dell'analita come frazione della velocità di migrazione della fase mobile): n di moli di analita nella f.m. c M V M v = u = u c M V M + c s V s n di moli totali di analita (f.m. + f.s.) c s V s c M V M K (coefficiente di partizione) v = u K V s V M Introduzione alla cromatografia: il cromatogramma V s e V M sono parametri sperimentali misurabili 7
8 Fattore di ritenzione k Si definisce fattore di ritenzione k: V k = s K oppure k = K V M β dove β è il rapporto tra le fasi La relazione con i tempi di ritenzione è derivabile come: v = u k L t R L = t M k Riarrangiando è possibile dimostrare che: t R - t = M k = t M t' R t M tempo di ritenzione corretto (adjusted retention time) Il fattore di ritenzione k può essere dedotto direttamente dal cromatogramma, sulla base dei tempi di ritenzione totali e del tempo morto, ottenendo il tempo di ritenzione corretto. I fattori di ritenzione dovrebbero aver valori tra 1 e 5 (k <1 eluito troppo velocemente; >20 tempo di ritenzione intollerabilmente lungo) Introduzione alla cromatografia: il cromatogramma Dynamics of Chromatography: Principles and Theory di J. Calvin Giddings 8
9 Fattore di selettività Il fattore di selettività o fattore di separazione è una misura della separazione di due sostanze ed è indicato con α. Utilizzando i coefficienti di partizione per calcolare il fattore di selettività per due sostanze A e B, si ottiene: α = K B K A = k B k A = (t R') B (t R ') A Quindi il fattore di selettività dipende dai tempi di ritenzione corretti (adjusted retention time) delle due sostanze A e B Introduzione alla cromatografia: il cromatogramma Dynamics of Chromatography: Principles and Theory di J. Calvin Giddings 9
10 Teoria classica La teoria classica della cromatografia esamina l effetto di allargamento dei picchi lungo la colonna e giunge alla conclusione che l ampiezza del picco è direttamente collegata all efficienza di separazione o efficienza di colonna. La teoria classica della cromatografia considera la trasposizione in una colonna di un numero discreto di stadi di partizione (i piatti «teorici»). Martin e Synge hanno introdotto: - l altezza equivalente a un piatto teorico H e - il numero dei piatti teorici N quali parametri di efficienza di una colonna. Secondo questa teoria, la colonna è immaginabile come una successione di piatti immaginari e su ciascun piatto teorico si verifica un equilibrazione della distribuzione dell analita tra f.m. e f.s.. Se la sostanza si muove attraverso la colonna, ciò significa che essa effettua un passaggio graduale da uno stadio di separazione a quello successivo. Introduzione alla cromatografia: teoria classica 10
11 Efficienza della colonna Supponiamo di iniettare in colonna un campione costituito da un unico componente: - Al momento dell'iniezione il campione occupa una banda stretta di larghezza finita. - Quando il campione percorre la colonna, la larghezza di tale banda aumenta continuamente in un processo che si chiama allargamento di banda. - L efficienza della colonna fornisce una misura quantitativa dell entità dell allargamento di banda. - Quando si inietta il campione la sua banda ha un profilo di concentrazione uniforme, o rettangolare, in funzione della distanza lungo la colonna. - Mentre scende nella colonna, la banda si allarga ed assume un profilo di concentrazione gaussiano. Introduzione alla cromatografia: teoria classica 11
12 Distribuzione gaussiana o normale Introduzione alla cromatografia: teoria classica 12
13 Dimostrazione teoria classica Nel loro modello teorico originale di cromatografia, Martin e Synge interpretarono i fenomeni che avvengono in una colonna cromatografica come uno sviluppo in sezioni discrete - che chiamavano piatti teorici in cui vi è una distribuzione di equilibrio del soluto tra la fase stazionaria e fase mobile. Descrissero l efficienza della colonna in termini di numero di piatti teorici: N = L H dove: L è la lunghezza della colonna e H è l'altezza di un piatto teorico. L efficienza della colonna migliora e i picchi cromatografici divengono più stretti, all aumentare dei piatti teorici. Se assumiamo che un picco cromatografico abbia un profilo gaussiano, allora l estensione della banda di allargamento è in relazione alla varianza o deviazione standard del picco. L'altezza di un piatto teorico (anche HETP Height Equivalent to the Theoretical Plate) si definisce come varianza per unità di lunghezza della colonna: H = σ L 2 L in cui la deviazione standard, σ L, assume le dimensioni di una lunghezza. Introduzione alla cromatografia: teoria classica 13
14 Poiché i tempi di ritenzione e le larghezze del picco di solito sono misurati in secondi o minuti, è più conveniente esprimere la deviazione standard in unità di tempo, σ t, dividendo σ L per la velocità lineare media del soluto, ν. = σ L σ t = σ L t r v L La velocità lineare media del soluto è la distanza percorsa, L, divisa per il suo tempo di ritenzione, t r. Per una forma di picco gaussiana, la larghezza alla base, w, è quattro volte la sua deviazione standard, σ t. w b = 4 σ t L'equazione può essere riformulata definendo l'altezza di un piatto teorico in termini di parametri cromatografici facilmente misurabili: σ t = σ L t r L = σ L σ t L t r H = L w b 2 16 t r 2 = σ L 2 σ t2 L 2 H = = L σ t 2 L L tr 2 t r 2 σ t = w b 4 Introduzione alla cromatografia: teoria classica 14
15 Si può quindi definire il numero di piatti teorici come: 16 t 2 N = L = r H = H w b 2 L w b 2 16 t r 2 Quindi il numero di piatti teorici può essere determinato da un cromatogramma, misurando il tempo di ritenzione e l ampiezza di base di un picco. Risultati migliori si ottengono con una equazione modificata che impiega l ampiezza al semi-massimo: = N 5.54 t r w h 2 Queste relazioni si impiegano per valutare le separazioni cromatografiche, ma la teoria dei piatti è un approssimazione dei processi che effettivamente avvengono in colonna: in realtà si verificano difficilmente stadi di equilibrio separati, poiché la f.m. è in movimento. Quando si comparano colonne usando la teoria dei piatti e N, bisogna riferirsi sempre ad una stessa sostanza. Introduzione alla cromatografia: teoria classica 15
16 Teoria cinetica L ampliamento dei picchi deriva da un effetto cinetico che si manifesta a seguito della velocità finita a cui decorre il processo di trasferimento di massa durante la migrazione dell analita lungo la colonna. L entità di questi effetti dipende dalla lunghezza (del percorso) dei possibili passaggi dell'analita tra f.m. e f.s. ed è direttamente proporzionale alla velocità di flusso della f.m. Per descrivere questo effetto bisogna investigare la dipendenza di H dalla velocità (di flusso) lineare u (cm s -1 ). Variabili importanti per descrivere l efficienza delle colonne sono: Variabili importanti per descrivere l efficienza delle colonne sono: Velocità lineare della fase mobile Coefficiente di diffusione nella f.m. Coefficiente di diffusione nella f.s. Diametro del materiale di impaccamento Spessore del rivestimento liquido della f.s. Tempo di desorbimento dell analita Diametro della colonna u D M D S d D d f t d d c Introduzione alla cromatografia: teoria cinetica 16
17 Dipendenza di H (altezza piatto teorico) da u (velocità lineare della f.m.) in LC e GC In LC si ottiene la minima altezza di H per velocità della f.m. (u) più basse rispetto a GC; Osservando i grafici risulta che è possibile, in linea di principio, ottenere H minori in LC rispetto a GC; Quindi, a parità di lunghezza, colonne LC contengono un numero più alto di piatti teorici (N) di quelle GC, pertanto sono più efficienti; Tuttavia in LC si utilizzano colonne lunghe tra i 25 cm e i 50 cm al massimo, poiché pressioni per mantenere il flusso attraverso colonne più lunghe non sono raggiungibili senza danni alla strumentazione; Le colonne GC sono mediamente lunghe tra i 30 m e i 60 m, ma possono essere lunghe anche 100 m (mantenere su lunghe colonne la pressione della f.m., che è un gas, non comporta problemi alla strumentazione). Introduzione alla cromatografia: teoria cinetica 17
18 Equazione di Van Deemter = B H A + + C u u coefficiente di DIFFUSIONE LONGITUDINALE (u = velocità della f.m.) coefficiente di DIFFUSIONE TURBOLENTA coefficiente di TRASFERIMENTO DI MASSA (f.m. f.s.) a) c) b) d) a) diffusione turbolenta b) trasferimento di massa nella f.s in LC c) trasferimento di massa nella f.s in GC d) trasferimento di massa nella f.m. Introduzione alla cromatografia: teoria cinetica 18
19 Effetto della diffusione turbolenta sull'ampiezza di picco La differenza di cammino di molecole dello stesso analita nel passaggio attraverso la f.s. in cromatografia liquida (LC) provoca un arrivo di molecole al detector in tempi diversi e quindi la registrazione di un picco allargato. Il fenomeno della diffusione turbolenta non riguarda GC in cui la fase stazionaria è liquida e non solida. Regolarità dell impaccamento (piccola distribuzione dimensionale delle particelle di f.s.) minimizza la diffusione turbolenta. Parametro indipendente da u. Introduzione alla cromatografia: teoria cinetica 19
20 Effetto della diffusione longitudinale sull'ampiezza di picco Le molecole di analita sono in continuo movimento. Diffondono da regioni a più alta concentrazione di analita verso quelle a più bassa concentrazione. Questi fenomeni di diffusione comportano un allargamento del picco. Alte velocità di flusso della f.m. riducono il tempo per i processi di diffusione longitudinale, così da ottenere picchi più stretti. Poiché il coefficiente di diffusione delle sostanze e più alto nella fase gas che nella fase liquida, la diffusione longitudinale contribuisce di più agli allargamenti di picco in GC che in LC. Introduzione alla cromatografia: teoria cinetica 20
21 Effetto del trasferimento di massa sull'ampiezza di picco Quando il soluto passa attraverso la colonna si muove tra la f.m. e la f.s., questo movimento tra le due fasi è detto trasferimento di massa. a) Equilibrio ideale con profili Gaussiani del soluto nella f.m. e nella f.s. b-c) Se la banda del soluto (nella f.m.) si sposta per una breve distanza lungo la colonna non c'è più equilibrio del soluto tra f.m. e f.s.. Le frecce mostrano il movimento del soluto (cioè il trasferimento di massa) tra f.s. e f.m. e viceversa. d) Una volta che l'equilibrio tra le due fasi è ristabilito la banda del soluto (nella f.m.) risulta più allargata che in precedenza. Quindi, se il movimento del soluto attraverso la f.m. o la f.s. non avviene a velocità comparabili per mantenere l'equilibrio di partizione tra le due fasi, il picco si allarga. Mediamente le molecole si muovono più velocemente nella f.m. che nella f.s., quindi per ridurre l'effetto di allargamento di picco dovuto al trasferimento di massa bisogna ridurre la velocità della f.m. per consentire il mantenimento dell'equilibrio di partizione tra le due fasi. Introduzione alla cromatografia: teoria cinetica 21
22 Equazione di Van Deemter modificata (modello più dettagliato) = B H C M u + + C u S u coefficiente di DIFFUSIONE LONGITUDINALE (u = velocità della f.m.) coefficiente di TRASFERIMENTO DI MASSA "da e verso" la fase mobile coefficiente di TRASFERIMENTO DI MASSA "da e verso" la fase stazionaria Introduzione alla cromatografia: teoria cinetica 22
23 Contributo dei termini individuali rispetto ai parametri di efficienza di colonna B H = C M u + + C u S u B = 2 k D D M coefficiente di DIFFUSIONE LONGITUDINALE C M = f(d D 2, d c 2 ) D M coefficiente di TRASFERIMENTO DI MASSA "da e verso" la fase mobile q k d 2 C S = f 2 t (1+k) 2 D d k = S (1+k) 2 Variabili importanti per descrivere l efficienza delle colonne sono: coefficiente di TRASFERIMENTO DI MASSA "da e verso" la fase stazionaria Velocità lineare della fase mobile Coefficiente di diffusione nella f.m. Coefficiente di diffusione nella f.s. Diametro del materiale di impaccamento Spessore del rivestimento liquido della f.s. Tempo di desorbimento dell analita Diametro della colonna u D M D S d D d f t d d c Fattore di ritenzione della sostanza Costanti Dipendenza funzionale ("funzione di") k k D, q f Introduzione alla cromatografia: teoria cinetica 23
24 Coefficiente di DIFFUSIONE LONGITUDINALE B = 2 k D D M B H = C M u + + C u S u Coefficiente di diffusione del soluto Coefficiente di diffusione nella f.m. Il coefficiente B descrive l'influenza della diffusione longitudinale; Questa influenza deriva dalla diffusione delle particelle lontano dal centro del picco, sia nella direzione del flusso della f.m. che in senso contrario; Il coefficiente B è l'unico che è indipendente dal diametro del materiale di impaccamento della colonna; Invece è direttamente proporzionale al coefficiente di diffusione del soluto nella fase mobile (k D ) e quindi aumenta al diminuire della massa molare del soluto; Il coefficiente B è di scarsa importanza in LC, è molto importante invece in GC; A parità degli altri termini dell'equazione un alto valore di B aumenta l'altezza del piatto teorico (H); Si può ridurre complessivamente il termine B/u dell'equazione di van Deemter (modificata) aumentando la velocità della f.m.(u), ma cioè comporta, a parità di altre condizioni, un maggior contributo degli altri due termini dell'equazione (C M u e C s u) all'altezza del piatto teorico (H). Introduzione alla cromatografia: teoria cinetica 24
25 coefficiente di TRASFERIMENTO DI MASSA "da e verso" la fase mobile "Funzione di" C M = f(d D 2, d c 2 ) D M Diametro del materiale di impaccamento Diametro della colonna B H = C M u + + C u S u Coefficiente di diffusione nella f.m. Durante la migrazione nella colonna, le molecole di campione si trasferiscono continuamente e in modo reversibile dalla f.m. alla f.s..; Le molecole devono raggiungere prima l interfase per poi dare luogo al trasferimento, quindi devono attraversare per diffusione la f.m. fino all interfase ed il tempo richiesto dipende dalla posizione della molecola; Il termine C M u nell'equazione di van Deemter (modificata) descrive questo fenomeno che provoca gli allargamenti di picco. In limitate condizioni questo termine corrisponde alla diffusione turbolenta A dell equazione di van Deemter. Il coefficiente C M è inversamente proporzionale al coefficiente di diffusione nella f.m. (D M ) e direttamente proporzionale al diametro del materiale di impaccamento della colonna (d D ) e al diametro della colonna stessa (d c ). D M è una grandezza proporzionale alla velocità con cui una molecola diffondente può muoversi nel mezzo di diffusione, quindi è: (1) direttamente proporzionale all'energia cinetica della particella; (2) inversamente proporzionale all'ingombro della particella (e quindi al suo raggio); (3) inversamente proporzionale alla viscosità del mezzo. LC Quindi se D M è grande il termine C M u è piccolo, pertanto, a parità di altre condizioni, l'altezza dei piatti (H) diminuisce; In LC la presenza di sacche di stagnazione di f.m. intrappolate nei pori e canali della f.s. aumenta l allargamento della banda (le molecole si muovono per diffusione dentro e fuori da questi pori) Introduzione alla cromatografia: teoria cinetica 25
26 coefficiente di TRASFERIMENTO DI MASSA "da e verso" la fase stazionaria B H = C M u + + C u S u C S = Costante Spessore del rivestimento liquido della f.s. Tempo di desorbimento dell analita q k d 2 f 2 t (1+k) 2 D d k S (1+k) 2 = (k = fattore di ritenzione della sostanza) Coefficiente di diffusione nella f.s. Per discutere il contributo del termine C S u bisogna distinguere due casi: Se la f.s. è LIQUIDA domina l equilibrio di distribuzione: quando una molecola di analita è trattenuta nella f.s., il movimento di quella molecola attraverso la colonna è rallentato, mentre le altre proseguono il cammino con la f.m.; L effetto aumenta all aumentare dello spessore della f.s. liquida (d f ) e con il diminuire del coefficiente di diffusione dell analita nella f.s (D S ); Quindi, a parità di altre condizioni, i piatti teorici saranno di altezza minore se lo spessore della f.s. è piccolo. Se la f.s. è SOLIDA C S dipende dal tempo necessario per i processi di adsorbimento e desorbimento (t d ) dell'analita; Quindi, più il tempo di desorbimento è lungo (per riportare l'analita in f.m. dalla f.s.), più alto sarà il piatto teorico(h). Introduzione alla cromatografia: teoria cinetica 26
27 Conclusioni B H = C M u + + C u S u u 2 > u 1 H 2 H 1 H 2 H 1 H 2 H 1 u 1 u 2 u 1 u 2 L obiettivo nelle cromatografie è quello di raggiungere separazioni efficaci in un breve tempo di analisi; ciò significa che si persegue una bassa altezza del piatto H (cioè la ricerca del minimo della funzione H(u)). Per aumentare la velocità di analisi (cioè, in pratica, la velocità di flusso u della f.m.) senza perdere efficienza (H minimo possibile) è bene che il minimo della funzione H(u) non sia troppo pronunciato (a "V") --> in figura, nel minimo, per una scelta di u 2 > u 1 si mantiene H "ottimizzato" cioè H 2 H 1. Bassi valori di H e curve H(u) con minimi non pronunciati si possono ottenere: Con f.s. solida con particelle piccole o con f.s. liquida con spessore piccolo; Con un impaccamento omogeneo di f.s. solida, usando materiale con una distribuzione dimensionale stretta; Con colonne dal piccolo diametro cioè sempre più strette (es. colonne capillari utilizzate in GC); Con coefficienti di diffusione elevati nella f.s. e bassi nella f.m. (in GC i coefficienti nella f.m. si abbassano significativamente abbassando T). Poiché i coefficienti di diffusione dipendono dalle dimensioni molecolari, l allargamento di un picco dipende dalla massa molare relativa (piccole molecole, buona efficienza). Introduzione alla cromatografia: teoria cinetica 27
28 Separazione dei picchi e risoluzione Già conosciamo il fattore di selettività o fattore di separazione che è una misura della separazione di due sostanze (A e B) ed è indicato con α: α = K B K A = k B k A = (t R') B (t R ') A Rapporto dei coefficienti di partizione Rapporto dei fattori di ritenzione Rapporto dei tempi di ritenzione corretti (per il tempo morto t M ) Il fattore di selettività α descrive solo la selettività del sistema di fasi impiegato. L efficienza di una colonna dipende anche dal numero di piatti N, e dall entità del fattore di ritenzione (k). Quindi si utilizza la RISOLUZIONE (R S ) per caratterizzare l abilità di una colonna cromatografica a separare due analiti (cioè la selettività). R S si calcola per i picchi gaussiani di A e B, impiegando le ampiezze di base (w b ). R S = Δt w A + w B 2 = tb R - t A R w b con w b w A w B "b" sta per "baseline" Introduzione alla cromatografia: separazione e risoluzione 28
CHIMICA ANALITICA II CON LABORATORIO. (AA ) 8 C.F.U. - Laurea triennale in Chimica
 CHIMICA ANALITICA II CON LABORATORIO (AA 2016-17) 8 C.F.U. - Laurea triennale in Chimica 10 Fondamenti teorici / cromatografia su colonna Lo sviluppo di un cromatogramma Tecnica di eluizione (eluente è
CHIMICA ANALITICA II CON LABORATORIO (AA 2016-17) 8 C.F.U. - Laurea triennale in Chimica 10 Fondamenti teorici / cromatografia su colonna Lo sviluppo di un cromatogramma Tecnica di eluizione (eluente è
Chromatography is a mature technique now. Gary Christian, Analytical Chemistry,
 Chromatography is a mature technique now. Gary Christian, nalytical Chemistry, 6th Ed. (Wiley) Descrizione generale della cromatografia I metodi cromatografici sono accomunati dalla separazione di sostanze
Chromatography is a mature technique now. Gary Christian, nalytical Chemistry, 6th Ed. (Wiley) Descrizione generale della cromatografia I metodi cromatografici sono accomunati dalla separazione di sostanze
Cromatografia. cromatogramma
 Cromatografia Il termine cromatografia racchiude una serie di metodi analitici impiegati per separare e quantificare singolarmente i diversi componenti presenti in miscele di analiti anche molto complesse.
Cromatografia Il termine cromatografia racchiude una serie di metodi analitici impiegati per separare e quantificare singolarmente i diversi componenti presenti in miscele di analiti anche molto complesse.
CORSO ANALISI CHIMICA Cromatografia: parametri U.D.2 ITIS VIOLA A.S. 2016/2017 CROMATOGRAFIA. PARTE GENERALE: parametri
 CROMATOGRAFIA PARTE GENERALE: parametri Schema Dalla combinazione dei meccanismi e dei supporti, si possono avere numerose varianti di tecniche cromatografiche 2 RIPASSO 1. Descrivi cosa si intente per
CROMATOGRAFIA PARTE GENERALE: parametri Schema Dalla combinazione dei meccanismi e dei supporti, si possono avere numerose varianti di tecniche cromatografiche 2 RIPASSO 1. Descrivi cosa si intente per
TIPI di CROMATOGRAFIA
 Metodo di separazione che si basa sulla distribuzione degli analiti tra una fase mobile e una fase stazionaria. TIPI di CROMATOGRAFIA Eluizione degli analiti può avvenire: Capillarità Gravità Pressione
Metodo di separazione che si basa sulla distribuzione degli analiti tra una fase mobile e una fase stazionaria. TIPI di CROMATOGRAFIA Eluizione degli analiti può avvenire: Capillarità Gravità Pressione
2 ZEPPA G. BELVISO S.
 Appunti di Tecniche avanzate per il controllo degli alimenti Parte 2 ZEPPA G. BELVISO S. Università degli Studi di Torino Il termine cromatografia indica un insieme di tecniche che hanno lo scopo di separare
Appunti di Tecniche avanzate per il controllo degli alimenti Parte 2 ZEPPA G. BELVISO S. Università degli Studi di Torino Il termine cromatografia indica un insieme di tecniche che hanno lo scopo di separare
ISIS A PONTI Gallarate
 4 A TCB 1 IL CROMATOGRAMMA: E il tracciato che descrive l andamento del segnale del rivelatore in funzione del tempo o del volume di eluente a partire dall istante in cui la miscela viene introdotta nella
4 A TCB 1 IL CROMATOGRAMMA: E il tracciato che descrive l andamento del segnale del rivelatore in funzione del tempo o del volume di eluente a partire dall istante in cui la miscela viene introdotta nella
Università degli Studi di Urbino
 Università degli Studi di Urbino Facoltà di Scienze e Tecnologie Effetto della temperatura nella preparazione e nell'uso di nano-colonne HPLC di Fabiana Capriotti Relatore: Achille Cappiello A. A. 2008-09
Università degli Studi di Urbino Facoltà di Scienze e Tecnologie Effetto della temperatura nella preparazione e nell'uso di nano-colonne HPLC di Fabiana Capriotti Relatore: Achille Cappiello A. A. 2008-09
GASCROMATOGRAFIA (UNA TECNICA DI SEPARAZIONE)
 GASCROMATOGRAFIA (UNA TECNICA DI SEPARAZIONE) Cromatografo Registratore Cromatogramma GC 1 14/15 1 COLONNE GC (IMPACCATE) Fase Mobile (Gas di trasporto) Supporto Solido Fase Stazionaria Liquida GC 1 14/15
GASCROMATOGRAFIA (UNA TECNICA DI SEPARAZIONE) Cromatografo Registratore Cromatogramma GC 1 14/15 1 COLONNE GC (IMPACCATE) Fase Mobile (Gas di trasporto) Supporto Solido Fase Stazionaria Liquida GC 1 14/15
Abbiamo visto che per efficienza di una colonna si intende la sua capacità di mantenere compatti i picchi lungo il percorso e quindi all uscita.
 Cromatografia 4 1 Abbiamo visto che per efficienza di una colonna si intende la sua capacità di mantenere compatti i picchi lungo il percorso e quindi all uscita. Tale grandezza, in omaggio al parallelismo
Cromatografia 4 1 Abbiamo visto che per efficienza di una colonna si intende la sua capacità di mantenere compatti i picchi lungo il percorso e quindi all uscita. Tale grandezza, in omaggio al parallelismo
GASCROMATOGRAFIA INTRODUZIONE
 GASCROMATOGRAFIA INTRODUZIONE La Gascromatografia è una tecnica analitica utile per separare componenti o soluti di una miscela, sulla base delle quantità relative di ogni soluto, distribuite fra un carrier
GASCROMATOGRAFIA INTRODUZIONE La Gascromatografia è una tecnica analitica utile per separare componenti o soluti di una miscela, sulla base delle quantità relative di ogni soluto, distribuite fra un carrier
TERMODINAMICA. t R = t M + t R. t R = t M (1 +k) t R = t M (1 +K c /β) GC 3 14/15 1
 TERMODINAMICA t R = t M + t R t R = t M (1 +k) t R = t M (1 +K c /β) GC 3 14/15 1 t O ALLARGAMENTO DELLA BANDA (H) t 1 t Iniziale A metà Alla fine GC 3 14/15 HETP Colonne Impaccate (VanDeemter - 1956):
TERMODINAMICA t R = t M + t R t R = t M (1 +k) t R = t M (1 +K c /β) GC 3 14/15 1 t O ALLARGAMENTO DELLA BANDA (H) t 1 t Iniziale A metà Alla fine GC 3 14/15 HETP Colonne Impaccate (VanDeemter - 1956):
Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta)
 Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta) E il termine generico che indica una serie di tecniche di separazione di molecole simili in
Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta) E il termine generico che indica una serie di tecniche di separazione di molecole simili in
fase stazionaria fase mobile
 Cromatografia Insieme di tecniche che hanno lo scopo di separare una miscela nei suoi componenti, per permetterne il riconoscimento qualitativo e quantitativo. Sono basate sulla distribuzione dei vari
Cromatografia Insieme di tecniche che hanno lo scopo di separare una miscela nei suoi componenti, per permetterne il riconoscimento qualitativo e quantitativo. Sono basate sulla distribuzione dei vari
Introduzione all analisi cromatografica
 Introduzione all analisi cromatografica La cromatografia La cromatografia è un metodo analitico largamente utilizzato per la separazione, l identificazione e la determinazione quantitativa dei componenti
Introduzione all analisi cromatografica La cromatografia La cromatografia è un metodo analitico largamente utilizzato per la separazione, l identificazione e la determinazione quantitativa dei componenti
IL CROMATOGRAMMA. I parametri fondamentali del cromatogramma. Costante di distribuzione o coefficiente di distribuzione
 IL CROMATOGRAMMA Tutte le tecniche cromatografiche, ad eccezione della cromatografia su colonna a bassa pressione e della TLC, si concludono con la registrazione di un cromatogramma, cioè di un tracciato
IL CROMATOGRAMMA Tutte le tecniche cromatografiche, ad eccezione della cromatografia su colonna a bassa pressione e della TLC, si concludono con la registrazione di un cromatogramma, cioè di un tracciato
SERATE CHIMICHE - Cromatografia - Chimica Analitica
 SERATE CHIMICHE - Cromatografia - Chimica Analitica CROMATOGRAFIA Introduzione e accenni Storici La cromatografia è una tecnica di separazione, che permette di dividere i vari componenti di una miscela
SERATE CHIMICHE - Cromatografia - Chimica Analitica CROMATOGRAFIA Introduzione e accenni Storici La cromatografia è una tecnica di separazione, che permette di dividere i vari componenti di una miscela
cromatografia Esplorando le proteine
 Cromatografia Flavia Frabetti Tecnici di laboratorio 2010/2011 Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per
Cromatografia Flavia Frabetti Tecnici di laboratorio 2010/2011 Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per
Esercitazione 4: determinazione della concentrazione di sodio e potassio nelle urine mediante spettroscopia di emissione in fiamma
 Esercitazione 4: determinazione della concentrazione di sodio e potassio nelle urine mediante spettroscopia di emissione in fiamma Apparato strumentale Sodio e potassio vengono determinati in campioni
Esercitazione 4: determinazione della concentrazione di sodio e potassio nelle urine mediante spettroscopia di emissione in fiamma Apparato strumentale Sodio e potassio vengono determinati in campioni
TECNICHE CROMATOGRAFICHE
 TECNICHE CROMATOGRAFICHE Le tecniche cromatografiche permettono di separare gli analiti presenti in una miscela complessa. Tutti i sistemi cromatografici sono costituiti da una fase stazionaria, che puo
TECNICHE CROMATOGRAFICHE Le tecniche cromatografiche permettono di separare gli analiti presenti in una miscela complessa. Tutti i sistemi cromatografici sono costituiti da una fase stazionaria, che puo
CROMATOGRAFIA. Egli intuì che la separazione era dovuta alla differente AFFINITÀ che i vari pigmenti avevano per la polvere calcarea
 Il termine CROMATOGRAFIA indica una serie di metodi analitici in grado di: ² SEPARARE, ² RICONOSCERE QUALITATIVAMENTE, ² QUANTIFICARE SINGOLARMENTE una miscela, anche molto complessa, nei suoi componenti
Il termine CROMATOGRAFIA indica una serie di metodi analitici in grado di: ² SEPARARE, ² RICONOSCERE QUALITATIVAMENTE, ² QUANTIFICARE SINGOLARMENTE una miscela, anche molto complessa, nei suoi componenti
CROMATOGRAFIA DOTT. JOANNA IZABELA LACHOWICZ
 CROMATOGRAFIA DOTT. JOANNA IZABELA LACHOWICZ Soltanto 23% delle sostanze possono essere separate nella GC Usando liquidi possiamo aumentare uso della cromatografia TIPI DI CROMATOGRAFIA RIPARTIZIONE
CROMATOGRAFIA DOTT. JOANNA IZABELA LACHOWICZ Soltanto 23% delle sostanze possono essere separate nella GC Usando liquidi possiamo aumentare uso della cromatografia TIPI DI CROMATOGRAFIA RIPARTIZIONE
Chimica Analitica Docente di riferimento Prof. DANILO SCIARRONE.
 Docente di riferimento Prof. DANILO SCIARRONE http://www.sepsci.unime.it dsciarrone@unime.it INTRODUZIONE Obiettivi formativi Il corso di fornisce allo Studente le nozioni fondamentali di chimica analitica
Docente di riferimento Prof. DANILO SCIARRONE http://www.sepsci.unime.it dsciarrone@unime.it INTRODUZIONE Obiettivi formativi Il corso di fornisce allo Studente le nozioni fondamentali di chimica analitica
CROMATOGRAFIA. Definizioni
 CROMATOGRAFIA Definizioni La cromatografia è una tecnica che permette di separare ed analizzare (sia per scopi qualitativi che quantitativi) miscele incognite liquide o gassose. Tutte le tecniche cromatografiche
CROMATOGRAFIA Definizioni La cromatografia è una tecnica che permette di separare ed analizzare (sia per scopi qualitativi che quantitativi) miscele incognite liquide o gassose. Tutte le tecniche cromatografiche
Legge di stato dei gas ideali
 Legge di stato dei gas ideali Le leggi di Boyle e Charles/Gay Lussac possono essere riunite, insieme al principio di Avogadro, in un'unica equazione che correla fra loro P, V, T e numero di moli di un
Legge di stato dei gas ideali Le leggi di Boyle e Charles/Gay Lussac possono essere riunite, insieme al principio di Avogadro, in un'unica equazione che correla fra loro P, V, T e numero di moli di un
Distribuzione di densità
 Distribuzione di densità Distribuzione di densità in presenza di forze conservative. A F dx A La forza conservativa esterna agisce su ciascuno degli N componenti del gas all interno del volume Adx. La
Distribuzione di densità Distribuzione di densità in presenza di forze conservative. A F dx A La forza conservativa esterna agisce su ciascuno degli N componenti del gas all interno del volume Adx. La
Un modello per il gas ideale
 Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
TIPI DI CROMATOGRAFIE
 Corso di Chimica Analitica TIPI DI CROMATOGRAFIE Prof. Paola Gramatica Fasi in successione: 2) Separazione dei componenti la miscela Dopo l isolamento della miscela da analizzare, se ne devono separare
Corso di Chimica Analitica TIPI DI CROMATOGRAFIE Prof. Paola Gramatica Fasi in successione: 2) Separazione dei componenti la miscela Dopo l isolamento della miscela da analizzare, se ne devono separare
Gas-cromatografia. onna.
 Gas-cromatografia La fase mobile è un gas. Le sostanze da separare (liquidi, solidi, gas) devono essere portate ad una temperatura sufficiente a renderle gassose o comunque portarle allo stato di vapore.
Gas-cromatografia La fase mobile è un gas. Le sostanze da separare (liquidi, solidi, gas) devono essere portate ad una temperatura sufficiente a renderle gassose o comunque portarle allo stato di vapore.
Stati di aggregazione della materia. dal microscopico al macroscopico: struttura. interazioni GASSOSO. proprietà SOLIDO LIQUIDO
 Stati di aggregazione della materia GASSOSO dal microscopico al macroscopico: struttura interazioni proprietà SOLIDO LIQUIDO Lo stato gassoso È uno dei tre stati di aggregazione della materia, caratterizzato
Stati di aggregazione della materia GASSOSO dal microscopico al macroscopico: struttura interazioni proprietà SOLIDO LIQUIDO Lo stato gassoso È uno dei tre stati di aggregazione della materia, caratterizzato
Lo stato gassoso. L atmosfera terrestre è il sistema gassoso in cui siamo immersi
 Lo stato gassoso L atmosfera terrestre è il sistema gassoso in cui siamo immersi I gas sono comprimibili (ampi spazi vuoti tra le particelle?) I gas si espandono facilmente riempiendo rapidamente lo spazio
Lo stato gassoso L atmosfera terrestre è il sistema gassoso in cui siamo immersi I gas sono comprimibili (ampi spazi vuoti tra le particelle?) I gas si espandono facilmente riempiendo rapidamente lo spazio
ESTRAZIONE PURIFICAZIONE. Modificazione chimica ANALISI STRUMENTALE
 Procedura per l analisi quali/quantitativa. Analita puro Composto di riferimento Curva di calibrazione Singolo-Più punti Campione biologico ESTRAZIONE PURIFICAZIONE Modificazione chimica ANALISI STRUMENTALE
Procedura per l analisi quali/quantitativa. Analita puro Composto di riferimento Curva di calibrazione Singolo-Più punti Campione biologico ESTRAZIONE PURIFICAZIONE Modificazione chimica ANALISI STRUMENTALE
Cenni sulle proprietà elastiche dei solidi
 Cenni sulle proprietà elastiche dei solidi La nozione di corpo rigido deriva dal fatto che i corpi solidi sono caratterizzati dall avere una forma ed un volume non facilmente modificabili. Nella realtà
Cenni sulle proprietà elastiche dei solidi La nozione di corpo rigido deriva dal fatto che i corpi solidi sono caratterizzati dall avere una forma ed un volume non facilmente modificabili. Nella realtà
Cromatografia di scambio ionico su colonna
 S.A.G.T. Anno Accademico 2009/2010 Laboratorio Ambientale II A Dottoressa Valentina Gianotti Marco Soda Matricola num. 10015062 Cromatografia di scambio ionico su colonna La cromatografia è un metodo di
S.A.G.T. Anno Accademico 2009/2010 Laboratorio Ambientale II A Dottoressa Valentina Gianotti Marco Soda Matricola num. 10015062 Cromatografia di scambio ionico su colonna La cromatografia è un metodo di
Leggi dei gas Equazione di stato dei gas perfetti
 Le leggi dei gas Quale descrizione fisico-matematica si può usare per i diversi stati di aggregazione della materia? Essa è tanto più semplice (equazioni) quanto meno interagenti sono fra loro le particelle
Le leggi dei gas Quale descrizione fisico-matematica si può usare per i diversi stati di aggregazione della materia? Essa è tanto più semplice (equazioni) quanto meno interagenti sono fra loro le particelle
con C A concentrazione del gas disciolto La PA è quindi funzione lineare della concentrazione. La pressione parziale è: P A = Y * Ptot.
 ASSORBIMENTO E una operazione unitaria la cui finalità è l eliminazione di un soluto volatile contenuto in una miscela gassosa. Il solvente liquido scende dall alto mentre la miscela gassosa entra dal
ASSORBIMENTO E una operazione unitaria la cui finalità è l eliminazione di un soluto volatile contenuto in una miscela gassosa. Il solvente liquido scende dall alto mentre la miscela gassosa entra dal
La termochimica. Energia in movimento
 La termochimica Energia in movimento Sistema termodinamico La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in
La termochimica Energia in movimento Sistema termodinamico La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in
Sostanze non volatili possono essere derivatizzate
 Gascromatografia Permette la separazione di sostanze gassose o gassificabili variando la temperatura. Sono sostanze a basso peso molecolare, di natura poco polare, assolutamente non ionica. Eventualmente
Gascromatografia Permette la separazione di sostanze gassose o gassificabili variando la temperatura. Sono sostanze a basso peso molecolare, di natura poco polare, assolutamente non ionica. Eventualmente
CANALE STAZIONARIO CANALE TEMPO INVARIANTE
 CANALE STAZIONARIO Si parla di un Canale Stazionario quando i fenomeni che avvengono possono essere modellati da processi casuali e le proprietà statistiche di tali processi sono indipendenti dal tempo.
CANALE STAZIONARIO Si parla di un Canale Stazionario quando i fenomeni che avvengono possono essere modellati da processi casuali e le proprietà statistiche di tali processi sono indipendenti dal tempo.
Università di Roma Tor Vergata
 Università di Roma Tor Vergata Facoltà di Ingegneria Dipartimento di Ingegneria Industriale Corso di: TERMOTECNICA TRASMISSIONE DEL CALORE: RESISTENZA DI CONTATTO Ing. G. Bovesecchi gianluigi.bovesecchi@gmail.com
Università di Roma Tor Vergata Facoltà di Ingegneria Dipartimento di Ingegneria Industriale Corso di: TERMOTECNICA TRASMISSIONE DEL CALORE: RESISTENZA DI CONTATTO Ing. G. Bovesecchi gianluigi.bovesecchi@gmail.com
La frazione lipidica TRIGLICERIDI
 Dott. Raffaele Marrone raffaele.marrone@unina.it La frazione lipidica TRIGLICERIDI 1 TRANSESTERIFICAZIONE reazione di sostituzione nucleofila GAS CROMATOGRAFIA La tecnica cromatografica consiste nello
Dott. Raffaele Marrone raffaele.marrone@unina.it La frazione lipidica TRIGLICERIDI 1 TRANSESTERIFICAZIONE reazione di sostituzione nucleofila GAS CROMATOGRAFIA La tecnica cromatografica consiste nello
Introduzione alla Chimica Analitica
 Corso di Chimica Ambientale Introduzione alla Chimica Analitica Prof. Paola Gramatica http://dipbsf.uninsubria.it/qsar dipbsf.uninsubria.it/qsar/ Education paola.gramatica @ uninsubria.it Prof. Paola Gramatica
Corso di Chimica Ambientale Introduzione alla Chimica Analitica Prof. Paola Gramatica http://dipbsf.uninsubria.it/qsar dipbsf.uninsubria.it/qsar/ Education paola.gramatica @ uninsubria.it Prof. Paola Gramatica
CROMATOGRAFIA IONICA (IC)
 CROMATOGRAFIA IONICA (IC) CROMATOGRAFIA CROMATOGRAFIA IONICA RESINE A SCAMBIO IONICO Struttura Meccanismo di scambio STRUMENTAZIONE IC SOPPRESSORE A MEMBRANA PROTOCOLLO DI ANALISI CROMATOGRAFIA Analisi
CROMATOGRAFIA IONICA (IC) CROMATOGRAFIA CROMATOGRAFIA IONICA RESINE A SCAMBIO IONICO Struttura Meccanismo di scambio STRUMENTAZIONE IC SOPPRESSORE A MEMBRANA PROTOCOLLO DI ANALISI CROMATOGRAFIA Analisi
Lo stato gassoso. Particelle con volume proprio trascurabile puntiformi
 Lo stato gassoso Gas ideale (o perfetto) Particelle in movimento (casuale) Particelle con volume proprio trascurabile puntiformi Assenza di interazioni tra le particelle trasformazioni fisiche e non chimiche
Lo stato gassoso Gas ideale (o perfetto) Particelle in movimento (casuale) Particelle con volume proprio trascurabile puntiformi Assenza di interazioni tra le particelle trasformazioni fisiche e non chimiche
CINETICA CHIMICA E CATALISI
 CINETICA CHIMICA E CATALISI A (g) + B (g) AB (g) Reazione omogenea, irreversibile a T cost VELOCITA di REAZIONE : variazione, nell unità di tempo, della concentrazione delle sostanze reagenti A e B Tale
CINETICA CHIMICA E CATALISI A (g) + B (g) AB (g) Reazione omogenea, irreversibile a T cost VELOCITA di REAZIONE : variazione, nell unità di tempo, della concentrazione delle sostanze reagenti A e B Tale
1 INTRODUZIONE 1.1 La cromatografia [1]
![1 INTRODUZIONE 1.1 La cromatografia [1] 1 INTRODUZIONE 1.1 La cromatografia [1]](/thumbs/63/48965705.jpg) 1 INTRODUZIONE 1.1 La cromatografia [1] Con il termine cromatografia s intende un processo chimico-fisico che permette di separare le molecole di una miscela. Il principio base della cromatografia è l'equilibrio
1 INTRODUZIONE 1.1 La cromatografia [1] Con il termine cromatografia s intende un processo chimico-fisico che permette di separare le molecole di una miscela. Il principio base della cromatografia è l'equilibrio
1. I fluidi e le loro caratteristiche. 2. La pressione in un fluido.
 UNITÀ 8 LA MECCANICA DEI FLUIDI 1. I fluidi e le loro caratteristiche. 2. La pressione in un fluido. 3. La pressione atmosferica. 4. La legge di Stevino. 5. La legge di Pascal. 6. La forza di Archimede.
UNITÀ 8 LA MECCANICA DEI FLUIDI 1. I fluidi e le loro caratteristiche. 2. La pressione in un fluido. 3. La pressione atmosferica. 4. La legge di Stevino. 5. La legge di Pascal. 6. La forza di Archimede.
Le reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Le reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO VIDEO Introduzione (I) La cinetica chimica è la branca della chimica che si interessa della velocità delle reazioni chimiche, cioè la variazione
Le reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO VIDEO Introduzione (I) La cinetica chimica è la branca della chimica che si interessa della velocità delle reazioni chimiche, cioè la variazione
Diagramma di stato di H 2 O
 Lezione 13 1. Pressione e temperatura 2. Leggi dei gas 3. Teoria cinetica ei gas 4. Gas ideali e gas reali 5. Miscele gassose: legge di Dalton 6. Frazioni molari Diagramma di stato di H 2 O Diagrammi di
Lezione 13 1. Pressione e temperatura 2. Leggi dei gas 3. Teoria cinetica ei gas 4. Gas ideali e gas reali 5. Miscele gassose: legge di Dalton 6. Frazioni molari Diagramma di stato di H 2 O Diagrammi di
La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione.
 Tecniche di analisi chimica Prof. Marcello Romagnoli Titolazione La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione. Una quantità nota del
Tecniche di analisi chimica Prof. Marcello Romagnoli Titolazione La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione. Una quantità nota del
Teorie per il calcolo dei coefficienti di trasporto di materia (interfaccia fluido-fluido) Fenomeni di Trasporto
 Teorie per il calcolo dei coefficienti di trasporto di materia (interfaccia fluido-fluido) Fenomeni di Trasporto 1 Teoria del film (Lewis, 1924) Si assume che il trasporto di materia avvenga in uno strato
Teorie per il calcolo dei coefficienti di trasporto di materia (interfaccia fluido-fluido) Fenomeni di Trasporto 1 Teoria del film (Lewis, 1924) Si assume che il trasporto di materia avvenga in uno strato
Lo stato gassoso e le sue proprietà
 Lo stato gassoso e le sue proprietà Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1
Lo stato gassoso e le sue proprietà Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1
GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato gassoso
 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
La corrente di un fluido
 La corrente di un fluido 0 La corrente di un fluido è il movimento ordinato di un liquido o di un gas. 0 La portata q è il rapporto tra il volume di fluido V che attraversa una sezione in un tempo t ed
La corrente di un fluido 0 La corrente di un fluido è il movimento ordinato di un liquido o di un gas. 0 La portata q è il rapporto tra il volume di fluido V che attraversa una sezione in un tempo t ed
CROMATOGRAFIA E SPETTROMETRIA DI MASSA DI COMPOSTI ORGANICI
 DIPARTIMENTO DI SCIENZE CHIMICHE Corso di laurea magistrale in Chimica organica e bioorganica Anno accademico 2017/2018-1 anno CROMATOGRAFIA E SPETTROMETRIA DI MASSA DI COMPOSTI ORGANICI CHIM/06-6 CFU
DIPARTIMENTO DI SCIENZE CHIMICHE Corso di laurea magistrale in Chimica organica e bioorganica Anno accademico 2017/2018-1 anno CROMATOGRAFIA E SPETTROMETRIA DI MASSA DI COMPOSTI ORGANICI CHIM/06-6 CFU
!"#$%&'"($%)*+%(,-#$*+*%(+"..*%/0".1&"%/"##*%',#&2$,3$%,+-"3$.4*
 !"#$%&'"($%)*+%(,-#$*+*%(+"..*%/0".1&"%/"##*%',#&2$,3$%,+-"3$.4* Filtrazione nel pallone ed evaporazione del solvente tramite rotavapor Cromatografia 5%6*(,/$%.+,6"(,-+"7$.$%8*3-,3,%&($#$22"($%)*+%#"%'*)"+"2$,3*%*%)&+$7$."2$,3*%/*$%.,6),'($%,+-"3$.$%9"'"3/,'$%'&##"%/$'(+$9&2$,3*%'*#*(($8"%/$%&3"%,%)$:%','("32*%(+"%/&*%7"'$;!Fase
!"#$%&'"($%)*+%(,-#$*+*%(+"..*%/0".1&"%/"##*%',#&2$,3$%,+-"3$.4* Filtrazione nel pallone ed evaporazione del solvente tramite rotavapor Cromatografia 5%6*(,/$%.+,6"(,-+"7$.$%8*3-,3,%&($#$22"($%)*+%#"%'*)"+"2$,3*%*%)&+$7$."2$,3*%/*$%.,6),'($%,+-"3$.$%9"'"3/,'$%'&##"%/$'(+$9&2$,3*%'*#*(($8"%/$%&3"%,%)$:%','("32*%(+"%/&*%7"'$;!Fase
BIOFISICA DELLE MEMBRANE
 BIOFISICA DELLE MEMBRANE Le funzioni biologiche di tutti gli organismi viventi si svolgono mediante scambio di sostanze ed informazioni attraverso membrane. Membrana = struttura che separa due mezzi diversi
BIOFISICA DELLE MEMBRANE Le funzioni biologiche di tutti gli organismi viventi si svolgono mediante scambio di sostanze ed informazioni attraverso membrane. Membrana = struttura che separa due mezzi diversi
1.Pressione di un Gas
 1.Pressione di un Gas Un gas è formato da molecole che si muovono in modo disordinato, urtandosi fra loro e urtando contro le pareti del recipiente che le contiene. Durante gli urti, le molecole esercitano
1.Pressione di un Gas Un gas è formato da molecole che si muovono in modo disordinato, urtandosi fra loro e urtando contro le pareti del recipiente che le contiene. Durante gli urti, le molecole esercitano
GAS IDEALI (o gas perfetti )
 GAS IDEALI (o gas perfetti ) TEORIA CINETICA DEI GAS (modello di gas ideale ) molecole puntiformi moto rettilineo ed urti elastici forze attrattive - repulsive intermolecolari nulle PARAMETRI DELLO STATO
GAS IDEALI (o gas perfetti ) TEORIA CINETICA DEI GAS (modello di gas ideale ) molecole puntiformi moto rettilineo ed urti elastici forze attrattive - repulsive intermolecolari nulle PARAMETRI DELLO STATO
Il processo di macinazione spesso serve anche per la miscelazione.
 La macinazione rappresenta una fase fondamentale e molto onerosa nella produzione ceramica. Può essere condotta attraverso diversi processi: 1) Mulino a rulli (in acciaio alto-legato o con rivestimento
La macinazione rappresenta una fase fondamentale e molto onerosa nella produzione ceramica. Può essere condotta attraverso diversi processi: 1) Mulino a rulli (in acciaio alto-legato o con rivestimento
SCHEMA DI UN GASCROMATOGRAFO
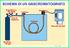 SCHEMA DI UN GASCROMATOGRAFO Regolatore a due Stadi Iniettore Rivelatore Gas di Trasporto Colonna Raccolta dei Dati Bombola del gas GC 2 14/15 1 REQUISITI DEL GAS DI TRASPORTO Filtro molecolare di 5 Angstrom
SCHEMA DI UN GASCROMATOGRAFO Regolatore a due Stadi Iniettore Rivelatore Gas di Trasporto Colonna Raccolta dei Dati Bombola del gas GC 2 14/15 1 REQUISITI DEL GAS DI TRASPORTO Filtro molecolare di 5 Angstrom
Calcolo di Integrali
 Calcolo di Integrali 28 aprile 2013 Indice 1 Teoria cinetica dei gas: la distribuzione delle velocità di Maxwell 2 2 Lavoro associato a una trasformazione isoterma 4 1 1 Teoria cinetica dei gas: la distribuzione
Calcolo di Integrali 28 aprile 2013 Indice 1 Teoria cinetica dei gas: la distribuzione delle velocità di Maxwell 2 2 Lavoro associato a una trasformazione isoterma 4 1 1 Teoria cinetica dei gas: la distribuzione
Dipartimento di Scienze Chimiche. Ambiente. Sistema
 Descrizione macroscopica dei sistemi materiali Sistema: materia compresa entro una superficie chiusa (ad esempio la superficie interna di un contenitore, ma può essere anche una superficie matematica,
Descrizione macroscopica dei sistemi materiali Sistema: materia compresa entro una superficie chiusa (ad esempio la superficie interna di un contenitore, ma può essere anche una superficie matematica,
IL PROBLEMA ANALITICO
 IL PROBLEMA ANALITICO COSA CERCARE? COME TROVARLO? 1. TRATTAMENTO CAMPIONE 2. ESTRAZIONE 3. PURIFICAZIONE 4. DETERMINAZIONE QUALI-QUANTITATIVA STORIA Cromatografia = colore + grafia 1906 Michael Tswett,
IL PROBLEMA ANALITICO COSA CERCARE? COME TROVARLO? 1. TRATTAMENTO CAMPIONE 2. ESTRAZIONE 3. PURIFICAZIONE 4. DETERMINAZIONE QUALI-QUANTITATIVA STORIA Cromatografia = colore + grafia 1906 Michael Tswett,
Seminario di Cacciatore Rosalia
 Un organismo vivente è un sistema chimico complesso nel quale la materia organica viene sintetizzata, riprodotta, trasformata e decomposta in un incessante ed intenso susseguirsi di reazioni e processi
Un organismo vivente è un sistema chimico complesso nel quale la materia organica viene sintetizzata, riprodotta, trasformata e decomposta in un incessante ed intenso susseguirsi di reazioni e processi
delle curve isoterme dell anidride carbonica
 COMPORTAMENTO DEI GAS REALI l andamento delle curve isoterme dell anidride carbonica mostra che: a temperature elevate le isoterme assomigliano a quelle di un gas perfetto Diagramma di Andrews a temperature
COMPORTAMENTO DEI GAS REALI l andamento delle curve isoterme dell anidride carbonica mostra che: a temperature elevate le isoterme assomigliano a quelle di un gas perfetto Diagramma di Andrews a temperature
La cinetica chimica studia la velocità con cui avviene una reazione chimica. dc dt. dn dt. per reazioni che avvengono a V costante
 Cinetica chimica La cinetica chimica studia la velocità con cui avviene una reazione chimica. a A + b B + l L + m M +... Velocità di reazione rispetto al componente i-esimo: v 1 = ± V dn dt (+) velocità
Cinetica chimica La cinetica chimica studia la velocità con cui avviene una reazione chimica. a A + b B + l L + m M +... Velocità di reazione rispetto al componente i-esimo: v 1 = ± V dn dt (+) velocità
[ C] [ D] EQUILIBRIO CHIMICO e ATTIVITA. Per una reazione generica aa + bb = cc + dd si ha:
![[ C] [ D] EQUILIBRIO CHIMICO e ATTIVITA. Per una reazione generica aa + bb = cc + dd si ha: [ C] [ D] EQUILIBRIO CHIMICO e ATTIVITA. Per una reazione generica aa + bb = cc + dd si ha:](/thumbs/88/115616770.jpg) 1 EQUILIBRIO CHIMICO e ATTIVITA Per una reazione generica aa + bb = cc + dd si ha: c ac Keq T = a aa a a d D b B c d [ C] [ D] [ A] a [ B] b K eq st = Nel caso di prodotti gassosi, si usa la pressione
1 EQUILIBRIO CHIMICO e ATTIVITA Per una reazione generica aa + bb = cc + dd si ha: c ac Keq T = a aa a a d D b B c d [ C] [ D] [ A] a [ B] b K eq st = Nel caso di prodotti gassosi, si usa la pressione
Serve per raccogliere solidi (in genere prodotti) dai liquidi dopo precipitazione o ricristallizzazione.
 FILTRAZINE Sotto vuoto Serve per raccogliere solidi (in genere prodotti) dai liquidi dopo precipitazione o ricristallizzazione. Materiale occorrente: beuta da vuoto, imbuto buchner, filtro di carta, adattatore
FILTRAZINE Sotto vuoto Serve per raccogliere solidi (in genere prodotti) dai liquidi dopo precipitazione o ricristallizzazione. Materiale occorrente: beuta da vuoto, imbuto buchner, filtro di carta, adattatore
Calorimetria. Principio zero Trasformazioni termodinamiche Lavoro termodinamico
 Calorimetria Principio zero Trasformazioni termodinamiche Lavoro termodinamico Stato di un sistema In Meccanica: lo stato di una particella è definito quando per ogni istante siano note, la posizione (x,
Calorimetria Principio zero Trasformazioni termodinamiche Lavoro termodinamico Stato di un sistema In Meccanica: lo stato di una particella è definito quando per ogni istante siano note, la posizione (x,
Stati della materia. Esempio. Fusione e solidificazione. Esempio. Stati di aggregazione della materia
 Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
ESERCIZI ESERCIZI. 3) Data la reazione chimica: H 2
 ESERCIZI 1) La velocità di una reazione chimica dipende: a. solo dalla temperatura b. solo dalla pressione c. dal fatto che la reazione sia eso- o endotermica d. dalla temperatura, dalle concentrazioni
ESERCIZI 1) La velocità di una reazione chimica dipende: a. solo dalla temperatura b. solo dalla pressione c. dal fatto che la reazione sia eso- o endotermica d. dalla temperatura, dalle concentrazioni
LEGGI DEI GAS. Gas sono sostanze sprovviste di forma e volume proprio
 LEGGI DEI GAS Gas sono sostanze sprovviste di forma e volume proprio Una grandezza molto significativa per descrivere un gas è la pressione, conseguenza delle collisioni del gas sulla superficie del contenitore.
LEGGI DEI GAS Gas sono sostanze sprovviste di forma e volume proprio Una grandezza molto significativa per descrivere un gas è la pressione, conseguenza delle collisioni del gas sulla superficie del contenitore.
L equilibrio dei gas. Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura
 Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
L equilibrio dei gas
 L equilibrio dei gas Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura 1 L equilibrio dei gas Un gas esercita una pressione sul recipiente che
L equilibrio dei gas Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura 1 L equilibrio dei gas Un gas esercita una pressione sul recipiente che
TERMODINAMICA. Il sistema è il corpo o l insieme dei corpi sotto esame.
 TERMODINAMICA SISTEMI TERMODINAMICI Il sistema è il corpo o l insieme dei corpi sotto esame. L ambiente esterno è l insieme di tutti i corpi che possono interagire con il sistema. Tipi di sistemi termodinamici
TERMODINAMICA SISTEMI TERMODINAMICI Il sistema è il corpo o l insieme dei corpi sotto esame. L ambiente esterno è l insieme di tutti i corpi che possono interagire con il sistema. Tipi di sistemi termodinamici
Lo stato gassoso gas. Caratteristiche dello stato gassoso. liquido. solido. assenza di volume proprio forma fluida
 Lo stato gassoso gas liquido solido assenza di volume proprio forma fluida Caratteristiche dello stato gassoso Capacità di occupare tutto lo spazio a disposizione Distanze molto grandi tra le particelle
Lo stato gassoso gas liquido solido assenza di volume proprio forma fluida Caratteristiche dello stato gassoso Capacità di occupare tutto lo spazio a disposizione Distanze molto grandi tra le particelle
Statica ed equilibrio dei corpi
 Statica ed equilibrio dei corpi Avendo stabilito le leggi che regolano il moto dei corpi è possibile dedurre le leggi che regolano il loro equilibrio in condizioni statiche, cioè in assenza di movimento.
Statica ed equilibrio dei corpi Avendo stabilito le leggi che regolano il moto dei corpi è possibile dedurre le leggi che regolano il loro equilibrio in condizioni statiche, cioè in assenza di movimento.
SPETTROSCOPIA UV-VIS LEZIONE 9
 SPETTROSCOPIA UV-VIS LEZIONE 9 RADIAZIONE ELETTROMAGNETICA La radiazione elettromagnetica è la propagazione nello spazio e nel tempo dell energia elettromagnetica tramite onde e corpuscoli. natura ondulatoria:
SPETTROSCOPIA UV-VIS LEZIONE 9 RADIAZIONE ELETTROMAGNETICA La radiazione elettromagnetica è la propagazione nello spazio e nel tempo dell energia elettromagnetica tramite onde e corpuscoli. natura ondulatoria:
Fisica per scienze ed ingegneria
 Serway, Jewett Fisica per scienze ed ingegneria Capitolo 19 Temperatura e principio zero della termodinamica I nostri sensi non sono affidabili per definire lo stato termico dei corpi. Ocorre un metodo
Serway, Jewett Fisica per scienze ed ingegneria Capitolo 19 Temperatura e principio zero della termodinamica I nostri sensi non sono affidabili per definire lo stato termico dei corpi. Ocorre un metodo
Lo stato liquido. i liquidi molecolari con legami a idrogeno: le interazioni tra le molecole si stabiliscono soprattutto attraverso legami a idrogeno
 Lo stato liquido Le particelle sono in continuo movimento, anche se questo risulta più limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle particelle è chiamato moto Browniano.
Lo stato liquido Le particelle sono in continuo movimento, anche se questo risulta più limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle particelle è chiamato moto Browniano.
Polveri: PROPRIETÀ DERIVATE
 Polveri: PROPRIETÀ DERIVATE DENSITÀ VERA = g di polvere/volume Vero DENSITÀ AL VERSAMENTO (APPARENTE) DENSITÀ ALLO SCUOTIMENTO (IMPACCATA) Densità da compattazione: PIGIATORE VOLUMETRICO Densità da compattazione:
Polveri: PROPRIETÀ DERIVATE DENSITÀ VERA = g di polvere/volume Vero DENSITÀ AL VERSAMENTO (APPARENTE) DENSITÀ ALLO SCUOTIMENTO (IMPACCATA) Densità da compattazione: PIGIATORE VOLUMETRICO Densità da compattazione:
Diffusione e osmosi. Roberto Cirio. Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico Corso di Fisica
 Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato liquido
 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato liquido Lo stato liquido Liquidi: energia dei moti termici confrontabile con quella delle forze coesive. Limitata libertà di movimento delle molecole, che
GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato liquido Lo stato liquido Liquidi: energia dei moti termici confrontabile con quella delle forze coesive. Limitata libertà di movimento delle molecole, che
REGISTRO DELLE LEZIONI 2005/2006. Tipologia. Addì Tipologia. Addì Tipologia
 Presentazione del corso. Modalità di svolgimento della prova di esame. Introduzione all'analisi organica qualitativa. Analisi organica qualitativa: comportamento alla calcinazione. Saggio di Laissagne
Presentazione del corso. Modalità di svolgimento della prova di esame. Introduzione all'analisi organica qualitativa. Analisi organica qualitativa: comportamento alla calcinazione. Saggio di Laissagne
Teoria delle Collisioni. k = fattore di fattore fattore. velocità specifica. frequenza sterico energetico. Reazione chimica. Urti fra molecole (atomi)
 CINETICA CHIMICA -Velocità delle reazioni -Teoria del complesso attivato -Diagramma Ep/coordinate di reazione -Equazione di Arrhenius -Equazioni cinetiche semplici -Meccanismo di reazione -Catalisi e catalizzatori
CINETICA CHIMICA -Velocità delle reazioni -Teoria del complesso attivato -Diagramma Ep/coordinate di reazione -Equazione di Arrhenius -Equazioni cinetiche semplici -Meccanismo di reazione -Catalisi e catalizzatori
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 2. La carta d identità delle sostanze SEGUI LA MAPPA descrivere atomica 1 descrivere
Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 2. La carta d identità delle sostanze SEGUI LA MAPPA descrivere atomica 1 descrivere
Estrazione con solvente 18/01/2010. Laboratorio di chimica. Prof. Aurelio Trevisi
 Laboratorio di chimica Prof. Aurelio Trevisi Estrazione con solvente SCOPO: Estrarre mediante cicloesano lo iodio da una soluzione idroalcolica L estrazione con solventi si basa sulla diversa affinità
Laboratorio di chimica Prof. Aurelio Trevisi Estrazione con solvente SCOPO: Estrarre mediante cicloesano lo iodio da una soluzione idroalcolica L estrazione con solventi si basa sulla diversa affinità
Stati di aggregazione della materia. GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti
 9. I Gas Farmacia Stati di aggregazione della materia GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti Stato solido Nello stato solido l energia di
9. I Gas Farmacia Stati di aggregazione della materia GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti Stato solido Nello stato solido l energia di
Bilancio di energia: il Primo Principio della Termodinamica. Termodinamica dell Ingegneria Chimica
 Bilancio di energia: il Primo Principio della Termodinamica Termodinamica dell Ingegneria Chimica 1 I Sistemi termodinamici Un sistema è definito da una superficie di controllo, reale o immaginaria, che
Bilancio di energia: il Primo Principio della Termodinamica Termodinamica dell Ingegneria Chimica 1 I Sistemi termodinamici Un sistema è definito da una superficie di controllo, reale o immaginaria, che
Solventi (eluenti) per cromatografia :)"#$#%#*1#5"#%+!()*/$'"=%3.$#-.#5"#
 Solventi (eluenti) per cromatografia!"#$#%&'%(#"$)*')%+,'-.#*/%&'%'&$)./$01$'%/%0/--)%(2#23 4'.*)#-/5) 6#"$/.*)$1$)%&'%./$0)5') 6)*1#5# 4*)$)7)$,') 8'.*)$),#"/5) 8'#"'*%#"#$#!"'*#%/.#"/") 9.#")5# :'$'&'5/!"/5)*)
Solventi (eluenti) per cromatografia!"#$#%&'%(#"$)*')%+,'-.#*/%&'%'&$)./$01$'%/%0/--)%(2#23 4'.*)#-/5) 6#"$/.*)$1$)%&'%./$0)5') 6)*1#5# 4*)$)7)$,') 8'.*)$),#"/5) 8'#"'*%#"#$#!"'*#%/.#"/") 9.#")5# :'$'&'5/!"/5)*)
Valori numerici dei parametri di collisione
 Valori numerici dei parametri di collisione Nella Lezione 9 si è mostrato che in un plasma le collisioni a grande angolo sono prevalentemente il risultato di collisioni multiple a piccolo angolo. Dato
Valori numerici dei parametri di collisione Nella Lezione 9 si è mostrato che in un plasma le collisioni a grande angolo sono prevalentemente il risultato di collisioni multiple a piccolo angolo. Dato
I vantaggi delle colonne Agilent AdvanceBio SEC per le analisi biofarmaceutiche
 I vantaggi delle colonne Agilent AdvanceBio SEC per le analisi biofarmaceutiche Confronto tra le colonne di diversi fornitori per una migliore qualità dei dati Caratteristiche tecniche Introduzione La
I vantaggi delle colonne Agilent AdvanceBio SEC per le analisi biofarmaceutiche Confronto tra le colonne di diversi fornitori per una migliore qualità dei dati Caratteristiche tecniche Introduzione La
H 2, I 2 HI. Reazione inversa. inizio: ho solo [HI] Tempo. Tempo. man mano che la reazione procede: [HI] e [H 2 ] e [I 2 ] (v 2 )
![H 2, I 2 HI. Reazione inversa. inizio: ho solo [HI] Tempo. Tempo. man mano che la reazione procede: [HI] e [H 2 ] e [I 2 ] (v 2 ) H 2, I 2 HI. Reazione inversa. inizio: ho solo [HI] Tempo. Tempo. man mano che la reazione procede: [HI] e [H 2 ] e [I 2 ] (v 2 )](/thumbs/85/92124180.jpg) EQUILIBRIO CHIMICO Concetto di equilibrio, attività e costante di equilibrio Capitolo 6 Crea pag 132-146146 EQUILIBRIO CHIMICO: ESEMPIO 1 oncentraz zione C diretta H 2(g) +I 2(g) 2HI (g) 440 C inversa
EQUILIBRIO CHIMICO Concetto di equilibrio, attività e costante di equilibrio Capitolo 6 Crea pag 132-146146 EQUILIBRIO CHIMICO: ESEMPIO 1 oncentraz zione C diretta H 2(g) +I 2(g) 2HI (g) 440 C inversa
