La teoria del legame di valenza
|
|
|
- Irene Lentini
- 5 anni fa
- Visualizzazioni
Transcript
1 La teoria del legame di valenza La teoria di Lewis (postulata prima dell'avvento della meccanica quantistica) considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali atomici. La teoria del legame di valenza integra il modello di Lewis nell'ambito della meccanica quantistica, mettendo in relazione il legame fra due atomi con gli orbitali atomici che descrivono gli elettroni implicati nel legame stesso Ciò che nella teoria di Lewis è descritto come condivisione di una coppia di elettroni, nella teoria del legame di valenza diventa sovrapposizione di opportuni orbitali atomici. La conseguenza è sempre la stessa: un aumento della densità elettronica fra i nuclei dei due atomi che si legano, con conseguente abbassamento dell'energia del sistema. La teoria del legame di valenza I postulati fondamentali della teoria del legame di valenza: Il legame fra due atomi si realizza mediante sovrapposizione di due opportuni orbitali atomici, uno per ciascun atomo. Nella maggioranza dei casi, si può assumere che i due orbitali che si sovrappongono per formare il cosiddetto orbitale di legame siano semioccupati, cioè contengano un elettrone ciascuno Nell'orbitale di legame che si viene a formare si vengono così a trovare due elettroni con spin antiparallelo. La formazione del legame H-H in H 2 viene descritta mediante la sovrapposizione dei due orbitali atomici semioccupati su ciascun atomo di idrogeno. 1
2 Principio della massima sovrapposizione Visto che ciò che tiene uniti due atomi è la densità elettronica che si viene a formare fra essi in seguito alla sovrapposizione di orbitali atomici, è naturale pensare che la forza di un legame sarà tanto maggiore quanto maggiore è la sovrapposizione fra i due orbitali In generale solo le coppie di orbitali atomici che si sovrappongono nella direzione del legame possono sovrapporsi in modo efficace! Gli orbitali di tipo s hanno simmetria sferica e quindi la sovrapposizione fra due orbitali di tipo s non presenta vincoli direzionali. Es. la molecola di H 2 Principio della massima sovrapposizione Un orbitale p e un orbitale s possono sovrapporsi in modo efficace solo quando l'orbitale s giace lungo l'asse che contiene i due lobi dell'orbitale p La sovrapposizione fra due orbitali di tipo p può avvenire in modo efficace se i due orbitali sono disposti lungo lo stesso asse. In tutti i casi appena visti (s-s, s-p ed p-p lungo lo stesso asse), la densità elettronica è concentrata lungo l'asse di legame e presenta simmetria cilindrica: si parla in questo caso di legame s 2
3 Principio della massima sovrapposizione Principio della massima sovrapposizione Due orbitali p possono sovrapporsi efficacemente anche in un altro modo, consistente nella sovrapposizione laterale dei rispettivi lobi. In tal modo, si ha un aumento di densità elettronica sopra e sotto un piano contenente i due nuclei e perpendicolare all'asse degli orbitali p che si sono sovrapposti, mentre su tale piano la densità elettronica è nulla. Si parla in questo caso di legame p e il piano sul quale la densità elettronica è nulla viene detto piano nodale Un legame di tipo p si può ottenere anche per sovrapposizione di un orbitale p con un orbitale d, opportunamente orientato. 3
4 Principio della massima sovrapposizione Principio della massima sovrapposizione 4
5 Principio della massima sovrapposizione Ibridazione di orbitali L'ibridazione degli orbitali è introdotta nella teoria VB per rendere conto delle geometrie molecolari sperimentalmente osservate e non riconducibili alla semplice sovrapposizione di orbitali atomici di tipo s, p o d. Ad esempio, la struttura del metano CH 4 è di tipo tetraedrico con quattro legami C-H equivalenti. Tale struttura non può essere ottenuta in alcun modo per sovrapposizione degli orbitali 2s e/o 2p dell'atomo di carbonio con gli orbitali 1s degli atomi di idrogeno. Si ammette allora che, prima della sovrapposizione con gli orbitali atomici di un altro atomo, gli orbitali atomici di un dato atomo possano essere combinati linearmente per dare origine a cosiddetti orbitali ibridi. La giustificazione di ciò poggia sulla proprietà dell'equazione d'onda secondo cui, se un certo set di funzioni sono delle sue soluzioni, allora anche una qualsiasi loro combinazione lineare continua a soddisfarla. L'orientazione degli orbitali ibridi che si ottengono in tal modo dipende dal tipo e dal numero degli orbitali atomici combinati, mentre il numero di orbitali ibridi è sempre uguale al numero totale di orbitali atomici che sono stati combinati. 5
6 Ibridazione di orbitali Tutti gli orbitali ibridi che si ottengono con una data combinazione hanno la medesima energia, il cui valore è una media dell'energia degli orbitali atomici componenti. I principali tipi di ibridazione (cioè combinazione lineare di orbitali atomici dello stesso atomo) sono: sp due orbitali ibridi orientati a 180 sp 2 sp 3 sp 3 d sp 3 d 2 tre orbitali ibridi con geometria trigonale planare quattro orbitali ibridi con geometria tetraedrica cinque orbitali ibridi con geometria bipiramidale trigonale sei orbitali ibridi con geometria ottaedrica Ibridazione di orbitali 6
7 Ibridazione di orbitali Ibridazione di orbitali 7
8 Ibridazione di orbitali Ibridazione di orbitali 8
9 Ibridazione di orbitali Ibridazione di orbitali L'impiego di orbitali ibridi porta generalmente alla formazione di legami s. Nell'ibridazione di tipo sp, solo uno dei tre orbitali p viene utilizzato. Rimangono così due orbitali p puri orientati perpendicolarmente fra loro e rispetto all'asse degli ibridi sp. Analogamente, nell'ibridazione di tipo sp 2 avanza un orbitale p puro, orientato perpendicolarmente rispetto al piano dei tre orbitali ibridi sp 2. Questi orbitali p puri possono venire impiegati per la formazione di legami p mediante sovrapposizione con orbitali di opportuna simmetria sull'altro atomo implicato nel legame, secondo lo schema di sovrapposizione laterale prima citato. Può accadere che per la formazione dei legami p ci siano diverse possibilità: in questo caso, la molecola sarà descritta con varie strutture di risonanza che differiscono solo per lo schema dei legami p (risonanza p). 9
10 Ibridazione di orbitali Geometrie molecolari La procedura per la descrizione delle molecole con la teoria del legame di valenza può essere così schematizzata: Disegnare la struttura di Lewis della molecola e determinare gli elettroni di valenza di ciascun atomo nel composto, considerando ogni legame come covalente puro (esattamente come visto per la carica formale) Determinare la geometria delle coppie strutturali intorno all'atomo centrale con la teoria VSEPR e in base a tale geometria determinare l'ibridazione necessaria: sp sp 2 sp 3 sp 3 d sp 3 d 2 lineare trigonale piana tetraedrica bipiramidale trigonale ottaedrica 10
11 Geometrie molecolari Rappresentare la configurazione elettronica di ciascun atomo nella molecola con lo schema a caselle Per quanto riguarda l'atomo centrale, assegnare gli elettroni di valenza agli orbitali ibridi e ad eventuali orbitali p o d puri basandosi sulla struttura di Lewis precedentemente disegnata tenendo presente che: coppie di non legame vanno assegnate agli orbitali ibridi saranno necessari tanti orbitali ibridi semioccupati quanti sono i legami s formati dall'atomo centrale saranno necessari tanti orbitali p o d puri semioccupati quanti sono i legami p formati dall'atomo centrale solo gli elementi con numero quantico n 3 hanno orbitali d ad energia sufficientemente bassa da poter essere impiegati per la formazione di legami p Geometrie molecolari In generale, gli atomi terminali non necessitano ibridazione: gli elettroni vanno assegnati seguendo il principio di Pauli e la regola di Hund Descrivere la formazione dei legami s e p mediante sovrapposizione degli opportuni orbitali sull'atomo centrale e sugli atomi terminali; le coppie elettroniche in ogni orbitale di legame così formato debbono avere spin antiparalleli Quando per la formazione dei legami p esistono più possibilità fra loro equivalenti, la molecola deve essere descritta da tutte le corrispondenti forme di risonanza Infine, si possono schematizzare gli orbitali presenti sui vari atomi ed evidenziare lo schema di sovrapposizione s e p 11
12 Geometrie molecolari: HF Geometrie molecolari: N 2 12
13 Geometrie molecolari: CH 4 Con la procedura generale si disegna la formula di Lewis per la molecola CH 4. Gli elettroni di valenza di ciascun atomo risultano: C 4 H 1 L'atomo di C è circondato da 4 coppie strutturali e quindi richiede un'ibridazione di tipo sp 3, ottenuta combinando l'orbitale 2s con i tre orbitali 2p. Dalla formula di Lewis si vede che l'atomo di C deve formare legami s : i 4 orbitali ibridi sp 3 dovranno perciò essere semioccupati; ciò si realizza disponendo i 4 elettroni di valenza dell'atomo di C uno per ciascun orbitale ibrido. Ciascun atomo di idrogeno possiede 1 elettrone di valenza che verrà sistemato nell'orbitale 1s. Inoltre, sempre dalla formula di Lewis, si vede che ciascun atomo di idrogeno forma un legame s con l'atomo di carbonio: tale legame sarà ottenuto dalla sovrapposizione di un orbitale ibrido sp 3 dell'atomo di carbonio con l'orbitale 1s dell'atomo di idrogeno; da notare come gli elettroni di ciascun legame siano indicati con spin antiparallelo. Non ci sono legami p. Geometrie molecolari: CH 4 Stato fondamentale Ibridizzazione 13
14 Geometrie molecolari: CH 4 Geometrie molecolari: NH 3 Con la procedura generale si disegna la formula di Lewis per la molecola NH 3. Gli elettroni di valenza di ciascun atomo risultano: N 5 H 1 L'atomo di N è circondato da 4 coppie strutturali e quindi richiede un'ibridazione di tipo sp 3, ottenuta combinando l'orbitale 2s con i tre orbitali 2p. Dalla formula di Lewis si vede che l'atomo di N possiede una coppia di non legame e deve formare 3 legami s: uno dei 4 orbitali ibridi sp 3 sarà quindi completamente occupato, mentre i rimanenti dovranno essere semioccupati. Ciò si realizza accoppiando 2 dei 5 elettroni di valenza in un orbitale ibrido sp 3 e disponendo gli altri 3 uno per ciascuno dei rimanenti 3 orbitali ibridi sp 3. Ciascun atomo di idrogeno possiede 1 elettrone di valenza che verrà sistemato nell'orbitale 1s. Inoltre, sempre dalla formula di Lewis, si vede che ciascun atomo di idrogeno forma un legame s con l'atomo di azoto: tale legame sarà ottenuto dalla sovrapposizione di un orbitale ibrido sp 3 dell'atomo di carbonio con l'orbitale 1s dell'atomo di idrogeno; da notare come gli elettroni di ciascun legame siano indicati con spin antiparallelo. Non ci sono legami p. 14
15 Geometrie molecolari: NH 3 H N H H Geometrie molecolari: H 2 CO Con la procedura generale si disegna la formula di Lewis per la molecola H 2 CO. Gli elettroni di valenza di ciascun atomo risultano: H 1 C 4 O 6 L'atomo di C è circondato da 3 coppie strutturali e quindi richiede un'ibridazione di tipo sp 2, ottenuta combinando l'orbitale 2s con 2 dei 3 orbitali 2p. Rimane un orbitale p normale al piano contenente i 3 orbitali ibridi sp 2. Dalla formula di Lewis si vede che l'atomo di C deve formare 3 legami s e 1 legame p; quindi, i 3 orbitali ibridi sp 2 e l'orbitale p puro dovranno essere semioccupati per formare i 3 legami s e il legame p, rispettivamente. Ciò si realizza assegnando ciascuno dei 4 elettroni di valenza ad un orbitale diverso. Sistemando i 6 elettroni di valenza dell'atomo di ossigeno secondo il principio di Pauli e la regola di Hund, si ottengono 2 orbitali 2p semioccupati: uno di essi avrà simmetria s e sovrapporrà con un orbitale ibrido dell'atomo di carbonio; l'altro avrà simmetria p e potrà sovrapporsi all'orbitale p puro dell'atomo di carbonio. Ciascun atomo di idrogeno possiede 1 elettrone di valenza che verrà sistemato nell'orbitale 1s, che potrà sovrapporsi con il relativo orbitale ibrido dell'atomo di carbonio. Gli elettroni di ciascun legame vanno indicati con spin antiparallelo. 15
16 Geometrie molecolari: H 2 CO Geometrie molecolari: H 2 C=CH 2 16
17 Geometrie molecolari: Benzene C 6 H 6 Geometrie molecolari: Benzene C 6 H 6 17
18 Geometrie molecolari: Benzene C 6 H 6 Geometrie molecolari: CO 2 Con la procedura generale si disegna la formula di Lewis per la molecola CO 2. Gli elettroni di valenza di ciascun atomo risultano: C 4 O 6 L'atomo di C è circondato da 2 coppie strutturali e quindi richiede un'ibridazione di tipo sp, ottenuta combinando l'orbitale 2s con 1 dei 3 orbitali p. Rimangono 2 orbitali p puri, normali fra loro e alla direzione dei 2 orbitali ibridi. Dalla formula di Lewis si vede che l'atomo di C deve formare 2 legami s e 2 legami p; quindi, i 2 orbitali ibridi e i 2 orbitali p puri dovranno essere semioccupati. Ciò si realizza assegnando ciascuno dei 4 elettroni di valenza ad un orbitale diverso. Sistemando i 6 elettroni di valenza di ciascun atomo di ossigeno secondo il principio di Pauli e la regola di Hund, si ottengono 2 orbitali p semioccupati: uno di essi avrà simmetria s e sovrapporrà con un orbitale ibrido dell'atomo di carbonio; l'altro avrà simmetria p e potrà sovrapporsi all'orbitale p puro dell'atomo di carbonio. Da notare che i piani nodali dei 2 legami p che si formano sono fra loro perpendicolari. Gli elettroni di ciascun legame vanno indicati con spin antiparallelo. 18
19 Geometrie molecolari: CO 2 Geometrie molecolari: NO 3 - Con la procedura generale si disegna la formula di Lewis per la molecola. Lo ione viene descritto come ibrido di risonanza tra 3 strutture limite equivalenti. Gli elettroni di valenza di ciascun atomo risultano: N 4 O 6 (doppio legame) O 7 (legame singolo) L'atomo di N è circondato da 3 coppie strutturali e quindi richiede un'ibridazione di tipo sp 2, ottenuta combinando l'orbitale 2s con 2 dei 3 orbitali 2p. Rimane 1 orbitale 2p puro, ortogonale al piano degli orbitali ibridi. Dalla formula di Lewis si vede che l'atomo di N deve formare 3 legami s e 1 legame p; quindi, i 3 orbitali ibridi e l'orbitale p puro dovranno essere semioccupati. Ciò si realizza assegnando ciascuno dei 4 elettroni di valenza ad un orbitale diverso. 19
20 Geometrie molecolari: NO 3 - Per quanto riguarda i 3 atomi di ossigeno, 2 di essi formano un legame singolo, mentre 1 forma un legame doppio. Gli atomi di ossigeno che formano solo un legame singolo possiedono 7 elettroni di valenza e quindi 1 orbitale p semioccupato che potrà sovrapporre con 1 orbitale ibrido dell'atomo di azoto per la formazione di un corrispondente orbitale di legame s. L'atomo di ossigeno che forma un doppio legame possiede 6 elettroni di valenza che, sistemati secondo il principio di Pauli e la regola di Hund, lasciano 2 orbitali p semioccupati, che formeranno un legame s e 1 legame p per sovrapposizione con il terzo orbitale ibrido e l'orbitale p puro dell'atomo di azoto, rispettivamente. Naturalmente, l'atomo di ossigeno che forma il doppio legame può essere qualsiasi dei 3 presenti nella molecola: si hanno quindi tre possibili forme di risonanza, corrispondenti alle tre possibili strutture di Lewis. Lo schema finale indicato si riferisce ad una sola forma limite. Gli elettroni di ciascun legame vanno indicati con spin antiparallelo. Geometrie molecolari: NO 3-20
21 Geometrie molecolari: SF 4 Con la procedura generale si disegna la formula di Lewis per la molecola, che prevede 4 legami s S-F e una coppia di non legame sull'atomo centrale. Gli elettroni di valenza di ciascun atomo nella molecola risultano: S 6 F 7 L'atomo di zolfo è circondato da 5 coppie strutturali (valenza espansa) e richiede pertanto un'ibridazione di tipo dsp 3, che si ottiene combinando l'orbitale 3s con i 3 orbitali 3p e 1 degli orbitali 3d, che nello zolfo, appartenente al terzo periodo, hanno energia sufficientemente bassa. Dei cinque orbitali ibridi così ottenuti, quattro sono semioccupati per formare i 4 legami s con gli atomi di fluoro mentre il quinto contiene una coppia solitaria. In accordo con la teoria VSEPR, la coppia solitaria andrà sistemata in uno dei 3 orbitali ibridi del piano equatoriale. Ciascun atomo di fluoro possiede un orbitale p formerà il legame s con l'atomo di zolfo. semioccupato che Gli elettroni di ciascun legame vengono indicati con spin antiparallelo. Geometrie molecolari: SF 4 21
22 Geometrie molecolari: SF 6 Con la procedura generale si disegna la formula di Lewis 6, che prevede 6 legami s S-F 6. Gli elettroni di valenza di ciascun atomo nella molecola risultano: S 6 F 7 L'atomo di zolfo è circondato da 6 coppie strutturali (valenza espansa) e richiede pertanto un'ibridazione di tipo d 2 sp 3, che si ottiene combinando l'orbitale 3s con i 3 orbitali 3p e 2 degli orbitali 3d, che nello zolfo, appartenente al terzo periodo, hanno energia sufficientemente bassa. Ciascuno dei sei elettroni di valenza dello zolfo nella molecola viene asegnato ad un orbitale ibrido. Ciascun atomo di fluoro possiede un orbitale p formerà il legame s con l'atomo di zolfo. semioccupato che Gli elettroni di ciascun legame vengono indicati con spin antiparallelo. Geometrie molecolari: SF 6 22
23 Geometrie molecolari: POCl 3 Con la procedura generale si disegna la formula di Lewis per la molecola, che prevede 3 legami s P-Cl e 1 legame doppio P=O. Gli elettroni di valenza di ciascun atomo nella molecola risultano: P 5 Cl 7 O 6 L'atomo di fosforo è circondato da 4 coppie strutturali e richiede pertanto un'ibridazione di tipo sp 3, che si ottiene combinando l'orbitale 3s con i 3 orbitali 3p. Siccome il fosforo deve formare 4 legami s (3 con gli atomi di cloro e 1 con l'atomo di ossigeno), i 4 orbitali ibridi dovranno essere semioccupati. Inoltre, siccome deve essere formato anche 1 legame p tra fosforo e ossigeno, il quinto elettrone di valenza del fosforo dovrà occupare un orbitale a simmetria p : questo sarà uno degli orbitali 3d, che nel fosforo (terzo periodo) hanno energia accessibile. Per quanto riguarda gli atomi di cloro, ciascuno possiede un orbitale 3p semioccupato che viene utilizzato per formare il legame s con l'atomo di fosforo. L'atomo di ossigeno possiede 2 orbitali 2p semioccupati: quello disposto lungo l'asse di uno degli orbitali ibridi del fosforo formerà il legame s, mentre il secondo sovrapporrà con l'opportuno orbitale d del fosforo per formare il legame p. Gli elettroni di ciascun legame vengono indicati con spin antiparallelo. Geometrie molecolari: POCl 3 23
24 Geometrie molecolari: SO 2 Applicando la procedura generale per disegnare le formule di Lewis, la molecola di SO 2 dovrebbe essere descritta come ibrido di risonanza tra due formule limite identiche, con un legame S-O singolo ed uno doppio. In tale formulazione, tuttavia, le cariche atomiche formali sullo zolfo e sull'ossigeno legato con legame singolo sarebbero +1 e -1, rispettivamente. Siccome lo zolfo può dare valenza espansa, un'altra possibile descrizione della molecola si ottiene assumendo che entrambi i legami S-O siano doppi: in tal modo lo zolfo è circondato da 10 e -, ma la carica atomica formale su ciascuno dei tre atomi costituenti la molecola è nulla. Questa descrizione è supportata dai dati sperimentali che indicano un considerevole carattere di legame multiplo tra zolfo ed ossigeno: si può pertanto considerare la molecola di SO 2 come un ibrido di risonanza tra le due strutture citate (di cui la prima, come detto, è espressa a sua volta con due formule limite equivalenti): Geometrie molecolari: SO 2 Limitandoci alla descrizione della molecola con 2 doppi legami (struttura C), gli elettroni di valenza di ciascun atomo risultano: S 6 O 6 O 6 L'atomo di S è circondato da 3 coppie strutturali e quindi richiede un'ibridazione di tipo sp 2, ottenuta combinando l'orbitale 3s con 2 dei 3 orbitali 3p. Dalla formula di Lewis si vede che l'atomo di S possiede una coppia di non legame e deve formare 2 legami s e 2 legami p; quindi, i 6 elettroni dello zolfo andranno sistemati come segue: una coppia solitaria occupa uno dei 3 orbitali ibridi, 2 elettroni vengono sistemati, uno per orbitale, nei rimanenti 2 orbitali ibridi. Gli ultimi 2 elettroni devono restare spaiati per formare i due legami p: uno di essi occupa l'orbitale 3p puro perpendicolare al piano degli orbitali idridi e l'altro occupa uno dei 5 orbitali 3d liberi, che nello zolfo, appartenente al terzo periodo, hanno energia accessibile (questo è il motivo per cui lo zolfo può dare valenza espansa). 24
25 Geometrie molecolari: SO 2 I 2 atomi di ossigeno possiedono 6 elettroni di valenza ciascuno. Sistemando tali elettroni secondo il principio di Pauli e la regola di Hund, rimangono su ciascun ossigeno 2 orbitali 2p semioccupati, che formano il legame s e quello p con lo zolfo. In particolare, il legame s viene formato per sovrapposizione dell'orbitale 2p semioccupato di opportuna simmetria con il corrispondente orbitale ibrido semioccupato dello zolfo; per la formazione dei legami p, un atomo di ossigeno sovrappone il secondo orbitale 2p semioccupato con l'orbitale 3p puro (anch'esso semioccupato) dello zolfo, mentre l'altro atomo di ossigeno sovrappone il secondo orbitale 2p semioccupato con l'orbitale 3d semioccupato dello zolfo. Naturalmente, questo schema di legame p è perfettamente intercambiabile, nel senso che si possono scrivere due formule limite di risonanza in cui la sovrapposizione p degli atomi di ossigeno è scambiata. Gli elettroni di ciascun legame vanno indicati con spin antiparallelo. Geometrie molecolari: SO 2 25
26 Geometrie molecolari: ClO 4 - Con la procedura generale si disegnano le possibili formule di Lewis per la molecola. Sulla base del calcolo della carica formale, si deduce che la formula limite più stabile è la D (vedere la figura). Chiaramente, si possono scrivere 4 formule di tipo D, tutte equivalenti fra loro. Gli elettroni di valenza di ciascun atomo nella formula limite più stabile risultano: Cl 7 O 6 (doppio legame) O 7(legame singolo) L'atomo di Cl è circondato da 4 coppie strutturali e quindi richiede un'ibridazione di tipo sp 3, ottenuta combinando l'orbitale 3s con i 3 orbitali 3p. Dalla formula di Lewis si vede che l'atomo di Cl deve formare 4 legami s e 3 legami p; i 4 orbitali ibridi dovranno perciò essere semioccupati. Inoltre, dal momento che il cloro appartiene al terzo periodo, i 3 legami p potranno essere formati grazie ad altrettanti orbitali d semioccupati (visto che tutti gli orbitali p sono stati impiegati per l'ibridazione). Ciò si realizza assegnando i 7 elettroni di valenza ai quattro orbitali ibridi e a 3 dei 5 orbitali d puri disponibili. Geometrie molecolari: ClO 4 - Per quanto riguarda i 4 atomi di ossigeno, 3 di essi formano un legame doppio, mentre 1 forma un legame singolo. L'atomo di ossigeno che forma solo un legame singolo possiede 7 elettroni di valenza e quindi 1 orbitale p semioccupato che potrà sovrapporre con 1 orbitale ibrido dell'atomo di cloro per la formazione di un corrispondente orbitale di legame s. Gli atomi di ossigeno che formano un doppio legame possiedono 6 elettroni di valenza che, sistemati secondo il principio di Pauli e la regola di Hund, lasciano 2 orbitali p semioccupati, che formeranno un legame s e un legame p per sovrapposizione con gli orbitali ibridi ed opportuni orbitali d puri dell'atomo di cloro, rispettivamente. Naturalmente, l'atomo di ossigeno che forma il legame singolo può essere qualsiasi dei 4 presenti nella molecola: si hanno quindi 4 possibili forme di risonanza, corrispondenti alle 4 possibili strutture di Lewis di tipo D. Lo schema finale indicato si riferisce ad una sola forma limite. Gli elettroni di ciascun legame vanno indicati con spin antiparallelo. 26
27 Geometrie molecolari: ClO 4 - Geometrie molecolari: esercizi XeO 2 F 2 ICl 4 - XeOF 4 27
La teoria del legame di valenza
 La teoria del legame di valenza La teoria di Lewis (postulata prima dell'avvento della meccanica quantistica) considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente
La teoria del legame di valenza La teoria di Lewis (postulata prima dell'avvento della meccanica quantistica) considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente
VSEPR Polarità Ibridizzazione
 VSEPR Polarità Ibridizzazione VSEPR VSEPR = Valance-Shell electron-pair repulsion Principio fondamentale: ciascun gruppo di elettroni di valenza attorno ad un atomo centrale è situato il più lontano possibile
VSEPR Polarità Ibridizzazione VSEPR VSEPR = Valance-Shell electron-pair repulsion Principio fondamentale: ciascun gruppo di elettroni di valenza attorno ad un atomo centrale è situato il più lontano possibile
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE. un atomo compie all atto di formazione di un composto al fine di formare un maggior
 CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
Poniamo il carbonio al centro, tre idrogeni sono legati al carbonio direttamente e uno attraverso l ossigeno
 Strutture di Lewis E un metodo semplice per ottenere le formule di struttura di composti covalenti nota la formula molecolare, la configurazione elettronica del livello di valenza degli atomi e la connettività
Strutture di Lewis E un metodo semplice per ottenere le formule di struttura di composti covalenti nota la formula molecolare, la configurazione elettronica del livello di valenza degli atomi e la connettività
LA MOLE LA MOLE 2.A PRE-REQUISITI 2.3 FORMULE E COMPOSIZIONE 2.B PRE-TEST
 LA MOLE 2.A PRE-REQUISITI 2.B PRE-TEST 2.C OBIETTIVI 2.1 QUANTO PESA UN ATOMO? 2.1.1 L IDEA DI MASSA RELATIVA 2.1.2 MASSA ATOMICA RELATIVA 2.2.4 ESERCIZI SVOLTI 2.3 FORMULE E COMPOSIZIONE 2.4 DETERMINAZIONE
LA MOLE 2.A PRE-REQUISITI 2.B PRE-TEST 2.C OBIETTIVI 2.1 QUANTO PESA UN ATOMO? 2.1.1 L IDEA DI MASSA RELATIVA 2.1.2 MASSA ATOMICA RELATIVA 2.2.4 ESERCIZI SVOLTI 2.3 FORMULE E COMPOSIZIONE 2.4 DETERMINAZIONE
GEOMETRIA MOLECOLARE
 GEOMETRIA MOLECOLARE Le molecole hanno geometrie spaziali ben definite caratterizzate da distanze di legame ed angoli di legame. Questi possono essere determinati sperimentalmente (es. raggi X). Si vede
GEOMETRIA MOLECOLARE Le molecole hanno geometrie spaziali ben definite caratterizzate da distanze di legame ed angoli di legame. Questi possono essere determinati sperimentalmente (es. raggi X). Si vede
MASSE ATOMICHE. 1,000 g di idrogeno reagiscono con 7,9367 g di ossigeno massa atomica ossigeno=2 x 7,9367=15,873 g (relativa all'idrogeno)
 MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
Formule di Struttura delle Molecole Organiche
 Formule di Struttura delle Molecole Organiche Costituzione L ordine in cui gli atomi di una molecola sono connessi è chiamata costituzione o connettività. La costituzione di una molecola deve essere determinata
Formule di Struttura delle Molecole Organiche Costituzione L ordine in cui gli atomi di una molecola sono connessi è chiamata costituzione o connettività. La costituzione di una molecola deve essere determinata
La Teoria dei Quanti e la Struttura Elettronica degli Atomi. Capitolo 7
 La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
Organic Chemistry. 4 th Edition Paula Yurkanis Bruice. Delocalizzazione degli elettroni e risonanza
 Organic Chemistry 4 th Edition Paula Yurkanis Bruice Delocalizzazione degli elettroni e risonanza 1 Elettroni Localizzati contro elettroni delocalizzati localized electrons localized electrons delocalized
Organic Chemistry 4 th Edition Paula Yurkanis Bruice Delocalizzazione degli elettroni e risonanza 1 Elettroni Localizzati contro elettroni delocalizzati localized electrons localized electrons delocalized
Dalla Chimica Generale
 RISNANZA RISNANZA Vi sono molecole le cui proprietà non sono ben spiegate da una singola struttura di Lewis che tenga conto cioé delle proprietà osservate (contenuto energetico, lunghezza dei legami, comportamento
RISNANZA RISNANZA Vi sono molecole le cui proprietà non sono ben spiegate da una singola struttura di Lewis che tenga conto cioé delle proprietà osservate (contenuto energetico, lunghezza dei legami, comportamento
Serie completa di Modelli Molecolari per la Chimica Organica
 EdiSES Istruzioni per l utilizzo dei modelli molecolari Serie completa di Modelli Molecolari per la Chimica Organica allegati ai seguenti volumi: Chimica Organica - Paula Y. Bruice Elementi di Chimica
EdiSES Istruzioni per l utilizzo dei modelli molecolari Serie completa di Modelli Molecolari per la Chimica Organica allegati ai seguenti volumi: Chimica Organica - Paula Y. Bruice Elementi di Chimica
CAPITOLO V. DATABASE: Il modello relazionale
 CAPITOLO V DATABASE: Il modello relazionale Il modello relazionale offre una rappresentazione matematica dei dati basata sul concetto di relazione normalizzata. I principi del modello relazionale furono
CAPITOLO V DATABASE: Il modello relazionale Il modello relazionale offre una rappresentazione matematica dei dati basata sul concetto di relazione normalizzata. I principi del modello relazionale furono
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
MODELLI ATOMICI. Modello Atomico di Dalton
 MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
I legami. 1) Rappresenta la struttura della molecola di idrogeno (numero atomico ZH = 1):
 Percorso 3 I legami E S E R C I Z I A Legame covalente omeopolare 1) Rappresenta la struttura della molecola di idrogeno (numero atomico ZH = 1): 2) Rappresenta la struttura della molecola di ossigeno
Percorso 3 I legami E S E R C I Z I A Legame covalente omeopolare 1) Rappresenta la struttura della molecola di idrogeno (numero atomico ZH = 1): 2) Rappresenta la struttura della molecola di ossigeno
 LEGAME CHIMICO In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE
LEGAME CHIMICO In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE
Teoria del campo cristallino (CFT)
 Teoria del campo cristallino (CFT) Interazione elettrostatica (non covalente) tra: - leganti anionici cariche elettriche puntiformi - leganti neutri dipoli elettrici con la parte negativa verso il centro
Teoria del campo cristallino (CFT) Interazione elettrostatica (non covalente) tra: - leganti anionici cariche elettriche puntiformi - leganti neutri dipoli elettrici con la parte negativa verso il centro
Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici.
 LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
MEMBRANE. struttura: fosfolipidi e proteine
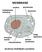 MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
LIPIDI. I lipidi sono suddivisi in due gruppi principali.
 LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA. L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
 COMPITI PER LE VACANZE E ATTIVITA PER IL RECUPERO a.s. 2014/2015 SECONDA E ITIS CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
COMPITI PER LE VACANZE E ATTIVITA PER IL RECUPERO a.s. 2014/2015 SECONDA E ITIS CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05
 I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
Gruppo 10 Nickel Ni (1751)
 Gruppo 10 ickel i (1751) Proprietà i Pd Pt Z 28 46 78 umero di isotopi 5 6 6 naturali Massa atomica 58.69 106.42 195.08 onfigurazione [Ar]3d 8 4s 2 [Kr]4d 10 [Xe]4f 14 5d 9 6s 1 elettronica Aspetto Metallo
Gruppo 10 ickel i (1751) Proprietà i Pd Pt Z 28 46 78 umero di isotopi 5 6 6 naturali Massa atomica 58.69 106.42 195.08 onfigurazione [Ar]3d 8 4s 2 [Kr]4d 10 [Xe]4f 14 5d 9 6s 1 elettronica Aspetto Metallo
Državni izpitni center. Prova d esame 1. Giovedì, 29 agosto 2013 / 90 minuti
 odice del candidato: ržavni izpitni center *M13243121I* SESSIONE UTUNNLE Prova d esame 1 Giovedì, 29 agosto 2013 / 90 minuti l candidato sono consentiti l'uso della penna stilografica o a sfera, matita
odice del candidato: ržavni izpitni center *M13243121I* SESSIONE UTUNNLE Prova d esame 1 Giovedì, 29 agosto 2013 / 90 minuti l candidato sono consentiti l'uso della penna stilografica o a sfera, matita
Energia elettrica. L atomo nel suo complesso è neutro perché ha l equilibrio tra protoni ed elettroni presenti nello stesso numero.
 Energia elettrica Si fonda sulla costituzione dell atomo che è costituito da particelle più piccole : neutroni (carica neutra) e protoni (carica +) che costituiscono il nucleo ed elettroni (carica negativa)
Energia elettrica Si fonda sulla costituzione dell atomo che è costituito da particelle più piccole : neutroni (carica neutra) e protoni (carica +) che costituiscono il nucleo ed elettroni (carica negativa)
Com è fatto l atomo ATOMO. UNA VOLTA si pensava che l atomo fosse indivisibile. OGGI si pensa che l atomo è costituito da tre particelle
 STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
Gli orbitali: modello atomico probabilistico
 1 Approfondimento 2.1 Gli orbitali: modello atomico probabilistico Modello atomico planetario (o a gusci): gli elettroni ruotano intorno al nucleo percorrendo orbite prefissate. Il modello atomico planetario
1 Approfondimento 2.1 Gli orbitali: modello atomico probabilistico Modello atomico planetario (o a gusci): gli elettroni ruotano intorno al nucleo percorrendo orbite prefissate. Il modello atomico planetario
Determinazione della composizione elementare dello ione molecolare. Metodo dell abbondanza isotopica. Misure di massa esatta
 Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
ESERCIZI DEL CORSO DI INFORMATICA
 ESERCIZI DEL CORSO DI INFORMTIC Questa breve raccolta di esercizi vuole mettere in luce alcuni aspetti della prima parte del corso e fornire qualche spunto di riflessione. Il contenuto del materiale seguente
ESERCIZI DEL CORSO DI INFORMTIC Questa breve raccolta di esercizi vuole mettere in luce alcuni aspetti della prima parte del corso e fornire qualche spunto di riflessione. Il contenuto del materiale seguente
SCUOLA PRIMARIA DI MAGGIATE Classe terza
 SCUOLA PRIMARIA DI MAGGIATE Classe terza Anno scolastico 2012-2013 TERRE ACQUE Osservando il nostro pianeta possiamo notare che la maggior parte della superficie è occupata dalle acque. Infatti esse occupano
SCUOLA PRIMARIA DI MAGGIATE Classe terza Anno scolastico 2012-2013 TERRE ACQUE Osservando il nostro pianeta possiamo notare che la maggior parte della superficie è occupata dalle acque. Infatti esse occupano
S P E T T R O S C O P I A. Dispense di Chimica Fisica per Biotecnologie Dr.ssa Rosa Terracciano
 S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
Risonanza magnetica nucleare protonica (NMR - PMR)
 Risonanza magnetica nucleare protonica (NMR - PMR) Basi fisiche I nuclei degli atomi hanno un movimento di rotazione intorno a se stessi (spin). Posto che ogni carica dotata di moto genera un campo magnetico,
Risonanza magnetica nucleare protonica (NMR - PMR) Basi fisiche I nuclei degli atomi hanno un movimento di rotazione intorno a se stessi (spin). Posto che ogni carica dotata di moto genera un campo magnetico,
UNIVERSITÀ DEGLI STUDI DI PADOVA Facoltà di Ingegneria A.A. 2009/10
 UNIVERSITÀ DEGLI STUDI DI PDOV Facoltà di Ingegneria Corso di Disegno Tecnico Industriale per i Corsi di Laurea triennale in Ingegneria Meccanica e in Ingegneria dell Energia Costruzioni geometriche in
UNIVERSITÀ DEGLI STUDI DI PDOV Facoltà di Ingegneria Corso di Disegno Tecnico Industriale per i Corsi di Laurea triennale in Ingegneria Meccanica e in Ingegneria dell Energia Costruzioni geometriche in
LEGAME CHIMICO. H + H H 2 cioè H-H
 LEGAME CIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
LEGAME CIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
Indice. 1 La materia e la sua struttura. 2 La radioattività ed i processi nucleari
 Indice PREFAZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi 5 1.3. L unità di
Indice PREFAZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi 5 1.3. L unità di
NUMERI DI OSSIDAZIONE
 NUMERI DI OSSIDAZIONE Numeri in caratteri romani dotati di segno Tengono conto di uno squilibrio di cariche nelle specie poliatomiche Si ottengono, formalmente, attribuendo tutti gli elettroni di valenza
NUMERI DI OSSIDAZIONE Numeri in caratteri romani dotati di segno Tengono conto di uno squilibrio di cariche nelle specie poliatomiche Si ottengono, formalmente, attribuendo tutti gli elettroni di valenza
Indice. 1 La materia e la sua struttura. 2 La radioattività ed i processi nucleari
 Indice PREFAZIONE ALLA SECONDA EDIZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi
Indice PREFAZIONE ALLA SECONDA EDIZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi
Illustrazione 1: Telaio. Piantanida Simone 1 G Scopo dell'esperienza: Misura di grandezze vettoriali
 Piantanida Simone 1 G Scopo dell'esperienza: Misura di grandezze vettoriali Materiale utilizzato: Telaio (carrucole,supporto,filo), pesi, goniometro o foglio con goniometro stampato, righello Premessa
Piantanida Simone 1 G Scopo dell'esperienza: Misura di grandezze vettoriali Materiale utilizzato: Telaio (carrucole,supporto,filo), pesi, goniometro o foglio con goniometro stampato, righello Premessa
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
UNITA 3 COMBUSTIONE, CARBURANTI, LUBRIFICANTI
 UNITA 3 COMBUSTIONE, CARBURANTI, LUBRIFICANTI Esercizio 3.1 Calcolare il potere calorifico superiore e inferiore del gas metano che brucia secondo la reazione CH 4 + 2 O 2 CO 2 + 2 H 2 O sapendo che l
UNITA 3 COMBUSTIONE, CARBURANTI, LUBRIFICANTI Esercizio 3.1 Calcolare il potere calorifico superiore e inferiore del gas metano che brucia secondo la reazione CH 4 + 2 O 2 CO 2 + 2 H 2 O sapendo che l
SOLUZIONE ESERCIZIO 1.1
 SOLUZIONE ESERCIZIO 1.1 La temperatura di fusione ed il coefficiente di espansione termica di alcuni metalli sono riportati nella tabella e nel diagramma sottostante: Metallo Temperatura di fusione [ C]
SOLUZIONE ESERCIZIO 1.1 La temperatura di fusione ed il coefficiente di espansione termica di alcuni metalli sono riportati nella tabella e nel diagramma sottostante: Metallo Temperatura di fusione [ C]
di manipolatori seriali
 Cinematica i diretta ed inversa di manipolatori seriali Robotica I Marco Gabiccini AA A.A. 2009/2010 LS Ing. Meccanica ed Automazione Struttura meccanica Struttura meccanica costituita da insieme di: corpi
Cinematica i diretta ed inversa di manipolatori seriali Robotica I Marco Gabiccini AA A.A. 2009/2010 LS Ing. Meccanica ed Automazione Struttura meccanica Struttura meccanica costituita da insieme di: corpi
COMPOSTI DI COORDINAZIONE (complessi)
 Gli ioni dei metalli di transizione nei sistemi biologici non si presentano come acquoioni [M(H 2 O) n ] x+ ma come. COMPOSTI DI COORDINAZIONE (complessi) derivano dall interazione (coordinazione) tra
Gli ioni dei metalli di transizione nei sistemi biologici non si presentano come acquoioni [M(H 2 O) n ] x+ ma come. COMPOSTI DI COORDINAZIONE (complessi) derivano dall interazione (coordinazione) tra
Il bilanciamento delle reazioni chimiche
 1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
INTERAZIONI DELLE RADIAZIONI CON LA MATERIA
 M. Marengo INTERAZIONI DELLE RADIAZIONI CON LA MATERIA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna mario.marengo@unibo.it Si definiscono radiazioni ionizzanti tutte le
M. Marengo INTERAZIONI DELLE RADIAZIONI CON LA MATERIA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna mario.marengo@unibo.it Si definiscono radiazioni ionizzanti tutte le
ELASTOMERI ELASTOMERI
 ELASTOMERI Gli elastomeri o gomme, sono materiali polimerici le cui dimensioni possono variare enormemente so
ELASTOMERI Gli elastomeri o gomme, sono materiali polimerici le cui dimensioni possono variare enormemente so
Il Metodo Scientifico
 Unita Naturali Il Metodo Scientifico La Fisica si occupa di descrivere ed interpretare i fenomeni naturali usando il metodo scientifico. Passi del metodo scientifico: Schematizzazione: modello semplificato
Unita Naturali Il Metodo Scientifico La Fisica si occupa di descrivere ed interpretare i fenomeni naturali usando il metodo scientifico. Passi del metodo scientifico: Schematizzazione: modello semplificato
PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO: CHIMICA, MATERIALI E BIOTECNOLOGIE
 RE P U B B L I C A I T A L I A N A ISTITUTO DI ISTRUZIONE SECONDARIA SUPERIORE MINERARIO G. ASPRONI E. FERMI DI IGLESIAS PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO:
RE P U B B L I C A I T A L I A N A ISTITUTO DI ISTRUZIONE SECONDARIA SUPERIORE MINERARIO G. ASPRONI E. FERMI DI IGLESIAS PROGRAMMAZIONE ANNUALE A.S. 2015/2016 DISCIPLINA: CHIMICA CLASSE: 2^A - INDIRIZZO:
Convenzioni di rappresentazione
 Convenzioni di rappresentazione Ogni elemento grafico su un elaborato deve avere un preciso ed inequivocabile significato, secondo le convenzioni di seguito illustrate. In particolare: Disegno tecnico:
Convenzioni di rappresentazione Ogni elemento grafico su un elaborato deve avere un preciso ed inequivocabile significato, secondo le convenzioni di seguito illustrate. In particolare: Disegno tecnico:
Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012)
 CORSO DI LAUREA IN SCIENZE BIOLOGICHE Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012) 1) Bilanciare la seguente ossidoriduzione: KMnO 4 + H 2 O 2 + H 2 SO 4 MnSO 4 + K 2 SO 4 + O 2 + H
CORSO DI LAUREA IN SCIENZE BIOLOGICHE Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012) 1) Bilanciare la seguente ossidoriduzione: KMnO 4 + H 2 O 2 + H 2 SO 4 MnSO 4 + K 2 SO 4 + O 2 + H
SCALA DEI PESI ATOMICI RELATIVI E MEDI
 SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
I differenti materiali differiscono per le caratteristiche meccaniche e fisiche.
 MATERIALI COMPOSITI I differenti materiali differiscono per le caratteristiche meccaniche e fisiche. I METALLI hanno forma cristallina e forti legami molecolari (legame metallico), che danno loro resistenza
MATERIALI COMPOSITI I differenti materiali differiscono per le caratteristiche meccaniche e fisiche. I METALLI hanno forma cristallina e forti legami molecolari (legame metallico), che danno loro resistenza
I semiconduttori Semiconduttori intrinseci
 I semiconduttori Semiconduttori intrinseci I semiconduttori naturali usati per la produzione di dispositivi elettronici sono stati per molti anni il silicio e il germanio. Il germanio è andato, con il
I semiconduttori Semiconduttori intrinseci I semiconduttori naturali usati per la produzione di dispositivi elettronici sono stati per molti anni il silicio e il germanio. Il germanio è andato, con il
Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI
 Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI Dott.ssa DANIELA DE VITA Orario ricevimento (previo appuntamento):lunedì 17.30-18.30 E-mail danidvd@hotmail.it daniela.devita@uniroma1.it
Corso di Chimica e Stechiometria per il corso di laurea in SCIENZE AMBIENTALI Dott.ssa DANIELA DE VITA Orario ricevimento (previo appuntamento):lunedì 17.30-18.30 E-mail danidvd@hotmail.it daniela.devita@uniroma1.it
0.1 Esercizi calcolo combinatorio
 0.1 Esercizi calcolo combinatorio Esercizio 1. Sia T l insieme dei primi 100 numeri naturali. Calcolare: 1. Il numero di sottoinsiemi A di T che contengono esattamente 8 pari.. Il numero di coppie (A,
0.1 Esercizi calcolo combinatorio Esercizio 1. Sia T l insieme dei primi 100 numeri naturali. Calcolare: 1. Il numero di sottoinsiemi A di T che contengono esattamente 8 pari.. Il numero di coppie (A,
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 2
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI Idrocarburi ciclici contenenti un sistema di elettroni delocalizzati su tutto il perimetro dell anello BENZENE C 6 H 6 sp 2 angoli 120 coplanarità struttura simmetrica ad esagono
IDROCARBURI AROMATICI Idrocarburi ciclici contenenti un sistema di elettroni delocalizzati su tutto il perimetro dell anello BENZENE C 6 H 6 sp 2 angoli 120 coplanarità struttura simmetrica ad esagono
2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà. I liquidi e loro proprietà
 2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà 1 I liquidi e loro proprietà 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito. I gas occupano i loro contenitori uniformemente
2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà 1 I liquidi e loro proprietà 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito. I gas occupano i loro contenitori uniformemente
Solidi cristallini. I solidi cristallini sono caratterizzati da una distribuzione regolare delle particelle nello spazio.
 Solidi cristallini. I solidi cristallini sono caratterizzati da una distribuzione regolare delle particelle nello spazio. Il modo in cui le particelle costituenti il cristallo sono disposti nello spazio
Solidi cristallini. I solidi cristallini sono caratterizzati da una distribuzione regolare delle particelle nello spazio. Il modo in cui le particelle costituenti il cristallo sono disposti nello spazio
L equilibrio dei gas. Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura
 Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Abilità Informatiche. Lezione II. Creazione di modelli 3D. arch. Gabriella Rendina
 Abilità Informatiche Lezione II Creazione di modelli 3D arch. Gabriella Rendina Modellazione 3D La modellazione 3D consente di creare progetti utilizzando modelli di solidi, superfici e mesh. Un modello
Abilità Informatiche Lezione II Creazione di modelli 3D arch. Gabriella Rendina Modellazione 3D La modellazione 3D consente di creare progetti utilizzando modelli di solidi, superfici e mesh. Un modello
Radiazione solare. Energia elettrica
 Un modulo fotovoltaico è un dispositivo in grado di convertire energia solare direttamente in energia elettrica mediante effetto fotovoltaico ed è impiegato come generatore di corrente quasi puro in un
Un modulo fotovoltaico è un dispositivo in grado di convertire energia solare direttamente in energia elettrica mediante effetto fotovoltaico ed è impiegato come generatore di corrente quasi puro in un
Consideriamo due polinomi
 Capitolo 3 Il luogo delle radici Consideriamo due polinomi N(z) = (z z 1 )(z z 2 )... (z z m ) D(z) = (z p 1 )(z p 2 )... (z p n ) della variabile complessa z con m < n. Nelle problematiche connesse al
Capitolo 3 Il luogo delle radici Consideriamo due polinomi N(z) = (z z 1 )(z z 2 )... (z z m ) D(z) = (z p 1 )(z p 2 )... (z p n ) della variabile complessa z con m < n. Nelle problematiche connesse al
Molecole singole come elementi attivi nei circuiti elettronici
 Molecole singole come elementi attivi nei circuiti elettronici La corrente che attraversa una singola molecola deve essere necessariamente misurabile. Il fatto che una corrente di 1 na potesse attraversare
Molecole singole come elementi attivi nei circuiti elettronici La corrente che attraversa una singola molecola deve essere necessariamente misurabile. Il fatto che una corrente di 1 na potesse attraversare
IDROCARBURI AROMATICI. Scaricato da Sunhope.it
 IDROCARBURI AROMATICI BENZENE E il capostipite degli idrocarburi aromatici. Osservazioni sperimentali: Formula bruta C 6 6 elevato grado di insaturazione (4) I 6 atomi di C sono legati a formare un anello
IDROCARBURI AROMATICI BENZENE E il capostipite degli idrocarburi aromatici. Osservazioni sperimentali: Formula bruta C 6 6 elevato grado di insaturazione (4) I 6 atomi di C sono legati a formare un anello
MURST - PROVA AMMISSIONE 2000 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA
 MURST - PROVA AMMISSIONE 2000 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA 21) La legge di Henry, che stabilisce una relazione tra pressione gassosa e solubilità
MURST - PROVA AMMISSIONE 2000 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA 21) La legge di Henry, che stabilisce una relazione tra pressione gassosa e solubilità
7 Disegni sperimentali ad un solo fattore. Giulio Vidotto Raffaele Cioffi
 7 Disegni sperimentali ad un solo fattore Giulio Vidotto Raffaele Cioffi Indice: 7.1 Veri esperimenti 7.2 Fattori livelli condizioni e trattamenti 7.3 Alcuni disegni sperimentali da evitare 7.4 Elementi
7 Disegni sperimentali ad un solo fattore Giulio Vidotto Raffaele Cioffi Indice: 7.1 Veri esperimenti 7.2 Fattori livelli condizioni e trattamenti 7.3 Alcuni disegni sperimentali da evitare 7.4 Elementi
REGOLE DELLA RISONANZA
 REGLE DELLA RISAZA 1 Tutte le strutture canoniche di risonanza devono essere strutturedi Lewis corrette per esempio, nessuna può avere atomi di con cinque valenze 2 La posizione dei nuclei DEVE essere
REGLE DELLA RISAZA 1 Tutte le strutture canoniche di risonanza devono essere strutturedi Lewis corrette per esempio, nessuna può avere atomi di con cinque valenze 2 La posizione dei nuclei DEVE essere
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He. 2) L'acqua è:
 1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola.
 Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
PROGRAMMA CALCOLO. Configurazione Elettronica degli Elementi p.3. Il Legame Dativo...p.11. Il Modello Quanto-Meccanico di Atomo..p.
 PROGRAMMA CALCOLO INDICE UNITA 1 UNITA 2 UNITA 3 UNITA 4 UNITA 5 UNITA 6 UNITA 7 UNITA 8 UNITA 9 Configurazione Elettronica degli Elementi p.3 Elettrone.....p.8 Il Legame Dativo...p.11 Il Modello Quanto-Meccanico
PROGRAMMA CALCOLO INDICE UNITA 1 UNITA 2 UNITA 3 UNITA 4 UNITA 5 UNITA 6 UNITA 7 UNITA 8 UNITA 9 Configurazione Elettronica degli Elementi p.3 Elettrone.....p.8 Il Legame Dativo...p.11 Il Modello Quanto-Meccanico
GIOCHI DELLA CHIMICA
 GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
Chimica generale. Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari.
 Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari. PARTE 5-2 1 ACIDI E BASI 2 1-Definizioni di acido e di base 1-1 Teoria
Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari. PARTE 5-2 1 ACIDI E BASI 2 1-Definizioni di acido e di base 1-1 Teoria
UNIVERSITÀ DEGLI STUDI DI PADOVA Facoltà di Ingegneria A.A. 2009/10
 UNIVERSITÀ DEGLI STUDI DI PADOVA Facoltà di Ingegneria A.A. 2009/10 Corso di Disegno Tecnico Industriale per i Corsi di Laurea triennale in Ingegneria Meccanica e in Ingegneria dell Energia Sistemi di
UNIVERSITÀ DEGLI STUDI DI PADOVA Facoltà di Ingegneria A.A. 2009/10 Corso di Disegno Tecnico Industriale per i Corsi di Laurea triennale in Ingegneria Meccanica e in Ingegneria dell Energia Sistemi di
Indice generale. Prefazione
 26-10-2009 10:41 Pagina VI Prefazione Ringraziamenti dell Editore Guida alla lettura XIII XV XVII Capitolo 0 Lessico della chimica 1 0.1 La chimica 1 0.1.1 Classificazioni della materia 2 0.1.2 Proprietà
26-10-2009 10:41 Pagina VI Prefazione Ringraziamenti dell Editore Guida alla lettura XIII XV XVII Capitolo 0 Lessico della chimica 1 0.1 La chimica 1 0.1.1 Classificazioni della materia 2 0.1.2 Proprietà
CHIMICA ORGANICA. L isomeria
 1 B-ISOMERIA IMIA ORGANIA L isomeria Gli isomeri sono composti diversi (ciascuno con proprietà fisiche e chimiche proprie) che hanno tuttavia la stessa composizione chimica e quindi la stessa formula chimica
1 B-ISOMERIA IMIA ORGANIA L isomeria Gli isomeri sono composti diversi (ciascuno con proprietà fisiche e chimiche proprie) che hanno tuttavia la stessa composizione chimica e quindi la stessa formula chimica
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Fascicolo 1. Matematica - Scuola primaria Classe quinta Anno scolastico 2013 2014
 Griglia di correzione DOMANDE APERTE Fascicolo 1 Matematica - Scuola primaria Classe quinta Anno scolastico 2013 2014 Si ricorda che i dati di tutte le classi (campione e non campione) devono essere trasmessi
Griglia di correzione DOMANDE APERTE Fascicolo 1 Matematica - Scuola primaria Classe quinta Anno scolastico 2013 2014 Si ricorda che i dati di tutte le classi (campione e non campione) devono essere trasmessi
Giochi della Chimica 1996 Fase regionale Classi A e B
 Giochi della Chimica 1996 Fase regionale Classi A e B 1. Indicare le percentuali in massa degli elementi K, S e O presenti in K 2 SO 4 : A) 44,9% K; 18,4% S; 36,7% O B) 22,3% K; 52,6 % S; 25,1% O C) 56,1%
Giochi della Chimica 1996 Fase regionale Classi A e B 1. Indicare le percentuali in massa degli elementi K, S e O presenti in K 2 SO 4 : A) 44,9% K; 18,4% S; 36,7% O B) 22,3% K; 52,6 % S; 25,1% O C) 56,1%
ESPERIENZE CON GLI SPECCHI PIANI
 1. Qual è la posizione dell immagine fornita da uno specchio piano? Di che tipo di immagine si tratta? Disponi il cilindro giallo dietro lo specchio, in modo che coincida con l immagine riflessa del cilindro
1. Qual è la posizione dell immagine fornita da uno specchio piano? Di che tipo di immagine si tratta? Disponi il cilindro giallo dietro lo specchio, in modo che coincida con l immagine riflessa del cilindro
La Densità dei Liquidi
 La Densità dei Liquidi A) Alcuni valori di densità di Liquidi Valori della densità di liquidi sono riportati sul Perry, Kern, Gallant B) Metodi di Predizione 1) Metodo addittivo di Schroeder Tra i metodi
La Densità dei Liquidi A) Alcuni valori di densità di Liquidi Valori della densità di liquidi sono riportati sul Perry, Kern, Gallant B) Metodi di Predizione 1) Metodo addittivo di Schroeder Tra i metodi
Le proprietà periodiche degli elementi LA LEZIONE
 Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
7 Esercizi e complementi di Elettrotecnica per allievi non elettrici. Circuiti elementari
 7 Esercizi e complementi di Elettrotecnica per allievi non elettrici Circuiti elementari Gli esercizi proposti in questa sezione hanno lo scopo di introdurre l allievo ad alcune tecniche, semplici e fondamentali,
7 Esercizi e complementi di Elettrotecnica per allievi non elettrici Circuiti elementari Gli esercizi proposti in questa sezione hanno lo scopo di introdurre l allievo ad alcune tecniche, semplici e fondamentali,
I Bistabili. Maurizio Palesi. Maurizio Palesi 1
 I Bistabili Maurizio Palesi Maurizio Palesi 1 Sistemi digitali Si possono distinguere due classi di sistemi digitali Sistemi combinatori Il valore delle uscite al generico istante t* dipende solo dal valore
I Bistabili Maurizio Palesi Maurizio Palesi 1 Sistemi digitali Si possono distinguere due classi di sistemi digitali Sistemi combinatori Il valore delle uscite al generico istante t* dipende solo dal valore
Chimica. Ingegneria Meccanica, Elettrica e Civile Simulazione d'esame
 Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
Trasmettitore per gas PrimaX
 Trasmettitore per gas PrimaX Il rilevatore di gas versatile per soddisfare le vostre esigenze Facilità d uso, versatilità ed affidabilità Il nuovo stile modulare Il nuovo trasmettitore per gas PrimaX offre
Trasmettitore per gas PrimaX Il rilevatore di gas versatile per soddisfare le vostre esigenze Facilità d uso, versatilità ed affidabilità Il nuovo stile modulare Il nuovo trasmettitore per gas PrimaX offre
Il Benzene e l aromaticità
 Il Benzene e l aromaticità Il benzene Il benzene è un idrocarburo la cui formula bruta, nota sin dal 1825, è C 6 H 6. In confronto ad un alcano a sei atomi di carbonio (C 6 H 14 ) e un cicloesano a sei
Il Benzene e l aromaticità Il benzene Il benzene è un idrocarburo la cui formula bruta, nota sin dal 1825, è C 6 H 6. In confronto ad un alcano a sei atomi di carbonio (C 6 H 14 ) e un cicloesano a sei
LA CHIMICA ORGANICA. Premessa e prerequisiti. Riguardo alla disciplina
 LA IMIA ORGANIA Premessa e prerequisiti Riguardo alla disciplina Questo testo facilitato è pensato per gli allievi del biennio superiore. In un istituto tecnico commerciale la chimica viene generalmente
LA IMIA ORGANIA Premessa e prerequisiti Riguardo alla disciplina Questo testo facilitato è pensato per gli allievi del biennio superiore. In un istituto tecnico commerciale la chimica viene generalmente
Quando un composto ionico viene immesso in acqua si dissocia formando uno ione negativo ed uno positivo.
 I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3.
 Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
UNIVERSITÀ DEGLI STUDI DI PADOVA Facoltà di Ingegneria sede di Vicenza A.A. 2007/08
 UNIVERSITÀ DEGLI STUDI DI PADOVA Facoltà di Ingegneria sede di Vicenza Corso di Disegno Tecnico Industriale per il Corso di Laurea triennale in Ingegneria Meccanica e in Ingegneria Meccatronica Tolleranze
UNIVERSITÀ DEGLI STUDI DI PADOVA Facoltà di Ingegneria sede di Vicenza Corso di Disegno Tecnico Industriale per il Corso di Laurea triennale in Ingegneria Meccanica e in Ingegneria Meccatronica Tolleranze
1 INCONTRO CHIMICA (PROF.SSA PAOLA BURANI) Ogni sostanza chimica è costituita dalla combinazione, in diverse proporzioni, di 92 tipi di atomi.
 1 INCONTRO CHIMICA (PROF.SSA PAOLA BURANI) 1 Atomi e Legami Ogni sostanza chimica è costituita dalla combinazione, in diverse proporzioni, di 92 tipi di atomi. Il termine atomo significa indivisibile e
1 INCONTRO CHIMICA (PROF.SSA PAOLA BURANI) 1 Atomi e Legami Ogni sostanza chimica è costituita dalla combinazione, in diverse proporzioni, di 92 tipi di atomi. Il termine atomo significa indivisibile e
PROBLEMI DI SCELTA dipendenti da due variabili d azione
 prof. Guida PROBLEMI DI SCELTA dipendenti da due variabili d azione in un problema di programmazione lineare, si ricorda che la funzione obiettivo z=f(x,y)=ax+by+c assume il suo valore massimo (o minimo)
prof. Guida PROBLEMI DI SCELTA dipendenti da due variabili d azione in un problema di programmazione lineare, si ricorda che la funzione obiettivo z=f(x,y)=ax+by+c assume il suo valore massimo (o minimo)
Struttura elettronica delle molecole. Teoria quantistica del legame chimico
 Strttra elettronica delle molecole. Teoria qantistica del legame chimico Lo ione idrogeno molecolare H 2 + Eq. Schroedinger singolo elettrone La fnzione d onda φ b soddisfa na eqazione analoga. Gli atovalori
Strttra elettronica delle molecole. Teoria qantistica del legame chimico Lo ione idrogeno molecolare H 2 + Eq. Schroedinger singolo elettrone La fnzione d onda φ b soddisfa na eqazione analoga. Gli atovalori
Agostinetti Piero (425902/IM)
 UNIVERSITA DEGLI STUDI DI PADOVA FACOLTA DI INGEGNERIA Corso di Laurea in Ingegneria Meccanica LABORATORIO DI ANALISI STRUTTURALE CON ANSYS 5.6: VERIFICHE STRUTTURALI PER IL BILANCERE DELLA PIATTAFORMA
UNIVERSITA DEGLI STUDI DI PADOVA FACOLTA DI INGEGNERIA Corso di Laurea in Ingegneria Meccanica LABORATORIO DI ANALISI STRUTTURALE CON ANSYS 5.6: VERIFICHE STRUTTURALI PER IL BILANCERE DELLA PIATTAFORMA
