Corso competenze di base Ambito chimico
|
|
|
- Fabiana Farina
- 8 anni fa
- Visualizzazioni
Transcript
1 Laboratorio di Chimica dell ITIS E.Majorana di Grugliasco ( Corso competenze di base Ambito chimico (Seconda parte) La dispensa è stata realizzata dalla prof. A. Martini con la collaborazione, per la parte laboratoriale, del tecnico G. Rizzo
2 2. Stati di aggregazione e passaggi di stato 2.1 Stati di aggregazione della materia Un altro criterio per classificare i materiali che ci circondano è quello di suddividerli in base al loro stato fisico fondamentale cioè a temperatura e pressione ambiente. La materia può esistere in quattro stati di aggregazione: solido, liquido, gas e plasma. Noi studieremo solo i primi tre perché, il plasma, pur essendo lo stato più abbondante nell universo (circa il 99 %, costituendo la materia di cui sono fatte le stelle, compreso il Sole, e le nebulose), esiste solo in condizioni molto drastiche (temperature superiori a 5000 C) e quindi sulla Terra è presente, oltre che in laboratorio, solo nei fulmini o nelle aurore boreali. Il fulmine è un esempio di plasma presente sulla Terra. I valori tipici di una scarica in un fulmine sono una corrente di ampere, una tensione di 100 milioni di volt e l emissione di luce e raggi X. Le temperature del plasma in un fulmine arrivano a C e le densità di elettroni possono arrivare a /m 3. A quelle elevate temperature, le collisioni tra le particelle sono così violente da provocare l allontanamento degli elettroni dagli atomi, e quindi lo stato di plasma è costituita da un mare agitatissimo di elettroni e ioni positivi in equilibrio tra di loro ed è fortemente influenzato sia da campi magnetici sia da campi elettrici. Ritornando ai tre stati di aggregazione più comuni, bisogna sottolineare come tutti i materiali, tranne rare eccezioni (per esempio, il diamante brucia, cioè interagisce chimicamente, prima di diventare liquido), possono mutare il loro stato di aggregazione fondamentale, variando la temperatura e/o la pressione. In particolare, aumentando la temperatura o diminuendo la pressione, si ottiene, di regola, un passaggio solido liquido gassoso, mentre il percorso inverso lo si ottiene diminuendo la temperatura o aumentando la pressione.
3 Prima di descrivere le caratteristiche dei tre principali stati di aggregazione della materia bisogna sottolineare che: 1) tutti i materiali sono formati da particelle in continuo, incessante, caotico movimento; 2) l energia cinetica (movimento) delle particelle dipende dalla temperatura e, in particolare, aumenta all aumentare della temperatura. Stato solido: Stato liquido: Stato gassoso: A livello macroscopico, i solidi hanno forma e volume propri. Tra le particelle che li costituiscono ci sono forze di coesione (attrazione) piuttosto intense e quindi le particelle non si possono muovere liberamente le une rispetto alle altre, ma solo oscillare intorno a posizioni fisse e determinate. Le particelle sono disposte in una struttura tridimensionale più o meno geometricamente ordinata, detta reticolo cristallino, che è una proprietà fisica caratteristica di ogni solido (ad esempio: le pietre preziose). A livello macroscopico, i liquidi hanno volume proprio ma assumono la forma del recipiente che li contiene. Le particelle che li costituiscono hanno un energia cinetica maggiore di quella che avevano allo stato solido e le forze di coesione sono meno intense, perciò si possono muovere abbastanza disordinatamente, ma solo scivolando le une sulle altre. Alla superficie, un certo numero di particelle può sottrarsi del tutto all attrazione delle altre, passando allo stato gassoso. I liquidi, pertanto, esistono sempre alla presenza del loro gas. A livello macroscopico, i gas non hanno né forma, né volume proprio, ma occupano tutto lo spazio a loro disposizione. Le forze di coesione sono del tutto trascurabili e quindi le particelle sono indipendenti e si muovono in maniera caotica con moto rettilineo uniforme fino a quando un urto con le pareti del recipiente o un altra particella non interviene a modificare la loro traiettoria. Lo studio degli stati di aggregazione permette di capire come le proprietà dei materiali dipendono non solo dalla presenza di particelle diverse (esempio: acqua e zucchero), ma anche da come le particelle presenti sono legate tra di loro (esempio: acqua e ghiaccio). Nei tre stati di aggregazione, le particelle di un materiale NON cambiano, ma presentano forze di coesione differenti. N.B. Negli ultimi anni, per la loro applicazione nei dispositivi di visualizzazione di immagini (display) di cui sono dotati gli schermi dei computers e i quadranti delle calcolatrici elettroniche e degli orologi digitali, stanno acquistando importanza le sostanze che possono formare i cosiddetti cristalli liquidi. Queste sostanze, che presentano proprietà intermedie tra quelle dei solidi e dei liquidi, sono costituite da molecole allungate a forma di bastoncino, disposte parallelamente in strati sovrapposti, che modificano il loro orientamento sia cambiando la temperatura (proprietà
4 sfruttata nella fabbricazione dei termometri con pellicole termosensibili che assumono colori diversi a seconda della temperatura cutanea), sia in presenza di un campo elettrico. Il liquido è racchiuso tra due lamine di vetro e, in condizioni di riposo, le molecole sono disposte ortogonalmente alle lamine e fanno passare la luce. Quando il display viene attivato e passa la corrente elettrica, le molecole si dispongono a 90 rispetto alla posizione di equilibrio e la zona occupata appare scura sul fondo chiaro di partenza. raggi di luce quadranti di vetro sezione di elemento quando non passa la corrente, i raggi di luce raggiungono l analizzatore analizzatore raggi di luce sezione di elemento quando passa la corrente, i raggi di luce non raggiungono l analizzatore analizzatore Le molecole dei cristalli liquidi quindi si comportano un po come le lamelle di una tenda alla veneziana che, a seconda della posizione assunta, lasciano passare o meno la luce. L immagine di ciascuna cifra di un display è suddivisa in 7 zone, ognuna delle quali è connessa con l esterno. Gli impulsi elettrici in arrivo fanno cambiare orientamento alle molecole di ciascuna zona e, a seconda delle zone attivate, si ha la visualizzazione di una cifra fra 0 e 9.
5 2.2 Passaggi di stato Tranne rare eccezioni, ogni materiale può esistere nei tre stati fisici di aggregazione. Come abbiamo visto, passando da solido a liquido e a gas, aumentano l energia (e il grado di disordine) del sistema, mentre accade il contrario nella sequenza inversa. Ogni aumento di temperatura, di conseguenza, favorisce l esistenza di stati via, via a più alta energia (e disordinati), mentre un raffreddamento favorisce la comparsa di stati più ordinati e a bassa energia. Nella figura sono elencati i nomi dei passaggi di stato, in funzione dell energia e temperatura crescenti ( ) o decrescenti ( ). Sublimazione Solido Fusione Liquido Evaporazione Ebollizione Gassoso Solidificazione Condensazione Brinamento Temperatura ed energia crescenti I passaggi di stato sono: 1. trasformazioni reversibili: a seconda delle condizioni di temperatura, i passaggi di stato possono avvenire nelle due direzioni e quindi ad ogni trasformazione corrisponde una controtrasformazione, ad esempio, fusione e solidificazione; 2. trasformazioni fisiche: i materiali (e quindi le particelle presenti!) restano gli stessi, cambiano alcune loro proprietà, ma non la composizione chimica. Ad esempio, le proprietà fisiche dell acqua cambiano quando solidifica e diventa ghiaccio ma, naturalmente, il ghiaccio è ancora fatto da molecole di acqua e il cambiamento può facilmente avvenire in senso inverso (fusione del ghiaccio). La stessa cosa si verifica quando l acqua bolle e si trasforma in vapor acqueo e nella relativa controtrasformazione in cui il vapor acqueo condensa, come, ad esempio, accade in inverno sui vetri delle finestre. Passando dal mondo macroscopico a quello simbolico delle particelle si può scrivere: acqua liquida ghiaccio H 2 O (l) H 2 O (s) acqua liquida vapor acqueo H 2 O (l) H 2 O (g) In tutti questi casi cambiano sole le forze di attrazione (coesione) tra le particelle, molto forti nel solido (ghiaccio), più deboli nell acqua liquida, assenti nel gas (vapor acqueo)
6 N.B. Differenza tra evaporazione ed ebollizione A livello macroscopico, nell evaporazione possono passare allo stato gassoso solo le particelle presenti sulla superficie del liquido, dotate di sufficiente energia cinetica, mentre l ebollizione interessa tutte le particelle, anche quelle presenti all interno del liquido. Le bolle che si formano nell ebollizione non sono altro che particelle di liquido già passate allo stato gassoso. Un altra importante differenza tra evaporazione ed ebollizione riguarda le relative temperature; quella di ebollizione è fissa e costante (l acqua distillata bolle a 100 C, a pressione ambiente), mentre l evaporazione avviene in un ampio range di temperature (l acqua di una pozzanghera evapora sia d inverno, quando la temperatura è molto bassa, sia d estate) Solo le particelle che raggiungono la superficie passano allo stato di gas Bolle di gas che si sono formate all interno del liquido Evaporazione Ebollizione Le bolle che si vedono all interno di una pentola di acqua all ebollizione sono di acqua diventata vapor acqueo all interno del liquido. Le bolle presenti nell alcool etilico che bolle sono formate da alcool etilico gassoso e così via. Le bolle presenti all ebollizione sono formate da particelle del liquido già passate allo stato gassoso. Qualche nota curiosa: passaggi di stato, meteorologia e I passaggi di stato sono tra le trasformazioni fisiche più comuni e nel mondo che ci circonda avvengono in continuazione, anche se non sempre ce ne rendiamo conto. Ecco alcuni esempi che mostrano il collegamento tra chimica, scienze meteorologiche e tecnologia. Il passaggio di stato da gas a solido (brinamento), ad una prima veloce osservazione, potrebbe sembrare particolare e persino un po strano, eppure proprio il suo nome ci dovrebbe ricordare un fenomeno che, in inverno, è tutt altro che raro: la formazione della brina.
7 La brina si forma nelle notti invernali, soprattutto con cielo sereno e calma di vento (condizioni che favoriscono la dispersione del calore) per trasformazione diretta (e quindi senza formazione intermedia di liquido) del vapor acqueo, contenuto nell aria, in aghetti di ghiaccio: brinamento vapor acqueo brina H 2 O (g) H 2 O (s) Durante l estate avviene un fenomeno analogo, ma data la temperatura, il vapore condensa sotto forma di acqua liquida e si ha la rugiada. condensazione vapor acqueo rugiada H 2 O (g) H 2 O (l) Sempre durante l inverno si può formare la galaverna, cioè un deposito di ghiaccio in forma di aghi o scaglie che può prodursi, in presenza di nebbia, quando la temperatura dell aria è inferiore a 0 C. Poiché la nebbia è una sospensione di minutissime goccioline d acqua liquida negli stati atmosferici in prossimità del suolo, anche la formazione della galaverna è un passaggio di stato, in particolare una solidificazione : solidificazione nebbia galaverna H 2 O (l) H 2 O (s) E neve e grandine? Anche la loro formazione comporta un passaggio di stato: in entrambi i casi, una solidificazione delle minutissime goccioline di acqua liquida che sono il principale componente delle nuvole. I minuscoli cristalli di ghiaccio della neve si formano quando una massa d aria calda e umida scorre su uno strato d aria fredda, stazionante in prossimità del suolo. I chicchi di grandine sono composti da vari strati sovrapposti di ghiaccio che si formano a causa dei moti ascendenti e discendenti cui sono sottoposti gli stessi chicchi all interno di una nube agitata dai moti turbolenti che si verificano durante un temporale. I sistemi antigrandine prevedono la disseminazione sulle nubi di opportuni cristalli in maniera da creare dei nuclei attorno ai quali si aggregano le goccioline d acqua che così cadono come pioggia prima che si formi la grandine. Ma come si formano le nuvole? Attraverso ben due passaggi di stato, anzi, in questo caso si verifica una trasformazione, l evaporazione dell acqua degli oceani e dei mari, seguita dalla corrispondente controtrasformazione, la condensazione del vapore acqueo nelle goccioline di acqua liquida di cui, come già detto, sono formate la maggior parte delle nubi (alcune presentano anche minuscoli cristalli di ghiaccio la cui formazione è avvenuta grazie ad un altro passaggio di stato!!). Alcuni processi industriali, come la liofilizzazione, sfruttano i passaggi di stato. Questa tecnica, che permette la conservazione degli alimenti anche per un lungo periodo di anni, prevede una rapida solidificazione, a temperature variabili tra 30 e i 50 C, in fiale (medicinali) o in diversi tipi di contenitori (caffè, alimenti, cibi omogeneizzati per l infanzia), seguita da una sublimazione a bassa temperatura ( 20 C) e sottovuoto. In queste condizioni l acqua, sotto forma di ghiaccio, contenuta nel prodotto è estratta come vapore che viene allontanato per brinamento su serpentine fredde dette impropriamente condensatori (il termine si riferisce alla trasformazione gas/liquido mentre in realtà è da vapore a solido). I prodotti ottenuti con questa tecnica presentano diversi vantaggi: ottime qualità organolettiche, lunga conservazione a temperatura ambiente, facilità di trasporto, minime modifiche strutturali e rapida preparazione. L unico svantaggio è il costo piuttosto elevato.
8 Parte sperimentale Esperimento 1 I passaggi di stato nella distillazione Dopo aver osservato l apparecchiatura per la distillazione, iniziare il riscaldamento. Quali e quante interazioni si verificano? In quali punti dell apparecchiatura? Come varia nel tempo la temperatura nei due termometri? Che cosa succede alle particelle durante le varie trasformazioni? Si modificano? Come? Come si collega il mondo macroscopico con quello delle particelle e dei simboli? Immagine da: Smoot, Price, Cacciatore, Smith, Corso di chimica moderna Zanichelli Esperimento 2 Misurazione della temperatura alla quale il ghiaccio fonde Mettere alcuni pezzi di ghiaccio in un becher. Agitando con attenzione, misurare la temperatura del sistema. Quali e quante interazioni si verificano? Che cosa succede alla temperatura? Come si collega il mondo macroscopico delle osservazioni con quello delle particelle e dei simboli? N.B. Nel linguaggio comune (e, purtroppo, anche in qualche trasmissione scientifica) si parla di scioglimento dei ghiacciai. In realtà questo è un errore piuttosto grave: il ghiaccio fonde e NON si scioglie! Il concetto di fusione (passaggio di un materiale dallo stato da solido a quello liquido) è completamente diverso da quello di scioglimento (o più correttamente di solubilizzazione) in cui un materiale si scioglie in un altro (generalmente un liquido). Esperimento 3 Perché d inverno si butta il sale sulle strade? In un becher contenete un sistema acqua ghiaccio aggiungere una certa quantità di sale (NaCl, cloruro di sodio), formando una miscela. Che cosa succede alla temperatura? Quali altre osservazioni possiamo fare? Esperimento 4 Sublimazione e brinamento dello IODIO Prendere una beuta (chiusa con un tappo a vite) contenente alcuni cristalli di iodio (I 2 ) e riscaldare. Si osserva la sublimazione con lo sviluppo di vapori violetti e poi, raffreddando il sistema, il brinamento. L esperimento consente di vedere la diffusione di un gas in tutto il volume del recipiente dovuto al moto incessante e caotico delle particelle, tenendo conto che questo criterio generale permette di descrivere il moto di tutti i tipi di particelle (atomi, molecole e ioni) in qualsiasi genere di fluido.
9 2.3 Caratteristiche dei passaggi di stato È possibile ricavare le principali caratteristiche dei passaggi di stato riflettendo sugli esperimenti che abbiamo eseguito. In particolare abbiamo osservato che: 1) durante l ebollizione e la condensazione dell acqua distillata (esperimento 1), i due termometri (quello immerso nel liquido e quello a contatto con i vapori) indicavano la stessa temperatura (100 C) che restava costante nonostante si continuasse a riscaldare; 2) la temperatura del sistema che conteneva ghiaccio e acqua restava costante a 0 C (esperimento 2), per abbassarsi fino a 16 C, quando si aggiungeva del sale (esperimento 3). Riscaldando un materiale, come abbiamo visto, avvengono le trasformazioni solido liquido gassoso e sperimentalmente è possibile ottenere una curva di riscaldamento diagrammando la temperatura (sull asse delle ordinate) in funzione del tempo (sull asse delle ascisse). Ecco, per esempio, la curva di riscaldamento per l acqua: Curva di riscaldamento dell acqua Dalla curva di riscaldamento si può notare come l evidenza sperimentale che sta avvenendo un passaggio di stato sia la sosta termica cioè un periodo di tempo in cui la temperatura resta costante, nonostante si continui a riscaldare o raffreddare il sistema. Le soste termiche, però, non si verificano in tutti i materiali, ma solo nelle sostanze pure. Le miscele, al contrario, fondono in un certo range di temperatura e NON ad una temperatura definita (esperimento 3). Facendo un collegamento con il mondo particellare si può dire: Una sostanza bolle (o fonde o solidifica) ad una temperatura fissa perché le particelle presenti sono tutte uguali e legate da forze di coesione uniformi. Al contrario, le miscele non hanno soste termiche perché sono formate da diversi tipi di particelle che, riscaldando o raffreddando, si comportano in maniera differente. Per esempio, l olio di oliva fonde ad una temperatura compresa tra 7 e 0 C, in quanto è costituto da diversi tipi di particelle (di acidi grassi, di vitamine, ecc). I passaggi di stato avvengono in tutti i materiali ma solo quelli delle sostanze (i materiali formati da particelle tutte uguali tra di loro) sono caratterizzati dalle soste termiche.
10 Le soste termiche permettono di individuare le temperature a cui avvengono i corrispondenti passaggi di stato di una sostanza pura, per cui possiamo individuare la: 1) temperatura di fusione o punto di fusione (p.f.): è la temperatura alla quale una sostanza comincia a fondere. Tale temperatura resta costante per tutta la durata della fusione. Una sostanza pura fonde a una temperatura fissa e costante (vedi esperimento 2). 2) temperatura di ebollizione o punto di ebollizione (p.e.): è la temperatura alla quale un liquido bolle (ad una certa pressione), resta costante fino a quando il liquido non è diventato gas. Le soste termiche possono essere utilizzati per identificare se un materiale è una sostanza (si verifica una sosta termica durante il passaggio di stato) oppure una miscela (il passaggio di stato avviene senza sosta termica). Nel caso delle sostanze, le temperature di fusione, di ebollizione, ecc, sono proprietà (vedi Competenze di base Parte prima ) che possono essere utilizzate per il loro riconoscimento. Nella tabella sono indicate le temperature di fusione ed ebollizione di alcune sostanze: Sostanza pura Temperatura di fusione ( C) Temperatura ebollizione ( C) a 1 atm Alcool etilico ,3 Acqua Mercurio 38,4 357 Rame Piombo 327, Ossigeno I passaggi di stato opposti di una sostanza avvengono alla stessa temperatura (il ghiaccio fonde a 0 C e l acqua solidifica a 0 C) perché sono uno la controtrasformazione dell altro. 2.4 Passaggi di stato e pressione Dalla tabella precedente si vede come i valori relativi alle temperature di ebollizione siano stati ottenuti alla pressione di un atmosfera che corrisponde a quella ambiente. Le sostanze, come già accennato, possono, infatti, mutare il loro stato di aggregazione fondamentale non solo variando la temperatura, ma anche modificando la pressione che agisce in maniera inversa alla temperatura. È possibile, per esempio, trasformare alcuni gas in liquidi per semplice compressione (aumento della pressione) e questa proprietà è sfruttata negli accendini (butano) o nel GPL. Un aumento della pressione favorisce i passaggi gas liquido solido, mentre una sua diminuzione fa avvenire i passaggi di stato inversi.
11 Tra i passaggi di stato, l ebollizione è quello più influenzato da questo fattore; per esempio, a livello del mare (pressione 1 atmosfera = 760 mm Hg), l acqua bolle a 100 C, se si sale a 1200 metri di altezza l ebollizione avviene a 95 C, a pressioni pari a metà della pressione atmosferica normale (condizione che si verifica a circa 5500 metri di quota) l acqua bolle a 86 C, mentre agli 8848 metri del monte Everest, basterebbero solo 71 C. Quando si cuociono i cibi in alta montagna, l acqua raggiunge prima l ebollizione ma, avendo una temperatura più bassa, la cottura richiede un tempo più lungo. In queste condizioni, per esempio, la cottura della pasta avviene con difficoltà proprio perché non si raggiunge la temperatura necessaria alla degradazione degli amidi presenti. Al contrario, nella pentola a pressione gli alimenti cuociono più rapidamente, perché il vapore trattenuto al suo interno crea un aumento di pressione (fino al doppio rispetto a quella atmosferica), che consente all'acqua di bollire a una temperatura più alta, intorno ai C. La fusione e la relativa temperatura sono invece molto meno influenzate dalla pressione, perciò un suo aumento provoca solo un modesto abbassamento della temperatura di fusione. Un interessante applicazione di questo fenomeno riguarda lo sport del pattinaggio su ghiaccio. I pattinatori scivolano sul ghiaccio perché la forte pressione, esercitata dalla lama del pattino, abbassa il punto di fusione e quindi provoca la fusione superficiale del ghiaccio con formazione di una sottile pellicola di liquido su cui il pattino scivola. Appena la pressione torna al livello normale, il velo di acqua solidifica nuovamente. Analogamente, se si appoggia su un blocco di ghiaccio un sottile filo con due pesi agli estremi, la pressione esercitata da questo fa fondere il ghiaccio e il filo attraversa il blocco, ma non lo spezza. L acqua, infatti, solidifica nuovamente e, alla fine il filo con i pesi cade, ma il blocco di ghiaccio appare intatto. Un aumento della pressione fa aumentare la temperatura di ebollizione e diminuire quella di fusione. Parte sperimentale Esperimento 1 Come si può gonfiare il palloncino al contrario? Dopo la visione del filmato. Quali passaggi di stato si sono verificati nel sistema? Perché? Esperimento 2 Studio del sistema acqua/olio/ghiaccio Vi viene consegnato un contenitore in cui sono presenti acqua distillata e olio. Dopo qualche minuto al sistema precedente verrà aggiunta una cubetto di ghiaccio. Osservate i fenomeni che accadono e completate il questionario.
12 1) Descrivete le caratteristiche (stato di aggregazione, aspetto, colore, ecc.) del sistema acqua/olio.. 2) I due materiali interagiscono tra di loro? SI/NO perché. 3) Il sistema acqua/olio è APERTO/CHIUSO/ISOLATO perché 4) Il sistema acqua/olio è una miscela eterogenea/ miscela omogenea perché.... 5) Descrivete che cosa succede quando si introduce il cubetto di ghiaccio nel sistema acqua / olio:.. 6) Il sistema acqua, olio, ghiaccio è una miscela eterogenea / una soluzione, perché... 7) Il cubetto di ghiaccio: a) interagisce sia con l acqua che con l olio, perché. b) interagisce solo con l acqua, perché c) interagisce solo con l olio, perché d) non interagisce né con l olio, né con l acqua, perché 8) Avvengono delle trasformazioni fisiche? SI / NO 9) Se la risposta alla domanda precedente è SI, indicate quali trasformazioni fisiche sono avvenute... Giustificate la risposta... 10) Avvengono delle trasformazioni chimiche? SI / NO 11) Se la risposta alla domanda precedente è SI, indicate quali evidenze sperimentali sono avvenute... Esperimento 3 Sistema precedente più permanganato di potassio Dopo qualche minuto al sistema precedente verrà aggiunta una piccola quantità di un solido viola, il permanganato di potassio. Osservate i fenomeni che accadono e completate il questionario. 1) Descrivete la caratteristiche del permanganato di potassio.. 2) Descrivete che cosa succede quando si introduce il permanganato di potassio nel sistema acqua / olio / ghiaccio:... 3) Il permanganato di potassio: a) interagisce con tutti i materiali presenti, perché b) interagisce sia con l acqua che con l olio, perché. c) interagisce solo con l acqua, perché d) interagisce solo con l olio, perché e) interagisce solo con il ghiaccio, perché f) non interagisce con nessuno dei materiali presenti, perché 4) Il sistema acqua, olio, permanganato, ghiaccio è una miscela eterogenea / una soluzione perché... 5) Il sottosistema acqua e permanganato prima di agitare è una miscela eterogenea / miscela omogenea perché.. 6) Il sottosistema acqua e permanganato dopo aver agitato è una miscela eterogenea / soluzione perché. 7) Avvengono delle trasformazioni fisiche? SI / NO 8) Se la risposta alla domanda precedente è SI, indicate quali trasformazioni fisiche sono avvenute... Giustificate la risposta... 9) Avvengono delle trasformazioni chimiche? SI / NO 10) Se la risposta alla domanda precedente è SI, indicate quali evidenze sperimentali sono avvenute...
La scuola integra culture. Scheda3c
 Scheda3c Gli ELEMENTI DEL CLIMA che caratterizzano le condizioni meteorologiche di una regione sono: la temperatura, la pressione atmosferica, i venti, l umidità e le precipitazioni. La temperatura è data
Scheda3c Gli ELEMENTI DEL CLIMA che caratterizzano le condizioni meteorologiche di una regione sono: la temperatura, la pressione atmosferica, i venti, l umidità e le precipitazioni. La temperatura è data
La materia. La materia è ogni cosa che occupa uno spazio (e possiamo percepire con i nostri sensi).
 La materia La materia è ogni cosa che occupa uno spazio (e possiamo percepire con i nostri sensi). Essa è costituita da sostanze, ciascuna delle quali è formata da un determinato tipo di particelle piccolissime,
La materia La materia è ogni cosa che occupa uno spazio (e possiamo percepire con i nostri sensi). Essa è costituita da sostanze, ciascuna delle quali è formata da un determinato tipo di particelle piccolissime,
Capitolo 2 Le trasformazioni fisiche della materia
 Capitolo 2 Le trasformazioni fisiche della materia 1.Gli stati fisici della materia 2.I sistemi omogenei e i sistemi eterogenei 3.Le sostanze pure e i miscugli 4.I passaggi di stato 5. la teoria particellare
Capitolo 2 Le trasformazioni fisiche della materia 1.Gli stati fisici della materia 2.I sistemi omogenei e i sistemi eterogenei 3.Le sostanze pure e i miscugli 4.I passaggi di stato 5. la teoria particellare
GAS. I gas si assomigliano tutti
 I gas si assomigliano tutti Aeriforme liquido solido GAS Descrizione macroscopica e microscopica degli stati di aggregazione della materia Fornendo energia al sistema, le forze di attrazione tra le particelle
I gas si assomigliano tutti Aeriforme liquido solido GAS Descrizione macroscopica e microscopica degli stati di aggregazione della materia Fornendo energia al sistema, le forze di attrazione tra le particelle
Acqua azzurra, acqua chiara. Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao
 Acqua azzurra, acqua chiara Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao Proprietà fisiche Ecosistemi acquatici Origine della vita Ciclo dell acqua Acqua Scoperte Sensazioni Leggi La
Acqua azzurra, acqua chiara Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao Proprietà fisiche Ecosistemi acquatici Origine della vita Ciclo dell acqua Acqua Scoperte Sensazioni Leggi La
TEORIA CINETICA DEI GAS
 TEORIA CINETICA DEI GAS La teoria cinetica dei gas è corrispondente con, e infatti prevede, le proprietà dei gas. Nella materia gassosa, gli atomi o le molecole sono separati da grandi distanze e sono
TEORIA CINETICA DEI GAS La teoria cinetica dei gas è corrispondente con, e infatti prevede, le proprietà dei gas. Nella materia gassosa, gli atomi o le molecole sono separati da grandi distanze e sono
Che cosa è la materia?
 Che cosa è la materia? Tutti gli oggetti e le sostanze che ci stanno intorno sono costituite da materia. Ma che cosa è la materia? Il banco, la cattedra occupano uno spazio nell aula a causa del loro volume,
Che cosa è la materia? Tutti gli oggetti e le sostanze che ci stanno intorno sono costituite da materia. Ma che cosa è la materia? Il banco, la cattedra occupano uno spazio nell aula a causa del loro volume,
Termodinamica. Sistema termodinamico. Piano di Clapeyron. Sistema termodinamico. Esempio. Cosa è la termodinamica? TERMODINAMICA
 Termodinamica TERMODINAMICA Cosa è la termodinamica? La termodinamica studia la conversione del calore in lavoro meccanico Prof Crosetto Silvio 2 Prof Crosetto Silvio Il motore dell automobile trasforma
Termodinamica TERMODINAMICA Cosa è la termodinamica? La termodinamica studia la conversione del calore in lavoro meccanico Prof Crosetto Silvio 2 Prof Crosetto Silvio Il motore dell automobile trasforma
CALORE. Compie lavoro. Il calore è energia. Temperatura e calore. L energia è la capacità di un corpo di compiere un lavoro
 Cos è il calore? Per rispondere si osservino le seguenti immagini Temperatura e calore Il calore del termosifone fa girare una girandola Il calore del termosifone fa scoppiare un palloncino Il calore del
Cos è il calore? Per rispondere si osservino le seguenti immagini Temperatura e calore Il calore del termosifone fa girare una girandola Il calore del termosifone fa scoppiare un palloncino Il calore del
Liquidi, Solidi e Forze Intermolecolari
 Liquidi, Solidi e Forze Intermolecolari Distanze tra molecole Stati Fisici (Fase) Comportamento atipico La maggiore differenza tra liquidi e solidi consiste nella libertà di movimento delle loro molecole
Liquidi, Solidi e Forze Intermolecolari Distanze tra molecole Stati Fisici (Fase) Comportamento atipico La maggiore differenza tra liquidi e solidi consiste nella libertà di movimento delle loro molecole
13 La temperatura - 8. Il gas perfetto
 La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
MATERIA: tutto ciò che ha una MASSA, occupa un VOLUME e ha ENERGIA
 La materia La materia MATERIA: tutto ciò che ha una MASSA, occupa un VOLUME e ha ENERGIA Il mondo che ci circonda è costituito da materia. La chimica studia le proprietà della materia e i suoi cambiamenti.
La materia La materia MATERIA: tutto ciò che ha una MASSA, occupa un VOLUME e ha ENERGIA Il mondo che ci circonda è costituito da materia. La chimica studia le proprietà della materia e i suoi cambiamenti.
Temperatura e Calore
 Temperatura e Calore 1 Temperatura e Calore Stati di Aggregazione Temperatura Scale Termometriche Dilatazione Termica Il Calore L Equilibrio Termico La Propagazione del Calore I Passaggi di Stato 2 Gli
Temperatura e Calore 1 Temperatura e Calore Stati di Aggregazione Temperatura Scale Termometriche Dilatazione Termica Il Calore L Equilibrio Termico La Propagazione del Calore I Passaggi di Stato 2 Gli
FISICA-TECNICA Miscela di gas e vapori. Igrometria
 FISICA-TECNICA Miscela di gas e vapori. Igrometria Katia Gallucci Spesso è necessario variare il contenuto di vapore presente in una corrente gassosa. Lo studio di come si possono realizzare queste variazioni
FISICA-TECNICA Miscela di gas e vapori. Igrometria Katia Gallucci Spesso è necessario variare il contenuto di vapore presente in una corrente gassosa. Lo studio di come si possono realizzare queste variazioni
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
La propagazione delle onde luminose può essere studiata per mezzo delle equazioni di Maxwell. Tuttavia, nella maggior parte dei casi è possibile
 Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it
 LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
CORRENTE E TENSIONE ELETTRICA LA CORRENTE ELETTRICA
 CORRENTE E TENSIONE ELETTRICA La conoscenza delle grandezze elettriche fondamentali (corrente e tensione) è indispensabile per definire lo stato di un circuito elettrico. LA CORRENTE ELETTRICA DEFINIZIONE:
CORRENTE E TENSIONE ELETTRICA La conoscenza delle grandezze elettriche fondamentali (corrente e tensione) è indispensabile per definire lo stato di un circuito elettrico. LA CORRENTE ELETTRICA DEFINIZIONE:
GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato gassoso
 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
Termologia. Introduzione Scale Termometriche Espansione termica Capacità termica e calori specifici Cambiamenti di fase e calori latenti
 Termologia Introduzione Scale Termometriche Espansione termica Capacità termica e calori specifici Cambiamenti di fase e calori latenti Trasmissione del calore Legge di Wien Legge di Stefan-Boltzmann Gas
Termologia Introduzione Scale Termometriche Espansione termica Capacità termica e calori specifici Cambiamenti di fase e calori latenti Trasmissione del calore Legge di Wien Legge di Stefan-Boltzmann Gas
IL TEMPO METEOROLOGICO
 VOLUME 1 CAPITOLO 4 MODULO D LE VENTI REGIONI ITALIANE IL TEMPO METEOROLOGICO 1. Parole per capire A. Conosci già queste parole? Scrivi il loro significato o fai un disegno: tempo... Sole... luce... caldo...
VOLUME 1 CAPITOLO 4 MODULO D LE VENTI REGIONI ITALIANE IL TEMPO METEOROLOGICO 1. Parole per capire A. Conosci già queste parole? Scrivi il loro significato o fai un disegno: tempo... Sole... luce... caldo...
ISTITUTO COMPRENSIVO G.MARITI Corso della Repubblica, 125 Fauglia (PI) LABORATORI DEI SAPERI SCIENTIFICI 2013-2014 DIARIO DEL GRUPPO
 ISTITUTO COMPRENSIVO G.MARITI Corso della Repubblica, 125 Fauglia (PI) LABORATORI DEI SAPERI SCIENTIFICI 2013-2014 SCUOLA: Secondaria di I grado Benci " Santa Luce CLASSE/SEZIONE :1 F INSEGNANTE: ORLANDINI
ISTITUTO COMPRENSIVO G.MARITI Corso della Repubblica, 125 Fauglia (PI) LABORATORI DEI SAPERI SCIENTIFICI 2013-2014 SCUOLA: Secondaria di I grado Benci " Santa Luce CLASSE/SEZIONE :1 F INSEGNANTE: ORLANDINI
CICLO DELL ACQUA. Marco Carozzi
 CICLO DELL ACQUA Marco Carozzi Sommario Ciclo biogeochimico La molecola d acqua: breve introduzione Ciclo dell acqua ed elementi del ciclo evaporazione, evapotraspirazione, condensazione, precipitazioni,
CICLO DELL ACQUA Marco Carozzi Sommario Ciclo biogeochimico La molecola d acqua: breve introduzione Ciclo dell acqua ed elementi del ciclo evaporazione, evapotraspirazione, condensazione, precipitazioni,
CHIMICA. Una teoria è scientifica solo se è falsificabile (cioè se è possibile sperimentalmente smentire le sue previsioni)
 CHIMICA SCIENZA SPERIMENTALE: cioè si basa sul metodo sperimentale (Galileo è il precursore). Osservazione dei fenomeni (raccolta e interpretazioni dati) Formulazione ipotesi Verifica sperimentale (eventualmente
CHIMICA SCIENZA SPERIMENTALE: cioè si basa sul metodo sperimentale (Galileo è il precursore). Osservazione dei fenomeni (raccolta e interpretazioni dati) Formulazione ipotesi Verifica sperimentale (eventualmente
SCIENZE. Le scienze e il metodo sperimentale, la materia e le sue proprietà. Le scienze e il metodo sperimentale 01.1
 il testo: 01.1 sperimentale Le scienze studiano i fenomeni della natura (fenomeni naturali). Spesso noi osserviamo la natura e ci chiediamo perché avvengono certi fenomeni. Ad esempio, ti sarà capitato
il testo: 01.1 sperimentale Le scienze studiano i fenomeni della natura (fenomeni naturali). Spesso noi osserviamo la natura e ci chiediamo perché avvengono certi fenomeni. Ad esempio, ti sarà capitato
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
LEZIONE 1. Materia: Proprietà e Misura
 LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
Termodinamica: legge zero e temperatura
 Termodinamica: legge zero e temperatura Affrontiamo ora lo studio della termodinamica che prende in esame l analisi dell energia termica dei sistemi e di come tale energia possa essere scambiata, assorbita
Termodinamica: legge zero e temperatura Affrontiamo ora lo studio della termodinamica che prende in esame l analisi dell energia termica dei sistemi e di come tale energia possa essere scambiata, assorbita
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di
 La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di un solido (polvere) che diverrà il ceramico, con un
La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di un solido (polvere) che diverrà il ceramico, con un
Esperimenti Informazioni per il PD
 Informazioni per il PD 1/7 Compito Gli alunni conducono degli esperimenti con il sale avendo così la possibilità di studiarlo in quanto composto chimico. Grazie ai vari esperimenti imparano anche quali
Informazioni per il PD 1/7 Compito Gli alunni conducono degli esperimenti con il sale avendo così la possibilità di studiarlo in quanto composto chimico. Grazie ai vari esperimenti imparano anche quali
SINTESI C1. Materia ed energia
 Le proprietà fisiche della materia Il mondo che ci circonda è formato da un gran numero di oggetti diversi. Siano essi di origine naturale o creati dagli esseri umani questi oggetti in chimica e fisica
Le proprietà fisiche della materia Il mondo che ci circonda è formato da un gran numero di oggetti diversi. Siano essi di origine naturale o creati dagli esseri umani questi oggetti in chimica e fisica
IL CAMPO MAGNETICO. V Scientifico Prof.ssa Delfino M. G.
 IL CAMPO MAGNETICO V Scientifico Prof.ssa Delfino M. G. UNITÀ - IL CAMPO MAGNETICO 1. Fenomeni magnetici 2. Calcolo del campo magnetico 3. Forze su conduttori percorsi da corrente 4. La forza di Lorentz
IL CAMPO MAGNETICO V Scientifico Prof.ssa Delfino M. G. UNITÀ - IL CAMPO MAGNETICO 1. Fenomeni magnetici 2. Calcolo del campo magnetico 3. Forze su conduttori percorsi da corrente 4. La forza di Lorentz
Corso competenze di base Ambito chimico
 Laboratorio di Chimica dell ITIS E.Majorana di Grugliasco (www.itismajo.it/chimica) Corso competenze di base Ambito chimico (Prima parte) La dispensa è stata realizzata dalla prof. A. Martini con la collaborazione,
Laboratorio di Chimica dell ITIS E.Majorana di Grugliasco (www.itismajo.it/chimica) Corso competenze di base Ambito chimico (Prima parte) La dispensa è stata realizzata dalla prof. A. Martini con la collaborazione,
V= R*I. LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro.
 LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
MISCUGLI E TECNICHE DI SEPARAZIONE
 MISCUGLI E TECNICHE DI SEPARAZIONE Classe 1^A Grafico Questo documento è solo una presentazione e non deve ritenersi completo se non è accompagnato dalla lezione in classe. Prof. Zarini Marta CLASSIFICAZIONE
MISCUGLI E TECNICHE DI SEPARAZIONE Classe 1^A Grafico Questo documento è solo una presentazione e non deve ritenersi completo se non è accompagnato dalla lezione in classe. Prof. Zarini Marta CLASSIFICAZIONE
LA CORRENTE ELETTRICA
 L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
Questa proprietà, posseduta da alcuni corpi, viene definita MAGNETISMO.
 MAGNETISMO Cos è il MAGNETISMO Sin dall'antichità era noto che un minerale di ferro, la magnetite, ha la proprietà di attirare il ferro. Questa proprietà, posseduta da alcuni corpi, viene definita MAGNETISMO.
MAGNETISMO Cos è il MAGNETISMO Sin dall'antichità era noto che un minerale di ferro, la magnetite, ha la proprietà di attirare il ferro. Questa proprietà, posseduta da alcuni corpi, viene definita MAGNETISMO.
TERMOMETRIA E PROCESSI TERMICI
 TERMOMETRIA E PROCESSI TERMICI SISTEMA parte di materia e/o spazio, idealmente isolata, su cui si concentra ntra l attenzione dell osservatore AMBIENTE ESTERNO tutto ciò che sta al di fuori, ma pur sempre
TERMOMETRIA E PROCESSI TERMICI SISTEMA parte di materia e/o spazio, idealmente isolata, su cui si concentra ntra l attenzione dell osservatore AMBIENTE ESTERNO tutto ciò che sta al di fuori, ma pur sempre
P.D 4 Acqua come solvente P.D 4A Miscugli e separazione di miscugli Schede esperimenti Scuola secondaria di primo grado
 P.D 4 Acqua come solvente P.D 4A Miscugli e separazione di miscugli Schede esperimenti Scuola secondaria di primo grado ESPERIENZA: LE SOLUZIONI 3 bicchierini di plastica trasparenti sale zucchero Riempiamo
P.D 4 Acqua come solvente P.D 4A Miscugli e separazione di miscugli Schede esperimenti Scuola secondaria di primo grado ESPERIENZA: LE SOLUZIONI 3 bicchierini di plastica trasparenti sale zucchero Riempiamo
'RPDQGHFRQFHWWXDOL Alcuni interrogativi su fenomeni fisici e chimici
 ,OPDWHULDOHGLGDWWLFRFKHVHJXHqVWDWRVFHOWRWUDGRWWRHDGDWWDWRGDO*UXSSRGLFKLPLFD GHOO,7,60DMRUDQDGL*UXJOLDVFR7RULQR0DUFR)DODVFD$QJHOR&LPHQLV3DROD&RVFLD /RUHGDQD$QJHOHUL$QWRQHOOD0DUWLQL'DULR*D]]ROD*UD]LD5L]]R*LXVL'L'LR
,OPDWHULDOHGLGDWWLFRFKHVHJXHqVWDWRVFHOWRWUDGRWWRHDGDWWDWRGDO*UXSSRGLFKLPLFD GHOO,7,60DMRUDQDGL*UXJOLDVFR7RULQR0DUFR)DODVFD$QJHOR&LPHQLV3DROD&RVFLD /RUHGDQD$QJHOHUL$QWRQHOOD0DUWLQL'DULR*D]]ROD*UD]LD5L]]R*LXVL'L'LR
Appunti sul galleggiamento
 Appunti sul galleggiamento Prof.sa Enrica Giordano Corso di Didattica della fisica 1B a.a. 2006/7 Ad uso esclusivo degli studenti frequentanti, non diffondere senza l autorizzazione della professoressa
Appunti sul galleggiamento Prof.sa Enrica Giordano Corso di Didattica della fisica 1B a.a. 2006/7 Ad uso esclusivo degli studenti frequentanti, non diffondere senza l autorizzazione della professoressa
LA CORRENTE ELETTRICA CONTINUA
 LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
LE SUCCESSIONI 1. COS E UNA SUCCESSIONE
 LE SUCCESSIONI 1. COS E UNA SUCCESSIONE La sequenza costituisce un esempio di SUCCESSIONE. Ecco un altro esempio di successione: Una successione è dunque una sequenza infinita di numeri reali (ma potrebbe
LE SUCCESSIONI 1. COS E UNA SUCCESSIONE La sequenza costituisce un esempio di SUCCESSIONE. Ecco un altro esempio di successione: Una successione è dunque una sequenza infinita di numeri reali (ma potrebbe
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
IL RISPARMIO ENERGETICO E GLI AZIONAMENTI A VELOCITA VARIABILE L utilizzo dell inverter negli impianti frigoriferi.
 IL RISPARMIO ENERGETICO E GLI AZIONAMENTI A VELOCITA VARIABILE L utilizzo dell inverter negli impianti frigoriferi. Negli ultimi anni, il concetto di risparmio energetico sta diventando di fondamentale
IL RISPARMIO ENERGETICO E GLI AZIONAMENTI A VELOCITA VARIABILE L utilizzo dell inverter negli impianti frigoriferi. Negli ultimi anni, il concetto di risparmio energetico sta diventando di fondamentale
Nascita e morte delle stelle
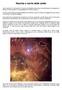 Nascita e morte delle stelle Se la materia che componeva l universo primordiale fosse stata tutta perfettamente omogenea e diffusa in modo uguale, non esisterebbero né stelle né pianeti. C erano invece
Nascita e morte delle stelle Se la materia che componeva l universo primordiale fosse stata tutta perfettamente omogenea e diffusa in modo uguale, non esisterebbero né stelle né pianeti. C erano invece
Energia e Lavoro. In pratica, si determina la dipendenza dallo spazio invece che dal tempo
 Energia e Lavoro Finora abbiamo descritto il moto dei corpi (puntiformi) usando le leggi di Newton, tramite le forze; abbiamo scritto l equazione del moto, determinato spostamento e velocità in funzione
Energia e Lavoro Finora abbiamo descritto il moto dei corpi (puntiformi) usando le leggi di Newton, tramite le forze; abbiamo scritto l equazione del moto, determinato spostamento e velocità in funzione
Le proprietà periodiche degli elementi LA LEZIONE
 Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Prova scritta di Fisica Generale I Corso di studio in Astronomia 22 giugno 2012
 Prova scritta di Fisica Generale I Corso di studio in Astronomia 22 giugno 2012 Problema 1 Due carrelli A e B, di massa m A = 104 kg e m B = 128 kg, collegati da una molla di costante elastica k = 3100
Prova scritta di Fisica Generale I Corso di studio in Astronomia 22 giugno 2012 Problema 1 Due carrelli A e B, di massa m A = 104 kg e m B = 128 kg, collegati da una molla di costante elastica k = 3100
SISTEMA BINARIO DI DUE LIQUIDI VOLATILI TOTALMENTE MISCIBILI che seguono Raoult
 SISTEM INRIO DI DUE IQUIDI OTII MENTE MISCIII che seguono Raoult Consideriamo due liquidi e totalmente miscibili di composizione χ e χ presenti in un contenitore ad una certa temperatura T=T 1. o strato
SISTEM INRIO DI DUE IQUIDI OTII MENTE MISCIII che seguono Raoult Consideriamo due liquidi e totalmente miscibili di composizione χ e χ presenti in un contenitore ad una certa temperatura T=T 1. o strato
Sono state usate altre scale ma sono tutte in disuso (Reamur e Rankine ad esempio).
 Le scale termometriche (UbiMath) - 1 Scale termometriche La temperatura di un corpo non dipende dalle nostre sensazioni. Le sensazioni di caldo e freddo dipendono dal calore che i vari oggetti scambiano
Le scale termometriche (UbiMath) - 1 Scale termometriche La temperatura di un corpo non dipende dalle nostre sensazioni. Le sensazioni di caldo e freddo dipendono dal calore che i vari oggetti scambiano
MASSA VOLUMICA o DENSITA
 MASSA VOLUMICA o DENSITA Massa volumica di una sostanza: è la massa di sostanza, espressa in kg, che occupa un volume pari a 1 m 3 1 m 3 di aria ha la massa di 1,2 kg 1 m 3 di acqua ha la massa di 1000
MASSA VOLUMICA o DENSITA Massa volumica di una sostanza: è la massa di sostanza, espressa in kg, che occupa un volume pari a 1 m 3 1 m 3 di aria ha la massa di 1,2 kg 1 m 3 di acqua ha la massa di 1000
IL SOLE. Il Sole è una stella cioè un corpo che emette luce ed energia ed è formato da gas, principalmente idrogeno (74%) ed elio (24%)
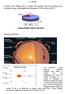 IL SOLE Il Sole è una stella cioè un corpo che emette luce ed energia ed è formato da gas, principalmente idrogeno (74%) ed elio (24%) Struttura del Sole 0 - nel NUCLEO viene prodotta l energia emessa
IL SOLE Il Sole è una stella cioè un corpo che emette luce ed energia ed è formato da gas, principalmente idrogeno (74%) ed elio (24%) Struttura del Sole 0 - nel NUCLEO viene prodotta l energia emessa
LA TERMOLOGIA. studia le variazioni di dimensione di un corpo a causa di una
 LA TERMOLOGIA La termologia è la parte della fisica che si occupa dello studio del calore e dei fenomeni legati alle variazioni di temperatura subite dai corpi. Essa si può distinguere in: Termometria
LA TERMOLOGIA La termologia è la parte della fisica che si occupa dello studio del calore e dei fenomeni legati alle variazioni di temperatura subite dai corpi. Essa si può distinguere in: Termometria
Quiz di scienze l acqua
 Quiz di scienze l acqua 1. Da cos e composta l acqua? Idrogeno e ossigeno Tanti piccoli animaletti trasparenti chiamati pesci acquiferi E uno dei misteri dell umanita, gli scienziati non sono ancora riusciti
Quiz di scienze l acqua 1. Da cos e composta l acqua? Idrogeno e ossigeno Tanti piccoli animaletti trasparenti chiamati pesci acquiferi E uno dei misteri dell umanita, gli scienziati non sono ancora riusciti
La combustione. Docente: prof.ssa Lobello Carmela
 La combustione Percorso didattico realizzato dalla classe II D Istituto d Istruzione secondaria di I grado S Francesco d Assisi Francavilla Fontana (Br) Docente: prof.ssa Lobello Carmela Perché la combustione?
La combustione Percorso didattico realizzato dalla classe II D Istituto d Istruzione secondaria di I grado S Francesco d Assisi Francavilla Fontana (Br) Docente: prof.ssa Lobello Carmela Perché la combustione?
Stati di aggregazione della materia unità 2, modulo A del libro
 Stati di aggregazione della materia unità 2, modulo A del libro Gli stati di aggregazione della materia sono tre: solido, liquido e gassoso, e sono caratterizzati dalle seguenti grandezze: Quantità --->
Stati di aggregazione della materia unità 2, modulo A del libro Gli stati di aggregazione della materia sono tre: solido, liquido e gassoso, e sono caratterizzati dalle seguenti grandezze: Quantità --->
 Il passaggio dal qualitativo al quantitativo: quando è necessario misurare Le condizioni delle misure: individuazione e controllo delle variabili significative Determinare una grandezza misurandone un
Il passaggio dal qualitativo al quantitativo: quando è necessario misurare Le condizioni delle misure: individuazione e controllo delle variabili significative Determinare una grandezza misurandone un
MODULO 3 - LA MATERIA: COMPOSIZIONE E TRASFORMAZIONI
 MODULO 3 - LA MATERIA: COMPOSIZIONE E TRASFORMAZIONI La materia è tutto ciò che ha una massa, energia e occupa spazio, cioè ha un volume; essa si classifica in base alla sua composizione chimica ed in
MODULO 3 - LA MATERIA: COMPOSIZIONE E TRASFORMAZIONI La materia è tutto ciò che ha una massa, energia e occupa spazio, cioè ha un volume; essa si classifica in base alla sua composizione chimica ed in
9. Urti e conservazione della quantità di moto.
 9. Urti e conservazione della quantità di moto. 1 Conservazione dell impulso m1 v1 v2 m2 Prima Consideriamo due punti materiali di massa m 1 e m 2 che si muovono in una dimensione. Supponiamo che i due
9. Urti e conservazione della quantità di moto. 1 Conservazione dell impulso m1 v1 v2 m2 Prima Consideriamo due punti materiali di massa m 1 e m 2 che si muovono in una dimensione. Supponiamo che i due
SENSORI E TRASDUTTORI
 SENSORI E TRASDUTTORI Il controllo di processo moderno utilizza tecnologie sempre più sofisticate, per minimizzare i costi e contenere le dimensioni dei dispositivi utilizzati. Qualsiasi controllo di processo
SENSORI E TRASDUTTORI Il controllo di processo moderno utilizza tecnologie sempre più sofisticate, per minimizzare i costi e contenere le dimensioni dei dispositivi utilizzati. Qualsiasi controllo di processo
Pressione. Esempio. Definizione di pressione. Legge di Stevino. Pressione nei fluidi EQUILIBRIO E CONSERVAZIONE DELL ENERGIA NEI FLUIDI
 Pressione EQUILIBRIO E CONSERVAZIONE DELL ENERGIA NEI FLUIDI Cos è la pressione? La pressione è una grandezza che lega tra di loro l intensità della forza e l aerea della superficie su cui viene esercitata
Pressione EQUILIBRIO E CONSERVAZIONE DELL ENERGIA NEI FLUIDI Cos è la pressione? La pressione è una grandezza che lega tra di loro l intensità della forza e l aerea della superficie su cui viene esercitata
Calore e temperatura. Calore e temperatura. Cos'è il calore? Il calore si chiama anche energia termica.
 sono due cose diverse (in scienze si dice sono due grandezze diverse). 01.1 Cos'è il calore? Per spiegare cos è il calore facciamo degli esempi. Esempi: quando ci avviciniamo o tocchiamo un oggetto caldo
sono due cose diverse (in scienze si dice sono due grandezze diverse). 01.1 Cos'è il calore? Per spiegare cos è il calore facciamo degli esempi. Esempi: quando ci avviciniamo o tocchiamo un oggetto caldo
Corso di Componenti e Impianti Termotecnici LE RETI DI DISTRIBUZIONE PERDITE DI CARICO LOCALIZZATE
 LE RETI DI DISTRIBUZIONE PERDITE DI CARICO LOCALIZZATE 1 PERDITE DI CARICO LOCALIZZATE Sono le perdite di carico (o di pressione) che un fluido, in moto attraverso un condotto, subisce a causa delle resistenze
LE RETI DI DISTRIBUZIONE PERDITE DI CARICO LOCALIZZATE 1 PERDITE DI CARICO LOCALIZZATE Sono le perdite di carico (o di pressione) che un fluido, in moto attraverso un condotto, subisce a causa delle resistenze
Usando il pendolo reversibile di Kater
 Usando il pendolo reversibile di Kater Scopo dell esperienza è la misurazione dell accelerazione di gravità g attraverso il periodo di oscillazione di un pendolo reversibile L accelerazione di gravità
Usando il pendolo reversibile di Kater Scopo dell esperienza è la misurazione dell accelerazione di gravità g attraverso il periodo di oscillazione di un pendolo reversibile L accelerazione di gravità
Capitolo 7. Le soluzioni
 Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
La corrente elettrica
 PROGRAMMA OPERATIVO NAZIONALE Fondo Sociale Europeo "Competenze per lo Sviluppo" Obiettivo C-Azione C1: Dall esperienza alla legge: la Fisica in Laboratorio La corrente elettrica Sommario 1) Corrente elettrica
PROGRAMMA OPERATIVO NAZIONALE Fondo Sociale Europeo "Competenze per lo Sviluppo" Obiettivo C-Azione C1: Dall esperienza alla legge: la Fisica in Laboratorio La corrente elettrica Sommario 1) Corrente elettrica
LA MATERIA MATERIA. COMPOSIZIONE (struttura) Atomi che la compongono
 LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
Estrazione del DNA. 1. Introduzione
 Estrazione del DNA 1. Introduzione L obiettivo di questa esperienza è quello di osservare la molecola degli acidi nucleici, una volta separata dall involucro cellulare in cui è contenuta all interno della
Estrazione del DNA 1. Introduzione L obiettivo di questa esperienza è quello di osservare la molecola degli acidi nucleici, una volta separata dall involucro cellulare in cui è contenuta all interno della
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
Forza. Forza. Esempi di forze. Caratteristiche della forza. Forze fondamentali CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA
 Forza CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA Cos è una forza? la forza è una grandezza che agisce su un corpo cambiando la sua velocità e provocando una deformazione sul corpo 2 Esempi
Forza CONCETTO DI FORZA E EQUILIBRIO, PRINCIPI DELLA DINAMICA Cos è una forza? la forza è una grandezza che agisce su un corpo cambiando la sua velocità e provocando una deformazione sul corpo 2 Esempi
Università degli studi di Messina facoltà di Scienze mm ff nn. Progetto Lauree Scientifiche (FISICA) Prisma ottico
 Università degli studi di Messina facoltà di Scienze mm ff nn Progetto Lauree Scientifiche (FISICA) Prisma ottico Parte teorica Fenomenologia di base La luce che attraversa una finestra, un foro, una fenditura,
Università degli studi di Messina facoltà di Scienze mm ff nn Progetto Lauree Scientifiche (FISICA) Prisma ottico Parte teorica Fenomenologia di base La luce che attraversa una finestra, un foro, una fenditura,
CICLO FRIGORIFERO PER RAFFREDDAMENTO
 CICLO FRIGORIFERO PER RAFFREDDAMENTO REGIONE CALDA Liquido saturo o sottoraffreddato Q out 3 2 Vapore surriscaldato valvola di espansione condensatore compressore P c evaporatore 4 1 Miscela bifase liquidovapore
CICLO FRIGORIFERO PER RAFFREDDAMENTO REGIONE CALDA Liquido saturo o sottoraffreddato Q out 3 2 Vapore surriscaldato valvola di espansione condensatore compressore P c evaporatore 4 1 Miscela bifase liquidovapore
Meccanica e Macchine
 Introduzione alle macchine Meccanica e Macchine La statica tratta lo studio dell equilibrio dei corpi, si occupa delle forze, dei baricentri delle leve e delle travi. La cinematica tratta lo studio del
Introduzione alle macchine Meccanica e Macchine La statica tratta lo studio dell equilibrio dei corpi, si occupa delle forze, dei baricentri delle leve e delle travi. La cinematica tratta lo studio del
Capitolo 13: L offerta dell impresa e il surplus del produttore
 Capitolo 13: L offerta dell impresa e il surplus del produttore 13.1: Introduzione L analisi dei due capitoli precedenti ha fornito tutti i concetti necessari per affrontare l argomento di questo capitolo:
Capitolo 13: L offerta dell impresa e il surplus del produttore 13.1: Introduzione L analisi dei due capitoli precedenti ha fornito tutti i concetti necessari per affrontare l argomento di questo capitolo:
Proprieta meccaniche dei fluidi
 Proprieta meccaniche dei fluidi 1. Definizione di fluido: liquido o gas 2. La pressione in un fluido 3. Equilibrio nei fluidi: legge di Stevino 4. Il Principio di Pascal 5. Il barometro di Torricelli 6.
Proprieta meccaniche dei fluidi 1. Definizione di fluido: liquido o gas 2. La pressione in un fluido 3. Equilibrio nei fluidi: legge di Stevino 4. Il Principio di Pascal 5. Il barometro di Torricelli 6.
Temperatura. V(t) = Vo (1+at) Strumento di misura: termometro
 I FENOMENI TERMICI Temperatura Calore Trasformazioni termodinamiche Gas perfetti Temperatura assoluta Gas reali Principi della Termodinamica Trasmissione del calore Termoregolazione del corpo umano Temperatura
I FENOMENI TERMICI Temperatura Calore Trasformazioni termodinamiche Gas perfetti Temperatura assoluta Gas reali Principi della Termodinamica Trasmissione del calore Termoregolazione del corpo umano Temperatura
LO STATO GASSOSO. Proprietà fisiche dei gas Leggi dei gas Legge dei gas ideali Teoria cinetico-molecolare dei gas Solubilità dei gas nei liquidi
 LO STATO GASSOSO Proprietà fisiche dei gas Leggi dei gas Legge dei gas ideali Teoria cinetico-molecolare dei gas Solubilità dei gas nei liquidi STATO GASSOSO Un sistema gassoso è costituito da molecole
LO STATO GASSOSO Proprietà fisiche dei gas Leggi dei gas Legge dei gas ideali Teoria cinetico-molecolare dei gas Solubilità dei gas nei liquidi STATO GASSOSO Un sistema gassoso è costituito da molecole
DAI MISCUGLI ALLE SOSTANZE PURE
 Come si presenta la materia? DAI MISCUGLI ALLE SOSTANZE PURE Il criterio per distinguere i materiali è la presenza di una o più FASI porzioni di materia fisicamente distinte tra loro delimitate da nette
Come si presenta la materia? DAI MISCUGLI ALLE SOSTANZE PURE Il criterio per distinguere i materiali è la presenza di una o più FASI porzioni di materia fisicamente distinte tra loro delimitate da nette
LA FORZA. Il movimento: dal come al perché
 LA FORZA Concetto di forza Principi della Dinamica: 1) Principio d inerzia 2) F=ma 3) Principio di azione e reazione Forza gravitazionale e forza peso Accelerazione di gravità Massa, peso, densità pag.1
LA FORZA Concetto di forza Principi della Dinamica: 1) Principio d inerzia 2) F=ma 3) Principio di azione e reazione Forza gravitazionale e forza peso Accelerazione di gravità Massa, peso, densità pag.1
Cognome. Nome Classe 1^ VERIFICA DI CHIMICA Recupero trimestre Data NB troverai le soluzioni nel testo in grassetto o sottolineato
 Cognome. Nome Classe 1^ ERIICA DI CHIMICA Recupero trimestre Data NB troverai le soluzioni nel testo in grassetto o sottolineato 1. Quale dei seguenti enunciati non descrive lo stato liquido? a) le particelle
Cognome. Nome Classe 1^ ERIICA DI CHIMICA Recupero trimestre Data NB troverai le soluzioni nel testo in grassetto o sottolineato 1. Quale dei seguenti enunciati non descrive lo stato liquido? a) le particelle
SOLUZIONI E MISCUGLI PERCORSO PER LA SCUOLA ELEMENTARE
 SOLUZIONI E MISCUGLI PERCORSO PER LA SCUOLA ELEMENTARE 1 STADIO Identificazione e definizione delle soluzioni Obiettivo : il bambino, attraverso un approccio fenomenologico, impara il concetto di SOLUZIONE
SOLUZIONI E MISCUGLI PERCORSO PER LA SCUOLA ELEMENTARE 1 STADIO Identificazione e definizione delle soluzioni Obiettivo : il bambino, attraverso un approccio fenomenologico, impara il concetto di SOLUZIONE
FENOMENI DI SUPERFICIE 1 Un possibile percorso: LA TENSIONE SUPERFICIALE Scheda esperienza 1
 PIANO ISS P r e s i d i o M I L A N O I s t i t u t o T e c n i c o I n d u s t r i a l e S t a t a l e L i c e o S c i e n t i f i c o T e c n o l o g i c o E t t o r e M o l i n a r i Via Crescenzago,
PIANO ISS P r e s i d i o M I L A N O I s t i t u t o T e c n i c o I n d u s t r i a l e S t a t a l e L i c e o S c i e n t i f i c o T e c n o l o g i c o E t t o r e M o l i n a r i Via Crescenzago,
1.6 Che cosa vede l astronomo
 1.6 Che cosa vede l astronomo Stelle in rotazione Nel corso della notte, la Sfera celeste sembra ruotare attorno a noi. Soltanto un punto detto Polo nord celeste resta fermo; esso si trova vicino a una
1.6 Che cosa vede l astronomo Stelle in rotazione Nel corso della notte, la Sfera celeste sembra ruotare attorno a noi. Soltanto un punto detto Polo nord celeste resta fermo; esso si trova vicino a una
COME SI SONO PRODOTTE? Tutte le fonti di energia rinnovabili ed esauribili, oggi a nostra disposizione si sono generate dal sole.
 LE FONTI DI ENERGIA COSA SONO? Le fonti di energia sono sostanze in cui all origine è immagazzinata l energia che gli uomini utilizzano. Le fonti di energia più importanti sono quelle che sono in grado
LE FONTI DI ENERGIA COSA SONO? Le fonti di energia sono sostanze in cui all origine è immagazzinata l energia che gli uomini utilizzano. Le fonti di energia più importanti sono quelle che sono in grado
All interno dei colori primari e secondari, abbiamo tre coppie di colori detti COMPLEMENTARI.
 Teoria del colore La teoria dei colori Gli oggetti e gli ambienti che ci circondano sono in gran parte colorati. Ciò dipende dal fatto che la luce si diffonde attraverso onde di diversa lunghezza: ad ogni
Teoria del colore La teoria dei colori Gli oggetti e gli ambienti che ci circondano sono in gran parte colorati. Ciò dipende dal fatto che la luce si diffonde attraverso onde di diversa lunghezza: ad ogni
Unità di misura. Perché servono le unità di misura nella pratica di laboratorio e in corsia? Le unità di misura sono molto importanti
 Unità di misura Le unità di misura sono molto importanti 1000 è solo un numero 1000 lire unità di misura monetaria 1000 unità di misura monetaria ma il valore di acquisto è molto diverso 1000/mese unità
Unità di misura Le unità di misura sono molto importanti 1000 è solo un numero 1000 lire unità di misura monetaria 1000 unità di misura monetaria ma il valore di acquisto è molto diverso 1000/mese unità
DIARIO DI BORDO DOCENTE PIERA FERRARIO SCUOLA MEDIA STATALE A. DE FERRARIIS GALATONE
 DIARIO DI BORDO DOCENTE PIERA FERRARIO SCUOLA MEDIA STATALE A. DE FERRARIIS GALATONE MISCUGLI E SOLUZIONI La trattazione di questo argomento è avvenuta nell ambito dello studio dell acqua e delle sue proprietà
DIARIO DI BORDO DOCENTE PIERA FERRARIO SCUOLA MEDIA STATALE A. DE FERRARIIS GALATONE MISCUGLI E SOLUZIONI La trattazione di questo argomento è avvenuta nell ambito dello studio dell acqua e delle sue proprietà
Capitolo 3. L applicazione Java Diagrammi ER. 3.1 La finestra iniziale, il menu e la barra pulsanti
 Capitolo 3 L applicazione Java Diagrammi ER Dopo le fasi di analisi, progettazione ed implementazione il software è stato compilato ed ora è pronto all uso; in questo capitolo mostreremo passo passo tutta
Capitolo 3 L applicazione Java Diagrammi ER Dopo le fasi di analisi, progettazione ed implementazione il software è stato compilato ed ora è pronto all uso; in questo capitolo mostreremo passo passo tutta
DIDATTICA DELLA CHIMICA
 DIDATTICA DELLA CHIMICA LEZIONE INTRODUTTIVA: Concetto di modello LEZIONE N 1 Domanda problema : se consideriamo un pezzo di legno, un mucchietto di sabbia, che aspetto hanno questi 2 tipi di materia?
DIDATTICA DELLA CHIMICA LEZIONE INTRODUTTIVA: Concetto di modello LEZIONE N 1 Domanda problema : se consideriamo un pezzo di legno, un mucchietto di sabbia, che aspetto hanno questi 2 tipi di materia?
I processi di tempra sono condotti sul manufatto finito per generare sforzi residui di compressione in superficie. Vengono sfruttate allo scopo
 I processi di tempra sono condotti sul manufatto finito per generare sforzi residui di compressione in superficie. Vengono sfruttate allo scopo diverse metodologie. 1 La tempra termica (o fisica) si basa
I processi di tempra sono condotti sul manufatto finito per generare sforzi residui di compressione in superficie. Vengono sfruttate allo scopo diverse metodologie. 1 La tempra termica (o fisica) si basa
Fondamenti e didattica delle scienze
 Fondamenti e didattica delle scienze Energia Daniela Allasia Andrea De Bortoli CORSI SPECIALI - Indirizzo Scuola Primaria 73 L energia e le sue proprietà L energia e le sue proprietà La parola energia
Fondamenti e didattica delle scienze Energia Daniela Allasia Andrea De Bortoli CORSI SPECIALI - Indirizzo Scuola Primaria 73 L energia e le sue proprietà L energia e le sue proprietà La parola energia
Modulo di Meccanica e Termodinamica
 Modulo di Meccanica e Termodinamica 1) Misure e unita di misura 2) Cinematica: + Moto Rettilineo + Moto Uniformemente Accelerato [+ Vettori e Calcolo Vettoriale] + Moti Relativi 3) Dinamica: + Forza e
Modulo di Meccanica e Termodinamica 1) Misure e unita di misura 2) Cinematica: + Moto Rettilineo + Moto Uniformemente Accelerato [+ Vettori e Calcolo Vettoriale] + Moti Relativi 3) Dinamica: + Forza e
CAFFE` Il segreto è nel fisico
 CAFFE` Il segreto è nel fisico Preparata la macchina del caffè, e messala sul fuoco: L acqua raggiunge rapidamente la temperatura di ebollizione (100 C). Lo spazio del serbatoio lasciato libero viene occupato
CAFFE` Il segreto è nel fisico Preparata la macchina del caffè, e messala sul fuoco: L acqua raggiunge rapidamente la temperatura di ebollizione (100 C). Lo spazio del serbatoio lasciato libero viene occupato
Esperienza 15: taratura. della termocoppia. Laboratorio di Fisica 1 (II Modulo) A. Baraldi, M. Riccò. Università di Parma. a.a.
 Esperienza 15: taratura Università di Parma della termocoppia a.a. 2011/2012 Laboratorio di Fisica 1 (II Modulo) A. Baraldi, M. Riccò Copyright M.Solzi Obiettivi dell esperienza Scopo dell'esperienza è
Esperienza 15: taratura Università di Parma della termocoppia a.a. 2011/2012 Laboratorio di Fisica 1 (II Modulo) A. Baraldi, M. Riccò Copyright M.Solzi Obiettivi dell esperienza Scopo dell'esperienza è
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B
 Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Esperienza A: idrofilicità e idrofobicità
 Esperienza A: idrofilicità e idrofobicità Obiettivo: Fare osservare che alcune sostanze, mescolate all'acqua, danno luogo a soluzioni omogenee mentre altre danno miscele eterogenee. Dalla descrizione delle
Esperienza A: idrofilicità e idrofobicità Obiettivo: Fare osservare che alcune sostanze, mescolate all'acqua, danno luogo a soluzioni omogenee mentre altre danno miscele eterogenee. Dalla descrizione delle
Capitolo 03 LA PRESSIONE ATMOSFERICA. 3.1 Esperienza del Torricelli 3.2 Unità di misura delle pressioni
 Capitolo 03 LA PRESSIONE ATMOSFERICA 3.1 Esperienza del Torricelli 3.2 Unità di misura delle pressioni 12 3.1 Peso dell aria I corpi solidi hanno un loro peso, ma anche i corpi gassosi e quindi l aria,
Capitolo 03 LA PRESSIONE ATMOSFERICA 3.1 Esperienza del Torricelli 3.2 Unità di misura delle pressioni 12 3.1 Peso dell aria I corpi solidi hanno un loro peso, ma anche i corpi gassosi e quindi l aria,
Librerie digitali. Video. Gestione di video. Caratteristiche dei video. Video. Metadati associati ai video. Metadati associati ai video
 Video Librerie digitali Gestione di video Ogni filmato è composto da più parti Video Audio Gestito come visto in precedenza Trascrizione del testo, identificazione di informazioni di interesse Testo Utile
Video Librerie digitali Gestione di video Ogni filmato è composto da più parti Video Audio Gestito come visto in precedenza Trascrizione del testo, identificazione di informazioni di interesse Testo Utile
