Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 32
|
|
|
- Caterina Lillo
- 8 anni fa
- Visualizzazioni
Transcript
1 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 32
2 La degradazione delle proteine Concetti chiave: La digestione delle proteine avviene ad opera di specifiche proteasi. Per essere assorbite nell intestino le proteine devono essere completamente degradate ad amminoacidi. Le altre proteine che devono essere degradate sono prima coniugate alla proteina ubiquitina. Il proteasoma, un complesso proteico a forma di barile, srotola la struttura delle proteine ubiquitinate con un processo ATP-dipendente e le degrada proteoliticamente.
3 Digestione e assorbimento di proteine Una volta ingerite le proteine vengono digerite (degradate) ad amminoacidi o a piccoli peptidi che sono assorbiti nell intestino e passano nel torrente circolatorio. La digestione inizia nello stomaco ad opera della pepsina (ph ottimale: 2).
4 Digestione e assorbimento di proteine Gli enzimi proteolitici secreti dal pancreas sottoforma di zimogeni inattivi vengono poi convertiti in enzimi attivi e sono i principali responsabili della digestione delle proteine, insieme alle amminopeptidasi localizzate sull epitelio intestinale. Gli amminoacidi liberi e i di-e tripeptidi vengono internalizzati nelle cellule intestinali ad opera di specifici trasportatori e rilasciati nel torrente circolatorio che li distribuisce ai diversi tessuti.
5 Turnover delle proteine Come fanno le proteine a distinguere le proteine che devono essere degradate? L ubiquitina, una piccola proteina di 8.5 kda presente in tutte le cellule eucariotiche è una sorta di contrassegno che serve ad identificare le proteine che devono essere distrutte.
6 Struttura dell ubiquitina L ubiquitina possiede un estremità carbossiterminale estesa che, una volta attivata, si lega alle proteine che devono essere degradate. Al residuo di Lys 48 si legano poi altre molecole di ubiquitina.
7 Coniugazione dell ubiquitina L enzima attivatore dell ubiquitina (E1) adenila l ubiquitina (1) e la trasferisce a uno dei suoi residui di cisteina (2). L ubiquitina viene poi trasferita ad un residuo di cisteina di un secondo enzima (E2) che coniuga l ubiquitina (3). Infine un terzo enzima (E3) trasferisce l ubiquitina ad un residuo di lisina sulla proteina bersaglio (4a e 4b).
8 Le reazioni di ubiquitinazione
9 Le reazioni di ubiquitinazione
10 Le reazioni di ubiquitinazione
11 Legame isopeptidico Il residuo di Gly al C-terminale dell ubiquitina lega covalentemente i gruppi ε-amminici dei residui di Lys della proteina da degradare. Tali legami sono detti isopeptidici (coinvolgono i gruppi amminici ε e non α). E una catena di 4 o più ubiquitine che segnalano la degradazione.
12 Segnali per la degradazione Quali sono i segnali per la degradazione?: Le cellule devono eliminare le proteine danneggiate (e.g. danni ossidativi) o difettose a causa di errori di traduzione o difetti di folding. Tali proteine devono essere rimosse prima che si formino aggregati proteici. L emivita delle proteine varia di diversi ordini di grandezza.
13 Regola dell N-terminale L emivita di una proteina plasmatica dipende in larga misura dal suo residuo N-terminale. Il tipo di aminoacido all N-terminale di una proteina definisce la vita media della proteina stessa. Fortemente stabilizzanti con t1/2 > 20 h (Met, Ser, Ala, Pro, Cys, Gly, Thr, Val) Intrinsecamente destabilizzanti con t1/2 da 2 a 30 min (Ile, Leu, Arg, Lys, His, Phe, Trp, Tyr) Destabilizzanti dopo modificazione chimica con t1/2 da 3 a 30 min (Asp, Asn, Gln, Glu) Se l ubiquitinazione è la condanna a morte chi esegue la sentenza?
14 Il proteasoma 26S Un grosso complesso con attività proteasica ATP-dipendente, detto proteasoma 26 S, digerisce le proteine ubiquitinate. Il proteasoma 26S è composto da due componenti: un complesso catalitico 20S e un complesso regolatorio 19S.
15 Il proteasoma 19S Il complesso regolatorio 19S è composto da 20 subunità e lega la catena di poliubiquitina. Esso è associato a sei ATPasi che sono coinvolte nello srotolamento della proteina substrato.
16 Il proteasoma 20S Il proteasoma 20S è costituito da 28 subunità omologhe disposte in quattro anelli di 7 subunità ciascuno. Alcune subunità β hanno il sito attivo proteasico nella regione amminoterminale.
17 Il proteasoma 26S Le proteine ubiquitinate vengono degradate a frammenti peptidici dai quali viene rimossa e riciclata l ubiquitina. I frammenti peptidici vengono ulteriormente digeriti ad amminoacidi liberi, riutilizzati in reazioni biosintetiche. Alternativamente, i gruppi amminici possono essere rimossi e trasformati in urea mentre gli scheletri carboniosi vengono utilizzati nella respirazione cellulare o per la sintesi di carboidrati o lipidi.
18 Evoluzione del proteasoma Anche nei procarioti sono presenti proteine omologhe al proteasoma. Il proteasoma degli archea è costituito da 14 subunitàαe 14 subunità β identiche tra loro. Nel proteasoma degli eucarioti vari eventi di duplicazione e specializzazione genica hanno formato 7 subunità distinte di ciascun tipo ma l organizzazione generale si è conservata.
19 Degradazione degli amminoacidi Quale è il destino metabolico degli amminoacidi che si rendono liberi durante la digestione o i turnover delle proteine? Gli amminoacidi derivati in gran parte dalla degradazione delle proteine intracellulari o della dieta possono essere ossidati per generare energia.
20 Catabolismo degli amminoacidi Il loro utilizzo come precursori di biosintesi è la funzione principale. Però la parte in eccesso viene metabolizzata per produrre composti che entrano nelle principali vie metaboliche. Il gruppo amminico viene rimosso e lo scheletro carbonioso viene riutilizzato.
21 Catabolismo degli amminoacidi Tre situazioni in cui gli amminoacidi negli animali subiscono una degradazione ossidativa: Durante la sintesi e degradazione delle proteine cellulari (turnover delle proteine), alcuni amminoacidi, se non necessari per la sintesi di altre proteine possono essere ossidati. Quando una dieta è ricca di proteine e gli amminoacidi sono in eccesso per la sintesi di proteine (non si possono formare riserve di amminoacidi!) Durante il digiuno prolungato.
22 La deaminazione degli amminoacidi Concetti chiave: La transaminazione interconverte tra loro un amminoacido e un α-cheto acido. La deaminazione ossidativa del glutammato rilascia ammoniaca da eliminare.
23 Transaminazione La prima tappa del catabolismo degli amminoacidi in qualunque organismo consiste normalmente nella rimozione del gruppo α-amminico per la successiva liberazione di NH 4+. La rimozione del gruppo α-amminico (con la formazione di un α-chetoacido) è dovuta all azione di enzimi chiamati amminotransferasi o transaminasi. Nel loro insieme le amminotransferasi convogliano il gruppo α-amminico della maggior parte degli amminoacidi all α-chetoglutarato formando glutammato.
24 Transaminazione L aspartato amminotrasferasi (AST o GOT), una delle transaminasi più importanti, catalizza il trasferimento del gruppo amminico dall aspartato all α-chetoglutarato con formazione di glutammato e ossalacetato.
25 Transaminazione L alanina amminotrasferasi (ALT o GPT) catalizza il trasferimento del gruppo amminico dall alanina all α-chetoglutarato con formazione di piruvato e glutammato. Glutammato Piruvato α-chetoglutarato Alanina Le reazioni di transaminazione sono reversibili e possono anche essere utilizzate per sintetizzare α-chetoacidi.
26 Transaminazione Tutte le amminotransferasi contengono come gruppo prostetico il piridossal fosfato (a, PLP) che deriva dalla vitamina piridossina (b, vitamina B6). Il piridossalfosfato è costituito da un anello piridinico leggermente basico cui è legato un gruppo OH leggermente acido.
27 Transaminazione Il più importante gruppo funzionale del PLP è il gruppo aldeidico che può formare basi di Schiff covalenti con i substrati amminoacidici. In assenza di substrato, il gruppo aldeidico del PLP forma una base di Schiff con il gruppo ε-amminico di un residuo specifico di lisina nel sito attivo dell enzima. Il gruppo α-amminico dell amminoacido substrato va a sostituirsi al gruppo amminico del residuo di Lys del sito attivo dell enzima.
28 Transaminazione Tale processo avviene attraverso una serie di tappe che prevedono la formazione di intermedi. La prima tappa genera la piridossammina fosfato (PMP) e l α-chetoacido. Nella seconda parte della reazione un secondo amminoacido reagisce con il complesso enzima- PMP per generare un secondo amminoacido e ripristinare il complesso enzima-plp.
29 Transaminazione La somma delle reazioni parziali è: Amminoacido 1 + α-chetoacido 2 Amminoacido 2 + α-chetoacido 1
30 Transaminazione PLP-dipendente
31 Transaminazione PLP-dipendente
32 Transaminazione PLP-dipendente
33 Transaminazione Il PLP agisce da catalizzatore in altre reazioni oltre che nelle transaminazioni (e.g. decarbossilazioni, deamminazioni, racemizzazioni, scissioni aldoliche). L orientamento del legame NH-Cα determina il tipo di rezione maggiormente favorita tra quelle catalizzate da un enzima con PLP. Il legame che ha maggiori probabilità di essere tagliato è quello perpendicolare agli orbitali π delocalizzati della trappola per gli elettroni PLP.
34 Transaminazione Nell AST il legame Cα-H è quasi perpendicolare al sistema di orbitali π ed è quindi tagliato. Lo stesso avviene per il legame Cα -Cβ tagliato dalla serina idrossimetil-trasferasi.
35 Deaminazione ossidativa del glutammato L atomo di azoto del glutammato viene convertito in ione ammonio mediante una reazione di deaminazione ossidastive. Il glutammato viene trasportato dal citosol nei mitocondri dove viene sottoposto a deaminazione ossidativa catalizzata dalla L- glutammato deidrogenasi. Tale enzima ha la caratteristica di poter utilizzare sia il NAD + sia il NADP +. La reazione procede attraverso la deidrogenazione del legame C-N seguita dall idrolisi della base di Schiff risultante.
36 Deaminazione ossidativa del glutammato La glutammato deidrogenasi è delocalizzata nei mitocondri insieme agli enzimi del ciclo dell urea. La compartimentazione mitocondriale sequestra lo ione ammonio che è tossico per l organismo. Nella maggior parte dei vertebrati terrestri lo ione NH 4+ viene convertito in urea ed escreto. L α-chetoglutarato, prodotto dalla reazione della glutammato deidrogenasi, è un intermedio del ciclo dell acido citrico.
37 Deaminazione ossidativa del glutammato La glutammato deidrogenasi è un enzima allosterico molto complesso. Il GTP, un prodotto della succinil-coa sintetasi nel ciclo dell acido citrico, ne è un modulatore negativo. Glutammato deidrogenasi Glutammato α-chetoglutarato
38 I tessuti periferici trasportano l azoto al fegato La degradazione degli amminoacidi avviene prevalentemente nel fegato. Tuttavia anche altri tessuti possono degradare gli amminoacidi. Il muscolo utilizza amminoacidi a catena ramificata (Leu, Ile, Val) come fonte di energia nel digiuno. Il muscolo non possiede però gli enzimi del ciclo dell urea e quindi l azoto deve essere rilasciato in una forma che possa essere poi catturata e convertita in urea.
39 Ciclo glucosio-alanina Il principale trasportatore di ammoniaca dal muscolo al fegato è l alanina. L azoto rimosso dagli amminoacidi a catena ramificata viene trasferito al piruvato formando alanina ad opera dell alanina transaminasi. L alanina viene rilasciata nel torrente circolatorio, catturata dal fegato e convertita nuovamente in piruvato per la sintesi di glucosio con la gluconeogenesi.
40 La glutammina trasporta ammoniaca attraverso il sangue L azoto può anche essere trasportato sotto forma di glutammina. Nei tessuti extraepatici lo ione NH 4+ prodotto dalla reazione catalizzata dalla glutammato deidrogenasi per l escrezione, reagisce col glutammato per formare glutammina, un trasportatore non tossico di gruppi amminici che può attraversare le membrane cellulari. Durante questa reazione, catalizzata dalla glutammina sintetasi viene idrolizzato ATP. La glutammina entra nel circolo sanguigno e raggiunge il fegato. Nei mitocondri epatici il gruppo amminico è nuovamente convertito in NH 4+, con l intervento della glutamminasi.
41 Ciclo glucosio-alanina
42 Panoramica del catabolismo degli amminoacidi
43 L ammoniaca e i prodotti di scarto meno tossici L ammoniaca libera è molto tossica e non può essere accumulata nell organismo. I gruppi amminici se non vengono riutilizzati per la sintesi di altri amminoacidi o altri prodotti azotati devono essere eliminati. Molti organismi ammoniotelici acquatici rilasciano l ammoniaca semplicemente sotto forma di ioni NH 4+. La maggior parte dei vertebrati terrestri converte l ammoniaca in urea (animali ureotelici). Uccelli e rettili convertono l ammoniaca in acido urico (animali uricotelici).
44 L ammoniaca e i prodotti di scarto meno tossici La modalità di escrezione dell azoto si è sviluppata nel corso dell evoluzione in dipendenza dell habitat degli organismi. Gli organismi che eliminano ammoniaca non possono vivere in ambienti in cui l acqua è limitata. L urea viene escreta con le urine diluita con acqua. L acido urico, poco solubile, viene escreto con le feci sotto forma di cristalli di acido urico con il vantaggio di eliminare quattro atomi di N. Come si forma l urea a partire dai gruppi NH 4+ formatisi durante i processi di transaminazione e deamidazione ossidativa?
45 Ciclo dell urea La prima reazione nella produzione dell urea consiste nella formazione del carmamil fosfato catalizzata dalla carbamil fosfato sintetasi I. Questo processo avviene all interno della matrice mitocondriale epatica e porta all accoppiamento covalente di un azoto del NH4+ con un atomo di carbonio.
46 Ciclo dell urea La reazione avviene in più tappe con il consumo di due molecole di ATP: 1. Carbossilazione dell HCO 3- a carbossifosfato 2. Reazione con NH 3 per formare acido carbammico 3. Fosforilazione dell acido carbammico a carbamil fosfato
47 Il meccanismo di reazione della CPS I 1. Carbossilazione dell HCO 3- a carbossifosfato
48 Il meccanismo di reazione della CPS I 2. Reazione con NH 3 per formare acido carbammico
49 Il meccanismo di reazione della CPS I 3. Fosforilazione dell acido carbammico a carbamil fosfato
50 Ciclo dell urea
51 Ciclo dell urea Reazione 2: Il gruppo carbamilico ha un elevato potenziale di trasferimento a causa del suo legame anidridico e viene trasferito all ornitina per formare citrullina (enzima: Ornitina transcarbamilasi).
52 Ciclo dell urea Reazione 3: La citrullina è trasportata dalla matrice mitocondriale nel citosol dove si condensa con l aspartato, il donatore del secondo gruppo amminico (enzima: Argininosuccinato sintetasi). La reazione richiede la scissione di ATP in AMP e pirofosfato che sarà poi successivamente idrolizzato.
53 Meccanismo di reazione dell argininosuccinato sintetasi
54 Meccanismo di reazione dell argininosuccinato sintetasi
55 Ciclo dell urea Reazione 4: L argininsuccinato viene scisso in arginina e fumarato (enzima: Argininosuccinasi).
56 Ciclo dell urea Reazione 5: L arginina è infine idrolizzata in urea e ornitina. L ornitina è trasportata nuovamente nel mitocondrio per iniziare un nuovo ciclo, mentre l urea è eliminata tramite escrezione (enzima: Arginasi).
57
58 Reazione complessiva del ciclo dell urea L escrezione dell urea e l idrolisi del pirofosfato spingono la reazione verso il compimento. Uno degli atomi di azoto proviene da NH 4+, mentre l altro dall aspartato. Considerando l idrolisi del pirofosfato, durante la produzione di una sola molecola di urea vengono scissi 4 legami fosfoanidridici. La detossificazione di NH 4+ è un processo che richiede energia.
59 Integrazione metabolica del metabolismo dell azoto La sintesi del fumarato è importante perché lega il ciclo dell urea al ciclo dell acido citrico. Il fumarato viene idratato a malato che a sua volta viene ossidato ad ossalacetato. L ossalacetato ha diversi possibili destini metabolici: 1) Transaminazione ad aspartato 2) Conversione a glucosio attraverso la via gluconeogenetica (via fosfoenolpiruvato) 3) Condensazione con l acetil CoA per la sintesi di citrato (ciclo dell acido citrico) 4) Conversione in piruvato.
60 La carbamil fosfato sintetasi Alcuni enzimi del ciclo dell urea sono evolutivamente correlati ad enzimi di altre vie metaboliche. Quattro dei cinque enzimi del ciclo dell urea si sono evoluti da enzimi coinvolti nella biosintesi dei nucleotidi. La carbamil fosfato sintetasi serve anche per la biosintesi delle pirimidine. In tal caso, l enzima utilizza glutammina come fonte di azoto al posto dell ammoniaca. Il dominio dell enzima dove avviene l idrolisi della glutammina è conservato e presente anche nell enzima del ciclo dell urea anche se è in forma cataliticamente inattiva. Carbamil fosfato sintetasi die. coli PDBid 1JDB
61 L N-acetilglutammato attiva la CPS I Il dominio della carbamil fosfato sintetasi del ciclo dell urea lega l N-acetilglutammato che agisce da attivatore allosterico dell enzima. Tale composto viene sintetizzato quando la velocità del catabolismo degli amminoacidi aumenta e segnala che si sta accumulando ione ammonio che deve essere eliminato.
62 Iperammonemia Il blocco di una qualunque delle reazioni del ciclo dell urea hanno effetti devastanti in quanto, non esistendo vie alternative alla sintesi dell urea, si verifica un accumulo di NH 4+ nel sangue (iperammonemia). L iperammonemia causa coma e danni cerebrali irreversibili.
63 Iperammonemia Ad esempio, carenze di carbamil fosfato sintetasi e ornitina transcarbamilasi portano ad accumulo di azoto sottoforma di glicina e glutammina. E possibile curare entrambe le carenze introducendo benzoato e fenilacetato nella dieta. In presenza di tali composti, l azoto è eliminato sottoforma di ippurato e fenilacetilglutammina.
64 Destino degli scheletri carboniosi degli amminoacidi Concetti chiave: L alanina, la cisteina, la glicina, la serina e la treonina sono degradate a piruvato. L asparagina e l aspartato sono degradati a ossalacetato. L α-chetoglutarato è prodotto dalla degradazione dell arginina, del glutammato, della glutammina, dell istidina e della prolina. L isoleucina, la metionina, la treonina e la valina sono convertite in succinil-coa. La degradazione della leucina e della lisina forma acetil-coa e acetoacetato. Il triptofano viene degradato ad acetoacetato. La fenilalanina e la tirosina formano fumarato e acetoacetato.
65 Destino degli scheletri carboniosi degli amminoacidi La strategia della degradazione degli amminoacidi è quella di convertire gli scheletri carboniosi in intermedi metabolici di primaria importanza, che possono essere trasformati in glucosio o ossidati nel ciclo dell acido citrico. Gli scheletri carboniosi dei 20 amminoacidi generano solo sette molecole: Piruvato Acetil CoA Acetoacetil CoA α-chetoglutarato Succinil CoA Fumarato Ossalacetato
66 Destino degli scheletri carboniosi degli amminoacidi Gli amminoacidi che sono degradati a acetil CoA o acetoacetil CoA sono detti chetogenici, in quanto possono dare origine a corpi chetonici oppure essere utilizzati per la sintesi di acidi grassi. Gli amminoacidi che sono degradati a piruvato o ad intermedi del ciclo dell acido citrico sono detti glucogenici perché possono essere utilizzati per la sintesi netta di glucosio. I mammiferi non hanno una via metabolica per la sintesi diretta di glucosio a partire da acetil CoA o acetoacetil CoA.
67 Destino degli scheletri carboniosi degli amminoacidi Gli amminoacidi glucogenici sono colorati in violetto, mentre quelli chetogenici sono colorati in giallo. Alcuni amminoacidi sono sia glucogenici che chetogenici. Solo la leucina e la lisina sono esclusivamente chetogenici.
68 La fissazione dell azoto e biosintesi degli amminoacidi Concetti chiave: La riduzione dell N 2 a NH 3 catalizzata dalla nitrogenasi è un processo energeticamente costoso. L ammoniaca è incorporata negli amminoacidi dalla glutammato sintetasi. Alcuni amminoacidi sono sintetizzati in una o più tappe partendo da metaboliti comuni. Gli amminoacidi essenziali sono per lo più derivati da altri amminoacidi e dai metaboliti del glucosio.
69 Ciclo dell azoto L atmosfera è ricca di azoto allo stato gassoso (N 2 ), una molecola molto poco reattiva. Alcuni organismi sono in grado di fissare l azoto atmosferico ossia formare NH 3 partendo da N 2.
70 Noduli delle radici della pianta di soia Alcuni batteri ad esempio possiedono l enzima nitrogenasi che catalizza tale reazione.
71 Fissazione dell azoto Gli elettroni fluiscono dalla ferredossina attraverso la riduttasi alla nitrogenasi per ridurre l azoto ad ammoniaca. L idrolisi di ATP nella riduttasi induce le modificazioni conformazionali necessarie al trasferimento di elettroni.
72 Biosintesi degli amminoacidi L azoto ridotto, sotto forma di ione ammonio NH 4+ è incorporato nelle biomolecole attraverso il glutammato e la glutammina. Il glutammato e la glutammina sono poi utilizzati direttamente o indirettamente come fonte di azoto per la biosintesi di altri composti azotati (altri amminoacidi, purine, pirimidine).
73 Biosintesi degli amminoacidi La glutammato deidrogenasi catalizza l amminazione riduttiva dell α-chetoglutarato. Gli equivalenti riducenti necessari alla reazione sono forniti dal NADPH. Nei mammiferi la glutammato deidrogenasi catalizza la reazione inversa durante il catabolismo degli amminoacidi (usando NAD + come ossidante). La glutammina sintetasi catalizza la produzione dipendente da ATP di glutammina da glutammato e NH 4+. La reazione catalizzata dalla glutammina sintetasi rappresenta il punto d ingresso dell azoto ridotto nel metabolismo cellulare.
74 Regolazione a feedback della glutammato sintetasi La glutammina sintetasi è il sito di regolazione del metabolismo dell azoto. Numerosi prodotti finali del metabolismo della glutammina sono inibitori allosterici dell enzima. La glutammina sintetasi è soggetta oltre alla regolazione allosterica anche a regolazione covalente (aggiunta reversibile di unità di AMP, adenilazione, o di UMP, uridilazione).
75 Biosintesi degli amminoacidi Le vie che conducono alla biosintesi degli altri amminoacidi conservano una caratteristica comune. Gli scheletri carboniosi dei loro substrati provengono dagli intermedi della glicolisi, della via dei pentoso-fosfati e del ciclo dell acido citrico.
76 Biosintesi degli amminoacidi In base alle caratteristiche di questi scheletri carboniosigli amminoacidi possono essere raggruppati in sei famiglie biosintetiche. I precursori metabolici principali sono riportati in blu, gli amminoacidi precursori di altri amminoacidi sono riportati in giallo. Gli amminoacidi essenziali sono riportati in grassetto.
77 Amminoacidi essenziali Molte proteine vengono costantemente degradate e risintetizzate a seconda del fabbisogno della cellula. Le proteine della dieta sono la fonte primaria di amminoacidi. Precursori chimici Proteina preposta alla sintesi Sintesi dell amminoacido Amminoacidi non essenziali Amminoacidi essenziali Digestione Sintesi di nuove proteine
78 Amminoacidi essenziali Negli organismi che non hanno la capacità di fissare l azoto, quello che viene perso, in condizioni di equilibrio metabolico, deve essere rimpiazzato. L assunzione di proteine, fonte primaria di N e amminoacidi nella dieta è dunque necessaria. Particolarmente importanti sono le proteine che contengono gli amminoacidi essenziali che non possono essere sintetizzati e che devono essere introdotti con la dieta. Nell'alimentazione umana si considerano essenziali i seguenti aminoacidi:
79 Amminoacidi essenziali
80 Amminoacidi essenziali Gli amminoacidi non essenziali sono in genere sintetizzati attraverso un numero piccolo di reazioni (e.g. alanina e aspartato sono sintetizzati in una singola tappa da piruvato e ossalacetato). La sintesi degli amminoacidi essenziali richiede al contrario un maggior numero di reazioni (da 5 a 16).
81 Amminoacidi essenziali Gli amminoacidi derivati in gran parte dalla degradazione delle proteine della dieta o intracellulari possono essere ossidati per generare energia. La quantità di energia ricavata dall ossidazione degli amminoacidi varia in funzione del tipo di organismo e della situazione metabolica. La carenza di un solo amminoacido causa una condizione di bilancio negativo dell azoto nonché diverse condizioni patologiche più o meno gravi.
82 Alterazioni delle vie di degradazione degli aa Gli errori del metabolismo degli amminoacidi sono stati i primi esempi di difetti biochimici correlati a condizioni patologiche. La fenilchetonuria è causata dall assenza o carenza di fenilalanina idrossilasi che converte Phe in Tyr. Questa condizione risulta nell accumulo di elevati livelli di fenilalanina che viene catabolizzata da una via alternativa in fenilpiruvato che compare nelle urine (fenilchetonuria).
83 Alterazioni delle vie di degradazione degli aa La patologia determina ritardo mentale a meno che fin dalla nascita non venga adottata una dieta povera di fenilalanina. Inoltre il difetto di sintesi di tirosina conduce a deficit di melanina con intolleranza alla luce.
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi Gli amminoacidi derivati in gran parte dalla degradazione delle proteine della dieta o intracellulari possono essere ossidati per generare e energia. La quantità di energia
Metabolismo degli amminoacidi Gli amminoacidi derivati in gran parte dalla degradazione delle proteine della dieta o intracellulari possono essere ossidati per generare e energia. La quantità di energia
Metabolismo degli aminoacidi
 Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
dieta vengono convertiti in composti dei corpi chetonici.
 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Metabolismo degli amminoacidi. Ciclo dell urea
 Metabolismo degli amminoacidi Ciclo dell urea Biosintesi di amminoacidiporfirine, creatina, carnitina, ormoni, nucleotidi Gli amminoacidi possono subire una degradazione ossidativa in 3 diverse situazioni
Metabolismo degli amminoacidi Ciclo dell urea Biosintesi di amminoacidiporfirine, creatina, carnitina, ormoni, nucleotidi Gli amminoacidi possono subire una degradazione ossidativa in 3 diverse situazioni
Metabolismo degli Ammino Acidi
 Metabolismo degli Ammino Acidi (La proteina stimola la secrezione della gastrina che stimola la secrezione di l e pepsinogeno) R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi)
Metabolismo degli Ammino Acidi (La proteina stimola la secrezione della gastrina che stimola la secrezione di l e pepsinogeno) R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi)
Degradazione delle proteine della dieta. Catabolismo degli aminoacidi
 Degradazione delle proteine della dieta Catabolismo degli aminoacidi LE PROTEINE DELLA DIETA SONO DEGRADATE ENZIMATICAMENTE AD AMINOACIDI LIBERI L ingresso di una proteina nello stomaco stimola la mucosa
Degradazione delle proteine della dieta Catabolismo degli aminoacidi LE PROTEINE DELLA DIETA SONO DEGRADATE ENZIMATICAMENTE AD AMINOACIDI LIBERI L ingresso di una proteina nello stomaco stimola la mucosa
Metabolismo dei composti azotati: aminoacidi e nucleotidi
 Metabolismo dei composti azotati: aminoacidi e nucleotidi Metabolismo degli aminoacidi I composti azotati L azoto contenuto nella cellula è presente soprattutto negli AMINOACIDI delle proteine e nelle
Metabolismo dei composti azotati: aminoacidi e nucleotidi Metabolismo degli aminoacidi I composti azotati L azoto contenuto nella cellula è presente soprattutto negli AMINOACIDI delle proteine e nelle
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 26 La gluconeogenesi Concetti chiave: Il fegato e il rene possono sintetizzare glucosio da lattato, piruvato e amminoacidi.
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 26 La gluconeogenesi Concetti chiave: Il fegato e il rene possono sintetizzare glucosio da lattato, piruvato e amminoacidi.
GLUCONEOGENESI. Sintesi (GENESI) di nuove (NEO) molecole di glucosio
 GLUCONEOGENESI Sintesi (GENESI) di nuove (NEO) molecole di glucosio CATABOLISMO ANABOLISMO OSSIDAZIONI Produzione di ATP RIDUZIONI Consumo di ATP La GLUCONEOGENESI è un PROCESSO ANABOLICO La gluconeogenesi
GLUCONEOGENESI Sintesi (GENESI) di nuove (NEO) molecole di glucosio CATABOLISMO ANABOLISMO OSSIDAZIONI Produzione di ATP RIDUZIONI Consumo di ATP La GLUCONEOGENESI è un PROCESSO ANABOLICO La gluconeogenesi
N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi
 Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI
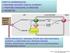 FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI Berg et al., BIOCHIMICA 6/E, Zanichelli editore S.p.A. Copyright 2007 PROTEINE INGERITE CON GLI ALIMENTI
FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI Berg et al., BIOCHIMICA 6/E, Zanichelli editore S.p.A. Copyright 2007 PROTEINE INGERITE CON GLI ALIMENTI
REPLICAZIONE DEL DNA
 REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
Digestione delle proteine: 6 fasi
 orletto a spazzola Digestione delle proteine: 6 fasi 1. Idrolisi gastrica del legame peptidico 2. Digestione a peptidi più piccoli da parte delle proteasi pancreatiche nel lume dell intestino tenue 3.
orletto a spazzola Digestione delle proteine: 6 fasi 1. Idrolisi gastrica del legame peptidico 2. Digestione a peptidi più piccoli da parte delle proteasi pancreatiche nel lume dell intestino tenue 3.
Continua. Peptidasi H 2 O
 Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Il ciclo dell acido citrico
 Il ciclo dell acido citrico Il catabolismo di proteine, grassi e carboidrati avviene nelle tre fasi della respirazione cellulare Il piruvato viene ossidato ad acetil-coa e CO 2 La decarbossilazione
Il ciclo dell acido citrico Il catabolismo di proteine, grassi e carboidrati avviene nelle tre fasi della respirazione cellulare Il piruvato viene ossidato ad acetil-coa e CO 2 La decarbossilazione
GLICOGENOLISI & GLICOGENOSINTESI
 GLICOGENOLISI & GLICOGENOSINTESI ALIMENTARE Glucosio GLUCONEOGENESI GLICOGENOLISI (epatica) Glicemia: 70-90 mg/100ml ~ 5 mm GLICOGENO Nel fegato fino al 6-10% della massa epatica (~100 grammi) Nel muscolo
GLICOGENOLISI & GLICOGENOSINTESI ALIMENTARE Glucosio GLUCONEOGENESI GLICOGENOLISI (epatica) Glicemia: 70-90 mg/100ml ~ 5 mm GLICOGENO Nel fegato fino al 6-10% della massa epatica (~100 grammi) Nel muscolo
Helena Curtis N. Sue Barnes
 Helena Curtis N. Sue Barnes LA RESPIRAZIONE CELLULARE INDICE Demolizione del glucosio Glicolisi Fermentazione lattica Fermentazione alcolica Respirazione cellulare Ciclo di Krebs Catena di trasporto degli
Helena Curtis N. Sue Barnes LA RESPIRAZIONE CELLULARE INDICE Demolizione del glucosio Glicolisi Fermentazione lattica Fermentazione alcolica Respirazione cellulare Ciclo di Krebs Catena di trasporto degli
SISTEMI ENERGETICI. L ATP privato di uno dei suoi 3 radicali fosforici diventa ADP (adenosindifosfato).
 SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
Metabolismo: Introduzione
 Metabolismo: Introduzione METABOLISMO Insieme delle reazioni chimiche coordinate e integrate che hanno luogo in tutte le cellule C A T A B O L I S M O Ossidazioni esoergoniche Alimenti: Carboidrati Lipidi
Metabolismo: Introduzione METABOLISMO Insieme delle reazioni chimiche coordinate e integrate che hanno luogo in tutte le cellule C A T A B O L I S M O Ossidazioni esoergoniche Alimenti: Carboidrati Lipidi
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
METABOLISMO DEGLI AMMINOACIDI
 METABOLISMO DEGLI AMMINOACIDI 1 Metabolismo degli amminoacidi: 1. Degradazione delle proteine 2. Incorporazione dell azoto nell urea 3. Sintesi dei singoli amminoacidi 2 Le cellule sintetizzano continuamente
METABOLISMO DEGLI AMMINOACIDI 1 Metabolismo degli amminoacidi: 1. Degradazione delle proteine 2. Incorporazione dell azoto nell urea 3. Sintesi dei singoli amminoacidi 2 Le cellule sintetizzano continuamente
SOLUZIONI DEGLI ESERCIZI
 Niccolò Taddei - Biochimica Capitolo 8 IL METABOLISMO DEI COMPOSTI AZOTATI 1 Gli amminoacidi sono coinvolti prevalentemente in processi plastici di sintesi e di degradazione, grazie ai quali le cellule
Niccolò Taddei - Biochimica Capitolo 8 IL METABOLISMO DEI COMPOSTI AZOTATI 1 Gli amminoacidi sono coinvolti prevalentemente in processi plastici di sintesi e di degradazione, grazie ai quali le cellule
PROTEINA GREGGIA (P.G.)
 PROTEINA GREGGIA (P.G.) Il contenuto proteico di un alimento è valutato dal suo tenore in azoto, determinato con il metodo Kjeldahl modificato. Il metodo Kjeldahl valuta la maggior parte dell azoto presente
PROTEINA GREGGIA (P.G.) Il contenuto proteico di un alimento è valutato dal suo tenore in azoto, determinato con il metodo Kjeldahl modificato. Il metodo Kjeldahl valuta la maggior parte dell azoto presente
Respirazione cellulare
 Respirazione cellulare L equazione generale della respirazione C 6 H 12 O 6 + 6 O 2! 6 CO 2 + 6 H 2 O + 36 ATP 1 molec zucchero 6 molec ossigeno 6 molec anidride carbonica 6 molec acqua + = + + 36 molecole
Respirazione cellulare L equazione generale della respirazione C 6 H 12 O 6 + 6 O 2! 6 CO 2 + 6 H 2 O + 36 ATP 1 molec zucchero 6 molec ossigeno 6 molec anidride carbonica 6 molec acqua + = + + 36 molecole
Si possono suddividere in:
 Si possono suddividere in: LIPIDI DI DEPOSITO: si accumulano nelle cellule del tessuto adiposo, sono una riserva energetica, mantengono costante la temperatura del corpo (termogenesi) LIPIDI STRUTTURALI:
Si possono suddividere in: LIPIDI DI DEPOSITO: si accumulano nelle cellule del tessuto adiposo, sono una riserva energetica, mantengono costante la temperatura del corpo (termogenesi) LIPIDI STRUTTURALI:
glicogeno Glucosio 6-P Piruvato Acetil CoA Intermedi del ciclo di Krebs
 PIRUVAT glicogeno Glicogeno sintesi glicogenolisi Glucosio Glucosio 6-P Ribosio 5-P glicolisi Gluconeogenesi Amino acidi Piruvato Acetil CoA lattato Intermedi del ciclo di Krebs Concentrazione di glicogeno
PIRUVAT glicogeno Glicogeno sintesi glicogenolisi Glucosio Glucosio 6-P Ribosio 5-P glicolisi Gluconeogenesi Amino acidi Piruvato Acetil CoA lattato Intermedi del ciclo di Krebs Concentrazione di glicogeno
Metabolismo di proteine e aminoacidi nel muscolo
 Metabolismo di proteine e aminoacidi nel muscolo L equilibrio tra proteolisi e sintesi determina la crescita, l ipertrofia e l atrofia del muscolo L equilibrio è anche importante per l omeostasi generale
Metabolismo di proteine e aminoacidi nel muscolo L equilibrio tra proteolisi e sintesi determina la crescita, l ipertrofia e l atrofia del muscolo L equilibrio è anche importante per l omeostasi generale
La fissazione dell azoto
 La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
Biosintesi non ribosomiale di metaboliti peptidici bioattivi
 Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
DEAMINAZIONE AA - 7. ADP + Pi ATP. glutamina sintetasi. glutaminasi COO CH 2 NH + 4. + _ COO L-glutamato (Glu) COO. L-glutamina (Gln) COO 2 H2O
 C DEAMIAZIE AA - 7 ATP ADP Pi C C C C 3 4 glutamina sintetasi C C 3 L-glutamato (Glu) L-glutamina (Gln) C C 4 C C C 3 L-glutamina (Gln) glutaminasi C C 3 L-glutamato (Glu) DEAMIAZIE AA - 8 tessuti extraepatici,
C DEAMIAZIE AA - 7 ATP ADP Pi C C C C 3 4 glutamina sintetasi C C 3 L-glutamato (Glu) L-glutamina (Gln) C C 4 C C C 3 L-glutamina (Gln) glutaminasi C C 3 L-glutamato (Glu) DEAMIAZIE AA - 8 tessuti extraepatici,
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Traduzione dell informazione genetica (1)
 Traduzione dell informazione genetica (1) 1 Traduzione dell informazione genetica (2) Il processo negli eucarioti richiede: 70 diverse proteine ribosomiali >20 enzimi che attivano i precursori degli amminoacidi
Traduzione dell informazione genetica (1) 1 Traduzione dell informazione genetica (2) Il processo negli eucarioti richiede: 70 diverse proteine ribosomiali >20 enzimi che attivano i precursori degli amminoacidi
GLUCONEOGENESI SINTESI DI NUOVO GLUCOSIO A PARTIRE DA FONTI NON GLUCIDICHE. L UOMO CONSUMA QUASI 160 g DI GLUCOSIO AL GIORNO
 GLUCONEOGENESI SINTESI DI NUOVO GLUCOSIO A PARTIRE DA FONTI NON GLUCIDICHE L UOMO CONSUMA QUASI 160 g DI GLUCOSIO AL GIORNO 75% DI TALE GLUCOSIO E NEL CERVELLO I FLUIDI CORPOREI CONTENGONO SOLO 20 g DI
GLUCONEOGENESI SINTESI DI NUOVO GLUCOSIO A PARTIRE DA FONTI NON GLUCIDICHE L UOMO CONSUMA QUASI 160 g DI GLUCOSIO AL GIORNO 75% DI TALE GLUCOSIO E NEL CERVELLO I FLUIDI CORPOREI CONTENGONO SOLO 20 g DI
Da dove prendono energia le cellule animali?
 Da dove prendono energia le cellule animali? La cellula trae energia dai legami chimici contenuti nelle molecole nutritive Probabilmente le più importanti sono gli zuccheri, che le piante sintetizzano
Da dove prendono energia le cellule animali? La cellula trae energia dai legami chimici contenuti nelle molecole nutritive Probabilmente le più importanti sono gli zuccheri, che le piante sintetizzano
Metabolismo degli Ammino Acidi
 Metabolismo degli Ammino Acidi R 1 C C - R 2 C C - N 3 Transaminasi R 1 C C - R 2 C C - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due a-cheto acidi.
Metabolismo degli Ammino Acidi R 1 C C - R 2 C C - N 3 Transaminasi R 1 C C - R 2 C C - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due a-cheto acidi.
Metabolismo degli Ammino Acidi
 Metabolismo degli Ammino Acidi R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due α-cheto acidi. Amminotransferasi
Metabolismo degli Ammino Acidi R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due α-cheto acidi. Amminotransferasi
Il metabolismo dell azoto
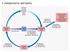 Il metabolismo dell azoto La fissazione dell azoto Radici di una leguminosa e il simbionte Rhizobium leguminosarum. Microrganismi azotofissatori : ad es. batteri appartenenti ai generi Clostridium e Azotobacter.
Il metabolismo dell azoto La fissazione dell azoto Radici di una leguminosa e il simbionte Rhizobium leguminosarum. Microrganismi azotofissatori : ad es. batteri appartenenti ai generi Clostridium e Azotobacter.
Βeta ossidazione degli acidi grassi BETA OSSIDAZIONE DEGLI ACIDI GRASSI 13/12/2013 SEMINARIO. Acidi grassi (2)
 Acidi grassi (1) Mitocondri SEMINARIO BETA OSSIDAZIONE DEGLI ACIDI GRASSI Sono le principali fonti di energia per alcuni tessuti (es. muscolo cardiaco). Si genera molto più energia dall ossidazione degli
Acidi grassi (1) Mitocondri SEMINARIO BETA OSSIDAZIONE DEGLI ACIDI GRASSI Sono le principali fonti di energia per alcuni tessuti (es. muscolo cardiaco). Si genera molto più energia dall ossidazione degli
Regolazione del metabolismo del glucosio
 Regolazione del metabolismo del glucosio Regolazione coordinata di glicolisi e gluconeogenesi Glicolisi e gluconeogenesi sono regolate in modo reciproco La regolazione è a livello dei punti di deviazione
Regolazione del metabolismo del glucosio Regolazione coordinata di glicolisi e gluconeogenesi Glicolisi e gluconeogenesi sono regolate in modo reciproco La regolazione è a livello dei punti di deviazione
Il metabolismo del glicogeno e la gluconeogenesi. Copyright 2013 Zanichelli editore S.p.A.
 Il metabolismo del glicogeno e la gluconeogenesi Copyright 2013 Zanichelli editore S.p.A. Capitolo 16 La demolizione del glicogeno Concetti chiave 16.1 Il glicogeno, la forma di immagazzinamento del glucosio,
Il metabolismo del glicogeno e la gluconeogenesi Copyright 2013 Zanichelli editore S.p.A. Capitolo 16 La demolizione del glicogeno Concetti chiave 16.1 Il glicogeno, la forma di immagazzinamento del glucosio,
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi Gli amminoacidi derivati in gran parte dalla degradazione delle proteine della dieta o intracellulari possono essere ossidati per generare energia. La quantità di energia
Metabolismo degli amminoacidi Gli amminoacidi derivati in gran parte dalla degradazione delle proteine della dieta o intracellulari possono essere ossidati per generare energia. La quantità di energia
Le proteine. Polimeri composto da 20 diversi aminoacidi
 Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
METABOLISMO delle PROTEINE
 METABOLISMO delle PROTEINE - Amminoacidi - Nucleotidi AZOTO essenziale per la vita In natura -N 2 atmosferico (N.B. N N triplo legame, molta energia per scinderlo) - ione nitrato NO 3 presente nel suolo
METABOLISMO delle PROTEINE - Amminoacidi - Nucleotidi AZOTO essenziale per la vita In natura -N 2 atmosferico (N.B. N N triplo legame, molta energia per scinderlo) - ione nitrato NO 3 presente nel suolo
ALIMENTAZIONE NELL UOMO
 ALIMENTAZIONE NELL UOMO Alimentazione e Nutrizione Corpo umano come macchina chimica che utilizza l energia chimica degli alimenti (quando si spezzano i legami chimici tra gli atomi che formano le macromolecole
ALIMENTAZIONE NELL UOMO Alimentazione e Nutrizione Corpo umano come macchina chimica che utilizza l energia chimica degli alimenti (quando si spezzano i legami chimici tra gli atomi che formano le macromolecole
Giovanni Di Bonaventura, Ph.D., B.Sc. Università di Chieti-Pescara
 Giovanni Di Bonaventura, Ph.D., B.Sc. Università di Chieti-Pescara Richieste metaboliche: elementi essenziali In generale, i batteri per la loro crescita hanno bisogno di elementi essenziali. In particolare
Giovanni Di Bonaventura, Ph.D., B.Sc. Università di Chieti-Pescara Richieste metaboliche: elementi essenziali In generale, i batteri per la loro crescita hanno bisogno di elementi essenziali. In particolare
Attenzione : lunedì 29 aprile NON ci sarà lezione
 Attenzione : lunedì 29 aprile NON ci sarà lezione Metabolismo dei lipidi a) Ossidazione degli acidi grassi Triacilgliceroli (90% del totale) Gruppi metilenici o metilici Richiedono molto O 2 per essere
Attenzione : lunedì 29 aprile NON ci sarà lezione Metabolismo dei lipidi a) Ossidazione degli acidi grassi Triacilgliceroli (90% del totale) Gruppi metilenici o metilici Richiedono molto O 2 per essere
4x4x4=4 3 =64 codoni. 20 aminoacidi
 4x4x4=4 3 =64 codoni 20 aminoacidi 1 Le 20 diverse catene laterali (gruppo R) che costituiscono gli aminoacidi si differenziano considerevolmente per dimensioni, volume e per le loro caratteristiche fisico-chimiche,
4x4x4=4 3 =64 codoni 20 aminoacidi 1 Le 20 diverse catene laterali (gruppo R) che costituiscono gli aminoacidi si differenziano considerevolmente per dimensioni, volume e per le loro caratteristiche fisico-chimiche,
BIOLOGIA GENERALE 22-24 ottobre 2007
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 22-24 ottobre 2007 Facoltà di Psicologia Tecniche di Psicologia Generale e Sperimentale Alessandro Massolo Dip.
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 22-24 ottobre 2007 Facoltà di Psicologia Tecniche di Psicologia Generale e Sperimentale Alessandro Massolo Dip.
L adattamento dei batteri. Strategie di adattamento
 L adattamento dei batteri Strategie di adattamento mutazione trasferimento genico orizzontale regolazione dell espressione genica regolazione della trascrizione regolazione della traduzione regolazione
L adattamento dei batteri Strategie di adattamento mutazione trasferimento genico orizzontale regolazione dell espressione genica regolazione della trascrizione regolazione della traduzione regolazione
19. Biosintesi e degradazione degli aminoacidi. Metabolismo delle proteine tratte dagli alimenti ed endogene. Introduzione. A.B.
 19. Biosintesi e degradazione degli aminoacidi A.B. Rawitch BIETTIVI DI APPRENDIMENT Dopo aver letto questo capitolo dovresti essere in grado di: n Descrivere i tre meccanismi che il nostro organismo utilizza
19. Biosintesi e degradazione degli aminoacidi A.B. Rawitch BIETTIVI DI APPRENDIMENT Dopo aver letto questo capitolo dovresti essere in grado di: n Descrivere i tre meccanismi che il nostro organismo utilizza
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
Biosintesi dei triacilgliceroli
 Biosintesi dei triacilgliceroli Destino della maggior parte degli acidi grassi sintetizzati o ingeriti: Ø triacilgliceroli (riserva) Ø fosfolipidi (membrane) in base alle necessità metaboliche I triacilgliceroli
Biosintesi dei triacilgliceroli Destino della maggior parte degli acidi grassi sintetizzati o ingeriti: Ø triacilgliceroli (riserva) Ø fosfolipidi (membrane) in base alle necessità metaboliche I triacilgliceroli
METABOLISMO DEL Glucosio
 METABLISM DEL Glucosio Il metabolismo del glucosio può essere suddiviso nelle seguenti vie metaboliche: Glicolisi ssidazione del glucosio in acido piruvico e acido lattico. Via del pentoso fosfato Via
METABLISM DEL Glucosio Il metabolismo del glucosio può essere suddiviso nelle seguenti vie metaboliche: Glicolisi ssidazione del glucosio in acido piruvico e acido lattico. Via del pentoso fosfato Via
A livello della loro struttura chimica, come i grassi, anche i carboidrati sono composti ternari, formati cioè da tre molecole:
 I carboidrati costituiscono la fonte di energia principale per lo svolgimento di tutte le funzioni organiche (mantenimento della temperatura corporea, battito cardiaco, funzioni cerebrali, digestione,
I carboidrati costituiscono la fonte di energia principale per lo svolgimento di tutte le funzioni organiche (mantenimento della temperatura corporea, battito cardiaco, funzioni cerebrali, digestione,
Mais, riso, patate, granozucchero di canna o barbabietola Latte da zucchero Polisaccaride Amido - - Disaccaride Maltosio Saccarosio Lattosio
 Abbiamo visto che i carboidrati sono la principale fonte di energia nell'alimentazione umana. Nella nostra dieta, sono sopratutto presenti nella forma di amido, ma anche il saccarosio è presente in una
Abbiamo visto che i carboidrati sono la principale fonte di energia nell'alimentazione umana. Nella nostra dieta, sono sopratutto presenti nella forma di amido, ma anche il saccarosio è presente in una
Le Biomolecole I parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Mediatore chimico. Recettore. Trasduzione del segnale. Risposta della cellula
 Mediatore chimico Recettore Trasduzione del segnale Risposta della cellula I mediatori chimici sono prodotti da cellule specializzate e sono diffusi nell organismo da apparati di distribuzione Sistemi
Mediatore chimico Recettore Trasduzione del segnale Risposta della cellula I mediatori chimici sono prodotti da cellule specializzate e sono diffusi nell organismo da apparati di distribuzione Sistemi
RNA polimerasi operone. L operatore è il tratto
 La regolazione genica nei procarioti Alcune proteine vengono prodotte dalla cellula ad un ritmo relativamente costante e l attività dei geni che codificano queste proteine non è regolata in modo sofisticato.
La regolazione genica nei procarioti Alcune proteine vengono prodotte dalla cellula ad un ritmo relativamente costante e l attività dei geni che codificano queste proteine non è regolata in modo sofisticato.
METABOLISMO E SISTEMI ENERGETICI
 METABOLISMO E SISTEMI ENERGETICI 1 Obiettivi della lezione 1) Capire come l organismo converta il cibo che ingeriamo in ATP per fornire ai muscoli l energia che essi necessitano per contrarsi. 2) Esaminare
METABOLISMO E SISTEMI ENERGETICI 1 Obiettivi della lezione 1) Capire come l organismo converta il cibo che ingeriamo in ATP per fornire ai muscoli l energia che essi necessitano per contrarsi. 2) Esaminare
Il ciclo nutrizione / digiuno
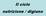 Il ciclo nutrizione / digiuno Aspetti generali La fase di assorbimento è il periodo che va dalle 2 alle 4 ore successive all assunzione di un pasto. Durante questo intervallo si verifica un transitorio
Il ciclo nutrizione / digiuno Aspetti generali La fase di assorbimento è il periodo che va dalle 2 alle 4 ore successive all assunzione di un pasto. Durante questo intervallo si verifica un transitorio
Macromolecole Biologiche. I domini (III)
 I domini (III) Domini α/β La cross over connection è l unità costitutiva su cui si basa la topologia di 3 tipi di domini α/β osservati nelle proteine: - α/β barrel - motivi ricchi di Leu (fold a ferro
I domini (III) Domini α/β La cross over connection è l unità costitutiva su cui si basa la topologia di 3 tipi di domini α/β osservati nelle proteine: - α/β barrel - motivi ricchi di Leu (fold a ferro
CONTROLLO ORMONALE DEL METABOLISMO GLUCIDICO DA PARTE DI GLUCAGONE, ADRENALINA E INSULINA
 CONTROLLO ORMONALE DEL METABOLISMO GLUCIDICO DA PARTE DI GLUCAGONE, ADRENALINA E INSULINA QUESTI ORMONI REGOLANO IL FLUSSO DEI METABOLITI NELLA GLICOLISI, NELLA GLICOGENO-SINTESI, NELLA GLIGENO-LISI E
CONTROLLO ORMONALE DEL METABOLISMO GLUCIDICO DA PARTE DI GLUCAGONE, ADRENALINA E INSULINA QUESTI ORMONI REGOLANO IL FLUSSO DEI METABOLITI NELLA GLICOLISI, NELLA GLICOGENO-SINTESI, NELLA GLIGENO-LISI E
FUNZIONI DEI MITOCONDRI
 FUNZIONI DEI MITOCONDRI La funzione principale dei mitocondri è di compiere le trasformazioni energetiche indispensabili per le funzioni cellulari. Metabolismo energetico: insieme delle reazioni chimiche
FUNZIONI DEI MITOCONDRI La funzione principale dei mitocondri è di compiere le trasformazioni energetiche indispensabili per le funzioni cellulari. Metabolismo energetico: insieme delle reazioni chimiche
La digestione degli alimenti
 La digestione degli alimenti Le sostanze alimentari complesse (lipidi, glucidi, protidi) che vengono introdotte nell organismo, devono subire delle profonde modificazioni che le trasformano in sostanze
La digestione degli alimenti Le sostanze alimentari complesse (lipidi, glucidi, protidi) che vengono introdotte nell organismo, devono subire delle profonde modificazioni che le trasformano in sostanze
TIAMINA (vitamina B1, aneurina)
 TIAMINA (vitamina B1, aneurina) Fonti alimentari: cereali integrali (germe e crusca), carne (maiale), lievito di birra, legumi Abbondanza nell organismo umano : 30-100 mg RDA (assunzione giornaliera di
TIAMINA (vitamina B1, aneurina) Fonti alimentari: cereali integrali (germe e crusca), carne (maiale), lievito di birra, legumi Abbondanza nell organismo umano : 30-100 mg RDA (assunzione giornaliera di
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 24
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 24 Una panoramica del metabolismo Concetti chiave: Organismi diversi utilizzano strategie differenti per catturare l'energia
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 24 Una panoramica del metabolismo Concetti chiave: Organismi diversi utilizzano strategie differenti per catturare l'energia
Le proteine. Le proteine sono i mattoncini che costituiscono gli organismi viventi.
 Le proteine Le proteine sono i mattoncini che costituiscono gli organismi viventi. Per avere un idea più precisa, basti pensare che tutti i muscoli del nostro corpo sono composti da filamenti di proteine
Le proteine Le proteine sono i mattoncini che costituiscono gli organismi viventi. Per avere un idea più precisa, basti pensare che tutti i muscoli del nostro corpo sono composti da filamenti di proteine
SINTESI PROTEICA. Replicazione. Trascrizione. Traduzione
 Replicazione SINTESI PROTEICA Trascrizione Traduzione 61 codoni codificanti 3 triplette non senso (STOP) AUG codone di inizio codone per Met Caratteristiche del codice genetico Specificità Il codice genetico
Replicazione SINTESI PROTEICA Trascrizione Traduzione 61 codoni codificanti 3 triplette non senso (STOP) AUG codone di inizio codone per Met Caratteristiche del codice genetico Specificità Il codice genetico
PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE
 Università di Roma Tor Vergata - Scienze della Nutrizione Umana Biochimica della Nutrizione Prof.ssa Luciana Avigliano 2011 PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE amminoacidi proteine
Università di Roma Tor Vergata - Scienze della Nutrizione Umana Biochimica della Nutrizione Prof.ssa Luciana Avigliano 2011 PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE amminoacidi proteine
ESERCITAZIONI DI BIOCHIMICA
 ESERCITAZIONI DI BIOCHIMICA La denaturazione delle proteine riguarda la struttura terziaria. La proteina attiva di solito è in forma globulare. La sequenza amminoacidica è responsabile dell assetto tridimensionale
ESERCITAZIONI DI BIOCHIMICA La denaturazione delle proteine riguarda la struttura terziaria. La proteina attiva di solito è in forma globulare. La sequenza amminoacidica è responsabile dell assetto tridimensionale
Capitolo 4: Le proteine: ossidazione degli amminoacidi, produzione dell urea e biosintesi degli amminoacidi
 Capitolo 4: Le proteine: ossidazione degli amminoacidi, produzione dell urea e biosintesi degli amminoacidi proteine della dieta nucleotidi, ammine biologiche amminoacidi proteine intracellulari ciclo
Capitolo 4: Le proteine: ossidazione degli amminoacidi, produzione dell urea e biosintesi degli amminoacidi proteine della dieta nucleotidi, ammine biologiche amminoacidi proteine intracellulari ciclo
Transferasi che hanno come coenzima FOSFOPANTOTEINA E COENZIMA A (derivati dalla VITAMINA B3 )
 Transferasi che hanno come coenzima FSFPANTTEINA E ENZIMA A (derivati dalla VITAMINA B3 ) Altre transferasi hanno come oe: Vitamina B3 (sintetizzata in vegetali e molti procarioti anche ospiti dell intestino
Transferasi che hanno come coenzima FSFPANTTEINA E ENZIMA A (derivati dalla VITAMINA B3 ) Altre transferasi hanno come oe: Vitamina B3 (sintetizzata in vegetali e molti procarioti anche ospiti dell intestino
METABOLISMO DEI LIPIDI
 METABOLISMO DEI LIPIDI Generalità I lipidi alimentari, per poter essere assorbiti dall organismo umano, devono essere preventivamente digeriti (ad eccezione del colesterolo), cioè, trasformati in molecole
METABOLISMO DEI LIPIDI Generalità I lipidi alimentari, per poter essere assorbiti dall organismo umano, devono essere preventivamente digeriti (ad eccezione del colesterolo), cioè, trasformati in molecole
Il DNA e la duplicazione cellulare. Acidi nucleici: DNA, materiale ereditario
 Il DN e la duplicazione cellulare Il DN, materiale ereditario Struttura del DN Replicazione del DN Dal DN alla proteina Il odice genetico iclo cellulare Mitosi Meiosi Da Figura 8-11 ampbell & Reece cidi
Il DN e la duplicazione cellulare Il DN, materiale ereditario Struttura del DN Replicazione del DN Dal DN alla proteina Il odice genetico iclo cellulare Mitosi Meiosi Da Figura 8-11 ampbell & Reece cidi
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici
 I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
CELLULE EUCARIOTICHE
 CELLULE EUCARIOTICHE Le cellule eucariotiche sono di maggiori dimensioni, rispetto a quelle procariotiche (almeno 10 volte più grandi) Oltre a: membrana plasmatica, citoplasma, DNA e ribosomi (comuni a
CELLULE EUCARIOTICHE Le cellule eucariotiche sono di maggiori dimensioni, rispetto a quelle procariotiche (almeno 10 volte più grandi) Oltre a: membrana plasmatica, citoplasma, DNA e ribosomi (comuni a
LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI PROTEINE. sono ACIDI NUCLEICI. molecole complesse = POLIMERI. formate dall'unione di
 LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
Ruolo metabolico delle flavine
 Ruolo metabolico delle flavine Deidrogenasi flaviniche che trasferiscono 2 elettroni Acil CoA deidrogenasi (beta ossidazione acidi grassi) Diidrolipoildeidrogenasi (complessi piruvato dh etc.) Glutatione
Ruolo metabolico delle flavine Deidrogenasi flaviniche che trasferiscono 2 elettroni Acil CoA deidrogenasi (beta ossidazione acidi grassi) Diidrolipoildeidrogenasi (complessi piruvato dh etc.) Glutatione
Valitutti, Taddei, Kreuzer, Massey, Sadava, Hills, Heller, Berenbaum
 Dal carbonio agli OGM VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni sono evidenziate
Dal carbonio agli OGM VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni sono evidenziate
a cura di : Gaia,Giulia, Lorenzo e Simone 2^ B ( LA MIGLIORE)
 a cura di : Gaia,Giulia, Lorenzo e Simone 2^ B ( LA MIGLIORE) I grassi nella piramide alimentare Forniscono molta ENERGIA!!! Danno gusto al cibo Trasportano alcune vitamine o LIPIDI Però se se ne mangiano
a cura di : Gaia,Giulia, Lorenzo e Simone 2^ B ( LA MIGLIORE) I grassi nella piramide alimentare Forniscono molta ENERGIA!!! Danno gusto al cibo Trasportano alcune vitamine o LIPIDI Però se se ne mangiano
Amminoacidi e Proteine
 Amminoacidi e Proteine Struttura generale di un α-amminoacido R = catena laterale AMMINOACIDI (AA) CELLULARI Gli amminoacidi presenti nella cellula possono essere il prodotto di idrolisi delle proteine
Amminoacidi e Proteine Struttura generale di un α-amminoacido R = catena laterale AMMINOACIDI (AA) CELLULARI Gli amminoacidi presenti nella cellula possono essere il prodotto di idrolisi delle proteine
Modello del collasso idrofobico. Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60
 Modello gerarchico Modello del collasso idrofobico Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60 Le Hsp70 si legano ai segmenti idrofobici di
Modello gerarchico Modello del collasso idrofobico Il folding è facilitato dalla presenza di chaperons molecolari quali le Heat Shock Proteins, Hsp70 e Hsp60 Le Hsp70 si legano ai segmenti idrofobici di
I peptidi sono polimeri formati da più amminoacidi, coniugati attraverso legami detti ammidici o peptidici.
 MODULO 5 IL METABOLISMO DEI COMPOSTI AZOTATI RICHIAMI SULLA CHIMICA DI AMMINO ACIDI E PROTEINE Introduzione Gli amminoacidi sono composti organici caratterizzati dalla presenza nella molecola di un gruppo
MODULO 5 IL METABOLISMO DEI COMPOSTI AZOTATI RICHIAMI SULLA CHIMICA DI AMMINO ACIDI E PROTEINE Introduzione Gli amminoacidi sono composti organici caratterizzati dalla presenza nella molecola di un gruppo
Svolgono funzioni biologiche di fondamentale importanza e possono essere divise in 7 gruppi principali:
 Svolgono funzioni biologiche di fondamentale importanza e possono essere divise in 7 gruppi principali: proteine strutturali (collagene, cheratine); proteine catalitiche (enzimi); proteine di trasporto
Svolgono funzioni biologiche di fondamentale importanza e possono essere divise in 7 gruppi principali: proteine strutturali (collagene, cheratine); proteine catalitiche (enzimi); proteine di trasporto
Mangiamo perché abbiamo bisogno di energia, di materiali con cui costruire il nostro corpo, di materiali per riparare parti del nostro corpo, di
 Mangiamo perché abbiamo bisogno di energia, di materiali con cui costruire il nostro corpo, di materiali per riparare parti del nostro corpo, di materiali per fare funzionare il nostro corpo È il carboidrato
Mangiamo perché abbiamo bisogno di energia, di materiali con cui costruire il nostro corpo, di materiali per riparare parti del nostro corpo, di materiali per fare funzionare il nostro corpo È il carboidrato
Attivitá e cinetica enzimatica
 Attivitá e cinetica enzimatica PAS : Classe di insegnamento A60 Biologia e scienze A.A. 2013/2014 09/05/2014 Cinetica Enzimatica La cinetica enzimatica è misurata come velocità di conversione del substrato
Attivitá e cinetica enzimatica PAS : Classe di insegnamento A60 Biologia e scienze A.A. 2013/2014 09/05/2014 Cinetica Enzimatica La cinetica enzimatica è misurata come velocità di conversione del substrato
METABOLISMO AMINO ACIDI
 METABOLISMO AMINO ACIDI AMINO ACIDI ESOGENI (ALIMENTAZIONE) POOL AMINO ACIDI PROTEINE DEMOLIZIONE AMINE BIOGENE ORMONI PROTEICI BASI AZOTATE.. SCHELETRO CARBONIOSO NH 3 RESINTESI CICLO KREBS LIPIDI (AA
METABOLISMO AMINO ACIDI AMINO ACIDI ESOGENI (ALIMENTAZIONE) POOL AMINO ACIDI PROTEINE DEMOLIZIONE AMINE BIOGENE ORMONI PROTEICI BASI AZOTATE.. SCHELETRO CARBONIOSO NH 3 RESINTESI CICLO KREBS LIPIDI (AA
Ossidazione degli amminoacidi e produzione dell urea
 Ossidazione degli amminoacidi e produzione dell urea Gli amminoacidi sono, con gli zuccheri ed i lipidi, la terza classe di molecole che, attraverso la degradazione ossidativa, contribuiscono significativamente
Ossidazione degli amminoacidi e produzione dell urea Gli amminoacidi sono, con gli zuccheri ed i lipidi, la terza classe di molecole che, attraverso la degradazione ossidativa, contribuiscono significativamente
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Niccolò Taddei Biochimica
 Niccolò Taddei Biochimica VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni sono
Niccolò Taddei Biochimica VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni sono
Nota dell editore Presentazione
 00PrPag 3-08-2007 11:42 Pagina V Autori Nota dell editore Presentazione XI XIII XV Parte I Chimica 1 Struttura dell atomo 3 Teorie atomiche 3 Costituenti dell atomo 4 Numeri quantici 5 Tipi di orbitali
00PrPag 3-08-2007 11:42 Pagina V Autori Nota dell editore Presentazione XI XIII XV Parte I Chimica 1 Struttura dell atomo 3 Teorie atomiche 3 Costituenti dell atomo 4 Numeri quantici 5 Tipi di orbitali
Progetto «Puliamo Garibaldi» Geanina Mihai VD Liceo classico Giulio Cesare
 Progetto «Puliamo Garibaldi» Geanina Mihai VD Liceo classico Giulio Cesare Qual è il rame e qual è lo stagno? E iniziato così questo progetto. Si tratta di «pulire Garibaldi»,quindi di pulire una statua.la
Progetto «Puliamo Garibaldi» Geanina Mihai VD Liceo classico Giulio Cesare Qual è il rame e qual è lo stagno? E iniziato così questo progetto. Si tratta di «pulire Garibaldi»,quindi di pulire una statua.la
ogni anno 200 miliardi di tonnellate di CO 2 vengono convertite in biomassa
 ogni anno 200 miliardi di tonnellate di CO 2 vengono convertite in biomassa La maggior parte di questo carbonio viene incorporato in composti organici attraverso le reazioni di riduzione del carbonio associate
ogni anno 200 miliardi di tonnellate di CO 2 vengono convertite in biomassa La maggior parte di questo carbonio viene incorporato in composti organici attraverso le reazioni di riduzione del carbonio associate
Tecniche di microscopia
 Tecniche di microscopia I microscopi permettono di vedere l estremamente piccolo I microscopi ottici utilizzano lenti di vetro in grado di deflettere e focalizzare i raggi luminosi per riprodurre le immagini
Tecniche di microscopia I microscopi permettono di vedere l estremamente piccolo I microscopi ottici utilizzano lenti di vetro in grado di deflettere e focalizzare i raggi luminosi per riprodurre le immagini
logo.jpg 18F-FDG Vari lavori hanno dimostrato che l accumulo di FDG correla con il Ki-67 MARKER DI PROLIFERAZIONE
 logo.jpg 18F-FDG 18F-FDG Entrata glucosio nelle cellule Segue due vie: diffusione facilitata (in presenza di eccesso) trasporto attivo Na-dipendente (richiede energia) logo.jpg FDG si accumula in base
logo.jpg 18F-FDG 18F-FDG Entrata glucosio nelle cellule Segue due vie: diffusione facilitata (in presenza di eccesso) trasporto attivo Na-dipendente (richiede energia) logo.jpg FDG si accumula in base
3.3. UMAMI NEGLI ALIMENTI
 3.3. UMAMI NEGLI ALIMENTI In questo capitolo saranno esaminati i vari cibi, ad esclusione di quelli ittici che verranno presi in considerazione successivamente, allo scopo di scoprire se in essi è presente,
3.3. UMAMI NEGLI ALIMENTI In questo capitolo saranno esaminati i vari cibi, ad esclusione di quelli ittici che verranno presi in considerazione successivamente, allo scopo di scoprire se in essi è presente,
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA
 PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
Dal DNA all RNA. La trascrizione nei procarioti e negli eucarioti
 Dal DNA all RNA La trascrizione nei procarioti e negli eucarioti DOGMA CENTRALE DELLA BIOLOGIA MOLECOLARE Gene Regione di DNA che porta l informazione (= che CODIFICA) per una catena polipeptidica o per
Dal DNA all RNA La trascrizione nei procarioti e negli eucarioti DOGMA CENTRALE DELLA BIOLOGIA MOLECOLARE Gene Regione di DNA che porta l informazione (= che CODIFICA) per una catena polipeptidica o per
