- Dati sperimentali: interazione luce / materia spettri caratteristici
|
|
|
- Arianna Di Lorenzo
- 4 anni fa
- Visualizzazioni
Transcript
1 - Thomson: evidenza sperimentale per elettrone misura e/m e - Millikan: misura la carica dell elettrone e ne ricava la massa e = 1,60 x C - Rutherford: stima le dimensioni atomiche struttura vuota dell atomo «sistema planetario» - Dati sperimentali: interazione luce / materia spettri caratteristici Non supportabile con le teorie classiche! di emissione di assorbimento Forma di Energia Radiazione elettromagnetica: Risultante di due campi elettrico e magnetico perpendicolari e oscillanti lungo il senso di propagazione λ(m) lunghezza d onda; ν (s -1 ) frequenza ν (s -1 ) = c (m s -1 ) / λ(m) xché? Planck: radiazione del corpo nero Einstein: effetto fotoelettrico ipotizza quantizzazione dell energia con E = h ν ipotizza natura corpuscolare della luce con energia del fotone E = h ν Bohr: «sistema planetario» con quantizzazione del momento angolare dell elettrone mv r = n h/π r = n h /4 π m e Z e E n = -1/n π me 4 Z / h
2 Per la luce: onda/particella Per le particelle? Onde stazionarie e Ipotesi di De Broglie: d = n λ/ π r = n λ Quantizzazione onde stazionarie Se alla particella e - in moto su un orbita circolare fosse associata un onda, allora: λ = π r/n con r = n h/ π m v (Bohr) λ = h / m e v e per elettrone con E = m c = h ν (Einstein) λ = h / m c per fotone λ = h / m v per ogni corpo di massa m e che si muova con velocità v!
3 verifichiamo Palla da golf : m = 45 g; v = 30 m/s λ = h / mv = 4,9x10-34 m Non è possibile verificare sperimentalmente!!! Elettrone nella 1 a orbita dell atomo di idrogeno: m = 9,11x10-31 Kg; v =,19x10 6 m/s λ = h / mv = 3,3x10-10 m È possibile verificare sperimentalmente!!! con la diffrazione, fenomeno tipicamente ondulatorio, che si verifica quando un'onda attraversa una fenditura o trova un ostacolo sul suo cammino: si produce una deviazione delle traiettorie di propagazione. La diffrazione appare evidente se le dimensioni della fenditura sono simili a quelle della lunghezza d'onda della radiazione incidente. Principio di indeterminazione di Heisenberg Non è possibile determinare contemporaneamente e con la stessa precisione posizione e quantità di moto di una particella-onda di dimensioni atomiche Δp Δx h / 4π verifichiamo massima incertezza sulla posizione 10-1 m (dimensioni atomiche): Δp Δx h / 4π se Δx ~ 10-1 m, allora Δp ~ 5,3x 10-3 Kg m s -1 da cui Δv = Δp / m e = 5,8x10 7 m s -1!!!
4 1. Dati sperimentali: esperimenti di interazione della luce con la materia spettri di emissione e di assorbimento. Ipotesi di Planck: quantizzazione dell energia E = n hν 3. Ipotesi di Einstein: natura corpuscolare della luce Per il fotone: E = hν Nasce la Meccanica Quantistica descrive i sistemi microscopici 4. Ipotesi di De Broglie: dualismo onda-corpuscolo λ = h / mv 1. i sistemi microscopici scambiano energia solo in quantità discrete. 5. Principio di Indeterminazione di Heisenberg: Δp Δx h / 4π. il moto delle particelle microscopiche è descritto in termini probabilistici.
5 Il moto di un elettrone descritto in termini ondulatori Equazione di Schrödinger: (-h / 8π m) d ψ (x) /dx + V(x) ψ(x) = E tot ψ(x) per una particella in moto lungo una sola direzione non soggetta a forza esterne quindi con V(x) = 0 Eq. Fondamentale della Meccanica Quantistica (-h / 8π m) d ψ /dx + d ψ/dy + d ψ /dz + V ψ = E tot ψ per e - in moto nelle tre direzioni dello spazio (x,y,z) o (r,θ, φ) e soggetto al campo elettrico del nucleo Risolvere l equazione significa trovare le funzioni d onda soluzioni ψ (x,y,z) o ORBITALI ψ ψ ψ (x,y,z) ΔV ampiezza dell onda in ogni punto dello spazio densità di probabilità per la particella probabilità che la particella si trovi nel volume ΔV(ΔxΔyΔz) o Δτ nell intorno del punto (x,y,z) o (r, θ, φ) (ψ continua, ad un solo valore in ogni punto dello spazio e con ψ dv = 1)
6 Infinite soluzioni ψ possibili, MA solo per valori DISCRETI di E si hanno soluzioni ψ indipendenti dal tempo, dette STATI STAZIONARI: QUANTIZZAZIONE COME CONSEGUENZA E NON COME IPOTESI!!! Quindi dalla soluzione dell EQ.: gli ORBITALI ψ valori permessi di E Ogni ORBITALE è definito da una terna di parametri n, l, m: n quantizza l energia E n E = E n = - Z e 4 m e / 8 ε 0 n h l quantizza il quadrato del momento angolare L L = l (l+1) h /4 π m quantizza la proiezione di L sull asse z L z = m h/ π I parametri n, l, m sono legati dalle relazioni: n = 1,,3 l = 0, (n-1) m = ±l, 0
7 Ogni terna di numeri quantici n, l, m identifica uno STATO QUANTICO dell atomo in cui e - possiede: E = E n ; L = h/π l(l+1) ; L z = m h/π n = 1 l = 0 m = 0 (1 stato quantico) n = l = 0 m = 0 l = 1 m = -1, 0, +1 (4 stati quantici) n = 3 l = 0 m = 0 l = 1 m = -1, 0, +1 l = m = -, -1, 0, +1, + (9 stati quantici) per ogni E n n stati quantici isoenergetici (degeneri) Dato un volume infinitesimo dτ: (ψ nlm ) dτ = [R nl (r)] [Y lm (θ, φ)] d τ probabilità di trovare e - nel volume dτ nell intorno di (r, θ, φ) nello stato quantico n, l, m Analisi grafica della funzione d onda forma dell orbitale descrizione quantistica del legame chimico e della forma delle molecole
8 Forma e dimensione degli orbitali n = l,,3 l = 0 ψ n0 (r) Orbitali s simmetria sferica rispetto al nucleo Rappresentazione grafica: metodo tridimensionale: ombreggiature grafico: distribuzione della densità di probabilità vs r Inoltre: r R n0 (r) vs r distribuzione di probabilità radiale vs r Dato un incremento dr, r R n0 (r) dr fornisce la probabilità di trovare l elettrone ovunque all interno di un guscio sferico di spessore dr, a distanza r dal nucleo
9 Forma e dimensione degli orbitali n =,3 l = 1 m = -1, 0, +1 ψ n1 Orbitali p simmetria non sferica TRE orbitali ψ n1 combinazioni lineari 3 Orbitali np: p y p x p z p x p y p z - Massima ampiezza lungo gli assi x, y, z - Piani nodali xy, xz, yz: la funzione si annulla e cambia segno stessa forma ma diverse orientazioni
10 Forma e dimensione degli orbitali n = 3 l = m = -, -1, 0, +1, + ψ n Orbitali d simmetria non sferica CINQUE orbitali ψ n d xy d xz d yz d x -y d z Massima ampiezza a 45 nei piani xy, xz, yz e lungo gli assi sul piano xy combinazioni lineari 4 Orbitali nd: d xy d yz d xz d x -y stessa forma ma diverse orientazioni + un QUINTO orbitale nd d z forma diversa
11 E le dimensioni? L atomo non ha confini! ma un limite arbitrario: contorno all interno del quale si ha una probabilità definita di trovare l elettrone (es. 90% ) Oppure Nota: tutte le funzioni radiali si annullano sul nucleo tranne le ns contorno in cui si ha la massima probabilità di trovare l elettrone. Riassumendo per Atomo Monoelettronico E dipende solo da n - l definisce la forma dell orbitale - la dimensione cioè la distanza media di e - dal nucleo cresce al crescere di n Livelli energetici dell atomo H Per r 0 ψ nlm (r, θ, φ) si annulla sempre tranne che per gli ns quindi solo sull orbitale s l elettrone ha probabilità non nulla di trovarsi sul nucleo
12 Gli atomi polielettronici Il più semplice, He: elettroni e nucleo con carica + Risolvere l Eq. comporta complicazioni matematiche con soluzioni di difficile interpretazione Approssimazione orbitalica del campo autoconsistente di Hartree 1. si imposta l Eq. Esatta: ogni elettrone è attratto e respinto dalle altre cariche. si approssima: ogni elettrone si muove in un campo elettrico «effettivo» a simmetria sferica, dovuto al nucleo ed agli altri e - Orbitali monoelettronici simili a quelli di H ψ nlm con stesse limitazioni per n, l, m - Modello a gusci (e - stesso n) e sottogusci (e - stesso nl) - E E H (e - poco schermati più vicini al nucleo; e - molto schermati più lontani ) - Rimozione della degenerazione nei sottogusci (ns meno schermati di np ed nd, quindi ns più penetranti sul nucleo) Infine: per ogni elettrone: m s = ± ½ Spin elettronico (da effetti relativistici non inclusi nell Eq.)
13 n, l, m descrive l orbitale n, l, m, m s descrive l elettrone Raddoppia il numero di stati quantici per E n : n MA COME E FATTO L ATOMO? Perché da questo dipendono le proprietà della materia! Come costruire un atomo: 1. Sequenza livelli energetici. Riempire degli orbitali partendo dal basso seguendo: Principio di esclusione di Pauli Nello stesso atomo non possono esistere due elettroni con la stessa quaterna di numeri quantici. Principio della massima molteplicità Gli elettroni si dispongono a spin parallelo sul massimo numero di orbitali isoenergetici disponibili CONFIGURAZIONI ELETTRONICHE
14 Tavola Periodica degli Elementi
15 Raggio atomico Energia di 1 a ionizzazione
Generalità delle onde elettromagnetiche
 Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Comune ordine di riempimento degli orbitali di un atomo
 Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
1 3 STRUTTURA ATOMICA
 1 3 STRUTTURA ATOMICA COME SI SPIEGA LA STRUTTURA DELL ATOMO? Secondo il modello atomico di Rutherford e sulla base della fisica classica, gli elettroni dovrebbero collassare sul nucleo per effetto delle
1 3 STRUTTURA ATOMICA COME SI SPIEGA LA STRUTTURA DELL ATOMO? Secondo il modello atomico di Rutherford e sulla base della fisica classica, gli elettroni dovrebbero collassare sul nucleo per effetto delle
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE
 LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica
 ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE
 LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA. (Plank Einstein)
 L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton)
 Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno:
 La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno: Vedi documento Atomo di Bohr.pdf sul materiale didattico per la derivazione di queste equazioni Livelli Energetici dell Atomo di Idrogeno
La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno: Vedi documento Atomo di Bohr.pdf sul materiale didattico per la derivazione di queste equazioni Livelli Energetici dell Atomo di Idrogeno
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Struttura Elettronica degli Atomi Meccanica quantistica
 Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
ATOMO. Avogadro (1811) Volumi uguali di gas diversi contengono un ugual numero di MOLECOLE (N A =6,022*10 23 )
 ATOMO Democrito IV secolo A.C. (atomos = indivisibile) Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811)
ATOMO Democrito IV secolo A.C. (atomos = indivisibile) Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811)
Modelli atomici Modello atomico di Rutheford Per t s d u i diare la t s rutt ttura t a omica Ruth th f or (
 Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford (1871-1937) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio) Rutherford suppose che gli atomi
Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford (1871-1937) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio) Rutherford suppose che gli atomi
Teoria Atomica Moderna. Chimica generale ed Inorganica: Chimica Generale. sorgenti di emissione di luce. E = hν. νλ = c. E = mc 2
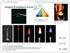 sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
mvr = n h e 2 r = m v 2 e m r v = La configurazione elettronica r = e 2 m v 2 (1) Quantizzazione del momento angolare (2) 4 πε.
 La configurazione elettronica Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica F = m a. F Coulomb = 1 4 πε. q q ' F r centrifuga = m v r ε =8.85*10-1 Fm-1 (costante
La configurazione elettronica Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica F = m a. F Coulomb = 1 4 πε. q q ' F r centrifuga = m v r ε =8.85*10-1 Fm-1 (costante
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
Capitolo 8 La struttura dell atomo
 Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
ATOMI E PARTICELLE SUBATOMICHE
 ATOMI E PARTICELLE SUBATOMICHE ELETTRICITÀ DELL ATOMO ESISTONO DUE TIPI DI CARICHE ELETTRICHE, DENOMINATE CONVENZIONALMENTE NEGATIVA E POSITIVA CARICHE DI SEGNO UGUALE SI RESPINGONO, MENTRE CARICHE DI
ATOMI E PARTICELLE SUBATOMICHE ELETTRICITÀ DELL ATOMO ESISTONO DUE TIPI DI CARICHE ELETTRICHE, DENOMINATE CONVENZIONALMENTE NEGATIVA E POSITIVA CARICHE DI SEGNO UGUALE SI RESPINGONO, MENTRE CARICHE DI
Il principio di indeterminazione di Heisenberg
 Il principio di indeterminazione di Heisenberg Il prodotto degli errori nella determinazione contemporanea della quantità di moto (q = mv) e della posizione di un corpo in movimento è almeno uguale a h
Il principio di indeterminazione di Heisenberg Il prodotto degli errori nella determinazione contemporanea della quantità di moto (q = mv) e della posizione di un corpo in movimento è almeno uguale a h
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
Lezione n. 19. L equazione. di Schrodinger L atomo. di idrogeno Orbitali atomici. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole
 Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole Secondo questa teoria l elettrone può essere descritto come fosse un
Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole Secondo questa teoria l elettrone può essere descritto come fosse un
A Z. L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone. +1e e.
 L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone +1e 0-1e e = Carica elettrica elementare 1.60 10-19 u.m.a.= Unità di Massa Atomica 1.6605 10-4 Il Nuclide A Z Nu Coulomb
L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone +1e 0-1e e = Carica elettrica elementare 1.60 10-19 u.m.a.= Unità di Massa Atomica 1.6605 10-4 Il Nuclide A Z Nu Coulomb
Le Caratteristiche della Luce
 7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
COMPORTAMENTO DUALISTICO della MATERIA
 COMPORTAMENTO DUALISTICO della MATERIA Come la luce anche la materia assume comportamento dualistico. Equazione di De Broglie: λ = h/mv Per oggetti macroscopici la lunghezza d onda è così piccola da non
COMPORTAMENTO DUALISTICO della MATERIA Come la luce anche la materia assume comportamento dualistico. Equazione di De Broglie: λ = h/mv Per oggetti macroscopici la lunghezza d onda è così piccola da non
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO
 La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
La struttura dell atomo
 La struttura dell atomo raggi catodici (elettroni) raggi canale (ioni positivi) Modello di Thomson Atomo come una piccola sfera omogenea carica di elettricità positiva, nella quale sono dispersi gli elettroni,
La struttura dell atomo raggi catodici (elettroni) raggi canale (ioni positivi) Modello di Thomson Atomo come una piccola sfera omogenea carica di elettricità positiva, nella quale sono dispersi gli elettroni,
Nell'atomo l'energia dell'elettrone varia per quantità discrete (quanti).
 4. ORBITALI ATOMICI Energia degli orbitali atomici Nell'atomo l'energia dell'elettrone varia per quantità discrete (quanti). Il diagramma energetico dell'atomo di idrogeno: i livelli (individuati da n)
4. ORBITALI ATOMICI Energia degli orbitali atomici Nell'atomo l'energia dell'elettrone varia per quantità discrete (quanti). Il diagramma energetico dell'atomo di idrogeno: i livelli (individuati da n)
Teoria Atomica di Dalton
 Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Atomo. Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale)
 Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano
Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano
n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]
![n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm] n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]](/thumbs/92/108343390.jpg) Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
La struttura dell atomo
 La Teoria Atomica La struttura dell atomo 10-10 m 10-14 m Proprietà delle tre particelle subatomiche fondamentali Carica Massa Nome (simbolo) relativa assoluta (C) relativa (uma)* Assoluta (g) Posizione
La Teoria Atomica La struttura dell atomo 10-10 m 10-14 m Proprietà delle tre particelle subatomiche fondamentali Carica Massa Nome (simbolo) relativa assoluta (C) relativa (uma)* Assoluta (g) Posizione
Elementi di struttura della materia
 Elementi di struttura della materia Luigi Sangaletti Università Cattolica del Sacro Cuore Dipartimento di Matematica e Fisica a.a. 2004-2005 Quantizzazione delle energie Tracciare ed identificare i primi
Elementi di struttura della materia Luigi Sangaletti Università Cattolica del Sacro Cuore Dipartimento di Matematica e Fisica a.a. 2004-2005 Quantizzazione delle energie Tracciare ed identificare i primi
Introduzione al corso. Cenni storici ed evidenze sperimentali determinanti lo sviluppo della fisica atomica come la conosciamo ora...
 Introduzione al corso Cenni storici ed evidenze sperimentali determinanti lo sviluppo della fisica atomica come la conosciamo ora... Legge di Boyle (1662)-> La pressione di un gas cresce quando decresce
Introduzione al corso Cenni storici ed evidenze sperimentali determinanti lo sviluppo della fisica atomica come la conosciamo ora... Legge di Boyle (1662)-> La pressione di un gas cresce quando decresce
Comunicazioni Docente - Studenti
 Comunicazioni Docente - Studenti 1. Lista di distribuzione: francesco.musiani.chimgenbiotech 2. Scrivere (moderatamente) a: francesco.musiani@unibo.it 3. Avvisi sul sito del docente: https://www.unibo.it/sitoweb/francesco.musiani
Comunicazioni Docente - Studenti 1. Lista di distribuzione: francesco.musiani.chimgenbiotech 2. Scrivere (moderatamente) a: francesco.musiani@unibo.it 3. Avvisi sul sito del docente: https://www.unibo.it/sitoweb/francesco.musiani
Struttura elettronica degli atomi. La teoria dei quanti e la meccanica ondulatoria. La moderna descrizione dell atomo
 Struttura elettronica degli atomi La teoria dei quanti e la meccanica ondulatoria La moderna descrizione dell atomo 1 Generalità delle onde elettromagnetiche λ Ampiezza massima: E max (B max ) Lunghezza
Struttura elettronica degli atomi La teoria dei quanti e la meccanica ondulatoria La moderna descrizione dell atomo 1 Generalità delle onde elettromagnetiche λ Ampiezza massima: E max (B max ) Lunghezza
raggio atomico: raggio del nucleo: cm cm
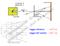 raggio atomico: raggio del nucleo: 10 10 8 1 cm cm Modello di Rutherford: contrasto con la fisica classica perché prima o poi l elettrone avrebbe dovuto cadere sul nucleo irradiando Energia. Le leggi valide
raggio atomico: raggio del nucleo: 10 10 8 1 cm cm Modello di Rutherford: contrasto con la fisica classica perché prima o poi l elettrone avrebbe dovuto cadere sul nucleo irradiando Energia. Le leggi valide
ATOMI MONOELETTRONICI
 ATOMI MONOELETTRONICI L equazione di Schrödinger per gli atomi contenenti un solo elettrone (atomo di idrogeno, ioni He +, Li 2+ ) può essere risolta in maniera esatta e le soluzioni ottenute permettono
ATOMI MONOELETTRONICI L equazione di Schrödinger per gli atomi contenenti un solo elettrone (atomo di idrogeno, ioni He +, Li 2+ ) può essere risolta in maniera esatta e le soluzioni ottenute permettono
STRUTTURA DELL'ATOMO
 STRUTTURA DELL'ATOMO IDROGENO 1 H ELIO He 1 2 4 Modello planetario di Rutherford -protoni e neutroni costituiscono il nucleo in cui è concentrata tutta la massa - gli elettroni ruotano attorno al nucleo
STRUTTURA DELL'ATOMO IDROGENO 1 H ELIO He 1 2 4 Modello planetario di Rutherford -protoni e neutroni costituiscono il nucleo in cui è concentrata tutta la massa - gli elettroni ruotano attorno al nucleo
Corso di CHIMICA LEZIONE 2
 Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
Introduzione alla meccanica quantistica. Vincenzo Barone
 Accademia delle Scienze di Torino 9 novembre 2017 Introduzione alla meccanica quantistica Vincenzo Barone barone@to.infn.it Parte I: Le basi della meccanica quantistica (questioni didattiche) Parte II:
Accademia delle Scienze di Torino 9 novembre 2017 Introduzione alla meccanica quantistica Vincenzo Barone barone@to.infn.it Parte I: Le basi della meccanica quantistica (questioni didattiche) Parte II:
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA
 LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
the power of ten Prof.ssa Patrizia Gallucci
 https://www.youtube.com/watch?v=5ckd0apswe8 the power of ten Prof.ssa Patrizia Gallucci ESPERIMENTO DI RUTHEFORD Dopo l esperimento Rutheford ipotizzò un atomo con un nucleo centrale,formato da neutroni
https://www.youtube.com/watch?v=5ckd0apswe8 the power of ten Prof.ssa Patrizia Gallucci ESPERIMENTO DI RUTHEFORD Dopo l esperimento Rutheford ipotizzò un atomo con un nucleo centrale,formato da neutroni
Seconda parte Teorie atomiche. Configurazione elettronica. Il legame chimico. Prof. Stefano Piotto Università di Salerno
 Seconda parte Teorie atomiche. Configurazione elettronica. Il legame chimico Prof. Stefano Piotto Università di Salerno Seconda parte 1. Teoria atomica 2. Esperimenti di Thompson e Millikan 3. Modello
Seconda parte Teorie atomiche. Configurazione elettronica. Il legame chimico Prof. Stefano Piotto Università di Salerno Seconda parte 1. Teoria atomica 2. Esperimenti di Thompson e Millikan 3. Modello
Struttura elettronica degli atomi. La teoria dei quanti e la meccanica ondulatoria. La moderna descrizione dell atomo
 Struttura elettronica degli atomi La teoria dei quanti e la meccanica ondulatoria La moderna descrizione dell atomo 1 La radiazione elettromagnetica Per spiegare i fenomeni relativi alla radiazione elettromagnetica
Struttura elettronica degli atomi La teoria dei quanti e la meccanica ondulatoria La moderna descrizione dell atomo 1 La radiazione elettromagnetica Per spiegare i fenomeni relativi alla radiazione elettromagnetica
Struttura atomica, configurazione elettronica e periodicità chimica
 Struttura atomica, configurazione elettronica e periodicità chimica Dualismo onda-particella (V. de Broglie) Principio di indeterminazione (W. Heisenberg) Equazione di Shrodinger(1925) Modello quantomeccanico
Struttura atomica, configurazione elettronica e periodicità chimica Dualismo onda-particella (V. de Broglie) Principio di indeterminazione (W. Heisenberg) Equazione di Shrodinger(1925) Modello quantomeccanico
Teoria atomica. Dr. Lucia Tonucci Ingegneria delle Costruzioni
 Teoria atomica Dr. Lucia Tonucci l.tonucci@unich.it Ingegneria delle Costruzioni Cenni storici V Sec. a.c. Democrito: la materia è costituita da corpuscoli indivisibili, gli atomi (atomo = indivisibile)
Teoria atomica Dr. Lucia Tonucci l.tonucci@unich.it Ingegneria delle Costruzioni Cenni storici V Sec. a.c. Democrito: la materia è costituita da corpuscoli indivisibili, gli atomi (atomo = indivisibile)
Struttura elettronica degli atomi. La teoria dei quanti e la meccanica ondulatoria. La moderna descrizione dell atomo
 Struttura elettronica degli atomi La teoria dei quanti e la meccanica ondulatoria La moderna descrizione dell atomo 1 La radiazione elettromagnetica Per spiegare i fenomeni relativi alla radiazione elettromagnetica
Struttura elettronica degli atomi La teoria dei quanti e la meccanica ondulatoria La moderna descrizione dell atomo 1 La radiazione elettromagnetica Per spiegare i fenomeni relativi alla radiazione elettromagnetica
Come sono disposti gli elettroni intorno al nucleo in un atomo?
 Come sono disposti gli elettroni intorno al nucleo in un atomo? La natura ondulatoria della radiazione elettromagnetica e della luce La luce è una radiazione elettromagnetica che si muove nello spazio
Come sono disposti gli elettroni intorno al nucleo in un atomo? La natura ondulatoria della radiazione elettromagnetica e della luce La luce è una radiazione elettromagnetica che si muove nello spazio
L atomo di Bohr. Argomenti. Al tempo di Bohr. Spettri atomici 19/03/2010
 Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
Enrico Silva - diritti riservati - Non è permessa, fra l altro, l inclusione anche parziale in altre opere senza il consenso scritto dell autore
 Indeterminazione Finora si sono considerate le proprietà ondulatorie, lavorando sulla fase di una (per ora non meglio specificata) funzione. Si sono ricavate o ipotizzate relazioni per: - lunghezza d onda
Indeterminazione Finora si sono considerate le proprietà ondulatorie, lavorando sulla fase di una (per ora non meglio specificata) funzione. Si sono ricavate o ipotizzate relazioni per: - lunghezza d onda
La struttura degli atomi
 1 La struttura degli atomi pg. 298 27-28 31-37 43 47 51-53 55-57 61-62 67(a/h) 68(a/i) La struttura degli atomi e gli andamenti periodici pg.332 1-7 11-15 17-18 27-30 37 40-42 51 Solvay conference, 1927
1 La struttura degli atomi pg. 298 27-28 31-37 43 47 51-53 55-57 61-62 67(a/h) 68(a/i) La struttura degli atomi e gli andamenti periodici pg.332 1-7 11-15 17-18 27-30 37 40-42 51 Solvay conference, 1927
LA RADIAZIONE ELETTROMAGNETICA. c = λ ν. c = 2, m s-1 (nel vuoto)
 LA RADIAZIONE ELETTROMAGNETICA c = λ ν c = 2,9979 108 m s-1 (nel vuoto) THE ELECTROMAGNETIC SPECTRUM E (erg) Alta energia Alta frequenza Piccola λ 10-6 VISIBLE X RAYS 2 10-12 ULTRAVIOLET 2 10-10 2 10-14
LA RADIAZIONE ELETTROMAGNETICA c = λ ν c = 2,9979 108 m s-1 (nel vuoto) THE ELECTROMAGNETIC SPECTRUM E (erg) Alta energia Alta frequenza Piccola λ 10-6 VISIBLE X RAYS 2 10-12 ULTRAVIOLET 2 10-10 2 10-14
3. Struttura dell atomo
 Di cosa parleremo L organizzazione interna delle particelle che costituiscono gli atomi è stata oggetto di studio per lungo tempo e le ipotesi sulla struttura atomica si sono evolute nel tempo in base
Di cosa parleremo L organizzazione interna delle particelle che costituiscono gli atomi è stata oggetto di studio per lungo tempo e le ipotesi sulla struttura atomica si sono evolute nel tempo in base
Fisica Moderna e contemporanea
 Fisica Moderna e contemporanea SSIS Puglia Prof. Luigi Schiavulli luigi.schiavulli@ba.infn.it Dipartimento Interateneo di Fisica Michelangelo Merlin 02/02/2006 1 Sommario Quadro riassuntivo sulla Fisica
Fisica Moderna e contemporanea SSIS Puglia Prof. Luigi Schiavulli luigi.schiavulli@ba.infn.it Dipartimento Interateneo di Fisica Michelangelo Merlin 02/02/2006 1 Sommario Quadro riassuntivo sulla Fisica
L evoluzione del modello di atomo
 L evoluzione del modello di atomo Dalton (1803) Thomson (1898) Rutherford (1911) Bohr (1913) L atomo di Bohr e la quantizzazione dell energia I pianeti più interni sentono maggiormente l attrazione gravitazionale
L evoluzione del modello di atomo Dalton (1803) Thomson (1898) Rutherford (1911) Bohr (1913) L atomo di Bohr e la quantizzazione dell energia I pianeti più interni sentono maggiormente l attrazione gravitazionale
J.J. Thomson (1897): dimostra l esistenza dell elettrone E. Ruthenford (1911): dimostra l esistenza del nucleo
 STRUTTURA dell ATOMO J.J. Thomson (1897): dimostra l esistenza dell elettrone E. Ruthenford (1911): dimostra l esistenza del nucleo J. Chadwich (193): dimostra l esistenza del neutrone J.J. Thomson (1897):
STRUTTURA dell ATOMO J.J. Thomson (1897): dimostra l esistenza dell elettrone E. Ruthenford (1911): dimostra l esistenza del nucleo J. Chadwich (193): dimostra l esistenza del neutrone J.J. Thomson (1897):
CORSO DI LAUREA IN OTTICA E OPTOMETRIA
 CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
La struttura dell atomo
 La struttura dell atomo Il modello di Thomson Il modello di Rutherford Il modello di Bohr Teoria di Sommerfeld ed effetto Zeeman Il modello ondulatorio Il modello ondulatorio Difetto fondamentale del modello
La struttura dell atomo Il modello di Thomson Il modello di Rutherford Il modello di Bohr Teoria di Sommerfeld ed effetto Zeeman Il modello ondulatorio Il modello ondulatorio Difetto fondamentale del modello
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI I numeri quantici Le funzioni d onda Ψ n, soluzioni dell equazione d onda, sono caratterizzate da certe combinazioni di numeri quantici: n, l, m l, m s n = numero quantico principale,
GLI ORBITALI ATOMICI I numeri quantici Le funzioni d onda Ψ n, soluzioni dell equazione d onda, sono caratterizzate da certe combinazioni di numeri quantici: n, l, m l, m s n = numero quantico principale,
Modello atomico ad orbitali e numeri quantici
 Modello atomico ad orbitali e numeri quantici Il modello atomico di Bohr permette di scrivere correttamente la configurazione elettronica di un atomo ma ha dei limiti che sono stati superati con l introduzione
Modello atomico ad orbitali e numeri quantici Il modello atomico di Bohr permette di scrivere correttamente la configurazione elettronica di un atomo ma ha dei limiti che sono stati superati con l introduzione
Struttura elettronica degli atomi. La teoria dei quanti e la meccanica ondulatoria. La moderna descrizione dell atomo
 Struttura elettronica degli atomi La teoria dei quanti e la meccanica ondulatoria La moderna descrizione dell atomo 1 Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza
Struttura elettronica degli atomi La teoria dei quanti e la meccanica ondulatoria La moderna descrizione dell atomo 1 Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza
Lezione n. 13. Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo. di idrogeno. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 13 Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo di idrogeno Antonino Polimeno 1 Radiazione elettromagnetica (1) - Rappresentazione
Chimica Fisica Biotecnologie sanitarie Lezione n. 13 Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo di idrogeno Antonino Polimeno 1 Radiazione elettromagnetica (1) - Rappresentazione
Rappresentazione dell atomo. Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano.
 Rappresentazione dell atomo Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano. Informazioni importanti circa la dimensione dell atomo e la distribuzione della massa
Rappresentazione dell atomo Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano. Informazioni importanti circa la dimensione dell atomo e la distribuzione della massa
Campo elettromagnetico
 Campo elettromagnetico z y Classicamente, è formato da un campo elettrico E e da un campo magnetico B oscillanti B E λ E = E 0 cos 2π(νt x/λ) B = B 0 cos 2π(νt x/λ) νλ = c ν, frequenza x λ, lunghezza d
Campo elettromagnetico z y Classicamente, è formato da un campo elettrico E e da un campo magnetico B oscillanti B E λ E = E 0 cos 2π(νt x/λ) B = B 0 cos 2π(νt x/λ) νλ = c ν, frequenza x λ, lunghezza d
Effetti relativistici e quantistici
 Effetti relativistici e quantistici Dott. Fabiano Nart Gruppo Divulgazione Scientifica Dolomiti E. Fermi www.gdsdolomiti.org info.gdsdolomiti@gmail.com Museo Scienze Naturali Bolzano, 24/05/2016 Dott.
Effetti relativistici e quantistici Dott. Fabiano Nart Gruppo Divulgazione Scientifica Dolomiti E. Fermi www.gdsdolomiti.org info.gdsdolomiti@gmail.com Museo Scienze Naturali Bolzano, 24/05/2016 Dott.
L atomo. Il neutrone ha una massa 1839 volte superiore a quella dell elettrone. 3. Le particelle fondamentali dell atomo
 L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
Il metodo scientifico
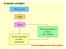 Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Introduzione alla Meccanica Quantistica (MQ):
 Introduzione alla Meccanica Quantistica (MQ): 1 MECCANICA QUANTISTICA ELETTRONI MATERIA MOLECOLE ATOMI NUCLEI La nostra attuale comprensione della struttura atomica e molecolare si basa sui principi della
Introduzione alla Meccanica Quantistica (MQ): 1 MECCANICA QUANTISTICA ELETTRONI MATERIA MOLECOLE ATOMI NUCLEI La nostra attuale comprensione della struttura atomica e molecolare si basa sui principi della
Fisica Quantistica. 1. Comportamento quantistico. 2. Effetto fotoelettrico. 3. Dualismo onda-corpuscolo. 4. Principio di indeterminazione
 Fisica Quantistica by Prof.ssa Paola Giacconi 1. Comportamento quantistico 2. Effetto fotoelettrico 3. Dualismo onda-corpuscolo 4. Principio di indeterminazione 1. COMPORTAMENTO QUANTISTICO La meccanica
Fisica Quantistica by Prof.ssa Paola Giacconi 1. Comportamento quantistico 2. Effetto fotoelettrico 3. Dualismo onda-corpuscolo 4. Principio di indeterminazione 1. COMPORTAMENTO QUANTISTICO La meccanica
Bohr 1913 Gli elettroni viaggiano su orbite fisse
 Democrito ( 400 a.c.) [ ] quando due elementi si combinano in modi diversi per formare diversi composti, posta fissa la quantità di uno dei due elementi, la quantità dell'altro elemento necessaria a reagire
Democrito ( 400 a.c.) [ ] quando due elementi si combinano in modi diversi per formare diversi composti, posta fissa la quantità di uno dei due elementi, la quantità dell'altro elemento necessaria a reagire
Bohr 1913 Gli elettroni viaggiano su orbite fisse
 Democrito ( 400 a.c.) [ ] quando due elementi si combinano in modi diversi per formare diversi composti, posta fissa la quantità di uno dei due elementi, la quantità dell'altro elemento necessaria a reagire
Democrito ( 400 a.c.) [ ] quando due elementi si combinano in modi diversi per formare diversi composti, posta fissa la quantità di uno dei due elementi, la quantità dell'altro elemento necessaria a reagire
Unità 2. La teoria quantistica
 Unità 2 La teoria quantistica L'effetto fotoelettrico Nel 1902 il fisico P. Lenard studiò l'effetto fotoelettrico. Esso è l'emissione di elettroni da parte di un metallo su cui incide un'onda elettromagnetica.
Unità 2 La teoria quantistica L'effetto fotoelettrico Nel 1902 il fisico P. Lenard studiò l'effetto fotoelettrico. Esso è l'emissione di elettroni da parte di un metallo su cui incide un'onda elettromagnetica.
L Equazione di Planck (1900)
 L Equazione di Planck (1900) Energia Teoria classica (5000 K) lunghezza d onda, µm Spettro di emissione di un corpo riscaldato Sperimentalmente si osserva che un corpo riscaldato emette radiazione le cui
L Equazione di Planck (1900) Energia Teoria classica (5000 K) lunghezza d onda, µm Spettro di emissione di un corpo riscaldato Sperimentalmente si osserva che un corpo riscaldato emette radiazione le cui
Laurea Magistrale di INGEGNERIA ELETTRONICA (LM-29) a.a , I semestre! Programma del corso di FISICA SUPERIORE! Docente: MAURO PAPINUTTO!
 Laurea Magistrale di INGEGNERIA ELETTRONICA (LM-29) a.a. 2013-14, I semestre Programma del corso di FISICA SUPERIORE Docente: MAURO PAPINUTTO Dipartimento di Fisica Phone: +39 06 4991 4376 Universita`
Laurea Magistrale di INGEGNERIA ELETTRONICA (LM-29) a.a. 2013-14, I semestre Programma del corso di FISICA SUPERIORE Docente: MAURO PAPINUTTO Dipartimento di Fisica Phone: +39 06 4991 4376 Universita`
Introduzione ai fenomeni quantistici
 Introduzione ai fenomeni quantistici Tratto da: The Feynman lectures on physics, vol. 3 Marco Bonvini Nicodemo Magnoli Meccanica: Keplero (1608-1619) Galilei (1630) Newton (1687) Termodinamica: Kelvin
Introduzione ai fenomeni quantistici Tratto da: The Feynman lectures on physics, vol. 3 Marco Bonvini Nicodemo Magnoli Meccanica: Keplero (1608-1619) Galilei (1630) Newton (1687) Termodinamica: Kelvin
CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI
 CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI Elettrici I anno - III Quadr. a.acc. 2006/07 Laboratorio: Laboratorio Materiali piano S-1 26/04/2007 Chimica e Scienza e Tecnologia dei Materiali
CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI Elettrici I anno - III Quadr. a.acc. 2006/07 Laboratorio: Laboratorio Materiali piano S-1 26/04/2007 Chimica e Scienza e Tecnologia dei Materiali
Il modello di Bohr. Lezioni d'autore di Giorgio Benedetti
 Il modello di Bohr Lezioni d'autore di Giorgio Benedetti VIDEO Gli spettri di emissione Nel 1859 il fisico G.R. Kirchoff scoprì che ogni elemento chimico presenta uno spettro di emissione caratteristico,
Il modello di Bohr Lezioni d'autore di Giorgio Benedetti VIDEO Gli spettri di emissione Nel 1859 il fisico G.R. Kirchoff scoprì che ogni elemento chimico presenta uno spettro di emissione caratteristico,
il modello atomico di Bohr
 il modello atomico di Bohr Lo scienziato Niels Bohr, ospite nel laboratorio di Rutherford a Manchester ma anche allievo di Planck, nel 93 pubblicò alcuni saggi in cui, accettando il modello planetario
il modello atomico di Bohr Lo scienziato Niels Bohr, ospite nel laboratorio di Rutherford a Manchester ma anche allievo di Planck, nel 93 pubblicò alcuni saggi in cui, accettando il modello planetario
Programma della I parte
 Programma della I parte Cenni alla meccanica quantistica: il modello dell atomo Dall atomo ai cristalli: statistica di Fermi-Dirac, il modello a bande di energia, popolazione delle bande, livello di Fermi
Programma della I parte Cenni alla meccanica quantistica: il modello dell atomo Dall atomo ai cristalli: statistica di Fermi-Dirac, il modello a bande di energia, popolazione delle bande, livello di Fermi
6) Modello atomico a ORBITALI
 6) Modello atomico a ORBITALI PREMESSA: LIMITI DEL MODELLO DI BOHR (pag. 94 par.3) Applicando il concetto di quantizzazione dell E all atomo, Bohr ipotizzò che un atomo potesse esistere solo in determinati
6) Modello atomico a ORBITALI PREMESSA: LIMITI DEL MODELLO DI BOHR (pag. 94 par.3) Applicando il concetto di quantizzazione dell E all atomo, Bohr ipotizzò che un atomo potesse esistere solo in determinati
La nascita della fisica moderna. (un racconto di inizio 900)
 La nascita della fisica moderna (un racconto di inizio 900) Sviluppo storico della fisica tra fine 800 e il 1927 Fisica sperimentale fine 800 Fisica teorica fine 800 1900 1905 1911 1913 1916 1924 1925-1927
La nascita della fisica moderna (un racconto di inizio 900) Sviluppo storico della fisica tra fine 800 e il 1927 Fisica sperimentale fine 800 Fisica teorica fine 800 1900 1905 1911 1913 1916 1924 1925-1927
STRUTTURA ATOMICA. Per lo studio della struttura dell atomo ci si avvale della Spettroscopia.
 STRUTTURA ATOMICA Il modello planetario dell atomo secondo Rutherford si appoggia sulla meccanica classica. Il modello non può essere corretto visto che per descrivere il comportamento delle particelle
STRUTTURA ATOMICA Il modello planetario dell atomo secondo Rutherford si appoggia sulla meccanica classica. Il modello non può essere corretto visto che per descrivere il comportamento delle particelle
Come si può definire la chimica? Quella scienza che studia la composizione, la struttura e le trasformazioni della materia. Cosa si intende per
 Come si può definire la chimica? Quella scienza che studia la composizione, la struttura e le trasformazioni della materia. Cosa si intende per materia?? Uno dei primi interrogativi che gli scienziati
Come si può definire la chimica? Quella scienza che studia la composizione, la struttura e le trasformazioni della materia. Cosa si intende per materia?? Uno dei primi interrogativi che gli scienziati
Teorie sull atomo: sviluppo storico
 Teorie sull atomo: sviluppo storico 1834 M.Faraday: la materia è costituita da particelle cariche elettricamente. 1897 J.J.Thomson: determinazione del rapporto e/m (carica/massa) per l elettrone (sempre
Teorie sull atomo: sviluppo storico 1834 M.Faraday: la materia è costituita da particelle cariche elettricamente. 1897 J.J.Thomson: determinazione del rapporto e/m (carica/massa) per l elettrone (sempre
Ma se dobbiamo trattare l elettrone come un onda occorre una funzione (che dobbiamo trovare) che ne descriva esaurientemente queste proprietà.
 Ma se dobbiamo trattare l elettrone come un onda occorre una funzione (che dobbiamo trovare) che ne descriva esaurientemente queste proprietà. Nell atomo l energia associata ad un elettrone (trascurando
Ma se dobbiamo trattare l elettrone come un onda occorre una funzione (che dobbiamo trovare) che ne descriva esaurientemente queste proprietà. Nell atomo l energia associata ad un elettrone (trascurando
La struttura dell atomo
 La struttura dell atomo Modello atomico di Rutherford Ernest Rutherford (1871 1937) Nobel per la Chimica 1908 Gli atomi sono costituiti da nuclei estremamente piccoli come sede della massa dell atomo e
La struttura dell atomo Modello atomico di Rutherford Ernest Rutherford (1871 1937) Nobel per la Chimica 1908 Gli atomi sono costituiti da nuclei estremamente piccoli come sede della massa dell atomo e
Lezioni di Meccanica Quantistica
 Luigi E. Picasso Lezioni di Meccanica Quantistica seconda edizione Edizioni ETS www.edizioniets.com Copyright 2015 EDIZIONI ETS Piazza Carrara, 16-19, I-56126 Pisa info@edizioniets.com www.edizioniets.com
Luigi E. Picasso Lezioni di Meccanica Quantistica seconda edizione Edizioni ETS www.edizioniets.com Copyright 2015 EDIZIONI ETS Piazza Carrara, 16-19, I-56126 Pisa info@edizioniets.com www.edizioniets.com
L atomo di Bohr e i raggi X
 L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
Particelle Subatomiche
 GLI ATOMI Particelle Subatomiche ELEMENTI I diversi atomi sono caratterizzati da un diverso numero di protoni e neutroni; il numero di elettroni è sempre uguale al numero dei protoni (negli atomi neutri)
GLI ATOMI Particelle Subatomiche ELEMENTI I diversi atomi sono caratterizzati da un diverso numero di protoni e neutroni; il numero di elettroni è sempre uguale al numero dei protoni (negli atomi neutri)
Teoria Quantistica dell'atomo (cap. 6)
 Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 08344 - CCS CHI e MAT Teoria Quantistica dell'atomo (cap. 6) Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/it/education/general-chemistry-lessons/
Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 08344 - CCS CHI e MAT Teoria Quantistica dell'atomo (cap. 6) Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/it/education/general-chemistry-lessons/
Fenomeni quantistici
 Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Come superare le critiche al modello di Bohr? 1 1
 Comportamento corpuscolare degli elettroni Parecchi dati sperimentali avevano già evidenziato come gli elettroni fossero delle particelle cariche negativamente Come superare le critiche al modello di Bohr?
Comportamento corpuscolare degli elettroni Parecchi dati sperimentali avevano già evidenziato come gli elettroni fossero delle particelle cariche negativamente Come superare le critiche al modello di Bohr?
dualismo onda corpuscolo
 dualismo onda corpuscolo Gli effetti che abbiamo visto finora sono manifestazioni della natura corpuscolare della radiazione elettromagnetica (e quindi della luce) Naturalmente la natura corpuscolare non
dualismo onda corpuscolo Gli effetti che abbiamo visto finora sono manifestazioni della natura corpuscolare della radiazione elettromagnetica (e quindi della luce) Naturalmente la natura corpuscolare non
La Teoria dei Quanti e la Struttura Elettronica degli Atomi. Capitolo 7
 La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
Tabella periodica degli elementi
 Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
