LA TERRA E LA CHIMICA: LA TAVOLA PERIODICA DEGLI ELEMENTI ELEMENTI E COMPOSTI
|
|
|
- Benvenuto Mattioli
- 8 anni fa
- Visualizzazioni
Transcript
1 I.I.S. A. PACINOTTI IST. TECNICO STATALE INDUSTRIALE Antonio PACINOTTI IST. TECNICO STATALE per GEOMETRI "Giorgio MASSARI" Via Caneve, n Mestre (VE) tel fax Dipartimento di Chimica interno 251 LA TERRA E LA CHIMICA: LA TAVOLA PERIODICA DEGLI ELEMENTI ELEMENTI E COMPOSTI
2 LA TERRA E LA CHIMICA: ELEMENTI E COMPOSTI. Tutti gli elementi presenti in natura sono raggruppati e ordinati nella TAVOLA PERIODICA DEGLI ELEMENTI. Nella tavola si possono leggere: nome, simbolo, proprietà e altri parametri importanti per la comprensione del loro comportamento. COMPORTAMENTO DI ALCUNI ELEMENTI CON L'ACQUA. Osserviamo il comportamento di alcuni elementi della prima colonna a sinistra detta anche 1 gruppo. 1) LITIO Il litio reagisce vivacemente con l'acqua (osservare lo sviluppo di gas, il dell'indicatore di ph, ecc.) per formare nuove sostanze di formula LiOH (litio idrossido) e H 2 (idrogeno); il litio idrossido è solubile nell'acqua, mentre l'idrogeno si libera come gas. Litio + Acqua con indicatore = Litio idrato con + H 2 + calore dell'indicatore di ph 2
3 2) SODIO Il sodio reagisce violentemente con l'acqua (osservare i movimenti rapidi del pezzettino di sodio sopra la superficie dell'acqua, lo sviluppo di gas, il dell'indicatore di ph, ecc.) per formare nuove sostanze di formula NaOH (sodio idrossido) e H 2 (idrogeno); il sodio idrossido è solubile nell'acqua, mentre l'idrogeno si libera come gas, dalla reazione si sviluppa calore. Sodio + Acqua con indicatore = Sodio idrato con + H 2 + calore dell'indicatore di ph A volte, quando il calore sviluppato è sufficiente, l'idrogeno reagisce con l'ossigeno dell'aria provocando una piccola fiamma seguita da uno scoppio; la reazione chimica è molto semplice e consiste nella combustione tra l'idrogeno (H 2 ) e l'ossigeno (O 2 ) per formare l'acqua (H 2 O): 2 H 2 + O 2 2 H 2 O 3) POTASSIO Il potassio ha un comportamento chimico analogo al sodio, ma la reazione è molto più violenta con un forte sviluppo di calore; il calore sviluppato provoca l'immediata accensione dell'idrogeno. Potassio + Acqua con indicatore = Potassio idrato con + H 2 + calore 3
4 Osserviamo il comportamento di un elemento della seconda colonna a sinistra detta anche 2 gruppo. 4) MAGNESIO + ACQUA Il magnesio reagisce molto lentamente con l'acqua (osservare lo sviluppo di gas e il cambiamento di colore dell'indicatore di ph) per formare nuove sostanze di formula Mg(OH) 2 (magnesio idrossido) e H 2 (idrogeno); la piccola quantità di magnesio idrossido formata, si scioglie nell'acqua e fa cambiare di colore l'indicatore in prossimità dell'elemento. Magnesio + Acqua con indicatore = Magnesio idrato con + H 2 + calore dell'indicatore di ph 5) MAGNESIO + OSSIGENO DELL'ARIA Il magnesio reagisce con l'ossigeno dell'aria previa attivazione iniziale mediante riscaldamento, trasformandosi in una nuova sostanza (composto chimico) di formula MgO (magnesio ossido) e liberando una luce tipica molto intensa; calore 2 Mg + O 2 2 MgO 6) ZINCO + OSSIGENO DELL'ARIA Lo zinco reagisce con l'ossigeno dell'aria sempre previa attivazione mediante riscaldamento, trasformandosi nella nuova sostanza (composto chimico) di formula ZnO (zinco ossido) dal caratteristico aspetto svolazzante : si vedono dei piccolissimi fiocchetti bianchi disperdersi nell'ambiente. calore 2 Zn + O 2 2 ZnO 4
5 COME RICONOSCERE GLI ELEMENTI CHIMICI Per riconoscere gli elementi costituenti un composto, il chimico ricorre a reazioni più o meno complesse che possono essere eseguite a secco (nel materiale solido) o per via umida (nel materiale sciolto in acqua). REAZIONE A SECCO: SAGGI ALLA FIAMMA Alcuni elementi, opportunamente eccitati da una sorgente di energia (la fiamma di una lampada Bunsen), emettono radiazioni luminose colorate caratteristiche dell'elemento. Nella tabella sono indicati gli elementi e il colore delle loro radiazioni. Elemento Colore della fiamma Li (litio) rosso carminio Na ( sodio ) ' giallo K (potassio) violetto Cu ( rame ) verde-azzurro Sr (stronzio) rosso scarlatto Ca ( calcio ) rosso aranciato a sprazzi Ba ( bario ) verde giallastro Osserviamo il composto litio cloruro (contenente l'elemento litio), il sodio cloruro (contenente l'elemento sodio), il potassio cloruro (contenente l'elemento potassio), il rame cloruro (contenente l'elemento rame), lo stronzio cloruro (contenente l'elemento stronzio), il calcio cloruro (contenente l'elemento calcio) e il bario cloruro (contenente l'elemento bario). Nell'esame di un composto incognito, dal colore della fiamma si risale alla presenza dell'elemento. Riconoscimento del PVC Un filo sottile di rame posto nella fiamma non da la caratteristica colorazione verde-azzurra perché il rame in queste condizioni non è volatile. Se riscaldiamo il filo di rame e lo mettiamo a contatto con materiale plastico a base di PVC (policloruro di vinile), poi riportiamo il filo con un po'di plastica fusa sulla fiamma, noteremo la caratteristica colorazione verde-azzurra perché in queste condizioni il rame diventa volatile per la presenza del cloro nel PVC. REAZIONI PER VIA UMIDA La maggior parte degli elementi portati in soluzione danno, aggiungendo reattivi specifici, reazioni caratteristiche che consentono il loro riconoscimento. Osserviamo i seguenti elementi portati in soluzione: Fe (ferro), Pb (piombo), Cu (rame), Ag (argento). Reazioni del ferro II ferro in soluzione e il solfocianuro di potassio reagiscono per dare una colorazione di color rossosangue: F e SCN - Fe(SCN) ++ (Ferro in soluzione) (ione solfocianuro) (ferro solfocianuro) 5
6 Il ferro in soluzione e il potassio ferrocianuro reagiscono per dare la colorazione caratteristica blu (blu di Prussia). 4Fe [Fe(CN) 6 ] 4 - Fe 4 [Fe(CN) 6 ] 3 (ferro in soluzione) (ione ferrocianuro) (blu di Prussia) Reazioni del piombo II piombo in soluzione e il cromato di potassio reagiscono per dare un composto chimico insolubile di colore caratteristico giallo uovo. Pb ++ + (piombo in soluzione) CrO (ione cromato) PbCrO 4 (cromato di piombo) II piombo in soluzione e il potassio ioduro reagiscono per dare un composto chimico insolubile di colore caratteristico giallo. Pb ++ + (piombo in soluzione) 2 I - (ione ioduro) PbI 2 (ioduro di piombo) Reazioni dell'argento L'argento in soluzione e il cromato di potassio reagiscono per dare un composto chimico insolubile di colore caratteristico rosso mattone. 2 Ag + + (argento in soluzione) CrO (ione cromato) Ag 2 CrO 4 (cromato d'argento) 6
7 L'argento in soluzione e il cloruro di sodio reagiscono per dare un composto chimico insolubile di colore caratteristico bianco. Ag + + Cl - AgCl (argento in soluzione) (ione cloruro) (cloruro d'argento) Reazioni del rame II rame in soluzione e l'ammoniaca reagiscono per dare un composto dalla caratteristica colorazione blu. Reazioni del nichel Cu ++ + NH 3 [Cu(NH 3 ) 4 ] ++ (rame in soluzione) (ammoniaca) soluzione cupro ammoniacale II nichel in soluzione e la dimetilgliossima reagiscono per dare un composto chimico insolubile di colore caratteristico rosso. Ni ++ + (nichel in soluzione) (dimetilgliossima) (complesso nichel-dimetilgliossima) Reazioni del mercurio II mercurio in soluzione e il sodio ioduro reagiscono per dare un composto chimico insolubile di colore caratteristico rosso aranciato. Hg I - HgI 2 (mercurio in soluzione) (ione ioduro) (ioduro di mercurio) 7
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
Scritto Chimica generale 13.02.2012 Gruppo A
 Scritto Chimica generale 13.02.2012 Gruppo A 1. Calcolare il ph di una soluzione ottenuta mescolando 12.0 ml di una soluzione 1.00 M di nitrato di calcio, 150 ml di una soluzione 1.00 M di acido cloridrico,
Scritto Chimica generale 13.02.2012 Gruppo A 1. Calcolare il ph di una soluzione ottenuta mescolando 12.0 ml di una soluzione 1.00 M di nitrato di calcio, 150 ml di una soluzione 1.00 M di acido cloridrico,
Smistamento e riconoscimento di una generica miscela inorganica
 Smistamento e riconoscimento di una generica miscela inorganica Soluzione acquosa HCl+BaCl 2 AgNO 3 Saggi Specifici Solfati Carbonati, Bicarbonati, Alogenuri, Fosfati, Borace, Nitriti, Tiosolfati, Idrossidi
Smistamento e riconoscimento di una generica miscela inorganica Soluzione acquosa HCl+BaCl 2 AgNO 3 Saggi Specifici Solfati Carbonati, Bicarbonati, Alogenuri, Fosfati, Borace, Nitriti, Tiosolfati, Idrossidi
MICRONUTRIENTI. Oligoelementi. Macroelementi. Ca= Calcio Mg= Magnesio P= Fosforo Na= Sodio Cl= Cloro K= Potassio S= Zolfo

Pb Pb 2+ + 2e 2Ag + + 2e 2Ag
 ELETTROCHIMICA OBIETTIVO DELL ESPERIENZA: conoscere i fenomeni elettrici che si basano su trasformazioni chimiche che avvengono tramite l energia elettrica. Principio teorico: l elettrochimica studia quelle
ELETTROCHIMICA OBIETTIVO DELL ESPERIENZA: conoscere i fenomeni elettrici che si basano su trasformazioni chimiche che avvengono tramite l energia elettrica. Principio teorico: l elettrochimica studia quelle
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Corso di Laurea in Chimica e Tecnologia Farmaceutiche Esame di Chimica Analitica e Complementi di Chimica Modulo di Chimica Analitica 8 Novembre 2012
 Modulo di Chimica Analitica 8 Novembre 2012 1. Una soluzione viene preparata sciogliendo1210 mg di K 3 Fe(CN) 6 in 775 ml di acqua. Calcolare: a) la concentrazione analitica di K 3 Fe(CN) 6 b) la concentrazione
Modulo di Chimica Analitica 8 Novembre 2012 1. Una soluzione viene preparata sciogliendo1210 mg di K 3 Fe(CN) 6 in 775 ml di acqua. Calcolare: a) la concentrazione analitica di K 3 Fe(CN) 6 b) la concentrazione
ANALISI SISTEMATICA DEI CATIONI
 ANALISI SISTEMATICA DEI CATIONI Particolare procedura analitica attraverso la quale tutte le specie cationiche presenti in una ipotetica miscela vengono inizialmente separate in gruppi, mediante l uso
ANALISI SISTEMATICA DEI CATIONI Particolare procedura analitica attraverso la quale tutte le specie cationiche presenti in una ipotetica miscela vengono inizialmente separate in gruppi, mediante l uso
Materiale Occorrente:
 Materiale Occorrente: una provetta, una molletta per supporta, un fornellino a gas, una cartina di indicatore universale, albume d'uovo, Idrossido di sodio Na(OH) Procedimento: aggiunge nella provetta
Materiale Occorrente: una provetta, una molletta per supporta, un fornellino a gas, una cartina di indicatore universale, albume d'uovo, Idrossido di sodio Na(OH) Procedimento: aggiunge nella provetta
Equilibri di precipitazione
 Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
Piano Lauree Scientifiche 2010 2012 Area Chimica Università di Bologna Facoltà di Chimica Industriale. Laboratori didattici dei Corsi di Laurea
 Chimica Industriale Bologna Faenza Rimini BOLOGNA La Chimica nella vita di tutti i giorni è scienza per il futuro Dr. ELENA STROCCHI elena.strocchi@unibo.it Tel. 051 2093645 FAENZA La Chimica e i Materiali:
Chimica Industriale Bologna Faenza Rimini BOLOGNA La Chimica nella vita di tutti i giorni è scienza per il futuro Dr. ELENA STROCCHI elena.strocchi@unibo.it Tel. 051 2093645 FAENZA La Chimica e i Materiali:
RICERCA DEI CATIONI NELLE SOSTANZE INORGANICHE O ORGANO-METALLICHE RICERCA DEGLI ANIONI NEI SALI DI AMMINE O DI AMMONIO QUATERNARIO
 RICERCA DEI CATIONI NELLE SOSTANZE INORGANICHE O ORGANO-METALLICHE RICERCA DEGLI ANIONI NEI SALI DI AMMINE O DI AMMONIO QUATERNARIO Prof. Antonio Lavecchia Ricerca dei Cationi nelle Sostanze Inorganiche
RICERCA DEI CATIONI NELLE SOSTANZE INORGANICHE O ORGANO-METALLICHE RICERCA DEGLI ANIONI NEI SALI DI AMMINE O DI AMMONIO QUATERNARIO Prof. Antonio Lavecchia Ricerca dei Cationi nelle Sostanze Inorganiche
DALLA MOLE AI CALCOLI STECHIOMETRICI
 Conversione Massa Moli DALLA MOLE AI CALCOLI STECHIOMETRICI - ESERCIZI GUIDATI - LEGENDA DEI SIMBOLI: M = Peso molecolare m(g) = quantità in g di elemento o di composto n = numero di moli Ricorda che l'unità
Conversione Massa Moli DALLA MOLE AI CALCOLI STECHIOMETRICI - ESERCIZI GUIDATI - LEGENDA DEI SIMBOLI: M = Peso molecolare m(g) = quantità in g di elemento o di composto n = numero di moli Ricorda che l'unità
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ]
![Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ] Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ]](/thumbs/34/16945364.jpg) La molecola d acqua è un dipolo perché l atomo di ossigeno è molto elettronegativo ed attira più vicini a sé gli elettroni di legame. Questo, unito alla forma della molecola, produce un accumulo di carica
La molecola d acqua è un dipolo perché l atomo di ossigeno è molto elettronegativo ed attira più vicini a sé gli elettroni di legame. Questo, unito alla forma della molecola, produce un accumulo di carica
SCALA DEI PESI ATOMICI RELATIVI E MEDI
 SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
= 9,3 10-5 M = 1,05 10-5 M
 - Calcolare la solubilità molare di CaCO 3 ( = 8,7 10-9 ). La reazione di solubilizzazione di CaCO 3 (carbonato di calcio) è: CaCO 3 (s) Ca 2+ + CO 3 L espressione della sarà quindi: = [Ca 2+ ] [CO 3 ]
- Calcolare la solubilità molare di CaCO 3 ( = 8,7 10-9 ). La reazione di solubilizzazione di CaCO 3 (carbonato di calcio) è: CaCO 3 (s) Ca 2+ + CO 3 L espressione della sarà quindi: = [Ca 2+ ] [CO 3 ]
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05
 I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
Gli elementi di transizione
 Gli elementi di transizione A partire dal quarto periodo del Sistema Periodico, nella costruzione della configurazione elettronica degli elementi, dopo il riempimento degli orbitali s del guscio di valenza
Gli elementi di transizione A partire dal quarto periodo del Sistema Periodico, nella costruzione della configurazione elettronica degli elementi, dopo il riempimento degli orbitali s del guscio di valenza
Dipendenza della Solubilità dalla temperatura
 SOLUBILIZZAZIONE Simile scioglie il simile: le molecole di sostanze diverse si mescolano intimamente nelle miscele se possiedono forze intermolecolari simili (soluzioni ideali). Anche se le forze intermolecolari
SOLUBILIZZAZIONE Simile scioglie il simile: le molecole di sostanze diverse si mescolano intimamente nelle miscele se possiedono forze intermolecolari simili (soluzioni ideali). Anche se le forze intermolecolari
Com è fatto l atomo ATOMO. UNA VOLTA si pensava che l atomo fosse indivisibile. OGGI si pensa che l atomo è costituito da tre particelle
 STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
ANALISI CHIMICA QUALITATIVA
 ANALISI CHIMICA QUALITATIVA Analisi per via secca: Saggi alla fiamma Scopo dell esperimento: Riconoscimento della presenza di alcuni elementi per via secca Premessa teorica: I saggi per via secca, così
ANALISI CHIMICA QUALITATIVA Analisi per via secca: Saggi alla fiamma Scopo dell esperimento: Riconoscimento della presenza di alcuni elementi per via secca Premessa teorica: I saggi per via secca, così
1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3.
 Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Quando un composto ionico viene immesso in acqua si dissocia formando uno ione negativo ed uno positivo.
 I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
Sostanze metallo organiche: determinazioni qualitative
 Tartrato acido di Potassio (European Pharmacopoeia IV th ) Identificazione A. GENERICA (Carattere acido). Disciogliere 15 mg di sostanza in 5 ml di acqua, scaldare se necessario. Aggiungere 0,1 ml di rosso
Tartrato acido di Potassio (European Pharmacopoeia IV th ) Identificazione A. GENERICA (Carattere acido). Disciogliere 15 mg di sostanza in 5 ml di acqua, scaldare se necessario. Aggiungere 0,1 ml di rosso
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola.
 Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
Capitolo 7. Le soluzioni
 Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Reazioni analitiche dello ione alluminio L ammoniaca in soluzione acquosa provoca la precipitazione dell idrossido Al(OH) 3 bianco gelatinoso.
 Reazioni analitiche dello ione alluminio L ammoniaca in soluzione acquosa provoca la precipitazione dell idrossido Al(OH) bianco gelatinoso. Al NHOH Al(OH) NH L idrossido precipitato è quasi insolubile
Reazioni analitiche dello ione alluminio L ammoniaca in soluzione acquosa provoca la precipitazione dell idrossido Al(OH) bianco gelatinoso. Al NHOH Al(OH) NH L idrossido precipitato è quasi insolubile
Sommario Finalità... 2 Viraggi ai solfuri... 2 Viraggi all'oro... 4 Viraggi ai ferrocianuri... 5 Viraggi - 1/6
 VIRAGGI Sommario Finalità... 2 Viraggi ai solfuri... 2 Viraggi all'oro... 4 Viraggi ai ferrocianuri... 5 Viraggi - 1/6 Finalità Il viraggio è un trattamento per sostituire, in tutto o in parte, l'argento
VIRAGGI Sommario Finalità... 2 Viraggi ai solfuri... 2 Viraggi all'oro... 4 Viraggi ai ferrocianuri... 5 Viraggi - 1/6 Finalità Il viraggio è un trattamento per sostituire, in tutto o in parte, l'argento
ELETTROCHIMICA. Uso di reazioni chimiche per produrre corrente elettrica (Pile)
 ELETTROCHIMICA Uso di reazioni chimiche per produrre corrente elettrica (Pile) Uso di forza elettromotrice (fem) esterna per forzare reazioni chimiche non spontanee (Elettrolisi) Coppia redox: Ossidazione
ELETTROCHIMICA Uso di reazioni chimiche per produrre corrente elettrica (Pile) Uso di forza elettromotrice (fem) esterna per forzare reazioni chimiche non spontanee (Elettrolisi) Coppia redox: Ossidazione
Analisi di Controllo di un Acqua Minerale Naturale
 Analisi di Controllo di un Acqua Minerale aturale ITODUZIOE Le acque potabili possono essere in diverse tipologie: si definiscono acque destinate al consumo umano, quelle acque rese potabili dopo aver
Analisi di Controllo di un Acqua Minerale aturale ITODUZIOE Le acque potabili possono essere in diverse tipologie: si definiscono acque destinate al consumo umano, quelle acque rese potabili dopo aver
3ULQFLSLGHOODFRPEXVWLRQH,FRPEXVWLELOL
 ,FRPEXVWLELOL I FRPEXVWLELOL sono sostanze capaci di bruciare, cioè in grado di dar luogo alla reazione chimica sopra descritta. Possono essere:,frpexvwlelol Solidi: ad esempio legno, carbone, carta, tessuto,
,FRPEXVWLELOL I FRPEXVWLELOL sono sostanze capaci di bruciare, cioè in grado di dar luogo alla reazione chimica sopra descritta. Possono essere:,frpexvwlelol Solidi: ad esempio legno, carbone, carta, tessuto,
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
Esame (0) - solubilità dei composti e reaz - Codice Prova:
 1) Ci si aspetta la formazione di un precipitato quando una soluzione acquosa di ioduro di potassio è aggiunta ad una soluzione acquosa di: A. idrossido di bario B. perclorato di piombo C. cloruro di ferro(ii)
1) Ci si aspetta la formazione di un precipitato quando una soluzione acquosa di ioduro di potassio è aggiunta ad una soluzione acquosa di: A. idrossido di bario B. perclorato di piombo C. cloruro di ferro(ii)
Fe(OH) 3. Mn(OH) 2 2H 2 O
 III Gruppo: Comprende quei cationi che precipitano selettivamente come idrossidi insolubili a ph = 9 (esclusi quelli del I e II Gruppo). Il reattivo precipitante è NH 4 OH/NH 4 Cl (soluzione tampone a
III Gruppo: Comprende quei cationi che precipitano selettivamente come idrossidi insolubili a ph = 9 (esclusi quelli del I e II Gruppo). Il reattivo precipitante è NH 4 OH/NH 4 Cl (soluzione tampone a
Fe(OH) 3. Mn(OH) 2. bianco. MnO 2 2H 2 O
 III Gruppo: Comprende quei cationi che precipitano selettivamente come idrossidi insolubili a ph = 9 (esclusi quelli del I e II Gruppo). Il reattivo precipitante è NH 4 OH/NH 4 Cl (soluzione tampone a
III Gruppo: Comprende quei cationi che precipitano selettivamente come idrossidi insolubili a ph = 9 (esclusi quelli del I e II Gruppo). Il reattivo precipitante è NH 4 OH/NH 4 Cl (soluzione tampone a
K [H 2 O] 2 = K w = [H 3 O + ][OH ]
![K [H 2 O] 2 = K w = [H 3 O + ][OH ] K [H 2 O] 2 = K w = [H 3 O + ][OH ]](/thumbs/27/10717050.jpg) Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
ESERCIZI DI CHIMICA. 5. Calcolare le masse in grammi di: a) 0,30 moli di HNO 3 ; b) 2,50 moli di Na 2 SO 4. [19 g di HNO 3 ; 355 g di Na 2 SO 4 ]
![ESERCIZI DI CHIMICA. 5. Calcolare le masse in grammi di: a) 0,30 moli di HNO 3 ; b) 2,50 moli di Na 2 SO 4. [19 g di HNO 3 ; 355 g di Na 2 SO 4 ] ESERCIZI DI CHIMICA. 5. Calcolare le masse in grammi di: a) 0,30 moli di HNO 3 ; b) 2,50 moli di Na 2 SO 4. [19 g di HNO 3 ; 355 g di Na 2 SO 4 ]](/thumbs/19/303703.jpg) ESERCIZI DI CHIMICA 1. Calcolare:a) le moli di H 2 O e le moli di atomi d idrogeno ed ossigeno contenuti in 10g di H 2 O; b) il numero di molecole di H 2 O e di atomi di idrogeno e di ossigeno. [0,55 moli;
ESERCIZI DI CHIMICA 1. Calcolare:a) le moli di H 2 O e le moli di atomi d idrogeno ed ossigeno contenuti in 10g di H 2 O; b) il numero di molecole di H 2 O e di atomi di idrogeno e di ossigeno. [0,55 moli;
primi passi nella chimica
 IS science centre immaginario scientifico Laboratorio dell'immaginario Scientifico - Trieste tel. 040224424 - fax 040224439 - e-mail: lis@lis.trieste.it - www.immaginarioscientifico.it indice Parole simpatiche
IS science centre immaginario scientifico Laboratorio dell'immaginario Scientifico - Trieste tel. 040224424 - fax 040224439 - e-mail: lis@lis.trieste.it - www.immaginarioscientifico.it indice Parole simpatiche
GAIALAB:INCONTRIAMO L AMBIENTE IN LABORATORIO
 LABORATORIO DI CHIMICA Le magie della chimica: l acqua scioglie e le sostanze reagiscono Il lavoro che vi proponiamo è una breve presentazione di alcune reazioni chimiche alcune di queste anche spettacolari
LABORATORIO DI CHIMICA Le magie della chimica: l acqua scioglie e le sostanze reagiscono Il lavoro che vi proponiamo è una breve presentazione di alcune reazioni chimiche alcune di queste anche spettacolari
REGOLE PER L'ATTRIBUZIONE DEI COEFFICIENTI STECHIOMETRICI DI UNA REAZIONE
 REGOLE PER L'ATTRIBUZIONE DEI COEFFICIENTI STECHIOMETRICI DI UNA REAZIONE OSSIDORIDUTTIVA SECONDO IL METODO DELLO IONE-ELETTRIONE. 1) Si individuano le coppie di atomi il cui numero di ossidazione cambia
REGOLE PER L'ATTRIBUZIONE DEI COEFFICIENTI STECHIOMETRICI DI UNA REAZIONE OSSIDORIDUTTIVA SECONDO IL METODO DELLO IONE-ELETTRIONE. 1) Si individuano le coppie di atomi il cui numero di ossidazione cambia
È importante quindi conoscere le proprietà chimiche dell acqua. Le reazioni acido base sono particolari esempi di equilibrio chimico in fase acquosa
 Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI
 DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI - si sfrutta una proprietà chimico-fisica o fisica che varia nel corso della titolazione - tale proprietà è in genere proporzionale
DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI - si sfrutta una proprietà chimico-fisica o fisica che varia nel corso della titolazione - tale proprietà è in genere proporzionale
Classificazione della materia: Sostanze pure e miscugli
 Classificazione della materia: Sostanze pure e miscugli la composizione e quindi le proprietà intensive sono le stesse in ogni parte del sistema La composizione e le proprietà intensive variano da una
Classificazione della materia: Sostanze pure e miscugli la composizione e quindi le proprietà intensive sono le stesse in ogni parte del sistema La composizione e le proprietà intensive variano da una
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He. 2) L'acqua è:
 1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012)
 CORSO DI LAUREA IN SCIENZE BIOLOGICHE Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012) 1) Bilanciare la seguente ossidoriduzione: KMnO 4 + H 2 O 2 + H 2 SO 4 MnSO 4 + K 2 SO 4 + O 2 + H
CORSO DI LAUREA IN SCIENZE BIOLOGICHE Esame di Chimica Generale (M-Z) A.A. 2011-2012 (25 gennaio 2012) 1) Bilanciare la seguente ossidoriduzione: KMnO 4 + H 2 O 2 + H 2 SO 4 MnSO 4 + K 2 SO 4 + O 2 + H
LA CHIMICA DEGLI ALIMENTI
 Sommario LA CHIMICA DEGLI ALIMENTI LA CHIMICA DEGLI ALIMENTI... 1 RICERCA DELLA VITAMINA C... 2 Metodo Qualitativo... 2 Metodo Quantitativo... 2 RICERCA DEGLI ZUCCHERI... 5 Metodo Qualitativo... 5 Metodo
Sommario LA CHIMICA DEGLI ALIMENTI LA CHIMICA DEGLI ALIMENTI... 1 RICERCA DELLA VITAMINA C... 2 Metodo Qualitativo... 2 Metodo Quantitativo... 2 RICERCA DEGLI ZUCCHERI... 5 Metodo Qualitativo... 5 Metodo
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI
 PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI DEFINIZIONE DI VETRO LO STATO VETROSO È QUELLO DI UN SOLIDO BLOCCATO NELLA STRUTTURA DISORDINATA DI UN LIQUIDO (FASE AMORFA) SOLIDO:ORDINE A LUNGO RAGGIO
PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI DEFINIZIONE DI VETRO LO STATO VETROSO È QUELLO DI UN SOLIDO BLOCCATO NELLA STRUTTURA DISORDINATA DI UN LIQUIDO (FASE AMORFA) SOLIDO:ORDINE A LUNGO RAGGIO
Storia dei generatori di tensione e della corrente elettrica
 Storia dei generatori di tensione e della corrente elettrica Prof. Daniele Ippolito Liceo Scientifico Amedeo di Savoia di Pistoia 1778 Alessandro Volta, in analogia al potenziale gravitazionale definito
Storia dei generatori di tensione e della corrente elettrica Prof. Daniele Ippolito Liceo Scientifico Amedeo di Savoia di Pistoia 1778 Alessandro Volta, in analogia al potenziale gravitazionale definito
Chimica Generale. Reazioni Chimiche. Reazioni Chimiche
 Una reazione chimica è un processo in cui avviene un cambiamento chimico di uno o più composti, detti reagenti, che vengono convertiti in una nuova serie di composti detti prodotti. Spesso le reazioni
Una reazione chimica è un processo in cui avviene un cambiamento chimico di uno o più composti, detti reagenti, che vengono convertiti in una nuova serie di composti detti prodotti. Spesso le reazioni
13 La temperatura - 8. Il gas perfetto
 La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
I MATERIALI SCELTA DEL MATERIALE SCELTA DEL MATERIALE FUNZIONALITÀ
 SCELTA DEL MATERIALE I MATERIALI LA SCELTA DEL MATERIALE PER LA COSTRUZIONE DI UN PARTICOLARE MECCANICO RICHIEDE: LA CONOSCENZA DELLA FORMA E DELLE DIMEN- SIONI DELL OGGETTO LA CONOSCENZA DEL CICLO DI
SCELTA DEL MATERIALE I MATERIALI LA SCELTA DEL MATERIALE PER LA COSTRUZIONE DI UN PARTICOLARE MECCANICO RICHIEDE: LA CONOSCENZA DELLA FORMA E DELLE DIMEN- SIONI DELL OGGETTO LA CONOSCENZA DEL CICLO DI
REAZIONI ESOTERMICHE ED ENDOTERMICHE
 REAZIONI ESOTERMICHE ED ENDOTERMICHE Obiettivo di questo esperimento è confrontare l effetto termico di 0,1 moli di diverse sostanze ioniche solide quando vengono sciolte in una stessa quantità di acqua.
REAZIONI ESOTERMICHE ED ENDOTERMICHE Obiettivo di questo esperimento è confrontare l effetto termico di 0,1 moli di diverse sostanze ioniche solide quando vengono sciolte in una stessa quantità di acqua.
Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni
 Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni Una delle più importanti proprietà di una soluzione acquosa è la sua concentrazione di ioni idrogeno. Lo ione H + o
Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni Una delle più importanti proprietà di una soluzione acquosa è la sua concentrazione di ioni idrogeno. Lo ione H + o
Il bilanciamento delle reazioni chimiche
 1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
La percentuale massa/volume (%m/v) indica la quantità di soluto espressa in grammi presente in 100 ml di soluzione.
 La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
RICONOSCIMENTO degli ELEMENTI PRESENTI in un CAMPIONE INCOGNITO
 RICONOSCIMENTO degli ELEMENTI PRESENTI in un CAMPIONE INCOGNITO OBIETTIVO: individuare gli elementi presenti in un campione solido inorganico di composizione incognita. Approccio al problema: l analisi
RICONOSCIMENTO degli ELEMENTI PRESENTI in un CAMPIONE INCOGNITO OBIETTIVO: individuare gli elementi presenti in un campione solido inorganico di composizione incognita. Approccio al problema: l analisi
1. Agli estremi di una resistenza di 30 ohm è applicata una tensione di 120 volt. Calcolare la quantità di elettricità passata in 12 ore.
 ESERCIZI pag: 458 1. Agli estremi di una resistenza di 30 ohm è applicata una tensione di 120 volt. Calcolare la quantità di elettricità passata in 12 ore. 2. Una dinamo produce 6 amp a 160 v. Calcolare
ESERCIZI pag: 458 1. Agli estremi di una resistenza di 30 ohm è applicata una tensione di 120 volt. Calcolare la quantità di elettricità passata in 12 ore. 2. Una dinamo produce 6 amp a 160 v. Calcolare
... corso di chimica elettrochimica 1
 ... corso di chimica elettrochimica 1 CONTENUTI reazioni elettrochimiche pile e celle elettrolitiche potenziale d elettrodo e forza elettromotrice equazione di Nernst elettrolisi leggi di Faraday batterie
... corso di chimica elettrochimica 1 CONTENUTI reazioni elettrochimiche pile e celle elettrolitiche potenziale d elettrodo e forza elettromotrice equazione di Nernst elettrolisi leggi di Faraday batterie
CAMPIONAMENTO DEL SUOLO
 CAMPINAMENT DEL SUL Metodo Nei tre anni di durata del progetto è stato effettuato un solo campionamento del suolo da tutte le 6 AdS di Livello IIA-B, esattamente tra la fine di Maggio e Giugno 1996. Il
CAMPINAMENT DEL SUL Metodo Nei tre anni di durata del progetto è stato effettuato un solo campionamento del suolo da tutte le 6 AdS di Livello IIA-B, esattamente tra la fine di Maggio e Giugno 1996. Il
Appunti di Chimica Le reazioni chimiche reattività reazione chimica equazione chimica bilanciare
 Appunti di Chimica Le reazioni chimiche Premesse... 1 Tipi di reazioni chimiche... 2 Reazioni di ossido-riduzione... 2 Reazioni di formazione... 2 Numero di ossidazione nei composti binari di tipo salino...
Appunti di Chimica Le reazioni chimiche Premesse... 1 Tipi di reazioni chimiche... 2 Reazioni di ossido-riduzione... 2 Reazioni di formazione... 2 Numero di ossidazione nei composti binari di tipo salino...
corrosione corrosione chimica
 La corrosione La corrosione è un consumo lento e continuo di un materiale (generalmente metallico) dovuto a fenomeni chimici o, più frequentemente, elettrochimici. La corrosione è dovuta al fatto che tutti
La corrosione La corrosione è un consumo lento e continuo di un materiale (generalmente metallico) dovuto a fenomeni chimici o, più frequentemente, elettrochimici. La corrosione è dovuta al fatto che tutti
La combustione. Docente: prof.ssa Lobello Carmela
 La combustione Percorso didattico realizzato dalla classe II D Istituto d Istruzione secondaria di I grado S Francesco d Assisi Francavilla Fontana (Br) Docente: prof.ssa Lobello Carmela Perché la combustione?
La combustione Percorso didattico realizzato dalla classe II D Istituto d Istruzione secondaria di I grado S Francesco d Assisi Francavilla Fontana (Br) Docente: prof.ssa Lobello Carmela Perché la combustione?
Progetto L età di Leonardo per i curricoli del biennio unitari finalizzati all innalzamento dell istruzione a 16 anni dall a.s.
 Progetto L età di Leonardo per i curricoli del biennio unitari finalizzati all innalzamento dell istruzione a 16 anni dall a.s. 2007/08 [Eleonora Aquilini] Le sostanze basiche Preparate una soluzione di
Progetto L età di Leonardo per i curricoli del biennio unitari finalizzati all innalzamento dell istruzione a 16 anni dall a.s. 2007/08 [Eleonora Aquilini] Le sostanze basiche Preparate una soluzione di
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B
 Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA
 EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
METALLI FERROSI GHISA ACCIAIO
 METALLI FERROSI I metalli ferrosi sono i metalli e le leghe metalliche che contengono ferro. Le leghe ferrose più importanti sono l acciaio e la ghisa. ACCIAIO: lega metallica costituita da ferro e carbonio,
METALLI FERROSI I metalli ferrosi sono i metalli e le leghe metalliche che contengono ferro. Le leghe ferrose più importanti sono l acciaio e la ghisa. ACCIAIO: lega metallica costituita da ferro e carbonio,
PROVA STRUTTURATA DI CHIMICA ORGANICA
 1. Una delle seguenti definizioni di gruppo funzionale è errata. Quale? "In chimica organica, i gruppi funzionali sono gruppi di atomi presenti in ogni molecola A. dai quali dipendono le caratteristiche
1. Una delle seguenti definizioni di gruppo funzionale è errata. Quale? "In chimica organica, i gruppi funzionali sono gruppi di atomi presenti in ogni molecola A. dai quali dipendono le caratteristiche
Nascita e morte delle stelle
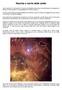 Nascita e morte delle stelle Se la materia che componeva l universo primordiale fosse stata tutta perfettamente omogenea e diffusa in modo uguale, non esisterebbero né stelle né pianeti. C erano invece
Nascita e morte delle stelle Se la materia che componeva l universo primordiale fosse stata tutta perfettamente omogenea e diffusa in modo uguale, non esisterebbero né stelle né pianeti. C erano invece
CHIMICA ORGANICA. Gli alcoli
 1 E1-ALCOLI CIMICA OGANICA ALCOLI Formula generale Desinenza -olo Gli alcoli Gli alcoli sono, dopo gli idrocarburi, i composti organici più comuni, che è possibile considerare come derivati dagli alcani
1 E1-ALCOLI CIMICA OGANICA ALCOLI Formula generale Desinenza -olo Gli alcoli Gli alcoli sono, dopo gli idrocarburi, i composti organici più comuni, che è possibile considerare come derivati dagli alcani
scheda di lavoro relativa all'esperienza di laboratorio: REAZIONI FRA IONI IN SOLUZIONE ACQUOSA Scopo dell'esperienza: verificare la formazione di...
 scheda di lavoro relativa all'esperienza di laboratorio: REAZIONI FRA IONI IN SOLUZIONE ACQUOSA Scopo dell'esperienza: verificare la formaz di... Prerequisiti: :.. composto ionico:.. reazioni di doppio
scheda di lavoro relativa all'esperienza di laboratorio: REAZIONI FRA IONI IN SOLUZIONE ACQUOSA Scopo dell'esperienza: verificare la formaz di... Prerequisiti: :.. composto ionico:.. reazioni di doppio
Corso di Laboratorio di Chimica Generale Esperienza 4: Proprietà dei sistemi in equilibrio chimico: Il principio di Le Châtelier
 Corso di Laboratorio di Chimica Generale Esperienza 4: Proprietà dei sistemi in equilibrio chimico: Il principio di Le Châtelier Quando si lavora in laboratorio spesso si osservano dei fenomeni che sono
Corso di Laboratorio di Chimica Generale Esperienza 4: Proprietà dei sistemi in equilibrio chimico: Il principio di Le Châtelier Quando si lavora in laboratorio spesso si osservano dei fenomeni che sono
Si definisce potabile un'acqua limpida, inodore, insapore, incolore e innocua, priva di microrganismi patogeni e sostanze chimiche nocive per l'uomo".
 LE ACQUE POTABILI Si definisce potabile un'acqua limpida, inodore, insapore, incolore e innocua, priva di microrganismi patogeni e sostanze chimiche nocive per l'uomo". I dati più significanti per la valutazione
LE ACQUE POTABILI Si definisce potabile un'acqua limpida, inodore, insapore, incolore e innocua, priva di microrganismi patogeni e sostanze chimiche nocive per l'uomo". I dati più significanti per la valutazione
Progetto macchina con tetto fotovoltaico
 ITIS A.PACINOTTI Via Montaione 15 Progetto macchina con tetto fotovoltaico Classe 2 C Informatica Docente referente: Prof.ssa Leccesi Progetto: Educarsi al futuro Premessa Motivazione per la partecipazione
ITIS A.PACINOTTI Via Montaione 15 Progetto macchina con tetto fotovoltaico Classe 2 C Informatica Docente referente: Prof.ssa Leccesi Progetto: Educarsi al futuro Premessa Motivazione per la partecipazione
TECNOLOGIE CHIMICHE INDUSTRIALI, PRINCIPI DI AUTOMAZIONE E DI ORGANIZZAZIONE INDUSTRIALE
 PROGRAMMAZIONE DI LABORATORIO DI: TECNOLOGIE CHIMICHE INDUSTRIALI, PRINCIPI DI AUTOMAZIONE E DI ORGANIZZAZIONE INDUSTRIALE allegato 1 Prove meccaniche presso il laboratorio di edilizia Esperienza: Determinazione
PROGRAMMAZIONE DI LABORATORIO DI: TECNOLOGIE CHIMICHE INDUSTRIALI, PRINCIPI DI AUTOMAZIONE E DI ORGANIZZAZIONE INDUSTRIALE allegato 1 Prove meccaniche presso il laboratorio di edilizia Esperienza: Determinazione
Chimica generale. Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari.
 Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari. PARTE 5-2 1 ACIDI E BASI 2 1-Definizioni di acido e di base 1-1 Teoria
Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari. PARTE 5-2 1 ACIDI E BASI 2 1-Definizioni di acido e di base 1-1 Teoria
Esercizi di Chimica (2 a prova in itinere)
 Esercizi di Chimica (2 a prova in itinere) 3) Calcolare la normalità (N) di una soluzione ottenuta sciogliendo 3,5 g di H 3 PO 4 in 900 ml di acqua [0,119 N] 4) Quanti grammi di soluto sono contenuti in
Esercizi di Chimica (2 a prova in itinere) 3) Calcolare la normalità (N) di una soluzione ottenuta sciogliendo 3,5 g di H 3 PO 4 in 900 ml di acqua [0,119 N] 4) Quanti grammi di soluto sono contenuti in
(Si identificano Ag +, Hg 2. , Pb 2+ ) - 1 GRUPPO - Reattivo Generale: HCl 2N. Soluzione. Precipitato. Soluzione. Residuo. Soluzione.
 Reattivo Generale: HCl 2N - 1 GRUPPO - (Si identificano Ag +, Hg 2 2+, Pb 2+ ) Esame Sistematico: Nella provetta da centrifuga contenente la soluzione in esame (preparata sciogliendo la sostanza in H 2
Reattivo Generale: HCl 2N - 1 GRUPPO - (Si identificano Ag +, Hg 2 2+, Pb 2+ ) Esame Sistematico: Nella provetta da centrifuga contenente la soluzione in esame (preparata sciogliendo la sostanza in H 2
Prova in itinere di Chimica Generale 1 Giugno 2011
 Prova in itinere di Chimica Generale 1 Giugno 2011 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Prova in itinere di Chimica Generale 1 Giugno 2011 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
CHIMICA. Una teoria è scientifica solo se è falsificabile (cioè se è possibile sperimentalmente smentire le sue previsioni)
 CHIMICA SCIENZA SPERIMENTALE: cioè si basa sul metodo sperimentale (Galileo è il precursore). Osservazione dei fenomeni (raccolta e interpretazioni dati) Formulazione ipotesi Verifica sperimentale (eventualmente
CHIMICA SCIENZA SPERIMENTALE: cioè si basa sul metodo sperimentale (Galileo è il precursore). Osservazione dei fenomeni (raccolta e interpretazioni dati) Formulazione ipotesi Verifica sperimentale (eventualmente
R i c o n o s c i m e n t o d e i g r u p p i f u n z i o n a l i attraverso r e a z i o n i s p e c i f i c h e
 R i c o n o s c i m e n t o d e i g r u p p i f u n z i o n a l i attraverso r e a z i o n i s p e c i f i c h e Considerazioni preliminari: 1) Sono saggi qualitativi in cui la positività del saggio viene
R i c o n o s c i m e n t o d e i g r u p p i f u n z i o n a l i attraverso r e a z i o n i s p e c i f i c h e Considerazioni preliminari: 1) Sono saggi qualitativi in cui la positività del saggio viene
I GAS GAS IDEALI. PV=nRT. Pressione Volume numero di moli Temperatura Costante dei gas. P V n T R. n, T= cost Legge di Boyle
 I GAS Pressione Volume numero di moli Temperatura Costante dei gas GAS IDEALI P V n T R n = 1 Isoterma: pv = cost Isobara: V/T = cost. Isocora: P/t = cost. n, T= cost Legge di Boyle n, P = cost Legge di
I GAS Pressione Volume numero di moli Temperatura Costante dei gas GAS IDEALI P V n T R n = 1 Isoterma: pv = cost Isobara: V/T = cost. Isocora: P/t = cost. n, T= cost Legge di Boyle n, P = cost Legge di
CAPITOLO 12 EQUILIBRI ACIDO-BASE E SOLUBILITA
 CAPITOLO 12 EQUILIBRI ACIDO-BASE E SOLUBILITA 12.1 (a) ph = 2,57 (b) ph = 4,44 12.3 (a) no. (b) no. (c) sì. (d) sì. (e) no. 12.5 ph = 8,88 12.7 0,024 12.9 0,58 12.11 ph = 9,25; ph = 9,18. 12.13 Na 2 A/NaHA.
CAPITOLO 12 EQUILIBRI ACIDO-BASE E SOLUBILITA 12.1 (a) ph = 2,57 (b) ph = 4,44 12.3 (a) no. (b) no. (c) sì. (d) sì. (e) no. 12.5 ph = 8,88 12.7 0,024 12.9 0,58 12.11 ph = 9,25; ph = 9,18. 12.13 Na 2 A/NaHA.
EQUILIBRI IN SOLUZIONI SATURE DI SALI POCO SOLUBILI. K eq = Ba 2+ SO 4 EQUILIBRIO CHIMICO. A a B b. Equilibri eterogenei: Equilibri omogenei:
 EQUILIBRIO CHIMICO aa + bb cc + dd K eq = C c D d A a B b K eq è una costante che dipende esclusivamente dalla natura delle specie all equilibrio e dalla temperatura Equilibri omogenei: Tutte le specie
EQUILIBRIO CHIMICO aa + bb cc + dd K eq = C c D d A a B b K eq è una costante che dipende esclusivamente dalla natura delle specie all equilibrio e dalla temperatura Equilibri omogenei: Tutte le specie
CO 2 aq l anidride carbonica disciolta, reagendo con l'acqua, forma acido carbonico secondo la reazione:
 DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
Fondamenti di chimica Raymond Chang Copyright 2009 The McGraw-Hill Companies srl CAPITOLO 18. Le reazioni redox e l elettrochimica
 CAPITOLO 18 Le reazioni redox e l elettrochimica 18.1 Seguiamo i passaggi descritti in dettaglio nella Sezione 18.1 del testo. (a) sono: Il problema è dato in forma ionica, così combinando lo step 1 co
CAPITOLO 18 Le reazioni redox e l elettrochimica 18.1 Seguiamo i passaggi descritti in dettaglio nella Sezione 18.1 del testo. (a) sono: Il problema è dato in forma ionica, così combinando lo step 1 co
2H 2 H H 3 E H H 2 E 2 E 2 H HE 3. tale acido può originare 4 diversi sali. Ad esempio, nel caso dello ione sodio ( Na ) i sali possono essere NaH 3
 DETERMINAZIONE COMPLESSOMETRICA DELLA DUREZZA DI UN'ACQUA. I complessi. I cationi metallici sono specie chimiche assimilabili ad atomi che hanno perso 1 o più elettroni acquistando nel contempo carica
DETERMINAZIONE COMPLESSOMETRICA DELLA DUREZZA DI UN'ACQUA. I complessi. I cationi metallici sono specie chimiche assimilabili ad atomi che hanno perso 1 o più elettroni acquistando nel contempo carica
IV Gruppo: H 2 S 2 H + + S = I solfuri insolubili nelle predette condizioni sono: ZnS. CoS. bianco. nero. MnS. rosa-salmone. nero.
 IV Gruppo: Comprende quei cationi che precipitano selettivamente come solfuri insolubili a ph = 9 in soluzione tampone: NH 4 OH/NH 4 Cl (esclusi quelli del I, II e III Gruppo). Il reattivo precipitante
IV Gruppo: Comprende quei cationi che precipitano selettivamente come solfuri insolubili a ph = 9 in soluzione tampone: NH 4 OH/NH 4 Cl (esclusi quelli del I, II e III Gruppo). Il reattivo precipitante
Dissociazione elettrolitica
 Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
Equilibri di Solubilità
 Equilibri di Solubilità Esercizio 6.1. Calcolare la solubilità in g L 1 dell idrossido di magnesio (a) in acqua pura e (b) in una soluzione acquosa di idrossido di potassio 0.10 M. (Kps = 1.2. 10 11 ;
Equilibri di Solubilità Esercizio 6.1. Calcolare la solubilità in g L 1 dell idrossido di magnesio (a) in acqua pura e (b) in una soluzione acquosa di idrossido di potassio 0.10 M. (Kps = 1.2. 10 11 ;
24. PRECIPITAZIONE Prodotto di solubilità (K s )
 24. PRECIPITAZIONE D. In un racconto di Primo Levi, a proposito di un analisi chimica di campioni di roccia, si incontrano queste parole apparentemente prive di senso: «... giù il ferro con ammoniaca,
24. PRECIPITAZIONE D. In un racconto di Primo Levi, a proposito di un analisi chimica di campioni di roccia, si incontrano queste parole apparentemente prive di senso: «... giù il ferro con ammoniaca,
Analisi delle acque dell isola di Favignana
 Analisi delle acque dell isola di Favignana Durante le attività svolte al campo scuola nell ambito del progetto Un mare di.. risorse, il nostro gruppo si è occupato di analizzare le acque del mare in diversi
Analisi delle acque dell isola di Favignana Durante le attività svolte al campo scuola nell ambito del progetto Un mare di.. risorse, il nostro gruppo si è occupato di analizzare le acque del mare in diversi
Risultati della caratterizzazione dei fumi
 Progetto Produzione di energia e sostanza organica dai sottoprodotti del vigneto Risultati della caratterizzazione dei fumi Paolo Giandon ARPAV Dipartimento Provinciale di Treviso Biella, 24 settembre
Progetto Produzione di energia e sostanza organica dai sottoprodotti del vigneto Risultati della caratterizzazione dei fumi Paolo Giandon ARPAV Dipartimento Provinciale di Treviso Biella, 24 settembre
ESERCIZI. 1. Completa le seguenti reazioni e, se necessario, bilanciale: b, K + H 2 O! c. Na + H 2! d. KOH + CO 2! e. K 2 CO 3! calore!
 ESERCIZI 1. Completa le seguenti reazioni e, se necessario, bilanciale: elettrolisi a. LiCl (fuso)!!! " b, K + H 2 O! c. Na + H 2! d. KOH + CO 2! e. K 2 CO 3! calore! " f. Na 2 CO 3 + H 2 SO 4! g. K 2
ESERCIZI 1. Completa le seguenti reazioni e, se necessario, bilanciale: elettrolisi a. LiCl (fuso)!!! " b, K + H 2 O! c. Na + H 2! d. KOH + CO 2! e. K 2 CO 3! calore! " f. Na 2 CO 3 + H 2 SO 4! g. K 2
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica -
 Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
Volume. Unità accettata dal SI è il L (litro) Lunghezza = 1 dimensione Superficie = 2 dimensioni Volume = 3 dimensioni
 Il volume è lo spazio occupato da un corpo oppure la capacità di un contenitore. E una grandezza derivata estensiva, simbolo V, equazione dimensionale [V] = [l 3 ]. L unità di misura SI è il m 3 (metro
Il volume è lo spazio occupato da un corpo oppure la capacità di un contenitore. E una grandezza derivata estensiva, simbolo V, equazione dimensionale [V] = [l 3 ]. L unità di misura SI è il m 3 (metro
