CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2006/2007. Corso di: Laboratorio di Biologia II Chimica Biologica
|
|
|
- Alessandro Damiano
- 7 anni fa
- Visualizzazioni
Transcript
1 CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2006/2007 Corso di: Laboratorio di Biologia II Chimica Biologica Dott. Marcello MEROLA Parziale purificazione dell enzima Alcool Deidrogenasi (ADH) di Bacillus stearothermophilus da estratto batterico mediante cromatografia a scambio ionico - Cromatografia a scambio ionico - Elettroforesi su gel di acrilammide in condizioni denaturanti - Saggio di attività enzimatica - Determinazione della concentrazione proteica di un campione di proteina purificata (spettrofotometrica) e di miscele proteiche (colorimetrica) - Calcolo dell Attività Specifica 1
2 CROMATOGRAFIA A SCAMBIO IONICO La resina DEAE-Sepharose è costituita di una matrice di agarosio a cui è covalentemente legato il gruppo dietilamminoetile [-CH 2 -CH 2 -N + H-(CH 2 -CH 3 ) 2, pk~ 8.5] ed è equilibrata in tampone sodio-fosfato 50 mm, ph 7. Il campione da cromatografare, solubilizzato nello stesso tampone, è rappresentato da un estratto di E.Coli indotto per l espressione dell ADH da Bacillus stearothermophilus. L alcool deidrogenasi di Bacillus stearothermophilus (ADH) nativa ha un peso molecolare di 140 kda ed un punto isoelettrico pari a 5. La cromatografia verrà sviluppata al flusso di 0.8 ml/min utilizzando una pompa peristaltica; l eluato verrà raccolto in frazioni di 3.2 ml di volume mediante un collettore automatico. 2
3 METODICA dopo avere rimosso il tampone presente sulla resina, caricare 1 ml di estratto di E.Coli; lavare la resina con 10 ml di tampone sodio-fosfato 50 mm, ph 7; eluire con un gradiente salino di NaCl da 0 M a 0.4 M in tampone sodio-fosfato 50 mm, ph 7 (30 ml di tampone sodio-fosfato 50 mm, ph 7, e 30 ml di tampone sodio-fosfato 50 mm, ph 7, NaCl 0.4 M); eluire con 30 ml di tampone sodio-fosfato 50 mm, ph 7, NaCl 0.5 M; leggere i valori di assorbanza a 280 nm delle singole frazioni eluite dalla colonna e riportare in grafico i dati ottenuti. Frazioni A 280 nm Frazioni A 280 nm
4 Separazione elettroforetica di proteine su gel di poliacrilammide in SDS L elettroforesi si basa sulla proprietà di una molecola dotata di carica netta di muoversi in un campo elettrico µ=q/f µ è la mobilità elettroforetica, q è la carica dello ione, f è il coefficiente frizionale che dipende dalla grandezza, dalla forma e dallo stato di solvatazione dello ione e dalla viscosità della soluzione. In Biochimica, le tecniche elettroforetiche di gran lunga più utilizzate si servono di una matrice di supporto porosa che agisce come un setaccio molecolare. Tale matrice ritarda o ostruisce il movimento delle molecole in misura proporzionale alla grandezza delle molecole stesse. A seconda della grandezza delle molecole da analizzare è possibile variare la grandezza dei pori della matrice così che nessuna specie sia impedita nella migrazione ma ciascuna ritardata in misura proporzionale alla sua dimensione. In tal modo si ottiene una separazione delle differenti specie presenti in un campione. 4
5 L elettroforesi in condizioni denaturanti prevede il trattamento con un detergente ad alte temperature per distruggere la struttura terziaria, e quaternaria in assenza di ponti disulfuro intercatena, delle proteine. Quando il detergente è l SDS (Sodio Deodecil Solfato, CH 3 (CH 2 ) 10 CH 2 -O-SO - 3 ), le proteine vengono interamente ricoperte da questo e le loro cariche mascherate dalla coda idrofobica dell SDS. I complessi SDS-proteina assumeranno carica netta negativa (dovuta alla ionizzazione del solfato) e migrano verso l anodo sotto l azione di un campo elettrico. Per le proprietà di setaccio molecolare del gel, le proteine a minor peso molecolare si muovono più velocemente mentre quelle a maggior peso molecolare migrano più lentamente. L elettroforesi in condizioni denaturanti e riducenti prevede un ultriore trattamento con un agente riducente (2-Mercaptoetanolo, HS-CH 2 - CH 2 -OH) i ponti disolfuro tra residui di Cisteina. Le proteine dopo separazione possono essere visualizzate mediante l uso di un colorante specifico (Coomassie Blue) che forma un complesso colorato in blu. Dopo trattamento del gel con la soluzione di Coomassie, si evidenzieranno una serie di bande corrispondenti al numero di proteine presenti nel campione la cui distanza dall origine di migrazione è funzione del peso molecolare di ciascuna proteina. La slab-gel-elettroforesi (strati di gel di 1 mm di spessore e di dimensioni 7 x 5 cm) è rapida ( 1 hr), sensibile (meno di 1μg di proteina) e permette di distinguere proteine che differiscono di circa il 2% in massa (es kda). Sistema Elettroforetico. gel di poliacrilammide al 10% (lower), al 4% (upper); tampone di corsa tampone Tris-glicina ph 8.3; soluzione denaturante per campioni: Tris-HCl 0.5 M ph 6.8, SDS 4%, glicerolo 10%, Blu di Bromofenolo 1%. soluzione denaturante e riducente per campioni: Tris.HCl 0.5 M ph 6,8, SDS 4%, glicerolo 10%, 2-mercaptoetanolo 1%, Blu di Bromofenolo 1%. soluzione colorazione gel: Preparato contenente Blu di Coomassie. soluzione per la decolorazione del gel: H 2 O distillata. 5
6 campioni: 1. Estratto di E.Coli 2. Estratto di E.Coli indotto per la produzione di ADH 3. ADH (eluita da DEAE-Sepharose) in condizioni denaturanti 4. ADH purificata in condizioni denaturanti 5. ADH purificata in condizioni denaturanti e riducenti 6. Miscela di proteine di peso molecolare noto: Miosina 220 kda BSA 100 kda GDH 60 kda LDH 45 kda Anidrasi carbonica 30 kda Inibitore tripsina 20 kda Lisozima 12 kda Aprotinina 8 kda Dopo aver sistemato la lastrine contenenti il gel nell apposito apparecchio ed aver riempito le apposite vaschette con il tampone di corsa, i campioni vengono stratificati nei diversi pozzetti, utilizzando il pipettatore automatico. Collegati gli elettrodi all alimentatore di corrente (200 V), si fa avvenire la corsa elettroforetica sino a quando il tracciante (Blu di Bromofenolo) raggiunge l estremità del gel. Ad elettroforesi terminata, smontato l apparecchio il gel viene liberato dalle lastrine e immerso nella soluzione di colorante per circa 20 minuti e poi nella soluzione di decolorante. Calcolare la migrazione elettroforetica (cm) dei marcatori di peso molecolare e allestire la retta mettendo in grafico il logaritmo del peso molecolare (ordinate) in funzione della migrazione (ascisse); calcolare il peso molecolare dell ADH in condizioni denaturanti (campione 4) e in condizioni denaturanti e riducenti (campione 5). Considerando che il peso molecolare dell ADH è di 140 kda, valutare se l ADH è una proteina dotate di struttura quaternaria stabilizzata anche da ponti disolfuro intercatena. 6
7 COLORIMETRIA E SPETTROFOTOMETRIA Dosaggio dell attività enzimatica della alcool Deidrogenasi (ADH) L ADH catalizza l ossidazione di alcooli primari in presenza del coenzima NAD +, ad un ph optimum di 8.0. ADH CH 3 -CH 2 -OH + NAD + O=CH-CH 3 + NADH +H + La quantità di NADH che si forma durante la reazione è calcolabile per via spettrofotometrica e permette la misura esatta della quantità di enzima presente nel campione (metodica indiretta). Ciò è possibile perché nello spettro di assorbimento del NADH appare un picco a 340 nm assente nel NAD+, dal cui valore è ricavabile la quantità di prodotto che si forma ai tempi iniziali della reazione. NAD Assorbanza NADH lunghezza d'onda (nm) La formazione del prodotto si misura ai tempi iniziali della reazione sia perché la velocità di una reazione è funzione della concentrazione di substrato sia perché la formazione dei prodotti promuove anche la reazione inversa (la riduzione dell aldeide con conseguente consumo di NADH). La variazione di assorbanza a 340 nm (variazione del rapporto forma ossidata e ridotta NAD + /NADH) per unità di tempo è misura dell attività enzimatica (vedi punto 5 pagina successiva) ed è, in generale, una reazione indicatrice molto usata in spettrofotometria per applicazioni cliniche. 7
8 Procedura per il saggio di attività dell alcool deidrogenasi (ADH): Miscela di reazione: 2 mm NAD +, 20 mm Etanolo in tampone sodio-fosfato M, ph 8.0. Mescolare 5 ml di tampone Sodio Fosfato 0.1 M ph 8.0, 4 ml di etanolo 0.1 M, 0.8 ml di NAD + 50 mm e portare a 20 ml con H 2 O; Allestire i saggi di attività utilizzando 1 ml di miscela di reazione in una cuvetta. Dopo aver azzerato l apparecchio a 340nm contro questa miscela, registrare l incremento di assorbanza a 340 nm in 30 secondi dopo aggiunta di 4 μl di estratto di E.Coli. Ripetere la procedura per le frazioni di eluato da analizzare (cioè quelle corrispondenti ad un picco di assorbanza a 280nm) utilizzandone 50 μl per ognuna di esse. É possibile determinare la concentrazione di una sostanza pura direttamente dal assorbanza (A) misurata grazie alla legge di Lambert-Beer: A = є c l dove l =1 (lunghezza del cammino ottico generalmente di 1 cm) c è la concentrazione della sostanza ed є è il coefficiente di estinzione mg/ml ecc.). espresso in unità di concentrazione (moli/litro, Per il N ADH il valore di є M (Coefficiente di Estinzione molare, moli/litro) è di O.D.* a 340 nm. Altrimenti detto, una soluzione che legge 6,2 OD a 340 nm ha una concentrazioen di 1mM, una che legge 0,062 OD 340 = 10 μm e così via. (*OD Optical Densities = Unità di misura dell Assorbanza). Calcolare le µmoli di NADH formate in 1 ml di miscela di reazione (da cui ricavare le Unità Enzimatiche). Questo valore si ottiene dividendo l incremento di assorbanza per minuto (ΔA/min) per il coefficiente di estinzione millimolare (mmoli/litro = µmoli/ml) dell NADH (є mm a 340 nm = 6. 2). 8
9 Definizione di Unità enzimatica: Una unità enzimatica è la quantità di enzima che converte in prodotto una µmole di substrato per minuto a 65 C nelle condizioni ottimali per il saggio Calcolare le unità di attività enzimatica contenute nel volume dei campioni usato per il saggio di attività. Infine calcolare le unità di attività enzimatica per millilitro (U.E./ml) di ogni campione saggiato, tenendo conto di quanti µl di ciascun campione (estratto e frazioni della colonna) sono stati utilizzati per il saggio. Esempio: ΔA/min = 0.4 OD incremento per minuto (0.2 in 30 sec) registrato utilizzando 100 μl di un campione di enzima 0.4/6.2 = 0,064 mm, ossia 0,064 μmoli/ml di NADH prodotto 0,064 μmoli/minuto = 0,064 Unità in 100 μl 0, 64 Unità/ml di ADH 9
10 Determinazione della concentrazione proteica Dosaggio della Albumina Serica Bovina (BSA) purificata: metodo diretto 1 Misurare l assorbanza della soluzione di BSA a 280 nm 2 Utilizzando la legge di Lambert-Beer (A= ε C l) calcolare la concentrazione (C) in base al coefficiente di estinzione della BSA espresso in mg/ml BSA: ε mg/ml a 280 nm = 0.67 OD 3 Una volta conosciuta la concentrazione della propria soluzione di BSA, calcolare a quanti μl equivalgono 2,5, 5, 7,5 e 10 μg di BSA Dosaggio della concentrazione proteica in una miscela: metodo indiretto Quando la soluzione è una miscela di proteine diverse, non è possibile applicare la spettrofotometria diretta per determinarne la concentrazione. Le varie specie proteiche avranno, infatti, ciascuna coefficienti di estinzione diversi. In questo caso si procede per via indiretta tramite metodo colorimetrico descritto in seguito. In questa procedura, la BSA rappresenta la proteina di riferimento in quanto è stato possibile determinarne la concentrazione esatta per via spettrofotometrica. Tale proteina è la Albumica Serica Bovina (BSA) Reazione Colorimetrica di Bradford In soluzione acida, il colorante triarilmetano (Coomassie Blu) si lega alle proteine sviluppando una colorazione blu. L intensità della colorazione, determinata a 595 nm, è direttamente proporzionale (in un definito intervallo) alla concentrazione proteica. La retta di taratura del saggio si costruisce facendo reagire il reattivo di Bradford (Coomassie Blu in soluzione acida) con quantità crescenti (2,5-5 7,5-10 μg) di una soluzione di BSA a concentrazione nota.. Mescolare 800 μl di soluzione contenente proteine (vedere schema) con 200 μl del reattivo di Bradford. Mescolare e leggere l assorbanza della soluzione a 595 nm 10
11 Tubo Campione H 2 O Reattivo OD 595nm μg 1 Bianco 800 μl 200 μl BSA 2.5 μg = μl μl 200 μl 2,5 3 BSA 5 μg = μl μl 200 μl 5,0 4 BSA 7,5 μg = μl μl 200 μl 7,5 5 BSA 10 μg = μl μl 200 μl 10,0 6 Estratto 2,5 μl 797,5 μl 200 μl 7 Estratto 8 μl 792 μl 200 μl 8 Frazione n 20 μl 780 μl 200 μl 9 Frazione n 100 μl 700 μl 200 μl Sottrarre a ogni lettura (tubi 2-8) l assorbanza del bianco; costruire la retta di taratura ponendo in grafico i valori di assorbanza (ordinate) registrati contro i relativi μg di BSA (ascisse); determinare la quantità di proteine presenti nell estratto di E.Coli (tubi 5-6), calcolando sulla retta di taratura a quanti μg di proteina corrispondono le letture ottenute: 2,5 μl estratto =. μg 8 μl estratto =.μg quindi determinare la concentrazione proteica in mg/ml facendo una media aritmetica dei due valori ottenuti determinare la quantità di proteine presenti in 20 e 100 μl della frazione attiva della colonna, calcolando sulla retta di taratura a quanti μg di proteina corrispondono le letture ottenute: 20 μl frazione n =. μg 100 μl frazione n. =. μg quindi determinare la concentrazione proteica in mg/ml facendo una media aritmetica dei due valori ottenuti. 11
12 Calcolo dell Attività specifica L attività specifica (A.S.) si definisce come il numero di unità enzimatiche (U.E.) per ml normalizzato per la concentrazione proteica sempre espressa in mg per ml di soluzione. Essa è il reale indice di efficienza durante il procedimento di purificazione di un enzima. A.S. = U.E./ml mg/ml (proteine) Si può quindi riempire la tabella di purificazione in basso e verificare se si è effettivamente proceduto ad una purificazione dell enzima ADH. Unità ADH/ml Proteine mg/ml ATTIVITA SPECIFICA Resa ESTRATTO FRAZIONE n 12
CORSO DI LAUREA IN BIOLOGIA GENERALE ED APPLICATA ESERCITAZIONE DEL CORSO DI ANALISI DI MACROMOLECOLE
 CORSO DI LAUREA IN BIOLOGIA GENERALE ED APPLICATA ESERCITAZIONE DEL CORSO DI ANALISI DI MACROMOLECOLE Anno accademico 2016-2017 L esperimento consiste nella analisi di due estratti proteici frazionati
CORSO DI LAUREA IN BIOLOGIA GENERALE ED APPLICATA ESERCITAZIONE DEL CORSO DI ANALISI DI MACROMOLECOLE Anno accademico 2016-2017 L esperimento consiste nella analisi di due estratti proteici frazionati
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2007/2008. Corso di: Laboratorio di Biologia II Chimica Biologica
 CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2007/2008 Corso di: Laboratorio di Biologia II Chimica Biologica Dott. Marcello MEROLA Parziale purificazione dell enzima Alcool Deidrogenasi
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2007/2008 Corso di: Laboratorio di Biologia II Chimica Biologica Dott. Marcello MEROLA Parziale purificazione dell enzima Alcool Deidrogenasi
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Corso di Tecniche biomolecolari applicate Modulo Analisi di Macromolecole
 CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Corso di Tecniche biomolecolari applicate Modulo Analisi di Macromolecole 1. Elettroforesi su gel di poliacrilammide (PAGE nativa) L esperimento consiste
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Corso di Tecniche biomolecolari applicate Modulo Analisi di Macromolecole 1. Elettroforesi su gel di poliacrilammide (PAGE nativa) L esperimento consiste
- determinazione colorimetrica della concentrazione di una miscela proteica
 CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2017/2018 Laboratorio di Chimica Biologica - Cromatografia a scambio ionico - determinazione colorimetrica della concentrazione di una miscela
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2017/2018 Laboratorio di Chimica Biologica - Cromatografia a scambio ionico - determinazione colorimetrica della concentrazione di una miscela
- determinazione colorimetrica della concentrazione di una miscela proteica
 CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2013/2014 Laboratorio di Chimica Biologica - Cromatografia a scambio ionico - determinazione colorimetrica della concentrazione di una miscela
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2013/2014 Laboratorio di Chimica Biologica - Cromatografia a scambio ionico - determinazione colorimetrica della concentrazione di una miscela
ESERCIZI 2. Spiegare il principio di.
 ESERCIZI 2 Spiegare il principio di. Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione
ESERCIZI 2 Spiegare il principio di. Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione
A = εlc c = A/εl c = 0.2/38000 M -1 cm -1 1 cm c = M = 5 μm
 COME PROCEDO? Ho una soluzione di una proteina purificata Preparo un bianco con lo stesso tampone utilizzato per dissolvere la proteina Effettuo l azzeramento dello spettrofotometro con il bianco e poi
COME PROCEDO? Ho una soluzione di una proteina purificata Preparo un bianco con lo stesso tampone utilizzato per dissolvere la proteina Effettuo l azzeramento dello spettrofotometro con il bianco e poi
- determinazione colorimetrica della concentrazione di una miscela proteica. - Determinazione spettrofotometrica dell attività enzimatica
 CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2012/2013 Laboratorio di Chimica Biologica - Cromatografia a scambio ionico - determinazione colorimetrica della concentrazione di una miscela
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2012/2013 Laboratorio di Chimica Biologica - Cromatografia a scambio ionico - determinazione colorimetrica della concentrazione di una miscela
ESERCIZI 2. Spiegare il principio di.
 ESERCIZI 2 Spiegare il principio di. Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione
ESERCIZI 2 Spiegare il principio di. Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione
Tra nm Nucleotidi mono-fosfato
 Un estratto proteico può contenere acidi nucleici, nucleotidi Posso verificare la loro presenza mediante la misura di uno spettro di assorbimento. Gli acidi nucleici e i nucleotidi assorbono nell UV, grazie
Un estratto proteico può contenere acidi nucleici, nucleotidi Posso verificare la loro presenza mediante la misura di uno spettro di assorbimento. Gli acidi nucleici e i nucleotidi assorbono nell UV, grazie
ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M
![ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M](/thumbs/59/43508258.jpg) ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
Metodi di studio delle proteine :
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D determinazione del peso molecolare Spettrofotometro
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D determinazione del peso molecolare Spettrofotometro
Quantizzazione del DNA con spettrofotometro
 Quantizzazione del DNA ed elettroforesi 1 Quantizzazione del DNA con spettrofotometro Al termine della metodica di estrazione, occorre quantificare il DNA isolato. Un metodo per quantificare in modo preciso
Quantizzazione del DNA ed elettroforesi 1 Quantizzazione del DNA con spettrofotometro Al termine della metodica di estrazione, occorre quantificare il DNA isolato. Un metodo per quantificare in modo preciso
ELETTROFORESI DI PROTEINE
 ELETTROFORESI DI PROTEINE ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni
ELETTROFORESI DI PROTEINE ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni
Elettroforesi = migrazione in campo elettrico
 Elettroforesi = migrazione in campo elettrico Molte molecole di interesse biologico possiedono gruppi ionizzabili. In opportune condizioni di ph presentano una carica elettrica + o e quindi sono in grado
Elettroforesi = migrazione in campo elettrico Molte molecole di interesse biologico possiedono gruppi ionizzabili. In opportune condizioni di ph presentano una carica elettrica + o e quindi sono in grado
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento
 TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
1. Cromatografia per gel-filtrazione
 1. Cromatografia per gel-filtrazione La gel filtrazione è un metodo cromatografico che separa le sostanze in base alle loro dimensioni molecolari. I materiali che costituiscono il supporto per la gel-filtrazione
1. Cromatografia per gel-filtrazione La gel filtrazione è un metodo cromatografico che separa le sostanze in base alle loro dimensioni molecolari. I materiali che costituiscono il supporto per la gel-filtrazione
Cosa determina l assorbanza di un cromoforo?
 Cosa determina l assorbanza di un cromoforo? I cromofori sono di solito caratterizzati da doppi legami e sistemi di risonanza Lo spettro di assorbimento di un cromoforo è solo parzialmente determinato
Cosa determina l assorbanza di un cromoforo? I cromofori sono di solito caratterizzati da doppi legami e sistemi di risonanza Lo spettro di assorbimento di un cromoforo è solo parzialmente determinato
3. ELETTROFORESI DI PROTEINE
 3. ELETTROFORESI DI PROTEINE Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) ELETTROFORESI PRINCIPI GENERALI Migrazione di particelle
3. ELETTROFORESI DI PROTEINE Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) ELETTROFORESI PRINCIPI GENERALI Migrazione di particelle
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA
 CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Curriculum Biologia della Nutrizione Anno Accademico 2012/2013 Corso di Chimica Biologica e laboratorio Dott. Eliodoro Pizzo Materiale Didattico Laboratorio
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Curriculum Biologia della Nutrizione Anno Accademico 2012/2013 Corso di Chimica Biologica e laboratorio Dott. Eliodoro Pizzo Materiale Didattico Laboratorio
PURIFICAZIONE E CARATTERIZZAZIONE BIOCHIMICA DI UNA TREALASI DI INSETTO ESPRESSA COME PROTEINA ETEROLOGA IN Escherichia coli.
 PURIFICAZIONE E CARATTERIZZAZIONE BIOCHIMICA DI UNA TREALASI DI INSETTO ESPRESSA COME PROTEINA ETEROLOGA IN Escherichia coli. La trealasi (α,α-trealosio glucoidrolasi EC 3.2.1.28) è un enzima che catalizza
PURIFICAZIONE E CARATTERIZZAZIONE BIOCHIMICA DI UNA TREALASI DI INSETTO ESPRESSA COME PROTEINA ETEROLOGA IN Escherichia coli. La trealasi (α,α-trealosio glucoidrolasi EC 3.2.1.28) è un enzima che catalizza
+ (ph < pi) 0/- (ph pi)
 Pianificare la separazione delle seguenti proteine utilizzando una colonna cromatografica contenente lo scambiatore di cationi CM-cellulosa. A quale valore di ph dobbiamo equilibrare la FS? Stabilire la
Pianificare la separazione delle seguenti proteine utilizzando una colonna cromatografica contenente lo scambiatore di cationi CM-cellulosa. A quale valore di ph dobbiamo equilibrare la FS? Stabilire la
cromatografia Elettroforesi
 Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
Laurea Magistrale in Biologia
 Laurea Magistrale in Biologia Laboratorio del corso di Chimica Fisica Biologica Anno accademico 2009/10 SCOPO Determinazione dei parametri termodinamici associati alla denaturazione termica di una piccola
Laurea Magistrale in Biologia Laboratorio del corso di Chimica Fisica Biologica Anno accademico 2009/10 SCOPO Determinazione dei parametri termodinamici associati alla denaturazione termica di una piccola
5- Estrazione ed analisi di DNA
 5- Estrazione ed analisi di DNA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU) 16 ore) Marco Scocchi ( BIO/10-11) La struttura del DNA La traduzione dell informazione
5- Estrazione ed analisi di DNA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU) 16 ore) Marco Scocchi ( BIO/10-11) La struttura del DNA La traduzione dell informazione
La Spettroscopia in Biologia
 La Spettroscopia in Biologia Linda Avesani Dip. Scientifico e Tecnologico Università di Verona Spettroscopia e Proprietà della luce La spettroscopia in biologia studia la struttura e la dinamica delle
La Spettroscopia in Biologia Linda Avesani Dip. Scientifico e Tecnologico Università di Verona Spettroscopia e Proprietà della luce La spettroscopia in biologia studia la struttura e la dinamica delle
Elettroforesi di Tamara Benincasa
 Elettroforesi di Tamara Benincasa L elettroforesi è una metodologia utilizzata in laboratorio attraverso la quale molecole biologiche (ammino acidi, peptidi, proteine, nucleotidi ed acidi nucleici), dotate
Elettroforesi di Tamara Benincasa L elettroforesi è una metodologia utilizzata in laboratorio attraverso la quale molecole biologiche (ammino acidi, peptidi, proteine, nucleotidi ed acidi nucleici), dotate
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI
 METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Elettroforesi proteine ed acidi nucleici
 Elettroforesi proteine ed acidi nucleici Flavia Frabetti Tecnici di laboratorio 2010/2011 ELETTORFORESI metodo fisico di separazione che sfrutta la mobilità elettroforetica di molecole cariche, sottoposte
Elettroforesi proteine ed acidi nucleici Flavia Frabetti Tecnici di laboratorio 2010/2011 ELETTORFORESI metodo fisico di separazione che sfrutta la mobilità elettroforetica di molecole cariche, sottoposte
Analisi delle Proteine
 Analisi delle Proteine Elementi che costituiscono le proteine: idrogeno, carbonio, azoto, ossigeno e zolfo; tra cui l azoto è l elemento più distintivo nei cibi, l azoto varia da 13,4% a 19,1%. L analisi
Analisi delle Proteine Elementi che costituiscono le proteine: idrogeno, carbonio, azoto, ossigeno e zolfo; tra cui l azoto è l elemento più distintivo nei cibi, l azoto varia da 13,4% a 19,1%. L analisi
Analisi spettrofotometrica dell Albumina di siero bovino: applicazione della legge di Lambert-Beer:
 Analisi spettrofotometrica dell Albumina di siero bovino: applicazione della legge di Lambert-Beer: Introduzione: La spettrofotometria o fotometria è una tecnica analitica che sfrutta il fenomeno dell'assorbimento
Analisi spettrofotometrica dell Albumina di siero bovino: applicazione della legge di Lambert-Beer: Introduzione: La spettrofotometria o fotometria è una tecnica analitica che sfrutta il fenomeno dell'assorbimento
Strategie per la purificazione delle proteine
 Strategie per la purificazione delle proteine In una cellula ci possono essere molte proteine (ad esempio, ci sono circa 4300 geni in E. coli) Una singola proteina può rappresentare una frazione tra lo
Strategie per la purificazione delle proteine In una cellula ci possono essere molte proteine (ad esempio, ci sono circa 4300 geni in E. coli) Una singola proteina può rappresentare una frazione tra lo
Genomica e Proteomica
 Genomica e Proteomica Genomica: sequenziamento del DNA presente in un organismo e analisi dei geni (bioinformatica) Proteomica: analisi delle proteine di un organismo: Quali proteine in un dato momento
Genomica e Proteomica Genomica: sequenziamento del DNA presente in un organismo e analisi dei geni (bioinformatica) Proteomica: analisi delle proteine di un organismo: Quali proteine in un dato momento
Spettroscopia molecolare: interazioni luce-materia
 Spettroscopia molecolare: interazioni luce-materia Nella spettroscopia molecolare il campione è irradiato con luce avente λ nell UV, nel visibile o nell infrarosso. Le molecole di cui è costituito il campione
Spettroscopia molecolare: interazioni luce-materia Nella spettroscopia molecolare il campione è irradiato con luce avente λ nell UV, nel visibile o nell infrarosso. Le molecole di cui è costituito il campione
ε (M -1 cm -1 ) Composto 260 nm 340 nm NAD ~ 0 NADPH
 1 Una soluzione contenente una miscela di NADPH e NAD + viene analizzata spettrofotometricamente. L assorbanza di tale miscela, misurata in una cuvetta da 1 cm di lunghezza, è pari a: A260 nm = 0,85 A340nm
1 Una soluzione contenente una miscela di NADPH e NAD + viene analizzata spettrofotometricamente. L assorbanza di tale miscela, misurata in una cuvetta da 1 cm di lunghezza, è pari a: A260 nm = 0,85 A340nm
TECNICHE ELETTROFORETICHE
 TECNICHE ELETTROFORETICHE L elettroforesi e un metodo di separazione che si basa sulla diversa mobilita degli ioni (o di sostanze elettricamente cariche), quando posti all interno di un campo elettrico
TECNICHE ELETTROFORETICHE L elettroforesi e un metodo di separazione che si basa sulla diversa mobilita degli ioni (o di sostanze elettricamente cariche), quando posti all interno di un campo elettrico
Determinazioni quantitative in farmacologia
 Determinazioni quantitative in farmacologia 1 Dosaggio biologico determinazione quantitativa della concentrazione o della potenza di una sostanza per mezzo della valutazione della risposta biologica che
Determinazioni quantitative in farmacologia 1 Dosaggio biologico determinazione quantitativa della concentrazione o della potenza di una sostanza per mezzo della valutazione della risposta biologica che
METODI BIOCHIMICI ESERCIZI D ESAME (by NewSgrunt)
 METODI BIOCHIMICI ESERCIZI D ESAME 2002 2006 (by NewSgrunt) A) SPETTROSCOPIA UV/vis, LAMBERT-BEER, STUDIO DELLE PROTEINE 1A) Il Citocromo c è caratterizzato dai seguenti coefficienti di estinzione molare:
METODI BIOCHIMICI ESERCIZI D ESAME 2002 2006 (by NewSgrunt) A) SPETTROSCOPIA UV/vis, LAMBERT-BEER, STUDIO DELLE PROTEINE 1A) Il Citocromo c è caratterizzato dai seguenti coefficienti di estinzione molare:
Schema a blocchi di uno spettrofluorimetro
 MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
TECNICHE ELETTROFORETICHE. - Purificazione di molecole: elettroforesi preparativa. - Controllo della purezza di una molecola in un campione
 TECNICHE ELETTROFORETICHE Aree di applicazione: - Purificazione di molecole: elettroforesi preparativa - Controllo della purezza di una molecola in un campione - Determinazione quantitativa di una molecola
TECNICHE ELETTROFORETICHE Aree di applicazione: - Purificazione di molecole: elettroforesi preparativa - Controllo della purezza di una molecola in un campione - Determinazione quantitativa di una molecola
LABORATORIO DI CHIMICA FISICA PER IL CORSO DI LAUREA IN SCIENZA DEI MATERIALI A.A. 2010/2011 DR. ESTER CHIESSI
 LABORATORIO DI CHIMICA FISICA ER IL CORSO DI LAUREA IN SCIENZA DEI MATERIALI A.A. 21/211 DR. ESTER CHIESSI DETERMINAZIONE DEI ARAMETRI TERMODINAMICI DI EQUILIBRIO DI UNA REAZIONE CHIMICA: LA FORMAZIONE
LABORATORIO DI CHIMICA FISICA ER IL CORSO DI LAUREA IN SCIENZA DEI MATERIALI A.A. 21/211 DR. ESTER CHIESSI DETERMINAZIONE DEI ARAMETRI TERMODINAMICI DI EQUILIBRIO DI UNA REAZIONE CHIMICA: LA FORMAZIONE
Chimica Analitica e Laboratorio 2. Modulo di Spettroscopia Analitica
 Chimica Analitica e Laboratorio 2 Modulo di Spettroscopia Analitica Determinazione della costante di dissociazione di un acido debole 2 Metodi di determinazione del pk d Potenziometria K d = + [ H ][ A
Chimica Analitica e Laboratorio 2 Modulo di Spettroscopia Analitica Determinazione della costante di dissociazione di un acido debole 2 Metodi di determinazione del pk d Potenziometria K d = + [ H ][ A
Modulo 3. Lavorare con le proteine
 Modulo 3 Lavorare con le proteine La purificazione delle proteine Il primo passaggio nello studio delle proprietà di una proteina è la sua purificazione: la sua estrazione dalla matrice biologica in cui
Modulo 3 Lavorare con le proteine La purificazione delle proteine Il primo passaggio nello studio delle proprietà di una proteina è la sua purificazione: la sua estrazione dalla matrice biologica in cui
V R V t. Proteine ad alto peso molecolare. Proteine a peso molecolare intermedio. Proteine a basso peso molecolare. Kd + piccolo.
 V 0 Proteine ad alto peso molecolare Proteine a peso molecolare intermedio V R V t Proteine a basso peso molecolare Kd elevato Kd piccolo Esclusione molecolare o gelfiltrazione = Volume totale V T = V
V 0 Proteine ad alto peso molecolare Proteine a peso molecolare intermedio V R V t Proteine a basso peso molecolare Kd elevato Kd piccolo Esclusione molecolare o gelfiltrazione = Volume totale V T = V
Dosaggio delle proteine
 Laboratorio Integrato 4 Lezione n.2 Dosaggio delle proteine Dott.ssa Francesca Zazzeroni METODI PER EFFETTUARE UN DOSAGGIO PROTEICO 1-Metodo del Biureto - il reattivo del biureto consiste in una soluzione
Laboratorio Integrato 4 Lezione n.2 Dosaggio delle proteine Dott.ssa Francesca Zazzeroni METODI PER EFFETTUARE UN DOSAGGIO PROTEICO 1-Metodo del Biureto - il reattivo del biureto consiste in una soluzione
Biochimica Analitica Esperienze di Laboratorio
 Corso di Laurea in Biotecnologie Insegnamento di Biochimica e Biochimica Analitica Dipartimento di Biotecnologie Università degli Studi di Verona Anno Accademico 2017-2018 Biochimica Analitica Esperienze
Corso di Laurea in Biotecnologie Insegnamento di Biochimica e Biochimica Analitica Dipartimento di Biotecnologie Università degli Studi di Verona Anno Accademico 2017-2018 Biochimica Analitica Esperienze
Metodologie di microbiologia e genetica
 Metodologie di microbiologia e genetica Modulo Metodologie di Genetica Prof.ssa Antonella Furini ESERCITAZIONE N 3 PREPARAZIONE DEL FRAMMENTO E DEL taglio con enzimi di restrizione 1. Taglio del plasmide
Metodologie di microbiologia e genetica Modulo Metodologie di Genetica Prof.ssa Antonella Furini ESERCITAZIONE N 3 PREPARAZIONE DEL FRAMMENTO E DEL taglio con enzimi di restrizione 1. Taglio del plasmide
ELETTROFORESI DI PROTEINE
 ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni di PROTEINE è più piccola
ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni di PROTEINE è più piccola
BENZILPENICILLINA BENZATINICA PREPARAZIONE INIETTABILI. Benzilpenicillina Benzatinica polvere sterile per preparazioni iniettabili
 1 1 1 1 1 1 1 1 0 1 0 1 0 1 1 01/FU Maggio 00 Commenti entro il 0 Settembre 00 NOTA: Corretta in seguito ai commenti della Dott.ssa Mozzetti La monografia è stata revisionata per armonizzarla con le altre
1 1 1 1 1 1 1 1 0 1 0 1 0 1 1 01/FU Maggio 00 Commenti entro il 0 Settembre 00 NOTA: Corretta in seguito ai commenti della Dott.ssa Mozzetti La monografia è stata revisionata per armonizzarla con le altre
Seminario di Cacciatore Rosalia
 Un organismo vivente è un sistema chimico complesso nel quale la materia organica viene sintetizzata, riprodotta, trasformata e decomposta in un incessante ed intenso susseguirsi di reazioni e processi
Un organismo vivente è un sistema chimico complesso nel quale la materia organica viene sintetizzata, riprodotta, trasformata e decomposta in un incessante ed intenso susseguirsi di reazioni e processi
Corso di Tecniche biomolecolari applicate Modulo Analisi di Macromolecole
 Laboratorio Giorno 1 Corso di Tecniche biomolecolari applicate Modulo Analisi di Macromolecole Docente: Dott. Andrea Strazzulli Attività: Determinazione della concentrazione proteica di un campione. Parte
Laboratorio Giorno 1 Corso di Tecniche biomolecolari applicate Modulo Analisi di Macromolecole Docente: Dott. Andrea Strazzulli Attività: Determinazione della concentrazione proteica di un campione. Parte
GENERALITA SULLA CROMATOGRAFIA
 GENERALITA SULLA CROMATOGRAFIA COSA SONO LE TECNICHE CROMATOGRAFICHE? La cromatografia consiste nello sfruttare la diversa attitudine di ogni molecola o ione nel distribuirsi fra 2 fasi differenti. Una
GENERALITA SULLA CROMATOGRAFIA COSA SONO LE TECNICHE CROMATOGRAFICHE? La cromatografia consiste nello sfruttare la diversa attitudine di ogni molecola o ione nel distribuirsi fra 2 fasi differenti. Una
Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo
 Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo spettrometria di massa elettroforesi Spettrometria di massa Tecnica per indagine che si basa sulla ionizzazione di una molecola
Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo spettrometria di massa elettroforesi Spettrometria di massa Tecnica per indagine che si basa sulla ionizzazione di una molecola
CINETICA ENZIMATICA - velocità di reazione
 [P] Velocità iniziale (V 0 ) CINETICA ENZIMATICA - velocità di reazione + + k 1 E + S ES ES E + P k 2 k 3 k 4 V = d[p]/dt = k 3 [ES] Velocità iniziale (V 0 ) quando [S] >> [P] V max t CINETICA ENZIMATICA:
[P] Velocità iniziale (V 0 ) CINETICA ENZIMATICA - velocità di reazione + + k 1 E + S ES ES E + P k 2 k 3 k 4 V = d[p]/dt = k 3 [ES] Velocità iniziale (V 0 ) quando [S] >> [P] V max t CINETICA ENZIMATICA:
AMPICILLINA SODICA PREPARAZIONE INIETTABILE. Ampicillina sodica polvere sterile per preparazioni iniettabili
 1 0 1 0 1 0 1 0 1 001/FU Aprile 00 Commenti entro il Settembre 00 NOTA: Armonizzata con la versione revisionata della B.P. La monografia è stata completamente revisionata per armonizzarla con le corrispondenti
1 0 1 0 1 0 1 0 1 001/FU Aprile 00 Commenti entro il Settembre 00 NOTA: Armonizzata con la versione revisionata della B.P. La monografia è stata completamente revisionata per armonizzarla con le corrispondenti
Elettroforesi: Separazione di molecole cariche mediante applicazione di un campo elettrico
 ELETTROFORESI 1 Elettroforesi: Separazione di molecole cariche mediante applicazione di un campo elettrico Cationi (+) Anioni (-) Polo negativo o CATODO Polo positivo o ANODO 1 Elettroforesi: Separazione
ELETTROFORESI 1 Elettroforesi: Separazione di molecole cariche mediante applicazione di un campo elettrico Cationi (+) Anioni (-) Polo negativo o CATODO Polo positivo o ANODO 1 Elettroforesi: Separazione
SPETTROFOTOMETRIA UV/VIS
 SPETTROFOTOMETRIA UV/VIS TECNICHE SPETTROSCOPICHE Le tecniche spettroscopiche sono tutte quelle tecniche basate sull interazione tra la materia e le radiazioni elettromagnetiche. La luce, il calore ed
SPETTROFOTOMETRIA UV/VIS TECNICHE SPETTROSCOPICHE Le tecniche spettroscopiche sono tutte quelle tecniche basate sull interazione tra la materia e le radiazioni elettromagnetiche. La luce, il calore ed
TECNICHE DI BIOLOGIA MOLECOLARE. Dott.ssa Francesca Santilli
 TECNICHE DI BIOLOGIA MOLECOLARE Dott.ssa Francesca Santilli Sin dai primi anni 60, i biologi molecolari hanno scoperto come caratterizzare, isolare e manipolare le componenti molecolari delle CELLULE e
TECNICHE DI BIOLOGIA MOLECOLARE Dott.ssa Francesca Santilli Sin dai primi anni 60, i biologi molecolari hanno scoperto come caratterizzare, isolare e manipolare le componenti molecolari delle CELLULE e
TECNICHE CROMATOGRAFICHE
 TECNICHE CROMATOGRAFICHE ISOLAMENTO DI MOLECOLE BIOLOGICHE Distruzione delle cellule e dei tessuti che contengono le molecole biologiche di nostro interesse (proteine o acidi nucleici) -Tampone (ph) -Sali
TECNICHE CROMATOGRAFICHE ISOLAMENTO DI MOLECOLE BIOLOGICHE Distruzione delle cellule e dei tessuti che contengono le molecole biologiche di nostro interesse (proteine o acidi nucleici) -Tampone (ph) -Sali
Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa
 WESTERN BLOTTING Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa Tecnica di trasferimento delle proteine da un gel ad una membrana associata ad utilizzo di anticorpi
WESTERN BLOTTING Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa Tecnica di trasferimento delle proteine da un gel ad una membrana associata ad utilizzo di anticorpi
Estrazione ed elettroforesi degli acidi nucleici
 Estrazione ed elettroforesi degli acidi nucleici Flavia Frabetti Estrazione acidi nucleici (DNA orna) Verifica tramite elettroforesi su gel di agarosio Amplificazione tramite PCR (da DNA) o RT-PCR (da
Estrazione ed elettroforesi degli acidi nucleici Flavia Frabetti Estrazione acidi nucleici (DNA orna) Verifica tramite elettroforesi su gel di agarosio Amplificazione tramite PCR (da DNA) o RT-PCR (da
TECNICHE SPETTROSCOPICHE
 TECNICHE SPETTROSCOPICHE L interazione delle radiazioni elettromagnetiche con la materia e essenzialmente un fenomeno quantico, che dipende sia dalle proprieta della radiazione sia dalla natura della materia
TECNICHE SPETTROSCOPICHE L interazione delle radiazioni elettromagnetiche con la materia e essenzialmente un fenomeno quantico, che dipende sia dalle proprieta della radiazione sia dalla natura della materia
Analisi di proteine:
 Analisi di proteine: Elettroforesi e Western Blot Seminario Metodologico per il Corso di Didattica Libera Marilena Dinardo mm.dinardo@biologia.uniba.it Le proteine sono il prodotto dei geni: sono le proteine
Analisi di proteine: Elettroforesi e Western Blot Seminario Metodologico per il Corso di Didattica Libera Marilena Dinardo mm.dinardo@biologia.uniba.it Le proteine sono il prodotto dei geni: sono le proteine
cromatografia Esplorando le proteine
 Cromatografia Flavia Frabetti Tecnici di laboratorio 2010/2011 Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per
Cromatografia Flavia Frabetti Tecnici di laboratorio 2010/2011 Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per
Analisi di proteine:
 Analisi di proteine: Elettroforesi e Western Blot Seminario Metodologico per il Corso di Didattica Libera Marilena Dinardo mariamaddalena.dinardo@uniba.it Le proteine sono il prodotto dei geni: sono le
Analisi di proteine: Elettroforesi e Western Blot Seminario Metodologico per il Corso di Didattica Libera Marilena Dinardo mariamaddalena.dinardo@uniba.it Le proteine sono il prodotto dei geni: sono le
determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Spettrofotometro cuvetta monocromatore rivelatore
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Spettrofotometro cuvetta monocromatore rivelatore
Elettroforesi. Separazione differenziata di molecole cariche (aminoacidi, peptidi, proteine, Acidi nucleici, ecc) sottoposte a un campo elelttrico
 Elettroforesi Separazione differenziata di molecole cariche (aminoacidi, peptidi, proteine, Acidi nucleici, ecc) sottoposte a un campo elelttrico Principio: Migrazione di particelle cariche sotto l azione
Elettroforesi Separazione differenziata di molecole cariche (aminoacidi, peptidi, proteine, Acidi nucleici, ecc) sottoposte a un campo elelttrico Principio: Migrazione di particelle cariche sotto l azione
1a ESERCITAZIONE CLOROFILLA
 1 a a ESERCITAZIONE 1 430 460 645 662 CLOROFILLA CAROTENOIIDII 2 3 PARTE I - ESTRAZIONE E DOSAGGIO DELLE CLOROFILLE Obiettivo: estrarre i pigmenti fogliari e quantificare per via spettrofotometrica la
1 a a ESERCITAZIONE 1 430 460 645 662 CLOROFILLA CAROTENOIIDII 2 3 PARTE I - ESTRAZIONE E DOSAGGIO DELLE CLOROFILLE Obiettivo: estrarre i pigmenti fogliari e quantificare per via spettrofotometrica la
la purificazione può essere di tipo analitico o preparativo Purificare una proteina significa ottenerla in forma omogenea
 la purificazione può essere di tipo analitico o preparativo Purificare una proteina significa ottenerla in forma omogenea Analisi delle sue proprietà fisiche e biologiche Come viene modulata la sua espressione
la purificazione può essere di tipo analitico o preparativo Purificare una proteina significa ottenerla in forma omogenea Analisi delle sue proprietà fisiche e biologiche Come viene modulata la sua espressione
TECNICHE CROMATOGRAFICHE
 TECNICHE CROMATOGRAFICHE Le tecniche cromatografiche permettono di separare gli analiti presenti in una miscela complessa. Tutti i sistemi cromatografici sono costituiti da una fase stazionaria, che puo
TECNICHE CROMATOGRAFICHE Le tecniche cromatografiche permettono di separare gli analiti presenti in una miscela complessa. Tutti i sistemi cromatografici sono costituiti da una fase stazionaria, che puo
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria contesto fisiologico livelli superiori funzione Elettrofores i
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria contesto fisiologico livelli superiori funzione Elettrofores i
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 13 Cromatografia ed elettroforesi Concetti chiave: Il comportamento cromatografico di una proteina è influenzato da alcune
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 13 Cromatografia ed elettroforesi Concetti chiave: Il comportamento cromatografico di una proteina è influenzato da alcune
Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta)
 Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta) E il termine generico che indica una serie di tecniche di separazione di molecole simili in
Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta) E il termine generico che indica una serie di tecniche di separazione di molecole simili in
Espressione eterologa, purificazione e saggio di attività della Fe-idrogenasi di Enterobacter cloacae
 Università degli studi di Padova - Facoltà di scienze MM.FF.NN. Laurea di primo livello in biologia molecolare Espressione eterologa, purificazione e saggio di attività della Fe-idrogenasi di Enterobacter
Università degli studi di Padova - Facoltà di scienze MM.FF.NN. Laurea di primo livello in biologia molecolare Espressione eterologa, purificazione e saggio di attività della Fe-idrogenasi di Enterobacter
WESTERN BLOTTING Tecnica che permette di valutare quanto è espressa una proteina e dove è localizzata. SDS-PAGE trasferimento saturazione
 WESTERN BLOTTING Tecnica che permette di valutare quanto è espressa una proteina e dove è localizzata. La procedura di Western Blotting consiste nei seguenti passaggi: - SDS-PAGE - trasferimento (blotting)
WESTERN BLOTTING Tecnica che permette di valutare quanto è espressa una proteina e dove è localizzata. La procedura di Western Blotting consiste nei seguenti passaggi: - SDS-PAGE - trasferimento (blotting)
IL MATERIALE CONTENUTO IN QUESTE DIAPOSITIVE E AD ESCLUSIVO USO DIDATTICO PER L UNIVERSITA DI TERAMO
 IL MATERIALE CONTENUTO IN QUESTE DIAPOSITIVE E AD ESCLUSIVO USO DIDATTICO PER L UNIVERSITA DI TERAMO LE IMMAGINE CONTENUTE SONO SCARICATE DAI SITI WEB DI CUI SONO RIPORTATI I LINK METODOLOGIE BIOCHIMICHE
IL MATERIALE CONTENUTO IN QUESTE DIAPOSITIVE E AD ESCLUSIVO USO DIDATTICO PER L UNIVERSITA DI TERAMO LE IMMAGINE CONTENUTE SONO SCARICATE DAI SITI WEB DI CUI SONO RIPORTATI I LINK METODOLOGIE BIOCHIMICHE
l'analisi dello spettro permette di individuare la natura della sostanza in esame
 L'analisi spettrofotometrica consiste nella misurazione di radiazioni elettromagnetiche per ottenere informazioni sia qualitative che quantitative: ogni sostanza assorbe o emette radiazioni di lunghezza
L'analisi spettrofotometrica consiste nella misurazione di radiazioni elettromagnetiche per ottenere informazioni sia qualitative che quantitative: ogni sostanza assorbe o emette radiazioni di lunghezza
RACCOLTA E PROCESSAMENTO CAMPIONE URINE PER ANALISI OMICHE
 RACCOLTA E PROCESSAMENTO CAMPIONE URINE PER ANALISI OMICHE 00049 Autori Vittorio Sirolli Contenuti Abstract raccolta e processamento dei campioni urinari Abstract release 1 pubblicata il 20 luglio 2012
RACCOLTA E PROCESSAMENTO CAMPIONE URINE PER ANALISI OMICHE 00049 Autori Vittorio Sirolli Contenuti Abstract raccolta e processamento dei campioni urinari Abstract release 1 pubblicata il 20 luglio 2012
Estrazione di proteine da matrici alimentari, determinazione ed analisi
 Estrazione di proteine da matrici alimentari, determinazione ed analisi Laboratorio di Biochimica Generale (Responsabile attività: Prof. Rocco Rossano, Tutor: Dr.ssa Marilena Larocca) 1. Omogeneizzazione
Estrazione di proteine da matrici alimentari, determinazione ed analisi Laboratorio di Biochimica Generale (Responsabile attività: Prof. Rocco Rossano, Tutor: Dr.ssa Marilena Larocca) 1. Omogeneizzazione
Esercitazioni di Chimica Biologica AA PURIFICAZIONE DI UNA PROTEINA DI FUSIONE GST-CATECOLO 1,2 DIOSSIGENASI
 Esercitazioni di Chimica Biologica AA 2005-06 PURIFICAZIONE DI UNA PROTEINA DI FUSIONE GST-CATECOLO 1,2 DIOSSIGENASI Viene utilizzato il pellet cellulare congelato ottenuto dalla crescita di cellule di
Esercitazioni di Chimica Biologica AA 2005-06 PURIFICAZIONE DI UNA PROTEINA DI FUSIONE GST-CATECOLO 1,2 DIOSSIGENASI Viene utilizzato il pellet cellulare congelato ottenuto dalla crescita di cellule di
PROGETTO di ALTERNANZA SCUOLA LAVORO
 PROGETTO di ALTERNANZA SCUOLA LAVORO Formazione sul rischio specifico chimico e biologico Progettazione e sintesi di composti organici di interesse farmaceutico; determinazione quali-quantitativa Attività
PROGETTO di ALTERNANZA SCUOLA LAVORO Formazione sul rischio specifico chimico e biologico Progettazione e sintesi di composti organici di interesse farmaceutico; determinazione quali-quantitativa Attività
WESTERN BLOT o IMMUNOFISSAZIONE
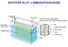 WESTERN BLOT o IMMUNOFISSAZIONE BLOTTING Trasferimento di macromolecole su una membrana immobilizzante. Southern DNA - da Edward Southern 1970 Northern Western RNA Proteine SCOPO DEL WESTERN BLOTTING Consente
WESTERN BLOT o IMMUNOFISSAZIONE BLOTTING Trasferimento di macromolecole su una membrana immobilizzante. Southern DNA - da Edward Southern 1970 Northern Western RNA Proteine SCOPO DEL WESTERN BLOTTING Consente
La cinetica enzimatica: Calcolo della K m e V max
 La cinetica enzimatica: Calcolo della K m e V max Parametri cinetici K m (numericamente uguale alla concentrazione di substrato alla quale la velocità iniziale è pari alla metà della velocità massima)
La cinetica enzimatica: Calcolo della K m e V max Parametri cinetici K m (numericamente uguale alla concentrazione di substrato alla quale la velocità iniziale è pari alla metà della velocità massima)
La legge. Il colorimetro. L esperienza. Realizzato da. August Beer ( ) Johann Heinrich Lambert ( )
 LA LEGGE DI LAMBERT-BEER BEER Esperienza con il sensore colorimetrico La legge Il colorimetro August Beer (1825-1863) L esperienza Johann Heinrich Lambert (1728-1777) Realizzato da La legge di Lambert
LA LEGGE DI LAMBERT-BEER BEER Esperienza con il sensore colorimetrico La legge Il colorimetro August Beer (1825-1863) L esperienza Johann Heinrich Lambert (1728-1777) Realizzato da La legge di Lambert
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa.
 La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
Amplificazione mediante PCR (Polymerase Chain Reaction) del DNA estratto dalla saliva.
 OBIETTIVO DEL LAVORO SPERIMENTALE: TIPIZZAZIONE DEI CROMOSOMI SESSUALI X e Y Amplificazione mediante PCR (Polymerase Chain Reaction) del DNA estratto dalla saliva. Cromosoma X Cromosoma y La tipizzazione
OBIETTIVO DEL LAVORO SPERIMENTALE: TIPIZZAZIONE DEI CROMOSOMI SESSUALI X e Y Amplificazione mediante PCR (Polymerase Chain Reaction) del DNA estratto dalla saliva. Cromosoma X Cromosoma y La tipizzazione
2. LA PURIFICAZIONE DI PROTEINE:
 2. LA PURIFICAZIONE DI PROTEINE: LA CROMATOGRAFIA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) LA PURIFICAZIONE DI PROTEINE Purificare
2. LA PURIFICAZIONE DI PROTEINE: LA CROMATOGRAFIA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) LA PURIFICAZIONE DI PROTEINE Purificare
L elettroforesi è una tecnica che consiste nella migrazione differenziata in un campo elettrico, di molecole elettricamente cariche.
 L elettroforesi è una tecnica che consiste nella migrazione differenziata in un campo elettrico, di molecole elettricamente cariche. L elettroforesi è una tecnica che viene usata per separare molecole
L elettroforesi è una tecnica che consiste nella migrazione differenziata in un campo elettrico, di molecole elettricamente cariche. L elettroforesi è una tecnica che viene usata per separare molecole
TIPI di CROMATOGRAFIA
 Metodo di separazione che si basa sulla distribuzione degli analiti tra una fase mobile e una fase stazionaria. TIPI di CROMATOGRAFIA Eluizione degli analiti può avvenire: Capillarità Gravità Pressione
Metodo di separazione che si basa sulla distribuzione degli analiti tra una fase mobile e una fase stazionaria. TIPI di CROMATOGRAFIA Eluizione degli analiti può avvenire: Capillarità Gravità Pressione
MA + H + MAH + Materiale: 500 cc di soluzione di NaOH 0.01 M 500 cc di soluzione di HCl 0.01 M fresca Metil-arancio (MA) Etanolo Acqua distillata
 Cambiamenti nell aspetto degli spettri di assorbimento elettronico del metilarancio in funzione del ph a seguito della reazione di protonazione del metilarancio. Scopo dell esperimento è osservare la variazione
Cambiamenti nell aspetto degli spettri di assorbimento elettronico del metilarancio in funzione del ph a seguito della reazione di protonazione del metilarancio. Scopo dell esperimento è osservare la variazione
FORMULARIO DI CHIMICA
 ARGOMENTO Grandezze chimiche fondamentali: 1. Numero di Avogadro 2. Mole 3. Massa Molare 4. Densità 5. Volume molare di un gas Modi di esprimere la concentrazione: 1. Molare M 2. Parti per milione ppm
ARGOMENTO Grandezze chimiche fondamentali: 1. Numero di Avogadro 2. Mole 3. Massa Molare 4. Densità 5. Volume molare di un gas Modi di esprimere la concentrazione: 1. Molare M 2. Parti per milione ppm
CFU. Nome e cognome. Metodi Biochimici in Biotecnologie 19 luglio 2AA7- Test B
 Metodi Biochimici in Biotecnologie 19 luglio 2AA7- Test B Nome e cognome CFU 1B) (3 punti max) L'enzima YZ contiene un atomo di rame nel suo sito attivo. Lo spettro di assorbimento del visibile di questo
Metodi Biochimici in Biotecnologie 19 luglio 2AA7- Test B Nome e cognome CFU 1B) (3 punti max) L'enzima YZ contiene un atomo di rame nel suo sito attivo. Lo spettro di assorbimento del visibile di questo
O (PM:266,45), resina Dowex AG50W-X2, acido perclorico 65%.
 Parte sperimentale Reagenti CrCl 3 x 6H 2 O (PM:266,45), resina Dowex AG50W-X2, acido perclorico 65%. Procedura sperimentale Preparazione delle soluzioni eluenti Preparare le seguenti soluzioni madre di
Parte sperimentale Reagenti CrCl 3 x 6H 2 O (PM:266,45), resina Dowex AG50W-X2, acido perclorico 65%. Procedura sperimentale Preparazione delle soluzioni eluenti Preparare le seguenti soluzioni madre di
Laboratorio 10.3 DETERMINAZIONE DEL FENOLO NELLE ACQUE
 2 Analisi chimica strumentale Laboratorio 10.3 DETERMINAZIONE DEL FENOLO NELLE ACQUE Determinazione spettrofotometrica U con il metodo delle aggiunte multiple Confronti tra l utilizzo dell altezza del
2 Analisi chimica strumentale Laboratorio 10.3 DETERMINAZIONE DEL FENOLO NELLE ACQUE Determinazione spettrofotometrica U con il metodo delle aggiunte multiple Confronti tra l utilizzo dell altezza del
Estrazione di acido salicilico con acetato di n-butile
 S.A.G.T. Anno Accademico 2009/2010 Laboratorio Ambientale II A Dottoressa Valentina Gianotti Marco Soda Matricola num. 10015062 Estrazione di acido salicilico con acetato di n-butile L estrazione liquido-liquido
S.A.G.T. Anno Accademico 2009/2010 Laboratorio Ambientale II A Dottoressa Valentina Gianotti Marco Soda Matricola num. 10015062 Estrazione di acido salicilico con acetato di n-butile L estrazione liquido-liquido
