Struttura fine dei livelli dell idrogeno
|
|
|
- Alessandro Giordano
- 7 anni fa
- Visualizzazioni
Transcript
1 Struttura fine dei livelli dell idrogeno. Introduzione Consideriamo un atomo idrogenoide di massa m N e carica atomica Z. Dall equazione di Schrödinger si ottengono per gli stati legati i seguenti autovalori dell energia: (.) E n = mz e 4 h n (Zα) = mc n, dove m = m e m N /(m e + m N ) è la massa ridotta del sistema (m e è la massa dell elettrone) e α = e / hc /37 è la costante della struttura fine. Nel limite non relativistico e tenendo conto dello spin, i livelli della (.) sono degeneri n volte. Nello spettro osservato, invece, questa degenerazione è in parte rimossa e ciascun livello E n si presenta come un multipletto di livelli vicini, con una struttura piuttosto complessa, che può essere spiegata tenendo conto di vari effetti. La correzione più importante ai livelli (.) è dell ordine E mc (Zα) 4 = Z 4 ev e corrisponde alla cosiddetta struttura fine. Questa è dovuta alla combinazione di due effetti relativistici. Il primo è puramente cinematico e viene dal fatto che la velocità dell elettrone non è trascurabile rispetto alla velocità della luce. Infatti nel modello di Bohr il rapporto v/c risulta v/c = Zα/n, cioè dell ordine dell %. Questo porta per l energia cinetica una correzione relativa dell ordine di (v/c) = (Zα/n), che corrisponde al valore assoluto detto prima. Il secondo effetto è dovuto all interazione spin-orbita e risulta, come vedremo, dello stesso ordine di grandezza. Il modo più corretto per tener conto di tutti gli effetti relativistici sarebbe quello di partire, anziché dall equazione di Schrödinger, dall equazione relativistica di Dirac. Ma poiché noi ci vogliamo limitare a calcolare le correzioni dell energia all ordine più basso, cioè (Zα) 4, sarà sufficiente prendere i termini correttivi della hamiltoniana all ordine più basso in v/c e calcolare poi le correzioni con la teoria delle perturbazioni al primo ordine. Scriviamo allora la hamiltoniana nella forma (.) H = H 0 + H cin + H so, dove (.3) H 0 = T 0 + V = p m Ze r è la hamiltoniana non relativistica di Schrödinger, H cin è la correzione relativistica all energia cinetica e H so è il termine di interazione spin-orbita. Cerchiamo quindi le espressioni di H cin e H so con cui potremo calcolare gli spostamenti dei livelli.
2 . Correzione dell energia cinetica Partendo dalla formula relativistica dell energia cinetica (.) T = ( ) c p + m c 4 mc = mc + p m c e sviluppando la radice quadrata in serie di potenze di p /m c = v /c si ottiene (.) T = p m (p ) 8m 3 c +... La prima correzione relativistica all energia cinetica risulta quindi (.3) H cin = (p ) 8m 3 c = T 0 mc. Per il calcolo perturbativo osserviamo che H cin è invariante per rotazioni e indipendente dallo spin, quindi commuta con tutti gli operatori del momento angolare ed è diagonale in qualunque base del momento angolare. Prendendo allora come base gli stati n l m l m s, si ha (.4) ( E n ) cin = mc T 0 mc n l m l m s T 0 n l m l m s. Per fare il calcolo conviene esprimere T 0 per mezzo di V nel modo seguente: (.5) T 0 = (H 0 V ) = H 0 + V H 0 V V H 0 = E n + V E n V. Il valore di aspettazione di V si può ottenere dal teorema del viriale, che ci dà In meccanica quantistica (non relativistica) esiste un teorema del viriale analogo a quello classico, che permette di esprimere i valori di aspettazione dell energia cinetica T = p /m e dell energia potenziale V = V (x) per mezzo dell energia totale E, nel caso che V (x) sia una funzione omogenea di x. Infatti se V (x) è omogenea di grado n, cioè tale che V (λx) = λ n V (x), valgono le relazioni i h [x p, T ] = i hm i h [x p, V (x)] = i [x i, p ] p i = m p = T i x i V (x) x i = nv (x) dove nella seconda equazione si è utilizzato il teorema di Eulero per le funzioni omogenee. Sommiamo membro a membro e prendiamo i valori di aspettazione in uno stato di energia E. Dalla relazione E [x p, H] E = 0 si ottiene Da quest equazione e dalla ovvia relazione T n V = 0 si ottengono infine le espressioni H = T + V = E V = n + E; T = n n + E. Per il potenziale coulombiano si ha n =, da cui segue la (.6).
3 (.6) V = E n. La (.5) diventa allora (.7) T 0 = V 3E n. Per calcolare V usiamo la formula (.8) r = m c h (Zα) n 3 (l + ), che si può ricavare dal teorema di Feynman-Helmann. Si ottiene quindi (.9) V = Z e 4 r = (mc ) (Zα) 4 n 3 (l + ) Dalle precedenti equazioni si ottiene infine la seguente espressione per la correzione dell energia cinetica : (.0) ( E n ) cin = [ (mc ) (Zα) 4 ( mc (Zα) ) ] mc n 3 3 (l + ) n = mc (Zα) 4 ( n 3 l + 3 ) 4n Sia data una hamiltoniana H(λ) funzione del parametro reale λ e siano E n (λ) e u n (λ) rispettivamente gli autovalori e gli autovettori. Il teorema di Feynman-Helmann afferma che vale la relazione u n (λ) dh(λ) dλ u n(λ) = de n(λ). dλ Il teorema si dimostra facilmente derivando rispetto a λ l equazione u n (λ) H(λ) u n (λ) = E n (λ) e utilizzando l equazione agli autovalori e il fatto che gli autovettori sono normalizzati. Come applicazione, consideriamo l hamiltoniana dell atomo di idrogeno in cui viene variato il potenziale centrifugo: H(λ) = p r m + λ L mr Ze r Per calcolare E n (λ), osserviamo che nell equazione di Schrödinger radiale dobbiamo sostituire nel potenziale centrifugo l(l + ) con λ l(l + ) = l (l + ). Gli autovalori sono dati dalla (.), dove n = n r + l + e il numero quantico radiale n r rimane costante. Il teorema di Feynman-Helmann ci dà allora h l(l + ) m da cui si ricava la (.8). r = mc (Zα) [ ] d dλ (n r + l + ) = mc (Zα) l(l + ) λ= n 3 l + 3
4 3. Interazione spin-orbita L interazione detta di spin-orbita proviene da due fenomeni distinti, che cercheremo di illustrare basandoci sul modello di Bohr. Il primo fenomeno è l interazione del momento magnetico dell elettrone col campo magnetico visto dall elettrone stesso. Infatti mentre nel sistema relativo che si usa per trovare i livelli E n il nucleo è fisso nell origine e un osservatore vede solo il campo elettrico del nucleo (3.) E = Ze r un osservatore solidale con l elettrone, che si muove rispetto al primo con velocità v, vedrebbe anche un campo magnetico B, che al primo ordine in v/c risulta x r, (3.) B = c v E = Ze c x v = Zµ B l, dove l è il momento angolare orbitale in unità h e µ B = e h/mc è il magnetone di Bohr. Pertanto l elettrone è soggetto all energia di interazione (3.3) H = µ B, dove µ = gµ B s è il momento magnetico dell elettrone, in cui g è il fattore giromagnetico. Dalle (3.3) e (3.) si ottiene (3.4) H = gzµ B Al primo ordine in v/c questa coincide con l energia d interazione nel sistema relativo. Il secondo fenomeno è noto come la precessione di Thomas ed è dovuto a una proprietà dello spazio-tempo relativistico, che riguarda la trasformazione di Lorentz 3 dal sistema di riferimento dell elettrone a quello del protone. Si verifica in particolare che l orientazione dello spin dell elettrone, che in assenza d interazioni rimane fissa nel riferimento dell elettrone, nel sistema del protone esegue un moto di precessione con una velocità angolare ω T, che all ordine più basso in v/c è data da (3.5) ω T = v a c,. dove a è l accelerazione. Dall equazione del moto classica e dalla (3.) si ha (3.6) a = ee m = Ze m e dalla (3.5) si ottiene allora x 3 Il fenomeno della precessione discende dalla proprietà delle trasformazioni di Lorentz per cui il prodotto di due boosts con velocità v e v non parallele è uguale al prodotto del boost con la velocità risultante dalla composizione di v e v per una rotazione pura. Se allora si trasforma la direzione della polarizzazione dell elettrone dal sistema dell elettrone a quello del protone a due tempi infinitamente vicini t e t + dt, si osserva che, mentre nel sistema dell elettrone la polarizzazione rimane invariata, nel sistema del protone essa ha compiuto una rotazione infinitesima che risulta ω T dt. 4
5 (3.7) ω T = Ze x v mc = Ze mc µ B In analogia col caso della precessione di Larmor, a questo moto di precessione corrisponde l energia d interazione 4 (3.8) H = h s ω T = Zµ B che ha la stessa forma della (3.4). Sommando i due contributi si ha (3.9) H so = H + H = (g + )Zµ B e ponendo g = si ottiene infine per l interazione spin-orbita la seguente espressione: (3.0) H so = Zµ B Per fare il calcolo perturbativo conviene usare la base degli stati n l j m j, poiché in questa base l operatore è diagonale. Si ha infatti (3.) = j l s, dove j = l + s è il momento angolare totale in unità h, da cui segue (3.) n l j m j = [ j(j + ) l(l + ) 3 4 (3.3) Utilizzando poi la relazione 5 = 0 l ] n l j mj. R nl(r) dr r = ( Z a 0 ) 3 n 3 l(l + )(l + ) si ottiene infine la seguente espressione per la correzione dell energia dovuta all interazione spinorbita: (3.4) ( E n ) so = Zµ B = mc (Zα) 4 j(j + ) l(l + ) 3 4 n 3. l(l + )(l + ) Osserviamo che l ultima espressione risulta indeterminata per l = 0, j =, poiché in questo caso si annullano tanto il numeratore che il denominatore della frazione. Questa ambiguità scompare quando si considera la correzione complessiva E n. 4 Ricordiamo che nella precessione di Larmor l energia d interazione è data dalla (3.3), ovvero H = gµ B s B e la velocità angolare della precessione risulta ω L = (gµ B / h)b. Utilizzando questa relazione, l interazione si può scrivere H = hs ω L. 5 Dall equazione di Schrödinger radiale si ricava la seguente relazione di ricorrenza per gli elementi di matrice I k = nl (Zr/a 0 ) k nl : [ ] k l(l + ) k I k (k + )I k + k + 4 n I k = 0. Ponendo k = e utilizzando per I la formula (.8), si ricava la (3.3). 5
6 4. Struttura fine dei livelli La correzione del livello n all ordine (Zα) 4 si ottiene sommando i contributi (.0) e (3.4) e si ha quindi il seguente risultato: (4.) E n = mc (Zα) 4 n 3 [ l + j(j + ) l(l + ) 3 4 l(l + )(l + ) 3 ]. 4n La somma dei primi due termini nella parentesi quadra si riduce a una forma molto semplice. Infatti per un dato l e per j = l ± si ha (4.) l + j(j + ) l(l + ) 3 4 l(l + )(l + ) = [ (l ± )(l ± + ) l(l + ) 3 ] 4 l + l(l + ) = [ ±l ± ] = [ l + l(l + ) l + ] l + ± = l ± + = j +. Per la struttura fine del livello n si ottiene quindi la seguente formula: ( (4.3) E n = nj = mc (Zα) 4 n 3 j + 3 ). 4n Questa coincide con il termine di ordine (Zα) 4 che si ottiene sviluppando la soluzione esatta 6 dell equazione di Dirac in serie di potenze di (Zα). Dalla (4.3) si vede che gli spostamenti del livello E n dipendono soltanto dai numeri quantici n e j e non da l. Questo fatto ha due conseguenze importanti: () che il livello E n si separa in un multipletto di livelli che dipendono solo da j, e () che questi livelli sono degeneri rispetto a l ed a m j. Esaminiamo più in dettaglio le proprietà dello spettro. Fissato n, j prende tutti i valori seminteri da fino a n, in totale n valori distinti. Pertanto il livello E n della (.) si separa in un multipletto di n livelli, ciascuno corrispondente a un valore di j. Dalla (4.3) si vede poi che gli spostamenti nj sono tutti negativi e le energie crescono al crescere di j. La distanza fra i livelli va invece a diminuire. Come si è detto, i livelli sono degeneri rispetto a l e a m j. Per un dato j, l può assumere i due valori j e j +, salvo che per j = n, dove l unico valore possibile è l = j = n. La degenerazione rispetto a m j è ovviamente sempre uguale a j +. In definitiva i livelli del multipletto sono degeneri (j + ) volte, eccetto il più alto, con j = n, che è degenere j + 6 Gli autovalori dell energia dell equazione di Dirac per gli stati legati di un atomo idrogenoide dipendono da n e da j e sono dati dalla formula { [ ( ) ] } Zα E nj = mc +, dove δ j = (j + n δ (j ) + ) (Zα). j Sviluppando in serie di potenze di (Zα) si trova: E nj = E n + nj + termini di ordine mc (Zα) 6. 6
7 volte. Si verifica facilmente che il numero complessivo di stati con un dato n è n, come deve essere. Per concludere, calcoliamo a titolo di esempio i seguenti valori numerici: - lo spostamento dell energia dello stato fondamentale dell idrogeno risulta = 8 mc α 4 = ev; - la separazione fra i livelli del doppietto con n = risulta 3 = 3 mc α 4 = ev. 7
Metodo variazionale e applicazione all atomo di elio
 Metodo variazionale e applicazione all atomo di elio Descrizione del metodo Il metodo detto variazionale è un metodo approssimato che si usa per ottenere una stima dell energia dello stato fondamentale
Metodo variazionale e applicazione all atomo di elio Descrizione del metodo Il metodo detto variazionale è un metodo approssimato che si usa per ottenere una stima dell energia dello stato fondamentale
Effetto Zeeman. p q c A) 2. i h ψ t. = Hψ (2)
 Effetto Zeeman Effetto Zeeman normale La hamiltoniana di una particella in presenza di un campo elettromagnetico, descritto dal potenziale vettore A e dal potenziale scalare Φ é H = 2M e l euazione di
Effetto Zeeman Effetto Zeeman normale La hamiltoniana di una particella in presenza di un campo elettromagnetico, descritto dal potenziale vettore A e dal potenziale scalare Φ é H = 2M e l euazione di
L atomo di idrogeno (1) H T = p2 1 2m 1. + p2 2 2m 2. + V ( r 1 r 2 ) (2) Definiamo le nuove variabili: 1. La massa totale M M = m 1 + m 2 (3)
 L atomo di idrogeno Il problema dell atomo di idrogeno é un problema esattamente risolubili ed i suoi risultati possono essere estesi agli atomi idrogenoidi, in cui solo c é solo un elettrone sottoposto
L atomo di idrogeno Il problema dell atomo di idrogeno é un problema esattamente risolubili ed i suoi risultati possono essere estesi agli atomi idrogenoidi, in cui solo c é solo un elettrone sottoposto
Misura del momento magnetico dell elettrone
 FACOLTÀ Università degli Studi di Roma Tre DI SCIENZE MATEMATICHE, FISICHE E NATURALI Corso di Laurea in Fisica Misura del momento magnetico dell elettrone Candidato: Andrea Sciandra Matricola 4480 Relatore:
FACOLTÀ Università degli Studi di Roma Tre DI SCIENZE MATEMATICHE, FISICHE E NATURALI Corso di Laurea in Fisica Misura del momento magnetico dell elettrone Candidato: Andrea Sciandra Matricola 4480 Relatore:
La struttura elettronica degli atomi
 1 In unità atomiche: a 0 me 0,59A unità di lunghezza e H 7, ev a H=Hartree unità di energia L energia dell atomo di idrogeno nello stato fondamentale espresso in unità atomiche è: 4 0 me 1 e 1 E H 13,
1 In unità atomiche: a 0 me 0,59A unità di lunghezza e H 7, ev a H=Hartree unità di energia L energia dell atomo di idrogeno nello stato fondamentale espresso in unità atomiche è: 4 0 me 1 e 1 E H 13,
Le coordinate e l equazione di Schrödinger
 ATOMO DI IDROGENO Le coordinate e l equazione di Schrödinger Non è necessario dilungarsi sull importanza dell atomo idrogenoide come base per lo studio della struttura di tutti gli atomi. Il sistema è
ATOMO DI IDROGENO Le coordinate e l equazione di Schrödinger Non è necessario dilungarsi sull importanza dell atomo idrogenoide come base per lo studio della struttura di tutti gli atomi. Il sistema è
Funzione d onda dello stato fondamentale (trascurando l interazione elettrone-elettrone)
 -e -e +2e ATOMO DI ELIO. Considero il nucleo fisso (sistema di riferimento del centro di massa, circa coincidente col nucleo). I due elettroni vanno trattati come indistinguibili. -e -e +2e SENZA il termine
-e -e +2e ATOMO DI ELIO. Considero il nucleo fisso (sistema di riferimento del centro di massa, circa coincidente col nucleo). I due elettroni vanno trattati come indistinguibili. -e -e +2e SENZA il termine
Effetto Stark (1) H 0 nlm > = E n nlm > (4) Ricordiamo che. E n = me4 2 h 2 n 2 = E 1
 Effetto Stark Studiamo l equazione di Schrödinger per l atomo di idrogeno in presenza di un campo elettrico costante e diretto lungo l asse z, E = E k. La hamiltoniana di Schrödinger per l atomo di idrogeno
Effetto Stark Studiamo l equazione di Schrödinger per l atomo di idrogeno in presenza di un campo elettrico costante e diretto lungo l asse z, E = E k. La hamiltoniana di Schrödinger per l atomo di idrogeno
Metalli come gas di elettroni liberi
 Metalli come gas di elettroni liberi I metalli sono caratterizzati da elevata conducibilità elettrica e termica. La conducibilità elettrica in particolare (o il suo inverso, la resistività) è una delle
Metalli come gas di elettroni liberi I metalli sono caratterizzati da elevata conducibilità elettrica e termica. La conducibilità elettrica in particolare (o il suo inverso, la resistività) è una delle
Richiami. Esercizio 1.1. La radiazione elettromagnetica del corpo nero ha la seguente densità di energia per unità di frequenza
 Parte I Problemi Richiami Esercizio 1.1. La radiazione elettromagnetica del corpo nero ha la seguente densità di energia per unità di frequenza u ν = 8π hν c 3 ν e βhν 1, dove c è la velocità della luce
Parte I Problemi Richiami Esercizio 1.1. La radiazione elettromagnetica del corpo nero ha la seguente densità di energia per unità di frequenza u ν = 8π hν c 3 ν e βhν 1, dove c è la velocità della luce
SOMMERFELD ORBITE ELLITTICHE NEL CASO DELL IDROGENO. e l energia potenziale diventa (indichiamo con E la carica del nucleo)
 SOMMERFELD ORBITE ELLITTICHE NEL CASO DELL IDROGENO Il nostro obbiettivo è di selezionare tra tutte le orbite ellittiche meccanicamente possibili quelle possibili anche secondo la teoria quantistica. Il
SOMMERFELD ORBITE ELLITTICHE NEL CASO DELL IDROGENO Il nostro obbiettivo è di selezionare tra tutte le orbite ellittiche meccanicamente possibili quelle possibili anche secondo la teoria quantistica. Il
Dalla struttura fine delle transizioni atomiche allo spin dell elettrone
 Dalla struttura fine delle transizioni atomiche allo spin dell elettrone Evidenze sperimentali Struttura fine delle transizioni atomiche (doppietto( del sodio) Esperimento di Stern-Gerlach Effetto Zeeman
Dalla struttura fine delle transizioni atomiche allo spin dell elettrone Evidenze sperimentali Struttura fine delle transizioni atomiche (doppietto( del sodio) Esperimento di Stern-Gerlach Effetto Zeeman
ANCORA SUL MOMENTO ANGOLARE
 Capitolo 15 ANCORA SUL MOMENTO ANGOLARE 15.1 Composizione di momenti angolari Per un sistema quantico costituito da N componenti, ciascuno di momento angolare l i (i=1,n), spesso è il momento angolare
Capitolo 15 ANCORA SUL MOMENTO ANGOLARE 15.1 Composizione di momenti angolari Per un sistema quantico costituito da N componenti, ciascuno di momento angolare l i (i=1,n), spesso è il momento angolare
Soluzione ragionata dell esercizio di Fisica Atomica del 20/6/2016
 Soluzione ragionata dell esercizio di Fisica Atomica del 0/6/016 1.1 prima parte: niente campo magnetico Un atomo alcalino neutro consiste di un core di gas raro (elettroni che occupano shell completi
Soluzione ragionata dell esercizio di Fisica Atomica del 0/6/016 1.1 prima parte: niente campo magnetico Un atomo alcalino neutro consiste di un core di gas raro (elettroni che occupano shell completi
Notiamo che, per una massa che rotorivoluisca sull orbita senza scorrimento, per la componente giroscopica, con V n. v p
 Natura fisica ed espressione della forza di Lorentz, calcolo del campo magnetico nucleare Abbiamo visto che, se applichiamo il principio di conservazione del momento angolare nello spazio, se la massa
Natura fisica ed espressione della forza di Lorentz, calcolo del campo magnetico nucleare Abbiamo visto che, se applichiamo il principio di conservazione del momento angolare nello spazio, se la massa
LA STRUTTURA ELETTRONICA DEGLI ATOMI
 LA STRUTTURA ELETTRONICA DEGLI ATOMI 127 Possiamo trattare insieme l atomo di idrogeno e gli atomi idrogenoidi He +, Li 2+, ecc., in quanto differiscono l uno dall altro solo per la carica nucleare. Protone
LA STRUTTURA ELETTRONICA DEGLI ATOMI 127 Possiamo trattare insieme l atomo di idrogeno e gli atomi idrogenoidi He +, Li 2+, ecc., in quanto differiscono l uno dall altro solo per la carica nucleare. Protone
Lo spin dell elettrone
 Lo spin dell elettrone Abbiamo visto che un elettrone che ruota intorno al nucleo possiede un momento angolare orbitale, con il quale è associato anche un momento magnetico. Ci sono evidenze sperimentali
Lo spin dell elettrone Abbiamo visto che un elettrone che ruota intorno al nucleo possiede un momento angolare orbitale, con il quale è associato anche un momento magnetico. Ci sono evidenze sperimentali
Comune ordine di riempimento degli orbitali di un atomo
 Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
Complementi di Fisica 1: Riassunto delle puntate precedenti
 Complementi di Fisica 1: Riassunto delle puntate precedenti Principi di Meccanica Quantistica L equazione di Schroedinger applicata allo studio dell Atomo di H Complementi di Fisica 1: LA LEZIONE DI OGGI
Complementi di Fisica 1: Riassunto delle puntate precedenti Principi di Meccanica Quantistica L equazione di Schroedinger applicata allo studio dell Atomo di H Complementi di Fisica 1: LA LEZIONE DI OGGI
Interazione spin-orbita
 Interazione spin-orbita Interazione spin-orbita Se teniamo conto anche dell interazione elettrostatica residua in alcuni casi non otteniamo comunque risultati in accordo con i dati sperimentali, e dunque
Interazione spin-orbita Interazione spin-orbita Se teniamo conto anche dell interazione elettrostatica residua in alcuni casi non otteniamo comunque risultati in accordo con i dati sperimentali, e dunque
Lezioni di Meccanica Quantistica
 Luigi E. Picasso Lezioni di Meccanica Quantistica seconda edizione Edizioni ETS www.edizioniets.com Copyright 2015 EDIZIONI ETS Piazza Carrara, 16-19, I-56126 Pisa info@edizioniets.com www.edizioniets.com
Luigi E. Picasso Lezioni di Meccanica Quantistica seconda edizione Edizioni ETS www.edizioniets.com Copyright 2015 EDIZIONI ETS Piazza Carrara, 16-19, I-56126 Pisa info@edizioniets.com www.edizioniets.com
Compito Scritto Meccanica Quantistica, 30/01/2018
 Compito Scritto Meccanica Quantistica, 30/01/2018 Esercizio 1. Si considerino due particelle indistinguibili, A e B, di spin 1/2, soggette alla Hamiltoniana H = H 0 (p A, r A )+H 0 (p B, r B )+ h L zs
Compito Scritto Meccanica Quantistica, 30/01/2018 Esercizio 1. Si considerino due particelle indistinguibili, A e B, di spin 1/2, soggette alla Hamiltoniana H = H 0 (p A, r A )+H 0 (p B, r B )+ h L zs
Simmetrie della hamiltoniana e degenerazione
 Simmetrie della hamiltoniana e degenerazione. Simmetrie e gruppi di trasformazioni In meccanica quantistica hanno grande importanza le simmetrie della hamiltoniana, dove per simmetria si intende l invarianza
Simmetrie della hamiltoniana e degenerazione. Simmetrie e gruppi di trasformazioni In meccanica quantistica hanno grande importanza le simmetrie della hamiltoniana, dove per simmetria si intende l invarianza
Struttura Elettronica degli Atomi Meccanica quantistica
 Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
Lezione n. 19. L equazione. di Schrodinger L atomo. di idrogeno Orbitali atomici. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
L P + 2 S P A B P. + 2 S z. B L z. + S z. B J z. Effetto Zeeman anomalo. Introduzione
 Effetto Zeeman anomalo Introduzione Abbiamo visto come l interazione spin-orbita rimuova solo parzialmente la degenerazione rispetto al momento angolare totale P J che rimaneva anche dopo aver tenuto conto
Effetto Zeeman anomalo Introduzione Abbiamo visto come l interazione spin-orbita rimuova solo parzialmente la degenerazione rispetto al momento angolare totale P J che rimaneva anche dopo aver tenuto conto
Oscillatore armonico in più dimensioni
 Oscillatore armonico in più dimensioni 1 Oscillatore in D dimensioni La teoria dell oscillatore armonico si può generalizzare facilmente da una a più dimensioni. Infatti la hamiltoniana di un oscillatore
Oscillatore armonico in più dimensioni 1 Oscillatore in D dimensioni La teoria dell oscillatore armonico si può generalizzare facilmente da una a più dimensioni. Infatti la hamiltoniana di un oscillatore
Prova Scritta del 9/07/2013
 Prova Scritta del 9/07/2013 Esame di Struttura della Materia e di Fondamenti di Fisica Atomica e Molecolare Prof. A. Sgarlata Prof. M. Fanfoni Esercizio n.1 Consideriamo un atomo di Li il cui elettrone
Prova Scritta del 9/07/2013 Esame di Struttura della Materia e di Fondamenti di Fisica Atomica e Molecolare Prof. A. Sgarlata Prof. M. Fanfoni Esercizio n.1 Consideriamo un atomo di Li il cui elettrone
La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno:
 La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno: Vedi documento Atomo di Bohr.pdf sul materiale didattico per la derivazione di queste equazioni Livelli Energetici dell Atomo di Idrogeno
La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno: Vedi documento Atomo di Bohr.pdf sul materiale didattico per la derivazione di queste equazioni Livelli Energetici dell Atomo di Idrogeno
Programma della I parte
 Programma della I parte Cenni alla meccanica quantistica: il modello dell atomo Dall atomo ai cristalli: statistica di Fermi-Dirac il modello a bande di energia popolazione delle bande livello di Fermi
Programma della I parte Cenni alla meccanica quantistica: il modello dell atomo Dall atomo ai cristalli: statistica di Fermi-Dirac il modello a bande di energia popolazione delle bande livello di Fermi
p e c = ev Å
 Corso di Introduzione alla Fisica Quantistica (f) Soluzioni Esercizi: Giugno 006 * Quale la lunghezza d onda di de Broglie di un elettrone che ha energia cinetica E 1 = KeV e massa a riposo m 0 = 9.11
Corso di Introduzione alla Fisica Quantistica (f) Soluzioni Esercizi: Giugno 006 * Quale la lunghezza d onda di de Broglie di un elettrone che ha energia cinetica E 1 = KeV e massa a riposo m 0 = 9.11
x 2 + (x+4) 2 = 20 Alle equazioni di secondo grado si possono applicare i PRINCIPI di EQUIVALENZA utilizzati per le EQUAZIONI di PRIMO GRADO.
 EQUAZIONI DI SECONDO GRADO Un'equazione del tipo x 2 + (x+4) 2 = 20 è un'equazione DI SECONDO GRADO IN UNA INCOGNITA. Alle equazioni di secondo grado si possono applicare i PRINCIPI di EQUIVALENZA utilizzati
EQUAZIONI DI SECONDO GRADO Un'equazione del tipo x 2 + (x+4) 2 = 20 è un'equazione DI SECONDO GRADO IN UNA INCOGNITA. Alle equazioni di secondo grado si possono applicare i PRINCIPI di EQUIVALENZA utilizzati
Microfisica Quantistica Esonero n Aprile 2011
 Microfisica Quantistica Esonero n. 1 9 Aprile 11 Soluzioni. Esercizio 1: Tenendo conto delle correzioni relativistiche e dell interazione spin-orbita, i livelli energetici di un atomo idrogenoide sono
Microfisica Quantistica Esonero n. 1 9 Aprile 11 Soluzioni. Esercizio 1: Tenendo conto delle correzioni relativistiche e dell interazione spin-orbita, i livelli energetici di un atomo idrogenoide sono
RETI LINEARI R 3 I 3 R 2 I 4
 RETI LINERI 1 Leggi di Kirchoff. Metodo delle correnti di maglia R 1 R 3 I 1 I 3 E 1 J 1 J 2 J 3 I 2 I 4 R 4 I 5 R 5 I 6 R 6 J 4 R 7 Il calcolo delle correnti e delle differenze di potenziale in un circuito
RETI LINERI 1 Leggi di Kirchoff. Metodo delle correnti di maglia R 1 R 3 I 1 I 3 E 1 J 1 J 2 J 3 I 2 I 4 R 4 I 5 R 5 I 6 R 6 J 4 R 7 Il calcolo delle correnti e delle differenze di potenziale in un circuito
Momento angolare: deuterio
 Esercizi 5 Momento angolare: deuterio 5. Il deuterio: stati possibili e osservabili Premessa: Una particella ha un momento magnetico µ se il suo accoppiamento con il campo magnetico è µ B. Il momento magnetico
Esercizi 5 Momento angolare: deuterio 5. Il deuterio: stati possibili e osservabili Premessa: Una particella ha un momento magnetico µ se il suo accoppiamento con il campo magnetico è µ B. Il momento magnetico
DAC Digital Analogic Converter
 DAC Digital Analogic Converter Osserviamo lo schema elettrico riportato qui a lato, rappresenta un convertitore Digitale-Analogico a n Bit. Si osservino le resistenze che di volta in volta sono divise
DAC Digital Analogic Converter Osserviamo lo schema elettrico riportato qui a lato, rappresenta un convertitore Digitale-Analogico a n Bit. Si osservino le resistenze che di volta in volta sono divise
Metodi per la risoluzione di sistemi lineari
 Metodi per la risoluzione di sistemi lineari Sistemi di equazioni lineari. Rango di matrici Come è noto (vedi [] sez.0.8), ad ogni matrice quadrata A è associato un numero reale det(a) detto determinante
Metodi per la risoluzione di sistemi lineari Sistemi di equazioni lineari. Rango di matrici Come è noto (vedi [] sez.0.8), ad ogni matrice quadrata A è associato un numero reale det(a) detto determinante
Iniziamo, a questo punto, lo studio del nucleo atomico con la determinazione delle caratteristiche orbitali dei protoni.
 Espressione teorica delle forze nucleari e caratteristiche di moto dei nucleoni. Nell Art. 5 abbiamo visto che il nucleo atomico, per poter fornire incrementi dell energia di legame, per aggiunta di un
Espressione teorica delle forze nucleari e caratteristiche di moto dei nucleoni. Nell Art. 5 abbiamo visto che il nucleo atomico, per poter fornire incrementi dell energia di legame, per aggiunta di un
Università degli Studi di Perugia - Corso di Laurea Triennale in Fisica. Corso di. Meccanica Quantistica. Prof. Gianluca Grignani.
 Università degli Studi di Perugia - Corso di Laurea Triennale in Fisica Corso di Prof. Gianluca Grignani Problem Set 6 Problema Si consideri un oscillatore armonico isotropo bidimensionale con Hamiltoniana
Università degli Studi di Perugia - Corso di Laurea Triennale in Fisica Corso di Prof. Gianluca Grignani Problem Set 6 Problema Si consideri un oscillatore armonico isotropo bidimensionale con Hamiltoniana
CHIMICA: studio della struttura e delle trasformazioni della materia
 CHIMICA: studio della struttura e delle trasformazioni della materia!1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
CHIMICA: studio della struttura e delle trasformazioni della materia!1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
Collegamento generatori di tensione. Collegamento parallelo. Sia dato il sistema di figura 1: Fig. 1 -
 Collegamento generatori di tensione Collegamento parallelo Sia dato il sistema di figura : Fig. - vogliamo trovare il bipolo equivalente al parallelo dei tre generatori di tensione, il bipolo, cioè, che
Collegamento generatori di tensione Collegamento parallelo Sia dato il sistema di figura : Fig. - vogliamo trovare il bipolo equivalente al parallelo dei tre generatori di tensione, il bipolo, cioè, che
Dalle configurazioni ai termini
 Dalle configurazioni ai termini Introduzione Nello sviluppare i metodi di Thomas - Fermi, di Hartree e di Hartree - Fock, abbiamo sempre rappresentato gli autostati di un sistema costituito da due o più
Dalle configurazioni ai termini Introduzione Nello sviluppare i metodi di Thomas - Fermi, di Hartree e di Hartree - Fock, abbiamo sempre rappresentato gli autostati di un sistema costituito da due o più
ESERCIZI SUI SISTEMI LINEARI
 ESERCIZI SUI SISTEMI LINEARI Consideriamo ora il sistema lineare omogeneo a coefficienti costanti associato alla matrice A M n n, cioè SLO Vale il seguente = A. Teorema. Sia v R n \ } e sia λ C. Condizione
ESERCIZI SUI SISTEMI LINEARI Consideriamo ora il sistema lineare omogeneo a coefficienti costanti associato alla matrice A M n n, cioè SLO Vale il seguente = A. Teorema. Sia v R n \ } e sia λ C. Condizione
sulla massa invariante Consideriamo i due processi per la produzione di antiprotoni
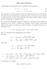 sulla massa invariante Consideriamo i due processi per la produzione di antiprotoni e + + e p + p, (1) p + p p + p + p + p. (2) Per entrambi si calcoli l energia cinetica di soglia del processo sia nel
sulla massa invariante Consideriamo i due processi per la produzione di antiprotoni e + + e p + p, (1) p + p p + p + p + p. (2) Per entrambi si calcoli l energia cinetica di soglia del processo sia nel
Esame Scritto di Meccanica Quantistica Traccia di soluzione
 Esame Scritto di Meccanica Quantistica Traccia di soluzione 7 Giugno 7. Per esprimere la hamiltoniana data H = P 4m + p m + mω X + x ) in termini di x e x si esegue il cambiamento di coordinate ) X = x
Esame Scritto di Meccanica Quantistica Traccia di soluzione 7 Giugno 7. Per esprimere la hamiltoniana data H = P 4m + p m + mω X + x ) in termini di x e x si esegue il cambiamento di coordinate ) X = x
FAM. T 1) α ν. (e α ν T 1) 2. (con l ipotesi ν > 0) si ottiene
 Serie 42: Soluzioni FAM C. Ferrari Esercizio 1 Corpo nero 1. Abbiamo: Sole λ max = 500nm - spettro visibile (giallo); Sirio B λ max = 290nm - ultravioletto; corpo umano λ max = 9300nm - infrarosso. 2.
Serie 42: Soluzioni FAM C. Ferrari Esercizio 1 Corpo nero 1. Abbiamo: Sole λ max = 500nm - spettro visibile (giallo); Sirio B λ max = 290nm - ultravioletto; corpo umano λ max = 9300nm - infrarosso. 2.
L equazione di Schrödinger
 1 Forma dell equazione L equazione di Schrödinger Postulato - ψ r, t 0 ) definisce completamente lo stato dinamico del sistema al tempo t 0. L equazione che regola l evoluzione di ψ r, t) deve essere:
1 Forma dell equazione L equazione di Schrödinger Postulato - ψ r, t 0 ) definisce completamente lo stato dinamico del sistema al tempo t 0. L equazione che regola l evoluzione di ψ r, t) deve essere:
e non ci possono chiaramente essere minori di ordine più grande per cui il rango per minori è 2. Rango per pivot: Svolgiamo la riduzione
 18 ottobre 2011 1. Per le matrici seguenti calcolare il rango per minori, il rango per pivot, il rango per righe ed il rango per colonne. Verificare che si ottiene sempre lo stesso numero. Determinare
18 ottobre 2011 1. Per le matrici seguenti calcolare il rango per minori, il rango per pivot, il rango per righe ed il rango per colonne. Verificare che si ottiene sempre lo stesso numero. Determinare
Gli accoppiamenti di spin. e i sistemi di spin nucleari
 Gli accoppiamenti di spin e i sistemi di spin nucleari l momento magnetico di un nucleo interagisce con i momenti magnetici dei nuclei vicini. sistono due tipi di interazioni: nterazione diretta, anisotropa
Gli accoppiamenti di spin e i sistemi di spin nucleari l momento magnetico di un nucleo interagisce con i momenti magnetici dei nuclei vicini. sistono due tipi di interazioni: nterazione diretta, anisotropa
Fisica Moderna: Corso di Laurea Scienze dei Materiali Prova scritta: 16/06/2017
 Fisica Moderna: Corso di aurea Scienze dei Materiali Prova scritta: 16/6/17 Problema 1 Una particella di spin 1/ è soggetta ad un campo magnetico uniforme B = B ẑ diretto lungo l asse delle z. operatore
Fisica Moderna: Corso di aurea Scienze dei Materiali Prova scritta: 16/6/17 Problema 1 Una particella di spin 1/ è soggetta ad un campo magnetico uniforme B = B ẑ diretto lungo l asse delle z. operatore
ESAME SCRITTO DI FISICA MODERNA. 22 giugno Traccia di soluzione
 ESAME SCRITTO DI FISICA MODERNA giugno 08 Traccia di soluzione ) Ponendo α = /σ ), il valore medio della posizione è + ψ ˆx ψ = dx ψ ˆx x x ψ = dx ψ x)xψx) = α + dx x e αx x 0), ) e con un semplice cambio
ESAME SCRITTO DI FISICA MODERNA giugno 08 Traccia di soluzione ) Ponendo α = /σ ), il valore medio della posizione è + ψ ˆx ψ = dx ψ ˆx x x ψ = dx ψ x)xψx) = α + dx x e αx x 0), ) e con un semplice cambio
n(z) = n(0) e m gz/k B T ; (1)
 Corso di Introduzione alla Fisica Quantistica (f) Prova scritta 4 Luglio 008 - (tre ore a disposizione) [sufficienza con punti 8 circa di cui almeno 4 dagli esercizi nn. 3 e/o 4] [i bonus possono essere
Corso di Introduzione alla Fisica Quantistica (f) Prova scritta 4 Luglio 008 - (tre ore a disposizione) [sufficienza con punti 8 circa di cui almeno 4 dagli esercizi nn. 3 e/o 4] [i bonus possono essere
MECCANICA QUANTISTICA. Corso di laurea in fisica PROGRAMMA DEL CORSO E PROGRAMMA D ESAME. Anno accademico 2011/2012
 MECCANICA QUANTISTICA Corso di laurea in fisica PROGRAMMA DEL CORSO E PROGRAMMA D ESAME Anno accademico 2011/2012 Argomenti facenti parte del programma d esame. Argomenti facenti parte del programma d
MECCANICA QUANTISTICA Corso di laurea in fisica PROGRAMMA DEL CORSO E PROGRAMMA D ESAME Anno accademico 2011/2012 Argomenti facenti parte del programma d esame. Argomenti facenti parte del programma d
Problemi di Meccanica Quantistica. Capitolo IX. Spin. a cura di Fedele Lizzi, Gennaro Miele e Francesco Nicodemi
 Problemi di Meccanica Quantistica Capitolo IX Spin a cura di Fedele Lizzi, Gennaro Miele e Francesco Nicodemi http://people.na.infn.it/%7epq-qp Problema IX.1 Un sistema consiste di due particelle distinguibili
Problemi di Meccanica Quantistica Capitolo IX Spin a cura di Fedele Lizzi, Gennaro Miele e Francesco Nicodemi http://people.na.infn.it/%7epq-qp Problema IX.1 Un sistema consiste di due particelle distinguibili
Soluzione Compito di Fisica Generale I Ing. Elettronica e delle Telecomunicazioni 12/01/2018
 Soluzione Compito di isica Generale I Ing. Elettronica e delle Telecomunicazioni 12/01/2018 Esercizio 1 1) Scriviamo le equazioni del moto della sfera sul piano inclinato. Le forze agenti sono il peso
Soluzione Compito di isica Generale I Ing. Elettronica e delle Telecomunicazioni 12/01/2018 Esercizio 1 1) Scriviamo le equazioni del moto della sfera sul piano inclinato. Le forze agenti sono il peso
Corso di Matematica II Anno Accademico Esercizi di Algebra Lineare. Calcolo di autovalori ed autovettori
 Esercizio 1 Corso di Matematica II Anno Accademico 29 21. Esercizi di Algebra Lineare. Calcolo di autovalori ed autovettori May 7, 21 Commenti e correzioni sono benvenuti. Mi scuso se ci fosse qualche
Esercizio 1 Corso di Matematica II Anno Accademico 29 21. Esercizi di Algebra Lineare. Calcolo di autovalori ed autovettori May 7, 21 Commenti e correzioni sono benvenuti. Mi scuso se ci fosse qualche
Particella in un campo elettromagnetico
 Particella in un campo elettromagnetico Vogliamo descrivere dal punto di vista quantistico una particella carica posta in un campo elettromagnetico. Momento di una particella Dal punto di vista classico
Particella in un campo elettromagnetico Vogliamo descrivere dal punto di vista quantistico una particella carica posta in un campo elettromagnetico. Momento di una particella Dal punto di vista classico
Esercitazioni di Meccanica Quantistica I
 Esercitazioni di Meccanica Quantistica I Sistema a due stati Consideriamo come esempio di sistema a due stati l ammoniaca. La struttura del composto è tetraedrico : alla sommità di una piramide con base
Esercitazioni di Meccanica Quantistica I Sistema a due stati Consideriamo come esempio di sistema a due stati l ammoniaca. La struttura del composto è tetraedrico : alla sommità di una piramide con base
ESERCIZI IN PIÙ I NUMERI COMPLESSI
 ESERCIZI IN PIÙ I NUMERI COMPLESSI L equazione x x 0 non ha soluzioni nell insieme dei numeri reali; infatti, applicando la formula ridotta, si ottiene x, 3. Interpretando come numero immaginario, cioè
ESERCIZI IN PIÙ I NUMERI COMPLESSI L equazione x x 0 non ha soluzioni nell insieme dei numeri reali; infatti, applicando la formula ridotta, si ottiene x, 3. Interpretando come numero immaginario, cioè
4 0 = 4 2 = 4 4 = 4 6 = 0.
 Elementi di Algebra e Logica 2008. Esercizi 4. Gruppi, anelli e campi. 1. Determinare la tabella additiva e la tabella moltiplicativa di Z 6. (a) Verificare dalla tabella moltiplicativa di Z 6 che esistono
Elementi di Algebra e Logica 2008. Esercizi 4. Gruppi, anelli e campi. 1. Determinare la tabella additiva e la tabella moltiplicativa di Z 6. (a) Verificare dalla tabella moltiplicativa di Z 6 che esistono
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
Comunicazioni Docente - Studenti
 Comunicazioni Docente - Studenti 1. Lista di distribuzione: francesco.musiani.chimgenbiotech 2. Scrivere (moderatamente) a: francesco.musiani@unibo.it 3. Avvisi sul sito del docente: https://www.unibo.it/sitoweb/francesco.musiani
Comunicazioni Docente - Studenti 1. Lista di distribuzione: francesco.musiani.chimgenbiotech 2. Scrivere (moderatamente) a: francesco.musiani@unibo.it 3. Avvisi sul sito del docente: https://www.unibo.it/sitoweb/francesco.musiani
QUANTITA DI MOTO Corso di Fisica per Farmacia, Facoltà di Farmacia, Università G. D Annunzio, Cosimo Del Gratta 2006
 QUANTITA DI MOTO DEFINIZIONE(1) m v Si chiama quantità di moto di un punto materiale il prodotto della sua massa per la sua velocità p = m v La quantità di moto è una grandezza vettoriale La dimensione
QUANTITA DI MOTO DEFINIZIONE(1) m v Si chiama quantità di moto di un punto materiale il prodotto della sua massa per la sua velocità p = m v La quantità di moto è una grandezza vettoriale La dimensione
Esercizi sulle affinità - aprile 2009
 Esercizi sulle affinità - aprile 009 Ingegneria meccanica 008/009 Esercizio Sono assegnate nel piano le sei rette r : =, s : =, t : =, r : =, s : =, t : = determinare l affinità che trasforma ordinatamente
Esercizi sulle affinità - aprile 009 Ingegneria meccanica 008/009 Esercizio Sono assegnate nel piano le sei rette r : =, s : =, t : =, r : =, s : =, t : = determinare l affinità che trasforma ordinatamente
Appunti di Elettronica I Lezione 3 Risoluzione dei circuiti elettrici; serie e parallelo di bipoli
 Appunti di Elettronica I Lezione 3 Risoluzione dei circuiti elettrici; serie e parallelo di bipoli Valentino Liberali Dipartimento di Tecnologie dell Informazione Università di Milano, 2603 Crema email:
Appunti di Elettronica I Lezione 3 Risoluzione dei circuiti elettrici; serie e parallelo di bipoli Valentino Liberali Dipartimento di Tecnologie dell Informazione Università di Milano, 2603 Crema email:
Modellistica dei Manipolatori Industriali 01BTT Esame del 18/02/2002 Soluzione
 Modellistica dei Manipolatori Industriali BTT Esame del 8/2/22 Soluzione Sistemi di riferimento e cinematica di posizione In Figura a) il manipolatore è stato ridisegnato per mettere in evidenza variabili
Modellistica dei Manipolatori Industriali BTT Esame del 8/2/22 Soluzione Sistemi di riferimento e cinematica di posizione In Figura a) il manipolatore è stato ridisegnato per mettere in evidenza variabili
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI I numeri quantici Le funzioni d onda Ψ n, soluzioni dell equazione d onda, sono caratterizzate da certe combinazioni di numeri quantici: n, l, m l, m s n = numero quantico principale,
GLI ORBITALI ATOMICI I numeri quantici Le funzioni d onda Ψ n, soluzioni dell equazione d onda, sono caratterizzate da certe combinazioni di numeri quantici: n, l, m l, m s n = numero quantico principale,
CORSO ZERO DI MATEMATICA
 UNIVERSITÀ DEGLI STUDI DI PALERMO FACOLTÀ DI ARCHITETTURA CORSO ZERO DI MATEMATICA EQUAZIONI E DISEQUAZIONI DI SECONDO GRADO Dr. Erasmo Modica erasmo@galois.it EQUAZIONI DI SECONDO GRADO Definizione: Dicesi
UNIVERSITÀ DEGLI STUDI DI PALERMO FACOLTÀ DI ARCHITETTURA CORSO ZERO DI MATEMATICA EQUAZIONI E DISEQUAZIONI DI SECONDO GRADO Dr. Erasmo Modica erasmo@galois.it EQUAZIONI DI SECONDO GRADO Definizione: Dicesi
ATOMI MONOELETTRONICI
 ATOMI MONOELETTRONICI L equazione di Schrödinger per gli atomi contenenti un solo elettrone (atomo di idrogeno, ioni He +, Li 2+ ) può essere risolta in maniera esatta e le soluzioni ottenute permettono
ATOMI MONOELETTRONICI L equazione di Schrödinger per gli atomi contenenti un solo elettrone (atomo di idrogeno, ioni He +, Li 2+ ) può essere risolta in maniera esatta e le soluzioni ottenute permettono
Esercitazione 6 - Soluzione
 Anno Accademico 28-29 Corso di Algebra Lineare e Calcolo Numerico per Ingegneria Meccanica Esercitazione 6 - Soluzione Immagine, nucleo. Teorema di Rouché-Capelli. Esercizio Sia L : R 3 R 3 l applicazione
Anno Accademico 28-29 Corso di Algebra Lineare e Calcolo Numerico per Ingegneria Meccanica Esercitazione 6 - Soluzione Immagine, nucleo. Teorema di Rouché-Capelli. Esercizio Sia L : R 3 R 3 l applicazione
Algebra dei vettori OPERAZIONI FRA VETTORI SOMMA DI VETTORI
 Algebra dei vettori Il vettore è un oggetto matematico che è caratterizzato da modulo, direzione e verso. Si indica graficamente con una freccia. Un vettore è individuato da una lettera minuscola con sopra
Algebra dei vettori Il vettore è un oggetto matematico che è caratterizzato da modulo, direzione e verso. Si indica graficamente con una freccia. Un vettore è individuato da una lettera minuscola con sopra
Calcolo teorico del campo magnetico terrestre, solare e nucleare con le equazioni di Maxwell generalizzate
 estratto da : L EQUILIBRIO UNIVERSALE dalla meccanica celeste alla fisica nucleare Calcolo teorico del campo magnetico terrestre, solare e nucleare con le equazioni di Maxwell generalizzate Prima di passare
estratto da : L EQUILIBRIO UNIVERSALE dalla meccanica celeste alla fisica nucleare Calcolo teorico del campo magnetico terrestre, solare e nucleare con le equazioni di Maxwell generalizzate Prima di passare
Corso di Geometria Meccanica, Elettrotecnica Esercizi 11: soluzioni
 Corso di Geometria 0- Meccanica Elettrotecnica Esercizi : soluzioni Esercizio Scrivere la matrice canonica di ciascuna delle seguenti trasformazioni lineari del piano: a) Rotazione di angolo π b) Rotazione
Corso di Geometria 0- Meccanica Elettrotecnica Esercizi : soluzioni Esercizio Scrivere la matrice canonica di ciascuna delle seguenti trasformazioni lineari del piano: a) Rotazione di angolo π b) Rotazione
E i = mgh 0 = mg2r mv2 = mg2r mrg = E f. da cui si ricava h 0 = 5 2 R
 Esercizio 1 Un corpo puntiforme di massa m scivola lungo una pista liscia di raggio R partendo da fermo da un altezza h rispetto al fondo della pista come rappresentato in figura. a) Determinare il valore
Esercizio 1 Un corpo puntiforme di massa m scivola lungo una pista liscia di raggio R partendo da fermo da un altezza h rispetto al fondo della pista come rappresentato in figura. a) Determinare il valore
Come risolvere i quesiti dell INVALSI - terzo
 Come risolvere i quesiti dell INVALSI - terzo Soluzione: Dobbiamo ricordare le precedenze. Prima le potenze, poi le parentesi tonde, quadre e graffe, seguono moltiplicazioni e divisioni nell ordine di
Come risolvere i quesiti dell INVALSI - terzo Soluzione: Dobbiamo ricordare le precedenze. Prima le potenze, poi le parentesi tonde, quadre e graffe, seguono moltiplicazioni e divisioni nell ordine di
Istituzioni di Fisica Nucleare e Subnucleare Prof. A. Andreazza. Lezione 7. Il modello a shell
 Istituzioni di Fisica Nucleare e Subnucleare Prof. A. Andreazza Lezione 7 Il modello a shell Modello a shell Le informazioni ottenute sul potenziale di interazione nucleone-nucleone vengono usate concretamente
Istituzioni di Fisica Nucleare e Subnucleare Prof. A. Andreazza Lezione 7 Il modello a shell Modello a shell Le informazioni ottenute sul potenziale di interazione nucleone-nucleone vengono usate concretamente
Appello di Meccanica Quantistica I
 Appello di Meccanica Quantistica I Facoltà di Scienze M.F.N. Università degli Studi di Pisa gennaio 007 (A.A. 06/07) Tempo a disposizione: 3 ore. Problemi e per il recupero Compitino I; problemi e 3 per
Appello di Meccanica Quantistica I Facoltà di Scienze M.F.N. Università degli Studi di Pisa gennaio 007 (A.A. 06/07) Tempo a disposizione: 3 ore. Problemi e per il recupero Compitino I; problemi e 3 per
Già con l atomo di Elio l interazione e-e non poteva essere trattata in termini perturbativi perchè molto grande.
 Atomi a multi elettroni Già con l atomo di Elio l interazione e-e non poteva essere trattata in termini perturbativi perchè molto grande. Nel caso di atomi a multi elettroni questa approssimazione è ancora
Atomi a multi elettroni Già con l atomo di Elio l interazione e-e non poteva essere trattata in termini perturbativi perchè molto grande. Nel caso di atomi a multi elettroni questa approssimazione è ancora
FM210 - Fisica Matematica I
 FM21 - Fisica Matematica I Prima Prova Scritta [26-1-212] Soluzioni Problema 1 1. Riscriviamo il sistema come e risolviamo la prima equazione: xt) = x e 3t + 2 ẋ = 3x + 2, ẏ = y + z 3, ż = 2x + z, Inserendo
FM21 - Fisica Matematica I Prima Prova Scritta [26-1-212] Soluzioni Problema 1 1. Riscriviamo il sistema come e risolviamo la prima equazione: xt) = x e 3t + 2 ẋ = 3x + 2, ẏ = y + z 3, ż = 2x + z, Inserendo
m p 6, j m 1 2 m e 3, j m 1 2 5, m 2 82, N w
 Teoria della carica elettrica e calcolo del valore teorico Questa relazione è stata ricavata senza porre alcuna ipotesi restrittiva e dunque risulta di validità universale, applicabile in ogni circostanza
Teoria della carica elettrica e calcolo del valore teorico Questa relazione è stata ricavata senza porre alcuna ipotesi restrittiva e dunque risulta di validità universale, applicabile in ogni circostanza
L atomo di idrogeno. R. Dovesi, M. De La Pierre, C. Murace. Chimica Fisica II. Corso di Laurea in Chimica A.A. 2012/2013
 L atomo di idrogeno R. Dovesi, M. De La Pierre, C. Murace Corso di Laurea in Chimica A.A. 2012/2013 Chimica Fisica II Modello per l atomo di idrogeno Modello: protone fisso nell origine ed elettrone in
L atomo di idrogeno R. Dovesi, M. De La Pierre, C. Murace Corso di Laurea in Chimica A.A. 2012/2013 Chimica Fisica II Modello per l atomo di idrogeno Modello: protone fisso nell origine ed elettrone in
PROBLEMI DI FISICA MODERNA E MECCANICA QUANTISTICA. FISICA MODERNA anno accademico
 PROBLEMI DI FISICA MODERNA E MECCANICA QUANTISTICA FISICA MODERNA anno accademico 007-008 () Sia dato un sistema che può trovarsi in tre stati esclusivi,, 3, e si supponga che esso si trovi nello stato
PROBLEMI DI FISICA MODERNA E MECCANICA QUANTISTICA FISICA MODERNA anno accademico 007-008 () Sia dato un sistema che può trovarsi in tre stati esclusivi,, 3, e si supponga che esso si trovi nello stato
Elementi di struttura della materia
 Elementi di struttura della materia Luigi Sangaletti Università Cattolica del Sacro Cuore Dipartimento di Matematica e Fisica a.a. 2004-2005 Quantizzazione delle energie Tracciare ed identificare i primi
Elementi di struttura della materia Luigi Sangaletti Università Cattolica del Sacro Cuore Dipartimento di Matematica e Fisica a.a. 2004-2005 Quantizzazione delle energie Tracciare ed identificare i primi
Generalità delle onde elettromagnetiche
 Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Esercizi sulle Disequazioni
 Esercizi sulle Disequazioni Esercizio Trovare le soluzioni delle seguenti disequazioni:.).).).) ).) ) ).).7) 8.8).) Esercizio Trovare le soluzioni delle seguenti disequazioni tratte dal secondo parziale
Esercizi sulle Disequazioni Esercizio Trovare le soluzioni delle seguenti disequazioni:.).).).) ).) ) ).).7) 8.8).) Esercizio Trovare le soluzioni delle seguenti disequazioni tratte dal secondo parziale
Prontuario degli argomenti di Algebra
 Prontuario degli argomenti di Algebra NUMERI RELATIVI Un numero relativo è un numero preceduto da un segno + o - indicante la posizione rispetto ad un punto di riferimento a cui si associa il valore 0.
Prontuario degli argomenti di Algebra NUMERI RELATIVI Un numero relativo è un numero preceduto da un segno + o - indicante la posizione rispetto ad un punto di riferimento a cui si associa il valore 0.
( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( )( ) ( )( ) ( )( )
 SOLUZIONI II ALLENAMENTO REGIONALE TEMATICO VENERDÌ 4 DICEMBRE 08 Quesito Siano due numeri interi primi tra loro tali che quanto vale? Sviluppando l espressione si ottiene quindi e e la soluzione è Quesito
SOLUZIONI II ALLENAMENTO REGIONALE TEMATICO VENERDÌ 4 DICEMBRE 08 Quesito Siano due numeri interi primi tra loro tali che quanto vale? Sviluppando l espressione si ottiene quindi e e la soluzione è Quesito
CAPITOLO 7: ESEMPI PRATICI: 7.1 Esempi di dinamica.
 CAPITOLO 7: ESEMPI PRATICI: 7.1 Esempi di dinamica. Questo capitolo vuole fornire una serie di esempi pratici dei concetti illustrati nei capitoli precedenti con qualche approfondimento. Vediamo subito
CAPITOLO 7: ESEMPI PRATICI: 7.1 Esempi di dinamica. Questo capitolo vuole fornire una serie di esempi pratici dei concetti illustrati nei capitoli precedenti con qualche approfondimento. Vediamo subito
Compito di gennaio 2001
 Compito di gennaio 001 Un asta omogenea A di massa m e lunghezza l è libera di ruotare attorno al proprio estremo mantenendosi in un piano verticale All estremità A dell asta è saldato il baricentro di
Compito di gennaio 001 Un asta omogenea A di massa m e lunghezza l è libera di ruotare attorno al proprio estremo mantenendosi in un piano verticale All estremità A dell asta è saldato il baricentro di
AUTOVALORI, AUTOVETTORI, AUTOSPAZI
 AUTOVALORI, AUTOVETTORI, AUTOSPAZI. Esercizi Esercizio. Sia f : R 3 R 3 l endomorfismo definito da f(x, y, z) = (x+y, y +z, x+z). Calcolare gli autovalori ed una base per ogni autospazio di f. Dire se
AUTOVALORI, AUTOVETTORI, AUTOSPAZI. Esercizi Esercizio. Sia f : R 3 R 3 l endomorfismo definito da f(x, y, z) = (x+y, y +z, x+z). Calcolare gli autovalori ed una base per ogni autospazio di f. Dire se
Le molecole ed il legame chimico
 La meccanica quantistica è in grado di determinare esattamente i livelli energetici dell atomo di idrogeno e con tecniche matematiche più complesse è anche in grado di descrivere l atomo di elio trovando
La meccanica quantistica è in grado di determinare esattamente i livelli energetici dell atomo di idrogeno e con tecniche matematiche più complesse è anche in grado di descrivere l atomo di elio trovando
CRISI DELLA FISICA CLASSICA e FISICA DEI QUANTI Esercitazione
 ! ISTITUTO LOMBARDO ACCADEMIA DI SCIENZE E LETTERE Ciclo formativo per Insegnanti di Scuola Superiore - anno scolastico 2017-2018 Prima lezione - Milano, 10 ottobre 2017 CRISI DELLA FISICA CLASSICA e FISICA
! ISTITUTO LOMBARDO ACCADEMIA DI SCIENZE E LETTERE Ciclo formativo per Insegnanti di Scuola Superiore - anno scolastico 2017-2018 Prima lezione - Milano, 10 ottobre 2017 CRISI DELLA FISICA CLASSICA e FISICA
CONICHE. Esercizi Esercizio 1. Nel piano con riferimento cartesiano ortogonale Oxy sia data la conica C di equazione
 CONICHE Esercizi Esercizio 1. Nel piano con riferimento cartesiano ortogonale Oy sia data la conica C di equazione 7 2 + 2 3y + 5y 2 + 32 3 = 0. Calcolare le equazioni di una rototraslazione che riduce
CONICHE Esercizi Esercizio 1. Nel piano con riferimento cartesiano ortogonale Oy sia data la conica C di equazione 7 2 + 2 3y + 5y 2 + 32 3 = 0. Calcolare le equazioni di una rototraslazione che riduce
SPAZI EUCLIDEI, APPLICAZIONI SIMMETRICHE, FORME QUADRATICHE
 SPAZI EUCLIDEI, APPLICAZIONI SIMMETRICHE, FORME QUADRATICHE. Esercizi Esercizio. In R calcolare il modulo dei vettori,, ),,, ) ed il loro angolo. Esercizio. Calcolare una base ortonormale del sottospazio
SPAZI EUCLIDEI, APPLICAZIONI SIMMETRICHE, FORME QUADRATICHE. Esercizi Esercizio. In R calcolare il modulo dei vettori,, ),,, ) ed il loro angolo. Esercizio. Calcolare una base ortonormale del sottospazio
Esercizi per Geometria II Geometria euclidea e proiettiva
 Esercizi per Geometria II Geometria euclidea e proiettiva Filippo F. Favale 10 aprile 01 Esercizio 1 Sia E 3 lo spazio euclideo tridimensionale dotato di un riferimento cartesiano ortonormale di coordinate
Esercizi per Geometria II Geometria euclidea e proiettiva Filippo F. Favale 10 aprile 01 Esercizio 1 Sia E 3 lo spazio euclideo tridimensionale dotato di un riferimento cartesiano ortonormale di coordinate
- Dati sperimentali: interazione luce / materia spettri caratteristici
 - Thomson: evidenza sperimentale per elettrone misura e/m e - Millikan: misura la carica dell elettrone e ne ricava la massa e = 1,60 x 10-19 C - Rutherford: stima le dimensioni atomiche struttura vuota
- Thomson: evidenza sperimentale per elettrone misura e/m e - Millikan: misura la carica dell elettrone e ne ricava la massa e = 1,60 x 10-19 C - Rutherford: stima le dimensioni atomiche struttura vuota
I seguenti grafici rappresentano istantanee dell onda di equazione:
 Descrizione matematica di un onda armonica La descrizione matematica di un onda è data dalla seguente formula : Y ; t) A cos( k ω t + ϕ ) () ( ove ω e k, dette rispettivamente pulsazione e numero d onda,
Descrizione matematica di un onda armonica La descrizione matematica di un onda è data dalla seguente formula : Y ; t) A cos( k ω t + ϕ ) () ( ove ω e k, dette rispettivamente pulsazione e numero d onda,
Capitolo 4: CAMBIAMENTO DI SISTEMA DI UNITÀ
 Capitolo 4: CAMBIAMENTO DI SISTEMA DI UNITÀ 4.1 Grandezze fondamentali e derivate Come abbiamo già osservato la scelta di un Sistema di unità di misura è largamente arbitraria e dettata in gran parte da
Capitolo 4: CAMBIAMENTO DI SISTEMA DI UNITÀ 4.1 Grandezze fondamentali e derivate Come abbiamo già osservato la scelta di un Sistema di unità di misura è largamente arbitraria e dettata in gran parte da
APPUNTI SULLA RELATIVITA' RISTRETTA. X = X ' V t
 APPUNTI SULLA RELATIVITA' RISTRETTA TRASFORMAZIONI DI LORENTZ X è la posizione del punto P misurata dal sistema O e X' è la posizione del punto P misurata dal sistema O'. Le equazioni di trasformazione
APPUNTI SULLA RELATIVITA' RISTRETTA TRASFORMAZIONI DI LORENTZ X è la posizione del punto P misurata dal sistema O e X' è la posizione del punto P misurata dal sistema O'. Le equazioni di trasformazione
