Le soluzioni. Fisica per Fisioterapisti
|
|
|
- Eleonora Bucci
- 7 anni fa
- Visualizzazioni
Transcript
1 Le soluzioni
2 Le soluzioni La soluzione è una miscela intima di due o più componenti Il componente più abbondante è denominato Solvente, il componente minoritario e detto Soluto Tipicamente il Solvente è liquido (acqua in molti casi) e il Soluto è solido (un sale ad esempio) Molto comuni sono le soluzioni di Liquido in Liquido (il vino è un esempio) In tutti i liquidi è spesso disciolto del gas (aria o CO 2 in genere)
3 Agitazione termica VIDEO A causa della agitazione termica le molecole sono in movimento Le molecole urtano contro le pareti del recipiente e danno origine a una pressione in eccesso (oltre alla pressione idrostatica)
4 Le soluzioni diluite Le considerazioni che seguono si applicano alle soluzioni diluite Poche molecole di soluto rispetto alle molecole di solvente
5 La concentrazione La concentrazione indica la quantità di soluto rispetto alla quantità di solvente o di soluzione. Concentrazione Molare: 1. Quantità di soluto: numero di moli 2. Quantità di soluzione: volume espresso in litri c = n V moli di soluto litri di soluzione
6 Acqua di mare In 1 litro di acqua di mare sono disciolti 27 g di Cloruro di Sodio (NaCl) più altri Sali Peso molecolare del NaCl : = 58 1 mole di NaCl = 58 g di NaCl 27 g di NaCl = 27/58 moli di NaCl = 0,47 moli Concentrazione Molare dell acqua di mare (considerando solo NaCl) : 0,47 M
7 Soluzione fisiologica salina La soluzione salina (flacone con etichetta di colore azzurro) contiene 0,15 moli di NaCl in 1 litro Concentrazione: 0,15 M 0,15 moli di NaCl = 0,15*58 g = 8,7 g La soluzione fisiologica salina si prepara sciogliendo 8,7 g di NaCl in 1 litro di acqua distillata
8 Soluzione fisiologica zuccherina La soluzione zuccherina (colore rosso) contiene 0,3 moli di C 6 H 12 O 6 in 1 litro Concentrazione: 0,3 M Massa di 0,3 moli di C 6 H 12 O 6 = 0,3*180 g = 54 g La soluzione fisiologica zuccherina si prepara sciogliendo 54 g di C 6 H 12 O 6 in 1 litro di acqua distillata
9 Fenomeni osmotici Attraverso la membrana cellulare avvengono scambi si molecole La causa principale è la diversa concentrazione di molecole tra interno ed esterno I fori della membrana cellulare non lasciano passare tutte le molecole Passano le molecole piccole (i nutrienti e i detriti) le molecole grandi (proteine) rimangono intrappolate Il fenomeno è interpretabile con le leggi della osmosi
10 Due ambienti separati da una membrana semipermeabile I fori della membrana lasciano passare le molecole piccole (il solvente) Le molecole più grandi (il soluto)rimangono intrappolate Si crea un eccesso di pressione nella parte che contiene la soluzione (solvente più soluto) VIDEO
11 L osmometro Un tubo a U con una membrana semipermeabile al centro A sinistra solvente puro A destra una soluzione diluita con concentrazione c Le molecole del solvente possono attraversare la membrana Le molecole di soluto sono trattenute nella porzione destra
12 L osmometro Dopo qualche tempo il livello dalla parte del solvente puro si abbassa Il livello dalla parte della soluzione si solleva Il solvente è passato dalla parte del solvente puro verso la parte della soluzione La soluzione si diluisce In realtà le molecole di solvente possono attraversare la membrana nei due versi Ma il passaggio da sinistra verso destra è prevalente
13 Equilibrio osmotico h L equilibrio si raggiunge dopo un tempo relativamente lungo A causa del dislivello tra i due rami dell osmometro si crea un eccesso di pressione idrostatica dalla parte della soluzione Questo eccesso di pressione ci consente di misurare la pressione osmoticaindicata con π π = ρ g h
14 Legge di Van t Hoff π = c K T n π = K T V π V = n K T ( P V = n R T ) La pressione osmotica π è proporzionale alla concentrazione c e alla temperatura assoluta T Esprimendo la concentrazione come moli su Volume si ottiene una formula molto simile alla legge dei gas Anche la costante Kha lo stesso valore della costante universale dei gas R = 8,314 J/ K
15 Interpretazione del fenomeno 1 A B Inizialmente le pressioni ai lati della membrana si equivalgono (i livelli nei due bracci dell osmometro sono uguali) La pressione è data dal numero di urti delle molecole contro le pareti della membrana Il numero di molecole che urtano contro la membrana nel lato Aè uguale a quello del lato B. Ma le molecole d acqua nel lato Asono in numero maggiore e perciò il passaggio da A a B è prevalente Il livello nel lato B tende a salire e il livello nel lato A scende Si ha un aumento di pressione nel lato B
16 Interpretazione del fenomeno 2 A B A seguito dell aumento della pressione nel lato B, aumenta il numero di molecole di solvente che urtano contro la membrana Ora le molecole d acqua che urtano sulle due facce si equivalgono I flussi d acqua nei due versi sono uguali e il flusso netto è nullo La pressione in eccesso nel lato B è dovuta alle molecole di soluto Quindi la relazione π V = n K T può essere interpretata come : il soluto si comporta come un gas di nmoli che occupa il volume V La costante K risulta uguale a R, costante universale dei gas
17 La dissociazione elettrolitica Na + Cl - Na + Cl - La molecola del NaCl (Cloruro di Sodio) è tenuta insieme dal legame ionico L atomo di Sodio cede l elettrone dell orbita esterna e diventa uno ione positivo Na + L atomo di Cloro acquista l elettrone ceduto dal Sodio e completa l orbita esterna con 8 elettroni e diventa uno ione negativo Cl - I due ioni si attirano e rimangono uniti La forza elettrostatica che tiene uniti i due ioni si riduce in acqua di un fattore circa 81 (costante dielettrica relativa) La molecola di NaCl dissocia in soluzione acquosa, la molecola di glucosio non dissocia Gli ioni Na + e Cl - si muovono in modo indipendente nella soluzione e quindi il numero di particelle raddoppia
18 La costante di dissociazione σ = σ σ c NaCl C numero di numero di 2 6 H = 12O6 1 π = σ c K T Osm = σ n V particelle molecole A causa della dissociazione elettrolitica delle molecole con legame ionico, il numero di particelle in soluzione è maggiore del numero di molecole Nel caso del NaCl la dissociazione è pressoché totale e il numero di particelle è il doppio del numero di molecole: σ = 2 Nel caso del C 6 H 12 O 6 non si ha dissociazione perché il legame tra gli atomi è omeopolare (non ionico) Se si tiene conto del numero di particelle in soluzione si parla ci concentrazione osmolare
19 La concentrazione osmolare nel plasma sanguigno Ione Na + Cl - K + HCO 3 - Totale c Osm 0,145 M 0,120 M 0,004 M 0,029 M 0,298 M La concentrazione osmolare totale nel plasma sanguigno è pari a circa 0,3 osmoli per litro Nel plasma sono presenti ioni di vario tipo con concentrazioni osmolari varie La concentrazione osmolare totale è data dalla somma delle singole concentrazioni osmolari Le particelle in soluzione sono in massima parte ioni Gli ioni più abbondanti sono Na + Cl - K + Na + è più abbondante all esterno delle cellule K + è più abbondante all interno delle cellule
20 La soluzione fisiologica n cosm = σ = σ c V cosm c = σ σ = 2 NaCl ; σ C6H12O 6 c ( plasma) = 0,3 c c Osm Osm Osm ( fis. sal.) = 1 = 0,3 c( fis. sal.) = 0,15 ( fis. zuc.) = 0,3 c( fis. zuc.) = 0,3 La soluzione fisiologica ha la stessa concentrazione osmolare del plasma sanguigno Quindi c Osm = 0,3 M Si deve tenere conto della costante di dissociazione Nel caso di soluzione zuccherina con C 6 H 12 O 6 la concentrazione molare deve essere c = 0,3 M Nel caso di soluzione salina con NaCl la concentrazione molare deve essere c = 0,15 M
21 Valori di concentrazione nella soluzione fisiologica litro g litro g zuc fis c g O H C mole zuc fis c zuc fis c litro g litro g sal fis c g NaCl mole sal fis c sal fis c plasma c Osm Osm Osm Osm ,3.). ( 180 ) ( 1 0,3.). ( 0,3.). ( 8,7 58 0,15.). ( 58 ) ( 1 0,15.). ( 0,3.). ( 0,3 ) ( = = = = = = = = = = =
22 Il rischio di iniettare soluzioni NON fisiologiche 1. Se si inietta una soluzione poco concentrata l acqua penetra all interno dei globuli rossi 2. La membrana del globulo rosso è rigida e un piccolo aumento di volume spacca la membrana 3. La emoglobina contenuta all interno del globulo rosso si riversa nella soluzione e la colora di rosso: si provoca la emolisi
23 Soluzioni isotoniche, ipotoniche e ipertoniche 1. Soluzione isotonicacon il plasma sanguigno: stessa concentrazione osmolare 2. Soluzione ipotonicarispetto al plasma sanguigno: concentrazione osmolare inferiore 3. Soluzione ipertonicarispetto al plasma sanguigno: concentrazione osmolare superiore Rischio legato alle concentrazioni ipotoniche: emolisi (l acqua penetra all interno dei globuli rossi che si spacca) Rischio legato alle concentrazioni ipertoniche: essicazione(l acqua fuoriesce dai globuli rossi che si raggrinziscono)
24 Soluzioni ipertoniche per la conservazione dei cibi Le soluzioni ipertoniche sono state sempre usate per la conservazione dei cibi Esempi tipici di soluzioni ipertoniche sono le conserve alimentari, le salamoie, le marmellate, il miele La soluzione ipertonica provoca la fuoriuscita dell acqua dall interno dei batteri presenti negli alimenti da conservare I batteri vengono essicati e uccisi o almeno bloccati nella riproduzione
25 Il lavoro osmotico V h P Il passaggio di solvente verso la soluzione comporta la esecuzione di un Lavoro Tra i due ambienti si esercita una differenza di pressione P = ρ g h che corrisponde alla pressione osmotica π Il lavoro dovuto al passaggio di una piccola quantità di volume è data da L = P * h = π * h Il lavoro complessivo è dato dalla somma di tutti i lavori parziali e può essere ricavato con il calcolo integrale L = nkt V V 1 π dv 2 V V 1 2 dv V = = V V 1 2 nkt ckt dv = dv V 2 c ln = nkt ln V1 c V V 1 2 n V KT 1 2 =
26 Effetti elettrici Na + Cl - K + Soluzione interstiziale Anioni - (proteine) 0,145 M 0,120 M 0,004 M 0,029 M Interno della cellula Na + Cl - K + Anioni - (proteine) 0,012 M 0,004 M 0,155 M 0,163 M Alcuni ioni possono attraversare la membrana cellulare, in particolare gli ioni Na + K + Cl - Altri ioni, in particolare le molecole organiche, sono troppo grossi per attraversare la membrana cellulare A causa della diversa concentrazione degli ioni si ha un passaggio dalla zona a concentrazione maggiore verso la zona con concentrazione minore
27 Effetti elettrici Na + Cl - K + Soluzione interstiziale Anioni - (proteine) 0,145 M 0,120 M 0,004 M 0,029 M Interno della cellula Na + Cl - K + Anioni - (proteine) 0,012 M 0,004 M 0,155 M 0,163 M 1. Si ha un passaggio di ioni Na + dalla soluzione interstiziale verso l interno della cellula 2. In senso inverso si ha un passaggio di ioni K + da l interno della cellula verso la soluzione interstiziale 3. Infine si ha un passaggio di ioni Cl - dalla soluzione interstiziale verso l interno della cellula La frazione di ioni che attraversa la membrana è minima ma è sufficiente a creare una differenza di potenziale
28 Differenza di potenziale tra interno ed esterno della cellula -95 mv Si può misurare la differenza di potenziale tra interno ed esterno della cellula Si ottiene un valore di 95 mv (millivolt) Questo a causa di un ingresso di ioni negativi Cl - all interno della cellula e ad una fuoriuscita di ioni positivi K + Questa differenza di potenziale è indicata come potenziale di riposo
29 Potenziale di riposoe potenziale di azione Consideriamo una cellula di forma allungata, può essere una fibra muscolare o l assone di un neurone A seguito di uno stimolo la membrana cellulare diventa più permeabile agli ioni Na + facendo affluire un eccesso di questi ioni positivi all interno della cellula Il potenziale all interno della cellula si inverte di segno e diventa positiva, assumendo un valore di circa + 40 mv Questo potenziale è detto potenziale di azione
30 Propagazione del potenziale di azione Condizione normale Zona polarizzata: potenziale di azione potenziale di riposo a) b) c) Cellula totalmente polarizzata d) Depolarizzazione Il potenziale di azione si propaga lungo la cellula La polarizzazione inizia da un punto, si propaga rapidamente e dopo pochi millisecondi la cellula ritorna in condizioni di riposo
31 Azione combinata di molte cellule polarizzate Elettrodo sulla pelle Pelle Un elettrodo sulla pelle può rivelare i segnali elettrici prodotti dalla azione combinata di molte cellule polarizzate in modo sincrono In questo modo si può rilevare la attività elettrica del cuore con l ElettroCardioGramma (ECG) o del cervello con l ElettroEncefaloGrafo (EEG)
32 Evoluzione del segnale ECG 1 1. Lo stimolo parte dal nodo seno atriale Si contraggono gli atrii 3. Il segnale arriva al nodo atrio-ventricolare 4. Lo stimolo si propaga attraverso i fasci di Hiss sino all apice dei ventricoli 5. Da qui partono le fibre di Purkinje che fanno contrarre i due ventricoli
33 Il vettore cardiaco I segnali elettrici prodotti dalle fibre cardiache che si polarizzano hanno un orientamento Convenzionalmente si fa riferimento al triangolo di Einthoven I vertici sono braccio destro, braccio sinistro, piede sinistro Il segnale più intenso si ha tra braccio destro e piede sinistro e si presenta con un aspetto caratteristico
34 La convenzione di Einthoven II I III Una prima serie di segnali elettrici, le derivazioni standard di Einthoven, sono una terna indicata convenzionalmente con i numerali romani I, II, III I è il segnale tra braccio destro e sinistro II tra braccio destro e gamba sinistra III tra braccio sinistro e gamba sinistra
35 Il segnale ECG II Il segnale più intenso e più caratteristico è il II Si osservano tre complessi 1. L onda P è generata dalla contrazione degli atrii 2. Il complesso QRS è generato dalla contrazione dei ventricoli 3. L onda T è dovuta alla ripolarizzazione delle fibre muscolari
36 Fasi cardiache e formazione ECG
37 Altri segnali ECG Gli altri segnali I e III danno ulteriori informazioni La combinazione delle derivazioni standard di Einthoven danno origine ad un altra terna: 1. avr (brsccio destro) 2. avl (braccio sinistro) 3. avf (gamba sinistra) Il cardiologo (e l infermiere esperto) sono in grado di diagnosticare patologie cardiache come l infarto e la fibrillazione atriale o ventricolare
38 I segnali avr, avl, avf I segnali avr,avl,avf sono ottenuti dalla combinazione lineare delle derivazioni standard I + II II avr = avl = I 2 2 I avf = II 2 Non sono necessari altri elettrodi per i tre segnali avx
39 La eliminazione del rumore Gamba DX Braccio SX Braccio DX 390kΩ 390kΩ OPA2604 1/2 390kΩ Braccio DX Gamba SX 390kΩ OPA2604 1/2 390kΩ 390kΩ OPA Braccio SX Gamba SX kΩ 10kΩ 10kΩ kΩ R G / 2 2.8kΩ OPA2604 1/2 2.8kΩ R G / 2 2.8kΩ OPA2604 1/2 2.8kΩ R G / 2 2.8kΩ OPA2604 1/ Vo Ref G=10 Vo Ref G=10 Vo Ref G=10 Al sistema di acquisizione I segnali ECG sono debolissimi, intorno a i mv come valore massimo Il corpo umano è una antenna che capta disturbi prodotti soprattutto dalla rete elettrica Per eliminarli si usa un circuito di eliminazione del rumore Un quarto elettrodo connesso alla gamba destra invia un segnale di cancellazione del rumore 1/2
Diffusione e osmosi. Roberto Cirio. Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico Corso di Fisica
 Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
Il potenziale di membrana a riposo
 Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti su entambe le facce della membrana; la membrana stessa;
Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti su entambe le facce della membrana; la membrana stessa;
FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA
 FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti
FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti
POTENZA METABOLICA. Fisica Applicata, Area Infermieristica, M. Ruspa
 POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
SOLUZIONI. Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto).
 SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
Proprietà delle Soluzioni
 Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
Le proprietà colligative delle soluzioni
 1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
Osmometria ed Emolisi
 Osmometria ed Emolisi 1 ADE: MISURA DELLA RESISTENZA OSMOTICA DEI GLOBULI ROSSI (2/12/08). Il globulo rosso è una piccola cellula del sangue deputata al trasporto dell'ossigeno e priva di nucleo e di organelli.
Osmometria ed Emolisi 1 ADE: MISURA DELLA RESISTENZA OSMOTICA DEI GLOBULI ROSSI (2/12/08). Il globulo rosso è una piccola cellula del sangue deputata al trasporto dell'ossigeno e priva di nucleo e di organelli.
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa
 Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
CdL Professioni Sanitarie A.A. 2012/2013. Unità 9: Gas e processi di diffusione
 L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
GLI STATI DELLA MATERIA
 GLI STATI DELLA MATERIA E LE SOLUZIONI Stati di aggregazione della materia Cambiamenti di stato La temperatura del cubetto di ghiaccio aumenta fino a raggiungere un valore detto PUNTO (O TEMPERATURA) DI
GLI STATI DELLA MATERIA E LE SOLUZIONI Stati di aggregazione della materia Cambiamenti di stato La temperatura del cubetto di ghiaccio aumenta fino a raggiungere un valore detto PUNTO (O TEMPERATURA) DI
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro.
 Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
ELETTROCARDIOGRAMMA (ECG) E la registrazione, nel tempo, dell attività elettrica del cuore.
 ELETTROCARDIOGRAMMA (ECG) E la registrazione, nel tempo, dell attività elettrica del cuore. Il succedersi di depolarizzazioni e ripolarizzazioni nelle varie parti del cuore crea una separazione tra zone
ELETTROCARDIOGRAMMA (ECG) E la registrazione, nel tempo, dell attività elettrica del cuore. Il succedersi di depolarizzazioni e ripolarizzazioni nelle varie parti del cuore crea una separazione tra zone
Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana
 Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana Le proteine diffondono nel piano della membrana per diffusione rotazionale e laterale Le membrane cellulari La componente
Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana Le proteine diffondono nel piano della membrana per diffusione rotazionale e laterale Le membrane cellulari La componente
Scaricato da
 -Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
-Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
Le proprietà colligative
 Le proprietà colligative Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Abbassamento
Le proprietà colligative Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Abbassamento
pressione esercitata dalle molecole di gas in equilibrio con Si consideri una soluzione di B in A. Per una soluzione ideale
 PROPRIETA COLLIGATIVE Proprietà che dipendono solo dal numero di particelle presenti in soluzione 1. TENSIONE DI VAPORE 2. INNALZAMENTO EBULLIOSCOPICO 3. ABBASSAMENTO CRIOSCOPICO 4. PRESSIONE OSMOTICA
PROPRIETA COLLIGATIVE Proprietà che dipendono solo dal numero di particelle presenti in soluzione 1. TENSIONE DI VAPORE 2. INNALZAMENTO EBULLIOSCOPICO 3. ABBASSAMENTO CRIOSCOPICO 4. PRESSIONE OSMOTICA
SOLUZIONI. Soluzioni gassose, liquide e solide
 LE SOLUZIONI SOLUZIONI Miscela fisicamente omogenea, cioè un insieme di due o più componenti che costituiscono un unica fase. Componente in eccesso: solvente Componente in minore quantità: soluto Soluzioni
LE SOLUZIONI SOLUZIONI Miscela fisicamente omogenea, cioè un insieme di due o più componenti che costituiscono un unica fase. Componente in eccesso: solvente Componente in minore quantità: soluto Soluzioni
Il binomio di van t Hoff Le proprietà colligative dipendono dal numero di particelle effettivamente presenti nella soluzione. Nel caso in cui il solut
 Proprietà colligative di soluzioni ideali Si definiscono proprietà colligative alcune proprietà delle soluzioni indipendenti dalla natura del soluto ma che dipendono soltanto dal numero delle particelle
Proprietà colligative di soluzioni ideali Si definiscono proprietà colligative alcune proprietà delle soluzioni indipendenti dalla natura del soluto ma che dipendono soltanto dal numero delle particelle
Trasporto di membrana
 Trasporto di membrana CdL Tecnici di Lab Biomedico AA. 2011/12 Prof.ssa Frabetti Trasporto di membrana molecole piccole molecole grosse trasporto passivo trasporto attivo (con pompe o cotrasportatori)
Trasporto di membrana CdL Tecnici di Lab Biomedico AA. 2011/12 Prof.ssa Frabetti Trasporto di membrana molecole piccole molecole grosse trasporto passivo trasporto attivo (con pompe o cotrasportatori)
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Soluzioni unità 3, modulo D del libro
 Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
ESECUZIONE e LETTURA di un ELETTROCARDIOGRAMMA
 ESECUZIONE e LETTURA di un ELETTROCARDIOGRAMMA SISTEMA MECCANICO OGNI ATTIVITA MECCANICA, ossia ogni CONTRAZIONE del CUORE è preceduta ed è determinata da una ATTIVITA ELETTRICA SISTEMA ELETTRICO Stato
ESECUZIONE e LETTURA di un ELETTROCARDIOGRAMMA SISTEMA MECCANICO OGNI ATTIVITA MECCANICA, ossia ogni CONTRAZIONE del CUORE è preceduta ed è determinata da una ATTIVITA ELETTRICA SISTEMA ELETTRICO Stato
La pompa sodio-potassio
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 La pompa sodio-potassio 14/3/2006 Efficienza del cuore Dipende dall ordinata sequenza di eccitazione e di contrazione che procede
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 La pompa sodio-potassio 14/3/2006 Efficienza del cuore Dipende dall ordinata sequenza di eccitazione e di contrazione che procede
L ELETTROCARDIOGRAMMA
 CONDUZIONE DELL IMPULSO L eccitamento del cuore ha origine nel nodo senoatriale (SA), dal quale la corrente si propaga alla muscolatura atriale, al nodo atrioventricolare (AV), al sistema di Purkinje,
CONDUZIONE DELL IMPULSO L eccitamento del cuore ha origine nel nodo senoatriale (SA), dal quale la corrente si propaga alla muscolatura atriale, al nodo atrioventricolare (AV), al sistema di Purkinje,
 positiva, endotermico (la soluzione si raffredda) negativa, esotermico (la soluzione si scalda). DH sol = E ret + E solv concentrazione Molare Esempio: Preparare mezzo litro (0,5 l) di soluzione acquosa
positiva, endotermico (la soluzione si raffredda) negativa, esotermico (la soluzione si scalda). DH sol = E ret + E solv concentrazione Molare Esempio: Preparare mezzo litro (0,5 l) di soluzione acquosa
Corso di Fisica Medica 1
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Elettrocardiogramma 27/4/2006 Cos è? L elettrocardiogramma è la registrazione grafica dell attività elettrica cardiaca Il cuore, durante
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Elettrocardiogramma 27/4/2006 Cos è? L elettrocardiogramma è la registrazione grafica dell attività elettrica cardiaca Il cuore, durante
ECG COSA SAPERE PER NON FARSI PRENDERE DAL PANICO CARDIOLOGIA SASSUOLO DOTT.SA ERMENTINA BAGNI 11 OTTOBE 2016
 ECG COSA SAPERE PER NON FARSI PRENDERE DAL PANICO CARDIOLOGIA SASSUOLO DOTT.SA ERMENTINA BAGNI 11 OTTOBE 2016 CUORE : Attività elettrica Attività meccanica L attivazione elettrica e vettori di attivazione
ECG COSA SAPERE PER NON FARSI PRENDERE DAL PANICO CARDIOLOGIA SASSUOLO DOTT.SA ERMENTINA BAGNI 11 OTTOBE 2016 CUORE : Attività elettrica Attività meccanica L attivazione elettrica e vettori di attivazione
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
Ioni fosfato e proteine (anioni) sono prevalenti nella cellula
 Equilibrio osmotico tra liquido intracellulare e liquido extracellulare (e plasma) mm Na + K + Cl - HCO 3 - grandi anioni proteine Liquido intracellulare Liquido extracellulare 10 140 140 5 5 35 10 35
Equilibrio osmotico tra liquido intracellulare e liquido extracellulare (e plasma) mm Na + K + Cl - HCO 3 - grandi anioni proteine Liquido intracellulare Liquido extracellulare 10 140 140 5 5 35 10 35
-PROPRIETA COLLIGATIVE-
 -PROPRIETA COLLIGATIVE- Le proprietà colligative sono proprietà delle soluzioni e sono funzioni del numero e non della natura delle particelle di soluto che le compongono. Abbassamento della pressione
-PROPRIETA COLLIGATIVE- Le proprietà colligative sono proprietà delle soluzioni e sono funzioni del numero e non della natura delle particelle di soluto che le compongono. Abbassamento della pressione
Il livello cellulare di organizzazione: la struttura cellulare. Cattedra di Fisiologia Umana
 Il livello cellulare di organizzazione: la struttura cellulare Cattedra di Fisiologia Umana 1. La diversità delle cellule nel corpo umano Le cellule del corpo hanno molte differenti forme ed una varietà
Il livello cellulare di organizzazione: la struttura cellulare Cattedra di Fisiologia Umana 1. La diversità delle cellule nel corpo umano Le cellule del corpo hanno molte differenti forme ed una varietà
9065X Chimica. Modello esame svolto. Esempio di compito scritto di Chimica. Politecnico di Torino CeTeM
 svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
ELETTROCARDIOGRAMMA (ECG) L elettrocardiogramma è la registrazione, nel tempo, dell attività elettrica del cuore.
 ELETTROCARDIOGRAMMA (ECG) L elettrocardiogramma è la registrazione, nel tempo, dell attività elettrica del cuore. I cambiamenti di polarità delle cellule cardiache generano un campo elettrico all esterno
ELETTROCARDIOGRAMMA (ECG) L elettrocardiogramma è la registrazione, nel tempo, dell attività elettrica del cuore. I cambiamenti di polarità delle cellule cardiache generano un campo elettrico all esterno
Lezione 11 Soluzioni. Diffusione ed osmosi.
 Lezione 11 Soluzioni. Diffusione ed osmosi. Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici
Lezione 11 Soluzioni. Diffusione ed osmosi. Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici
Il modello strutturale dell atomo
 Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Le soluzioni possono esistere in ognuno dei tre stati della materia: gas, liquido o solido.
 SOLUZIONI Una soluzione è una miscela omogenea (=la sua composizione e le sue proprietà sono uniformi in ogni parte del campione) di due o più sostanze formate da ioni o molecole. Differenza con i colloidi
SOLUZIONI Una soluzione è una miscela omogenea (=la sua composizione e le sue proprietà sono uniformi in ogni parte del campione) di due o più sostanze formate da ioni o molecole. Differenza con i colloidi
Fisiologia Renale 6. Bilancio idro-elettrolitico I. Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona
 Fisiologia Renale 6. Bilancio idro-elettrolitico I Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona Obiettivi Acqua corporea totale: volume e distribuzione Distretti intra
Fisiologia Renale 6. Bilancio idro-elettrolitico I Carlo Capelli Fisiologia Corso di Laurea in Scienze Motorie Università di Verona Obiettivi Acqua corporea totale: volume e distribuzione Distretti intra
La formula chimica di una sostanza nota la sua composizione %
 La formula chimica di una sostanza nota la sua composizione % Si consideri la sostanza costituita dagli elementi A, B e C e sia nota la sua composizione %, che si ottiene sperimentalmente 1. Si divide
La formula chimica di una sostanza nota la sua composizione % Si consideri la sostanza costituita dagli elementi A, B e C e sia nota la sua composizione %, che si ottiene sperimentalmente 1. Si divide
Le proprietà colligative delle soluzioni
 Le proprietà colligative delle soluzioni Alcune immagine sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Le proprietà colligative Alcune proprietà delle
Le proprietà colligative delle soluzioni Alcune immagine sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Le proprietà colligative Alcune proprietà delle
ESERCIZI sulle SOLUZIONI
 ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
Permeabilità Di Membrana Cellulare
 Permeabilità Di Membrana Cellulare Le membrane biologiche rappresentano una barriera per le molecole polari La membrana cellulare controlla il volume, la componente ionica e molecolare della cellula Una
Permeabilità Di Membrana Cellulare Le membrane biologiche rappresentano una barriera per le molecole polari La membrana cellulare controlla il volume, la componente ionica e molecolare della cellula Una
SOLUZIONI e DILUIZIONI
 SOLUZIONI e DILUIZIONI Introduzione In chimica viene definita soluzione un sistema in cui due o più sostanze formano un miscuglio omogeneo. Nella maggior parte dei casi una soluzione è costituita da due
SOLUZIONI e DILUIZIONI Introduzione In chimica viene definita soluzione un sistema in cui due o più sostanze formano un miscuglio omogeneo. Nella maggior parte dei casi una soluzione è costituita da due
Stimolazione artificiale del cuore
 Stimolazione artificiale del cuore Il ciclo del cuore: Impulso elettrico di stimolazione da parte di un gruppo di fibre nervose il nodo sinoatriale, Stimolatori artificiali Pacemaker impiantati chirurgicamente
Stimolazione artificiale del cuore Il ciclo del cuore: Impulso elettrico di stimolazione da parte di un gruppo di fibre nervose il nodo sinoatriale, Stimolatori artificiali Pacemaker impiantati chirurgicamente
Un elemento è una sostanza pura che non può essere divisa in sostanze più semplici. Le sue molecole sono tutte uguali.
 Elementi, composti, miscugli Un elemento è una sostanza pura che non può essere divisa in sostanze più semplici. Le sue molecole sono tutte uguali. Il composto è formato da sostanze pure scomponibili in
Elementi, composti, miscugli Un elemento è una sostanza pura che non può essere divisa in sostanze più semplici. Le sue molecole sono tutte uguali. Il composto è formato da sostanze pure scomponibili in
CORSO DI CHIMICA PER L AMBIENTE. Lezione del 12 Aprile 2016
 CORSO DI CHIMICA PER L AMBIENTE Lezione del 12 Aprile 2016 Proprietà dei Metalli Malleabilità: i metalli possono esser facilmente ridotti in lamine sottili per battitura Duttilità: i metalli possono essere
CORSO DI CHIMICA PER L AMBIENTE Lezione del 12 Aprile 2016 Proprietà dei Metalli Malleabilità: i metalli possono esser facilmente ridotti in lamine sottili per battitura Duttilità: i metalli possono essere
Elettricità cellulare
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Elettricità cellulare 30/3/2006 Sistemi biologici Essenzialmente costituiti da acqua (solvente) e da differenti soluti (molti dei
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Elettricità cellulare 30/3/2006 Sistemi biologici Essenzialmente costituiti da acqua (solvente) e da differenti soluti (molti dei
Il riducente si ossida cedendo elettroni all agente ossidante
 L ossidante si riduce acquistando elettroni dall agente riducente Il riducente si ossida cedendo elettroni all agente ossidante La conduzione dell elettricità Quando una sostanza è sottoposta ad una differenza
L ossidante si riduce acquistando elettroni dall agente riducente Il riducente si ossida cedendo elettroni all agente ossidante La conduzione dell elettricità Quando una sostanza è sottoposta ad una differenza
Per esempio, possiamo osservare il legame ionico nella molecola di cloruro di sodio. Il cloro e il sodio hanno le seguenti strutture di Lewis:
 IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
SOLUZIONI. solide (es. leghe)
 SOLUZIONI Definizione: Miscela omogenea (una sola fase) di due o più componenti Soluzioni liquide (es. bevande alcoliche) gassose (es. aria) solide (es. leghe) 1 Unità di misura della concentrazione %
SOLUZIONI Definizione: Miscela omogenea (una sola fase) di due o più componenti Soluzioni liquide (es. bevande alcoliche) gassose (es. aria) solide (es. leghe) 1 Unità di misura della concentrazione %
Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Il sistema cardiovascolare (cenni)
 Il sistema cardiovascolare (cenni) Il sistema cardiovascolare (cenni) Il movimento del sangue nei vasi è mantenuto dal cuore, la cui funzione è quella di pompare nelle arterie (ad alta pressione), dopo
Il sistema cardiovascolare (cenni) Il sistema cardiovascolare (cenni) Il movimento del sangue nei vasi è mantenuto dal cuore, la cui funzione è quella di pompare nelle arterie (ad alta pressione), dopo
LA FORMAZIONE DELLE SOLUZIONI.
 LA FORMAZIONE DELLE SOLUZIONI. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore
LA FORMAZIONE DELLE SOLUZIONI. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei Mantenere costanti volume ed osmolarità dei liquidi corporei è essenziale per l omeostasi. Questo è possibile solo se assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei Mantenere costanti volume ed osmolarità dei liquidi corporei è essenziale per l omeostasi. Questo è possibile solo se assunzione ed eliminazione di H 2
1) Calcola la massa molecolare relativa e la massa molare delle seguenti sostanze: NH ( x3) = u.m.a 17.
 1) Calcola la massa molecolare relativa e la massa molare delle seguenti sostanze: NH3 14.0067+(1.00797x3) = 17.03 u.m.a 17.03 gr mol -1 2) Qual è la massa in grammi di 1,00 mol di atomi di fosforo (P)
1) Calcola la massa molecolare relativa e la massa molare delle seguenti sostanze: NH3 14.0067+(1.00797x3) = 17.03 u.m.a 17.03 gr mol -1 2) Qual è la massa in grammi di 1,00 mol di atomi di fosforo (P)
GAS. H 2 N 2 O 2 F 2 Cl 2 CO CO 2 NO 2 SO 2 CH 4
 GAS Non hanno né forma né volume propri. Sono facilmente comprimibili. Sono in genere gassose le sostanze costituite da molecole piccole e di basso peso molecolare. H 2 N 2 O 2 F 2 Cl 2 He Ne Ar CO CO
GAS Non hanno né forma né volume propri. Sono facilmente comprimibili. Sono in genere gassose le sostanze costituite da molecole piccole e di basso peso molecolare. H 2 N 2 O 2 F 2 Cl 2 He Ne Ar CO CO
Esercitazioni di Elementi di Chimica. Modulo 3 Trasformazioni della Materia
 Esercitazioni di Elementi di Chimica Modulo 3 Trasformazioni della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Quale/i dei seguenti
Esercitazioni di Elementi di Chimica Modulo 3 Trasformazioni della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Quale/i dei seguenti
 ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
-SOLUZIONE- In una soluzione liquida si possono distinguere un solvente (il componente liquido più abbondante) e uno o più soluti.
 -SOLUZIONE- Una soluzione è una miscela omogenea di due o più componenti. In generale una soluzione può essere in fase solida (leghe metalliche), liquida (gas + liquido, liquido + liquido, solido + liquido),
-SOLUZIONE- Una soluzione è una miscela omogenea di due o più componenti. In generale una soluzione può essere in fase solida (leghe metalliche), liquida (gas + liquido, liquido + liquido, solido + liquido),
I compartimenti liquidi corporei
 I compartimenti liquidi corporei Il mantenimento di un volume relativamente costante e di una composizione stabile dei liquidi corporei è essenziale per l omeostasi. In condizioni di equilibrio, l assunzione
I compartimenti liquidi corporei Il mantenimento di un volume relativamente costante e di una composizione stabile dei liquidi corporei è essenziale per l omeostasi. In condizioni di equilibrio, l assunzione
L equilibrio dell acqua
 L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
1) Bilanciare la seguente reazione redox con il metodo ionico-elettronico Ag (s) + H + (aq) + NO 3
 A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
Fisiologia cardiovascolare
 Corso Integrato di Fisiologia Umana Fisiologia cardiovascolare La funzione cardiaca: Eventi elettrici e meccanici Anno Accademico 2007-2008 1 Anatomia macroscopica del cuore Anno Accademico 2007-2008 2
Corso Integrato di Fisiologia Umana Fisiologia cardiovascolare La funzione cardiaca: Eventi elettrici e meccanici Anno Accademico 2007-2008 1 Anatomia macroscopica del cuore Anno Accademico 2007-2008 2
FISIOLOGIA VEGETALE. I movimenti dell acqua e dei soluti
 FISIOLOGIA VEGETALE I movimenti dell acqua e dei soluti MOVIMENTI DELL ACQUA E DEI SOLUTI L acqua si muove seguente delle differenze di potenziali di energia Il potenziale di energia è l energia che viene
FISIOLOGIA VEGETALE I movimenti dell acqua e dei soluti MOVIMENTI DELL ACQUA E DEI SOLUTI L acqua si muove seguente delle differenze di potenziali di energia Il potenziale di energia è l energia che viene
MEMBRANE osmosi. MEMBRANE osmosi. elio giroletti
 UNIVERSITÀ DEGLI STUDI DI PAVIA dip. fisica nucleare e teorica via bassi 6, 27100 pavia, italy tel. 038298.7905 - girolett@unipv.it - www.unipv.it/webgiro webgiro 1 elio giroletti EBRANE osmosi FISICA
UNIVERSITÀ DEGLI STUDI DI PAVIA dip. fisica nucleare e teorica via bassi 6, 27100 pavia, italy tel. 038298.7905 - girolett@unipv.it - www.unipv.it/webgiro webgiro 1 elio giroletti EBRANE osmosi FISICA
Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza?
 Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza? Fisicamente è impossibile contare gli atomi contenuti in una data quantita di sostanza. E impossibile
Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza? Fisicamente è impossibile contare gli atomi contenuti in una data quantita di sostanza. E impossibile
Lezione 2. Leggi ponderali
 Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
3. Fisiologia Cellulare Potenziale transmembranario, potenziale d azione
 3. Fisiologia Cellulare Potenziale transmembranario, potenziale d azione Prof. Carlo Capelli Fisiologia Laurea in Scienze delle attività motorie e sportive Università di Verona Obiettivi Genesi e mantenimento
3. Fisiologia Cellulare Potenziale transmembranario, potenziale d azione Prof. Carlo Capelli Fisiologia Laurea in Scienze delle attività motorie e sportive Università di Verona Obiettivi Genesi e mantenimento
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I - (aq) + NO 3
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
PROPRIETÀ TIPICHE DEI LIQUIDI
 STATO LIQUIDO PROPRIETÀ TIPICHE DEI LIQUIDI - hanno volume ma non forma propria - hanno maggiore densità rispetto ai gas - sono incomprimibili - hanno capacità di fluire (forze di Van der Waals) EQUILIBRIO
STATO LIQUIDO PROPRIETÀ TIPICHE DEI LIQUIDI - hanno volume ma non forma propria - hanno maggiore densità rispetto ai gas - sono incomprimibili - hanno capacità di fluire (forze di Van der Waals) EQUILIBRIO
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 6 Le leggi dei gas 1. I gas ideali e la teoria cinetico-molecolare 2. La pressione dei gas 3.
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 6 Le leggi dei gas 1. I gas ideali e la teoria cinetico-molecolare 2. La pressione dei gas 3.
Organizzazione della materia
 Organizzazione della materia Elementi: sostanze che non possono essere scisse in altre più semplici mediante reazioni chimiche ordinarie. Atomo: è la porzione più piccola di un elemento, formato da 3 particelle
Organizzazione della materia Elementi: sostanze che non possono essere scisse in altre più semplici mediante reazioni chimiche ordinarie. Atomo: è la porzione più piccola di un elemento, formato da 3 particelle
ATOMI E MOLECOLE. Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti).
 1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
Dipartimento di Farmacia
 Dipartimento di Farmacia 1) L esame è diviso in: PARTE A (Elementi di Biologia, Anatomia e Fisiologia Generale); PARTE B (Fisiopatologia della Nutrizione); 2) PARTE A e PARTE B possono essere sostenute
Dipartimento di Farmacia 1) L esame è diviso in: PARTE A (Elementi di Biologia, Anatomia e Fisiologia Generale); PARTE B (Fisiopatologia della Nutrizione); 2) PARTE A e PARTE B possono essere sostenute
SOLUZIONI E CONCENTRAZIONE
 SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
LEZIONE 4. Le soluzioni
 LEZIONE 4 Le soluzioni Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il componente delle
LEZIONE 4 Le soluzioni Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il componente delle
MASSE ATOMICHE. Oggi è possibile misurare accuratamente le masse atomiche tramite uno strumento chiamato spettrometro di massa
 Stechiometria MASSE ATOMICHE Dal 1969 si usa una scala basata sull'isotopo 12 C : a tale isotopo è stata arbitrariamente assegnata una massa di 12 unità di massa atomica. Una unità di massa atomica (a.m.u.)=
Stechiometria MASSE ATOMICHE Dal 1969 si usa una scala basata sull'isotopo 12 C : a tale isotopo è stata arbitrariamente assegnata una massa di 12 unità di massa atomica. Una unità di massa atomica (a.m.u.)=
Sistema Termodinamico
 Sistema Termodinamico Un insieme di elementi con un certo grado di correlazione. Esempio: un organismo; un organo; un organello; una macromolecola biologica; una reazione chimica. Ambiente Sistema Q, W
Sistema Termodinamico Un insieme di elementi con un certo grado di correlazione. Esempio: un organismo; un organo; un organello; una macromolecola biologica; una reazione chimica. Ambiente Sistema Q, W
Modalità di trasporto di membrana (DIFFUSIONE FACILITATA)
 Modalità di trasporto di membrana (DIFFUSIONE FACILITATA) Classi di proteine di trasporto presenti nella membrana plasmatica (o CARRIER) Porta girevole Porta aperta I canali ionici Sezione trasversale
Modalità di trasporto di membrana (DIFFUSIONE FACILITATA) Classi di proteine di trasporto presenti nella membrana plasmatica (o CARRIER) Porta girevole Porta aperta I canali ionici Sezione trasversale
Carica elettrica. Costituzione dell atomo: nucleo con protoni (carica +e) e neutroni (carica 0) elettroni (carica -e) orbitanti attorno al nucleo
 I FENOMENI ELETTRICI Carica elettrica Forza di Coulomb Campo elettrico Potenziale elettrico Intensità di corrente Leggi di Ohm Resistenza e resistivita Effetto termico della corrente Elettrolisi Carica
I FENOMENI ELETTRICI Carica elettrica Forza di Coulomb Campo elettrico Potenziale elettrico Intensità di corrente Leggi di Ohm Resistenza e resistivita Effetto termico della corrente Elettrolisi Carica
CORSO TEORICO-PRATICO DI ELETTROCARDIOGRAFIA PER INFERMIERI
 Novi Ligure, 10-11 Dicembre 2007 CORSO TEORICO-PRATICO DI ELETTROCARDIOGRAFIA PER INFERMIERI Gabriele Zaccone Laura Giorcelli L ELETTROCARDIOGRAMMA Laura GIORCELLI L ECG Significato Esecuzione Interpretazione
Novi Ligure, 10-11 Dicembre 2007 CORSO TEORICO-PRATICO DI ELETTROCARDIOGRAFIA PER INFERMIERI Gabriele Zaccone Laura Giorcelli L ELETTROCARDIOGRAMMA Laura GIORCELLI L ECG Significato Esecuzione Interpretazione
I LEGAMI CHIMICI. I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune
 I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
Vena cava superiore) Arteria polmonare valvole semilunari Arterie polmonari sinistre. Arterie polmonari destre) Vena cava inferiore) Ventricolo destro
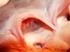 Fisiologia cardiaca Arterie polmonari destre) Vena cava superiore) Arteria polmonare valvole semilunari Arterie polmonari sinistre Atrio destro Vene polmonari sinistre Valvola bicuspide (mitrale) Valvola
Fisiologia cardiaca Arterie polmonari destre) Vena cava superiore) Arteria polmonare valvole semilunari Arterie polmonari sinistre Atrio destro Vene polmonari sinistre Valvola bicuspide (mitrale) Valvola
CAP.2 Bioelementi. Importanza biologica dell acqua. Ciclo dell acqua. Osmosi. Diffusione.
 CAP.2 Bioelementi. Importanza biologica dell acqua. Ciclo dell acqua. Osmosi. Diffusione. 2.1 Bioelementi Gli elementi essenziali per la vita sono molteplici, ma quattro, carbonio (C), idrogeno (H), ossigeno
CAP.2 Bioelementi. Importanza biologica dell acqua. Ciclo dell acqua. Osmosi. Diffusione. 2.1 Bioelementi Gli elementi essenziali per la vita sono molteplici, ma quattro, carbonio (C), idrogeno (H), ossigeno
L APPARATO CIRCOLATORIO
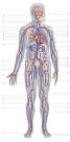 L APPARATO CIRCOLATORIO Il sangue Il sangue è un tessuto liquido connettivo (presenza di importante materia extracellulare), formato da una parte liquida, il plasma e una parte corpuscolare formata da
L APPARATO CIRCOLATORIO Il sangue Il sangue è un tessuto liquido connettivo (presenza di importante materia extracellulare), formato da una parte liquida, il plasma e una parte corpuscolare formata da
La nuova biologia.blu
 David Sadava, David M. Hillis, H. Craig Heller, May R. Berenbaum La nuova biologia.blu Il corpo umano PLUS 2 Capitolo C2 La circolazione sanguigna 3 L apparato cardiovascolare L apparato cardiovascolare
David Sadava, David M. Hillis, H. Craig Heller, May R. Berenbaum La nuova biologia.blu Il corpo umano PLUS 2 Capitolo C2 La circolazione sanguigna 3 L apparato cardiovascolare L apparato cardiovascolare
Gas. Chimica generale ed Inorganica: Chimica Generale. I palloni ad aria calda
 Gas I palloni ad aria calda Gas FIGURA 6-1 Lo stato gassoso di tre alogeni (Gruppo 17) Gas FIGURA 6-1 Lo stato gassoso di tre alogeni (Gruppo 17) Gas FIGURA 6-2 Illustrando la pressione esercitata da un
Gas I palloni ad aria calda Gas FIGURA 6-1 Lo stato gassoso di tre alogeni (Gruppo 17) Gas FIGURA 6-1 Lo stato gassoso di tre alogeni (Gruppo 17) Gas FIGURA 6-2 Illustrando la pressione esercitata da un
ECG standard Parametri di normalità Eventi elettro-meccanici. Dott.Walter Donzelli Cardiologia - Carate B.za
 ECG standard Parametri di normalità Eventi elettro-meccanici Dott.Walter Donzelli Cardiologia - Carate B.za Tutti abbiamo un cuore Cuo re org ano vita le Il cuore batte su impulso elettrico ELETTROC ARDIOGRA
ECG standard Parametri di normalità Eventi elettro-meccanici Dott.Walter Donzelli Cardiologia - Carate B.za Tutti abbiamo un cuore Cuo re org ano vita le Il cuore batte su impulso elettrico ELETTROC ARDIOGRA
struttura e composizione della membrana cellulare Prof. Davide Cervia - Fisiologia Fisiologia della cellula: trasporti di membrana
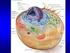 struttura e composizione della membrana cellulare 1 funzioni: separazione, regolazione, comunicazione, stabilizzazione modello a mosaico liquido 2 lipidi di membrana 3 4 Glicoproteine Glicolipidi Glicocalice
struttura e composizione della membrana cellulare 1 funzioni: separazione, regolazione, comunicazione, stabilizzazione modello a mosaico liquido 2 lipidi di membrana 3 4 Glicoproteine Glicolipidi Glicocalice
PROPRIETA COLLIGATIVE o CORRELATE
 PROPRIETA COLLIGATIVE o CORRELATE Si definiscono proprietà colligative delle soluzioni quelle proprietà che non dipendono dalla natura chimica del soluto ma solo dalla concentrazione delle particelle di
PROPRIETA COLLIGATIVE o CORRELATE Si definiscono proprietà colligative delle soluzioni quelle proprietà che non dipendono dalla natura chimica del soluto ma solo dalla concentrazione delle particelle di
Biologia generale Robert J. Brooker, Eric P. Widmaier, Linda E. Graham, Peter D. Stiling Copyright 2009 The McGraw-Hill Companies srl
 RISPOSTE AGLI SPUNTI DI RIFLESSIONE Figura 5.4 Capitolo 5 RISPOSTA : La bassa temperatura impedisce la diffusione laterale delle proteine di membrane. Quindi, dopo la fusione, tutte le proteine di topo
RISPOSTE AGLI SPUNTI DI RIFLESSIONE Figura 5.4 Capitolo 5 RISPOSTA : La bassa temperatura impedisce la diffusione laterale delle proteine di membrane. Quindi, dopo la fusione, tutte le proteine di topo
POTENZIALE DI MEMBRANA
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 POTENZIALE DI MEMBRANA Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 POTENZIALE DI MEMBRANA Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Il Legame Ionico. Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B -
 Il Legame Ionico Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B - A + B - Le coppie di ioni si attraggono elettrostaticamente Il
Il Legame Ionico Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B - A + B - Le coppie di ioni si attraggono elettrostaticamente Il
Movimenti dell acqua e dei soluti nella cellula vegetale
 Movimenti dell acqua e dei soluti nella cellula vegetale L acqua si sposta in funzione dell energia potenziale in essa contenuta o Potenziale idrico Si sposta da una regione dove il potenziale idrico è
Movimenti dell acqua e dei soluti nella cellula vegetale L acqua si sposta in funzione dell energia potenziale in essa contenuta o Potenziale idrico Si sposta da una regione dove il potenziale idrico è
23/10/2013. La normalità si può mettere in relazione con la molarità di una soluzione attraverso la relazione: N = M x n
 Moli (n) = massa del soluto/pm Molarità = moli (n) di soluto contenute in 1 litro di soluzione Molalità = moli (n) di soluto contenute in 1Kg di soluzione Normalità = Eq/V (numero di equivalenti di soluto
Moli (n) = massa del soluto/pm Molarità = moli (n) di soluto contenute in 1 litro di soluzione Molalità = moli (n) di soluto contenute in 1Kg di soluzione Normalità = Eq/V (numero di equivalenti di soluto
