Raggio e densità nucleare Forza nucleare forte e debole Masse atomiche e nucleari Equivalenza massa-energia Difetto di massa e energia di legame
|
|
|
- Adolfo Salvadori
- 7 anni fa
- Visualizzazioni
Transcript
1 L ATOMO Modelli atomici Struttura e dimensioni Numero e peso atomico Raggio atomico e energia di prima ionizzazione Elementi e isotopi IL NUCLEO ATOMICO Raggio e densità nucleare Forza nucleare forte e debole Masse atomiche e nucleari Equivalenza massa-energia Difetto di massa e energia di legame pag.1
2 L antica storia dell atomo I filosofi greci nel VI-V secolo a.c. fanno le prime ipotesi sulla struttura della materia. Secondo Empedocle, tutte le cose sono composte da 4 elementi: terra, acqua, aria e fuoco. Secondo Democrito, suddividendo la materia in pezzettini sempre più piccoli, prima o poi si deve arrivare ad una particella fondamentale e indivisibile (altrimenti, se si potesse dividere sempre più fino all infinito, le cose si dissolverebbero nel nulla). in greco: à-tomos Anche se questa ipotesi (2300 anni dopo!) si è rivelata sbagliata, contiene un idea esatta fondamentale: per tutte le cose, la struttura più interna della materia è IDENTICA! pag.2
3 Diversi atomi per diverse sostanze Lo studio della struttura tt della materia riprende solo agli inizi del XIX secolo. Si è ormai affermato il metodo sperimentale di Galileo: sono gli esperimenti a condurre alle teorie, non viceversa! Teoria atomica di Dalton-Avogadro La materia è formata da atomi indivisibili e indistruttibili I diversi elementi hanno atomi diversi tra loro e con masse diverse I composti sono sostanze pure formate da due o più atomi diversi che si combinano in molecole secondo un rapporto definito Le reazioni chimiche avvengono tra molecole e non tra atomi pag.3
4 Le proprietà chimiche si ripetono periodicamente Mendeleev 1869: tutte le sostanze possono essere descritte in termini di diverse composizioni di solo poco più di 100 atomi (lui ne conosceva 63, ma ne previde altri poi scoperti), suddivisi in modo che a intervalli regolari (periodici) si presentano elementi con uguali proprietà p chimiche! pag.4
5 Le cariche elettriche e la divisione dell atomo Thomson 1897: i raggi catodici sono costituiti da una particella di carica negativa e massa 2000 volte minore della massa dell atomo di idrogeno: l elettrone. Tubo catodico La materia è elettricamente neutra. Da dove viene l elettrone? L elettrone deve essere contenuto all interno dell atomo. Ma allora nell atomo devono esistere anche delle cariche positive in modo che l atomo nel suo complesso sia neutro! L atomo non è indivisibile: è stato diviso! Modello atomico di Thomson: Un panettone di carica positiva che contiene al suo interno gli elettroni Ma è giusto? Bisogna verificare sperimentalmente pag.5
6 Il nucleo atomico e gli elettroni orbitali Esperimento di Rutherford (1911): bombardando con particelle α (massa dell elio, 4 volte l idrogeno) una lamina d oro, si osserva che in alcuni casi (1 su 20000) le particelle vengono deflesse all indietro, come se rimbalzassero, mentre quasi sempre proseguono in avanti. L atomo di Thomson è sbagliato! Modello planetario di Rutherford: L atomo non è omogeneo: ha un nucleo centrale a carica positiva attorno al quale orbitano gli elettroni attirati dalla forza elettromagnetica pag.6
7 Il protone e il neutrone Rutherford 1919: scoperta del protone particella a carica positiva e massa 1836 volte superiore all elettrone Modello finale dell atomo di Rutherford: Gli atomi hanno tanti protoni nel nucleo quanti elettroni nelle orbite, in modo che le cariche elettriche positive e negative si compensano. Atomi di elementi diversi hanno diverso numero di protoni e elettroni. Capito tutto? Ancora no! L analisi sperimentale dice che: gli atomi hanno masse doppie o anche più di quel che dovrebbero in base al numero dei protoni i protoni dovrebbero respingersi fortemente per la forza elettromagnetica Ipotesi: nel nucleo c è anche un altra particella neutra e pesante come il protone un altra forza attrattiva più forte della repulsione coulombiana Chadwick 1932: scoperta del neutrone pag.7
8 L atomo classico e l atomo quantistico Per una comprensione reale è necessaria la Meccanica Quantistica. Con un processo di misura si ottiene: in mecc.quantistica la probabilità di un risultato in mecc.classicaclassica il valore certo di un risultato Heisemberg (1927): la misura contemporanea di posizione e impulso è possibile a meno di un indeterminazione e dell ordine della costante di Planck: h/2π = J s La conservazione dell energia può essere anche violata, purché per un tempo brevissimo! i Δp x Δx 2 ΔEΔt 2 L atomo classico L atomo quantistico (modello) (realtà) pag.8
9 curiosità La Meccanica Quantistica a livello macroscopico pag.9
10 Com è fatto un atomo R nucleone m = 1 fm R atomo m = 1 Å il nucleo è volte più piccolo dell atomo! Z protoni m -27 p = kg q = +e = C N neutroni m n = kg q = 0 Z elettroni m e = kg q = -e = C 1 fm (femtometro) = m fermi Ratomo R nucleone 10 5! Numero di massa: A = Z + N Z A Notazione: o X pag.10
11 Quanto pesa un atomo? Z = numero atomico A = numero di massa N = numero di neutroni Numero di massa: A = Z + N Notazione: Peso atomico Unità di misura SI: u.m.a. (a.m.u.: atomic mass unit) = 1/12 della massa del 12 C 1 u.m.a. = 1 dalton = kg = g Mole (grammo-molecola) A m[g] A = Quantità di materia numericamente uguale NA in g al peso atomico. Contiene N = A atomi/molecole Es. 1 mole di acqua (H 2 O) = 18 g ( ) contiene N A molecole quindi 1 molecola d acqua pesa (18 g)/n = A g cioè circa 18 u.m.a. A Z X pag.11
12 Atomi, nuclei, particelle: le loro dimensioni pag.12
13 Le particelle subatomiche elettrone protone neutrone carica elettrica e + e 0 dimensione < m (*) m m massa kg kg kg vita media stabile stabile 17 min (**) (*) limite superiore (**) neutrone libero pag.13
14 Elementi chimici Elementi chimici: atomi con diverso Z naturali: da idrogeno (Z=1) a uranio (Z=92) artificiali: tecnezio (Z=43) e transuranici (Z>92) Tabella interattiva: pag.14
15 Raggio atomico Raggio medio degli atomi Ordine di grandezza: 1 Å (angstrom) = 0.1 nm = m r (nm) K Li Na B Cl O Rb Cs Fe Pb Ag I Bi Z Valori alti per i metalli alcalini, bassi per i gas nobili e gli elementi con diversi elettroni nell ultimo lti orbitale. Il totale riempimento di un orbitale dà luogo a un nucleo compatto. L inizio del riempimento di un nuovo orbitale (metalli alcalini: li i 1 elettrone in un nuovo orbitale più esterno) aumenta di molto le dimensioni atomiche. Volume atomico pag.15
16 Energia di prima ionizzazione atomica Energia necessaria per strappare da un atomo un elettrone singolo ordine di grandezza: 10 ev Valori più elevati nei gas nobili, meno elevati nei metalli alcalini Per ionizzare un atomo di gas nobile, che ha gli orbitali completamente pieni, serve un energia molto maggiore di quella necessaria a sottrarre l unico elettrone presente in un orbitale esterno di un metallo alcalino. pag.16
17 Isotopi Isotopi stesso n.protoni Z diverso n.neutroni N (stessa specie chimica, diversa massa) stabili radioattivi (naturali e artificiali) N Stabilità dei nuclei: Nuclei leggeri (Z 20) N = Z Nuclei pesanti (Z > 20) N > Z come si spiega? Regione di stabilità nucleare Z pag.17
18 Abbondanza isotopica isotopi = elementi con stesso Z e diverso N elemento isotopi Z A N=A Z abbondanza relativa (%) carbonio ossigeno 16 O 17 O 18 O potassio piombo 12 C C C tracce 39 K 40 K 41 K 204 Pb 206 Pb 207 Pb 208 Pb peso atomico (u.m.a.) pag.18
19 Ma il nucleo come può esistere? Nel nucleo ci sono Z protoni molto vicini tra loro (d 2r 0 =2 (1.2 fm) = m), che quindi risentono delle forze di attrazione gravitazionale e repulsione elettrostatica m i m ( ) F G N 27 2 p p g = = (2r 0) ( ) 1 2 ee i ( (1.6i10 ) Fe = k = N (2r ) (2.4i10 ) F 0 In base alle forze che conosciamo (gravitazionale ed elettromagnetica) i protoni dovrebbero respingersi violentemente e quindi distruggere o impedire la formazione dei nuclei atomici. 40 N = = e 35 Fg N 36 P P F E F G F G F E A MENO CHE pag.19
20 La colla nucleare A MENO CHE all interno dei nuclei atomici si manifesti una ulteriore nuova forza di attrazione, capace di incollare tra loro i protoni vincendo la loro repulsione coulombiana. E questa forza agisca solo a distanze così piccole. come incollare un francobollo a una busta Per vincere la repulsione coulombiana tra protoni, questa forza deve essere FORTE! E poiché non esistono nuclei solo di protoni, evidentemente essa viene sentita anche dai neutroni. Per tenere uniti i protoni sono necessari anche i NEUTRONI! FORZA NUCLEARE FORTE: E sempre attrattiva Si manifesta solo a distanze d m Vale tra protoni, tra neutroni, tra protoni e neutroni ( charge independence della forza nucleare)... ma ancora non basta a spiegare come sono fatti i nuclei... pag.20
21 Guardando i nuclei leggeri... si vede che quando ci sono troppi o pochi neutroni il nucleo non è stabile Idrogeno: Z=1 Elio: Z=2 1 1 H 2 1 H 3 1 H Deuterio Trizio instabile! 2 2 He 3 2 He 4 2 He Non esiste! 5 2 He instabile! La forza nucleare non basta ancora: ci deve essere un altra forza responsabile dei decadimenti nucleari FORZA NUCLEARE DEBOLE pag.21
22 I nuclei più stabili La natura sembra favorire alcune particolari configurazioni nucleari. Nuclei magici e doppiamente magici: livelli nucleari completi Z=2,8,20,28,50, N=2,8,20,28,50,82,126 pag.22
23 Ma quanti neutroni ci vogliono nel nucleo? Né troppi, né troppo pochi! N Z La forza nucleare p-p, p-n, n-n è uguale. Quindi il rapporto tra protoni e neutroni non dovrebbe influenzare la stabilità del nucleo, tranne che per la repulsione elettrostatica tra i protoni. Invece si verifica che in natura esistono solo nuclei leggeri (Z 20) con N Z nuclei pesanti (Z > 20) con N > Z (fino a N 1.5 Z) e alcune configurazioni (Z-N pari, nuclei magici) sono più favorite di altre. Altri nuclei non esistono, o se prodotti decadono spontaneamente dopo un certo tempo, emettendo particelle, o trasformandosi in altre specie, o spezzandosi in nuclei più piccoli. RADIOATTIVITA pag.23
24 La Natura si fa in 4 Forza LE 4 INTERAZIONI FONDAMENTALI (intensità relativa raggio d azione) Gravitazionale infinito ( 1/r 2 ) Elettromagnetica 10-2 infinito ( 1/r 2 ) Nucleare forte 1 r -15 nucl 10 m Nucleare debole r nucl m pag.24
25 La Natura si fa in 4 Forte Elettromagnetica Gravitazionale Debole pag.25
26 Densità nucleare d Raggio del nucleone: r cm = 1.2 fm Impaccamento di nucleoni Raggio del nucleo: r r r 1/3 0 A 0 M Zm + (A Z)m nucl p = = 1 V 4 3 nucl 3 π(r0 A ) Zm p + (A Z)m p π(r A ) nucl = Am = m p p πr0 A 3πr0 d cost nucl Il raggio del nucleo dipende da A g cm n La densità del nucleo NON dipende da A: tutti i nuclei hanno la stessa densità! La densità nucleare è enorme! confronto: densità Terra d T 10 g/cm 3 Lo spazio è quasi tutto vuoto! 14 = i Per avere la stessa densità la Terra 3 dovrebbe avere un raggio di circa 184 m!! pag.26
27 Spettrometro di massa La misura della massa atomica Strumento per misurare masse atomiche e molecolari. La sostanza in esame viene bombardata da un fascio di elettroni. Gli ioni positivi prodotti per frammentazione vengono accelerati da un campo elettrico e deviati da un campo magnetico lungo una traiettoria curvilinea. Dalla forza di Lorentz, misurando il raggio di curvatura di diversi ioni carichi si può risalire alla loro massa. pag.27
28 Masse atomiche e nucleari Sommando le masse dei componenti, dovrebbe essere: M nucleo = Zm p + Nm n M atomo = M nucleo + Zm e = Zm p + Nm n + Zm e Invece sperimentalmente t si misurano masse inferiori. i i Spiegazione: il legame atomico/nucleare equivale a una situazione di minor energia potenziale che appare come minor massa! infatti per togliere un elettrone a un atomo un nucleone a un nucleo bisogna compiere lavoro i cioè fornire energia Einstein E=mc 2 pag.28
29 Equivalenza massa-energia La massa di un corpo è già di per sé una forma di energia! E viceversa, ad ogni energia si può attribuire una massa! Massa in quiete m 0 Energia a riposo E 0 = m 0 c 2 Una variazione de di energia comporta una variazione dm di massa: ΔE = Δm cc 2 Δm = ΔE/c 2 Energia di legame (MeV) Difetto di massa (MeV/c 2 ) Nuova unità di misura per la massa: MeV/c 2 pag.29
30 Massa (energia a riposo) delle particelle subatomiche Ricordando che: 1 ev = J 1 J = ev : Z protoni m p = kg = uma massa protone m pc 2 = ( kg)( m/s) 2 = J = MeV N neutroni m n = kg = uma massa neutrone m n c 2 = ( kg)( m/s) 2 = J = MeV Z elettroni m e = kg = uma massa elettrone m e c 2 = ( kg)( m/s) 2 = J = MeV In Fisica Nucleare le masse Semplificazione: c=1 si esprimono in unità di MeV/c 2 : m p = MeV/c 2 Masse in MeV m = MeV/c 2 2 E E = m c m = 2 n c m e = MeV/c 2 (c = 1) [m ] = [E] pag.30
31 curiosità Le energie in MeV,GeV,TeV Ma le masse-energie in ev a cosa corrispondono? Insomma, questi elettronvolt sono tanti o pochi??? Ricorda: 1 ev = J 1 J = ev Energia per sollevare una penna di 20 g caduta da un tavolo alto 1 m: E = mgh = J = J = ev! L energia di 1 ev è ben poca cosa!!! Ma allora al CERN di Ginevra, nel collisionatore LCH, anche l energia di un protone è poca cosa... 7 TeV = ev =1.12 x 10-6 J (è l energia per sollevare la penna di mm...) Il problema è che al CERN i protoni sono tantissimi! In ogni fascio di LHC ci sono protoni/pacchetto 2800 pacchetti J/protone = J = MJ!! (cioè l energia per sollevare la penna di 1.6 milioni di km!) pag.31
32 curiosità La temperatura in ev Perfino la temperatura si può scrivere in ev... La costante di Boltzmann vale k = J/ o K = ev/ o K. Per un gas monoatomico, l energia cinetica media a temperatura ambiente (T = 300 o K) è kt = ( ev/ o K) (300 o K) = ev = 25 mev. Cioè si può identificare anche la temperatura con l energia: 1 o K ev 1 ev o K Ecco perché in Fisica Nucleare si parla di neutroni termici intendendo neutroni a temperatura ambiente, cioè a energia di 25 mev (=1/40 ev) E quindi, in questo senso, al CERN che temperature si raggiungono? pag.32
33 curiosità Le temperature del Big Bang Al CERN le energie dei fasci di LHC sono di 7 TeV, e quindi corrispondono a temperature di ( ev) (12000 o K/eV) = o K! La temperatura interna del Sole è di circa o K. Quindi è come se al CERN si raggiungessero temperature miliardi di volte più alte di quelle delle stelle (in uno spazio-tempo piccolissimo!), paragonabili a quelle raggiunte appena dopo il Big Bang, al momento della formazione delle particelle. Ecco perché i giornali titolavano Al CERN raggiunte le temperature più alte dell Universo Al CERN ricreate le temperature del Big Bang pag.33
34 La massa del nucleo: difetto di massa ed energia di legame Mediante spettrometro di massa si misura la massa atomica: M atomo = M nucleo + Zm e B e B e = energia di legame degli elettroni atomici: B e (13.6 ev) Z Per differenza (B e <<m e trascurabile) si determina la massa del nucleo: B A = energia di legame M nucleo = M atomo (Zm e B e ) del nucleo = Zm p + Nm n B A B A = Energia di legame del nucleo = = lavoro necessario per separare tutti i nucleoni del nucleo = Δm = Difetto di massa = massa equivalente a questa energia = differenza tra la somma delle masse dei nucleoni e la massa effettiva del nucleo pag.34
35 L energia di legame per nucleone Es. differenza idrogeno-deuterio In base alla sola somma delle masse: M D = 1m p +1m e +1m n = M H +1m n M H = ( ) MeV/c 2 = MeV/c 2 M D = ( ) MeV/c 2 = MeV/c 2 Invece la misura sperimentale dà M D = MeV/c 2 L energia di legame p-n nel nucleo di deuterio è negativa = B D = ( ) MeV = MeV Es. massa 17 8O Somma delle masse: M( 17 8O) = 8m p +8m e +9m n = MeV/c 2 Misura sperimentale: M( 17 8O) = MeV/c 2 Energia di legame: B( 17 8O) = MeV stato legato Energia di legame per nucleone: E A = B A /A = ( MeV)/17 = 7.20 MeV pag.35
36 Il grafico dell energia di legame per nucleone nucleo B A (MeV) B A /A (MeV) 2 H He Li C Al Ca Fe I pag.36
37 Il grafico dell energia di legame per nucleone MeV/A 56 Fe nucleo più stabile (max.energia di legame) 8 MeV 4 He nucleo leggero particolarmente a te stabile Energia di legame per nucleone: E A = B/A pressoché uguale: E A 8 MeV per tutti tti i nuclei (tranne i più leggeri) (cf. energia di legame atomica B E 13 ev Z) fusione fissione A pag.37
L ATOMO. Risponde (o almeno ci prova)
 L ATOMO Di cosa sono fatte le cose? Come si è arrivati a capire gli atomi? Com è fatto un atomo? Quanto è grande un atomo? Che atomi esistono in natura? Perché esistono gli atomi? Risponde (o almeno ci
L ATOMO Di cosa sono fatte le cose? Come si è arrivati a capire gli atomi? Com è fatto un atomo? Quanto è grande un atomo? Che atomi esistono in natura? Perché esistono gli atomi? Risponde (o almeno ci
Radioattività. 1. Massa dei nuclei. 2. Decadimenti nucleari. 3. Legge del decadimento XVI - 0. A. Contin - Fisica Generale Avanzata
 Radioattività 1. Massa dei nuclei 2. Decadimenti nucleari 3. Legge del decadimento XVI - 0 Nucleoni Protoni e neutroni sono chiamati, indifferentemente, nucleoni. Il numero di protoni (e quindi di elettroni
Radioattività 1. Massa dei nuclei 2. Decadimenti nucleari 3. Legge del decadimento XVI - 0 Nucleoni Protoni e neutroni sono chiamati, indifferentemente, nucleoni. Il numero di protoni (e quindi di elettroni
Capitolo 2. Cenni alla Composizione e Struttura dell atomo
 Master in Verifiche di qualità in radiodiagnostica, medicina nucleare e radioterapiar Capitolo 2 Cenni alla Composizione e Struttura dell atomo 24 Atomi, Molecole,, e Ioni L idea di Atomo è antica come
Master in Verifiche di qualità in radiodiagnostica, medicina nucleare e radioterapiar Capitolo 2 Cenni alla Composizione e Struttura dell atomo 24 Atomi, Molecole,, e Ioni L idea di Atomo è antica come
Struttura atomica della materia
 Struttura atomica della materia 1 FASE fase 3 fase 1 fase 2 FASE: porzione di materia chimicamente e fisicamente omogenea delimitata da superfici di separazione ben definite 2 Classificazione della materia
Struttura atomica della materia 1 FASE fase 3 fase 1 fase 2 FASE: porzione di materia chimicamente e fisicamente omogenea delimitata da superfici di separazione ben definite 2 Classificazione della materia
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Sommario della lezione 4. Proprietà periodiche. Massa atomica e massa molecolare. Concetto di mole. Prime esercitazioni
 Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
Cenni di fisica moderna
 Cenni di fisica moderna 1 fisica e salute la fisica delle radiazioni è molto utilizzata in campo medico esistono applicazioni delle radiazioni non ionizzanti nella terapia e nella diagnosi (laser per applicazioni
Cenni di fisica moderna 1 fisica e salute la fisica delle radiazioni è molto utilizzata in campo medico esistono applicazioni delle radiazioni non ionizzanti nella terapia e nella diagnosi (laser per applicazioni
LA STRUTTURA DELL ATOMO
 Capitolo 4 LA STRUTTURA DELL ATOMO N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo Leo - Chimica
Capitolo 4 LA STRUTTURA DELL ATOMO N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo Leo - Chimica
Scienziati in Erba Chimica
 Scienziati in Erba Chimica Acqua Oro Zucchero La Chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola periodica degli elementi
Scienziati in Erba Chimica Acqua Oro Zucchero La Chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola periodica degli elementi
Atomi, molecole e ioni
 Atomi, molecole e ioni anione + - catione Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento
Atomi, molecole e ioni anione + - catione Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento
struttura atomica della materia La chimica
 Struttura atomica della materia 1 La chimica La chimica è la scienza che si occupa dello studio della composizione e delle proprietà delle varie forme della materia 2 bbvbsxbfxbfx 1 Classificazione della
Struttura atomica della materia 1 La chimica La chimica è la scienza che si occupa dello studio della composizione e delle proprietà delle varie forme della materia 2 bbvbsxbfxbfx 1 Classificazione della
ESERCIZI W X Y Z. Numero di massa Neutroni nel nucleo Soluzione
 ESERCIZI 1) La massa di un elettrone, rispetto a quella di un protone, è: a. uguale b. 1850 volte più piccola c. 100 volte più piccola d. 18,5 volte più piccola 2) I raggi catodici sono: a. radiazioni
ESERCIZI 1) La massa di un elettrone, rispetto a quella di un protone, è: a. uguale b. 1850 volte più piccola c. 100 volte più piccola d. 18,5 volte più piccola 2) I raggi catodici sono: a. radiazioni
ATOMI E MOLECOLE. Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti).
 1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
Struttura atomica della materia
 Struttura atomica della materia 1 FASE fase 3 fase 1 fase 2 FASE: porzione di materia chimicamente e fisicamente omogenea delimitata da superfici di separazione ben definite 2 Classificazione della materia
Struttura atomica della materia 1 FASE fase 3 fase 1 fase 2 FASE: porzione di materia chimicamente e fisicamente omogenea delimitata da superfici di separazione ben definite 2 Classificazione della materia
Esercitazioni di Elementi di Chimica. Modulo 2 Struttura della Materia
 Esercitazioni di Elementi di Chimica Modulo 2 Struttura della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Qual è lo stato fisico
Esercitazioni di Elementi di Chimica Modulo 2 Struttura della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Qual è lo stato fisico
Cos è. la Chimica? G. Micera Chimica Generale e Inorganica
 Cos è la Chimica? La Chimica descrive la materia, le sue proprietà, le trasformazioni che essa subisce, e le variazioni di energia associate Materia è tutto ciò che ha massa e volume Energia è la capacità
Cos è la Chimica? La Chimica descrive la materia, le sue proprietà, le trasformazioni che essa subisce, e le variazioni di energia associate Materia è tutto ciò che ha massa e volume Energia è la capacità
Lo strofinio di qualsiasi oggetto provoca la comparsa su di esso di una carica elettrica che può attrarre piccoli oggetti.
 1. La natura elettrica della materia Lo strofinio di qualsiasi oggetto provoca la comparsa su di esso di una carica elettrica che può attrarre piccoli oggetti. La carica elettrica può essere positiva o
1. La natura elettrica della materia Lo strofinio di qualsiasi oggetto provoca la comparsa su di esso di una carica elettrica che può attrarre piccoli oggetti. La carica elettrica può essere positiva o
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero La vita è una reazione chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola
La Vita è una Reazione Chimica Acqua Oro Zucchero La vita è una reazione chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola
Sono gli atomi indivisibili?
 Sono gli atomi indivisibili? L atomo è la particella più piccola di un elemento che possiede tutte le caratteristiche chimiche dell elemento stesso. Sono noti 112 elementi o specie atomiche diverse (90
Sono gli atomi indivisibili? L atomo è la particella più piccola di un elemento che possiede tutte le caratteristiche chimiche dell elemento stesso. Sono noti 112 elementi o specie atomiche diverse (90
U.M.A. e le masse ATOMICHE
 U.M.A. e le masse ATOMICHE L unità di massa atomica (u.m.a.) viene definita come 1/12 della massa del 12 C Il peso atomico (massa atomica relativa) di un atomo viene definito come: massa atomo considerato
U.M.A. e le masse ATOMICHE L unità di massa atomica (u.m.a.) viene definita come 1/12 della massa del 12 C Il peso atomico (massa atomica relativa) di un atomo viene definito come: massa atomo considerato
CHIMICA: studio della struttura e delle trasformazioni della materia
 CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
ELEMENTI di CHIMICA NUCLEARE. La FISSIONE NUCLEARE
 ELEMENTI di CHIMICA NUCLEARE La FISSIONE NUCLEARE Lo scienziato Otto Hahn nel 938 scoprì che l'uranio 35 9U è fissile. La fissione è una rottura dei nuclei pesanti e può avvenire quando un neutrone lento
ELEMENTI di CHIMICA NUCLEARE La FISSIONE NUCLEARE Lo scienziato Otto Hahn nel 938 scoprì che l'uranio 35 9U è fissile. La fissione è una rottura dei nuclei pesanti e può avvenire quando un neutrone lento
Teoria Atomica di Dalton
 Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Le particelle dell atomo
 La carica elettrica I fenomeni elettrici sono noti fin dall antichità: gli antichi Greci usavano la parola elektron per spiegare il fenomeno dell elettrizzazione dell ambra. I Greci sapevano che strofinando
La carica elettrica I fenomeni elettrici sono noti fin dall antichità: gli antichi Greci usavano la parola elektron per spiegare il fenomeno dell elettrizzazione dell ambra. I Greci sapevano che strofinando
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 7 Le particelle dell atomo 3 Sommario (I) 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 7 Le particelle dell atomo 3 Sommario (I) 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le
Cenni di Fisica del Nucleo
 Capitolo 8 Cenni di Fisica del Nucleo 8.1 Proprietà generali dei nuclei In questo capitolo affrontiamo lo studio dei nuclei. Un nucleo è un insieme di neutroni e protoni legati insieme ( incollati ) dalla
Capitolo 8 Cenni di Fisica del Nucleo 8.1 Proprietà generali dei nuclei In questo capitolo affrontiamo lo studio dei nuclei. Un nucleo è un insieme di neutroni e protoni legati insieme ( incollati ) dalla
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni
 CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni composto materia sostanza pura miscela omogenea elemento eterogenea Elementi, Composti e Miscele Miscela eterogenea
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni composto materia sostanza pura miscela omogenea elemento eterogenea Elementi, Composti e Miscele Miscela eterogenea
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. Le particelle fondamentali
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. Le particelle fondamentali
Classificazione della materia 3 STATI DI AGGREGAZIONE
 Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Esercizi su Chimica Nucleare e Nucleogenesi
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi su Chimica Nucleare e Nucleogenesi Prof. Dipartimento CMIC Giulio Natta http://chimicaverde.vosi.org/citterio/it//
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi su Chimica Nucleare e Nucleogenesi Prof. Dipartimento CMIC Giulio Natta http://chimicaverde.vosi.org/citterio/it//
Il modello strutturale dell atomo
 Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
RIASSUNTI DI CHIMICA
 Tecla Spelgatti RIASSUNTI DI CHIMICA per il liceo scientifico 2 - LA TAVOLA PERIODICA Questo testo è distribuito con licenza Common Creative: http://creativecommons.org/licenses/ CC BY-NC-ND Attribuzione
Tecla Spelgatti RIASSUNTI DI CHIMICA per il liceo scientifico 2 - LA TAVOLA PERIODICA Questo testo è distribuito con licenza Common Creative: http://creativecommons.org/licenses/ CC BY-NC-ND Attribuzione
Corso di CHIMICA INORGANICA
 Corso di CHIMICA INORGANICA Lezione Seconda La teoria atomica La massa atomica e il concetto di Isotopi Dentro l atomo, le particelle subatomiche La Tavola Periodica degli Elementi 2 Gli atomi di un certo
Corso di CHIMICA INORGANICA Lezione Seconda La teoria atomica La massa atomica e il concetto di Isotopi Dentro l atomo, le particelle subatomiche La Tavola Periodica degli Elementi 2 Gli atomi di un certo
Unità didattica 10. Decima unità didattica (Fisica) 1. Corso integrato di Matematica e Fisica per il Corso di Farmacia
 Unità didattica 10 Radioattività... 2 L atomo... 3 Emissione di raggi x... 4 Decadimenti nucleari. 6 Il decadimento alfa.... 7 Il decadimento beta... 8 Il decadimento gamma...... 9 Interazione dei fotoni
Unità didattica 10 Radioattività... 2 L atomo... 3 Emissione di raggi x... 4 Decadimenti nucleari. 6 Il decadimento alfa.... 7 Il decadimento beta... 8 Il decadimento gamma...... 9 Interazione dei fotoni
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Peso Atomico. Tre problemi da risolvere!! (2) Quale unità di misura conviene adottare?
 Peso Atomico Tre problemi da risolvere!! (1) Difetto di massa (2) Quale unità di misura conviene adottare? (3) Come tener conto della miscela isotopica naturale per ciascun elemento? Il difetto di massa
Peso Atomico Tre problemi da risolvere!! (1) Difetto di massa (2) Quale unità di misura conviene adottare? (3) Come tener conto della miscela isotopica naturale per ciascun elemento? Il difetto di massa
Il Nucleo. Dimensioni del nucleo dell'ordine di 10. m Il raggio nucleare R = R 0 -15
 Il Nucleo Nucleo e' costituito da nucleoni (protoni e neutroni). Mentre i neutroni liberi sono abbastanza instabili tendono a decadere in un protone ed un elettrone (t 1/2 circa 900 s), i protoni sono
Il Nucleo Nucleo e' costituito da nucleoni (protoni e neutroni). Mentre i neutroni liberi sono abbastanza instabili tendono a decadere in un protone ed un elettrone (t 1/2 circa 900 s), i protoni sono
L atomo. Il neutrone ha una massa 1839 volte superiore a quella dell elettrone. 3. Le particelle fondamentali dell atomo
 L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
Modelli atomici. Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle.
 Modelli atomici Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle. Presupposti 1. Legge di Lavoisier della conservazione della massa: in una reazione chimica nulla si
Modelli atomici Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle. Presupposti 1. Legge di Lavoisier della conservazione della massa: in una reazione chimica nulla si
P. Sapia Università della Calabria. a.a. 2009/10
 FISICA PER I BENI CULTURALI Ii MATERIA E INTERAZIONE CON LA RADIAZIONE P. Sapia Università della Calabria a.a. 2009/10 Interazioni fondamentali Gravitazionale Debolmente attrattiva, tra tutte le particelle
FISICA PER I BENI CULTURALI Ii MATERIA E INTERAZIONE CON LA RADIAZIONE P. Sapia Università della Calabria a.a. 2009/10 Interazioni fondamentali Gravitazionale Debolmente attrattiva, tra tutte le particelle
Struttura dell atomo atomo particelle sub-atomiche - protoni positiva - neutroni } nucleoni - elettroni negativa elemento
 Struttura dell atomo L atomo è la più piccola parte dell elemento che conserva le proprietà dell elemento Negli atomi ci sono tre diverse particelle sub-atomiche: - protoni (con carica positiva unitaria)
Struttura dell atomo L atomo è la più piccola parte dell elemento che conserva le proprietà dell elemento Negli atomi ci sono tre diverse particelle sub-atomiche: - protoni (con carica positiva unitaria)
Testi Consigliati. I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli. Qualsiasi altro testo che tratti gli argomenti elencati nel programma
 Chimica Generale ed Inorganica Testi Consigliati I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli Chimica Organica Hart-Craine Introduzione alla Chimica Organica Zanichelli. Qualsiasi altro testo che
Chimica Generale ed Inorganica Testi Consigliati I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli Chimica Organica Hart-Craine Introduzione alla Chimica Organica Zanichelli. Qualsiasi altro testo che
Elementi sistemati nella TAVOLA PERIODICA DEGLI ELEMENTI in base al numero atomico crescente O, H, N, C (+ del 96% della materia vivente)
 OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
Chimica Generale ed Inorganica
 Chimica Generale ed Inorganica Chimica Generale prof. Dario Duca H 2 O, CO, CO 2 MgO legge di conservazione della massa Lavoisier legge della composizione costante Proust teoria atomica di Dalton i) gli
Chimica Generale ed Inorganica Chimica Generale prof. Dario Duca H 2 O, CO, CO 2 MgO legge di conservazione della massa Lavoisier legge della composizione costante Proust teoria atomica di Dalton i) gli
Corso di Studi in Scienze Naturali Corso di Chimica Generale e Inorganica Dott.ssa Maria Cristina Paganini Prof. Elio Giamello
 Corso di Studi in Scienze Naturali Corso di Chimica Generale e Inorganica Dott.ssa Maria Cristina Paganini Prof. Elio Giamello Avvertenza: Le immagini seguenti, proiettate durante le lezioni sono tratte
Corso di Studi in Scienze Naturali Corso di Chimica Generale e Inorganica Dott.ssa Maria Cristina Paganini Prof. Elio Giamello Avvertenza: Le immagini seguenti, proiettate durante le lezioni sono tratte
Chimica Nucleare. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Chimica Nucleare Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. 1 Riassunto Numero Atomico (Z) = numero di protoni nel nucleo Numero di Massa (A) = numero di
Chimica Nucleare Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. 1 Riassunto Numero Atomico (Z) = numero di protoni nel nucleo Numero di Massa (A) = numero di
Classe4:chimicaStrutturaAtomica1. Controlla se sai definire i seguenti termini: teoria atomica di Dalton (atomo di Dalton),
 Classe4:chimicaStrutturaAtomica1. Controlla se sai definire i seguenti termini: teoria atomica di Dalton (atomo di Dalton), particelle subatomiche, protone, neutrone, elettronie, nucleo. 2. Decidi se tra
Classe4:chimicaStrutturaAtomica1. Controlla se sai definire i seguenti termini: teoria atomica di Dalton (atomo di Dalton), particelle subatomiche, protone, neutrone, elettronie, nucleo. 2. Decidi se tra
CAPITOLO 20 LA CHIMICA NUCLEARE
 CAPITOLO 20 LA CHIMICA NUCLEARE 20.5 (a) La soma dei numeri atomici e la somma dei numeri di massa, da entrambi i lati dell equazione nucleare, deve coincidere. Dalla parte sinistra di questa equazione
CAPITOLO 20 LA CHIMICA NUCLEARE 20.5 (a) La soma dei numeri atomici e la somma dei numeri di massa, da entrambi i lati dell equazione nucleare, deve coincidere. Dalla parte sinistra di questa equazione
Pinzani, Panero, Bagni Sperimentare la chimica Soluzioni degli esercizi Capitolo 9
 Pinzani, Panero, Bagni Sperimentare la chimica Soluzioni degli esercizi Capitolo 9 Esercizio PAG 198 ES 1 PAG 198 ES 2 PAG 198 ES 3 PAG 198 ES 4 PAG 198 ES 5 PAG 198 ES 6 PAG 198 ES 7 PAG 198 ES 8 PAG
Pinzani, Panero, Bagni Sperimentare la chimica Soluzioni degli esercizi Capitolo 9 Esercizio PAG 198 ES 1 PAG 198 ES 2 PAG 198 ES 3 PAG 198 ES 4 PAG 198 ES 5 PAG 198 ES 6 PAG 198 ES 7 PAG 198 ES 8 PAG
La Radioattività. da:ispra istituto superiore per la ricerca e protezione ambientale
 La Radioattività da:ispra istituto superiore per la ricerca e protezione ambientale Isotopi: Nuclei diversi del medesimo elemento chimico Vi sono elementi con atomi che, a parità di numero di protoni,
La Radioattività da:ispra istituto superiore per la ricerca e protezione ambientale Isotopi: Nuclei diversi del medesimo elemento chimico Vi sono elementi con atomi che, a parità di numero di protoni,
Le radiazioni e la loro misura
 Le radiazioni e la loro misura Le radiazioni e le radiazioni ionizzanti Nuclei, radioattività, reazioni nucleari Einstein, la legge E = mc 2 e l'energia nucleare Uso degli strumenti di misura Che cosa
Le radiazioni e la loro misura Le radiazioni e le radiazioni ionizzanti Nuclei, radioattività, reazioni nucleari Einstein, la legge E = mc 2 e l'energia nucleare Uso degli strumenti di misura Che cosa
2.1 (p. 37) Bohr descrisse un orbitale atomico come una traiettoria circolare seguita dall elettrone. Un orbitale è una
 Capitolo 2 Risposte alle Domande ed esercizi inclusi nel Capitolo 2.1 (p. 37) Bohr descrisse un orbitale atomico come una traiettoria circolare seguita dall elettrone. Un orbitale è una regione di spazio
Capitolo 2 Risposte alle Domande ed esercizi inclusi nel Capitolo 2.1 (p. 37) Bohr descrisse un orbitale atomico come una traiettoria circolare seguita dall elettrone. Un orbitale è una regione di spazio
Stati di Aggregazione e Composizione - elementi atomo - composti - miscele omo- ed eterogenee L Atomo - particelle subatomiche e proprietà - Numero
 1. La Materia Stati di Aggregazione e Composizione - elementi atomo - composti - miscele omo- ed eterogenee L Atomo - particelle subatomiche e proprietà - Numero Atomico e Numero di Massa Gli Isotopi La
1. La Materia Stati di Aggregazione e Composizione - elementi atomo - composti - miscele omo- ed eterogenee L Atomo - particelle subatomiche e proprietà - Numero Atomico e Numero di Massa Gli Isotopi La
Chimica. 1) Il simbolo del Carbonio è: A) C B) Ca. C) Ce D) Cu. 2) Secondo il principio della conservazione della materia:
 Chimica 1) Il simbolo del Carbonio è: A) C B) Ca C) Ce D) Cu 2) Secondo il principio della conservazione della materia: A) Durante le reazioni chimiche il numero totale di atomi di ciascun elemento chimico
Chimica 1) Il simbolo del Carbonio è: A) C B) Ca C) Ce D) Cu 2) Secondo il principio della conservazione della materia: A) Durante le reazioni chimiche il numero totale di atomi di ciascun elemento chimico
Chimica generale e inorganica
 Corso di: Chimica generale e inorganica Prof. Roberta Spadaccini rspadacc@unisannio.it Orario di ricevimento: lunedi 16-17 Libri di testo consigliati: Brown-Lemay Fondamenti di chimica EDISES Giannoccaro
Corso di: Chimica generale e inorganica Prof. Roberta Spadaccini rspadacc@unisannio.it Orario di ricevimento: lunedi 16-17 Libri di testo consigliati: Brown-Lemay Fondamenti di chimica EDISES Giannoccaro
CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI
 CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI Elettrici I anno - III Quadr. a.acc. 2006/07 Laboratorio: Laboratorio Materiali piano S-1 26/04/2007 Chimica e Scienza e Tecnologia dei Materiali
CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI Elettrici I anno - III Quadr. a.acc. 2006/07 Laboratorio: Laboratorio Materiali piano S-1 26/04/2007 Chimica e Scienza e Tecnologia dei Materiali
Chimica. Lezione 1 La materia
 Chimica Lezione 1 La materia Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido, gassoso) o della COMPOSIZIONE
Chimica Lezione 1 La materia Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido, gassoso) o della COMPOSIZIONE
Interazione radiazione materia Dott.ssa Alessandra Bernardini
 Interazione radiazione materia Dott.ssa Alessandra Bernardini 1 Un po di storia Lo studio delle radiazioni ionizzanti come materia di interesse nasce nel novembre del 1895 ad opera del fisico tedesco Wilhelm
Interazione radiazione materia Dott.ssa Alessandra Bernardini 1 Un po di storia Lo studio delle radiazioni ionizzanti come materia di interesse nasce nel novembre del 1895 ad opera del fisico tedesco Wilhelm
Atomi, Molecole e Ioni. Capitolo 2
 Atomi, Molecole e Ioni Capitolo 2 La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti gli atomi di un dato elemento sono identici
Atomi, Molecole e Ioni Capitolo 2 La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti gli atomi di un dato elemento sono identici
La fusione. Lezioni d'autore. di Claudio Cigognetti
 La fusione Lezioni d'autore di Claudio Cigognetti La bomba H (da Ulisse Rai) VIDEO VIDEO Il plasma costituito da un gas di ioni, elettroni, atomi o molecole complessivamente neutro in esso dominano gli
La fusione Lezioni d'autore di Claudio Cigognetti La bomba H (da Ulisse Rai) VIDEO VIDEO Il plasma costituito da un gas di ioni, elettroni, atomi o molecole complessivamente neutro in esso dominano gli
Principio dell Aufbau (riempimento)
 LA TABELLA PERIODICA DEGLI ELEMENTI Principio dell Aufbau (riempimento) Schema semplificato dei livelli energetici atomici Distribuzione energetica reale dei livelli energetici atomici 7p Schema empirico
LA TABELLA PERIODICA DEGLI ELEMENTI Principio dell Aufbau (riempimento) Schema semplificato dei livelli energetici atomici Distribuzione energetica reale dei livelli energetici atomici 7p Schema empirico
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 4 Le teorie della materia 1. L atomo e la sua storia 2. Le «prove sperimentali» della teoria atomica 3. La teoria
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 4 Le teorie della materia 1. L atomo e la sua storia 2. Le «prove sperimentali» della teoria atomica 3. La teoria
Capitolo 4 Le teorie della materia
 Atomo: Prime Teorie Capitolo 4 Le teorie della materia 1. L atomo e la sua storia 2. Le «prove sperimentali» della teoria atomica 3. La teoria atomica spiega le leggi ponderali 4. La teoria atomica e le
Atomo: Prime Teorie Capitolo 4 Le teorie della materia 1. L atomo e la sua storia 2. Le «prove sperimentali» della teoria atomica 3. La teoria atomica spiega le leggi ponderali 4. La teoria atomica e le
Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe
 1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
Corso di CHIMICA LEZIONE 3
 Corso di CHIMICA LEZIONE 3 1 2 3 4 5 6 7 H Li Na K Fr Be Ma g Ca Ba TAVOLA PERIODICA He I II s 1 s 2 III IV V VI VII VIII p 1 p 2 p 3 p 4 p 5 p 6 blocco s La Ac 6 7 d 1 d 2 d 3 d 4 d 5 d 6 d 7 d 8 d 9
Corso di CHIMICA LEZIONE 3 1 2 3 4 5 6 7 H Li Na K Fr Be Ma g Ca Ba TAVOLA PERIODICA He I II s 1 s 2 III IV V VI VII VIII p 1 p 2 p 3 p 4 p 5 p 6 blocco s La Ac 6 7 d 1 d 2 d 3 d 4 d 5 d 6 d 7 d 8 d 9
Lezione n. 13. Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo. di idrogeno. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 13 Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo di idrogeno Antonino Polimeno 1 Radiazione elettromagnetica (1) - Rappresentazione
Chimica Fisica Biotecnologie sanitarie Lezione n. 13 Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo di idrogeno Antonino Polimeno 1 Radiazione elettromagnetica (1) - Rappresentazione
Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton)
 Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Configurazioni elettroniche e periodicità
 Configurazioni elettroniche e periodicità Le configurazioni elettroniche dei vari elementi sono una funzione periodica del numero atomico Z. Gli elementi che appartengono allo stesso gruppo nella tavola
Configurazioni elettroniche e periodicità Le configurazioni elettroniche dei vari elementi sono una funzione periodica del numero atomico Z. Gli elementi che appartengono allo stesso gruppo nella tavola
Cos è un trasformazione chimica?
 Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Istituzioni di Fisica Nucleare e Subnucleare Prof. A. Andreazza. Lezione 10. Fusione nucleare
 Istituzioni di Fisica Nucleare e Subnucleare Prof. A. Andreazza Lezione 10 Fusione nucleare Fusione nucleare (Das-Ferbel, cap. 5.3) Abbiamo già accennato alla fusione nucleare che costituisce la sorgente
Istituzioni di Fisica Nucleare e Subnucleare Prof. A. Andreazza Lezione 10 Fusione nucleare Fusione nucleare (Das-Ferbel, cap. 5.3) Abbiamo già accennato alla fusione nucleare che costituisce la sorgente
L Atomo e le Molecole
 L Atomo e le Molecole L atomo L'atomo, la particella che come un mattone costituisce tutta la materia, non è un corpicciolo semplice. Esso è a sua volta composto da particelle elementari piccolissime:
L Atomo e le Molecole L atomo L'atomo, la particella che come un mattone costituisce tutta la materia, non è un corpicciolo semplice. Esso è a sua volta composto da particelle elementari piccolissime:
Prof. Luisa Ferronato 1
 Prof. Luisa Ferronato 1 L atomo e l antichitl antichità Forse venticinque secoli fa, sulle rive del mare divino, dove il canto degli aedi si era appena spento, qualche filosofo insegnava già che la mutevole
Prof. Luisa Ferronato 1 L atomo e l antichitl antichità Forse venticinque secoli fa, sulle rive del mare divino, dove il canto degli aedi si era appena spento, qualche filosofo insegnava già che la mutevole
Fenomeno fisico. Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici
 Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
Cosa alimenta le stelle? Stefano Covino INAF / Osservatorio Astronomico di Brera
 Cosa alimenta le stelle? Stefano Covino INAF / Osservatorio Astronomico di Brera Dato di ingresso: il Sole splende La quantità di energia che riceviamo dal Sole è nota come Costante Solare (CS): 1,37 kw/m
Cosa alimenta le stelle? Stefano Covino INAF / Osservatorio Astronomico di Brera Dato di ingresso: il Sole splende La quantità di energia che riceviamo dal Sole è nota come Costante Solare (CS): 1,37 kw/m
ELEMENTI DI DI OTTICA E FISICA NUCLEARE INSEGNAMENTO COMPLEMENTARE (9 CFU) PER:
 ELEMENTI DI DI OTTICA E FISICA NUCLEARE INSEGNAMENTO COMPLEMENTARE (9 CFU) PER: CORSO DI LAUREA TRIENNALE IN SCIENZE E TECNOLOGIE PER LO STUDIO E LA CONSERVAZIONE DEI BENI CULTURALI E DEI SUPPORTI DELLA
ELEMENTI DI DI OTTICA E FISICA NUCLEARE INSEGNAMENTO COMPLEMENTARE (9 CFU) PER: CORSO DI LAUREA TRIENNALE IN SCIENZE E TECNOLOGIE PER LO STUDIO E LA CONSERVAZIONE DEI BENI CULTURALI E DEI SUPPORTI DELLA
ATOMI E MOLECOLE. Psicobiologia Lezione nr. 1. Prof. Lasaponara
 ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
Principi della chimica
 6 Novembre 016 Principi della chimica L atomo La materia è formata da atomi, particelle subatomiche costituite da cariche negative (elettroni, e-) che sono situati intorno ad un nucleo dove risiedono le
6 Novembre 016 Principi della chimica L atomo La materia è formata da atomi, particelle subatomiche costituite da cariche negative (elettroni, e-) che sono situati intorno ad un nucleo dove risiedono le
CORSO DI LAUREA IN OTTICA E OPTOMETRIA
 CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
Esercizi di. Stechiometria dei composti. mercoledì 9 dicembre 2015
 Esercizi di Stechiometria dei composti mercoledì 9 dicembre 2015 Il cloro ha due isotopi stabili contenenti rispettivamente 18 e 20 neutroni. Utilizzando la tavola periodica degli elementi, scrivere i
Esercizi di Stechiometria dei composti mercoledì 9 dicembre 2015 Il cloro ha due isotopi stabili contenenti rispettivamente 18 e 20 neutroni. Utilizzando la tavola periodica degli elementi, scrivere i
Struttura dell atomo e Sistema Periodico degli elementi unità 1, 2 e 3, modulo C del libro
 Struttura dell atomo e Sistema Periodico degli elementi unità 1, 2 e 3, modulo C del libro Gli atomi di tutti gli elementi sono formati da tre tipi di particelle elementari: elettrone, protone e neutrone.
Struttura dell atomo e Sistema Periodico degli elementi unità 1, 2 e 3, modulo C del libro Gli atomi di tutti gli elementi sono formati da tre tipi di particelle elementari: elettrone, protone e neutrone.
L abbondanza degli elementi nell universo
 L abbondanza degli elementi nell universo Abbondanze nel sistema solare Abbondanze fotosferiche e meteoriche Abbondanze cosmiche Chi da dove? a)nucleosisntesi primordiale b)nucleosintesi stellare fino
L abbondanza degli elementi nell universo Abbondanze nel sistema solare Abbondanze fotosferiche e meteoriche Abbondanze cosmiche Chi da dove? a)nucleosisntesi primordiale b)nucleosintesi stellare fino
Chimica e Propedeutica Biochimica
 Chimica e Propedeutica Biochimica Beatrice Vallone Linda Savino Dipartimento di Scienze Biochimiche Sapienza - Università di Roma E-mail: beatrice.vallone@uniroma.it CHIMICA: STUDIO DELLA MATERIA: Proprietà
Chimica e Propedeutica Biochimica Beatrice Vallone Linda Savino Dipartimento di Scienze Biochimiche Sapienza - Università di Roma E-mail: beatrice.vallone@uniroma.it CHIMICA: STUDIO DELLA MATERIA: Proprietà
1. L'esperienza di Rutherford Dal Seicento all'ottocento si sviluppò lo studio delle strutture microscopiche, grazie ai microscopi ottici.
 Il modello atomico 1. L'esperienza di Rutherford Dal Seicento all'ottocento si sviluppò lo studio delle strutture microscopiche, grazie ai microscopi ottici. I microscopi ottici, tuttavia, non vedono attraverso
Il modello atomico 1. L'esperienza di Rutherford Dal Seicento all'ottocento si sviluppò lo studio delle strutture microscopiche, grazie ai microscopi ottici. I microscopi ottici, tuttavia, non vedono attraverso
Carica elettrica. Costituzione dell atomo: nucleo con protoni (carica +e) e neutroni (carica 0) elettroni (carica -e) orbitanti attorno al nucleo
 I FENOMENI ELETTRICI Carica elettrica Forza di Coulomb Campo elettrico Potenziale elettrico Intensità di corrente Leggi di Ohm Resistenza e resistivita Effetto termico della corrente Elettrolisi Carica
I FENOMENI ELETTRICI Carica elettrica Forza di Coulomb Campo elettrico Potenziale elettrico Intensità di corrente Leggi di Ohm Resistenza e resistivita Effetto termico della corrente Elettrolisi Carica
Distaccamento Volontari Caselle Torinese 5) RADIOATTIVITA. Testi, immagini ed argomenti trattati a cura del Comando Provinciale di Torino
 5) RADIOATTIVITA 5.1 Radioattività Parlando di radioattività bisogna partire dai concetti introduttivi di fisica nucleare. 5.1.1 L atomo L atomo può essere definito la più piccola parte di un elemento
5) RADIOATTIVITA 5.1 Radioattività Parlando di radioattività bisogna partire dai concetti introduttivi di fisica nucleare. 5.1.1 L atomo L atomo può essere definito la più piccola parte di un elemento
GLI ELEMENTI CHIMICI
 I costituenti degli elementi chimici GLI ELEMENTI CHIMICI Gli elementi chimici si differenziano per il numero di protoni nel nucleo. Il numero dei protoni definisce il numero atomico (Z) di un elemento.
I costituenti degli elementi chimici GLI ELEMENTI CHIMICI Gli elementi chimici si differenziano per il numero di protoni nel nucleo. Il numero dei protoni definisce il numero atomico (Z) di un elemento.
Il bosone di Higgs: che cosa è? Come funziona? E a che cosa serve? Stefano Sandrelli INAF Osservatorio Astronomico di Brera
 Il bosone di Higgs: che cosa è? Come funziona? E a che cosa serve? Stefano Sandrelli INAF Osservatorio Astronomico di Brera Riassunto: che cosa è la luce? Onda o par5cella? Il fotone. Natura ondulatoria
Il bosone di Higgs: che cosa è? Come funziona? E a che cosa serve? Stefano Sandrelli INAF Osservatorio Astronomico di Brera Riassunto: che cosa è la luce? Onda o par5cella? Il fotone. Natura ondulatoria
Le proprietà periodiche degli elementi. Problema: ordinare gli elementi secondo un criterio logico e memorizzabile
 Le proprietà periodiche degli elementi Problema: ordinare gli elementi secondo un criterio logico e memorizzabile Nei periodi gli elementi presentano numero atomico crescente e le proprietà chimiche
Le proprietà periodiche degli elementi Problema: ordinare gli elementi secondo un criterio logico e memorizzabile Nei periodi gli elementi presentano numero atomico crescente e le proprietà chimiche
Struttura dell atomo e Sistema Periodico degli elementi unità 1, 2 e 3, modulo C del libro
 Struttura dell atomo e Sistema Periodico degli elementi unità 1, 2 e 3, modulo C del libro Gli atomi di tutti gli elementi sono formati da tre tipi di particelle elementari: elettrone, protone e neutrone.
Struttura dell atomo e Sistema Periodico degli elementi unità 1, 2 e 3, modulo C del libro Gli atomi di tutti gli elementi sono formati da tre tipi di particelle elementari: elettrone, protone e neutrone.
Generalità delle onde elettromagnetiche
 Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
RIASSUNTO DEGLI ARGOMENTI DI CHIMICA TRATTATI IN 1 LICEO
 RIASSUNTO DEGLI ARGOMENTI DI CHIMICA TRATTATI IN 1 LICEO La chimica è una disciplina scientifica che si occupa dello studio della composizione, della struttura interna e delle proprietà delle sostanze,
RIASSUNTO DEGLI ARGOMENTI DI CHIMICA TRATTATI IN 1 LICEO La chimica è una disciplina scientifica che si occupa dello studio della composizione, della struttura interna e delle proprietà delle sostanze,
Fisica del VITA MEDIA o <<TEMPO SCALA>> di una stella. RISERVA ENERGETICA (masse delle particelle) POTENZA IRRADIATA
 Bollitore tibetano Fisica del 1900 VITA MEDIA o di una stella RISERVA ENERGETICA (masse delle particelle) POTENZA IRRADIATA M i c h e l s o n In Fisica oramai, è soltanto questione di mettere
Bollitore tibetano Fisica del 1900 VITA MEDIA o di una stella RISERVA ENERGETICA (masse delle particelle) POTENZA IRRADIATA M i c h e l s o n In Fisica oramai, è soltanto questione di mettere
CHIMICA: è la scienza che studia la struttura, le proprietà e le trasformazioni della materia che ci circonda
 CHIMICA: è la scienza che studia la struttura, le proprietà e le trasformazioni della materia che ci circonda In passato si credeva che tutta la materia fosse formata dall insieme di quattro elementi:
CHIMICA: è la scienza che studia la struttura, le proprietà e le trasformazioni della materia che ci circonda In passato si credeva che tutta la materia fosse formata dall insieme di quattro elementi:
Unità Didattica 3. L atomo di idrogeno
 Diapositiva 1 Unità Didattica 3 L atomo di idrogeno Questa unità contiene informazioni sull atomo di idrogeno, i modelli di Tomson, Ruterford e Bor, l esperimento di Frank-Hertz e infine la formula di
Diapositiva 1 Unità Didattica 3 L atomo di idrogeno Questa unità contiene informazioni sull atomo di idrogeno, i modelli di Tomson, Ruterford e Bor, l esperimento di Frank-Hertz e infine la formula di
2. La struttura dell atomo
 2. La struttura dell atomo 2.1 Particelle elementari 2.2 I modelli atomici: storia dell atomo 2.3 Numero atomico e numero di massa; 2.4 Isotopi; 2.5 Elementi e tavola periodica 2.1 Particelle elementari
2. La struttura dell atomo 2.1 Particelle elementari 2.2 I modelli atomici: storia dell atomo 2.3 Numero atomico e numero di massa; 2.4 Isotopi; 2.5 Elementi e tavola periodica 2.1 Particelle elementari
Tavola Periodica degli Elementi
 Tavola Periodica degli Elementi È possibile classificare gli elementi? Hp: In base alla massa atomica. Ogni 8 elementi le proprietà si ripetono. Incongruenze A Ar >A K Il Problema Le proprietà Chimiche
Tavola Periodica degli Elementi È possibile classificare gli elementi? Hp: In base alla massa atomica. Ogni 8 elementi le proprietà si ripetono. Incongruenze A Ar >A K Il Problema Le proprietà Chimiche
Il nucleo degli atomi
 Il nucleo atomico 1. Energia di legame nucleare 2. La radioattività naturale 3. Banda di stabilità degli isotopi degli elementi naturali 4. Decadimenti radioattivi 5. Reazioni nucleari Il nucleo degli
Il nucleo atomico 1. Energia di legame nucleare 2. La radioattività naturale 3. Banda di stabilità degli isotopi degli elementi naturali 4. Decadimenti radioattivi 5. Reazioni nucleari Il nucleo degli
PROPRIETÀ PERIODICHE DEGLI ELEMENTI
 PROPRIETÀ PERIODICHE DEGLI ELEMENTI 1) Energia di ionizzazione E ion Energia necessaria per sottrarre ad un atomo, allo stato di gas monoatomico, un elettrone A (g) d A + (g) + e - E ion processo endotermico
PROPRIETÀ PERIODICHE DEGLI ELEMENTI 1) Energia di ionizzazione E ion Energia necessaria per sottrarre ad un atomo, allo stato di gas monoatomico, un elettrone A (g) d A + (g) + e - E ion processo endotermico
Il nucleo dell'atomo
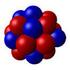 Il nucleo dell'atomo L'atomo si può considerare suddiviso in due regioni: Il nucleo, carico positivamente: è formato di protoni e neutroni La nuvola elettronica, carica negativamente: lo spazio intorno
Il nucleo dell'atomo L'atomo si può considerare suddiviso in due regioni: Il nucleo, carico positivamente: è formato di protoni e neutroni La nuvola elettronica, carica negativamente: lo spazio intorno
VITA, MORTE E MIRACOLI DEL MODELLO STANDARD
 VITA, MORTE E MIRACOLI DEL MODELLO STANDARD Una stella media delle dimensioni del Sole ha una massa di circa 10^33 g, ma per indagare la natura di questi giganti la scienza sta studiando particelle con
VITA, MORTE E MIRACOLI DEL MODELLO STANDARD Una stella media delle dimensioni del Sole ha una massa di circa 10^33 g, ma per indagare la natura di questi giganti la scienza sta studiando particelle con
