Unità Didattica 3. L atomo di idrogeno
|
|
|
- Michele Randazzo
- 7 anni fa
- Visualizzazioni
Transcript
1 Diapositiva 1 Unità Didattica 3 L atomo di idrogeno Questa unità contiene informazioni sull atomo di idrogeno, i modelli di Tomson, Ruterford e Bor, l esperimento di Frank-Hertz e infine la formula di Rydberg-Ritz. Diapositiva Sommario Modelli dell atomo di idrogeno - cenni storici - modello di Tomson - modello di Ruterford - modello di Bor - l esperienza di Frank e Hertz I livelli energetici dell atomo di Idrogeno - formula di Rydberg - Ritz
2 Diapositiva 3 Cenni storici - dal IV secolo a.c. Leucippo e Democrito (filosofi greci) Lucrezio (filosofo romano), i cosiddetti atomisti : materia costituita da particelle minuscole e indivisibili (atomòs = indivisibile). - Considerazioni derivate da semplici intuizioni filosofice e non da una corretta analisi sperimentale dei fenomeni, ce verrà introdotta da Galileo Galilei Diapositiva 4 Avvalendosi delle teorie cimice del tempo Dalton nel 1803 formulò la sua teoria atomica : materia formata da atomi, inalterabili ed indivisibili; in una stessa sostanza (elemento) gli atomi sono tutti uguali; gli atomi di diversi elementi differiscono per massa e per altre particolarità; le trasformazioni cimice avvengono per unione o separazione di atomi tra di loro.
3 Diapositiva 5 Modello di Tomson Campo elettrico in grado di deviare i raggi catodici, portando sostegno all ipotesi della loro natura corpuscolare. Con il suo esperimento, Tomson ciarì ce i raggi catodici erano particelle carice negativamente (elettroni) e riuscì a misurare il rapporto carica/massa. I suoi studi misero ance in evidenza l esistenza di altre particelle, di carica opposta e di massa molto maggiore. Nel 1898 Tomson formulò il primo modello atomico. Diapositiva 6 Elettroni immersi in un sottofondo di carica positiva uniformemente distribuita
4 Diapositiva 7 Modello di Ruterford Nel 1909 modello di Tomson in crisi: Ruterford evidenzia l esistenza del nucleo dell atomo Diapositiva 8 Il moto dell elettrone è il risultato dell equilibrio tra forza centrifuga e forza di attrazione elettrostatica: v m r Ze = 4πε o r (1) Energia dell elettrone (en. cinetica + en. potenziale elettrica): 1 E = mv Ze 4πε o r () Secondo la teoria classica l orbita di un elettrone in un atomo dovrebbe decadere per emissione di radiazione elettromagnetica Inoltre, i livelli energetici dell elettrone sono infiniti e questo non permetteva di spiegare gli spettri a rige La formula (1) riporta a sinistra la forza centripeta a cui è sottoposto l elettrone, mentre a destra è riportata la forza elettrostatica per un atomo con numero atomico Z. Le costanti sono : m = massa dell elettrone v = velocità dell elettrone r = distanza dell elettrone dal nucleo ε 0 = costante dielettrica nel vuoto
5 Diapositiva 9 Modello di Bor Nel 1913 Bor sviluppa un modello partendo da: Ruterford + teoria quantistica maturata da Planck Da (1) si ricava: mv = Ze 4πε o r (3) Ce sostituita nella () porge: E = 1 Ze Ze 1 Ze = 4πε r 4πε r 4πε r o o o (4) Diapositiva 10 Condizione di quantizzazione del momento angolare: L = mvr = n π (5) Con n=1,,3, = 6, J s Costante di Planck L elettrone ce ruota attorno al nucleo avrà un certo momento angolare, quantità ce è data dal prodotto della quantità di moto per la distanza della particella dal centro di riferimento. L idea di Bor è ce l elettrone non assuma qualsiasi valore del momento angolare, ma solo valori ben definiti, multipli interi della costante di Planck.
6 Diapositiva 11 Elevando al quadrato la (5): m v r = n 4π mv = n 4π mr ce sostituita nella (3): r n n ε o = (6) Raggi orbite permesse! πmze Es.: Z=1, n=1 si ottiene r 1 = m raggio di Bor Con semplici passaggi matematici, utilizzando le espressioni fin qui esposte, si ottiene una formula ce serve per calcolare i raggi delle orbite permesse degli elettroni, ce quindi non si possono trovare a una distanza qualsiasi dal nucleo. La (6) è una formula ce dipende esclusivamente dal numero atomico Z e dal numero quantico n. Diapositiva 1 Sostituendo la (6) nella (4): 4 4 mz e 1 me 18 En = dove: = 18, 10 J = 13, 6 ev 8ε 8ε o n o quindi: Z = 13.6 n E n ev (7) Energia di legame dell elettrone Dalla quantizzazione del momento angolare derivano la quantizzazione di r e di E Nota l espressione ce definisce il raggio di ogni orbita possibile per un elettrone, è facile calcolare l energia associata ad ogni orbita. Con le opportune conversioni fra unità di misura si ricava un espressione molto semplice ce dipende dal numero atomico Z e dal numero quantico n. In particolare, per un atomo di idrogeno (Z=1) l energia di legame dell elettrone è massima quando l elettrone si trova al livello n=1, ciamato ance livello fondamentale, e vale 13.6 ev, e diminuisce man mano ce l elettrone si sposta a livelli superiori, n > 1, e quindi man mano ce l elettrone viene a trovarsi più lontano dal nucleo.
7 Diapositiva 13 Seconda ipotesi di Bor: quando un elettrone passa da uno stato eccitato allo stato fondamentale l energia viene emessa sotto forma di paccetti: E E = ν 1 (8) Frequenza e lungezza d onda dell energia emessa dall atomo quantizzate Questo permetteva di spiegare la formazione delle rige spettrali Diapositiva 14 Esperimento di Frank e Hertz L esperimento (1914) conferma l ipotesi di Bor I livelli discreti di energia dell atomo sono stati per la prima volta mostrati direttamente nell esperimento di Frank e Hertz. In un tubo riempito di neon (in origine di mercurio) degli elettroni vengono emessi da un catodo e accelerati da un potenziale, poi rallentati da un potenziale contrario e raccolti dalla parte opposta per misurare la corrente. In un tubo vuoto la corrente crescerebbe linearmente all aumentare del potenziale, mentre questo non avviene se è presente un gas in quanto gli elettroni urtano contro gli atomi del gas. Si osserva ce la corrente cresce, ma quando gli elettroni anno abbastanza energia da eccitare i livelli di energia degli atomi del gas, la perdono in loro favore e la corrente diminuisce rapidamente fino ad un minimo. All aumentare del potenziale di nuovo la corrente cresce fincé gli elettroni eccitano il gas due volte. E questo processo va avanti in modo ripetitivo. La differenza di potenziale fra un minimo e un massimo è equivalente all energia del livello eccitato.
8 Diapositiva 15 Alla d.d.p. di 6 V la corrente cade a 0. Picci di corrente a ca. 4.9 V, 9.8 V, 14.7 V, ecc. Un atomo di Hg in uno stato eccitato torna allo stato fondamentale emettendo radiazione alla lungezza d onda di 35.6 nm, ce corrisponde ad un energia di : c E = ν = = λ 34 8 ( ) ( 3 10 ) 19 = J cioè ~5 ev L atomo assorbe energia per quantità discrete Diapositiva 16 Ipotesi di de Broglie Nel 194 de Broglie estese alla materia il concetto del dualismo onda-corpuscolo. Ad ogni particella materiale con quantità di moto p=mv deve essere associata un onda di lungezza d onda : λ = p Agli oggetti macroscopici corrispondono lungezze d onda praticamente nulle e non generano alcun effetto osservabile.
9 Diapositiva 17 Se un elettrone descrive indisturbato una certa orbita, ad esso deve essere associata un onda stazionaria, cioè un onda ce permanga invariata fino a ce l elettrone non cambia stato di moto. La lungezza dell orbita non può avere un valore arbitrario, ma deve essere un multiplo della λ associata all elettrone: πr =nλ Diapositiva 18 ma questo si scrive: π r = n p p=mv, per cui: π r = n mv mvr = n π Coincide con la regola di quantizzazione di Bor!
10 Diapositiva 19 Formula di Rydberg-Ritz Ritz Sperimentalmente, rige emesse dall idrogeno o dagli idrogenoidi raggruppate in serie con frequenze ben rappresentate dalla formula di Rydberg-Ritz (1890): 1 1 ν = RZ m n dove R è una costante (per l idrogeno R Hz), Z è il numero atomico e m e n due numeri naturali con n>m. Diapositiva 0 Ma il modello di Bor (formule 7 e 8) dice ce: E E ν = = Z = m n m n dove si è posto Z=1 per l atomo di idrogeno. Ponendo m=1, n=,3,4 si ottiene la serie di Lyman (ultravioletto). Ponendo m=, n=3,4,5 si ottiene la serie di Balmer (visibile). Ponendo m=3, n=4,5,6 si ottiene la serie di Pascen (infrarosso). m=4, n=5,6,7 serie di Brackett m=5, n=6,7,8 serie di Pfund
11 Diapositiva 1 Diapositiva Caso m=: n=3 ν= Hz da cui λ=656.3 nm, ossia Hα. n=4 Hβ (λ=486.1 nm) n=5 Hγ (λ=434.1 nm) n=6 Hδ (λ=410. nm)
12 Diapositiva 3
Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton)
 Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Le Caratteristiche della Luce
 7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
Teoria Atomica di Dalton
 Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Capitolo 8 La struttura dell atomo
 Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Questa unità descrive brevemente la natura duale (onda-particella) della luce attraverso la descrizione e spiegazione di alcuni fenomeni, quali : 1)
 Questa unità descrive brevemente la natura duale (onda-particella) della luce attraverso la descrizione e spiegazione di alcuni fenomeni, quali : 1) il principio di Huygens e il fenomeno dell interferenza,
Questa unità descrive brevemente la natura duale (onda-particella) della luce attraverso la descrizione e spiegazione di alcuni fenomeni, quali : 1) il principio di Huygens e il fenomeno dell interferenza,
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA
 LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
Lezione n. 13. Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo. di idrogeno. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 13 Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo di idrogeno Antonino Polimeno 1 Radiazione elettromagnetica (1) - Rappresentazione
Chimica Fisica Biotecnologie sanitarie Lezione n. 13 Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo di idrogeno Antonino Polimeno 1 Radiazione elettromagnetica (1) - Rappresentazione
MODELLO ATOMICO DI BOHR - ULTERIORI APPROFONDIMENTI
 MODELLO ATOMICO DI BOHR - ULTERIORI APPROFONDIMENTI Se riscaldiamo un qualsiasi elemento chimico ponendolo ad esempio su una fiamma, notiamo che esso emette un colore caratteristico. Ad esempio riscaldando
MODELLO ATOMICO DI BOHR - ULTERIORI APPROFONDIMENTI Se riscaldiamo un qualsiasi elemento chimico ponendolo ad esempio su una fiamma, notiamo che esso emette un colore caratteristico. Ad esempio riscaldando
Fenomeni quantistici
 Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
CORSO DI LAUREA IN OTTICA E OPTOMETRIA
 CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
Spettro elettromagnetico
 Spettro elettromagnetico Sorgenti Finestre Tipo Oggetti rilevabili Raggi γ ev Raggi X Lunghezza d onda E hc = hν = = λ 12. 39 λ( A o ) Visibile Infrarosso icro onde Onde-radio Dimensione degli oggetti
Spettro elettromagnetico Sorgenti Finestre Tipo Oggetti rilevabili Raggi γ ev Raggi X Lunghezza d onda E hc = hν = = λ 12. 39 λ( A o ) Visibile Infrarosso icro onde Onde-radio Dimensione degli oggetti
Generalità delle onde elettromagnetiche
 Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Produzione dei raggi X
 I RAGGI X Produzione dei raggi X Tubo a raggi X Emissione per frenamento Emissione per transizione Spettro di emissione pag.1 Lunghezza d onda, frequenza, energia (fm) λ (m) 10 14 RAGGI GAMMA ν 10 12 (Å)
I RAGGI X Produzione dei raggi X Tubo a raggi X Emissione per frenamento Emissione per transizione Spettro di emissione pag.1 Lunghezza d onda, frequenza, energia (fm) λ (m) 10 14 RAGGI GAMMA ν 10 12 (Å)
J.J. Thomson (1897): dimostra l esistenza dell elettrone E. Ruthenford (1911): dimostra l esistenza del nucleo
 STRUTTURA dell ATOMO J.J. Thomson (1897): dimostra l esistenza dell elettrone E. Ruthenford (1911): dimostra l esistenza del nucleo J. Chadwich (193): dimostra l esistenza del neutrone J.J. Thomson (1897):
STRUTTURA dell ATOMO J.J. Thomson (1897): dimostra l esistenza dell elettrone E. Ruthenford (1911): dimostra l esistenza del nucleo J. Chadwich (193): dimostra l esistenza del neutrone J.J. Thomson (1897):
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO
 La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
Pinzani, Panero, Bagni Sperimentare la chimica Soluzioni degli esercizi Capitolo 9
 Pinzani, Panero, Bagni Sperimentare la chimica Soluzioni degli esercizi Capitolo 9 Esercizio PAG 198 ES 1 PAG 198 ES 2 PAG 198 ES 3 PAG 198 ES 4 PAG 198 ES 5 PAG 198 ES 6 PAG 198 ES 7 PAG 198 ES 8 PAG
Pinzani, Panero, Bagni Sperimentare la chimica Soluzioni degli esercizi Capitolo 9 Esercizio PAG 198 ES 1 PAG 198 ES 2 PAG 198 ES 3 PAG 198 ES 4 PAG 198 ES 5 PAG 198 ES 6 PAG 198 ES 7 PAG 198 ES 8 PAG
L atomo di Bohr. Argomenti. Al tempo di Bohr. Spettri atomici 19/03/2010
 Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
L energia assorbita dall atomo durante l urto iniziale è la stessa del fotone che sarebbe emesso nel passaggio inverso, e quindi vale: m
 QUESITI 1 Quesito Nell esperimento di Rutherford, una sottile lamina d oro fu bombardata con particelle alfa (positive) emesse da una sorgente radioattiva. Secondo il modello atomico di Thompson le particelle
QUESITI 1 Quesito Nell esperimento di Rutherford, una sottile lamina d oro fu bombardata con particelle alfa (positive) emesse da una sorgente radioattiva. Secondo il modello atomico di Thompson le particelle
n(z) = n(0) e m gz/k B T ; (1)
 Corso di Introduzione alla Fisica Quantistica (f) Prova scritta 4 Luglio 008 - (tre ore a disposizione) [sufficienza con punti 8 circa di cui almeno 4 dagli esercizi nn. 3 e/o 4] [i bonus possono essere
Corso di Introduzione alla Fisica Quantistica (f) Prova scritta 4 Luglio 008 - (tre ore a disposizione) [sufficienza con punti 8 circa di cui almeno 4 dagli esercizi nn. 3 e/o 4] [i bonus possono essere
p e c = ev Å
 Corso di Introduzione alla Fisica Quantistica (f) Soluzioni Esercizi: Giugno 006 * Quale la lunghezza d onda di de Broglie di un elettrone che ha energia cinetica E 1 = KeV e massa a riposo m 0 = 9.11
Corso di Introduzione alla Fisica Quantistica (f) Soluzioni Esercizi: Giugno 006 * Quale la lunghezza d onda di de Broglie di un elettrone che ha energia cinetica E 1 = KeV e massa a riposo m 0 = 9.11
LASER. Light Amplification by Stimulated Emission of Radiation. Introduzione. Assorbimento, emissione spontanea, emissione stimolata
 LASER Light Amplification by Stimulated Emission of Radiation Introduzione. Assorbimento, emissione spontanea, emissione stimolata Cenni storici 1900 Max Planck introduce la teoria dei quanti (la versione
LASER Light Amplification by Stimulated Emission of Radiation Introduzione. Assorbimento, emissione spontanea, emissione stimolata Cenni storici 1900 Max Planck introduce la teoria dei quanti (la versione
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA. (Plank Einstein)
 L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
La complessa semplicità dell'atomo di idrogeno!
 La complessa semplicità dell'atomo di idrogeno Bergamo, venerdì 1 Febbraio 2013 Stefano Covino INAF - Osservatorio Astronomico di Brera Un po di terminologia Atomo (dal greco, indivisibile): atomismo (Leucippo,
La complessa semplicità dell'atomo di idrogeno Bergamo, venerdì 1 Febbraio 2013 Stefano Covino INAF - Osservatorio Astronomico di Brera Un po di terminologia Atomo (dal greco, indivisibile): atomismo (Leucippo,
CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI
 CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI Elettrici I anno - III Quadr. a.acc. 2006/07 Laboratorio: Laboratorio Materiali piano S-1 26/04/2007 Chimica e Scienza e Tecnologia dei Materiali
CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI Elettrici I anno - III Quadr. a.acc. 2006/07 Laboratorio: Laboratorio Materiali piano S-1 26/04/2007 Chimica e Scienza e Tecnologia dei Materiali
Teoria atomica. Dr. Lucia Tonucci Ingegneria delle Costruzioni
 Teoria atomica Dr. Lucia Tonucci l.tonucci@unich.it Ingegneria delle Costruzioni Cenni storici V Sec. a.c. Democrito: la materia è costituita da corpuscoli indivisibili, gli atomi (atomo = indivisibile)
Teoria atomica Dr. Lucia Tonucci l.tonucci@unich.it Ingegneria delle Costruzioni Cenni storici V Sec. a.c. Democrito: la materia è costituita da corpuscoli indivisibili, gli atomi (atomo = indivisibile)
Lezione n. 19. L equazione. di Schrodinger L atomo. di idrogeno Orbitali atomici. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Radioattività. 1. Massa dei nuclei. 2. Decadimenti nucleari. 3. Legge del decadimento XVI - 0. A. Contin - Fisica Generale Avanzata
 Radioattività 1. Massa dei nuclei 2. Decadimenti nucleari 3. Legge del decadimento XVI - 0 Nucleoni Protoni e neutroni sono chiamati, indifferentemente, nucleoni. Il numero di protoni (e quindi di elettroni
Radioattività 1. Massa dei nuclei 2. Decadimenti nucleari 3. Legge del decadimento XVI - 0 Nucleoni Protoni e neutroni sono chiamati, indifferentemente, nucleoni. Il numero di protoni (e quindi di elettroni
Elettricità e Fisica Moderna
 Esercizi di fisica per Medicina C.Patrignani, Univ. Genova (rev: 9 Ottobre 2003) 1 Elettricità e Fisica Moderna 1) Una candela emette una potenza di circa 1 W ad una lunghezza d onda media di 5500 Å a)
Esercizi di fisica per Medicina C.Patrignani, Univ. Genova (rev: 9 Ottobre 2003) 1 Elettricità e Fisica Moderna 1) Una candela emette una potenza di circa 1 W ad una lunghezza d onda media di 5500 Å a)
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
FISICA QUANTISTICA LIMITI AL MODELLO ATOMICO DI RUTHERFORD. e - Per spiegare la disposizione degli elettroni nell atomo (STRUTTURA ELETTRONICA)
 LIMITI AL MODELLO ATOMICO DI RUTHERFORD e - + nucleo In base alle leggi della FISICA CLASSICA, una particella carica dotata di un movimento circolare libera energia. Di conseguenza, gli elettroni che,
LIMITI AL MODELLO ATOMICO DI RUTHERFORD e - + nucleo In base alle leggi della FISICA CLASSICA, una particella carica dotata di un movimento circolare libera energia. Di conseguenza, gli elettroni che,
P. Sapia Università della Calabria. a.a. 2009/10
 FISICA PER I BENI CULTURALI Ii MATERIA E INTERAZIONE CON LA RADIAZIONE P. Sapia Università della Calabria a.a. 2009/10 Interazioni fondamentali Gravitazionale Debolmente attrattiva, tra tutte le particelle
FISICA PER I BENI CULTURALI Ii MATERIA E INTERAZIONE CON LA RADIAZIONE P. Sapia Università della Calabria a.a. 2009/10 Interazioni fondamentali Gravitazionale Debolmente attrattiva, tra tutte le particelle
Università Primo Levi
 Università Primo Levi Primo Levi 2013 Le forze fondamentali e la fisica dei quanta INAF Osservatorio Astronomico di Bologna via Ranzani, 1 40127 - Bologna - Italia Tel, 051-2095721 Fax, 051-2095700 http://www.bo.astro.it/~bedogni/primolevi
Università Primo Levi Primo Levi 2013 Le forze fondamentali e la fisica dei quanta INAF Osservatorio Astronomico di Bologna via Ranzani, 1 40127 - Bologna - Italia Tel, 051-2095721 Fax, 051-2095700 http://www.bo.astro.it/~bedogni/primolevi
Fisica atomica. Marcello Borromeo corso di Fisica per Farmacia - Anno Accademico
 Fisica atomica Nel 1905 Einstein sostiene che la luce viaggia in pacchetti di energia, chiamati fotoni Ogni fotone ha energia proporzionale alla propria frequenza E = hν: h = 6.626 10 34 J s è chiamata
Fisica atomica Nel 1905 Einstein sostiene che la luce viaggia in pacchetti di energia, chiamati fotoni Ogni fotone ha energia proporzionale alla propria frequenza E = hν: h = 6.626 10 34 J s è chiamata
Il corpo nero e l ipotesi di Planck
 Il corpo nero e l ipotesi di Planck La crisi della fisica classica Alla fine del XIX secolo ci sono ancora del fenomeni che la fisica classica non riesce a spiegare: lo spettro d irraggiamento del corpo
Il corpo nero e l ipotesi di Planck La crisi della fisica classica Alla fine del XIX secolo ci sono ancora del fenomeni che la fisica classica non riesce a spiegare: lo spettro d irraggiamento del corpo
1. La struttura atomica Le particelle subatomiche L atomo, per molti secoli ritenuto indivisibile, è formato da particelle più piccole.
 1. La struttura atomica Le particelle subatomiche L atomo, per molti secoli ritenuto indivisibile, è formato da particelle più piccole. Le particelle fondamentali che costituiscono l atomo sono: Il protone,
1. La struttura atomica Le particelle subatomiche L atomo, per molti secoli ritenuto indivisibile, è formato da particelle più piccole. Le particelle fondamentali che costituiscono l atomo sono: Il protone,
Il metodo scientifico
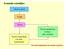 Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi stato fondamentale stati eccitati
 4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi Accanto allo spettro continuo che i corpi emettono in ragione del loro stato termico, si osservano spettri discreti che sono caratteristici
4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi Accanto allo spettro continuo che i corpi emettono in ragione del loro stato termico, si osservano spettri discreti che sono caratteristici
La teoria del corpo nero
 La teoria del corpo nero Max Planck Primo Levi 2014 Roberto Bedogni INAF Osservatorio Astronomico di Bologna via Ranzani, 1 40127 - Bologna - Italia Tel, 051-2095721 Fax, 051-2095700 http://www.bo.astro.it/~bedogni/primolevi
La teoria del corpo nero Max Planck Primo Levi 2014 Roberto Bedogni INAF Osservatorio Astronomico di Bologna via Ranzani, 1 40127 - Bologna - Italia Tel, 051-2095721 Fax, 051-2095700 http://www.bo.astro.it/~bedogni/primolevi
Modelli atomici. Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle.
 Modelli atomici Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle. Presupposti 1. Legge di Lavoisier della conservazione della massa: in una reazione chimica nulla si
Modelli atomici Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle. Presupposti 1. Legge di Lavoisier della conservazione della massa: in una reazione chimica nulla si
Struttura Elettronica degli Atomi Meccanica quantistica
 Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
Capitolo 2. Cenni alla Composizione e Struttura dell atomo
 Master in Verifiche di qualità in radiodiagnostica, medicina nucleare e radioterapiar Capitolo 2 Cenni alla Composizione e Struttura dell atomo 24 Atomi, Molecole,, e Ioni L idea di Atomo è antica come
Master in Verifiche di qualità in radiodiagnostica, medicina nucleare e radioterapiar Capitolo 2 Cenni alla Composizione e Struttura dell atomo 24 Atomi, Molecole,, e Ioni L idea di Atomo è antica come
Corso di CHIMICA LEZIONE 2
 Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
approfondimento Struttura atomica e conservazione della carica nei fenomeni elettrici
 approfondimento Struttura atomica e conservazione della carica nei fenomeni elettrici Flusso del campo elettrico e legge di Gauss: Il campo elettrico generato da distribuzioni di carica a simmetria sferica
approfondimento Struttura atomica e conservazione della carica nei fenomeni elettrici Flusso del campo elettrico e legge di Gauss: Il campo elettrico generato da distribuzioni di carica a simmetria sferica
La fisica del XX secolo ovvero la tecnologia consente di eseguire esperimenti sempre più spinti e. tutto deve essere messo in discussione
 ovvero la tecnologia consente di eseguire esperimenti sempre più spinti e. tutto deve essere messo in discussione The fundamental cause of the trouble is that in the modern world the stupid are cocksure
ovvero la tecnologia consente di eseguire esperimenti sempre più spinti e. tutto deve essere messo in discussione The fundamental cause of the trouble is that in the modern world the stupid are cocksure
May 5, 2013. Fisica Quantistica. Monica Sambo. Sommario
 May 5, 2013 Bohr, Born,, Dirac e Pauli accettano in modo incondizionato la nuova fisica Einstein, De, e pur fornendo importanti contributi alla nuova teoria cercano di ottenere una descrizione CAUSALE
May 5, 2013 Bohr, Born,, Dirac e Pauli accettano in modo incondizionato la nuova fisica Einstein, De, e pur fornendo importanti contributi alla nuova teoria cercano di ottenere una descrizione CAUSALE
Theory Italiano (Italy)
 Q3-1 Large Hadron Collider (10 punti) Prima di iniziare questo problema, leggi le istruzioni generali nella busta a parte. In questo problema è discussa la fisica dell acceleratore di particelle del CERN
Q3-1 Large Hadron Collider (10 punti) Prima di iniziare questo problema, leggi le istruzioni generali nella busta a parte. In questo problema è discussa la fisica dell acceleratore di particelle del CERN
Tabella periodica degli elementi
 Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
La nascita della fisica moderna. (un racconto di inizio 900)
 La nascita della fisica moderna (un racconto di inizio 900) Sviluppo storico della fisica tra fine 800 e il 1927 Fisica sperimentale fine 800 Fisica teorica fine 800 1900 1905 1911 1913 1916 1924 1925-1927
La nascita della fisica moderna (un racconto di inizio 900) Sviluppo storico della fisica tra fine 800 e il 1927 Fisica sperimentale fine 800 Fisica teorica fine 800 1900 1905 1911 1913 1916 1924 1925-1927
Spettroscopia. Spettroscopia
 Spettroscopia Spettroscopia IR Spettroscopia NMR Spettrometria di massa 1 Spettroscopia E un insieme di tecniche che permettono di ottenere informazioni sulla struttura di una molecola attraverso l interazione
Spettroscopia Spettroscopia IR Spettroscopia NMR Spettrometria di massa 1 Spettroscopia E un insieme di tecniche che permettono di ottenere informazioni sulla struttura di una molecola attraverso l interazione
F = q E + q v x B, dove v è la velocità di q. Il campo magnetico non agisce su una carica q ferma. Unità di misura: [E] = N/C = V/m, [B] = T.
![F = q E + q v x B, dove v è la velocità di q. Il campo magnetico non agisce su una carica q ferma. Unità di misura: [E] = N/C = V/m, [B] = T. F = q E + q v x B, dove v è la velocità di q. Il campo magnetico non agisce su una carica q ferma. Unità di misura: [E] = N/C = V/m, [B] = T.](/thumbs/62/47096822.jpg) CAMPI ELETTRICI E MAGNETICI La presenza di cariche modifica le proprietà dello spazio. Questa modifica viene quantificata assegnando due campi vettoriali: il campo elettrico E ed il campo magnetico B.
CAMPI ELETTRICI E MAGNETICI La presenza di cariche modifica le proprietà dello spazio. Questa modifica viene quantificata assegnando due campi vettoriali: il campo elettrico E ed il campo magnetico B.
L atomo. Il neutrone ha una massa 1839 volte superiore a quella dell elettrone. 3. Le particelle fondamentali dell atomo
 L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
Quantum Theory. E la natura dell'atomo. M. Orlandelli, A. Peloni
 Quantum Theory E la natura dell'atomo M. Orlandelli, A. Peloni Quantum Mechanics: prime idee (inizio 1900) A. Einstein: Effetto fotoelettrico C. Maxwell Equazioni delle onde elettromagnetiche M. Planck:
Quantum Theory E la natura dell'atomo M. Orlandelli, A. Peloni Quantum Mechanics: prime idee (inizio 1900) A. Einstein: Effetto fotoelettrico C. Maxwell Equazioni delle onde elettromagnetiche M. Planck:
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni
 CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni composto materia sostanza pura miscela omogenea elemento eterogenea Elementi, Composti e Miscele Miscela eterogenea
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni composto materia sostanza pura miscela omogenea elemento eterogenea Elementi, Composti e Miscele Miscela eterogenea
La Teoria dei Quanti e la Struttura Elettronica degli Atomi. Capitolo 7
 La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA
 pg 1 STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA Per capire il comportamento degli atomi dobbiamo studiare il comportamento dei suoi elettroni L'atomo e le sue particelle NON sono direttamente visibili
pg 1 STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA Per capire il comportamento degli atomi dobbiamo studiare il comportamento dei suoi elettroni L'atomo e le sue particelle NON sono direttamente visibili
Dalla struttura fine delle transizioni atomiche allo spin dell elettrone
 Dalla struttura fine delle transizioni atomiche allo spin dell elettrone Evidenze sperimentali Struttura fine delle transizioni atomiche (doppietto( del sodio) Esperimento di Stern-Gerlach Effetto Zeeman
Dalla struttura fine delle transizioni atomiche allo spin dell elettrone Evidenze sperimentali Struttura fine delle transizioni atomiche (doppietto( del sodio) Esperimento di Stern-Gerlach Effetto Zeeman
L atomo di idrogeno (1) H T = p2 1 2m 1. + p2 2 2m 2. + V ( r 1 r 2 ) (2) Definiamo le nuove variabili: 1. La massa totale M M = m 1 + m 2 (3)
 L atomo di idrogeno Il problema dell atomo di idrogeno é un problema esattamente risolubili ed i suoi risultati possono essere estesi agli atomi idrogenoidi, in cui solo c é solo un elettrone sottoposto
L atomo di idrogeno Il problema dell atomo di idrogeno é un problema esattamente risolubili ed i suoi risultati possono essere estesi agli atomi idrogenoidi, in cui solo c é solo un elettrone sottoposto
La struttura della materia
 La struttura della materia IL CORPO NERO In fisica, i corpi solidi o liquidi emettono radiazioni elettromagnetiche, a qualsiasi temperatura. Il corpo nero, invece, è un oggetto ideale che assorbe tutta
La struttura della materia IL CORPO NERO In fisica, i corpi solidi o liquidi emettono radiazioni elettromagnetiche, a qualsiasi temperatura. Il corpo nero, invece, è un oggetto ideale che assorbe tutta
5) Modello atomico di BOHR
 5) Modello atomico di BOHR (pag.92 par.3 - parziale- ) PREMESSA: LIMITI DEL MODELLO DI RUTHERFORD Il modello planetario dell atomo sostenuto da Rutherford si adattava bene a molti dati sperimentali ma
5) Modello atomico di BOHR (pag.92 par.3 - parziale- ) PREMESSA: LIMITI DEL MODELLO DI RUTHERFORD Il modello planetario dell atomo sostenuto da Rutherford si adattava bene a molti dati sperimentali ma
Bohr e la struttura dell atomo. Lezioni 11-12
 Bohr e la struttura dell atomo Lezioni 11-12 Onde elettromagnetiche Radiazione Elettromagnetica raggi X e raggi > 10 3 Hz
Bohr e la struttura dell atomo Lezioni 11-12 Onde elettromagnetiche Radiazione Elettromagnetica raggi X e raggi > 10 3 Hz
Sulla superficie interna del guscio sferico (induzione totale) si avrà la carica indotta q distribuita uniformemente, quindi
 1) Una sfera conduttrice di raggio r = 5 cm possiede una carica q = 10 8 C ed è posta nel centro di un guscio sferico conduttore, di raggio interno R = 20 cm, posto in contatto con la terra (a massa).
1) Una sfera conduttrice di raggio r = 5 cm possiede una carica q = 10 8 C ed è posta nel centro di un guscio sferico conduttore, di raggio interno R = 20 cm, posto in contatto con la terra (a massa).
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI I numeri quantici Le funzioni d onda Ψ n, soluzioni dell equazione d onda, sono caratterizzate da certe combinazioni di numeri quantici: n, l, m l, m s n = numero quantico principale,
GLI ORBITALI ATOMICI I numeri quantici Le funzioni d onda Ψ n, soluzioni dell equazione d onda, sono caratterizzate da certe combinazioni di numeri quantici: n, l, m l, m s n = numero quantico principale,
2.1 (p. 37) Bohr descrisse un orbitale atomico come una traiettoria circolare seguita dall elettrone. Un orbitale è una
 Capitolo 2 Risposte alle Domande ed esercizi inclusi nel Capitolo 2.1 (p. 37) Bohr descrisse un orbitale atomico come una traiettoria circolare seguita dall elettrone. Un orbitale è una regione di spazio
Capitolo 2 Risposte alle Domande ed esercizi inclusi nel Capitolo 2.1 (p. 37) Bohr descrisse un orbitale atomico come una traiettoria circolare seguita dall elettrone. Un orbitale è una regione di spazio
Storia della meccanica quantistica
 Storia della meccanica quantistica Prof. Daniele Ippolito Liceo Scientifico Amedeo di Savoia di Pistoia La quantizzazione della luce La quantizzazione della materia La nuova meccanica quantistica La quantizzazione
Storia della meccanica quantistica Prof. Daniele Ippolito Liceo Scientifico Amedeo di Savoia di Pistoia La quantizzazione della luce La quantizzazione della materia La nuova meccanica quantistica La quantizzazione
3. Struttura dell atomo
 Di cosa parleremo L organizzazione interna delle particelle che costituiscono gli atomi è stata oggetto di studio per lungo tempo e le ipotesi sulla struttura atomica si sono evolute nel tempo in base
Di cosa parleremo L organizzazione interna delle particelle che costituiscono gli atomi è stata oggetto di studio per lungo tempo e le ipotesi sulla struttura atomica si sono evolute nel tempo in base
Il principio di indeterminazione di Heisenberg
 Il principio di indeterminazione di Heisenberg Il prodotto degli errori nella determinazione contemporanea della quantità di moto (q = mv) e della posizione di un corpo in movimento è almeno uguale a h
Il principio di indeterminazione di Heisenberg Il prodotto degli errori nella determinazione contemporanea della quantità di moto (q = mv) e della posizione di un corpo in movimento è almeno uguale a h
Fisica atomica CAPITOLO. Contenuti
 CAPITOLO 3 Fisica atomica In alcune meduse, ad esempio nella Aequorea victoria mostrata nella fotografia, è presente una particolare proteina, la GFP, dall inglese Green Fluorescent Protein, che consente
CAPITOLO 3 Fisica atomica In alcune meduse, ad esempio nella Aequorea victoria mostrata nella fotografia, è presente una particolare proteina, la GFP, dall inglese Green Fluorescent Protein, che consente
Radiazione e Materia. Insegnamento di Chimica Generale CCS CHI e MAT. Scuola di Ingegneria Industriale e dell Informazione
 Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Radiazione e Materia Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio
Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Radiazione e Materia Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio
- + MODELLI ATOMICI + + Particelle subatomiche
 MODELLI ATOMICI Particelle subatomiche L atomo è costituito da due zone: il NUCLEO, formato al suo interno da due tipi di particelle subatomiche, ovvero particelle ancora più piccole dell atomo (i protoni
MODELLI ATOMICI Particelle subatomiche L atomo è costituito da due zone: il NUCLEO, formato al suo interno da due tipi di particelle subatomiche, ovvero particelle ancora più piccole dell atomo (i protoni
Particelle Subatomiche
 GLI ATOMI Particelle Subatomiche ELEMENTI I diversi atomi sono caratterizzati da un diverso numero di protoni e neutroni; il numero di elettroni è sempre uguale al numero dei protoni (negli atomi neutri)
GLI ATOMI Particelle Subatomiche ELEMENTI I diversi atomi sono caratterizzati da un diverso numero di protoni e neutroni; il numero di elettroni è sempre uguale al numero dei protoni (negli atomi neutri)
ESERCIZI W X Y Z. Numero di massa Neutroni nel nucleo Soluzione
 ESERCIZI 1) La massa di un elettrone, rispetto a quella di un protone, è: a. uguale b. 1850 volte più piccola c. 100 volte più piccola d. 18,5 volte più piccola 2) I raggi catodici sono: a. radiazioni
ESERCIZI 1) La massa di un elettrone, rispetto a quella di un protone, è: a. uguale b. 1850 volte più piccola c. 100 volte più piccola d. 18,5 volte più piccola 2) I raggi catodici sono: a. radiazioni
E noto che la luce, o radiazione elettromagnetica, si propaga sottoforma di onde. Un onda è caratterizzata da due parametri legati fra loro: la
 1 E noto che la luce, o radiazione elettromagnetica, si propaga sottoforma di onde. Un onda è caratterizzata da due parametri legati fra loro: la lunghezza d onda ( ), definita come la distanza fra due
1 E noto che la luce, o radiazione elettromagnetica, si propaga sottoforma di onde. Un onda è caratterizzata da due parametri legati fra loro: la lunghezza d onda ( ), definita come la distanza fra due
Materia e radiazione. Lezione 6
 Materia e radiazione Lezione 6 Sommario Luce e radiazione: come estrarre l informazione fisica dalla luce delle stelle. La radiazione di corpo nero: leggi di Wien e di Stefan. Struttura Atomica: nucleo
Materia e radiazione Lezione 6 Sommario Luce e radiazione: come estrarre l informazione fisica dalla luce delle stelle. La radiazione di corpo nero: leggi di Wien e di Stefan. Struttura Atomica: nucleo
Lezione simulata: il modello atomico di Bohr
 : il modello atomico di Bohr Emanuele Biolcati Prova orale concorso docenti classe A020 18 agosto 2016 Emanuele Biolcati 1 Sommario Introduzione 1 Introduzione Contesto e finalità Modalità di lezione e
: il modello atomico di Bohr Emanuele Biolcati Prova orale concorso docenti classe A020 18 agosto 2016 Emanuele Biolcati 1 Sommario Introduzione 1 Introduzione Contesto e finalità Modalità di lezione e
Lezione 5: Primi modelli atomici
 Corso di Fisica moderna di base Modulo 1: Elementi di Struttura della Materia ATTENZIONE: LE SEGUENTI PAGINE SONO INTESE COME UNO SCHEMATICO RIASSUNTO DI QUANTO TRATTATO IN AULA, NON PRETENDONO DI ESSERE
Corso di Fisica moderna di base Modulo 1: Elementi di Struttura della Materia ATTENZIONE: LE SEGUENTI PAGINE SONO INTESE COME UNO SCHEMATICO RIASSUNTO DI QUANTO TRATTATO IN AULA, NON PRETENDONO DI ESSERE
MISURA DELLA MASSA DELL ELETTRONE
 MISURA DELLA MASSA DELL ELETTRONE di Arianna Carbone, Giorgia Fortuna, Nicolò Spagnolo Liceo Scientifico Farnesina Roma Interazioni tra elettroni e fotoni Per misurare la massa dell elettrone abbiamo sfruttato
MISURA DELLA MASSA DELL ELETTRONE di Arianna Carbone, Giorgia Fortuna, Nicolò Spagnolo Liceo Scientifico Farnesina Roma Interazioni tra elettroni e fotoni Per misurare la massa dell elettrone abbiamo sfruttato
Concorso di ammissione al primo anno, a.a. 2006/07 Prova scritta di fisica
 Concorso di ammissione al primo anno, a.a. 2006/07 Prova scritta di fisica Corsi di laurea in Fisica, Informatica e Matematica. 1) Si osserva che una stella collassata (pulsar) ruota attorno al suo asse
Concorso di ammissione al primo anno, a.a. 2006/07 Prova scritta di fisica Corsi di laurea in Fisica, Informatica e Matematica. 1) Si osserva che una stella collassata (pulsar) ruota attorno al suo asse
Modello atomico. di Bohr
 Modello atomico di Bohr Bohr e lo spettro a righe dell Idrogeno Visto il successo ottenuto nella risoluzione del problema del corpo nero e dell'effetto fotoelettrico, attraverso l'introduzione nel formalismo
Modello atomico di Bohr Bohr e lo spettro a righe dell Idrogeno Visto il successo ottenuto nella risoluzione del problema del corpo nero e dell'effetto fotoelettrico, attraverso l'introduzione nel formalismo
Le particelle dell atomo
 La carica elettrica I fenomeni elettrici sono noti fin dall antichità: gli antichi Greci usavano la parola elektron per spiegare il fenomeno dell elettrizzazione dell ambra. I Greci sapevano che strofinando
La carica elettrica I fenomeni elettrici sono noti fin dall antichità: gli antichi Greci usavano la parola elektron per spiegare il fenomeno dell elettrizzazione dell ambra. I Greci sapevano che strofinando
La Meccanica Quantistica
 La Meccanica Quantistica Se quando pensiamo a un atomo ci immaginiamo qualcosa di questo tipo Dobbiamo rivedere le nostre idee LA CRISI DELLA FISICA CLASSICA La crisi della fisica classica Un secolo fa
La Meccanica Quantistica Se quando pensiamo a un atomo ci immaginiamo qualcosa di questo tipo Dobbiamo rivedere le nostre idee LA CRISI DELLA FISICA CLASSICA La crisi della fisica classica Un secolo fa
Sottodiscipline della Chimica Fisica Storicamente
 Sottodiscipline della Chimica Fisica Storicamente Termodinamica Chimica. Si occupa di tutti i processi (principalmente macroscopici) legati all energia e al suo scambio, nelle varie forme che esso può
Sottodiscipline della Chimica Fisica Storicamente Termodinamica Chimica. Si occupa di tutti i processi (principalmente macroscopici) legati all energia e al suo scambio, nelle varie forme che esso può
Quarta unità didattica. Disposizione degli elettroni nell atomo
 Quarta unità didattica Disposizione degli elettroni nell atomo Modello atomico di Bohr 1913 L' atomo di Borh consiste in un nucleo di carica positiva al quale ruotano intorno gli elettroni di carica negativa
Quarta unità didattica Disposizione degli elettroni nell atomo Modello atomico di Bohr 1913 L' atomo di Borh consiste in un nucleo di carica positiva al quale ruotano intorno gli elettroni di carica negativa
FISICA MODERNA per allievi di Matematica, Fisica Computazionale e Informatica (De Angelis)
 Università di Udine Facoltà di Scienze Matematiche, Fisiche e Naturali FISICA MODERNA per allievi di Matematica, Fisica Computazionale e Informatica (De Angelis) Appunti per il corso dell A.A. 2002/2003
Università di Udine Facoltà di Scienze Matematiche, Fisiche e Naturali FISICA MODERNA per allievi di Matematica, Fisica Computazionale e Informatica (De Angelis) Appunti per il corso dell A.A. 2002/2003
Capitolo 12. Moto oscillatorio
 Moto oscillatorio INTRODUZIONE Quando la forza che agisce su un corpo è proporzionale al suo spostamento dalla posizione di equilibrio ne risulta un particolare tipo di moto. Se la forza agisce sempre
Moto oscillatorio INTRODUZIONE Quando la forza che agisce su un corpo è proporzionale al suo spostamento dalla posizione di equilibrio ne risulta un particolare tipo di moto. Se la forza agisce sempre
IL MODELLO ATOMICO DI BOHR
 IL MODELLO ATOMICO DI BOHR LA LUCE Un valido contributo alla comprensione della struttura dell atomo venne dato dallo studio delle radiazioni luminose emesse dagli atomi opportunamente sollecitati. Lo
IL MODELLO ATOMICO DI BOHR LA LUCE Un valido contributo alla comprensione della struttura dell atomo venne dato dallo studio delle radiazioni luminose emesse dagli atomi opportunamente sollecitati. Lo
Chimica e laboratorio
 Chimica e laboratorio L atomo: configurazione elettronica Classi Terze Lic. Sc. Tecnologico Anno Scolastico 2007/2008 Prerequisiti Conoscere l evoluzione delle conoscenze sulla costituzione dell atomo,
Chimica e laboratorio L atomo: configurazione elettronica Classi Terze Lic. Sc. Tecnologico Anno Scolastico 2007/2008 Prerequisiti Conoscere l evoluzione delle conoscenze sulla costituzione dell atomo,
Tabella 1 80,0 5,7 70,0 5,0 60,0 4,3 50,0 3,6 40,0 2,9 30,0 2,2 20,0 1,5 10,0 0,9 5,0 0,5
 PROBLEMA 1 Un piccolo magnete permanente di massa viene lasciato cadere liberamente in un tubo verticale e fisso, di materiale isolante come il plexiglas; si osserva che esso cade con la stessa accelerazione
PROBLEMA 1 Un piccolo magnete permanente di massa viene lasciato cadere liberamente in un tubo verticale e fisso, di materiale isolante come il plexiglas; si osserva che esso cade con la stessa accelerazione
Come superare le critiche al modello di Bohr? 1 1
 Comportamento corpuscolare degli elettroni Parecchi dati sperimentali avevano già evidenziato come gli elettroni fossero delle particelle cariche negativamente Come superare le critiche al modello di Bohr?
Comportamento corpuscolare degli elettroni Parecchi dati sperimentali avevano già evidenziato come gli elettroni fossero delle particelle cariche negativamente Come superare le critiche al modello di Bohr?
Dai primi modelli alla teoria moderna
 MODELLI ATOMICI Dai primi modelli alla teoria moderna I modelli atomici nacquero, dall'intuizione di alcuni scienziati di fronte all'impossibilità di interpretare in modo semplice i fenomeni complessi.
MODELLI ATOMICI Dai primi modelli alla teoria moderna I modelli atomici nacquero, dall'intuizione di alcuni scienziati di fronte all'impossibilità di interpretare in modo semplice i fenomeni complessi.
Quadro di Riferimento della II prova di Fisica dell esame di Stato per i Licei Scientifici
 Quadro di Riferimento della II prova di Fisica dell esame di Stato per i Licei Scientifici Il presente documento individua le conoscenze, abilità e competenze che lo studente dovrà aver acquisito al termine
Quadro di Riferimento della II prova di Fisica dell esame di Stato per i Licei Scientifici Il presente documento individua le conoscenze, abilità e competenze che lo studente dovrà aver acquisito al termine
S P E T T R O S C O P I A. Dispense di Chimica Fisica per Biotecnologie Dr.ssa Rosa Terracciano
 S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
TEORIA QUANTISTICA E STRUTTURA ATOMICA
 TEORIA QUANTISTICA E STRUTTURA ATOMICA Gli argomenti di queste lezioni sono trattati nel Capitolo 7 del testo e nei paragrafi 1, e 3 del Capitolo 8. Non ci sono parti da non considerare. La moderna definizione
TEORIA QUANTISTICA E STRUTTURA ATOMICA Gli argomenti di queste lezioni sono trattati nel Capitolo 7 del testo e nei paragrafi 1, e 3 del Capitolo 8. Non ci sono parti da non considerare. La moderna definizione
Cognome Nome Matricola
 Cognome Nome Matricola DOCENTE Energetica Biomedica DM 270 Elettronica Informazione Informatica DM509 Problema 1 Nel circuito di figura (a) i resistori hanno valori tali che R 1 / = 2 e i condensatori
Cognome Nome Matricola DOCENTE Energetica Biomedica DM 270 Elettronica Informazione Informatica DM509 Problema 1 Nel circuito di figura (a) i resistori hanno valori tali che R 1 / = 2 e i condensatori
il modello atomico di Bohr
 il modello atomico di Bohr Lo scienziato Niels Bohr, ospite nel laboratorio di Rutherford a Manchester ma anche allievo di Planck, nel 93 pubblicò alcuni saggi in cui, accettando il modello planetario
il modello atomico di Bohr Lo scienziato Niels Bohr, ospite nel laboratorio di Rutherford a Manchester ma anche allievo di Planck, nel 93 pubblicò alcuni saggi in cui, accettando il modello planetario
Struttura dell atomo atomo particelle sub-atomiche - protoni positiva - neutroni } nucleoni - elettroni negativa elemento
 Struttura dell atomo L atomo è la più piccola parte dell elemento che conserva le proprietà dell elemento Negli atomi ci sono tre diverse particelle sub-atomiche: - protoni (con carica positiva unitaria)
Struttura dell atomo L atomo è la più piccola parte dell elemento che conserva le proprietà dell elemento Negli atomi ci sono tre diverse particelle sub-atomiche: - protoni (con carica positiva unitaria)
La struttura elettronica degli atomi
 1 In unità atomiche: a 0 me 0,59A unità di lunghezza e H 7, ev a H=Hartree unità di energia L energia dell atomo di idrogeno nello stato fondamentale espresso in unità atomiche è: 4 0 me 1 e 1 E H 13,
1 In unità atomiche: a 0 me 0,59A unità di lunghezza e H 7, ev a H=Hartree unità di energia L energia dell atomo di idrogeno nello stato fondamentale espresso in unità atomiche è: 4 0 me 1 e 1 E H 13,
TECNICHE SPETTROSCOPICHE
 TECNICHE SPETTROSCOPICHE L interazione delle radiazioni elettromagnetiche con la materia e essenzialmente un fenomeno quantico, che dipende sia dalle proprieta della radiazione sia dalla natura della materia
TECNICHE SPETTROSCOPICHE L interazione delle radiazioni elettromagnetiche con la materia e essenzialmente un fenomeno quantico, che dipende sia dalle proprieta della radiazione sia dalla natura della materia
CHIMICA: studio della struttura e delle trasformazioni della materia
 CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
