Applicazione del principio di conservazione dell energia a sistemi aventi un gran numero di particelle.
|
|
|
- Tiziano Villa
- 6 anni fa
- Visualizzazioni
Transcript
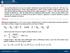
1 PRIMO PRINCIPIO DLLA RMODINAMICA In una trasformazione adiabatia: In una trasformazione isoora: L In una trasformazione generia: L (7) (Primo riniio della termodinamia) Aliazione del riniio di onservazione dell energia a sistemi aventi un gran numero di artielle. N.B.: La (7) è una forma ridotta del riniio generale di onservazione dell energia: non inlude il termine relativo a ossibili variazioni di energia inetia he si avrebbe se il entro di massa del sistema fosse in moto risetto al riferimento del laboratorio.
2 è una funzione di stato (diende soltanto dallo stato del sistema). diende soltanto dallo stato iniziale (A) e finale (B) ma non dalla trasformazione. L diende non solo dallo stato iniziale e finale ma anhe dalla trasformazione. L si omorta ome L Per una trasformazione infinitesima: d dl d dove dl e d sono quantità infinitesime e non differenziali esatti (d invee lo è).
3 CALOR SPCIFICO DI SOLIDI In un solido ogni atomo uò osillare orno alla osizione di equilibrio in tre direzioni indiendenti. Ciò imlia: nergia inetia on 3 termini quadratii (1/ m v x, 1/ m v y, 1/ m v z ) nergia otenziale on altri 3 termini quadratii (1/ k x, 1/ k y, 1/ k z ) uindi: Ogni atomo ossiede 6 gradi di libertà. L energia erna di un solido ostituito da N atomi ed n moli, er il teorema di equiartizione dell energia, vale: 1 6N ( k ) ( n N A)(3 k ) 3 n R Se si fornise al solido una quantità di alore, aumentando la sua temeratura di, la variazione di energia erna è: 3 nr Per il rimo riniio della termodinamia, essendo nullo il lavoro omiuto sul sistema, si ottiene: L 3 nr
4 Per la definizione di alore seifio molare, si ha quindi: 3 n R 3R n n ssendo R = 8.31 J/(mol K), si riava in definitiva he: 5 J/(mol K), in aordo on quanto trovato da Dulong e Petit (valore asotio del alore seifio molare alle alte temerature).
5 CALORI SPCIFICI DI UN GAS IDAL Il gas ideale è un tiio esemio in ui il valore del alore seifio diende dalla trasformazione. Calore seifio molare a volume ostante Si definise alore seifio molare a volume ostante di un dato sistema ostituito da n moli la grandezza: n ost Siome in questo aso il alore viene eduto al sistema tramite una trasformazione isoora (L = 0), er il rimo riniio della termodinamia si uò srivere: L ioè: n n (8) Riordando i risultati reedentemente ottenuti usando il riniio di equiartizione dell energia, si ottengono, a seonda dei vari tii di gas erfetto, le seguenti esressioni er la variazione di energia erna:
6 1) Gas monoatomio 3 n R ) Gas biatomio 5 n R 3) Gas oliatomio 3 nr Sostituendo questi valori nella (8), si ottiene infine: 3 5 R, R, 3R er un gas ideale monoatomio, biatomio e oliatomio, risettivamente.
7 Calore seifio molare a ressione ostante e relazione di Mayer Si definise alore seifio molare a ressione ostante di un dato sistema ostituito da n moli la grandezza: n ost (9) Consideriamo due trasformazioni, la rima isoora (A B) e la seonda isobara (A C), he onnettono lo stato A a temeratura on due stati B e C aartenenti ad una stessa isoterma di temeratura + (v. figura). Siome il gas è ideale ( funzione solo della temeratura), la sua energia erna negli stati B e C vale: ( B) ( C)
8 Pertanto: ( A B) ( A C) (10) Nella trasformazione isoora, er il rimo riniio e er la (8), risulta: ( A B) n Nella trasformazione isobara, er il rimo riniio, er la (9) e er l equazione di stato, si ha: ( A C) L n n n R Sostituendo le due reedenti esressioni nella (10) si riava: n n n R da ui si ottiene la osiddetta relazione di Mayer: R Sfruttando i valori del alore seifio molare a volume ostante rima riavati, risulta infine: 5 7 R, R, 4R er un gas ideale monoatomio, biatomio e oliatomio, risettivamente.
9 APPLICAZIONI DL PRIMO PRINCIPIO DLLA RMODINAMICA rasformazioni adiabatihe ed esonente adiabatio Per un gas ideale (monoatomio) la variazione infinitesima di energia erna è data da: d 3 n R d n d D altra arte, er il riniio della termodinamia, in forma infinitesima, valido er una trasformazione adiabatia: d dl d dl d da ui: d n d (11) L equazione di stato si uò srivere in forma differenziale ome: d ( ) d ( n R ) d d n R d he, er la (11) e la relazione di Mayer, diventa: d d n R d n d n R d n d
10 Dividendo membro a membro la reedente er la (11), risulta: d d n n d d Riordinando si trova: d d Integrando tra lo stato iniziale e quello finale: f i d f i d ln f i ln f i he uò essere sritta ome: i i f f Ma, essendo i ed f due stati qualsiasi, arbitrariamente selti, si giunge alla formula iù generale: ostante (1) uesta equazione esrime la relazione fra la ressione ed il volume di un gas ideale sottoosto ad una trasformazione adiabatia.
11 Riordando la definizione dell esonente adiabatio ed i valori dei alori seifii a ressione e a volume ostante er i vari tii di gas ideale, si ha: 1) Gas monoatomio ) Gas biatomio ) Gas oliatomio Si osservi he: ostante ( ) 1 ostante e, riordando l equazione di stato, si uò srivere: 1 ostante (13) uesta equazione esrime la relazione fra la temeratura ed il volume di un gas ideale sottoosto ad una trasformazione adiabatia.
12 N.B.: la ostante he omare nella (13) differise da quella he omare nella (1) er il fattore moltiliativo 1/(n R). rasformazioni isoterme Siome er un gas ideale la variazione di energia erna è roorzionale alla variazione di temeratura, in una trasformazione isoterma si ha: 0 quindi, er il rimo riniio: = L Se sul gas si omie un lavoro L (ositivo) un equivalente quantità di alore si trasferise dal gas all ambiente esterno: nulla del lavoro svolto rimane immagazzinato ome energia erna del gas. rasformazioni isoore In questo aso, essendo L = 0, ome abbiamo già visto, si ha: utto il alore assorbito (o eduto) dal sistema si tramuta in un inremento (o in un deremento) di energia erna.
13 rasformazioni ilihe In un ilo: 0 = L (14) In una trasformazione ilia il alore assorbito dal sistema è uguale al lavoro omiuto sul sistema ambiato di segno. 1) Se in un diagramma - un ilo è erorso in senso orario, allora L < 0 (lavoro ositivo omiuto dal sistema) e, er la (14), > 0 (alore netto assorbito dal sistema). ) Se un ilo è erorso in senso antiorario, allora L > 0 (lavoro ositivo omiuto sul sistema) e, er la (14), < 0 (alore netto eduto dal sistema all ambiente).
14 Su un ilo di tio (1) si basa il funzionamento delle mahine termihe. Il alore 1, assorbito da un termostato a temeratura 1, in arte viene onvertito in lavoro meanio (L < 0), in arte ( ) viene restituito all ambiente irostante a temeratura (on < 1 ). Cioè: 1 = + L = 1 = L La mahina, anhe se avviata, essa di fornire lavoro se non assorbe alore imossibilità del osiddetto moto eretuo di rima seie Su un ilo di tio () si basa il funzionamento delle mahine frigorifere.
15 sansione libera In questo aso un gas è inizialmente onentrato nella arte sinistra di un ontenitore adiabatio. Arendo il rubinetto il gas si esande: nel roesso non viene effettuato alun lavoro (L = 0) e non si ha nessuno sambio di alore on l ambiente ( = 0). Per il rimo riniio: 0 0 Durante l esansione la temeratura del gas rimane ostante. L esansione libera è un esemio tiio di roesso di non equilibrio: lo stato iniziale (a sinistra nella figura) e quello finale (a destra) sono stati di equilibrio; durante l esansione, erò, i arametri di stato del sistema non hanno valori definiti e la trasformazione non uò essere raresentata on un grafio nel iano -.
Primo principio della termodinamica
 Primo riniio della termodinamia Priniio di equivalenza Due ori a temeratura diversa, in ontatto, raggiungono l'equilibrio termio Durante il ontatto, il "alore" si trasferise dal oro iù aldo al oro iù freddo
Primo riniio della termodinamia Priniio di equivalenza Due ori a temeratura diversa, in ontatto, raggiungono l'equilibrio termio Durante il ontatto, il "alore" si trasferise dal oro iù aldo al oro iù freddo
Termometria e calorimetria
 ermometria e alorimetria Priniio zero della termodinamia: 2 ori, e, a temerature differenti ( < ) osti a ontatto raggiungono l equilibrio termio. Se e sono in equilibrio termio on un terzo oro C allora
ermometria e alorimetria Priniio zero della termodinamia: 2 ori, e, a temerature differenti ( < ) osti a ontatto raggiungono l equilibrio termio. Se e sono in equilibrio termio on un terzo oro C allora
Impianti di Propulsione Navale
 A/A 2011/12 orso di: Imianti di Proulsione Naale rihiami di termodinamia e mahine Sistema hiuso a) sistema isolato b) sistema rigido ) sistema adiabatio IPN027 Sistema aerto IPN028 I rinii termodinamia
A/A 2011/12 orso di: Imianti di Proulsione Naale rihiami di termodinamia e mahine Sistema hiuso a) sistema isolato b) sistema rigido ) sistema adiabatio IPN027 Sistema aerto IPN028 I rinii termodinamia
Lezione 10 Termodinamica
 rgomenti della lezione: Lezione 0 ermodinamica relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot secondo riiio della termodinamica cenni sull entroia
rgomenti della lezione: Lezione 0 ermodinamica relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot secondo riiio della termodinamica cenni sull entroia
pdv + p ponendo v T v p
 Nel aso artiolare in i δl sia esresso in fnzione delle oordinate e, è er trasformazione internamente reersibile ari a : δl d laoro di ariazione di olme, essendo d d d esso si ò osì esrimere δl d d onendo
Nel aso artiolare in i δl sia esresso in fnzione delle oordinate e, è er trasformazione internamente reersibile ari a : δl d laoro di ariazione di olme, essendo d d d esso si ò osì esrimere δl d d onendo
Termodinamica. Studia il bilancio energetico di sistemi fisici nel modo più generale, compresi scambi di energia non meccanici (calore).
 ermodinamia Studia il bilanio energetio di sistemi fisii nel modo iù generale, omresi sambi di energia non meanii (alore). NC In meania E M E K E P L energia meania si onserva se le forze sono onservative
ermodinamia Studia il bilanio energetio di sistemi fisii nel modo iù generale, omresi sambi di energia non meanii (alore). NC In meania E M E K E P L energia meania si onserva se le forze sono onservative
Legge del gas perfetto e termodinamica
 Scheda riassuntia 5 caitoli 9-0 Legge del gas erfetto e termodinamica Gas erfetto Lo stato gassoso è quello di una sostanza che si troa oltre la sua temeratura critica. La temeratura critica è quella oltre
Scheda riassuntia 5 caitoli 9-0 Legge del gas erfetto e termodinamica Gas erfetto Lo stato gassoso è quello di una sostanza che si troa oltre la sua temeratura critica. La temeratura critica è quella oltre
Il primo principio della termodinamica
 Il rimo rinciio della termodinamica 1) Concetti di variabile di stato e di trasformazione termodinamica Per studiare le relazioni fra calore Q, lavoro W e energia interna U Int nelle interazioni fra sistemi
Il rimo rinciio della termodinamica 1) Concetti di variabile di stato e di trasformazione termodinamica Per studiare le relazioni fra calore Q, lavoro W e energia interna U Int nelle interazioni fra sistemi
FISICA. V [10 3 m 3 ]
![FISICA. V [10 3 m 3 ] FISICA. V [10 3 m 3 ]](/thumbs/24/2838543.jpg) Serie 5: Soluzioni FISICA II liceo Esercizio 1 Primo rinciio Iotesi: Trattiamo il gas con il modello del gas ideale. 1. Dalla legge U = cnrt otteniamo U = 1,50 10 4 J. 2. Dal rimo rinciio U = Q+W abbiamo
Serie 5: Soluzioni FISICA II liceo Esercizio 1 Primo rinciio Iotesi: Trattiamo il gas con il modello del gas ideale. 1. Dalla legge U = cnrt otteniamo U = 1,50 10 4 J. 2. Dal rimo rinciio U = Q+W abbiamo
Esercizi svolti di termodinamica applicata
 0 ; 0 ; 0 Esercizi solti di termodinamica alicata Ex) A g di aria engono forniti 00 J di calore una olta a ressione costante ed una olta a olume costante semre a artire dallo stesso stato iniziale. Calcolare
0 ; 0 ; 0 Esercizi solti di termodinamica alicata Ex) A g di aria engono forniti 00 J di calore una olta a ressione costante ed una olta a olume costante semre a artire dallo stesso stato iniziale. Calcolare
5. Energia libera e potenziale chimico
 5. Energia libera e otenziale chimico Obiettivo: riconoscere lo stato di equilibrio di un sistema mantenuto a temeratura e ressione costanti. costante term 1 2 costante ext 1 2 ext costante term costante
5. Energia libera e otenziale chimico Obiettivo: riconoscere lo stato di equilibrio di un sistema mantenuto a temeratura e ressione costanti. costante term 1 2 costante ext 1 2 ext costante term costante
LAVORO DI UN GAS. Espansione di un gas a pressione costante V A V B
 LORO DI UN GS Esansione di un gas a ressione costante L F h S h Δ 1 LORO DI UN GS Se la ressione non è costante durante la trasformazione il lavoro si calcola come somma dei lavori comiuti in iccole trasformazioni
LORO DI UN GS Esansione di un gas a ressione costante L F h S h Δ 1 LORO DI UN GS Se la ressione non è costante durante la trasformazione il lavoro si calcola come somma dei lavori comiuti in iccole trasformazioni
RELAZIONE DI MAYER. Per quanto riguarda l ultimo termine, esprimendo V in funzione di p e T si ha: dv dp. dv dt. nrt dt
 RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du L () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che ortino
RELAZIONE DI MAYER La relazione di Mayer è: C C R IL rinciio della termodinamica si uò scrivere come du L () Consideriamo due trasformazioni, delle quali una sia un isocora e l altra una isobara, che ortino
IL CICLO DI CARNOT. Scambi di energia durante il ciclo
 IL CICLO DI CNO Consideriamo un gas ideale, contenuto nel solito cilindro, che compie un ciclo di 4 trasformazioni reversibili (2 isoterme + 2 adiabatiche) rappresentate nel piano -p come in figura. cambi
IL CICLO DI CNO Consideriamo un gas ideale, contenuto nel solito cilindro, che compie un ciclo di 4 trasformazioni reversibili (2 isoterme + 2 adiabatiche) rappresentate nel piano -p come in figura. cambi
GRANDEZZE OPERATIVE DELLE MACCHINE OPERANTI CON FLUIDI COMPRIMIBILI
 CAPITOLO 6 GRANDEZZE OPERATIVE DELLE MACCHINE OPERANTI CON FLUIDI COMPRIMIBILI 6.) Lavori, rendimenti e otenze. Sviluando i termini ontenuti nell'equazione dell'energia (3.) e indiando on i edii "" e ""
CAPITOLO 6 GRANDEZZE OPERATIVE DELLE MACCHINE OPERANTI CON FLUIDI COMPRIMIBILI 6.) Lavori, rendimenti e otenze. Sviluando i termini ontenuti nell'equazione dell'energia (3.) e indiando on i edii "" e ""
TEORIA CINETICA DEI GAS
 TEORI CIETIC DEI GS Gas erfetto molto grande Traiettorie classiche Interazione da sfere rigide, urti elastici Casualita x jx 0 x y z x j 0 j jx + jy + jz x x j 1 l ( ; ) Δx Pxx+Δ x l PRESSIOE f i Δ m(
TEORI CIETIC DEI GS Gas erfetto molto grande Traiettorie classiche Interazione da sfere rigide, urti elastici Casualita x jx 0 x y z x j 0 j jx + jy + jz x x j 1 l ( ; ) Δx Pxx+Δ x l PRESSIOE f i Δ m(
CHIMICA FISICA I. Le leggi dei gas
 A.A. 2014-2015 Corso di Laurea in CHIMICA INDUSTRIALE CHIMICA FISICA I Le leggi dei gas Lezioni di Chimia Fisia I A.A. 2014-2015 Leggi dei gas - Pagina 1 Un sistema ostituito da un gas puro si omporta
A.A. 2014-2015 Corso di Laurea in CHIMICA INDUSTRIALE CHIMICA FISICA I Le leggi dei gas Lezioni di Chimia Fisia I A.A. 2014-2015 Leggi dei gas - Pagina 1 Un sistema ostituito da un gas puro si omporta
ESERCIZI SUL BILANCIO TERMICO DEI GENERATORI E DEGLI ACCUMULI
 ESERCIZI SUL BILANCIO TERMICO DEI GENERATORI E DEGLI ACCUMULI FORMULARIO DI RIEPILOGO Tabella 0.1 Poteri alorifii di aluni ombustibili. PCI [MJ/kg] PCS [MJ/kg] Petrolio greggio 41,9 44,8 Benzina er auto
ESERCIZI SUL BILANCIO TERMICO DEI GENERATORI E DEGLI ACCUMULI FORMULARIO DI RIEPILOGO Tabella 0.1 Poteri alorifii di aluni ombustibili. PCI [MJ/kg] PCS [MJ/kg] Petrolio greggio 41,9 44,8 Benzina er auto
Processi irreversibili
 Proessi irreversibili a nostra esperienza quotidiana è segnata da una moltitudine di proessi irreversibili, he ioè avvengono spontaneamente in una sola direzione e non possono essere riprodotti uguali
Proessi irreversibili a nostra esperienza quotidiana è segnata da una moltitudine di proessi irreversibili, he ioè avvengono spontaneamente in una sola direzione e non possono essere riprodotti uguali
ESAME DI AMMISSIONE ALLA TERZA LICEO SCIENZE SPERIMENTALI: FISICA
 LICO CANTONAL DI LUGANO 2 SAM DI AMMISSION ALLA TRZA LICO SCINZ SRIMNTALI: FISICA COGNOM: NOM:...... RONINZA SCOLASTICA:. unti esercizi 1 2 3 TOT 18 4 3 25 unti fatti Nota SRCIZIO 1 Annerire o crociare
LICO CANTONAL DI LUGANO 2 SAM DI AMMISSION ALLA TRZA LICO SCINZ SRIMNTALI: FISICA COGNOM: NOM:...... RONINZA SCOLASTICA:. unti esercizi 1 2 3 TOT 18 4 3 25 unti fatti Nota SRCIZIO 1 Annerire o crociare
Termodinamica. Ireneo Kikic. DICAMP - SFLAB - University of Trieste
 ermodinamica Ireneo Kikic DIAM - FLAB - University of rieste IRENEO.KIKI@DIAM.UNI.I rimo principio della termodinamica alore e lavoro solo quando sono trasferiti tra i corpi Energia uò essere convertita
ermodinamica Ireneo Kikic DIAM - FLAB - University of rieste IRENEO.KIKI@DIAM.UNI.I rimo principio della termodinamica alore e lavoro solo quando sono trasferiti tra i corpi Energia uò essere convertita
SISTEMI E STATI TERMODINAMICI
 ittorio Mussino: vittorio.mussino@olito.it SISEMI E SI ERMODINMICI Nel corso di Fisica I (meccanica), si sono determinate le leggi che governano il moto dei sistemi di articelle (discreti e continui) e
ittorio Mussino: vittorio.mussino@olito.it SISEMI E SI ERMODINMICI Nel corso di Fisica I (meccanica), si sono determinate le leggi che governano il moto dei sistemi di articelle (discreti e continui) e
Andrea Scozzari a.a Analisi di sensibilità
 Andrea Sozzari a.a. 2012-2013 Analisi di sensibilità 1 Problema di Massimo in forma generale ma 130 100 1,5 0,3 0,5, 27 21 15 16 0 regione ammissibile 2 Problema di Massimo in forma generale ma 130 100
Andrea Sozzari a.a. 2012-2013 Analisi di sensibilità 1 Problema di Massimo in forma generale ma 130 100 1,5 0,3 0,5, 27 21 15 16 0 regione ammissibile 2 Problema di Massimo in forma generale ma 130 100
Termologia. Paolo Bagnaia - CTF Esercizi di termologia e termodinamica 1
 ermologia Paolo Bagnaia - CF - 3 - Esercizi di termologia e termodinamica 1 Esercizio Un cubetto di ghiaccio di 150 g alla temeratura di 0 C è gettato in unreciiente, i che contiene 300 g di acqua alla
ermologia Paolo Bagnaia - CF - 3 - Esercizi di termologia e termodinamica 1 Esercizio Un cubetto di ghiaccio di 150 g alla temeratura di 0 C è gettato in unreciiente, i che contiene 300 g di acqua alla
3. Le Trasformazioni Termodinamiche
 3. Le Trasformazioni Termodinamiche Lo stato termodinamico di un gas (perfetto) è determinato dalle sue variabili di stato: ressione, olume, Temperatura, n moli ffinché esse siano determinate è necessario
3. Le Trasformazioni Termodinamiche Lo stato termodinamico di un gas (perfetto) è determinato dalle sue variabili di stato: ressione, olume, Temperatura, n moli ffinché esse siano determinate è necessario
Dispense del corso di Processi e Impianti Chimici. Corso di Laurea Specialistica in Chimica Industriale. Docente Guido Sassi
 Disense del orso di Proessi e ianti Chiii Corso di Laurea eialistia in Chiia ndustriale Doente Guido assi Faoltà di ienze ateatihe Fisihe e Naturali Università di Torino eattori 2 odellazione di eattori
Disense del orso di Proessi e ianti Chiii Corso di Laurea eialistia in Chiia ndustriale Doente Guido assi Faoltà di ienze ateatihe Fisihe e Naturali Università di Torino eattori 2 odellazione di eattori
Consideriamo un gas ideale in equilibrio termodinamico alla pressione p 1. , contenuto in un volume V
 LEGGI DEI GS Per gas si intende un fluido rivo di forma o volume rorio e facilmente comrimibile in modo da conseguire notevoli variazioni di ressione e densità. Le variabili termodinamiche iù aroriate
LEGGI DEI GS Per gas si intende un fluido rivo di forma o volume rorio e facilmente comrimibile in modo da conseguire notevoli variazioni di ressione e densità. Le variabili termodinamiche iù aroriate
Formulario di Termodinamica
 Formulario di Termodinamica Punto triplo dell acqua: T triplo = 273.16 K. Conversione tra gradi Celsius e gradi Kelvin (temperatura assoluta): t( C) = T (K) 273.15 Conversione tra Caloria e Joule: 1 cal
Formulario di Termodinamica Punto triplo dell acqua: T triplo = 273.16 K. Conversione tra gradi Celsius e gradi Kelvin (temperatura assoluta): t( C) = T (K) 273.15 Conversione tra Caloria e Joule: 1 cal
Per quanto detto prima il fenomeno di svuotamento termina quando la pressione di ristagno è pari a:
 Esercizi Si consideri il serbatoio schematicamente raresentato in Fig., in cui è contenuto un gas avente inizialmente (cioè al temo t=0) temeratura T o =0F e ressione oi =0si. Il serbatoio è collegato
Esercizi Si consideri il serbatoio schematicamente raresentato in Fig., in cui è contenuto un gas avente inizialmente (cioè al temo t=0) temeratura T o =0F e ressione oi =0si. Il serbatoio è collegato
Impianto di pressurizzazione e condizionamento
 IMPIANTI E SISTEMI Disense del orso, versione 2014 Caitolo 9 Imianto di ressurizzazione e ondizionamento Caitolo 9 Imianto di ressurizzazione e ondizionamento Queste disense ossono essere liberamente sariate
IMPIANTI E SISTEMI Disense del orso, versione 2014 Caitolo 9 Imianto di ressurizzazione e ondizionamento Caitolo 9 Imianto di ressurizzazione e ondizionamento Queste disense ossono essere liberamente sariate
1 TERMODINAMICA DELLE TURBINE A GAS 1.1 INTRODUZIONE
 TERMODINAMICA DELLE TURBINE A GAS. INTRODUZIONE Il ciclo termodinamico su cui è imostato il funzionamento delle turbine a gas è il ciclo Bryton, la cui analisi orta alla determinazione di due arametri
TERMODINAMICA DELLE TURBINE A GAS. INTRODUZIONE Il ciclo termodinamico su cui è imostato il funzionamento delle turbine a gas è il ciclo Bryton, la cui analisi orta alla determinazione di due arametri
QUESITI DI FISICA RISOLTI A LEZIONE TERMODINAMICA
 QUESITI DI FISICA RISOLTI A LEZIONE TERMODINAMICA Un recipiente contiene gas perfetto a 27 o C, che si espande raggiungendo il doppio del suo volume iniziale a pressione costante. La temperatura finale
QUESITI DI FISICA RISOLTI A LEZIONE TERMODINAMICA Un recipiente contiene gas perfetto a 27 o C, che si espande raggiungendo il doppio del suo volume iniziale a pressione costante. La temperatura finale
Cinematica grafica C.R P 2
 inematica grafica ome già evidenziato in recedenza, in alternativa alla formulazione analitica e limitatamente ai roblemi iani, è ossibile dare del roblema cinematico una formulazione grafica, che in qualche
inematica grafica ome già evidenziato in recedenza, in alternativa alla formulazione analitica e limitatamente ai roblemi iani, è ossibile dare del roblema cinematico una formulazione grafica, che in qualche
È quella parte della termologia che studia le trasformazioni di calore in lavoro e viceversa.
 EMODINMI È quella arte della termologia che studia le trasformazioni di calore in lavoro e viceversa. PINIPIO DI EUIENZ OE - OO Grazie a questo imortante eserimento, Joule oté verificare che il calore
EMODINMI È quella arte della termologia che studia le trasformazioni di calore in lavoro e viceversa. PINIPIO DI EUIENZ OE - OO Grazie a questo imortante eserimento, Joule oté verificare che il calore
Q Q. Energia scambiata per ciclo legata alle differenze di pressione ed al valore della pressione stessa. I Principio macchina CICLICA L = Q 12 -Q 34
 Fisia enia G. Grazzini UNIVERSIA DI FIRENZE Diagramma Indiatore Energia sambiata per ilo legata alle differenze di pressione ed al alore della pressione stessa. I Prinipio maina CICLICA L 2-34 L ε 2 Reersibilità
Fisia enia G. Grazzini UNIVERSIA DI FIRENZE Diagramma Indiatore Energia sambiata per ilo legata alle differenze di pressione ed al alore della pressione stessa. I Prinipio maina CICLICA L 2-34 L ε 2 Reersibilità
Capacità termica e calore specifico
 Calori specifici Capacità termica e calore specifico Il calore si trasferisce da un corpo ad un altro fintanto che i corpi sono a temperature differenti. Potremo scrivere quindi: Q = C ΔT = C (T f T i
Calori specifici Capacità termica e calore specifico Il calore si trasferisce da un corpo ad un altro fintanto che i corpi sono a temperature differenti. Potremo scrivere quindi: Q = C ΔT = C (T f T i
Tre tipi di Sistema Un richiamo
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Programma: a che unto siamo? Lezioni 25-26 2010 re tii di Sistema Un richiamo Un aio di riferimenti matematici Sistema isolato:
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Programma: a che unto siamo? Lezioni 25-26 2010 re tii di Sistema Un richiamo Un aio di riferimenti matematici Sistema isolato:
9. TRASFORMAZIONI TERMODINAMICHE E CICLI REALI
 9. TRASFORMAZIONI TERMODINAMICHE E CICLI REALI 9. Introduzione I rocessi termodinamici che vengono realizzati nella ratica devono consentire la realizzazione di uno scambio di energia termica o di energia
9. TRASFORMAZIONI TERMODINAMICHE E CICLI REALI 9. Introduzione I rocessi termodinamici che vengono realizzati nella ratica devono consentire la realizzazione di uno scambio di energia termica o di energia
6. I GAS IDEALI. 6.1 Il Gas perfetto
 6. I GAS IDEALI 6. Il Gas erfetto Il gas erfetto o ideale costituisce un modello astratto del comortamento dei gas cui tendono molti gas reali a ressioni rossime a quella atmosferica. Questo modello di
6. I GAS IDEALI 6. Il Gas erfetto Il gas erfetto o ideale costituisce un modello astratto del comortamento dei gas cui tendono molti gas reali a ressioni rossime a quella atmosferica. Questo modello di
CAPITOLO 4 EQUAZIONI di CONSERVAZIONE
 CAPIOLO 4 EQUAZIONI di CONSERVAZIONE 4. Cassifiazione dee ahine Chiamasi mahina a sede di una trasformazione energetia oerante mediante uno o iù fuidi in azione dinamia o inematia; detti fuidi sono i ettori
CAPIOLO 4 EQUAZIONI di CONSERVAZIONE 4. Cassifiazione dee ahine Chiamasi mahina a sede di una trasformazione energetia oerante mediante uno o iù fuidi in azione dinamia o inematia; detti fuidi sono i ettori
PRIMI ELEMENTI DI TERMODINAMICA. La termodinamica studia le leggi con cui i sistemi scambiano (cedono e ricevono) energia con l ambiente.
 PRIMI ELEMENTI DI TERMODINAMICA Un sistema è un insieme di corpi che possiamo immaginare avvolti da una superficie chiusa, ma permeabile alla materia e all energia. L ambiente è tutto ciò che si trova
PRIMI ELEMENTI DI TERMODINAMICA Un sistema è un insieme di corpi che possiamo immaginare avvolti da una superficie chiusa, ma permeabile alla materia e all energia. L ambiente è tutto ciò che si trova
D.E.TE.C. Corso di Termofluidodinamica Prof. Luigi de Luca TERMODINAMICA
 ERMODINAMICA La termodinamia è una arte della fisia he rientra nello studio della meania: studia il omortamento della materia, sia essa allo stato solido, liquido o gassoso. Noi i oueremo dei fluidi, ossia
ERMODINAMICA La termodinamia è una arte della fisia he rientra nello studio della meania: studia il omortamento della materia, sia essa allo stato solido, liquido o gassoso. Noi i oueremo dei fluidi, ossia
CALORE E TERMODI NAMI CA - PRI MO PRI NCI PI O
 CALORE E ERMODI NAMI CA PRI MO PRI NCI PI O uanto calore è necessario er riscaldare, alla ressione di atm, una massa di kg di ghiaccio, inizialm ent e a 0 C, finchè t ut t o il ghiaccio non si è trasformato
CALORE E ERMODI NAMI CA PRI MO PRI NCI PI O uanto calore è necessario er riscaldare, alla ressione di atm, una massa di kg di ghiaccio, inizialm ent e a 0 C, finchè t ut t o il ghiaccio non si è trasformato
Peso atomico (meglio massa atomica)
 Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22//2 7.52 stamato il
Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22//2 7.52 stamato il
Primo principio della Termodinamica
 rimo principio della ermodinamica Sistemi termodinamici Esperimento di Joule Energia interna rimo principio della ermodinamica Leggi dei gas Gas erfetto Calori specifici dei gas 1 Sistemi ermodinamici
rimo principio della ermodinamica Sistemi termodinamici Esperimento di Joule Energia interna rimo principio della ermodinamica Leggi dei gas Gas erfetto Calori specifici dei gas 1 Sistemi ermodinamici
ESERCIZI DI TERMODINAMICA
 ESERCIZI DI TERMODINAMICA Un otore a cobustione eroga una otenza effettiva di k con un rendiento totale del 8% Il cobustibile utilizzato ha un otere calorifico inferiore di 000 k Calcolare la assa di cobustibile
ESERCIZI DI TERMODINAMICA Un otore a cobustione eroga una otenza effettiva di k con un rendiento totale del 8% Il cobustibile utilizzato ha un otere calorifico inferiore di 000 k Calcolare la assa di cobustibile
Dal modellino dei Gas perfetti alla Tecnologia del vuoto
 Dal modellino dei Gas erfetti alla ecnologia del vuoto Il gas erfetto è un modellino teorico che ermette di rogettare e dimensionare i sistemi da vuoto, arte tutto da P= Nk () (*) P ressione del gas, olume
Dal modellino dei Gas erfetti alla ecnologia del vuoto Il gas erfetto è un modellino teorico che ermette di rogettare e dimensionare i sistemi da vuoto, arte tutto da P= Nk () (*) P ressione del gas, olume
Capitolo 2. Funzioni
 Caitolo 2 Funzioni 2.1. De nizioni Un concetto di fondamentale imortanza è quello di funzione. roosito la seguente de nizione: Vale a questo De nizione 10 Dati due insiemi (non vuoti) X e Y, si chiama
Caitolo 2 Funzioni 2.1. De nizioni Un concetto di fondamentale imortanza è quello di funzione. roosito la seguente de nizione: Vale a questo De nizione 10 Dati due insiemi (non vuoti) X e Y, si chiama
Verifica di ipotesi: approfondimenti
 1. Il -value Verifica di iotesi: arofondimenti Il test si uò effettuare: Determinando reventivamente le regioni di accettazione di H 0 e H 1 er lo stimatore considerato (sulla base del livello α e osservando
1. Il -value Verifica di iotesi: arofondimenti Il test si uò effettuare: Determinando reventivamente le regioni di accettazione di H 0 e H 1 er lo stimatore considerato (sulla base del livello α e osservando
Esercitazione X - Legge dei gas perfetti e trasformazioni
 Esercitazione X - Legge dei gas perfetti e trasformazioni termodinamiche Formulario Il primo principio della termodinamica afferma che la variazione dell energia interna di un sistema U è uguale alla somma
Esercitazione X - Legge dei gas perfetti e trasformazioni termodinamiche Formulario Il primo principio della termodinamica afferma che la variazione dell energia interna di un sistema U è uguale alla somma
Tonzig La fisica del calore
 0 Tonzig La fisica del calore c) Per stati di equilibrio caratterizzati da uno stesso valore della ressione (e del numero di moli), volume e temeratura assoluta sono direttamente roorzionali. Se 0 è il
0 Tonzig La fisica del calore c) Per stati di equilibrio caratterizzati da uno stesso valore della ressione (e del numero di moli), volume e temeratura assoluta sono direttamente roorzionali. Se 0 è il
Corso di Laurea: INGEGNERIA INFORMATICA (classe 09) Insegnamento: n Lezione: Titolo: V M. Fig. 5.1 Schematizzazione di una macchina a fluido
 Corso di Laurea: INGEGNERIA INFORMATICA (lasse 09) Le equazioni del moto dei fluidi L equazione di onservazione dell energia in forma termodinamia V M Ω Ω Fig. 5. Shematizzazione di una mahina a fluido
Corso di Laurea: INGEGNERIA INFORMATICA (lasse 09) Le equazioni del moto dei fluidi L equazione di onservazione dell energia in forma termodinamia V M Ω Ω Fig. 5. Shematizzazione di una mahina a fluido
Gas, liquidi, solidi. Tutti i gas, tranne l'elio, solidificano a basse temperature (alcuni richiedono anche alte pressioni).
 Gas, liquidi, solidi Tutti i gas raffreddati liquefano Tutti i gas, tranne l'elio, solidificano a basse temperature (alcuni richiedono anche alte pressioni). Sostanza T L ( C) T E ( C) He - -269 H 2-263
Gas, liquidi, solidi Tutti i gas raffreddati liquefano Tutti i gas, tranne l'elio, solidificano a basse temperature (alcuni richiedono anche alte pressioni). Sostanza T L ( C) T E ( C) He - -269 H 2-263
Enunciato di Kelvin-Plank
 ezione VI - 3/03/003 ora 8:30-0:30 - Enunciato di Kelin-Plank, laoro nelle trasformazioni di gas erfetti, Entalia - Originale di Cara Mauro e Dondi Silia Enunciato di Kelin-Plank Non è ossibile effettuare
ezione VI - 3/03/003 ora 8:30-0:30 - Enunciato di Kelin-Plank, laoro nelle trasformazioni di gas erfetti, Entalia - Originale di Cara Mauro e Dondi Silia Enunciato di Kelin-Plank Non è ossibile effettuare
L Q = 1. e nel ciclo di Carnot questo rendimento assume valore massimo pari a : η =
 CICLI ERMODINAMICI DIREI: Maccine termice Le maccine ce anno come scoo uello di trasformare ciclicamente in lavoro il calore disonibile da una sorgente termica sono dette maccine termice o motrici e il
CICLI ERMODINAMICI DIREI: Maccine termice Le maccine ce anno come scoo uello di trasformare ciclicamente in lavoro il calore disonibile da una sorgente termica sono dette maccine termice o motrici e il
GAS IDEALI E MACCHINE TERMICHE. G. Pugliese 1
 GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
CALDAIA A CONDENSAZIONE. Il rendimento termico di una caldaia, con riferimento al potere calorifico inferiore LHV, può essere espresso come:
 CALDAIA A CONDENSAZIONE Il rendimento termio di una aldaia, on riferimento al otere alorifio inferiore, uò essere esresso ome: i d dove i, e d raresentano le otenze erse er unità di otenza messa a disosizione
CALDAIA A CONDENSAZIONE Il rendimento termio di una aldaia, on riferimento al otere alorifio inferiore, uò essere esresso ome: i d dove i, e d raresentano le otenze erse er unità di otenza messa a disosizione
sorgente di lavoro meccanico operante in maniera ciclica internamente reversibile esternamente reversibile termostato T
 CICLI MOORI Utilizzando un motore (sorgente di lavoro meccanico oerante in maniera ciclica) che evolve secondo il ciclo isotermo-adiabatico di Carnot in maniera internamente reversibile, scambiando calore
CICLI MOORI Utilizzando un motore (sorgente di lavoro meccanico oerante in maniera ciclica) che evolve secondo il ciclo isotermo-adiabatico di Carnot in maniera internamente reversibile, scambiando calore
DINAMICA DEI FLUIDI. Diretta generalizzazione della meccanica del punto materiale. Procedimento estremamente complicato.
 DINMIC DEI FLUIDI PPROCCIO LGRNGINO Descrie il moto di un fluido ensandolo scomosto in elementi infinitesimali di olume (le articelle fluide) di cui si cerca di esrimere osizione e elocità in funzione
DINMIC DEI FLUIDI PPROCCIO LGRNGINO Descrie il moto di un fluido ensandolo scomosto in elementi infinitesimali di olume (le articelle fluide) di cui si cerca di esrimere osizione e elocità in funzione
Entalpia. L'entalpia è una funzione di stato ed è una grandezza estensiva. dh=du+pdv+vdp --> du+pdv = dh - Vdp
 Entalpia Si definisce entalpia la grandezza H ( 1 H = U + pv L'entalpia è una funzione di stato ed è una grandezza estensiva. Differenziando la (1) si ha dh=du+pdv+vdp --> du+pdv = dh - Vdp In una generica
Entalpia Si definisce entalpia la grandezza H ( 1 H = U + pv L'entalpia è una funzione di stato ed è una grandezza estensiva. Differenziando la (1) si ha dh=du+pdv+vdp --> du+pdv = dh - Vdp In una generica
MATEMATICA CORSO A COMPITINO DI RECUPERO (Tema 2) 13 Febbraio 2014
 MATEMATICA CORSO A COMPITINO DI RECUPERO (Tema 2) 13 Febbraio 2014 Soluzioni 1. In un sahetto i sono 9 palline olorate: 2 rosse, 4 verdi e 3 gialle. Si fanno 3 estrazioni on rimessa. a) Calola la probabilità
MATEMATICA CORSO A COMPITINO DI RECUPERO (Tema 2) 13 Febbraio 2014 Soluzioni 1. In un sahetto i sono 9 palline olorate: 2 rosse, 4 verdi e 3 gialle. Si fanno 3 estrazioni on rimessa. a) Calola la probabilità
Dispensa del corso di FLUIDODINAMICA DELLE MACCHINE
 Disensa del corso di FLUIDODINAICA DELLE ACCHINE Argomento: Onde di ach e onde d'urto (flusso stazionario, non viscoso di un gas erfetto) Prof. Pier Ruggero Sina Diartimento di Ingegneria Prof. P. R. Sina
Disensa del corso di FLUIDODINAICA DELLE ACCHINE Argomento: Onde di ach e onde d'urto (flusso stazionario, non viscoso di un gas erfetto) Prof. Pier Ruggero Sina Diartimento di Ingegneria Prof. P. R. Sina
ESERCIZI SULLA DINAMICA DI CORPI RIGIDI.
 ESERCIZI SULL DINMIC DI CRPI RIIDI. Risoluzione mediante equazioni di Lagrange, equilibrio relativo (forze aarenti), stazionarietà del otenziale U; stabilità dell equilibrio e analisi delle iccole oscillazioni.
ESERCIZI SULL DINMIC DI CRPI RIIDI. Risoluzione mediante equazioni di Lagrange, equilibrio relativo (forze aarenti), stazionarietà del otenziale U; stabilità dell equilibrio e analisi delle iccole oscillazioni.
Istituzione di Fisica Statistica
 Istituzione di Fisica Statistica Comito e rova arziale (December 9, 004) Mattia Donega 8 dicembre 006 Esercizio Un gas classico di N articelle di massa m in equilibrio alla temeratura T è riartito fra
Istituzione di Fisica Statistica Comito e rova arziale (December 9, 004) Mattia Donega 8 dicembre 006 Esercizio Un gas classico di N articelle di massa m in equilibrio alla temeratura T è riartito fra
E la componente della forza parallella allo spostamento che compie lavoro.
 Lavoro ed energia Lavoro di una forza Energia cinetica teorema dell energia cinetica orze conservative e energia otenziale orze non conservative ed energia totale Conservazione dell energia Il lavoro di
Lavoro ed energia Lavoro di una forza Energia cinetica teorema dell energia cinetica orze conservative e energia otenziale orze non conservative ed energia totale Conservazione dell energia Il lavoro di
ESERCITAZIONE 4: MONOPOLIO E CONCORRENZA PERFETTA
 ESERCITAZIONE 4: MONOPOLIO E CONCORRENZA PERFETTA Esercizio : Scelta ottimale di un monoolista e imoste Si consideri un monoolista con la seguente funzione di costo totale: C ( ) = 400 + + 0 0 La domanda
ESERCITAZIONE 4: MONOPOLIO E CONCORRENZA PERFETTA Esercizio : Scelta ottimale di un monoolista e imoste Si consideri un monoolista con la seguente funzione di costo totale: C ( ) = 400 + + 0 0 La domanda
Scrivere una relazione
 Srivere una relazione La relazione sull eserienza fatta in laboratorio deve essere sritta suonendo he hi la legge non saia osa avete fatto, non ensate he sarà il doente he vi ha seguito a orreggerla. Quindi
Srivere una relazione La relazione sull eserienza fatta in laboratorio deve essere sritta suonendo he hi la legge non saia osa avete fatto, non ensate he sarà il doente he vi ha seguito a orreggerla. Quindi
A1. Soluzione. Ilcalore Q per unita di massa e negativo (ceduto all esterno) e vale:
 A. na maccina disosta su un asse orizzontale è alimentata da una ortata di 0 kg/s di aria (R = 87 J/kg K, c = 004 J/kg K) alla ressione P = 0 bar e alla temeratura T = 00 C, da un condotto circolare di
A. na maccina disosta su un asse orizzontale è alimentata da una ortata di 0 kg/s di aria (R = 87 J/kg K, c = 004 J/kg K) alla ressione P = 0 bar e alla temeratura T = 00 C, da un condotto circolare di
1) Si deve progettare un auto reattore per un missile che vola a M 1 := 1.8. Supponendo che
 Esercizi di Esame 1.mcd (1/9) 1) Si deve rogettare un auto reattore er un missile che vola a M 1 : 1.8. Suonendo che T 1 : 73.15 K, 1 : 0.7 atm, A : 0.0347 m, A 3 /A 1.34 e che la combustione roduce 196.7kJ/kg.
Esercizi di Esame 1.mcd (1/9) 1) Si deve rogettare un auto reattore er un missile che vola a M 1 : 1.8. Suonendo che T 1 : 73.15 K, 1 : 0.7 atm, A : 0.0347 m, A 3 /A 1.34 e che la combustione roduce 196.7kJ/kg.
Esercizi proposti - Gruppo 7
 Argomenti di Matematica er l Ingegneria - Volume I - Esercizi roosti Esercizi roosti - Gruo 7 1) Verificare che ognuina delle seguenti coie di numeri razionali ( ) r + 1, r + 1, r Q {0} r ha la rorietà
Argomenti di Matematica er l Ingegneria - Volume I - Esercizi roosti Esercizi roosti - Gruo 7 1) Verificare che ognuina delle seguenti coie di numeri razionali ( ) r + 1, r + 1, r Q {0} r ha la rorietà
Fisica dei mezzi trasmissivi Prof. G. Macchiarella Prova del 28 Febbraio 2013
 Fisia dei mezzi trasmissivi Prof. G. Mahiarella Prova del 8 Febbraio 013 1 3 4 non srivere nella zona soprastante COGNOME E NOME MTRICO FIRM Eserizio 1 Un generatore, la ui tensione varia nel tempo ome
Fisia dei mezzi trasmissivi Prof. G. Mahiarella Prova del 8 Febbraio 013 1 3 4 non srivere nella zona soprastante COGNOME E NOME MTRICO FIRM Eserizio 1 Un generatore, la ui tensione varia nel tempo ome
C V. gas monoatomici 3 R/2 5 R/2 gas biatomici 5 R/2 7 R/2 gas pluriatomici 6 R/2 8 R/2
 46 Tonzig La fisica del calore o 6 R/2 rispettivamente per i gas a molecola monoatomica, biatomica e pluriatomica. Per un gas perfetto, il calore molare a pressione costante si ottiene dal precedente aggiungendo
46 Tonzig La fisica del calore o 6 R/2 rispettivamente per i gas a molecola monoatomica, biatomica e pluriatomica. Per un gas perfetto, il calore molare a pressione costante si ottiene dal precedente aggiungendo
I PRINCIPI DELLA TERMODINAMICA
 Il diagramma - I RINCII DLLA TRMODINAMICA Un sistema termodinamico è una quantità di materia racchiusa all interno di una superficie chiusa, che può scambiare energia con l ambiente esterno. Lo stato di
Il diagramma - I RINCII DLLA TRMODINAMICA Un sistema termodinamico è una quantità di materia racchiusa all interno di una superficie chiusa, che può scambiare energia con l ambiente esterno. Lo stato di
ESERCIZI ESERCIZI. Macchine termiche Motori a combustione interna QUANTO?
 Mahine termihe Motori a ombustione interna QUANO? Una mahina termia produe 40 J a ilo, assorbendo 0 J di alore. Quanto alore viene disperso nell ambiente? 680 J@ QUANO? Una mahina termia ha un rendimento
Mahine termihe Motori a ombustione interna QUANO? Una mahina termia produe 40 J a ilo, assorbendo 0 J di alore. Quanto alore viene disperso nell ambiente? 680 J@ QUANO? Una mahina termia ha un rendimento
Gas ideale: velocità delle particelle e pressione (1)
 Gas ideale: velocità delle particelle e pressione (1) In un gas ideale le particelle sono considerate puntiformi e risentono di forze solo durante gli urti (perfettamente elastici) con le pareti del recipiente.
Gas ideale: velocità delle particelle e pressione (1) In un gas ideale le particelle sono considerate puntiformi e risentono di forze solo durante gli urti (perfettamente elastici) con le pareti del recipiente.
il ciclo di Ericsson (1853) caratterizzato da due isoterme e due isobare; il ciclo di Reitlinger (1873) con due isoterme e due politropiche.
 16 Il ciclo di Stirling Il coefficiente di effetto utile per il ciclo frigorifero di Carnot è, in base alla (2.9): T min ɛ =. (2.31) T max T min Il ciclo di Carnot è il ciclo termodinamico che dà il maggior
16 Il ciclo di Stirling Il coefficiente di effetto utile per il ciclo frigorifero di Carnot è, in base alla (2.9): T min ɛ =. (2.31) T max T min Il ciclo di Carnot è il ciclo termodinamico che dà il maggior
IL SECONDO PRINCIPIO DELLA TERMODINAMICA
 IL SECONDO PRINCIPIO DELLA TERMODINAMICA DOWNLOAD Il pdf di questa lezione (0518.pdf) è scaricabile dal sito http://www.ge.infn.it/ calvini/biot/ 18/05/2017 SECONDO PRINCIPIO: ENUNCIATI - Kelvin-Planck:
IL SECONDO PRINCIPIO DELLA TERMODINAMICA DOWNLOAD Il pdf di questa lezione (0518.pdf) è scaricabile dal sito http://www.ge.infn.it/ calvini/biot/ 18/05/2017 SECONDO PRINCIPIO: ENUNCIATI - Kelvin-Planck:
La macchina termica. Marina Cobal - Dipt.di Fisica - Universita' di Udine 1
 La macchina termica Universita' di Udine 1 La macchina termica Un insieme di trasformazioni che parta da uno stato e vi ritorni costituisce una macchina termica un ciclo termodinamico Universita' di Udine
La macchina termica Universita' di Udine 1 La macchina termica Un insieme di trasformazioni che parta da uno stato e vi ritorni costituisce una macchina termica un ciclo termodinamico Universita' di Udine
C e detta capacita termica
 Capacita termica la quantita di calore che occorre fornire o sottrarre ad un corpo per modificarne la temperatura e direttamente proporzionale alla sua variazione T T f T i di temperatura ( attenzione
Capacita termica la quantita di calore che occorre fornire o sottrarre ad un corpo per modificarne la temperatura e direttamente proporzionale alla sua variazione T T f T i di temperatura ( attenzione
Fisica Generale 1 per Chimica Formulario di Termodinamica e di Teoria Cinetica
 Fisica Generale 1 per Chimica Formulario di Termodinamica e di Teoria Cinetica Termodinamica Equazione di Stato: p = pressione ; V = volume ; T = temperatura assoluta ; n = numero di moli ; R = costante
Fisica Generale 1 per Chimica Formulario di Termodinamica e di Teoria Cinetica Termodinamica Equazione di Stato: p = pressione ; V = volume ; T = temperatura assoluta ; n = numero di moli ; R = costante
Calore, lavoro e trasformazioni termodinamiche (1)
 Calore, lavoro e trasformazioni termodinamiche (1) Attraverso scambi di calore un sistema scambia energia con l ambiente. Tuttavia si scambia energia anche quando le forze (esterne e interne al sistema)
Calore, lavoro e trasformazioni termodinamiche (1) Attraverso scambi di calore un sistema scambia energia con l ambiente. Tuttavia si scambia energia anche quando le forze (esterne e interne al sistema)
Fisica dell Atmosfera e del Clima
 Università degli studi di rento Facoltà di Ingegneria Corso di Laurea Magistrale in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Civile ed Ambientale Fisica dell Atmosfera
Università degli studi di rento Facoltà di Ingegneria Corso di Laurea Magistrale in Ingegneria er l Ambiente e il erritorio Prof. Dino Zardi Diartimento di Ingegneria Civile ed Ambientale Fisica dell Atmosfera
Stati della materia. Esempio. Fusione e solidificazione. Esempio. Stati di aggregazione della materia
 Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Gli approcci alla programmazione dinamica: alcuni esempi
 Gli approi alla programmazione dinamia: aluni esempi Franeso Menonin February, 2002 Ottimizzazione dinamia Il problema he qui si onsidera è quello di un soggetto he intende massimizzare (o minimizzare)
Gli approi alla programmazione dinamia: aluni esempi Franeso Menonin February, 2002 Ottimizzazione dinamia Il problema he qui si onsidera è quello di un soggetto he intende massimizzare (o minimizzare)
Dato che i tre corpi non scambiano calore con l ambiente esterno, allora la somma algebrica dei calori scambiati deve essere uguale a zero: + Q 3
 isica (.. 004/005) Esercizi ermodinamica ( a parte) ) re corpi di capacità termica,,, che si trovano alle temperature,,, vengono posti a contatto. Nell ipotesi che i tre corpi non scambino calore con l
isica (.. 004/005) Esercizi ermodinamica ( a parte) ) re corpi di capacità termica,,, che si trovano alle temperature,,, vengono posti a contatto. Nell ipotesi che i tre corpi non scambino calore con l
VOLUME 2 - MODULO C UNITÀ DIDATTICA C1 SOLUZIONE DEL PROBLEMA INIZIALE
 Vol_C.doc VOLUME - MODULO C UNITÀ DIDATTICA C SOLUZIONI DELLE VERIFICHE DEI PREREQUISITI. Il eso volumico o eso secifico è ari al rodotto della massa volumica er l accelerazione di gravità. Pertanto si
Vol_C.doc VOLUME - MODULO C UNITÀ DIDATTICA C SOLUZIONI DELLE VERIFICHE DEI PREREQUISITI. Il eso volumico o eso secifico è ari al rodotto della massa volumica er l accelerazione di gravità. Pertanto si
Lezione 5: Termodinamica. Seminario didattico
 Lezione 5: Termodinamica Seminario didattico Esercizio n 1 Ad una mole di gas monoatomico viene fatto percorrere il ciclo mostrato in figura il processo bc è una espansione adiabatica; p B =1.03 bar, V
Lezione 5: Termodinamica Seminario didattico Esercizio n 1 Ad una mole di gas monoatomico viene fatto percorrere il ciclo mostrato in figura il processo bc è una espansione adiabatica; p B =1.03 bar, V
p atm 1. V B ; 2. T B ; 3. W A B 4. il calore specifico a volume costante c V
 1 Esercizio (tratto dal Problema 13.4 del Mazzoldi 2) Un gas ideale compie un espansione adiabatica contro la pressione atmosferica, dallo stato A di coordinate, T A, p A (tutte note, con p A > ) allo
1 Esercizio (tratto dal Problema 13.4 del Mazzoldi 2) Un gas ideale compie un espansione adiabatica contro la pressione atmosferica, dallo stato A di coordinate, T A, p A (tutte note, con p A > ) allo
TEOREMA DEL CAMPIONAMENTO
 1 TEOREMA DEL CAMPIONAMENTO nota per il orso di Teleomuniazioni a ura di F. Benedetto G. Giunta 1. Introduzione Il proesso di ampionamento è di enorme importanza ai fini della realizzazione dei dispositivi
1 TEOREMA DEL CAMPIONAMENTO nota per il orso di Teleomuniazioni a ura di F. Benedetto G. Giunta 1. Introduzione Il proesso di ampionamento è di enorme importanza ai fini della realizzazione dei dispositivi
Modellazione dinamica per il controllo di processo. Davide Manca Strumentazione e Controllo di Impianti Chimici Politecnico di Milano
 L2 Modellazione dinamica er il controllo di rocesso Davide Manca Strumentazione e Controllo di Imianti Chimici Politecnico di Milano L2 Dinamica di rocesso Il controllo di rocesso richiede la conoscenza
L2 Modellazione dinamica er il controllo di rocesso Davide Manca Strumentazione e Controllo di Imianti Chimici Politecnico di Milano L2 Dinamica di rocesso Il controllo di rocesso richiede la conoscenza
f Le trasformazioni e il trattamento dell aria
 f Le trasformazioni e il trattamento dell aria 1 Generalità Risolvendo il sistema (1) rispetto ad m a si ottiene: () Pertanto, il punto di misela sul diagramma psirometrio è situato sulla ongiungente dei
f Le trasformazioni e il trattamento dell aria 1 Generalità Risolvendo il sistema (1) rispetto ad m a si ottiene: () Pertanto, il punto di misela sul diagramma psirometrio è situato sulla ongiungente dei
ESERCIZI ELEMENTARI DI FLUIDODINAMICA
 ISTITUZIONI I INGEGNERI EROSPZILE ESERCIZI ELEMENTRI I FLUIOINMIC ESERCIZI ELEMENTRI I FLUIOINMIC RICHIMI INTROUTTII Il fluido viene onsiderato ome un ontinuo, ossia vengono identifiate alune grandezze
ISTITUZIONI I INGEGNERI EROSPZILE ESERCIZI ELEMENTRI I FLUIOINMIC ESERCIZI ELEMENTRI I FLUIOINMIC RICHIMI INTROUTTII Il fluido viene onsiderato ome un ontinuo, ossia vengono identifiate alune grandezze
Lezione 24 IL TEOREMA DI BERNOULLI
 unti dei corsi di Idraulica e Idrodinamica Lezione 4 IL TEOREM DI ERNOULLI Nella LEZIONE 3 abbiamo dedotto il teorema di ernoulli er le correnti fluide, artendo dall equazione del moto valida in tali circostanze.
unti dei corsi di Idraulica e Idrodinamica Lezione 4 IL TEOREM DI ERNOULLI Nella LEZIONE 3 abbiamo dedotto il teorema di ernoulli er le correnti fluide, artendo dall equazione del moto valida in tali circostanze.
Principi di Economia Microeconomia. Esercitazione 1 Domanda, Offerta ed Equilibrio. Soluzioni
 Princii di Economia Microeconomia Esercitazione 1 Domanda, Offerta ed Equilibrio Soluzioni Maria Tsouri Novembre 1 1. Raresentate graficamente le seguenti funzioni di domanda e di offerta: (a) d =1-P Calcoliamo
Princii di Economia Microeconomia Esercitazione 1 Domanda, Offerta ed Equilibrio Soluzioni Maria Tsouri Novembre 1 1. Raresentate graficamente le seguenti funzioni di domanda e di offerta: (a) d =1-P Calcoliamo
A.A Corso di GESTIONE DELLE RISORSE IDRICHE APPENDICE F LAMINAZIONE DELLE PIENE AD OPERA DEI SERBATOI
 A.A. 2000-2001 Corso di GESTIONE DELLE RISORSE IDRICHE APPENDICE F LAMINAZIONE DELLE PIENE AD OPERA DEI SERBATOI 1 LA LAMINAZIONE DELLE PIENE NEI SERBATOI Esistono essenzialmente tre tiologie di oere er
A.A. 2000-2001 Corso di GESTIONE DELLE RISORSE IDRICHE APPENDICE F LAMINAZIONE DELLE PIENE AD OPERA DEI SERBATOI 1 LA LAMINAZIONE DELLE PIENE NEI SERBATOI Esistono essenzialmente tre tiologie di oere er
Principi di Economia - Microeconomia Esercitazione 2 Domanda, offerta ed equilibrio di mercato Soluzioni
 Princii di Economia - Microeconomia Esercitazione 2 Domanda, offerta ed equilibrio di mercato Soluzioni Daria Vigani Febbraio 2014 1. Assumiamo la seguente funzione di domanda di mercato er il gelato:
Princii di Economia - Microeconomia Esercitazione 2 Domanda, offerta ed equilibrio di mercato Soluzioni Daria Vigani Febbraio 2014 1. Assumiamo la seguente funzione di domanda di mercato er il gelato:
5. Misure di capacità termica a bassa temperatura
 Edoardo Milotti Laboratorio di Fisica I, A. A. 007-008 5. Misure di capacità termica a bassa temperatura Si trova sperimentalmente che la capacità termica molare (a volume costante) dei solidi elementari
Edoardo Milotti Laboratorio di Fisica I, A. A. 007-008 5. Misure di capacità termica a bassa temperatura Si trova sperimentalmente che la capacità termica molare (a volume costante) dei solidi elementari
 La costante (p 0 0 /273) la si riesprime come n R dove R è una costante universale il cui valore dipende solo dalle unità di misura usate: R8.31 Joule/(K mole) e n è il numero di moli L equazione di stato
La costante (p 0 0 /273) la si riesprime come n R dove R è una costante universale il cui valore dipende solo dalle unità di misura usate: R8.31 Joule/(K mole) e n è il numero di moli L equazione di stato
Trasformazioni termodinamiche
 Trasformazioni termodinamiche Evoluzione di un sistema termodinamico -> trasformazione termodinamica Trasformazione quasi statica : stati successivi assunti dal sistema sono stati di equilibrio (parametri
Trasformazioni termodinamiche Evoluzione di un sistema termodinamico -> trasformazione termodinamica Trasformazione quasi statica : stati successivi assunti dal sistema sono stati di equilibrio (parametri
Equilibri in fase gassosa
 Equilibri in fase gassosa 1) Le seguenti reazioni hanno luogo in fase gassosa; srivere la ostante di equilibrio ed indiare: - se sono spontanee o no a ondizioni standard; - se sono favorite o sfavorite
Equilibri in fase gassosa 1) Le seguenti reazioni hanno luogo in fase gassosa; srivere la ostante di equilibrio ed indiare: - se sono spontanee o no a ondizioni standard; - se sono favorite o sfavorite
