Il gruppo peptidico ha una struttura rigida e planare, dovuta al parziale. legame peptidico. O O - N N + H H
|
|
|
- Berto Bettini
- 6 anni fa
- Visualizzazioni
Transcript
1 Il legame peptidico Il gruppo peptidico ha una struttura rigida e planare, dovuta al parziale (~40 %) carattere di doppio legame del legame peptidico. O O - C C N N + H H
2 Il legame peptidico pp Il legame peptidico C N è 0.13 Å più corto del legame singolo N C α e0.08å più lungo di un doppio legame C=N. Il legame peptidico, quindi, presenta per il 60 % una natura di legame singolo e per il 40 % una natura di legame doppio.
3 Il legame peptidico Generalmente il gruppo peptidico assume la conformazione trans trans -atomi (C α ) n e(c α ) n+1 opposti legame peptidico C N. rispetto al In alcuni casi il gruppo peptidico può assume la conformazione cis (~8 kj mol -1 meno stabile della conformazione trans. Problemi sterici, perché distanza C α -C α =2.8Å). cis
4 Il legame peptidico O Il gruppo peptidico ha un momento di dipolo. Gli atomi O e N sono rispettivamente più elettronegativi di C ed H. La conseguente delocalizzazione di carica porta alla N formazione di due dipoli (CO ed NH) con analoga direzione e verso nel gruppo H peptidico. Il momento di dipolo risultante è di circa 3.5 Debye. C
5 Angoli diedri φ e ψ Proprietà fondamentale del legame peptidico è di essere rigido e planare. Isoligradidilibertàdell unità peptidica rigida sono: - rotazione intorno al legame N C α (angolo φ) - rotazione intorno al legame C α C (angolo ψ) A ciascun aminoacido viene associata una coppia di angoli diedri (φ, ψ), che determina in modo univoco la conformazione della catena principale. i
6 Angoli diedri φ e ψ Molte combinazioni di angoli (φ, ψ) per gli aminoacidi non sono permesse, a causa delle collisioni steriche fra atomi della catena principale e/o delle catene laterali. I valori di (φ, ψ) stericamente permessi si possono determinare calcolando le distanze fra gli atomi di un tripeptide in corrispondenza di tutti i valori (φ, ψ) per l unità peptidica centrale. Le conformazioni stericamente proibite sono quelle per cui la distanza interatomica di un interazione non covalente è inferiore alla corrispondente somma di raggi di van der Waals.
7 La struttura secondaria Le strutture secondarie sono disposizioni regolari della catena polipeptidica principale, che vengono classificate senza fare riferimento al tipo di aminoacidi. Esse sono stabilizzate da legami idrogeno fra il gruppo aminico e il gruppo carbonilico della catena principale. La regolarità della conformazione risulta dalla regolarità della struttura atomica della catena polipeptidica, ed è evidenziata dai valori degli angoli diedri (φ, ψ) di ciascun aminoacido, che si ripetono quasi costantemente all interno di ogni elemento di struttura secondaria.
8 La struttura secondaria Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse turn Circa il % degli aminoacidi delle proteine globulari assume la conformazione regolare tipica di uno dei tre tipi di struttura secondaria. I segmenti di catena polipeptidica che non sono in α elica, foglietto β o turn, assumono o la conformazione o o chiamata ata loop o random coil,, struttura non ripetitiva né regolare, spesso priva di legami idrogeno tra gli aminoacidi che la compongono.
9 α elica L α elica èla struttura secondaria più frequentemente adottata dalla catena polipeptidica delle proteine: circa il % degli aminoacidi delle proteine globulari di struttura tridimensionale nota assume la conformazione ad α elica. Fu descritta per la prima volta nel 1951 da Linus Pauling e Robert Corey (California Institute of Technology), che ipotizzarono una struttura stabile ed energeticamente favorita nelle proteine, sulla base di parametri geometrici accurati per lunitàpeptidica l unità dedotti dall analisi analisi cristallografica di strutture di piccole molecole. La previsione di Pauling e Corey ricevette molto presto il supporto sperimentale dalla determinazione della struttura tridimensionale della mioglobina (John Kendrew, 1960) e dell emoglobina (Max Perutz, 1961), due proteine i cui elementi di struttura secondaria sono α eliche.
10 α elica Un α elica destrorsa è caratterizzata da: (φ, ψ) =(-57, -47 ), corrispondenti al quadrante in basso a sinistra del plot di Ramachandran; n =3.6 residui per giro p =5.4 Å d =1.5 Å Esistono anche α eliche di tipo sinistrorso (quadrante in alto a destra del plot di Ramachandran), molto rare e limitate a pochi aminoacidi. Esse sono caratterizzate da valori (φ, ψ) = (+57, +47 ) e da stessi valori per n e p (n negativo).
11 α elica Le catene laterali degli aminoacidi che appartengono ad un α elica destrorsa sono rivolte verso l esterno e verso l estremità N-terminale dell elica. In questo modo si evitano interferenze steriche con la catena polipeptidica principale e tra le catene laterali stesse. Un α elica sinistrorsa i si trova molto raramente nelle proteine (solo brevi tratti di 3-5 aminoacidi) perché le catene laterali interferirebbero stericamente con la catena principale.
12 Foglietto β Nll Nello stesso anno (1951) in cui proposero l α elica, Pauling e Corey postularono anche l esistenza di un altra struttura secondaria: il foglietto β (β-sheet). Dopo l α elica, la conformazione più ricorrente adottata dalla catena polipeptidica delle proteine è il foglietto β: circa il % degli aminoacidi nelle proteine globulari conosciute ricorre in questa conformazione. Gli angoli diedri (φ, ψ) della catena polipeptidica in conformazione foglietto β cadono nella zona permessa del plot di Ramachandran (quadrante in alto a sinistra).
13 Filamento β L unità costituente i foglietti β èilfilamento β (βstrand), lungo in media da 5 a 10 aminoacidi, con la catena polipeptidica quasi completamente estesa. I foglietti β nelle proteine globulari sono costituiti da 2 a 15 filamenti β abbinati lateralmente, con un valor medio di 6. Il filamento β si può considerare un tipo speciale di elica, con n = 2 residui per giro e una traslazione d =3.4Åper aminoacido. I filamenti β sono allineati uno vicino all altro, in modo tale che si possano formare legami idrogeno tra i gruppi CO di un filamento eigruppi NH del filamento β adiacente e viceversa.
14 Foglietto β I foglietti β formati da un certo numero di filamenti β sono pieghettati (pleated), con gli atomi C α degli aminoacidi adiacenti alternativamente leggermente sopra e sotto il piano del foglietto β, dando al foglietto β l apparenza di un foglietto pieghettato. Le catene laterali degli aminoacidi che compongono il foglietto β seguono lo stesso andamento, per cui puntano alternativamente sopra e sotto il foglietto β. Spesso un foglietto β può presentare tutte le catene laterali polari su una faccia e tutte le catene laterali non polari sull altra (ideale per costruire la superficie delle proteine).
15 Foglietto β (v (v. Animated_Lesson 8_1c) I filamenti β possono interagire fra loro a formare i foglietti β in due modi diversi: -gli aminoacidi nei filamenti β adiacenti hanno direzioni alternate (N-term C-term seguito da C-term N-term seguito da N-term C-term, ) esi parla di foglietto β antiparallelo; -gli aminoacidi nei filamenti β allineati vanno tutti nella stessa direzione (sempre N-term C-term) esi parla di foglietto β parallelo.
16 Foglietto β antiparallelo Angoli diedri (φ, ψ) =(-139, 135 ). Coppie di legami idrogeno poco spaziate si alternano a coppie largamente spaziate. Tali legami idrogeno sono paralleli fra loro e perpendicolari alla direzione dei filamenti β. Idipoli associati alle unità peptidiche costituenti un filamento β si annullano.
17 Foglietto β parallelo Angoli diedri (φ, ψ) =(-119, 113 ). Coppie di legami idrogeno uniformemente spaziati, non sono paralleli fra loro né perpendicolari alla direzione dei filamenti β. I dipoli associati alle unità peptidiche costituenti un filamento β si annullano. I foglietti β paralleli sono meno frequenti di quelli antiparalleli.
18 Foglietto β misto I filamenti β si possono anche combinare aformare un foglietto β misto, con alcune coppie di filamenti antiparalleli ed altre paralleli. I foglietti β misti sono meno frequenti di dei foglietti β antiparalleli e paralleli.
19 Domini e struttura terziaria Struttura terziaria L arrangiamento spaziale degli amminoacidi di una singola catena polipeptidica a formare la sua struttura 3D viene chiamata struttura terziaria (o struttura tridimensionale) - ripiegamento nello spazio dell intera catena polipeptidica (catena principale e catene laterali) - la catena polipeptidica decorre in modo da non formare mai nodi elementi di struttura secondaria elementi di struttura supersecondaria (motivi) domini struttura terziaria
20 Domini e struttura terziaria Architettura della Struttura terziaria Le strutture terziarie delle proteine sono molto diversificate. E tuttavia possibile trovare una logica nello loro architettura: - alcuni elementi di struttura secondaria possono organizzarsi reciprocamente a dare motivi strutturali o strutture supersecondarie (gli stessi motivi sono ricorrenti in molte proteine) - più motivi possono unirsi a e dar luogo ad un dominio strutturale (regione strutturalmente parzialmente autonoma) - una molecola proteica può essere costituita da uno o più domini
21 Struttura Supersecondaria o Motivi I domini sono costituiti da diverse combinazioni di elementi di struttura secondaria e di motivi Struttura supersecondaria o motivi -le α eliche e i filamenti β costituenti i motivi sono adiacenti uno all altro nella struttura tridimensionale e connessi da regioni di loop; a loro volta, i motivi adiacenti o formati da regioni consecutive della catena polipeptidica sono vicini nella struttura tridimensionale - alcuni di questi motivi si possono associare ad una particolare funzione, come ad esempio il legame del DNA, mentre altri non hanno una funzione biologica specifica, ma sono semplicemente parte di organizzazioni strutturali più ampie e complesse. I principali motivi individuati nelle proteine sono: (1) motivi α, (2) motivi β, (3) motivi α/β
22 Motivi e domini Motivi α Le α eliche isolate non sono stabili in soluzione nelle strutture terziarie delle proteine le α eliche si impaccano in modo adiacente una all altra attraverso interazioni tra le catene laterali idrofobiche. I principali motivi α sono: (1) α-loop-α e (2) EF-hand α-loop-α Il motivo α più semplice consiste di 2 α eliche antiparallele collegate da una regione di loop, chiamato α hairpin. N C La più breve connessione fra 2 α eliche coinvolge 2 amminoacidi, di cui il secondo è sempre Gly, orientati perpendicolarmente agli assi delle eliche.
23 Motivi e domini Motivi β β-hairpin 2 filamenti β antiparalleli adiacenti collegati da un tratto di loop. ricorre molto frequentemente nelle strutture β antiparallele, come motivo isolato o come parte di un foglietto β più complesso. La lunghezza del tratto di loop tra i filamenti β è variabile, ma di solito è costituito da 2-5 amminoacidi. A questo motivo β non è associata nessuna funzione specifica.
24 Motivi e domini Motivi αβ Crossover connection La cross over connection consiste di di due filamenti β paralleli, un α elica e due loop (che possono variare notevolmente in lunghezza). L α elica si impacca con i 2 filamenti β, riparando dal solvente gli amminoacidi idrofobici dei filamenti β. La cross over connection può essere considerata come un largo giro di superelica, a partire dal primo filamento β, attraverso la connessione, fino al secondo filamento β.
25 Domini e struttura terziaria Architettura della Struttura terziaria L unità fondamentale della struttura terziaria è il dominio struttura terziaria viene usato sia per indicare il modo in cui le strutture secondarie si arrangiano a formare i domini, sia il modo in cui una singola catena polipeptidica si ripiega in uno o più domini - se esiste una significativa omologia di sequenza fra due domini di proteine diverse, questi domini hanno struttura terziaria simile
26 Domini e struttura terziaria Domini I domini sono definiti come una catena polipeptidica o parte di essa che si ripiega indipendentemente in una struttura stabile, tale da esistere da solo in soluzione acquosa. - i domini hanno dimensione variabile, di solito < 250 aa - il 49% di tutti i domini varia tra 51 e 150 aa - il dominio più grande ha 907 aa - il numero max di domini in una proteina è 13 I domini sono unità funzionali e spesso a domini diversi di una proteina sono associate funzioni diverse. I domini hanno cuori idrofobici minimizzazione numero interazioni sfavorevoli dei gruppi idrofobici con il solvente acquoso massimizzazione numero interazioni favorevoli di van der Waals dei gruppi idrofobici fra loro
27 Domini e struttura terziaria Stabilizzazione struttura terziaria la struttura terziaria delle proteine è estremamente compatta. La densità della porzione interna di una molecola proteica globulare è pari a quella di cristalli di amminoacidi il denso impaccamento dei residui massimizza le interazioni di van der Waals in generale, i residui idrofobici sono all interno della molecola e quelli idrofilici all esterno. Le molecole proteiche hanno uno o più nuclei idrofobici (effetto idrofobico) all interno tutte le eventuali cariche sono accoppiate (legami ionici) tutti i gruppi capaci di formare legami-h li formano gli eventuali ponti disolfuro (presenti prevalentemente in proteine extracellulari) conferiscono un ulteriore effetto stabilizzante sulla struttura terziaria).
28 Motivi e domini Domini Michael Levitt and Cyrus Chothia, sulla base di semplici considerazioni sulla connessione dei motivi, hanno classificato i domini in 3 gruppi principali, a seconda delle strutture secondarie e dei motivi coinvolti nella loro formazione: - domini α (coiled-coil, fascio a 4 eliche, fold globinico) - domini β (topologia ad up-and-down, chiave greca, jelly roll) - domini α/β - altro (domini α+β, domini irregolari con legami crociati)
29 Motivi e domini Domini α Coiled-coil Il modo più semplice di associazione compatta di α eliche è quello di impaccarsi a coppie. I coiled coil sono la base di alcune proteine fibrose, quali l α cheratina e la miosina, e di proteine che legano DNA o RNA. Superelica sinistrorsa costituita da 2 α eliche destrorse (3.5 residui per giro), in modo tale che le interazioni delle catene laterali fra le 2 eliche si ripetano ogni 7 amminoacidi (2 giri di elica). Motivo di sequenza (eptapeptide con residui indicati con le lettere a-g)
30 Page 232 Struttura schematica dell α-cheratina
Macromolecole Biologiche. La struttura secondaria (II)
 La struttura secondaria (II) Nello stesso anno (1951) in cui proposero l α elica, Pauling e Corey postularono anche l esistenza di un altra struttura secondaria: il foglietto β (β-sheet). Dopo l α elica,
La struttura secondaria (II) Nello stesso anno (1951) in cui proposero l α elica, Pauling e Corey postularono anche l esistenza di un altra struttura secondaria: il foglietto β (β-sheet). Dopo l α elica,
Macromolecole Biologiche. La struttura secondaria (I)
 La struttura secondaria (I) La struttura secondaria Struttura primaria PRPLVALLDGRDETVEMPILKDVATVAFCDAQSTQEIHE Struttura secondaria La struttura secondaria Le strutture secondarie sono disposizioni regolari
La struttura secondaria (I) La struttura secondaria Struttura primaria PRPLVALLDGRDETVEMPILKDVATVAFCDAQSTQEIHE Struttura secondaria La struttura secondaria Le strutture secondarie sono disposizioni regolari
Chimica Biologica A.A α-elica foglietto β reverse turn
 Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Diagramma di Ramachandran
 Chimica Biologica A.A. 2010-2011 Diagramma di Ramachandran Diagramma di Ramachandran Catena polipeptidica La formazione in successione di legami peptidici genera la cosiddetta catena principale o scheletro
Chimica Biologica A.A. 2010-2011 Diagramma di Ramachandran Diagramma di Ramachandran Catena polipeptidica La formazione in successione di legami peptidici genera la cosiddetta catena principale o scheletro
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi. Possono assumere forme diverse a seconda della funzione
 Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Macromolecole Biologiche. La struttura secondaria (III)
 La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
La struttura delle proteine
 La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico
 gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico Il legame peptidico si ha quando il gruppo carbossilico (-
gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico Il legame peptidico si ha quando il gruppo carbossilico (-
Chimotripsina Una proteina globulare. Glicina Un amminoacido
 Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
30/10/2015 LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE
 LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE 1 CARATTERISTICHE DEL LEGAME PEPTIDICO lunghezza intermedia tra un legame singolo e uno doppio ibrido di risonanza per il parziale carattere di doppio
LIVELLI DI ORGANIZZAZIONE STRUTTURALE DELLE PROTEINE 1 CARATTERISTICHE DEL LEGAME PEPTIDICO lunghezza intermedia tra un legame singolo e uno doppio ibrido di risonanza per il parziale carattere di doppio
Proprietà comuni. Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici
 Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Struttura secondaria, Motivi e Domini nelle Proteine
 Struttura secondaria, Motivi e Domini nelle Proteine Proprietà generali Le forme ioniche degli aminoacidi, senza considerare alcuna ionizzazione delle catene laterali. Proprietà generali Tutti gli aminoacidi
Struttura secondaria, Motivi e Domini nelle Proteine Proprietà generali Le forme ioniche degli aminoacidi, senza considerare alcuna ionizzazione delle catene laterali. Proprietà generali Tutti gli aminoacidi
Formazione del legame peptidico:
 Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
La struttura delle proteine e e descritta da quattro livelli di organizzazione
 La struttura delle proteine e e descritta da quattro livelli di organizzazione Struttura Primaria- - la sequenza di aminoacidi Struttura Secondaria - strutture locali stabilizzate da legami H che coinvolgono
La struttura delle proteine e e descritta da quattro livelli di organizzazione Struttura Primaria- - la sequenza di aminoacidi Struttura Secondaria - strutture locali stabilizzate da legami H che coinvolgono
Gli angoli diedri (φ, ψ) della catena polipeptidica in conformazione foglietto β cadono nella. (quadrante in alto a sinistra).
 Strutture secondarie (b) Foglietto β Nello stesso anno (1951) in cui proposero l α α elica, Pauling e Corey postularono anche l esistenza di un altra struttura secondaria: il foglietto β (β-sheet). Dopo
Strutture secondarie (b) Foglietto β Nello stesso anno (1951) in cui proposero l α α elica, Pauling e Corey postularono anche l esistenza di un altra struttura secondaria: il foglietto β (β-sheet). Dopo
Il legame peptidico è polare
 Scaricato da Il legame peptidico è polare SONO FAVORITE QUELLE CONFIGURAZIONI CHE CONSENTONO IL MAGGIOR NUMERO DI INTERAZIONI TRA LE PARTI DELLA CATENA POLIPEPTIDICA. A CAUSA DELLA POLARITA' DEL LEGAME
Scaricato da Il legame peptidico è polare SONO FAVORITE QUELLE CONFIGURAZIONI CHE CONSENTONO IL MAGGIOR NUMERO DI INTERAZIONI TRA LE PARTI DELLA CATENA POLIPEPTIDICA. A CAUSA DELLA POLARITA' DEL LEGAME
Aminoacidi. Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α
 Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Macromolecole Biologiche. I domini (I)
 I domini (I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una
I domini (I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una
CENNI SUL TIPO DI FORZE
 CENNI SUL TIPO DI FORZE Forze deboli che influenzano la struttura delle proteine: le interazioni di van der Waals repulsione attrazione Forze attrattive dovute a interazioni istantanee che si generano
CENNI SUL TIPO DI FORZE Forze deboli che influenzano la struttura delle proteine: le interazioni di van der Waals repulsione attrazione Forze attrattive dovute a interazioni istantanee che si generano
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
scaricato da I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE
 Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
LE PROTEINE -struttura tridimensionale-
 LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
Proteine. Struttura tridimensionale Parte II
 Proteine Struttura tridimensionale Parte II (D.L. Nelson, M.M. Cox, Lehninger Principles of Biochemistry, 4th ed., W.H. Freeman & Co., 2005) Plot di Ramachandran Una situazione opposta a quella della glicina
Proteine Struttura tridimensionale Parte II (D.L. Nelson, M.M. Cox, Lehninger Principles of Biochemistry, 4th ed., W.H. Freeman & Co., 2005) Plot di Ramachandran Una situazione opposta a quella della glicina
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 6
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 6 La struttura secondaria delle proteine Concetti chiave: Il carattere planare di un gruppo peptidico limita la flessibilitàconformazionale
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 6 La struttura secondaria delle proteine Concetti chiave: Il carattere planare di un gruppo peptidico limita la flessibilitàconformazionale
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
COMPORTAMENTO ANFOTERO DEGLI AA
 Proprietà acido-basiche degli aminoacidi FORMA NON IONICA Non esiste a nessun valore di ph FORMA ZWITTERIONICA È la forma prevalente a ph 7 COMPORTAMENTO ANFOTERO DEGLI AA CARICA NETTA +1 CARICA NETTA
Proprietà acido-basiche degli aminoacidi FORMA NON IONICA Non esiste a nessun valore di ph FORMA ZWITTERIONICA È la forma prevalente a ph 7 COMPORTAMENTO ANFOTERO DEGLI AA CARICA NETTA +1 CARICA NETTA
PROTEINE DEFINIZIONE:
 Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
Struttura delle Proteine
 Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari
Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari
Le macromolecole dei tessuti - 1
 Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Parametri dell α-elica. residui/giro 3.6. passo dell elica
 GRAFICO DI RAMACHANDRAN Parametri dell α-elica residui/giro 3.6 spazio/residuo passo dell elica 1.5 Å 5.4 Å 1 L α-elica può essere destabilizzata da interazioni tra i gruppi R: repulsione/attrazione elettrostatica
GRAFICO DI RAMACHANDRAN Parametri dell α-elica residui/giro 3.6 spazio/residuo passo dell elica 1.5 Å 5.4 Å 1 L α-elica può essere destabilizzata da interazioni tra i gruppi R: repulsione/attrazione elettrostatica
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Domini nelle Proteine
 Struttura secondaria, Motivi e Domini nelle Proteine Proprietà generali Le forme ioniche degli aminoacidi, senza considerare alcuna ionizzazione delle catene laterali. Proprietà generali Tutti gli aminoacidi
Struttura secondaria, Motivi e Domini nelle Proteine Proprietà generali Le forme ioniche degli aminoacidi, senza considerare alcuna ionizzazione delle catene laterali. Proprietà generali Tutti gli aminoacidi
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Le proteine. Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico.
 Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Formazione. di un peptide.
 Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
Le Biomolecole II parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole II parte Lezioni d'autore di Giorgio Benedetti LA STRUTTURA TERZIARIA DI UNA PROTEINA La struttura tridimensionale adottata da una proteina è detta struttura terziaria. Essa prende in considerazione
Le Biomolecole II parte Lezioni d'autore di Giorgio Benedetti LA STRUTTURA TERZIARIA DI UNA PROTEINA La struttura tridimensionale adottata da una proteina è detta struttura terziaria. Essa prende in considerazione
I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini.
 I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una catena polipeptidica
I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una catena polipeptidica
La struttura delle proteine e. organizzazione. ramificati di aminoacidi
 La struttura delle proteine e descritta da quattro livelli di organizzazione Struttura Primaria- la sequenza di aminoacidi Struttura Secondaria - strutture locali stabilizzate da legami H che coinvolgono
La struttura delle proteine e descritta da quattro livelli di organizzazione Struttura Primaria- la sequenza di aminoacidi Struttura Secondaria - strutture locali stabilizzate da legami H che coinvolgono
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE
 CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
Macromolecole Biologiche Interazioni non covalenti
 Interazioni non covalenti D H A δ - δ + δ - Le interazioni non covalenti Interazioni fra atomi che non sono legati da legami covalenti. Le interazioni non covalenti sono molto meno intense rispetto alle
Interazioni non covalenti D H A δ - δ + δ - Le interazioni non covalenti Interazioni fra atomi che non sono legati da legami covalenti. Le interazioni non covalenti sono molto meno intense rispetto alle
Funzioni delle proteine
 Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
STRUTTURA TRIDIMENSIONALE DELLE PROTEINE
 STRUTTURA TRIDIMENSIONALE DELLE PROTEINE Biologia della Cellula Animale 2016 1 STRUTTURA PROTEINE Cooper: The Cell, a Molecular Approach, 2 nd ed. http://en.wikipedia.org/wiki/protein_structure STRUTTURA
STRUTTURA TRIDIMENSIONALE DELLE PROTEINE Biologia della Cellula Animale 2016 1 STRUTTURA PROTEINE Cooper: The Cell, a Molecular Approach, 2 nd ed. http://en.wikipedia.org/wiki/protein_structure STRUTTURA
Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH
 Nomenclatura AMIDI Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH R-CO-O-CO-R + H 2 O Alcol + Acido estere R-COOH
Nomenclatura AMIDI Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH R-CO-O-CO-R + H 2 O Alcol + Acido estere R-COOH
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi-Peptidi-Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Stereoisomeri: composti con la stessa connessione tra gli atomi, ma con una differente
Amminoacidi Peptidi Proteine Amminoacidi-Peptidi-Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Stereoisomeri: composti con la stessa connessione tra gli atomi, ma con una differente
Nel DNA e nell RNA i nucleotidi sono legati covalentemente da legami fosfodiesterei.
 DNA e RNA Composizione e proprietà Struttura Analisi 1 STRUTTURA DAGLI ACIDI NUCLEICI Nel DNA e nell RNA i nucleotidi sono legati covalentemente da legami fosfodiesterei. I gruppi fosforici hanno pka vicino
DNA e RNA Composizione e proprietà Struttura Analisi 1 STRUTTURA DAGLI ACIDI NUCLEICI Nel DNA e nell RNA i nucleotidi sono legati covalentemente da legami fosfodiesterei. I gruppi fosforici hanno pka vicino
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
Macromolecole Biologiche. I domini (II)
 I domini (II) Domini β Nonostante l elevato numero di possibili disposizioni di filamenti β (a costituire foglietti β antiparalleli) connessi da tratti di loop, i domini β più frequentemente osservati
I domini (II) Domini β Nonostante l elevato numero di possibili disposizioni di filamenti β (a costituire foglietti β antiparalleli) connessi da tratti di loop, i domini β più frequentemente osservati
Proteine. Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana)
 Proteine Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana) Ormoni e Fattori di crescita Anticorpi Trasporto Trasporto (emoglobina, LDL, HDL.) Fenotipo Proteine
Proteine Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana) Ormoni e Fattori di crescita Anticorpi Trasporto Trasporto (emoglobina, LDL, HDL.) Fenotipo Proteine
lati esterni altamente Idrofilici
 I due filamenti complementari del DNA sono antiparalleli: uno è in direzione 5-3 e l altro in direzione 3-5. parte interna idrofobica lati esterni altamente Idrofilici APPAIAMENTO DELLE BASI AZOTATE: 2
I due filamenti complementari del DNA sono antiparalleli: uno è in direzione 5-3 e l altro in direzione 3-5. parte interna idrofobica lati esterni altamente Idrofilici APPAIAMENTO DELLE BASI AZOTATE: 2
Le Biomolecole I parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Introduzione alla biologia della cellula. Lezione 2 Le biomolecole
 Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita i da unoo più domini.
 Idomini(I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita i da unoo più domini. I domini sono definiti come parte
Idomini(I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita i da unoo più domini. I domini sono definiti come parte
Biologia. Lezione 09/11/2010
 Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
La struttura delle proteine viene suddivisa in quattro livelli di organizzazione:
 Luciferasi Emoglobina Cheratina La struttura delle proteine viene suddivisa in quattro livelli di organizzazione: Struttura primaria Struttura secondaria Struttura terziaria Struttura quaternaria Sequenza
Luciferasi Emoglobina Cheratina La struttura delle proteine viene suddivisa in quattro livelli di organizzazione: Struttura primaria Struttura secondaria Struttura terziaria Struttura quaternaria Sequenza
Macromolecole Biologiche. I domini (III)
 I domini (III) Domini α/β La cross over connection è l unità costitutiva su cui si basa la topologia di 3 tipi di domini α/β osservati nelle proteine: - α/β barrel - motivi ricchi di Leu (fold a ferro
I domini (III) Domini α/β La cross over connection è l unità costitutiva su cui si basa la topologia di 3 tipi di domini α/β osservati nelle proteine: - α/β barrel - motivi ricchi di Leu (fold a ferro
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 5
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 5 Il legame peptidico Concetti chiave: In un polipeptide gli amminoacidi sono uniti dai legami peptidici. Il legame
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 5 Il legame peptidico Concetti chiave: In un polipeptide gli amminoacidi sono uniti dai legami peptidici. Il legame
Acidi Nucleici: DNA = acido deossiribonucleico
 Acidi Nucleici: DNA = acido deossiribonucleico depositario dell informazione genetica RNA: acido ribonucleico trascrizione e traduzione dell informazione genetica dogma centrale della biologia molecolare
Acidi Nucleici: DNA = acido deossiribonucleico depositario dell informazione genetica RNA: acido ribonucleico trascrizione e traduzione dell informazione genetica dogma centrale della biologia molecolare
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso secco. Svolgono funzioni biologiche
STRUTTURA E FUNZIONE DELLE PROTEINE Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso secco. Svolgono funzioni biologiche
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
I PROTIDI ASPETTI GENERALI
 I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
Struttura secondaria
 Struttura secondaria Struttura localmente ordinata Polimeri lineari ad unità monomeriche asimmetriche elica j = 0,1,2,..., N N = numero di residui z j = h z j + z 0 x j = r cos (j2p h z /P + d 0 ) y j
Struttura secondaria Struttura localmente ordinata Polimeri lineari ad unità monomeriche asimmetriche elica j = 0,1,2,..., N N = numero di residui z j = h z j + z 0 x j = r cos (j2p h z /P + d 0 ) y j
- Φ e ψ Presenta 3,6 residui per spira -HB between C=O n residue n and NH n+4. - α-helix
 Structure Basic elements - Φ e ψ -60-50. -Presenta 3,6 residui per spira -HB between C=O n residue n and NH n+4. - α-helix Β-sheet Red oxygen Blu nitrogen white hydrogen black Cα Violet lateral chain -at
Structure Basic elements - Φ e ψ -60-50. -Presenta 3,6 residui per spira -HB between C=O n residue n and NH n+4. - α-helix Β-sheet Red oxygen Blu nitrogen white hydrogen black Cα Violet lateral chain -at
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. STRUTTURA TERZIARIA
 STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
Il legame peptidico. Il legame che ne risulta è il legame peptidico. Nelle cellule il legame viene creato nei ribosomi, catalizzato da enzimi.
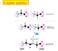 Il legame peptidico Il legame peptidico La polimerizzazione di AA viene raggiunta per eliminazione di una molecola d acqua tra il gruppo carbossilico di un AA e il gruppo amminico del successivo. Il legame
Il legame peptidico Il legame peptidico La polimerizzazione di AA viene raggiunta per eliminazione di una molecola d acqua tra il gruppo carbossilico di un AA e il gruppo amminico del successivo. Il legame
α-cheratine (α-elica) collageni e cheratine β-cheratine (conformazione β) M.N. Gadaleta
 Per la scoperta delle conformazioni più comuni delle catene polipeptidiche cioè α-elica e β-conformazione è stato particolarmente importante lo studio delle cheratine, proteine fibrose, e l analisi della
Per la scoperta delle conformazioni più comuni delle catene polipeptidiche cioè α-elica e β-conformazione è stato particolarmente importante lo studio delle cheratine, proteine fibrose, e l analisi della
Percorsi di chimica organica - Soluzioni degli esercizi del testo
 ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
IL GRUPPO EME. PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici.
 IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
BIOMOLECOLE STRUTTURA E FUNZIONE
 BIOMOLECOLE STRUTTURA E FUNZIONE Lo studio delle relazioni tra struttura e funzione nelle biomolecole è uno degli aspetti più importanti per la comprensione del funzionamento dei processi biologici La
BIOMOLECOLE STRUTTURA E FUNZIONE Lo studio delle relazioni tra struttura e funzione nelle biomolecole è uno degli aspetti più importanti per la comprensione del funzionamento dei processi biologici La
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
INTERAZIONI INTERMOLECOLARI NELLE PROTEINE
 INTERAZIONI INTERMOLECOLARI NELLE PROTEINE 1 RICHIAMI DI TERMODINAMICA 2 Entalpia Entropia Energia Libera di Gibbs ENERGIA INTERNA (U) L energia interna riassume tutti i contributi cinetici e potenziali
INTERAZIONI INTERMOLECOLARI NELLE PROTEINE 1 RICHIAMI DI TERMODINAMICA 2 Entalpia Entropia Energia Libera di Gibbs ENERGIA INTERNA (U) L energia interna riassume tutti i contributi cinetici e potenziali
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COOH che un gruppo amminico -NH2. Le proteine, a
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COOH che un gruppo amminico -NH2. Le proteine, a
FUNZIONI DELLE PROTEINE
 FUNZIONI DELLE PROTEINE 1 CATALISI ENZIMATICA 2 TRASPORTO E DEPOSITO 3 MOVIMENTO COORDINATO 4 SUPPORTO MECCANICO 5 PROTEZIONE IMMUNITARIA 6 GENERAZIONE E TRASMISSIONE DELL IMPULSO NERVOSO 7 CONTROLLO DELLA
FUNZIONI DELLE PROTEINE 1 CATALISI ENZIMATICA 2 TRASPORTO E DEPOSITO 3 MOVIMENTO COORDINATO 4 SUPPORTO MECCANICO 5 PROTEZIONE IMMUNITARIA 6 GENERAZIONE E TRASMISSIONE DELL IMPULSO NERVOSO 7 CONTROLLO DELLA
Modello Watson-Crick del DNA
 Modello Watson-Crick del DNA Diffrazione raggi X (Wilkins & Franklin) Modello atomico a doppia elica (B-DNA, Watson & Crick) VMD 1 Modello Watson-Crick del DNA B-DNA: doppia elica destrorsa Doppia elica
Modello Watson-Crick del DNA Diffrazione raggi X (Wilkins & Franklin) Modello atomico a doppia elica (B-DNA, Watson & Crick) VMD 1 Modello Watson-Crick del DNA B-DNA: doppia elica destrorsa Doppia elica
ACIDI GRASSI INSATURI
 LIPIDI ACIDI GRASSI SATURI ACIDI GRASSI INSATURI TRIGLICERIDI TRIGLICERIDI Grassi neutri o lipidi semplici glicerolo + 1 acido grasso monogliceride glicerolo + 2 acidi grassi digliceride glicerolo + 3
LIPIDI ACIDI GRASSI SATURI ACIDI GRASSI INSATURI TRIGLICERIDI TRIGLICERIDI Grassi neutri o lipidi semplici glicerolo + 1 acido grasso monogliceride glicerolo + 2 acidi grassi digliceride glicerolo + 3
CARBOIDRATI C H O ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO
 CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
30/10/2015. Molte proteine sono. intrinsecamente disordinate. o destrutturate (IDP/IUP), cioè non hanno una struttura
 Molte proteine sono intrinsecamente disordinate o destrutturate (IDP/IUP), cioè non hanno una struttura terziaria e/o secondaria stabile. Le IUP sono caratterizzate da - scarso contenuto in aa apolari,
Molte proteine sono intrinsecamente disordinate o destrutturate (IDP/IUP), cioè non hanno una struttura terziaria e/o secondaria stabile. Le IUP sono caratterizzate da - scarso contenuto in aa apolari,
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
LIVELLI DI STRUTTURA DELLE PROTEINE
 FUNZIONI E STRUTTURA DELLE PROTEINE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE -------------------------------------------------------------------------------------------------------------- 3 2 LIVELLI
FUNZIONI E STRUTTURA DELLE PROTEINE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE -------------------------------------------------------------------------------------------------------------- 3 2 LIVELLI
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE
 Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE LE PROTEINE possono assumere 4 LIVELLI DI ORGANIZZAZIONE STRUTTURA PRIMARIA SEQUENZA degli amminoacidi STRUTTURA SECONDARIA Ripiegamento locale
Dipartimento Di Scienze Della Vita STRUTTURA DELLE PROTEINE LE PROTEINE possono assumere 4 LIVELLI DI ORGANIZZAZIONE STRUTTURA PRIMARIA SEQUENZA degli amminoacidi STRUTTURA SECONDARIA Ripiegamento locale
LEZIONE DEL 21/03/2017 Struttura terziaria: foglietti β, α-eliche uniti tra loro - la proteina acquisisce la onformazione privilegiata (il falding)
 LEZIONE DEL 21/03/2017 Struttura terziaria: foglietti β, α-eliche uniti tra loro - la proteina acquisisce la onformazione privilegiata (il falding) Una s. terziaria mi dà le percentuali di: - random coil
LEZIONE DEL 21/03/2017 Struttura terziaria: foglietti β, α-eliche uniti tra loro - la proteina acquisisce la onformazione privilegiata (il falding) Una s. terziaria mi dà le percentuali di: - random coil
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π
 IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
IL LEGAME SIGMA σ E IL LEGAME PI- GRECO π La teoria di Lewis considera gli elettroni di valenza degli atomi che formano legami,ma prescinde totalmente dal fatto che tali elettroni sono descritti da orbitali
ACIDI NUCLEICI Il dogma centrale della biologia
 ACIDI NUCLEICI Il dogma centrale della biologia DNA RNA PROTEINE DNA POLINUCLEOTIDI NUCLEOTIDI NUCLEOSIDI ZUCCHERI ACIDO FOSFORICO BASI AZOTATE Ribosio 2 deossiribosio PURINE PIRIMIDINE Adenina Guanina
ACIDI NUCLEICI Il dogma centrale della biologia DNA RNA PROTEINE DNA POLINUCLEOTIDI NUCLEOTIDI NUCLEOSIDI ZUCCHERI ACIDO FOSFORICO BASI AZOTATE Ribosio 2 deossiribosio PURINE PIRIMIDINE Adenina Guanina
Chimica generale e inorganica Studia gli elementi e i composti inorganici
 Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
MOLECOLE. 2 - i legami chimici. Prof. Vittoria Patti
 MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
Le interazioni reversibili tra le macromolecole sono mediate da 3 specie di legami non covalenti:
 Le interazioni reversibili tra le macromolecole sono mediate da 3 specie di legami non covalenti: 1) Legami elettrostatici 2) Legami idrogeno 3) Forze di van der Waals Le interazioni deboli tra biomolecole
Le interazioni reversibili tra le macromolecole sono mediate da 3 specie di legami non covalenti: 1) Legami elettrostatici 2) Legami idrogeno 3) Forze di van der Waals Le interazioni deboli tra biomolecole
LE MEMBRANE CELLULARI
 LE MEMBRANE CELLULARI Sono strutture sovramolecolari che racchiudono e delimitano l ambiente intracellulare e negli eucarioti anche gli organuli citoplasmatici. Hanno funzione di Protezione. Sostegno.
LE MEMBRANE CELLULARI Sono strutture sovramolecolari che racchiudono e delimitano l ambiente intracellulare e negli eucarioti anche gli organuli citoplasmatici. Hanno funzione di Protezione. Sostegno.
Idrocarburi Saturi. Cicloalcani
 Idrocarburi Saturi Cicloalcani Cicloalcani I cicloalcani sono idrocarburi i cui atomi di carbonio sono uniti per formare un anello In natura sono presenti cicloalcani con dimensioni dell anello che vanno
Idrocarburi Saturi Cicloalcani Cicloalcani I cicloalcani sono idrocarburi i cui atomi di carbonio sono uniti per formare un anello In natura sono presenti cicloalcani con dimensioni dell anello che vanno
IL LEGAME A IDROGENO
 IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
Daniela Carotti. Dipartimento di Scienze Biochimiche III piano - stanza 310.
 Daniela Carotti Dipartimento di Scienze Biochimiche III piano - stanza 310 06 49910969 daniela.carotti@uniroma1.it organismo cellula componenti biochimiche acqua ioni carboidrati riserva di energia ruolo
Daniela Carotti Dipartimento di Scienze Biochimiche III piano - stanza 310 06 49910969 daniela.carotti@uniroma1.it organismo cellula componenti biochimiche acqua ioni carboidrati riserva di energia ruolo
LE MEMBRANE Le membrane sono composte da lipidi e proteine in composizioni che variano in base alla specie,al tipo cellulare e all organello.
 LE MEMBRANE Le membrane sono composte da lipidi e proteine in composizioni che variano in base alla specie,al tipo cellulare e all organello.il modello a mosaico fluido descrive la struttura comune a tutte
LE MEMBRANE Le membrane sono composte da lipidi e proteine in composizioni che variano in base alla specie,al tipo cellulare e all organello.il modello a mosaico fluido descrive la struttura comune a tutte
BIOMOLECOLE LE BASI DELLA BIOCHIMICA. Capitolo 1 Dal Carbonio agli OGM PLUS
 BIOMOLECOLE LE BASI DELLA BIOCHIMICA Capitolo 1 Dal Carbonio agli OGM PLUS BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici Proteine BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici - monosaccaridi - disaccaridi
BIOMOLECOLE LE BASI DELLA BIOCHIMICA Capitolo 1 Dal Carbonio agli OGM PLUS BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici Proteine BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici - monosaccaridi - disaccaridi
Riepilogo 1^ lezione
 Riepilogo 1^ lezione I 20 amminoacidi che si trovano comunemente nelle proteine sono uniti l uno all altro da legami peptidici. La sequenza lineare degli amminoacidi legati contiene l informazione necessaria
Riepilogo 1^ lezione I 20 amminoacidi che si trovano comunemente nelle proteine sono uniti l uno all altro da legami peptidici. La sequenza lineare degli amminoacidi legati contiene l informazione necessaria
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
