LE MOLECOLE. 5.1 I legami molecolari 5.2 Le forze di Van der Walls 5.3 Il legame idrogeno 5.4 La teoria VSEPR
|
|
|
- Rosina Roberti
- 6 anni fa
- Visualizzazioni
Transcript
1 LE MOLECOLE 5.1 I legami molecolari 5.2 Le forze di Van der Walls 5.3 Il legame idrogeno 5.4 La teoria VSEPR
2 5.1 I legami molecolari Si ha un legame chimico quando una forza di natura elettrostatica tiene uniti più atomi in una specie chimica (legami forti, o intramolecolari) o più molecole in una sostanza allo stato condensato (legami deboli, o intermolecolari). Legami atomici ionico covalente dativo metallico Legami molecolari Forze di London Forze di Van der Walls Interazione dipolodipolo Legame a idrogeno
3 5.1 I legami molecolari Le interazioni tra le molecole e le interazioni tra ioni e molecole sono attrazioni più deboli dei legami veri e propri. Si esercitano tra molecole e tra ioni e molecole, quindi tra specie già possedenti legami e capaci di esistere in forma stabile. Per quanto più deboli dei veri e propri legami (legami forti) e al massimo definite legami deboli o interazioni deboli, sono interazioni molto importanti nel determinare le proprietà fisiche delle sostanze.
4 Esistono le seguenti tipologie di forze intermolecolari (in ordine di forza crescente): Forza di dispersione di London: interazione dipolo indotto-dipolo indotto (con energia di legame compresa fra 0,05-40 kj/mol) Forza di Debye: interazione dipolo-dipolo indotto (con energia di legame compresa fra 2-10 kj/mol) Interazione ione-dipolo indotto (con energia di legame compresa fra 3-15 kj/mol) Forze di van der Waals: interazione dipolo-dipolo (con energia di legame compresa fra 5-25 kj/mol) Legame a idrogeno (con energia di legame compresa fra kj/mol) Legame ad alogeno (con energia di legame compresa fra kj/mol) Interazione ione-dipolo (con energia di legame compresa fra kj/mol)
5 I moderni mezzi di indagine hanno messo in evidenza che in una molecola gli atomi sono disposti in rapporti geometrici particolari che conferiscono alle sostanze le loro proprietà peculiari. Ciò che definisce la geometria di una molecola è l angolo di legame, ovvero l angolo formato dagli assi congiungenti i nuclei degli atomi che si legano.
6 5.2 Le forze di Van der Walls Le forze di van der Waals, chiamate così in onore dello studioso Johannes Diderik van der Waals che ne formula la legge nel 1873, sono forze attrattive o repulsive tra molecole. Il termine forza di van de Waals include tre tipi diversi di interazione intermolecolari forza dipolo permanentedipolo permanente (o forza di Keesom forza dipolo permanentedipolo indotto (o forza di Debye) forza dipolo indotto istantaneo-dipolo indotto istantaneo (o forza di dispersione di London)
7 5.2 Le forze di Van der Walls Sebbene le forze di van de Waals siano relativamente deboli comparate ai legami chimici normali tra atomi, hanno un ruolo fondamentale in diversi campi scientifici come in chimica supramolecolare, biologia strutturale, nanotecnologia, scienza delle superfici o in fisica della materia condensata. Le forze di van de Waals differiscono dal legame covalente e ionico in quanto dipendono dalle fluttuazioni nella distribuzione delle cariche nelle molecole. Si tratta di forze attrattive a lungo raggio e repulsive a corto raggio. Tutte le forze di van de Waals presentano anisotropia, ciò significa che dipendono dall'orientamento relativo delle molecole. Le interazioni di induzione (forza di Debye) e dispersione (forza di London) sono sempre attrattive, indipendentemente dall'orientamento, tuttavia le interazioni elettrostatiche (forza di Keesom) cambiano segno con la rotazione delle molecole
8 5.2 Le forze di dispersione di London Le forze di dispersione di London, chiamate così in onore del fisico Fritz London, sono forze intermolecolari deboli che si formano a causa delle forze tra dipoli temporali in molecole senza momento dipolare permanente. Per esempio, nelle molecole non polari come gli alogeni, gli elettroni che si muovono intorno alle molecole si distribuiscono in modo non equilibrato istante per istante: nel momento in cui gli elettroni non sono disposti equamente si forma un dipolo temporale che interagisce con altri dipoli vicini e induce le altre molecole nelle quali, a loro volta, si formano dipoli indotti. Nel vuoto le forze di London sono le forze intermolecolari più deboli, tuttavia restano le principali forze attrattive di molecole non polari, come per esempio il metano, e dei gas nobili: senza di esse, infatti, i gas nobili non potrebbero presentarsi in stato liquido.
9 5.2 Forza di Debye e Forza di Keesom Le forze di Debye sono forze intermolecolari, risultato dell'interazione tra un dipolo permanente e un dipolo indotto (quest'ultimo noto anche come polarizzazione) Le forze di Keesom (anche dette forze dipolo-dipolo) sono il risultato dell'interazione intermolecolare tra dipoli permanenti. Furono chiamate così in onore di Willem Hendrik Keesom che riuscì a darne una formulazione matematica nel Il legame a idrogeno è considerato l'estremo di questo genere di interazioni. L'energia media delle forze dipolo-dipolo è circa 4 KJ/mole, molto debole se comparata a quella di un legame covalente (circa 400 KJ/mole). I legami tra dipoli permanenti avvengono tra molecole che possiedono momento dipolare intrinseco che spesso si relaziona a una differenza di elettronegatività.
10 5.3 Il Legame Idrogeno Il legame idrogeno o ponte idrogeno è un caso di interazione fra dipoli. In particolare si tratta di un legame dipolo permanente - dipolo permanente in cui è implicato un atomo di idrogeno coinvolto in un legame covalente con elementi molto elettronegativi (come fluoro, ossigeno, azoto), i quali attraggono a sé gli elettroni di valenza, acquisendo una parziale carica negativa (-) lasciando l'idrogeno con una parziale carica positiva (+). Il legame a idrogeno si forma quando la parziale carica positiva dell'idrogeno viene in contatto con un doppietto elettronico di un elemento fortemente elettronegativo (fluoro, ossigeno o azoto), il quale lega l'h (che viene definito accettore, invece l'elemento dove è legato l'h viene definito donatore). Ad esempio nel radicale idrossile OH e nell anione idrossido OH - è presente una parziale carica negativa sull'o e una equivalente positiva sull'h, quindi tali composti si polarizzano parzialmente (dipolo permanente). Se questo gruppo ne incontra un altro polare (ad esempio un gruppo carbonile), si crea una interazione elettrostatica.
11 5.3 Il Legame Idrogeno Il legame idrogeno è presente nell'acqua sia allo stato liquido che allo stato solido, ed è responsabile della sua relativamente alta temperatura di ebollizione (se paragonata per esempio all'h 2 S, che pur avendo peso molecolare maggiore è significativamente meno polare). In particolare, senza il contributo dei legami idrogeno, l'acqua bollirebbe a -100 C. Una caratteristica peculiare del legame idrogeno è quella di mantenere le molecole interessate più distanti fra loro rispetto agli altri tipi di legame: è per questo che il ghiaccio è meno denso dell acqua (nell'acqua, infatti, le molecole scorrono l'una sull'altra mentre il ghiaccio assume una struttura cristallina dovuta proprio ai legami idrogeno) Il legame idrogeno presente nelle proteine (principalmente nelle strutture secondarie: alfa elica e beta foglietto) e negli acidi nucleici, è una delle forze che tiene uniti i due filamenti del DNA.
12 Legami a confronto La forza di legame è legata all energia necessaria per allontanare particelle legate tra loro.
13 Legami a confronto La scala di energia dei legami atomici è assai diversa da quella delle forze intermolecolari.
14 5.4 La teoria VSEPR La teoria VSEPR è usata come metodo per valutare la disposizione geometrica degli atomi di una molecola. L'acronimo VSEPR abbrevia l'espressione inglese Valence Shell Electron Pair Repulsion, cioè repulsione delle coppie elettroniche nel guscio di valenza; tale repulsione consente di fare ipotesi sulla geometria finale della molecola. L'ipotesi di questa teoria è che la distribuzione dei legami attorno ad un atomo dipende dal numero totale di coppie di elettroni, sia di non legame (lone pair = coppie solitarie) che di legame, che lo circondano: queste coppie si dispongono nello spazio geometrico in modo da minimizzare la loro reciproca repulsione. Le repulsioni tra due coppie di non legame sono maggiori che tra una coppia di non legame e coppia di legame a loro volta maggiori delle repulsioni tra due coppie di legame.
15 5.4 La teoria VSEPR: punti principali della teoria Le coppie di elettroni nel guscio di valenza dell'atomo centrale si respingono a vicenda; Queste coppie di elettroni tendono a occupare la posizione più adatta per minimizzare la repulsione, massimizzando quindi lo spazio interposto tra gli elettroni; Il guscio di valenza è considerato come una sfera sulla cui superficie sono localizzati gli elettroni, che manterranno la massima distanza tra loro; Un legame multiplo è considerato come una singola coppia di elettroni, quindi due o tre coppie di elettroni di un legame multiplo si considerano come una super coppia di elettroni; Il modello VSEPR è applicabile quando due o più strutture di risonanza possono rappresentare una molecola.
16 5.4 La teoria VSEPR: punti principali della teoria Si prendono in considerazione tre tipi di repulsione tra gli elettroni di una molecola: La repulsione tra coppia solitaria e coppia solitaria (dall'inglese lone pair-lone pair, lp-lp). La repulsione tra coppia solitaria e coppia di elettroni di legame (lone pair-bonding pair, lp-bp). La repulsione tra coppia di elettroni di legame e coppia di elettroni di legame (bonding pair-bonding pair, bp-bp). Una molecola deve minimizzare e stabilizzare ogni tipo di repulsione elettronica; quando ciò non è possibile, è preferibile prendere in considerazione una repulsione debole (che causa una lieve deviazione dalla configurazione ideale). La repulsione tra coppia solitaria e coppia solitaria (lp-lp) è considerata più forte di quella tra coppia solitaria e coppia di elettroni di legame (lp-bp): infatti la repulsione tra coppia di elettroni di legame e coppia di elettroni di legame (bp-bp) è più debole e quindi più stabile della repulsione tra coppia solitaria e coppia solitaria (lp-lp) o tra coppia solitaria ed coppia di elettroni di legame (lp-bp).
17 In base al numero di coppie elettroniche intorno all atomo centrale si ha che due coppie individuano una geometria lineare con angoli di 180 ; tre coppie determinano un assetto triangolare equilatero con angoli di 120 ; quattro coppie individuano una geometria tetraedrica con angoli di 109,5.
18 Il metodo AXE di conteggio degli elettroni è comunemente usato per l'applicazione della teoria VSEPR. La sigla AXE rappresenta con la lettera A l'atomo centrale e ha sempre come valore sottinteso 1. La X rappresenta quanti legami sigma si formano tra l'atomo centrale e gli atomi ad esso legati. I legami covalenti multipli (doppi, tripli, etc) contano come un X. Infine la E rappresenta il numero di coppie singole di elettroni (lone pairs) presenti nel guscio di valenza dell'atomo centrale. La somma di X ed E, definita come numero sterico, è associata anche al numero totale di orbitali ibridati considerati dalla teoria del legame di valenza. Nel caso di coppie elettroniche libere, la forma della molecola tiene conto anche del doppietto elettronico. I legami covalenti doppi e tripli valgono come un legame singolo ai fini della geometria molecolare.
19
20 Anche la polarità di una molecola dipende anche dalla geometria della molecola, cioè dalla disposizione nello spazio dei suoi legami.
21 Una molecola è polare se la somma dei momenti dipolari di tutti i suoi legami è diversa da zero. La polarità delle molecole determina la solubilità della sostanza nei diversi solventi. I solventi sciolgono le sostanze che hanno polarità simile: solventi polari sciolgono sostanze polari, solventi apolari solubilizzano sostanze apolari
22 Anche le proprietà macroscopiche della materia dipendono dalle interazioni fra particelle microscopiche che la costituiscono. I solidi vengono classificati in base al tipo di legame che aggrega le unità costitutive. I solidi cristallini hanno una disposizione interna regolare di atomi, molecole e ioni. Essi possono essere ionici; reticolari; molecolari; metallici. I cristalli ionici si formano in virtù dell attrazione fra ioni con carica opposta. Sono fragili, presentano elevata temperatura di fusione, conducono elettricità allo stato fuso e in soluzione acquosa. I cristalli covalenti o solidi reticolari si formano grazie a una rete tridimensionale di legami covalenti fra gli atomi. Sono duri, hanno temperatura di fusione elevata, non conducono elettricità e non sono solubili in acqua.
23 I solidi cristallini possono ancora essere molecolari; metallici. I cristalli molecolari apolari sono costituiti da molecole apolari tenute insieme da forze di Van der Waals. Sono solidi a bassissime temperature, quasi mai a temperatura ambiente, sono solubili in solventi apolari e non in acqua. I cristalli molecolari polari sono costituiti da molecole polari che si attraggono con legami dipolo-dipolo o legami a idrogeno. Hanno basse temperature di fusione, non conducono elettricità nonostante siano solubili in acqua. I cristalli metallici sono costituiti da atomi legati con legame metallico. Sono duttili, malleabili, conducono elettricità e calore.
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1. L energia di legame. 2. I gas nobili e a regola dell ottetto. 3. Il legame covalente. 4. Il legame covalente dativo. 5. Il legame covalente polare
 Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
1. L energia di legame
 legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno 5. Legami a confronto
 Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia
 Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
Introduzione alla chimica organica. 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole
 Introduzione alla chimica organica 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole La chimica organica tratta di pochissimi atomi che si possono combinare in moltissimi modi Grande importanza
Introduzione alla chimica organica 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole La chimica organica tratta di pochissimi atomi che si possono combinare in moltissimi modi Grande importanza
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
ATOMI E MOLECOLE. Psicobiologia Lezione nr. 1. Prof. Lasaponara
 ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame.
 Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
 ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
Il legame chimico ATOMI MOLECOLE
 Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
FORZE INTERMOLECOLARI o LEGAMI DEBOLI
 FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
Legame chimico e proprietà delle sostanze
 I solidi hanno volume e forma propria. Stati di aggregazione della materia stato solido stato liquido stato gassoso Il loro volume dipende da temperatura e pressione e in generale aumenta leggermente all
I solidi hanno volume e forma propria. Stati di aggregazione della materia stato solido stato liquido stato gassoso Il loro volume dipende da temperatura e pressione e in generale aumenta leggermente all
Il Legame Chimico e la Struttura Molecolare
 A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
L'energia media V di interazione fra uno ione avente carica q e un dipolo permanente ad una distanza r Ä
 Interazioni intermolecolari Interazioni ione-dipolo Interazioni dipolo-dipolo Interazione dipolo permanente-dipolo indotto Interazione dipolo istantaneo-dipolo indotto Forze di Van der Waals Legame idrogeno
Interazioni intermolecolari Interazioni ione-dipolo Interazioni dipolo-dipolo Interazione dipolo permanente-dipolo indotto Interazione dipolo istantaneo-dipolo indotto Forze di Van der Waals Legame idrogeno
MOLECOLE. 2 - i legami chimici. Prof. Vittoria Patti
 MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo
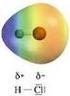 La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
FORZE INTERMOLECOLARI o LEGAMI DEBOLI
 FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
PROPRIETA DEI MATERIALI
 PROPRIETA DEI MATERIALI Una proprietà è la risposta di un materiale ad una sollecitazione esterna. Per i materiali solidi le proprietà possono raggrupparsi in sei differenti categorie: 1. Meccaniche 2.
PROPRIETA DEI MATERIALI Una proprietà è la risposta di un materiale ad una sollecitazione esterna. Per i materiali solidi le proprietà possono raggrupparsi in sei differenti categorie: 1. Meccaniche 2.
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
GEOMETRIA MOLECOLARE. La struttura di Lewis non fornisce alcuna indicazione sulla forma delle molecole in
 GEOMETRIA MOLECOLARE La struttura di Lewis non fornisce alcuna indicazione sulla forma delle molecole in quanto dipende dagli ANGOLI DI LEGAME cioè gli angoli tra le linee che congiungono i nuclei degli
GEOMETRIA MOLECOLARE La struttura di Lewis non fornisce alcuna indicazione sulla forma delle molecole in quanto dipende dagli ANGOLI DI LEGAME cioè gli angoli tra le linee che congiungono i nuclei degli
VIRT&L-COMM IL LEGAME CHIMICO. TFA II Ciclo a.a.2014/2016. Dott. Angela Casu ISSN:
 IL LEGAME CHIMICO TFA II Ciclo a.a.2014/2016 Dott. Angela Casu UN VIDEO INTRODUTTIVO Per vedere il video CLICCA QUI Sommario 1. Il legame chimico 2. L elettronegatività 3. Il legame ionico 4. Composti
IL LEGAME CHIMICO TFA II Ciclo a.a.2014/2016 Dott. Angela Casu UN VIDEO INTRODUTTIVO Per vedere il video CLICCA QUI Sommario 1. Il legame chimico 2. L elettronegatività 3. Il legame ionico 4. Composti
Legame Chimico. Legame Chimico
 Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
LEGAMI INTERMOLECOLARI LEGAMI INTERMOLECOLARI
 I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
Gli elettroni della molecola sono quindi descritti da
 IL LEGAME COVALENTE: TEORIA DELL ORBITALE MOLECOLARE La molecola è considerata come un insieme di nuclei ed elettroni e, attraverso la valutazione delle reciproche interazioni, la teoria dell orbitale
IL LEGAME COVALENTE: TEORIA DELL ORBITALE MOLECOLARE La molecola è considerata come un insieme di nuclei ed elettroni e, attraverso la valutazione delle reciproche interazioni, la teoria dell orbitale
METALLI: bassa energia di ionizzazione bassa affinità elettronica. NON METALLI: elevata energia di ionizzazione elevata affinità elettronica
 METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
Forze intermolecolari
 Forze intermolecolari Le forze intermolecolari sono forze attrattive tra molecole, tra ioni o tra ioni e molecole. In assenza di tali forze tutte le molecole sarebbero gas le molecole possono stabilire
Forze intermolecolari Le forze intermolecolari sono forze attrattive tra molecole, tra ioni o tra ioni e molecole. In assenza di tali forze tutte le molecole sarebbero gas le molecole possono stabilire
IL LEGAME A IDROGENO
 IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
I LEGAMI CHIMICI. A cura della prof. C. Viscardi
 I LEGAMI CIMICI A cura della prof. C. Viscardi 1 ATOMI E MOLECOLE È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti
I LEGAMI CIMICI A cura della prof. C. Viscardi 1 ATOMI E MOLECOLE È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
Legame covalente. H 1s un protone e un elettrone
 Legame covalente H 1s un protone e un elettrone Il legame covalente è formato da una coppia di elettroni condivisa fra due atomi. L energia richiesta per separare gli atomi legati è detta energia di legame.
Legame covalente H 1s un protone e un elettrone Il legame covalente è formato da una coppia di elettroni condivisa fra due atomi. L energia richiesta per separare gli atomi legati è detta energia di legame.
Interazioni deboli. Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012
 Interazioni deboli 1 Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012 Legami deboli o interazioni deboli La forza di un legame chimico viene stabilita in base alla energia del
Interazioni deboli 1 Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012 Legami deboli o interazioni deboli La forza di un legame chimico viene stabilita in base alla energia del
Atomi e molecole. Gli atomi degli elementi si trovano in natura generalmente combinati tra loro in molecole o composti ionici
 IL LEGAME CHIMICO Atomi e molecole È estremamente difficile trovare in natura una sostanza formata da singoli atomi isolati Solo i gas nobili sono presenti in natura come gas monoatomici Gli atomi degli
IL LEGAME CHIMICO Atomi e molecole È estremamente difficile trovare in natura una sostanza formata da singoli atomi isolati Solo i gas nobili sono presenti in natura come gas monoatomici Gli atomi degli
LEGAMI CHIMICI e GEOMETRIA MOLECOLARE
 DAI LEGAMI CH HIMICI ALLA GEOMETRIA DELLE MOLECOLE. LEGAMI CHIMICI e GEOMETRIA MOLECOLARE Cos è un legame chimico? Il legame chimico non esiste Quanti tipi di legame? Legame ionico Legame covalente LEGAME
DAI LEGAMI CH HIMICI ALLA GEOMETRIA DELLE MOLECOLE. LEGAMI CHIMICI e GEOMETRIA MOLECOLARE Cos è un legame chimico? Il legame chimico non esiste Quanti tipi di legame? Legame ionico Legame covalente LEGAME
Corso di Laurea in CHIMICA (L.T.) Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule
 orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU)
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
Tensione di vapore evaporazione
 Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Molecole e legami. Chimica generale
 Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 13-14 2010 Configurazioni elettroniche Descrizioni diverse Sistema periodico Configurazioni elettroniche Il modello
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 13-14 2010 Configurazioni elettroniche Descrizioni diverse Sistema periodico Configurazioni elettroniche Il modello
Il legame chimico. Lezioni 17-20
 Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Chimica. Lezione 2 Parte II Composti ionici e molecolari
 Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2
 ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
Forze interioniche ed intermolecolari
 Forze interioniche ed intermolecolari Forze interioniche ed intermolecolari Le interazioni ione-dipolo sono forti nel caso di ioni piccoli e di carica elevata. Una conseguenza è che i cationi piccoli e
Forze interioniche ed intermolecolari Forze interioniche ed intermolecolari Le interazioni ione-dipolo sono forti nel caso di ioni piccoli e di carica elevata. Una conseguenza è che i cationi piccoli e
Proprietà Chimico-fisiche dei composti organici
 Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Elettronegatività Elettronegatività
 Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
Un compostoè costituito da due o più elementi in proporzioni costanti, ottenibili dai composti per trasformazioni chimiche.
 Le Formule Chimiche Un compostoè costituito da due o più elementi in proporzioni costanti, ottenibili dai composti per trasformazioni chimiche. La formula minima(o empirica): indica gli elementi che formano
Le Formule Chimiche Un compostoè costituito da due o più elementi in proporzioni costanti, ottenibili dai composti per trasformazioni chimiche. La formula minima(o empirica): indica gli elementi che formano
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO
 I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta della struttura elettronica delle molecole, come quella
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta della struttura elettronica delle molecole, come quella
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
LEGAME CHIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici.
 LEGAME CIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
LEGAME CIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Per esempio, possiamo osservare il legame ionico nella molecola di cloruro di sodio. Il cloro e il sodio hanno le seguenti strutture di Lewis:
 IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
CHIMICA ORGANICA PER BIOTECNOLOGIE con esercitazioni di LABORATORIO D. Savoia
 CHIMICA RGANICA PER BITECNLGIE con esercitazioni di LABRATRI D. Savoia Brown, Poon - Introduzione alla Chimica rganica Brown, Foote - Chimica rganica Bruyce - Chimica rganica Solomons McMurray Etc Cos
CHIMICA RGANICA PER BITECNLGIE con esercitazioni di LABRATRI D. Savoia Brown, Poon - Introduzione alla Chimica rganica Brown, Foote - Chimica rganica Bruyce - Chimica rganica Solomons McMurray Etc Cos
Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame
 IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
La struttura di ioni e molecole
 La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
ESERCIZI ESERCIZI. il basso d. aumenta lungo un periodo da sinistra verso
 ESERCIZI 1) L elettronegatività di un elemento: a è l energia che esso libera acquistando un elettrone e trasformandosi in ione negativo b è l energia necessaria per trasformarlo in ione positivo c indica
ESERCIZI 1) L elettronegatività di un elemento: a è l energia che esso libera acquistando un elettrone e trasformandosi in ione negativo b è l energia necessaria per trasformarlo in ione positivo c indica
Anche tra le molecole si instaurano forze di attrazione, meno intense dei legami chimici, che vengono chiamate legami secondari o legami deboli.
 I legami chimici Gli atomi isolati sono in generale instabili e tendono naturalmente a combinarsi attraverso legami chimici per formare molecole e aggregati cristallini caratterizzati da maggiore stabilità.
I legami chimici Gli atomi isolati sono in generale instabili e tendono naturalmente a combinarsi attraverso legami chimici per formare molecole e aggregati cristallini caratterizzati da maggiore stabilità.
Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi
 LE MOLECOLE Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi ChimicaGenerale_lezione8 1 Risonanza * La teoria della risonanza
LE MOLECOLE Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi ChimicaGenerale_lezione8 1 Risonanza * La teoria della risonanza
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
Struttura e proprietà
 Struttura e proprietà Entrando nel sito attivo di un enzima : comprendere Interleuchina e recettore : comprendere Molecular docking: prevedere Amprenavir e HIV proteasi: modificare 1 Geometria molecolare:
Struttura e proprietà Entrando nel sito attivo di un enzima : comprendere Interleuchina e recettore : comprendere Molecular docking: prevedere Amprenavir e HIV proteasi: modificare 1 Geometria molecolare:
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
CENNI SUL TIPO DI FORZE
 CENNI SUL TIPO DI FORZE Forze deboli che influenzano la struttura delle proteine: le interazioni di van der Waals repulsione attrazione Forze attrattive dovute a interazioni istantanee che si generano
CENNI SUL TIPO DI FORZE Forze deboli che influenzano la struttura delle proteine: le interazioni di van der Waals repulsione attrazione Forze attrattive dovute a interazioni istantanee che si generano
Formule di Lewis e regola dell ottetto
 Formule di Lewis e regola dell ottetto 1916-1919 Lewis si accorse che: Qualcosa di unico nelle configurazioni elettroniche dei gas nobili è responsabile della loro inerzia; gli atomi degli altri elementi
Formule di Lewis e regola dell ottetto 1916-1919 Lewis si accorse che: Qualcosa di unico nelle configurazioni elettroniche dei gas nobili è responsabile della loro inerzia; gli atomi degli altri elementi
Elementi sistemati nella TAVOLA PERIODICA DEGLI ELEMENTI in base al numero atomico crescente O, H, N, C (+ del 96% della materia vivente)
 OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
Corso di Chimica Generale CL Biotecnologie
 Corso di Chimica Generale CL Biotecnologie STATI DELLA MATERIA Prof. Manuel Sergi MATERIA ALLO STATO GASSOSO MOLECOLE AD ALTA ENERGIA CINETICA GRANDE DISTANZA TRA LE MOLECOLE LEGAMI INTERMOLECOLARI DEBOLI
Corso di Chimica Generale CL Biotecnologie STATI DELLA MATERIA Prof. Manuel Sergi MATERIA ALLO STATO GASSOSO MOLECOLE AD ALTA ENERGIA CINETICA GRANDE DISTANZA TRA LE MOLECOLE LEGAMI INTERMOLECOLARI DEBOLI
Se non avviene niente tra gli elettroni, i due atomi si respingono e non si ha nessun legame.
 IL LEGAME CHIMICO Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti fra essi danno luogo alla formazione di un aggregato di atomi (molecola) sufficientemente stabile da consentire
IL LEGAME CHIMICO Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti fra essi danno luogo alla formazione di un aggregato di atomi (molecola) sufficientemente stabile da consentire
Lezione 3 - Legame chimico
 Lezione 3 - Legame chimico Generalità sul legame chimico Strutture di Lewis Elettronegatività e legame chimico Il legame covalente Gli orbitali molecolari e Il legame ionico Il legame metallico Orbitali
Lezione 3 - Legame chimico Generalità sul legame chimico Strutture di Lewis Elettronegatività e legame chimico Il legame covalente Gli orbitali molecolari e Il legame ionico Il legame metallico Orbitali
Le interazioni deboli:
 Le interazioni deboli: sono legami non covalenti sono da 1 a 3 ordini di grandezza più deboli dei legami covalenti sono alcune volte maggiori della tendenza a dissociare dovuta all agitazione termica delle
Le interazioni deboli: sono legami non covalenti sono da 1 a 3 ordini di grandezza più deboli dei legami covalenti sono alcune volte maggiori della tendenza a dissociare dovuta all agitazione termica delle
INDICE PARTE PRIMA LE RISORSE MATERIALI ED ENERGETICHE E L'ANALISI DELLE LORO PROPRIETÀ STRUTTURALI E TERMODINAMICHE
 INDICE Nota dell'autore 9 PARTE PRIMA LE RISORSE MATERIALI ED ENERGETICHE E L'ANALISI DELLE LORO PROPRIETÀ STRUTTURALI E TERMODINAMICHE Capitolo I La formazione dell'universo 11 1.1 La storia dell universo
INDICE Nota dell'autore 9 PARTE PRIMA LE RISORSE MATERIALI ED ENERGETICHE E L'ANALISI DELLE LORO PROPRIETÀ STRUTTURALI E TERMODINAMICHE Capitolo I La formazione dell'universo 11 1.1 La storia dell universo
CHIMICA II (CHIMICA ORGANICA)
 CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
 LEGAME CHIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
LEGAME CHIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
I legami fra molecole nei liquidi non sono forti ed esse possono fluire Riducendo l agitazione termica. legami tra molecole più stabili
 I legami fra molecole nei liquidi non sono forti ed esse possono fluire Riducendo l agitazione termica legami tra molecole più stabili formazione una massa rigida Una disposizione ordinata delle molecole
I legami fra molecole nei liquidi non sono forti ed esse possono fluire Riducendo l agitazione termica legami tra molecole più stabili formazione una massa rigida Una disposizione ordinata delle molecole
Trasformazioni chimiche:
 Il legame chimico 1 Trasformazioni chimiche Trasformazioni chimiche: Le sostanze si trasformano in altre sostanze aventi proprietà differenti (livello macroscopico). Le trasformazioni chimiche avvengono
Il legame chimico 1 Trasformazioni chimiche Trasformazioni chimiche: Le sostanze si trasformano in altre sostanze aventi proprietà differenti (livello macroscopico). Le trasformazioni chimiche avvengono
Il legame tra le molecole
 1 Il legame tra le molecole Obiettivo L'obiettivo di questa lezione è piuttosto ambizioso. Partendo dal concetto di dipolo elettrico e passando per la forma delle molecole arriveremo a definire il concetto
1 Il legame tra le molecole Obiettivo L'obiettivo di questa lezione è piuttosto ambizioso. Partendo dal concetto di dipolo elettrico e passando per la forma delle molecole arriveremo a definire il concetto
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Il legame ionico legame ionico
 Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
Esercizi sulle Forze Intermolecolari
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
ESEMPI DI QUIZ sulle precedenti lezioni
 ESEMPI DI QUIZ sulle precedenti lezioni I numeri quantici sono: A.2 B.5 C.6 D.4 Il numero di neutroni è pari a: A.Il numero di protoni B.Il numero di elettroni C.Il numero di nuclei D.La differenza fra
ESEMPI DI QUIZ sulle precedenti lezioni I numeri quantici sono: A.2 B.5 C.6 D.4 Il numero di neutroni è pari a: A.Il numero di protoni B.Il numero di elettroni C.Il numero di nuclei D.La differenza fra
Stati della materia. Stati della materia
 Stati della materia La materia può esistere in 3 diversi STATI DI AGGREGAZIONE: SOLIDO LIQUIDO GASSOSO MACROSCOPICHE MICROSCOPICHE Stati della materia Lo stato di aggregazione di una sostanza dipende dal
Stati della materia La materia può esistere in 3 diversi STATI DI AGGREGAZIONE: SOLIDO LIQUIDO GASSOSO MACROSCOPICHE MICROSCOPICHE Stati della materia Lo stato di aggregazione di una sostanza dipende dal
Formule e Strutture. Chimica Generale ed Inorganica. Chimica Inorganica 1. prof. Dario Duca
 Formule e Strutture Chimica Generale ed Inorganica Chimica Inorganica 1 prof. Dario Duca richiami su strutture molecolari, risonanza, cariche formali elettronegatività l elettronegatività origina da un
Formule e Strutture Chimica Generale ed Inorganica Chimica Inorganica 1 prof. Dario Duca richiami su strutture molecolari, risonanza, cariche formali elettronegatività l elettronegatività origina da un
GEOMETRIA MOLECOLARE
 GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
Legame chimico unità 1, modulo D del libro
 Legame chimico unità 1, modulo D del libro PERCHÉ IL LEGAME CHIMICO? Gli atomi si trovano raramente isolati, spesso due o più atomi si uniscono tramite un legame chimico. Perché ciò avviene? Perché l insieme
Legame chimico unità 1, modulo D del libro PERCHÉ IL LEGAME CHIMICO? Gli atomi si trovano raramente isolati, spesso due o più atomi si uniscono tramite un legame chimico. Perché ciò avviene? Perché l insieme
LEGAME COVALENTE. ( Elettronegatività tra gli atomi < 2)
 LEGAME COVALENTE ( Elettronegatività tra gli atomi < 2) Le sostanze molecolari hanno un tipo di legame che non comporta l acquisto o la cessione di e - ma la condivisione diunacoppiadie - tragliatomi Non
LEGAME COVALENTE ( Elettronegatività tra gli atomi < 2) Le sostanze molecolari hanno un tipo di legame che non comporta l acquisto o la cessione di e - ma la condivisione diunacoppiadie - tragliatomi Non
Descrivere come dedurre la polarità delle molecole dalla geometria molecolare STRUTTURA ELETTRONICA DEGLI ATOMI
 Descrivere come dedurre la polarità delle molecole dalla geometria molecolare STRUTTURA ELETTRONICA DEGLI ATOMI Ogni atomo contiene un piccolo denso nucleo,formato da neutroni e protoni carichi positivamente.
Descrivere come dedurre la polarità delle molecole dalla geometria molecolare STRUTTURA ELETTRONICA DEGLI ATOMI Ogni atomo contiene un piccolo denso nucleo,formato da neutroni e protoni carichi positivamente.
20/10/2015. Importanza dei legami non covalenti in Biologia. Legami covalenti
 Legami covalenti Gli atomi che costituiscono le molecole sono tenuti insieme da legami covalenti in cui coppie di elettroni sono condivise tra coppie di atomi. La formazione del legame covalente si basa
Legami covalenti Gli atomi che costituiscono le molecole sono tenuti insieme da legami covalenti in cui coppie di elettroni sono condivise tra coppie di atomi. La formazione del legame covalente si basa
Il legame chimico. Energia di legame
 Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
Il legame chimico Si definisce Legame chimico l effetto correlato alla forza che tiene uniti due atomi Elemento, o sostanza elementare, se vi è un legame tra atomi uguali Composto, o sostanza composta,
Siena, 10 Giugno 2015 Sandra Defazio Serena Fedi
 CLASSE I A Costruzione Ambiente e Territorio omogenei ed eterogenei e curva di riscaldamento di un miscuglio. nobili. Distinzione fra molecole e atomi. Principio di conservazione della massa. Teoria atomica
CLASSE I A Costruzione Ambiente e Territorio omogenei ed eterogenei e curva di riscaldamento di un miscuglio. nobili. Distinzione fra molecole e atomi. Principio di conservazione della massa. Teoria atomica
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A Prova scritta del corso di Chimica A-K Compito prova
 CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2012-2013 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2012-2013 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
Fenomeno fisico. Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici
 Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
Atomi e molecole Fenomeno fisico Le trasformazioni che la materia subisce senza modificare la sua composizione e che sono reversibili si chiamano fenomeni fisici Fenomeno chimico Le trasformazioni che
Idrogeno (H) Azoto (N) La materia è costituita da elementi chimici. In natura sono presenti 92 elementi
 Gli organismi sono fatti da MATERIA*. (*qualsiasi cosa che occupa uno spazio e ha una massa) Gli antichi filosofi greci dicevano che la materia deriva da 4 ingredienti di base o ELEMENTI (ARIA, ACQUA,
Gli organismi sono fatti da MATERIA*. (*qualsiasi cosa che occupa uno spazio e ha una massa) Gli antichi filosofi greci dicevano che la materia deriva da 4 ingredienti di base o ELEMENTI (ARIA, ACQUA,
CAPITOLO 4 STRUTTURE MOLECOLARI
 APITL 4 STRUTTURE MLELARI 4.1 (a) Di seguito è mostrata la struttura di Lewis di P 3. Nella teoria VSEPR il numero di coppie di elettroni attorno all atomo centrale è fondamentale per determinare la struttura.
APITL 4 STRUTTURE MLELARI 4.1 (a) Di seguito è mostrata la struttura di Lewis di P 3. Nella teoria VSEPR il numero di coppie di elettroni attorno all atomo centrale è fondamentale per determinare la struttura.
CORSO DI CHIMICA ORGANICA. Testo consigliato: Chimica Organica H.Hart,D.J.Hart, L.E.Craine Zanichelli
 CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
