Ionizzazione Forze INTERMOLECOLARI
|
|
|
- Nicola Sacchi
- 6 anni fa
- Visualizzazioni
Transcript
1 Conformazione Interazioni INTRAMLECLARI Ionizzazione Forze INTERMLECLARI Distribuzione elettronica SLUBILITA RIPARTIZINE
2 Forze di Ricognizione Forze di Van der Waals Interazioni Elettrostatiche Legami ionici Interazioni arile-arile a traferimento di carica Legame ione-dipolo (permanente e indotto) Legami-H rinforzati Legami-H normali Forze d RIENTAMENT (dipolo permanente- dipolo permanente) Forze d INDUZINE (dipolo permanente- dipolo indotto) Forze di DISPERSINE (dipolo istantaneo - dipolo indotto) Interazioni Idrofobiche Lipofilia logp = av - Λ Polarità Idrofobicità
3 Solubilità: la massima concentrazione che può essere ottenuta dissolvendo un soluto in uno specifico solvente Soluzione satura: soluzione ottenuta dissolvendo un soluto in un solvente ad una concentrazione tale per cui qualsiasi ulteriore aggiunta di soluto alla stessa non incrementa ulteriormente la concentrazione producendo soltanto ulteriore massa indisciolta (corpo di fondo). La formazione di una soluzione è la risultante di forze d interazione tra soluto e solvente
4 Temperatura L aumento di temperatura generalmente incrementa la solubilità. Solubilità ph Forma fisica Acidi e basi deboli sono più solubili (H2) nella loro forma ionizzata rispetto a quella non-ionizzata Solidi non-cristallini (amorfi) sono generalmente più solubili di quelli cristallini. Differenti forme polimorfiche, solvatate ed idrate possono avere differenti solubilità.
5 Processo di Dissoluzione Variazioni di energia e formazione di soluzione Variazione di entalpia nel processo di dissoluzione Separazione delle molecole di soluto (ΔH 1 ) Separazione delle molecole di solvente (ΔH 2 ) Formazione di interazioni soluto-solvente (ΔH 3 ) Variazione totale di entalpia nel processo di dissoluzione ΔH soln = ΔH 1 + ΔH 2 + ΔH 3 Il ΔH soln può essere positivo (endotermico) o negativo (esotermico) in funzione delle forze intermolecolari ΔH = q (quantità di calore trasferita a pressione costante)
6
7 ΔH 3 ΔH 3 endotermico
8 Natura chimico-fisica delle interazioni soluto-solvente Legame covalente * Legame ionico rinforzato 10* Legame ionico Legame dipolo-ione Legame dipolo-dipolo Legame idrogeno Trasferimento di carica Interazione idrofobica Interazione di van der Waals 5* 1-7* 1-7* 1-7* 1-7* 1* 0.5-1* *Εnergia di interazione (ΔG0, Kcal/ mole)
9 Rimozione di una molecola dalla fase soluto soluto Formazione di una cavità sufficientemente grande da ospitare la molecola di soluto solvente
10
11 Relazione tra struttura e polarità nel processo di dissoluzione di un soluto in un solvente Solvente*: generalmente una sostanza liquida capace di dissolvere altre sostanze formando una miscela uniforme definita soluzione La sostanza dissolta è definita soluto* ed è generalmente cosiderata come il componente presente in minor quantità. Solubilità Alterazione della polarità del soluto Mix di solventi per ottimizzare la polarità (solvent blending or cosolvency) Stato dissociato Stato indissociato ph ε vs tossicità *According to this definition, an almost-dry or slightly swollen resin film comprises a solution of a liquid (the solute) in a resin (the solvent), even though conventionally the liquid is usually referred to as the solvent, and the resin as the solute.
12
13 Utili approssimazioni: a. Fino a 5 atomi C con un gruppo funzionale (HB) sono generalmente solubili; b. Molecole con sostituenti alchilici ramificati sono più solubili di quelle isomeriche con sostituenti lineari c. La solubilità in acqua diminuisce all aumentare del peso molecolare.
14 Perspectives in Drug Discovery and Design, 18: 39 60, 2000.(494)
15
16 Termini relativi di solubilità Termine descrittivo Parti di solvente richieste per solubilizzare una parte di soluto Molto solubile Facilmente solubile Solubile Moderatamente solubile Poco solubile Molto poco solubile Insolubile < >10000
17 pka=9.98 CH 3 N CH 3 pka=8.19 H H N CH 3 pka=9.72 H pka=7.93 H pka=8.14 H N H H 3 C NH N CH 3 H pka=9.24 H 2 CH3 CH3 N N pka=2.32 pka=6.50 NH S NH 2 N N pka=1.15;1.15;1.57
18
19
20 Parametri di Solubilità : Teoria ed Applicazioni E tuttavia l insieme delle forze di van der Waals che è riflesso nel più semplice tra I termini di solubilità: il parametro di Hildebrandt. Un parametro di solubilità è un valore numerico che indica la relativa capacità solvatante e dissolutiva di uno specifico solvente. deriva dalla densità dell energia coesiva a sua volta derivata dal calore di vaporizzazione Calore di vaporizzazione Densità di energia coesiva Volume molare
21 Parametro di solubilità di Hildebrand Solvente δ SI n-pentano Dietil etere Cicloesano CarbonioTetracloruro Etile acetato Tetraidrofurano Benzene Cloroformio Acetone Solvente δ SI Metilene cloruro Dimetilformamide Alcol etilico Dimetilsolfossido Alcol metilico Glicole propilenico Glicole etilenico Glicerolo Acqua δ/cal 1/2 cm- 3/2 = x δ/mpa 1/2 δ/mpa 1/2 = x /cal 1/2 cm -3/2
22
23
24
25
26
27 K b K a Ka L incremento di forza di un acido è descritto da: L incremento di forza di una base è descritto da: Ka pka Aumento di Ka Diminuzione di pka Diminuzione di Ka Aumento di pka pka
28 Ka = 1.75x10-5 ; pka = 4.76 Ka = 1.03x10-3 ; pka = 2.97
29
30 Equazione di Henderson-Hasselbalch pka Eq. HH HA/A - B/BH + ph
31
32 S= [A - ] + [HA] S= Ka[HA]/[H + ] + [HA] S= S 0 (Ka/[H + ] + 1) S=S 0 (10 -pka+ 10 ph + 1 ) logs=logs 0 + log(10 -pka+ 10 ph + 1)
33 H N H 3 C NH pka = 7.41 H 3 C H pka = 4.76
34 H pka = H CH 3 pka = 2.97
35 N piridina pka = 5.15 CH 3 NH N CH 3 CH 3 CH 3 lidocaina pka = 8.53
36 pka<7 pka<10 pka< Soluzione HCl ph Soluzione NaHC 3 Soluzione Na 2 C 3 Soluzione NaH
37 H - CH 3 CH
38 Tutti i processi sono controllati dalle costanti chimico-fisiche del farmaco decomposizione stabilità distribuzione logp/logd RISPSTA HA (membrana) HA (acq) solubilità HA (solido) P ap p pk a H + + A - stabilità decomposizione
39 Definizione del coefficiente di partizione P = C C ( water ) ( oct. ) Assorbimento e permeazione insufficicenti saranno più probabili quando: Ci sono più di 5 funzioni donatrici di HB. Il peso molecolare è maggiore di 500. Il logp è maggiore di 5. Ci sono più di 10 funzioni accetrici di HB. Substrati dei carriers e prodotti naturali sono eccezioni. La regola del 5 di Lipinski Advanced Drug Delivery Reviews (1997)
40 LogD 6 pk a = 8.84 Log P = Base with 1 charge Base monoprotica Log P = 1.5 pk a1 = Log P = 0.01 Acido diprotico pk a2 = 4.79 Log P =
41 Campione sostanza organica da identificare Solubile H 2 dist. Solubile CH 2 Cl 2 Insolub. H 2 dist. Insolub. HCl Solub. HCl (base) ph 1-4 (cartina indicatrice) Acido forte (basso PM), cloridrato base ph 9-14 (cartina indicatrice) Base forte (basso PM) Insolub. NaHC 3 Insolub. Na 2 C 3 Solub. NaHC 3 (Es. acidi carbossilici, fosfati, fosfonati, fosfonici, solfati, solfonici..) pka ~ 0-6) Solub. Na 2 C 3 (Es. immidi, nitrofenoli, barbiturici) pka ~ 7-9 ph 6-8 (cartina indicatrice) Sostanza neutra (es. carboidrati, urea) Insolub. NaH Solub. NaH (Es. fenoli, solfonammidi) pka ~ 9-11
42 H Acido-(1,1 -bifenil)-4- acetico logp: 3.26 H fenbufen
43 CH 3 N S H logp: 3.78 (10-Methyl-2-phenothiazinyl)acetic Acid
44 Na + - Cl HN Cl 2-[(2,6-Dichlorophenyl)amino]benzeneacetic acid Na salt logp: 3.28 (Indiss)
45 Cl logp: 3.1 N CH 3 H 3 C H H 3 C CH 3 N logp: 5.36 N Cl S H CH 3 H 3 C H H N CH 3 H NH 2 logp: H H H
Soluzioni, elettroliti e non
 Soluzioni, elettroliti e non Il processo di solubilizzazione è un processo complesso, per interpretarlo occorre conoscere la natura ei legami chimici coinvolti COSA CONSIDERARE? 1) Interazioni soluto -
Soluzioni, elettroliti e non Il processo di solubilizzazione è un processo complesso, per interpretarlo occorre conoscere la natura ei legami chimici coinvolti COSA CONSIDERARE? 1) Interazioni soluto -
FORZE INTERMOLECOLARI o LEGAMI DEBOLI
 FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FORZE INTERMOLECOLARI o LEGAMI DEBOLI
 FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
Lo stato liquido. i liquidi molecolari con legami a idrogeno: le interazioni tra le molecole si stabiliscono soprattutto attraverso legami a idrogeno
 Lo stato liquido Le particelle sono in continuo movimento, anche se questo risulta più limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle particelle è chiamato moto Browniano.
Lo stato liquido Le particelle sono in continuo movimento, anche se questo risulta più limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle particelle è chiamato moto Browniano.
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero I Legami Chimici F N F F Il legame chimico il legame ionico Polare il legame covalente Dativo Gli elettroni di valenza sono gli elettroni del livello più
La Vita è una Reazione Chimica Acqua Oro Zucchero I Legami Chimici F N F F Il legame chimico il legame ionico Polare il legame covalente Dativo Gli elettroni di valenza sono gli elettroni del livello più
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Esame del
 Chimica Generale ed Inorganica Esame del 08-02-2011 Chimica Generale Mazzi 1) La teoria VSEPR afferma che quando un atomo forma legami covalenti: A. tutti i suoi elettroni si respingono e si dispongono
Chimica Generale ed Inorganica Esame del 08-02-2011 Chimica Generale Mazzi 1) La teoria VSEPR afferma che quando un atomo forma legami covalenti: A. tutti i suoi elettroni si respingono e si dispongono
Le soluzioni. possono essere. solide (leghe) liquide aeriformi
 Le soluzioni Sono miscele omogenee di due o più sostanze (in forma di molecole, atomi, ioni) di cui quella presente in quantità maggiore è definita solvente, le altre soluti. possono essere solide (leghe)
Le soluzioni Sono miscele omogenee di due o più sostanze (in forma di molecole, atomi, ioni) di cui quella presente in quantità maggiore è definita solvente, le altre soluti. possono essere solide (leghe)
Sommario della lezione 18. Proprietà colligative
 Sommario della lezione 18 Proprietà colligative Interazioni soluto-solvente Interazioni soluto-solvente La solubilità di un soluto in un particolare solvente dipende da: la natura delle particelle di solvente
Sommario della lezione 18 Proprietà colligative Interazioni soluto-solvente Interazioni soluto-solvente La solubilità di un soluto in un particolare solvente dipende da: la natura delle particelle di solvente
I Legami intermolecolari
 I Legami intermolecolari Legami tra gli atomi di una molecola riepilogando Ionico D >1,9 Legami forti Covalente D = differenza di elettronegatività tra gli atomi Metallico (dovuto alla dislocazione di
I Legami intermolecolari Legami tra gli atomi di una molecola riepilogando Ionico D >1,9 Legami forti Covalente D = differenza di elettronegatività tra gli atomi Metallico (dovuto alla dislocazione di
LE SOLUZIONI Soluzione: sistema omogeneo di due o più componenti
 LE SOLUZIONI Soluzione: sistema omogeneo di due o più componenti Il processo di solubilizzazione è una trasformazione fisica, pertanto le proprietà chimiche dei componenti si conservano Le soluzioni possono
LE SOLUZIONI Soluzione: sistema omogeneo di due o più componenti Il processo di solubilizzazione è una trasformazione fisica, pertanto le proprietà chimiche dei componenti si conservano Le soluzioni possono
Le forze intermolecolari ed i liquidi Brooks/Cole - Cengage
 2018 Le forze intermolecolari ed i liquidi 1 2009 Brooks/Cole - Cengage Forze Intermolecolari 2 Forze intermolecolari sono forze che si esercitano fra molecole, fra ioni, o fra molecole e ioni. Forze intramolecolari
2018 Le forze intermolecolari ed i liquidi 1 2009 Brooks/Cole - Cengage Forze Intermolecolari 2 Forze intermolecolari sono forze che si esercitano fra molecole, fra ioni, o fra molecole e ioni. Forze intramolecolari
Olimpiadi di Chimica
 Olimpiadi di Chimica Acqua Oro Zucchero I Legami Chimici F N F F Il legame chimico il legame ionico Polare il legame covalente Dativo Gli elettroni di valenza sono gli elettroni del livello più esterno
Olimpiadi di Chimica Acqua Oro Zucchero I Legami Chimici F N F F Il legame chimico il legame ionico Polare il legame covalente Dativo Gli elettroni di valenza sono gli elettroni del livello più esterno
legge dell azione di massa: all equilibrio K c = [C] c [D] d / [A] a [B] b = k 1 /k -1
![legge dell azione di massa: all equilibrio K c = [C] c [D] d / [A] a [B] b = k 1 /k -1 legge dell azione di massa: all equilibrio K c = [C] c [D] d / [A] a [B] b = k 1 /k -1](/thumbs/71/65830231.jpg) EQUILIBRIO CHIMICO 1 Consideriamo la reazione chimica seguente: CH 3 COOH + C 2 H 5 OH CH 3 COOC 2 H 5 + H 2 O K c = [estere] [acqua] / [acido] [alcol] K c = costante di equilibrio legge dell azione di
EQUILIBRIO CHIMICO 1 Consideriamo la reazione chimica seguente: CH 3 COOH + C 2 H 5 OH CH 3 COOC 2 H 5 + H 2 O K c = [estere] [acqua] / [acido] [alcol] K c = costante di equilibrio legge dell azione di
IL LEGAME A IDROGENO
 IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
Trimetilammina, Nicotina, Cocaina. Ammine
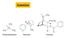 Trimetilammina, Nicotina, Cocaina Ammine Morfina, Codeina, Eroina Alcaloidi Nomenclatura IUPAC ammine alifatiche cicloesanammina IUPAC: alcanammina Polisostituite: N-alchil alcanammina N-etil-N-metilcicloesanammina
Trimetilammina, Nicotina, Cocaina Ammine Morfina, Codeina, Eroina Alcaloidi Nomenclatura IUPAC ammine alifatiche cicloesanammina IUPAC: alcanammina Polisostituite: N-alchil alcanammina N-etil-N-metilcicloesanammina
Teoria di Arrhenius: sono acide (basiche) tutte quelle sostanze che, poste in acqua, sono capaci di dissociarsi formando ioni H + (OH - ).
 ACIDI, BASI e ph Teoria di Arrhenius: sono acide (basiche) tutte quelle sostanze che, poste in acqua, sono capaci di dissociarsi formando ioni H + (OH - ). Teoria di Brönsted-Lowry: un acido (base) è una
ACIDI, BASI e ph Teoria di Arrhenius: sono acide (basiche) tutte quelle sostanze che, poste in acqua, sono capaci di dissociarsi formando ioni H + (OH - ). Teoria di Brönsted-Lowry: un acido (base) è una
Brady Senese Pignocchino Chimica.blu Zanichelli 2014 Soluzione degli esercizi Capitolo 22
 Brady Senese Pignocchino Chimica.blu Zanichelli 014 Soluzione degli esercizi Capitolo Esercizio Risposta PAG 515 ES 1 Basica, a causa dell idrolisi dell anione (base coniugata di un acido debole). PAG
Brady Senese Pignocchino Chimica.blu Zanichelli 014 Soluzione degli esercizi Capitolo Esercizio Risposta PAG 515 ES 1 Basica, a causa dell idrolisi dell anione (base coniugata di un acido debole). PAG
ACIDI E BASI ORGANICI: pka e ph
 Soluzione ph NaOH, 0,1 M Candeggina domestica Ammoniaca domestica ACIDI E BASI ORGANICI: pka e ph Magnesia Borace Bicarbonato Acqua di mare, albume Sangue, lacrime Latte Saliva Pioggia Caffè Pomodori Vino
Soluzione ph NaOH, 0,1 M Candeggina domestica Ammoniaca domestica ACIDI E BASI ORGANICI: pka e ph Magnesia Borace Bicarbonato Acqua di mare, albume Sangue, lacrime Latte Saliva Pioggia Caffè Pomodori Vino
Esercizi su Cambiamenti di Stato
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Esercizi su Cambiamenti di Stato Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Esercizi su Cambiamenti di Stato Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/
Proprietà Chimico-fisiche dei composti organici
 Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Legami secondari e lo stato fisico
 Legami secondari e lo stato fisico Gli stati aggregati (stato solido, liquido) richiedono la presenza di forze intermolecolari tra le molecole che compongono la sostanza. Legame ione dipolo (si forma fra
Legami secondari e lo stato fisico Gli stati aggregati (stato solido, liquido) richiedono la presenza di forze intermolecolari tra le molecole che compongono la sostanza. Legame ione dipolo (si forma fra
Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente
 Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente Soluzioni Sistema Omogeneo (presenta le stesse proprietà in qualsiasi sua porzione) Monofasico Nella fase omogenea
Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente Soluzioni Sistema Omogeneo (presenta le stesse proprietà in qualsiasi sua porzione) Monofasico Nella fase omogenea
DISSOLUZIONE. Velocità di dissoluzione di un farmaco è un importante parametro preformulativo
 DISSOLUZIONE Velocità di dissoluzione di un farmaco è un importante parametro preformulativo Se C< 0,15C s dm dt = ka(c s -C) condizioni sink dm dt o =kac s Figura 2.6 Profili di concentrazione relativi
DISSOLUZIONE Velocità di dissoluzione di un farmaco è un importante parametro preformulativo Se C< 0,15C s dm dt = ka(c s -C) condizioni sink dm dt o =kac s Figura 2.6 Profili di concentrazione relativi
 SLUBILITA SLUBILITA IN ACQUA MLECLE DI ACQUA SLUBILITA Rappresenta un parametro di estrema importanza che molto spesso consente non solo di capire la natura della sostanza in esame ma può condurre
SLUBILITA SLUBILITA IN ACQUA MLECLE DI ACQUA SLUBILITA Rappresenta un parametro di estrema importanza che molto spesso consente non solo di capire la natura della sostanza in esame ma può condurre
Le soluzioni e la loro concentrazione
 Le soluzioni e la loro concentrazione Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
Le soluzioni e la loro concentrazione Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Soluti in acqua. Elettroliti. Non elettroliti
 Soluti in acqua Elettroliti Forti Dissociazione Elettrolitica COMPLETA Soluto Deboli Dissociazione Elettrolitica NON COMPLETA Non elettroliti Dissociazione Elettrolitica NaCl (s) + acqua Na + (aq) + Cl
Soluti in acqua Elettroliti Forti Dissociazione Elettrolitica COMPLETA Soluto Deboli Dissociazione Elettrolitica NON COMPLETA Non elettroliti Dissociazione Elettrolitica NaCl (s) + acqua Na + (aq) + Cl
Esame di Fondamenti di Chimica - Meccanici/Energetici/Aerospaziali I verifica: 14/11/08 - A
 Esame di Fondamenti di Chimica - Meccanici/Energetici/Aerospaziali I verifica: 14/11/08 - A Avvertenze: scrivere le soluzioni sull apposito foglio che va completato con tutti i dati richiesti prima di
Esame di Fondamenti di Chimica - Meccanici/Energetici/Aerospaziali I verifica: 14/11/08 - A Avvertenze: scrivere le soluzioni sull apposito foglio che va completato con tutti i dati richiesti prima di
Le soluzioni possono esistere in ognuno dei tre stati della materia: gas, liquido o solido.
 SOLUZIONI Una soluzione èuna miscela omogenea (=la sua composizione e le sue proprietà sono uniformi in ogni parte del campione) di due o più sostanze formate da ioni o molecole. Differenza con i colloidi
SOLUZIONI Una soluzione èuna miscela omogenea (=la sua composizione e le sue proprietà sono uniformi in ogni parte del campione) di due o più sostanze formate da ioni o molecole. Differenza con i colloidi
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU)
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
Testi Consigliati: Farmacocinetica e Farmacodinamica. Giovanni Greco, Loghia.
 Prof. Antonio Randazzo Corso di: Fondamenti di Chimica Fitoterapeutica. Basi molecolari dellʼazione dei principi attivi estratti da piante. Testi Consigliati: Farmacocinetica e Farmacodinamica. Giovanni
Prof. Antonio Randazzo Corso di: Fondamenti di Chimica Fitoterapeutica. Basi molecolari dellʼazione dei principi attivi estratti da piante. Testi Consigliati: Farmacocinetica e Farmacodinamica. Giovanni
PROPRIETÁ DEI LIQUIDI
 PROPRIETÁ DEI LIQUIDI Viscosità: resistenza di un fluido al flusso, ossia scorrimento relativo delle molecole Una semplice misura (indiretta) è il tempo di efflusso di un dato volume di liquido attraverso
PROPRIETÁ DEI LIQUIDI Viscosità: resistenza di un fluido al flusso, ossia scorrimento relativo delle molecole Una semplice misura (indiretta) è il tempo di efflusso di un dato volume di liquido attraverso
 positiva, endotermico (la soluzione si raffredda) negativa, esotermico (la soluzione si scalda). DH sol = E ret + E solv concentrazione Molare Esempio: Preparare mezzo litro (0,5 l) di soluzione acquosa
positiva, endotermico (la soluzione si raffredda) negativa, esotermico (la soluzione si scalda). DH sol = E ret + E solv concentrazione Molare Esempio: Preparare mezzo litro (0,5 l) di soluzione acquosa
21/03/2017 EQUILIBRI IN SOLUZIONE ACQUOSA EQUILIBRI IN SOLUZIONE ACQUOSA EQUILIBRI IN SOLUZIONE ACQUOSA
 EQUILIBRI IN SOLUZIONE ACQUOSA EQUILIBRI IN SOLUZIONE ACQUOSA EQUILIBRI IN SOLUZIONE ACQUOSA 1 Concentrazione Molarità : numero di moli di soluto per litro di soluzione. Molalità : numero di moli di soluto
EQUILIBRI IN SOLUZIONE ACQUOSA EQUILIBRI IN SOLUZIONE ACQUOSA EQUILIBRI IN SOLUZIONE ACQUOSA 1 Concentrazione Molarità : numero di moli di soluto per litro di soluzione. Molalità : numero di moli di soluto
Acidi e basi sono sostanze note da molto tempo e diverse classificazioni sono state fatte nel corso del tempo in base alle loro proprietà.
 TEORIE ACIDO-BASE Acidi e basi sono sostanze note da molto tempo e diverse classificazioni sono state fatte nel corso del tempo in base alle loro proprietà. Teoria di Arrhenius Arrhenius fu il primo a
TEORIE ACIDO-BASE Acidi e basi sono sostanze note da molto tempo e diverse classificazioni sono state fatte nel corso del tempo in base alle loro proprietà. Teoria di Arrhenius Arrhenius fu il primo a
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame.
 Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
Le forze intermolecolari Manifestazione delle forze intermolecolari
 1 Le forze intermolecolari Manifestazione delle forze intermolecolari 2 I gas nobili (He, Ne, Ar...) che NON formano legami chimici dovrebbero restare gassosi a qualsiasi temperatura. Invece a T molto
1 Le forze intermolecolari Manifestazione delle forze intermolecolari 2 I gas nobili (He, Ne, Ar...) che NON formano legami chimici dovrebbero restare gassosi a qualsiasi temperatura. Invece a T molto
PON C4 "LE SCIENZE IN GARA!"
 PON C4 "LE SCIENZE IN GARA!" Approfondimenti di Chimica e Biologia: ph, poh, soluzioni tampone, acidi monoprotici e poliprotici, acido acetico, acetati, ammine, ammidi. prof. Ciro Formica Calcolo della
PON C4 "LE SCIENZE IN GARA!" Approfondimenti di Chimica e Biologia: ph, poh, soluzioni tampone, acidi monoprotici e poliprotici, acido acetico, acetati, ammine, ammidi. prof. Ciro Formica Calcolo della
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
Concentrazione nel solvente 2. Concentrazione nel solvente 1
 Concentrazione nel solvente 2 Concentrazione nel solvente 1 Costanti di Equilibrio e Separazioni (Estrazioni liquido-liquido) (acq) aa + bb cc+ dd (org) Keq = [C] [A] c a [D] [B] d b A(fase iniziale o
Concentrazione nel solvente 2 Concentrazione nel solvente 1 Costanti di Equilibrio e Separazioni (Estrazioni liquido-liquido) (acq) aa + bb cc+ dd (org) Keq = [C] [A] c a [D] [B] d b A(fase iniziale o
Lezione 4. Le soluzioni Acidi e Basi Reazioni Chimiche La Concentrazione delle Soluzioni
 2018 Lezione 4. Le soluzioni Acidi e Basi Reazioni Chimiche La Concentrazione delle Soluzioni Una soluzione è una miscela omogenea di 2 o più sostanze Il soluto è la sostanza (o sostanze) presente/i in
2018 Lezione 4. Le soluzioni Acidi e Basi Reazioni Chimiche La Concentrazione delle Soluzioni Una soluzione è una miscela omogenea di 2 o più sostanze Il soluto è la sostanza (o sostanze) presente/i in
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Soluzioni. Miscele: (gas in gas) Leghe: (solidi in solidi) Soluzioni p.d: (solventi liquidi)
 Soluzioni Sono miscele omogenee in cui si riconoscono 2 componenti o fasi: il soluto, presente in quantità minore il solvente presente in quantità maggiore. Tipi di soluzioni: Miscele: (gas in gas) Leghe:
Soluzioni Sono miscele omogenee in cui si riconoscono 2 componenti o fasi: il soluto, presente in quantità minore il solvente presente in quantità maggiore. Tipi di soluzioni: Miscele: (gas in gas) Leghe:
1) A che cosa è dovuta la elevata viscosità del mercurio elementare (allo stato liquido)?
 1) A che cosa è dovuta la elevata viscosità del mercurio elementare (allo stato liquido)? A. ai legami ad idrogeno tra gli atomi di mercurio B. alle interazioni tipo London tra gli atomi di mercurio C.
1) A che cosa è dovuta la elevata viscosità del mercurio elementare (allo stato liquido)? A. ai legami ad idrogeno tra gli atomi di mercurio B. alle interazioni tipo London tra gli atomi di mercurio C.
EQUILIBRIO CHIMICO REAZIONI A TERMINE REAZIONI DI EQUILIBRIO 04/11/2015. Reazione: A B
 REAZIONI A TERMINE Reazione: A B REAZIONI DI EQUILIBRIO EQUILIBRIO CHIMICO L'equilibrio chimico è la condizione dipendente dalla temperatura in cui le concentrazioni delle specie chimiche che partecipano
REAZIONI A TERMINE Reazione: A B REAZIONI DI EQUILIBRIO EQUILIBRIO CHIMICO L'equilibrio chimico è la condizione dipendente dalla temperatura in cui le concentrazioni delle specie chimiche che partecipano
Soluzioni e Concentrazione
 Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Soluzioni e Concentrazione Prof. Dipartimento CMIC Giulio Natta https://corsi.chem.polimi.it/citterio/default.htm
Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Soluzioni e Concentrazione Prof. Dipartimento CMIC Giulio Natta https://corsi.chem.polimi.it/citterio/default.htm
Teoria di Lewis. Un acido di Lewis è una specie chimica che può formare un legame covalente accettando una coppia di elettroni da un altra specie.
 Teoria di Lewis Spiega perché alcune reazioni hanno proprietà acidobase pur non avendo idrogeni. Nella teoria di Lewis le reazioni acido-base hanno come protagonista la messa in condivisione di una coppia
Teoria di Lewis Spiega perché alcune reazioni hanno proprietà acidobase pur non avendo idrogeni. Nella teoria di Lewis le reazioni acido-base hanno come protagonista la messa in condivisione di una coppia
SOLUZIONI E CONCENTRAZIONE
 SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
Presentazione. Introduzione
 Presentazione Introduzione xiii xv 1 Dal sistema chimico al nucleo atomico 1 1.1 Il sistema chimico........................ 2 1.2 Molecole............................. 6 1.3 Atomi...............................
Presentazione Introduzione xiii xv 1 Dal sistema chimico al nucleo atomico 1 1.1 Il sistema chimico........................ 2 1.2 Molecole............................. 6 1.3 Atomi...............................
ESTRAZIONE CON SOLVENTE
 ESTRAZIONE CON SOLVENTE TECNICA DI SEPARAZIONE BASATA SUL TRASFERIMENTO SELETTIVO DI UNO O PIÙ COMPONENTI DI UNA MISCELA SOLIDA, LIQUIDA O GASSOSA DA UN SOLVENTE AD UN ALTRO SOLVENTE IMMISCIBILE CON IL
ESTRAZIONE CON SOLVENTE TECNICA DI SEPARAZIONE BASATA SUL TRASFERIMENTO SELETTIVO DI UNO O PIÙ COMPONENTI DI UNA MISCELA SOLIDA, LIQUIDA O GASSOSA DA UN SOLVENTE AD UN ALTRO SOLVENTE IMMISCIBILE CON IL
LA MOLE. Si definisce MOLE una quantita di sostanza di un sistema che contiene tante entita elementari quanti sono gli atomi (NA) in 12g di C 12
 LA MOLE Si definisce MOLE una quantita di sostanza di un sistema che contiene tante entita elementari quanti sono gli atomi (NA) in 12g di C 12 NA = 6,022 x 10 23 particelle /mol numero di Avogadro 1 mole
LA MOLE Si definisce MOLE una quantita di sostanza di un sistema che contiene tante entita elementari quanti sono gli atomi (NA) in 12g di C 12 NA = 6,022 x 10 23 particelle /mol numero di Avogadro 1 mole
Tensione di vapore evaporazione
 Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Fasi di identificazione di una sostanza
 Fasi di identificazione di una sostanza 5 Analisi strutturale A - Analisi qualitativa degli elementi B - Saggi di riconoscimento di carattere generale: ricerca anello aromatico, ricerca insaturazioni C
Fasi di identificazione di una sostanza 5 Analisi strutturale A - Analisi qualitativa degli elementi B - Saggi di riconoscimento di carattere generale: ricerca anello aromatico, ricerca insaturazioni C
Acidi e Basi. Acido H + (aq) +... Base OH - (aq) +... Tipici acidi di Arrhenius: HCl, HNO 3, HCN,... Tipiche basi di Arrhenius: NaOH, KOH, Ba(OH) 2,
 Lezione 16 1. Definizioni di acido e base (Arrhenius) 2. Coppie coniugate acido-base (Bronsted-Lowry) 3. Acidi e basi di Lewis 4. Forza di acidi e basi. Le costanti di dissociazione acida e basica 5. La
Lezione 16 1. Definizioni di acido e base (Arrhenius) 2. Coppie coniugate acido-base (Bronsted-Lowry) 3. Acidi e basi di Lewis 4. Forza di acidi e basi. Le costanti di dissociazione acida e basica 5. La
Lezione 6. Acidi e Basi Equilibri Acido Base ph delle Soluzioni Saline
 2018 Lezione 6. Acidi e Basi Equilibri Acido Base ph delle Soluzioni Saline 1 Definizioni di Acido e Base Arrhenius - Brønsted - Lewis Acido di Arrhenius è una sostanza che libera in acqua ioni H + (H
2018 Lezione 6. Acidi e Basi Equilibri Acido Base ph delle Soluzioni Saline 1 Definizioni di Acido e Base Arrhenius - Brønsted - Lewis Acido di Arrhenius è una sostanza che libera in acqua ioni H + (H
LEGAMI INTERMOLECOLARI LEGAMI INTERMOLECOLARI
 I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
FORZA DI ACIDI E BASI HA + :B HB + + A
 FORZA DI ACIDI E BASI n La forza di un acido è la misura della tendenza di una sostanza a cedere un protone. n La forza di una base è una misura dell'affinità di un composto ad accettare un protone. n
FORZA DI ACIDI E BASI n La forza di un acido è la misura della tendenza di una sostanza a cedere un protone. n La forza di una base è una misura dell'affinità di un composto ad accettare un protone. n
SOLUZIONI MISCELE FISICAMENTE OMOGENEE SOLIDE, LIQUIDE, GASSOSE
 SOLUZIONI MISCELE FISICAMENTE OMOGENEE SOLIDE, LIQUIDE, GASSOSE SOLUZIONE SOLVENTE (Liquido) POLARE (es. H 2 O) APOLARE (solventi organici) ELETTROLITA (es. NaCl) SOLUTO (Solido, liquido, gas) NON ELETTROLITA
SOLUZIONI MISCELE FISICAMENTE OMOGENEE SOLIDE, LIQUIDE, GASSOSE SOLUZIONE SOLVENTE (Liquido) POLARE (es. H 2 O) APOLARE (solventi organici) ELETTROLITA (es. NaCl) SOLUTO (Solido, liquido, gas) NON ELETTROLITA
Smistamento sistema+co H. Staudinger
 Smistamento sistema+co H. Staudinger onsente mediante procedimen+ sistema+ci lo smistamento in gruppi di una miscela incognita sulla base delle diverse cara8eris+che chimico-fisiche dei componen+ Frazione
Smistamento sistema+co H. Staudinger onsente mediante procedimen+ sistema+ci lo smistamento in gruppi di una miscela incognita sulla base delle diverse cara8eris+che chimico-fisiche dei componen+ Frazione
Teorie Acido-Base. Gli acidi in acqua si dissociano e rilasciano H + Le basi in acqua si dissociano e rilasciano OH -
 Teorie Acido-Base Arrhenius: Gli acidi in acqua si dissociano e rilasciano H + Le basi in acqua si dissociano e rilasciano OH - Broensted-Lowry: Gli acidi rilasciano H + Le basi accettano H + Lewis gli
Teorie Acido-Base Arrhenius: Gli acidi in acqua si dissociano e rilasciano H + Le basi in acqua si dissociano e rilasciano OH - Broensted-Lowry: Gli acidi rilasciano H + Le basi accettano H + Lewis gli
Le interazioni reversibili tra le macromolecole sono mediate da 3 specie di legami non covalenti:
 Le interazioni reversibili tra le macromolecole sono mediate da 3 specie di legami non covalenti: 1) Legami elettrostatici 2) Legami idrogeno 3) Forze di van der Waals Le interazioni deboli tra biomolecole
Le interazioni reversibili tra le macromolecole sono mediate da 3 specie di legami non covalenti: 1) Legami elettrostatici 2) Legami idrogeno 3) Forze di van der Waals Le interazioni deboli tra biomolecole
Equilibrio Acido base
 Equilibrio Acido base Acido e base secondo ARRHENIUS Un acido è una sostanza che in soluzione acquosa libera ioni idrogeno HA à H A - HCl à H Cl - Un base è una sostanza che in soluzione acquosa libera
Equilibrio Acido base Acido e base secondo ARRHENIUS Un acido è una sostanza che in soluzione acquosa libera ioni idrogeno HA à H A - HCl à H Cl - Un base è una sostanza che in soluzione acquosa libera
Tecniche di separazione e purificazione dei composti organici
 Tecniche di separazione e purificazione dei composti organici I composti organici, sia di origine naturale che prodotti in laboratorio mediante sintesi chimica, si trovano spesso miscelati ad altre sostanze
Tecniche di separazione e purificazione dei composti organici I composti organici, sia di origine naturale che prodotti in laboratorio mediante sintesi chimica, si trovano spesso miscelati ad altre sostanze
Analisi dei Medicinali II
 Università degli Studi Magna Græcia cia di Catanzaro Facoltà di Farmacia Corso di Analisi dei Medicinali II A.A. 2007/2008 Francesco rtuso Esame sistematico di una sostanza organica Isolamento della sostanza
Università degli Studi Magna Græcia cia di Catanzaro Facoltà di Farmacia Corso di Analisi dei Medicinali II A.A. 2007/2008 Francesco rtuso Esame sistematico di una sostanza organica Isolamento della sostanza
Analisi Chimico Farmaceutica e Tossicologica con Laboratorio
 Analisi Chimico Farmaceutica e Tossicologica con Laboratorio corso di Laurea in Farmacia canale A-L anno accademico 2018-2019 Dr. Antonio Coluccia Dipartimento di Chimica e Tecnologie del Farmaco Sapienza
Analisi Chimico Farmaceutica e Tossicologica con Laboratorio corso di Laurea in Farmacia canale A-L anno accademico 2018-2019 Dr. Antonio Coluccia Dipartimento di Chimica e Tecnologie del Farmaco Sapienza
Corso di Chimica Generale CL Biotecnologie
 Corso di Chimica Generale CL Biotecnologie STATI DELLA MATERIA Prof. Manuel Sergi MATERIA ALLO STATO GASSOSO MOLECOLE AD ALTA ENERGIA CINETICA GRANDE DISTANZA TRA LE MOLECOLE LEGAMI INTERMOLECOLARI DEBOLI
Corso di Chimica Generale CL Biotecnologie STATI DELLA MATERIA Prof. Manuel Sergi MATERIA ALLO STATO GASSOSO MOLECOLE AD ALTA ENERGIA CINETICA GRANDE DISTANZA TRA LE MOLECOLE LEGAMI INTERMOLECOLARI DEBOLI
Soluzioni RAGIONAMENTO LOGICO E CULTURA GENERALE. Risposta. Risposta. Risposta. Risposta. Risposta. Risposta. Risposta. Risposta. Risposta.
 Soluzioni 1 A 2 B 3 B 4 E 5 D 6 E 7 B 8 D 9 C 10 B 11 D 12 B 13 E 14 D 15 C 16 C 17 B 18 D 19 A 20 C 21 D 22 C 23 D 24 C 25 E 26 C 27 D 28 C 29 B 30 B 31 D 32 E 33 B 34 C 35 E 36 A 37 D 38 B 39 C 40 D
Soluzioni 1 A 2 B 3 B 4 E 5 D 6 E 7 B 8 D 9 C 10 B 11 D 12 B 13 E 14 D 15 C 16 C 17 B 18 D 19 A 20 C 21 D 22 C 23 D 24 C 25 E 26 C 27 D 28 C 29 B 30 B 31 D 32 E 33 B 34 C 35 E 36 A 37 D 38 B 39 C 40 D
Interazioni deboli. Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012
 Interazioni deboli 1 Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012 Legami deboli o interazioni deboli La forza di un legame chimico viene stabilita in base alla energia del
Interazioni deboli 1 Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012 Legami deboli o interazioni deboli La forza di un legame chimico viene stabilita in base alla energia del
L ACQUA. E il mezzo in cui avvengono le maggiori reazioni. Tutte le molecole biologiche assumono forma e
 L ACQUA E il mezzo in cui avvengono le maggiori reazioni biochimiche Tutte le molecole biologiche assumono forma e funzione in base alle proprietà chimiche e fisiche delle molecole di H 2 O che le circondano
L ACQUA E il mezzo in cui avvengono le maggiori reazioni biochimiche Tutte le molecole biologiche assumono forma e funzione in base alle proprietà chimiche e fisiche delle molecole di H 2 O che le circondano
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Oltre alle forze intramolecolari (legami) esistono nella materia forze intermolecolari (tra molecole diverse), anch esse dovute ad interazioni elettrostatiche. Le forze intermolecolari
FORZE INTERMOLECOLARI Oltre alle forze intramolecolari (legami) esistono nella materia forze intermolecolari (tra molecole diverse), anch esse dovute ad interazioni elettrostatiche. Le forze intermolecolari
Acidi e basi di Lewis
 Gli acidi e le basi Acidi e basi di Lewis Acidi di Lewis= specie che possono accettare in compartecipazione una coppia di elettroni da un altra specie. Base di Lewis = specie che può cedere in compartecipazione
Gli acidi e le basi Acidi e basi di Lewis Acidi di Lewis= specie che possono accettare in compartecipazione una coppia di elettroni da un altra specie. Base di Lewis = specie che può cedere in compartecipazione
Prova scritta CTF del 20- Gen NO 2
 Prova scritta CTF del 20Gen2011 1) Il Legame Covalente 2) Bilanciare in ambiente acido la seguente reazione di ossido riduzione: MnO 4 + NO 2 = Mn 2+ + NO 3 3) Applicando la teoria della repulsione delle
Prova scritta CTF del 20Gen2011 1) Il Legame Covalente 2) Bilanciare in ambiente acido la seguente reazione di ossido riduzione: MnO 4 + NO 2 = Mn 2+ + NO 3 3) Applicando la teoria della repulsione delle
ph di Acidi e Basi Forti Molto Diluiti
 ph di Acidi e Basi Forti Molto Diluiti Come si calcola il ph di acidi e basi forti molto diluiti Proviamo a determinare il ph di una soluzione di HCl avente una concentrazione 10-7 mol/l. Applicando il
ph di Acidi e Basi Forti Molto Diluiti Come si calcola il ph di acidi e basi forti molto diluiti Proviamo a determinare il ph di una soluzione di HCl avente una concentrazione 10-7 mol/l. Applicando il
Gli stati di aggregazione della materia.
 Gli stati di aggregazione della materia. Stati di aggregazione della materia: Solido, liquido, gassoso Passaggi di stato: Solido Liquido (fusione) e liquido solido (solidificazione); Liquido aeriforme
Gli stati di aggregazione della materia. Stati di aggregazione della materia: Solido, liquido, gassoso Passaggi di stato: Solido Liquido (fusione) e liquido solido (solidificazione); Liquido aeriforme
DI FASE DISTILLAZIONE
 Chimica Silvia LICOCCIA Professore Ordinario di Fondamenti Chimici per le Tecnologie Dipartimento di Scienze e Tecnologie Chimiche Università di Roma Tor Vergata TRANSIZIONI DI FASE DISTILLAZIONE Le fasi
Chimica Silvia LICOCCIA Professore Ordinario di Fondamenti Chimici per le Tecnologie Dipartimento di Scienze e Tecnologie Chimiche Università di Roma Tor Vergata TRANSIZIONI DI FASE DISTILLAZIONE Le fasi
LEGAMI CHIMICI. Gli elettroni esterni sono implicati nella formazione dei legami chimici
 LEGAMI CHIMICI Gli elettroni esterni sono implicati nella formazione dei legami chimici La VALENZA di un elemento è data dal numero di elettroni che esso deve perdere, o acquistare, o mettere in comune
LEGAMI CHIMICI Gli elettroni esterni sono implicati nella formazione dei legami chimici La VALENZA di un elemento è data dal numero di elettroni che esso deve perdere, o acquistare, o mettere in comune
ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383
 ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: Rosmarini Diana Classe: I Sez.:
ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: Rosmarini Diana Classe: I Sez.:
GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato liquido
 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato liquido Lo stato liquido Liquidi: energia dei moti termici confrontabile con quella delle forze coesive. Limitata libertà di movimento delle molecole, che
GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato liquido Lo stato liquido Liquidi: energia dei moti termici confrontabile con quella delle forze coesive. Limitata libertà di movimento delle molecole, che
1 Generalità. Teoria acido-base 1. Il ph. HCl H + + Cl (acido) NaOH Na + + OH (base)
 Il p 1 Generalità O 104 δ+ δ- igura 1 La struttura molecolare dell acqua (in evidenza la sua polarità) L acqua ( 2 O) è il solvente più diffuso in natura. Realizza miscugli di ogni genere sia con sostanze
Il p 1 Generalità O 104 δ+ δ- igura 1 La struttura molecolare dell acqua (in evidenza la sua polarità) L acqua ( 2 O) è il solvente più diffuso in natura. Realizza miscugli di ogni genere sia con sostanze
Le forze intermolecolari e i liquidi Brooks/Cole - Cengage
 Le forze intermolecolari e i liquidi 1 2017 2009 Brooks/Cole - Cengage 2 Forze Intermolecolari Forze attrattive che si esercitano fra molecole, fra ioni, o fra molecole e ioni. queste forze sono responsabili
Le forze intermolecolari e i liquidi 1 2017 2009 Brooks/Cole - Cengage 2 Forze Intermolecolari Forze attrattive che si esercitano fra molecole, fra ioni, o fra molecole e ioni. queste forze sono responsabili
ACIDI e BASI. Definizione di Brønsted-Lowry (non solo limitata alle soluzioni acquose)
 ACIDI e BASI Definizione di Brønsted-Lowry (non solo limitata alle soluzioni acquose) ACIDO = Sostanza in grado di donare ioni H + (protoni o ioni idrogeno) BASE = Sostanza in grado di accettare ioni H
ACIDI e BASI Definizione di Brønsted-Lowry (non solo limitata alle soluzioni acquose) ACIDO = Sostanza in grado di donare ioni H + (protoni o ioni idrogeno) BASE = Sostanza in grado di accettare ioni H
L acqua. Ci devono essere delle forze che tengono saldamente insieme le molecole d acqua
 L acqua Comparata a molecole con caratteristiche atomiche simili e di grandezza comparabile, l acqua presenta alcune caratteristiche peculiari Comparando l idruro dell ossigeno con gli idruri degli elementi
L acqua Comparata a molecole con caratteristiche atomiche simili e di grandezza comparabile, l acqua presenta alcune caratteristiche peculiari Comparando l idruro dell ossigeno con gli idruri degli elementi
le SOSTANZE Sostanze elementari (ELEMENTI) COMPOSTI Costituiti da due o più atomi DIVERSI tra loro
 Il legame chimico In natura gli atomi sono solitamente legati ad altri in unità più complesse che, se aggregate fra loro costituiscono quello che macroscopicamente percepiamo come materia, le SOSTANZE
Il legame chimico In natura gli atomi sono solitamente legati ad altri in unità più complesse che, se aggregate fra loro costituiscono quello che macroscopicamente percepiamo come materia, le SOSTANZE
-DEFINIZIONE DI ACIDI E BASI-
 -DEFINIZIONE DI ACIDI E BASI- DEFINIZIONE DI ARRHENIUS ACIDO: rilascia ioni H + HCl H + + Cl - BASE: rilascia ioni OH - NaOH Na + + OH - DEFINIZIONE DI BRÖNSTED ACIDO: rilascia ioni H + BASE: lega ioni
-DEFINIZIONE DI ACIDI E BASI- DEFINIZIONE DI ARRHENIUS ACIDO: rilascia ioni H + HCl H + + Cl - BASE: rilascia ioni OH - NaOH Na + + OH - DEFINIZIONE DI BRÖNSTED ACIDO: rilascia ioni H + BASE: lega ioni
SOLUZIONE TAMPONE. Soluzione il cui ph non è modificato dall aggiunta di modiche quantità di acido o di base forti
 SOLUZIONE TAMPONE Soluzione il cui ph non è modificato dall aggiunta di modiche quantità di acido o di base forti Una soluzione tampone è costituita da Acido debole in presenza della propria base coniugata
SOLUZIONE TAMPONE Soluzione il cui ph non è modificato dall aggiunta di modiche quantità di acido o di base forti Una soluzione tampone è costituita da Acido debole in presenza della propria base coniugata
1. Perché le sostanze si sciolgono?
 1. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
1. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
Istituto di Istruzione Secondaria Superiore Statale «IIS Via Silvestri 301»
 Istituto di Istruzione Secondaria Superiore Statale «IIS Via Silvestri 301» Classe 1 a A Indirizzo ELETTRONICA ED ELETTROTECNICA ARGOMENTO 1 Dai miscugli alle sostanze 1.1 Osservando la materia 1.2 Grandezze
Istituto di Istruzione Secondaria Superiore Statale «IIS Via Silvestri 301» Classe 1 a A Indirizzo ELETTRONICA ED ELETTROTECNICA ARGOMENTO 1 Dai miscugli alle sostanze 1.1 Osservando la materia 1.2 Grandezze
Reazioni in soluzione acquosa
 Reazioni in soluzione acquosa Equazioni ioniche e molecolari Consideriamo le seguente reazione: Ca(OH) 2 (aq) + Na 2 CO 3 (aq) CaCO 3 (s) + 2 NaOH (aq) Essa è scritta come equazione molecolare anche se
Reazioni in soluzione acquosa Equazioni ioniche e molecolari Consideriamo le seguente reazione: Ca(OH) 2 (aq) + Na 2 CO 3 (aq) CaCO 3 (s) + 2 NaOH (aq) Essa è scritta come equazione molecolare anche se
MOLECOLE. 2 - i legami chimici. Prof. Vittoria Patti
 MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
 ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
PROPRIETÀ TIPICHE DEI LIQUIDI
 STATO LIQUIDO PROPRIETÀ TIPICHE DEI LIQUIDI - hanno volume ma non forma propria - hanno maggiore densità rispetto ai gas - sono incomprimibili - hanno capacità di fluire (forze di Van der Waals) EQUILIBRIO
STATO LIQUIDO PROPRIETÀ TIPICHE DEI LIQUIDI - hanno volume ma non forma propria - hanno maggiore densità rispetto ai gas - sono incomprimibili - hanno capacità di fluire (forze di Van der Waals) EQUILIBRIO
Energia e reazioni chimiche. Cap , 19-21, 27-30, 47-48, 50, 59-62
 2016-2017 CCS Biologia CCS Scienze Geologiche 1 Energia e reazioni chimiche Cap 5. 7-13, 19-21, 27-30, 47-48, 50, 59-62 2009 Brooks/Cole - Cengage Energia & Chimica 2 ENERGIA è la capacità di compiere
2016-2017 CCS Biologia CCS Scienze Geologiche 1 Energia e reazioni chimiche Cap 5. 7-13, 19-21, 27-30, 47-48, 50, 59-62 2009 Brooks/Cole - Cengage Energia & Chimica 2 ENERGIA è la capacità di compiere
Appunti di Stechiometria per Chimica
 Appunti di Stechiometria per Chimica Equilibri in soluzione acquosa Teoria degli acidi/basi secondo Brönsted-Lowry Acido una qualunque sostanza che è capace di donare uno ione idrogeno ad un altra sostanza
Appunti di Stechiometria per Chimica Equilibri in soluzione acquosa Teoria degli acidi/basi secondo Brönsted-Lowry Acido una qualunque sostanza che è capace di donare uno ione idrogeno ad un altra sostanza
Le soluzioni. A cura della Prof. ssa Barone Antonina
 Le soluzioni A cura della Prof. ssa Barone Antonina Le soluzioni: caratteri generali Sono sistemi omogenei; In esse, in qualsiasi punto si esegue una misurazione, si ottengono le stesse caratteristiche
Le soluzioni A cura della Prof. ssa Barone Antonina Le soluzioni: caratteri generali Sono sistemi omogenei; In esse, in qualsiasi punto si esegue una misurazione, si ottengono le stesse caratteristiche
Farmacocinetica. Lo studio di questi quattro processi viene definito come FARMACOCINETICA del farmaco
 Farmacocinetica Affinché un farmaco possa raggiungere il sito d azione ad una concentrazione sufficiente per esercitare il proprio effetto terapeutico specifico deve generalmente essere: assorbito dal
Farmacocinetica Affinché un farmaco possa raggiungere il sito d azione ad una concentrazione sufficiente per esercitare il proprio effetto terapeutico specifico deve generalmente essere: assorbito dal
