a.a. 2017/18 Prof.ssa Pia Lucidi Laboratorio di Cognizione e Benessere Animale RICEVIMENTO: Lunedì 17:30-18:30
|
|
|
- Fabiano Valle
- 5 anni fa
- Visualizzazioni
Transcript
1 a.a. 2017/18 Prof.ssa Pia Lucidi Laboratorio di Cognizione e Benessere Animale RICEVIMENTO: Lunedì 17:3018:30
2 Omeostasi acidobasica Gli enzimi operano ad un ph ottimale in un range molto ristretto (7.4 ± 0.02) Gli acidi possono liberare ioni H + Le basi possono accettare ioni H + I tamponi prevengono variazioni elevate dal ph fisiologico nel sangue: emoglobina e bicarbonati nelle cellule: proteine e fosfati
3 Regolazione del ph Ioni idrogeno (H + ) si liberano continuamente dall ossidazione di proteine acidi nucleici dalla conversione della CO 2 acido carbonico dal metabolismo anaerobico di carboidrati e grassi: liberazione di acido lattico liberazione di altri acidi H 2 SO 4 e H 3 PO 4
4 A livello di sangue A livello di osso A livello renale A livello polmonare Sistemi tampone
5 ph < 7.38 ACIDOSI Acidosi grave : ph < 7.2
6 ph > 7.42 ALCALOSI Alcalosi grave : ph > 7.6
7 ACIDOSI diminuzione della concentrazione di HCO 3 ACIDOSI METABOLICA aumento della CO 2 ACIDOSI RESPIRATORIA
8 ALCALOSI aumento della concentrazione di HCO 3 ALCALOSI METABOLICA diminuzione della CO 2 ALCALOSI RESPIRATORIA
9 Risposte compensatorie Acidosi/alcalosi metaboliche compenso respiratorio Acidosi/alcalosi respiratorie compenso renale
10 ACIDOSI METABOLICA E caratterizzata da: basso ph ph < 7.4 dovuto a : riduzione della concentrazione plasmatica di HCO 3 HCO 3 < 24 meq/l Risposta compensatoria: iperventilazione polmonare pco2 < 40 mmhg
11 ALCALOSI METABOLICA E caratterizzata da: aumento del ph ph > 7.4 dovuto a : aumento della concentrazione plasmatica di HCO 3 HCO 3 > 24 meq/l Risposta compensatoria: ipoventilazione polmonare pco2 > 40mmHg
12 Turbe metaboliche equilibrio acidobase: respiro conseguenze cliniche frequente e profondo (nell acidosi metabolica) lento e superficiale (nell alcalosi metabolica)
13 L EGA NORMALE (emogasanalisi) ph 7.4 pco 2 40 mmhg HCO 3 24 meq/l
14 Importanza dei meccanismi tampone Carnivori: tendenza all acidosi Notevole produzione di cataboliti acidi H 2 SO 4 H 2 PO 3 CO 2 Erbivori: tendenza all alcalosi Notevole assunzione di radicali basici Na + K + Cl
15 Sistemi tampone del sangue Bicarbonati Fosfati Proteine
16 Sono miscele di acidi deboli e dei loro Sali Es: NaHCO 3 (bicarbonato di sodio) e H 2 CO 3 (acido carbonico) Na + HCO 3 H + HCO 3 H 2 CO 3 Se si aggiunge un acido, la dissociazione dell acido carbonico si sposta, fornendo più accettori di H + per tamponare il ph
17 SISTEMA TAMPONE IDEALE: quello in cui il valore di pk corrisponde al valore di ph del sangue! In questo modo il rapporto sale/acido=1 e il log di 1=0 pk=ph!!!
18 Tamponi ideali Nell organismo non esistono sistemi con pk=7,4 I principali sistemi tampone hanno pk tendenzialmente acido Fosfati: Bicarbonati: Proteine: ogni aminoacido ha un suo valore di pk
19 Tampone fosfato I fosfati sarebbero tamponi ideali in quanto: pk= 6,8 Rapporto sale/acido = 4/1 ph = 6,8 + log4/1 ph = 6,8 + 0,6 =7,4
20 Tampone bicarbonato pk più acido rispetto ai fosfati pk = 6,1 dal p.d.v. chimico rappresentano quindi un sistema meno efficace dei fosfati rapporto sale/acido (HCO 3 /H 2 CO 3 ) =20/1 ph = 6,1 + log20/1 ph = 6,1 + 1,3 =7,4
21 Sistema HCO 3 /H 2 CO 3 Nonostante non siano ideali da un p.d.v. chimico, lo sono da un p.d.v. fisiologico, per la tendenza all acidosi che esiste a livello ematico (20/1) e renale viene prodotta una gran quantità di CO 2 CO 2 viene risentita dai glomi aortici e carotidei attivazione dell eliminazione attraverso la respirazione
22 Sistemi tampone Il meccanismo plasmatico lavora in sinergismo con i sistemi tampone renali, nel TUBULO CONTORTO DISTALE Carnivori: sistemi (bicarbonati, fosfati, proteine) che determinano perdita di radicali acidi con le urine e recupero di radicali basici nel sangue Erbivori (e vegetariani): scarsa acidificazione dell urina (alcalinizzazione)
23 Carnivori: sistemi tampone Nel TCD troviamo tre meccanismi: I: sistema bicarbonati II: sistema fosfati III: sistema proteine/ammonio
24 I: sistema bicarbonati ultrafiltrato Cellula TCD sangue HCO 3 Na + HCO 3 H + H 2 O + CO 2 H 2 CO 3 H + + HCO 3 Na + anidrasi carbonica Na + HCO 3 NB: per ogni sodio recuperato, un H + viene estruso Se l aldosterone lavora meno, si recupera meno sodio (acidosi)
25 I: sistema bicarbonati ultrafiltrato Cellula TCD sangue HCO 3 Na + HCO 3 H + H 2 O + CO 2 H 2 CO 3 H + + HCO 3 Na + anidrasi carbonica Na + HCO 3 H 2 CO 3 CO 2 CO 2 CO 2 H 2 O
26 I: sistema bicarbonati sangue Glomi aortici e carotidei Na + HCO 3 Aumento della frequenza e della profondità del respiro CO 2 RISERVA ALCALINA
27 II: sistema fosfati ultrafiltrato Cellula TCD sangue HPO 4 2Na + H 2 O + CO 2 H 2 CO 3 anidrasi carbonica HPO4 Na + H + H + + HCO 3 HCO 3 Na + HCO 3 Na + Na + NaH 2 PO 4 RISERVA ALCALINA
28 NB Anche con il sistema fosfati abbiamo recupero delle basi Tuttavia NON SI FORMA CO 2, Non c è stimolazione dei glomi Non è possibile l eliminazione per via respiratoria
29 III. Sistema proteine ultrafiltrato Cellula TCD sangue Na + Cl H 2 O + CO 2 anidrasi carbonica H 2 CO 3 Cl H + H+ HCO3 HCO 3 HCl Na+ Na + Na + HCO 3 glutamina glutaminasi Ac. Glutamico + NH 3 NH 4 + Cl
30 Riassumendo Na + passa (dalla cellula) nel sangue H + passa (dalla cellula) nel lume Il tutto dipende dall attività della pompa Na/H che dipende da: aldosterone pco 2 nella cellula Attività massima 1:1000 (cellula:lume)
31 Riassumendo Poiché ph= log 1/[H+] Log 10 di 1000 = 3 ph minimo delle urine = 7,43 = 4,4 Tuttavia la pompa di solito lavora a + basso regime (1:10, 1:20) L attività della pompa è regolata da pco 2 nella cellula (nel sangue)
32 Regolazione ph negli erbivori Alimentazione a base di foraggi Notevoli quantità di sostanze basiche, soprattutto sali di potassio Il K + è presente sia nel sangue e nelle cellule in concentrazione superiore ai carnivori La pompa non fa differenza tra H+ e K+
33 ultrafiltrato Cellula TCD sangue Na + HCO 3 HCO 3 Na + H 2 O + CO 2 H 2 CO 3 H + + HCO 3 anidrasi carbonica K + Na + HCO 3 Na + Na + K + HCO 3 K+
Plasma ph Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca
 Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE 1 I tamponi fisiologici del ph 1 - Il sistema acido carbonico-bicarbonato: H 2 CO 3 H + + HCO 3 pka = 6.1 ph = 6.1 + log [HCO 3 ] [H 2 CO 3 ] 2 - Il sistema fosfato:
L EQUILIBRIO ACIDO-BASE NEL SANGUE 1 I tamponi fisiologici del ph 1 - Il sistema acido carbonico-bicarbonato: H 2 CO 3 H + + HCO 3 pka = 6.1 ph = 6.1 + log [HCO 3 ] [H 2 CO 3 ] 2 - Il sistema fosfato:
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante di dissociazione
L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante di dissociazione
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi Lezione 24 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante
L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi Lezione 24 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante
Equilibrio acido base
 Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
Trasporto dei gas respiratori nel sangue
 Trasporto dei gas respiratori nel sangue La soluzione dei gas nei liquidi C Legge di Henry acq P gas S gas C acq = quantità di gas disciolta nella fase acquosa P gas = pressione parziale del gas nella
Trasporto dei gas respiratori nel sangue La soluzione dei gas nei liquidi C Legge di Henry acq P gas S gas C acq = quantità di gas disciolta nella fase acquosa P gas = pressione parziale del gas nella
Tamponi biologici per il controllo del ph
 Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI
 EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI SOMMARIO ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO ACIDO-BASE EGA (EMOGAS-ANALISI) ANALISI) ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO
EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI SOMMARIO ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO ACIDO-BASE EGA (EMOGAS-ANALISI) ANALISI) ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO
Le reazioni metaboliche sono estremamente sensibili alla concentrazione degli ioni H + nel liquido in cui avvengono, perché gli ioni H + influenzano
 EQUILIBRIO ACIDOBASE Le reazioni metaboliche sono estremamente sensibili alla concentrazione degli ioni H + nel liquido in cui avvengono, perché gli ioni H + influenzano il funzionamento degli enzimi.
EQUILIBRIO ACIDOBASE Le reazioni metaboliche sono estremamente sensibili alla concentrazione degli ioni H + nel liquido in cui avvengono, perché gli ioni H + influenzano il funzionamento degli enzimi.
ph = log 1/[H + ] = log [H + ]
![ph = log 1/[H + ] = log [H + ] ph = log 1/[H + ] = log [H + ]](/thumbs/49/24977942.jpg) ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
Rene ed equilibrio acido-base
 Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Per le lezioni del prof. P.P. Battaglini Schemi di. v 3.2. ph = pka + log10 [!$]
![Per le lezioni del prof. P.P. Battaglini Schemi di. v 3.2. ph = pka + log10 [!$] Per le lezioni del prof. P.P. Battaglini Schemi di. v 3.2. ph = pka + log10 [!$]](/thumbs/92/108719223.jpg) Per le lezioni del prof. P.P. Battaglini Schemi di v 3.2 ph = pka + log10! " [!$] Dichiarazione Le immagini presenti in questo file sono state reperite in rete o modificate da testi cartacei. Queste immagini
Per le lezioni del prof. P.P. Battaglini Schemi di v 3.2 ph = pka + log10! " [!$] Dichiarazione Le immagini presenti in questo file sono state reperite in rete o modificate da testi cartacei. Queste immagini
2.Controllo dell equilibrio acido-base - II. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 2.Controllo dell equilibrio acidobase II Carlo Capelli Fisiologia Facoltà di Scienze Motorie Università di Verona 1. Tampone bicarbonatoco 2 E il sistema tampone fisiologico più importante [ CO 2] = PCO
2.Controllo dell equilibrio acidobase II Carlo Capelli Fisiologia Facoltà di Scienze Motorie Università di Verona 1. Tampone bicarbonatoco 2 E il sistema tampone fisiologico più importante [ CO 2] = PCO
Controllo nervoso del respiro
 Controllo nervoso del respiro La respirazione è una funzione involontaria controllata da 3 gruppi di neuroni (centri) localizzati nel tronco encefalico: Controllo nervoso del respiro Centro respiratorio
Controllo nervoso del respiro La respirazione è una funzione involontaria controllata da 3 gruppi di neuroni (centri) localizzati nel tronco encefalico: Controllo nervoso del respiro Centro respiratorio
Equilibrio acido-base: il ph è importante
 Equilibrio acido-base: il ph è importante il ph è strettamente controllato il ph influenza l attività enzimatica il ph è diverso nei vari compartimenti: Esempio: stomaco- acido duodeno alcalino Il ph varia
Equilibrio acido-base: il ph è importante il ph è strettamente controllato il ph influenza l attività enzimatica il ph è diverso nei vari compartimenti: Esempio: stomaco- acido duodeno alcalino Il ph varia
Equilibrio acido-base
 Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
L'EQUILIBRIO ACIDO-BASE
 L'EQUILIBRIO ACIDO-BASE La concentrazione nell'organismo degli ioni H+ è finemente regolata perché quasi tutte le attività enzimatiche sono influenzate sostanzialmente dalle variazioni di ph. Quindi l'attività
L'EQUILIBRIO ACIDO-BASE La concentrazione nell'organismo degli ioni H+ è finemente regolata perché quasi tutte le attività enzimatiche sono influenzate sostanzialmente dalle variazioni di ph. Quindi l'attività
CHIRURGIA III ED EMERGENZE MEDICO - CHIRURGICHE. Sezione di Anestesia e Rianimazione Dir. Prof. Carlo Alberto Volta
 CHIRURGIA III ED EMERGENZE MEDICO - CHIRURGICHE Sezione di Anestesia e Rianimazione Dir. Prof. Carlo Alberto Volta Equilibrio acido-base Ph normale: 7.35-7.45 Acidemia per ph < 7.35 Alcalemia per ph >
CHIRURGIA III ED EMERGENZE MEDICO - CHIRURGICHE Sezione di Anestesia e Rianimazione Dir. Prof. Carlo Alberto Volta Equilibrio acido-base Ph normale: 7.35-7.45 Acidemia per ph < 7.35 Alcalemia per ph >
diminuito aumentato I disordini acido-base primari metabolici si riconoscono attraverso la valutazione della concentrazione di HCO3-
 diminuito aumentato I disordini acido-base primari metabolici si riconoscono attraverso la valutazione della concentrazione di HCO3- Risposta compensatoria all acidosi metabolica Compensazione polmonare
diminuito aumentato I disordini acido-base primari metabolici si riconoscono attraverso la valutazione della concentrazione di HCO3- Risposta compensatoria all acidosi metabolica Compensazione polmonare
Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio
 Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Tamponi Biologici. AO/Febbraio 2016
 Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
Equilibrio acido-base
 Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Rene ed equilibrio acido base. La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica. Principali funzioni renali
 Rene ed equilibrio acido base La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica Savi Umberto Scuola di Specializzazione in Nefrologia S.C. di Nefrologia e Dialisi Cattinara
Rene ed equilibrio acido base La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica Savi Umberto Scuola di Specializzazione in Nefrologia S.C. di Nefrologia e Dialisi Cattinara
DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE
 VOLUMI POLMONARI DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE DEFINIRE LE RESISTENZE POLMONARI DEFINIRE IL LAVORO POLMONARE Equazione
VOLUMI POLMONARI DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE DEFINIRE LE RESISTENZE POLMONARI DEFINIRE IL LAVORO POLMONARE Equazione
SOLUZIONE TAMPONE. Soluzione il cui ph non è modificato dall aggiunta di modiche quantità di acido o di base forti
 SOLUZIONE TAMPONE Soluzione il cui ph non è modificato dall aggiunta di modiche quantità di acido o di base forti Una soluzione tampone è costituita da Acido debole in presenza della propria base coniugata
SOLUZIONE TAMPONE Soluzione il cui ph non è modificato dall aggiunta di modiche quantità di acido o di base forti Una soluzione tampone è costituita da Acido debole in presenza della propria base coniugata
Emogasanalisi in t.i.
 Emogasanalisi in t.i. 9 volte su 10 6 volte su 10 100 e più alterati rispetto ai v.n. interpretazioni inesatte diagrammi, nomogrammi, equazioni e sistemi di valutazione 100 anni dall equazione di Handerson
Emogasanalisi in t.i. 9 volte su 10 6 volte su 10 100 e più alterati rispetto ai v.n. interpretazioni inesatte diagrammi, nomogrammi, equazioni e sistemi di valutazione 100 anni dall equazione di Handerson
Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia
 Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia Obiettivi Produzione e bilancio degli idrogenioni Regolazione respiratoria e renale del ph Riassorbimento del bicarbonato e secrezione
Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia Obiettivi Produzione e bilancio degli idrogenioni Regolazione respiratoria e renale del ph Riassorbimento del bicarbonato e secrezione
LA RISPOSTA POLMONARE
 IL CONTROLLO INTEGRATO DELL EQUILIBRIO ACIDO-BASE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE --------------------------------------------------------------------------------------------------------------
IL CONTROLLO INTEGRATO DELL EQUILIBRIO ACIDO-BASE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE --------------------------------------------------------------------------------------------------------------
PRINCIPALI SISTEMI TAMPONE
 SISTEMI TAMPONE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE -------------------------------------------------------------------------------------------------------------- 3 2 PRINCIPALI SISTEMI TAMPONE
SISTEMI TAMPONE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE -------------------------------------------------------------------------------------------------------------- 3 2 PRINCIPALI SISTEMI TAMPONE
I tre sistemi per la regolazione del ph
 I tre sistemi per la regolazione del ph Se vuoi finalmente capire quali sono e come funzionano i sistemi per la regolazione del ph questo breve articolo fa proprio al caso tuo. In questo articolo parleremo
I tre sistemi per la regolazione del ph Se vuoi finalmente capire quali sono e come funzionano i sistemi per la regolazione del ph questo breve articolo fa proprio al caso tuo. In questo articolo parleremo
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra ). La stabilità del ph è insidiata da
 Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Equilibri acido-base, ph e sistemi tampone
 Equilibri acido-base, ph e sistemi tampone Tiziana Bellini Dipartimento di Scienze Biomediche Chirurgico Specialistiche Facoltà di Medicina Farmacia e Prevenzione Università di Ferrara Cos è un acido?
Equilibri acido-base, ph e sistemi tampone Tiziana Bellini Dipartimento di Scienze Biomediche Chirurgico Specialistiche Facoltà di Medicina Farmacia e Prevenzione Università di Ferrara Cos è un acido?
Alterazione della capacità tampone nell'organismo. Alterazione capacità tampone rev. 0 - data: 5 luglio
 Alterazione della capacità tampone nell'organismo Alterazione capacità tampone rev. 0 - data: 5 luglio 2008 1 Il ph fisiologico dell'organismo è compreso tra 7.38 e 7.44 Nel liquido extracellulare sono
Alterazione della capacità tampone nell'organismo Alterazione capacità tampone rev. 0 - data: 5 luglio 2008 1 Il ph fisiologico dell'organismo è compreso tra 7.38 e 7.44 Nel liquido extracellulare sono
In base all equazione di Henderson-Hasselbalch
 Alterazioni dell equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Si ha acidosi quando il rapporto HCO 3 /CO 2 diminuisce, causando una diminuzione del ph.
Alterazioni dell equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Si ha acidosi quando il rapporto HCO 3 /CO 2 diminuisce, causando una diminuzione del ph.
Sistema urinario: la funzione renale
 Sistema urinario: la funzione renale FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici, i reni ne regolano la concentrazione plasmatica
Sistema urinario: la funzione renale FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici, i reni ne regolano la concentrazione plasmatica
17/05/2010. Equilibrio idrico. Variazioni del volume ematico indicono risposte omeostatiche
 Equilibrio idrico Variazioni del volume ematico indicono risposte omeostatiche 1 Ruolo del rene nel bilancio idrico Variazioni dell osmolarità attraverso la midollare 2 Scambio per controcorrente nella
Equilibrio idrico Variazioni del volume ematico indicono risposte omeostatiche 1 Ruolo del rene nel bilancio idrico Variazioni dell osmolarità attraverso la midollare 2 Scambio per controcorrente nella
equilibrio acido base
 Alterazioni dell equilibrio equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [ ] [CO 2 ] Si ha acidosi quando, per diminuzione del rapporto /CO 2 il ph diminuisce. L acidosi
Alterazioni dell equilibrio equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [ ] [CO 2 ] Si ha acidosi quando, per diminuzione del rapporto /CO 2 il ph diminuisce. L acidosi
Equilibrio Acido-Base: interpretazione dati emogasanalitici
 Equilibrio Acido-Base: interpretazione dati emogasanalitici Dott.ssa M. Martino Corso di medicina generale Anno 2010 L EMOGASANALISI è stata definita dall OMS come l esame in assoluto con il miglior rapporto
Equilibrio Acido-Base: interpretazione dati emogasanalitici Dott.ssa M. Martino Corso di medicina generale Anno 2010 L EMOGASANALISI è stata definita dall OMS come l esame in assoluto con il miglior rapporto
SCOPI DELL EMOGASANALISI
 EMOGASANALISI SCOPI DELL EMOGASANALISI La funzione principale della respirazione è quella di assicurare ossigeno all organismo e di eliminare l eccesso di anidride carbonica. L emogasanalisi arteriosa
EMOGASANALISI SCOPI DELL EMOGASANALISI La funzione principale della respirazione è quella di assicurare ossigeno all organismo e di eliminare l eccesso di anidride carbonica. L emogasanalisi arteriosa
1. Controllo dell equilibrio acido-base. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 1. Controllo dell equilibrio acido-base Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Misura dell acidità di una soluzione Definizione di acido: qualsiasi sostanza chimica che
1. Controllo dell equilibrio acido-base Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Misura dell acidità di una soluzione Definizione di acido: qualsiasi sostanza chimica che
LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE
 LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE 1 ALDOSTERONE Ormone steroideo rilasciato dalla corticale surrenale l aldosterone stimola: riassorbimento di Na +
LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE 1 ALDOSTERONE Ormone steroideo rilasciato dalla corticale surrenale l aldosterone stimola: riassorbimento di Na +
Controllo nervoso del respiro
 Controllo nervoso del respiro La respirazione è una funzione involontaria controllata da 3 gruppi di neuroni (centri) localizzati nel tronco encefalico: Controllo nervoso del respiro Centro respiratorio
Controllo nervoso del respiro La respirazione è una funzione involontaria controllata da 3 gruppi di neuroni (centri) localizzati nel tronco encefalico: Controllo nervoso del respiro Centro respiratorio
EQUILIBRIO ACIDO - BASE
 EQUILIBRIO ACIDO - BASE da appunti del dott. Claudio Italiano, internista ospedaliero Che significa? Vuol dire che l organismo ha un suo equilibrio, detto omeòstasi, cioè il sangue deve necessariamente
EQUILIBRIO ACIDO - BASE da appunti del dott. Claudio Italiano, internista ospedaliero Che significa? Vuol dire che l organismo ha un suo equilibrio, detto omeòstasi, cioè il sangue deve necessariamente
DISORDINI DELL EQUILIBRIO ACIDO - BASE
 DISORDINI DELL EQUILIBRIO ACIDO - BASE Equilibrio acido-base e potassio Nel tubulo distale e dotto collettore il riassorbimento del bicarbonato è legato a quello del potassio Il riassorbimento del bicarbonato
DISORDINI DELL EQUILIBRIO ACIDO - BASE Equilibrio acido-base e potassio Nel tubulo distale e dotto collettore il riassorbimento del bicarbonato è legato a quello del potassio Il riassorbimento del bicarbonato
L emogas analisi (EGA) Arterial Blood Gases (ABG) analysis. Marianna Maranghi
 L emogas analisi (EGA) Arterial Blood Gases (ABG) analysis Marianna Maranghi Leggere l EGA in 6 punti 1. Il ph è normale? 2. La CO2 è normale? 3. L HCO3 è normale? 4. Accoppia la CO2 o l HCO3 con il ph
L emogas analisi (EGA) Arterial Blood Gases (ABG) analysis Marianna Maranghi Leggere l EGA in 6 punti 1. Il ph è normale? 2. La CO2 è normale? 3. L HCO3 è normale? 4. Accoppia la CO2 o l HCO3 con il ph
ALTERAZIONI IDROELETTROLITICHE. ACIDO-BASE (2 parte) scaricato da EQUILIBRIO ACIDO-BASE (EAB) NECESSITA : EQUILIBRIO ACIDO-BASE
 (EAB) ALTERAZIONI IDROELETTROLITICHE ED ACIDOBASE (2 parte) NECESSITA : Mantenere costante il ph dei liquidi dell organismo su valori di 7,407,41 a fronte della produzione continua di acidi fissi ( 1mEq/kg
(EAB) ALTERAZIONI IDROELETTROLITICHE ED ACIDOBASE (2 parte) NECESSITA : Mantenere costante il ph dei liquidi dell organismo su valori di 7,407,41 a fronte della produzione continua di acidi fissi ( 1mEq/kg
Raffaele Alvisi 14 gennaio 1916
 Raffaele Alvisi 14 gennaio 1916 Alterazioni del ph = Alterazioni dell equilibrio Acido-Base X 1 2 3 4 5 6 7 8 9 Conoscenze o Capacità Acquisite SI/NO Il clinico sospetta e dimostra l alterazione dell equilibrio
Raffaele Alvisi 14 gennaio 1916 Alterazioni del ph = Alterazioni dell equilibrio Acido-Base X 1 2 3 4 5 6 7 8 9 Conoscenze o Capacità Acquisite SI/NO Il clinico sospetta e dimostra l alterazione dell equilibrio
SOLUZIONI derivate da: Acido debole/ sale (CH 3 COOH/CH 3 COONa) Base debole/ suo sale (NH 4 OH/NH 4 Cl)
 Soluzioni Tampone Si definiscono soluzioni tampone quelle soluzioni in grado di mantenere pressoché costante il proprio ph per aggiunta di una ragionevole quantità di acido o di base forte o per moderata
Soluzioni Tampone Si definiscono soluzioni tampone quelle soluzioni in grado di mantenere pressoché costante il proprio ph per aggiunta di una ragionevole quantità di acido o di base forte o per moderata
L anatomia dell apparato urinario
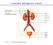 L anatomia dell apparato urinario Le funzioni del rene Secrezione (escrezione) Equilibrio idrico (controllo della pressione arteriosa) Equilibrio salino (controllo della composizione elettrolitica) Endocrina
L anatomia dell apparato urinario Le funzioni del rene Secrezione (escrezione) Equilibrio idrico (controllo della pressione arteriosa) Equilibrio salino (controllo della composizione elettrolitica) Endocrina
La eliminazione dei protoni nelle urine permette il ripristino di bicarbonato nel circolo sistemico.
 ESCREZIONE URINARIA DI ACIDI : 1-1,5 meq/l Es. produzione endogena di ac. solforico o cloridrico, formazione di sodio solfato o cloruro, eliminazione urinaria di ammonio legato ai sali. La eliminazione
ESCREZIONE URINARIA DI ACIDI : 1-1,5 meq/l Es. produzione endogena di ac. solforico o cloridrico, formazione di sodio solfato o cloruro, eliminazione urinaria di ammonio legato ai sali. La eliminazione
EQUILIBRIO ACIDO - BASE
 EQUILIBRIO ACIDO BASE Le reazioni metaboliche sono molto sensibili a cambiamenti del ph: il ph dei liquidi dell organismo è mantenuto entro un range di valori molto stretto. ph intracellulare è generalmente
EQUILIBRIO ACIDO BASE Le reazioni metaboliche sono molto sensibili a cambiamenti del ph: il ph dei liquidi dell organismo è mantenuto entro un range di valori molto stretto. ph intracellulare è generalmente
L EMOGASANALISI. P. Scavalli, M. Vitto, S. Mosillo
 L EMOGASANALISI P. Scavalli, M. Vitto, S. Mosillo EMOGASANALISI Consente la misurazione immediata dei due gas più importanti del sangue e di un terzo parametro fondamentale per la valutazione dell omeostasi
L EMOGASANALISI P. Scavalli, M. Vitto, S. Mosillo EMOGASANALISI Consente la misurazione immediata dei due gas più importanti del sangue e di un terzo parametro fondamentale per la valutazione dell omeostasi
EMOGASANALISI ARTERIOSA INTERPRETAZIONE
 EMOGASANALISI ARTERIOSA INTERPRETAZIONE A cosa serve? Esame rapido Valutare la ventilazione Valutare il metabolismo Valutare parametri quali: Emoglobina Glicemia Elettroliti Interpretazione emogasanalisi
EMOGASANALISI ARTERIOSA INTERPRETAZIONE A cosa serve? Esame rapido Valutare la ventilazione Valutare il metabolismo Valutare parametri quali: Emoglobina Glicemia Elettroliti Interpretazione emogasanalisi
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da
 Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
 Trigliceridi Colesterolo Esteri del Colesterolo Fosfolipidi Trasporti attraverso le membrane Diffusione facilitata: Scambio dei cloruri o Scambio Cl - /HCO - 3 Cl - HCO3
Trigliceridi Colesterolo Esteri del Colesterolo Fosfolipidi Trasporti attraverso le membrane Diffusione facilitata: Scambio dei cloruri o Scambio Cl - /HCO - 3 Cl - HCO3
[H + ] X [A - ] [ HA ]
![[H + ] X [A - ] [ HA ] [H + ] X [A - ] [ HA ]](/thumbs/81/84332766.jpg) Equazione di Handerson-HasselbalchHasselbalch [H + ] X [A - ] [ HA ] = K [H + ]X[HCO3 - ] [H2C03] = K 1 Composizione aria O 2 = 20.93% CO 2 = 0.03% N 2 + gas nobili = 79.04% Pressione esercitata dai gas
Equazione di Handerson-HasselbalchHasselbalch [H + ] X [A - ] [ HA ] = K [H + ]X[HCO3 - ] [H2C03] = K 1 Composizione aria O 2 = 20.93% CO 2 = 0.03% N 2 + gas nobili = 79.04% Pressione esercitata dai gas
Sistema urinario: la funzione renale
 Sistema urinario: la funzione renale La principale funzione dei reni è il bilancio idrosalino FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici,
Sistema urinario: la funzione renale La principale funzione dei reni è il bilancio idrosalino FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici,
Funzioni. Regola composizione ionica plasmatica Volume plasmatico Osmolarità ph Rimuove I prodotti di scarto
 La Funzione Renale Funzioni Regola composizione ionica plasmatica Volume plasmatico Osmolarità ph Rimuove I prodotti di scarto Il Nefrone Distinguiamo un tubulo renale (trasporto) ed un corpuscolo renale
La Funzione Renale Funzioni Regola composizione ionica plasmatica Volume plasmatico Osmolarità ph Rimuove I prodotti di scarto Il Nefrone Distinguiamo un tubulo renale (trasporto) ed un corpuscolo renale
Interpretazione dell emogasanalisi
 Interpretazione dell emogasanalisi Guglielmo IMBRIACO Gaetano TAMMARO Rianimazione Terapia Intensiva Ospedale MAGGIORE - Bologna A cosa serve l emogasanalisi? Esame rapido Valutare la ventilazione Valutare
Interpretazione dell emogasanalisi Guglielmo IMBRIACO Gaetano TAMMARO Rianimazione Terapia Intensiva Ospedale MAGGIORE - Bologna A cosa serve l emogasanalisi? Esame rapido Valutare la ventilazione Valutare
Fisiologia Renale 4. Equilibrio acido-base: Fisiologia e fisiopatologia
 Fisiologia Renale 4. Equilibrio acido-base: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Tamponi fisiologici
Fisiologia Renale 4. Equilibrio acido-base: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Tamponi fisiologici
EQUILIBRI IN SOLUZIONE ACQUOSA
 EQUILIBRI IN SOLUZIONE ACQUOSA Costante di equilibrio Si consideri la seguente reazione di equilibrio: aa + bb cc + dd La costante di equilibrio della reazione ad una data temperatura è definita come il
EQUILIBRI IN SOLUZIONE ACQUOSA Costante di equilibrio Si consideri la seguente reazione di equilibrio: aa + bb cc + dd La costante di equilibrio della reazione ad una data temperatura è definita come il
Emogasanalisi arteriosa: Valutaz. dell ossiemia Trasporto della PaCO2 Disturbi dell EAB. ph potere tampone compenso renale
 Emogasanalisi arteriosa: Valutaz. dell ossiemia Trasporto della PaCO2 Disturbi dell EAB ph potere tampone compenso renale EMOGASANALISI ARTERIOSA Misura l efficienza della funzione respiratoria e della
Emogasanalisi arteriosa: Valutaz. dell ossiemia Trasporto della PaCO2 Disturbi dell EAB ph potere tampone compenso renale EMOGASANALISI ARTERIOSA Misura l efficienza della funzione respiratoria e della
Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali:
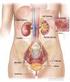 Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali: 1) Secerne Idrogenioni; 1a) Riassorbe il Bicarbonato Filtrato; 1b) Produce Nuovo Bicarbonato. 4320 meq/die
Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali: 1) Secerne Idrogenioni; 1a) Riassorbe il Bicarbonato Filtrato; 1b) Produce Nuovo Bicarbonato. 4320 meq/die
Biochimica clinica. Corso di Laurea Triennale in Biotecnologie per la salute
 Corso di Laurea Triennale in Biotecnologie per la salute Biochimica clinica Argomenti della lezione:» Aspetti generali dell'equilibrio acidobase» Regolazione renale e polmonare» Emogasanalisi Gli elettroliti
Corso di Laurea Triennale in Biotecnologie per la salute Biochimica clinica Argomenti della lezione:» Aspetti generali dell'equilibrio acidobase» Regolazione renale e polmonare» Emogasanalisi Gli elettroliti
Milano, 9 giugno acido-base? Ernesto Cristiano Lauritano
 ACQUA E SALE Milano, 9 giugno 2012 Quale approccio ai disordini acido-base? Ernesto Cristiano Lauritano Dipartimento di Emergenza e Accettazione Azienda Ospedaliera Nazionale SS. Antonio e Biagio e Cesare
ACQUA E SALE Milano, 9 giugno 2012 Quale approccio ai disordini acido-base? Ernesto Cristiano Lauritano Dipartimento di Emergenza e Accettazione Azienda Ospedaliera Nazionale SS. Antonio e Biagio e Cesare
Soluzioni tampone. Francesca Montemurro
 Soluzioni tampone Francesca Montemurro DEFINIZIONE ACIDO BASE ü ARRENIUS: acido libera H + e la base OH -, era una definizione che andava bene per reazioni in soluzione acquosa ma non in ambiente gassoso.
Soluzioni tampone Francesca Montemurro DEFINIZIONE ACIDO BASE ü ARRENIUS: acido libera H + e la base OH -, era una definizione che andava bene per reazioni in soluzione acquosa ma non in ambiente gassoso.
APPARATO RESPIRATORIO
 Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia Medica A.A. 2017-18 APPARATO RESPIRATORIO Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unicampania.it
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia Medica A.A. 2017-18 APPARATO RESPIRATORIO Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unicampania.it
Teorie Acido-Base. Gli acidi in acqua si dissociano e rilasciano H + Le basi in acqua si dissociano e rilasciano OH -
 Teorie Acido-Base Arrhenius: Gli acidi in acqua si dissociano e rilasciano H + Le basi in acqua si dissociano e rilasciano OH - Broensted-Lowry: Gli acidi rilasciano H + Le basi accettano H + Lewis gli
Teorie Acido-Base Arrhenius: Gli acidi in acqua si dissociano e rilasciano H + Le basi in acqua si dissociano e rilasciano OH - Broensted-Lowry: Gli acidi rilasciano H + Le basi accettano H + Lewis gli
IL RUOLO DELL EMOGASANALISI NELL INSUFFIENZA RESPIRATORIA
 I CONGRESSO REGIONALE SIMEU BASILICATA 13 E 14 GIUGNO 2014 IL RUOLO DELL EMOGASANALISI NELL INSUFFIENZA RESPIRATORIA DOTT.SSA GIOVANNA ESPOSITO PS e MU DEA NOCERAPAGANI SEGRETARIO NAZIONALE FIMEUC PRESISDENTE
I CONGRESSO REGIONALE SIMEU BASILICATA 13 E 14 GIUGNO 2014 IL RUOLO DELL EMOGASANALISI NELL INSUFFIENZA RESPIRATORIA DOTT.SSA GIOVANNA ESPOSITO PS e MU DEA NOCERAPAGANI SEGRETARIO NAZIONALE FIMEUC PRESISDENTE
SOLUZIONI TAMPONE SOLUZIONI TAMPONE
 SOLUZIONI TAMPONE Le soluzioni tampone (o tamponi) sono costituite da: un acido debole e un suo sale (tampone acido) oppure una base debole e un suo sale (tampone basico) Una soluzione di un acido debole
SOLUZIONI TAMPONE Le soluzioni tampone (o tamponi) sono costituite da: un acido debole e un suo sale (tampone acido) oppure una base debole e un suo sale (tampone basico) Una soluzione di un acido debole
EQUILIBRI DEI SISTEMI TAMPONE ACIDO-BASE
 EQUILIBRI DEI SISTEMI TAMPONE ACIDO-BASE E importante per poter controllare l andamento di una reazione mantenere costante il ph di una soluzione. Ad esempio il ph del plasma può variare, senza influenzare
EQUILIBRI DEI SISTEMI TAMPONE ACIDO-BASE E importante per poter controllare l andamento di una reazione mantenere costante il ph di una soluzione. Ad esempio il ph del plasma può variare, senza influenzare
PSEUDOIPERKALEMIA o IPERPOTASSIEMIA SPURIA. Il paziente non ha problemi cardiaci ma iperpotassiemia
 PSEUDOIPERKALEMIA o IPERPOTASSIEMIA SPURIA Il paziente non ha problemi cardiaci ma iperpotassiemia Cause: Prolungato utilizzo del laccio emostatico Rottura delle cellule, durante il prelievo di sangue
PSEUDOIPERKALEMIA o IPERPOTASSIEMIA SPURIA Il paziente non ha problemi cardiaci ma iperpotassiemia Cause: Prolungato utilizzo del laccio emostatico Rottura delle cellule, durante il prelievo di sangue
Trasporto di O 2 nel sangue
 Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
LA MOLE. Si definisce MOLE una quantita di sostanza di un sistema che contiene tante entita elementari quanti sono gli atomi (NA) in 12g di C 12
 LA MOLE Si definisce MOLE una quantita di sostanza di un sistema che contiene tante entita elementari quanti sono gli atomi (NA) in 12g di C 12 NA = 6,022 x 10 23 particelle /mol numero di Avogadro 1 mole
LA MOLE Si definisce MOLE una quantita di sostanza di un sistema che contiene tante entita elementari quanti sono gli atomi (NA) in 12g di C 12 NA = 6,022 x 10 23 particelle /mol numero di Avogadro 1 mole
Proprietà delle Soluzioni
 Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
AUTOIONIZZAZIONE DELL ACQUA
 AUTOIONIZZAZIONE DELL ACQUA H 2 O si comporta da acido e da base anfiprotica CH 3 COOH + H 2 O CH 3 COO - + H 3 O + NH 3 +H 2 O NH 4 + + OH - A1 B2 H 2 O + H 2 O H 3 O + + OH - B1 A1 K eq [ H O ][ OH 3
AUTOIONIZZAZIONE DELL ACQUA H 2 O si comporta da acido e da base anfiprotica CH 3 COOH + H 2 O CH 3 COO - + H 3 O + NH 3 +H 2 O NH 4 + + OH - A1 B2 H 2 O + H 2 O H 3 O + + OH - B1 A1 K eq [ H O ][ OH 3
INTRODUZIONE ALLA BIOCHIMICA
 INTRODUZIONE ALLA BIOCHIMICA Sistema vivente sistema complesso ed altamente organizzato dotato di una composizione chimica determinata e unica grazie a tale composizione chimica al suo interno si formano
INTRODUZIONE ALLA BIOCHIMICA Sistema vivente sistema complesso ed altamente organizzato dotato di una composizione chimica determinata e unica grazie a tale composizione chimica al suo interno si formano
DEBOLE MEDIA FORTE FARMACI DIURETICI AD INTENSITÀ D AZIONE
 FARMACI DIURETICI AD INTENSITÀ D AZIONE a) osmotici mannitolo (Isotol), glicerina b) inibitori dell anidrasi carbonica acetazolamide (Diamox) c) risparmiatori di spironolattone (Aldactone, Spirolang),
FARMACI DIURETICI AD INTENSITÀ D AZIONE a) osmotici mannitolo (Isotol), glicerina b) inibitori dell anidrasi carbonica acetazolamide (Diamox) c) risparmiatori di spironolattone (Aldactone, Spirolang),
Esperienza 4: Preparazione di soluzioni tampone e verifica del potere tamponante
 Esperienza 4: Preparazione di soluzioni tampone e verifica del potere tamponante Soluzione tampone: soluzione il cui ph non varia in modo apprezzabile per piccole aggiunte di acidi o di basi. Inoltre,
Esperienza 4: Preparazione di soluzioni tampone e verifica del potere tamponante Soluzione tampone: soluzione il cui ph non varia in modo apprezzabile per piccole aggiunte di acidi o di basi. Inoltre,
La spirometria. La spirometria
 La spirometria La spirometria studia a fondo la funzione polmonare. Con questo semplice esame infatti è possibile determinare numerosi parametri che guidano il medico nella diagnosi delle malattie polmonari.
La spirometria La spirometria studia a fondo la funzione polmonare. Con questo semplice esame infatti è possibile determinare numerosi parametri che guidano il medico nella diagnosi delle malattie polmonari.
Un mare di Risorse 3 edizione
 Liceo Scientifico «G. Marconi» - Foggia Un mare di Risorse 3 edizione Analisi delle acque Prof.ssa Flora Marino Nitrati Lo ione nitrato è un importante anione poliatomico. Ha formula NO 3. Lo ione NO 3
Liceo Scientifico «G. Marconi» - Foggia Un mare di Risorse 3 edizione Analisi delle acque Prof.ssa Flora Marino Nitrati Lo ione nitrato è un importante anione poliatomico. Ha formula NO 3. Lo ione NO 3
In acqua pura o in soluzione acquosa, si ha sempre il seguente equilibrio: + +
 Ionizzazione dell Acqua e ph In acqua pura o in soluzione acquosa, si ha sempre il seguente equilibrio: + + L acqua è una sostanza anfiprotica, cioè può sia donare che accettare protoni (ioni H + ). Costante
Ionizzazione dell Acqua e ph In acqua pura o in soluzione acquosa, si ha sempre il seguente equilibrio: + + L acqua è una sostanza anfiprotica, cioè può sia donare che accettare protoni (ioni H + ). Costante
Le soluzioni tampone
 Le soluzioni tampone Se in una soluzione acquosa sono presenti un acido debole e la sua base coniugata (CH 3 COOH e CH 3 COO - ;H 2 CO 3 e HCO 3 -, etc.) si ha una soluzione tampone (o come detto in alcuni
Le soluzioni tampone Se in una soluzione acquosa sono presenti un acido debole e la sua base coniugata (CH 3 COOH e CH 3 COO - ;H 2 CO 3 e HCO 3 -, etc.) si ha una soluzione tampone (o come detto in alcuni
Equilibrio dei liquidi, degli elettroliti e acido-base
 25 Equilibrio dei liquidi, degli elettroliti e acido-base OBIETTIVI DI APPRENDIMENTO Questi obiettivi di apprendimento corrispondono ai numeri dei moduli di questo capitolo e indicano ciò che si dovrebbe
25 Equilibrio dei liquidi, degli elettroliti e acido-base OBIETTIVI DI APPRENDIMENTO Questi obiettivi di apprendimento corrispondono ai numeri dei moduli di questo capitolo e indicano ciò che si dovrebbe
Equilibri ionici in soluzione acquosa. Acidi, basi, scala del ph
 Equilibri ionici in soluzione acquosa Acidi, basi, scala del ph 1 L equilibrio chimico LA LEGGE DELL EQUILIBRIO CHIMICO (legge dell azione di massa) Ad equilibrio raggiunto il rapporto tra il prodotto
Equilibri ionici in soluzione acquosa Acidi, basi, scala del ph 1 L equilibrio chimico LA LEGGE DELL EQUILIBRIO CHIMICO (legge dell azione di massa) Ad equilibrio raggiunto il rapporto tra il prodotto
Il processo di ultrafiltrazione è interamente passivo e dipende sostanzialmente da tre fattori:
 Il processo di ultrafiltrazione è interamente passivo e dipende sostanzialmente da tre fattori: 1) Dalla differenza netta di pressione tra il lume del capillare ed il lume della capsula di Bowman; 2) dalla
Il processo di ultrafiltrazione è interamente passivo e dipende sostanzialmente da tre fattori: 1) Dalla differenza netta di pressione tra il lume del capillare ed il lume della capsula di Bowman; 2) dalla
ph = log 1/[H+] = - log [H+]
![ph = log 1/[H+] = - log [H+] ph = log 1/[H+] = - log [H+]](/thumbs/34/16948015.jpg) ph = log 1/[H+] = log [H+] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = inizio 7,36 max 6.8) ph superiori = alcalosi (limite ph inizio 7,44 max 7.8) ph intracellulare
ph = log 1/[H+] = log [H+] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = inizio 7,36 max 6.8) ph superiori = alcalosi (limite ph inizio 7,44 max 7.8) ph intracellulare
Riassorbimento tubulare
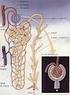 Riassorbimento tubulare Riassorbimento Secrezione Qtr = Qf- Qe Qts = Qe Qf Qtr = VFG*P UV Qts = UV VFG*P Le urine si formano mediante tre processi: Filtrazione glomerulare Riassorbimento di acqua e soluti
Riassorbimento tubulare Riassorbimento Secrezione Qtr = Qf- Qe Qts = Qe Qf Qtr = VFG*P UV Qts = UV VFG*P Le urine si formano mediante tre processi: Filtrazione glomerulare Riassorbimento di acqua e soluti
Gli scambi gassosi LA MISURA DELLA FUNZIONE RESPIRATORIA. OLTRE LA SPIROMETRIA Torino, 5 ottobre 2013
 LA MISURA DELLA FUNZIONE RESPIRATORIA OLTRE LA SPIROMETRIA Torino, 5 ottobre 2013 Gli scambi gassosi Claudio Norbiato AO Ordine Mauriziano SC Medicina Interna Emogasanalisi L emogasanalisi e l analisi
LA MISURA DELLA FUNZIONE RESPIRATORIA OLTRE LA SPIROMETRIA Torino, 5 ottobre 2013 Gli scambi gassosi Claudio Norbiato AO Ordine Mauriziano SC Medicina Interna Emogasanalisi L emogasanalisi e l analisi
www.slidetube.it Il nefrone è costituito dal corpuscolo renale e dal tubulo
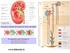 Il nefrone è costituito dal corpuscolo renale e dal tubulo Il corpuscolo renale è formato da : a) il glomerulo arterioso b) la capsula di Bowman www.slidetube.it Zona corticale Zona midollare Dall arteria
Il nefrone è costituito dal corpuscolo renale e dal tubulo Il corpuscolo renale è formato da : a) il glomerulo arterioso b) la capsula di Bowman www.slidetube.it Zona corticale Zona midollare Dall arteria
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE
 FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
Indice INTRODUZIONE
 EQUILIBRIO ACIDO-BASE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE -------------------------------------------------------------------------------------------------------------- 3 2 OMEOSTASI DEL PH --------------------------------------------------------------------------------------------------------
EQUILIBRIO ACIDO-BASE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE -------------------------------------------------------------------------------------------------------------- 3 2 OMEOSTASI DEL PH --------------------------------------------------------------------------------------------------------
INTERPRETAZIONE DELL EMOGASANALISI ACQUA ELETTROLITI ED EQUILIBRIO ACIDI-BASE
 INTERPRETAZIONE DELL EMOGASANALISI ACQUA ELETTROLITI ED EQUILIBRIO ACIDI-BASE Il prelievo arterioso può essere eseguito a livello di arteria femorale e arteria radiale (più doloroso) Il prelievo venoso
INTERPRETAZIONE DELL EMOGASANALISI ACQUA ELETTROLITI ED EQUILIBRIO ACIDI-BASE Il prelievo arterioso può essere eseguito a livello di arteria femorale e arteria radiale (più doloroso) Il prelievo venoso
Ionizzazione spontanea dell acqua: autoprotolisi o autoionizzazione dell acqua. [ H ] 2
![Ionizzazione spontanea dell acqua: autoprotolisi o autoionizzazione dell acqua. [ H ] 2 Ionizzazione spontanea dell acqua: autoprotolisi o autoionizzazione dell acqua. [ H ] 2](/thumbs/57/40353351.jpg) Equilibri ionici in soluzione acquosa L acqua, anche se purissima, rivela una conducibilità elettrica piccola ma misurabile che indica la presenza di ioni. Una ridotta frazione di molecole di acqua è dissociata
Equilibri ionici in soluzione acquosa L acqua, anche se purissima, rivela una conducibilità elettrica piccola ma misurabile che indica la presenza di ioni. Una ridotta frazione di molecole di acqua è dissociata
Gli equilibri omeodinamici: dalla fisiopatologia alla clinica pratica
 CONVEGNO SIMI Gli equilibri omeodinamici: dalla fisiopatologia alla clinica pratica Dr. Francesco Sgambato U. O. Complessa di Medicina Interna Ospedale Fatebenefratelli - Benevento sgambatof@gmail.com
CONVEGNO SIMI Gli equilibri omeodinamici: dalla fisiopatologia alla clinica pratica Dr. Francesco Sgambato U. O. Complessa di Medicina Interna Ospedale Fatebenefratelli - Benevento sgambatof@gmail.com
Anatomia funzionale del rene
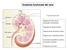 Anatomia funzionale del rene Funzione dei reni: Regolazione del volume del liquido extracellulare Regolazione dell osmolarità Mantenimento del bilancio idrico Regolazione omeostatica del ph Escrezione
Anatomia funzionale del rene Funzione dei reni: Regolazione del volume del liquido extracellulare Regolazione dell osmolarità Mantenimento del bilancio idrico Regolazione omeostatica del ph Escrezione
Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE
 Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE Molti sali reagiscono con l acqua alterando il suo rapporto molare tra [H] e [OH] -
Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE Molti sali reagiscono con l acqua alterando il suo rapporto molare tra [H] e [OH] -
Sodio. L introduzione giornaliera con la dieta di sodio (200 meq/l) è maggiore del nostro fabbisogno (20 meq/l): è necessaria l escrezione urinaria
 Sodio L introduzione giornaliera con la dieta di sodio (200 meq/l) è maggiore del nostro fabbisogno (20 meq/l): è necessaria l escrezione urinaria E elemento principale per il controllo dell osmolalità
Sodio L introduzione giornaliera con la dieta di sodio (200 meq/l) è maggiore del nostro fabbisogno (20 meq/l): è necessaria l escrezione urinaria E elemento principale per il controllo dell osmolalità
