Il Livello Chimico di Organizzazione
|
|
|
- Leopoldo Visconti
- 6 anni fa
- Visualizzazioni
Transcript
1 Scuola di Ingegneria Industriale e dell Informazione Course (095857) Introduction to Green and Sustainable Chemistry A.A. 2015/2016 Il Livello Chimico di Organizzazione A. Citterio Dept. CMIC
2 Riassunto Atomi e Molecole Struttura dell atomo Elettroni Legami Notazione Chimica Reazioni Chimiche Concetti base sull energia Tipi di reazioni Acidi e basi ph Composti Inorganici Biossido di Carbonio e ossigeno Acqua Acidi e basi Sali Composti Organici ATP Carboidrati Lipidi Proteine Acidi Nucleici
3 Materia, Elementi e Atomi Materia: qualunque cosa che occupa spazio e possiede massa 3 stati di aggregazione Solido Liquido Gas Tutta la materia è composta da elementi Non si possono rompere (a bassa T) Il componente minimo di un elemento è l atomo Ogni elemento ha un unico simbolo chimico L Atomo è costituito da 3 particelle subatomiche Protoni Neutroni Elettroni
4 Struttura dell Atomo Protoni e neutroni si trovano nel nucleo (d = m) Gli elettroni occupano una nuvola elettronica (strato) esterno (d = m) Queste particelle caratterizzano le dimensioni dell atomo (Å) e la reattività chimica (cinetica e termodinamica). (a) Nuvola elettronica o Modello «space filling» (b) Modello a strato elettronico
5 Struttura dell Atomo ed Elementi Numero Atomico = Z = # di protoni ed anche # di elettroni in un atomo neutro. Massa (Peso) Atomica = A = # p + # n Gli atomi che differiscono per A ma hanno lo stesso Z sono chiamati isotopi ( ) C, C, C Gli Elementi rappresentano la distribuzione naturale degli isotopi. A Z
6 Elettroni e Strati Elettronici Solo gli elettroni dello strato più esterno possono interagire (formando legami)! Se lo strato esterno è pieno, l elemento è stabile a bassa T (He) Se lo strato esterno non è pieno, l elemento è instabile e si lega Il primo strato ospita 2 elettroni Il secondo strato ne ospita 6 2 nd shell can hold 8 electrons
7 Molecole e Composti Gli Atomi si stabilizzano mediante: Condivisione di elettroni Acquisto di elettroni Perdita di elettroni Ciò corrisponde ad una reazione chimica Molecole e composti ne sono il risultato Le Molecole sono strutture chimiche contenenti 2 o più atomi Per Es.: O 2, O 3, S 8 I Composti contengono 2 o più atomi di diversi elementi Per es.: H 2 O, CH 3 COOH, H 2 NCH 2 COOH
8 Importanti Concetti di Legame Tutti gli atomi tendono a raggiungere uno stato stabile! Stabilità significa raggiungere la configurazione a 8 elettroni nello strato esterno per gli atomi dei primi periodi e 18 per i successivi A meno che non riempiano il primo strato (2 elettroni) Gli Opposti si attraggono! Gli atomi sono elettricamente neutri! 3 tipi di legami Ionico Covalente Polare Apolare Metallico Interazioni Legami a idrogeno e altri
9 Legami Ionici Gli ioni sono atomi con una carica positiva o negativa Anioni Ioni con carica negativa L atomo guadagna un elettrone (accettore di elettroni) Più elettroni che protoni Cationi Ioni con carica positiva L atomo perde un elettrone (datore di elettroni) più protoni che elettroni I legami ionici sono legami polimerici tra molti anioni e molti cationi Per es.: NaCl, KCl
10 Legami Covalenti Formano un legame scambiando elettroni Legame covalente Singolo Legame covalente Doppio (triplo) Scambiano una copia di elettroni Scambiano due (o tre) coppie di elettroni Nitrogen (N 2 ) N N
11 Legami Covalenti Legami covalenti apolari Gli elettroni sono ugualmente condivisi Atomi di carbonio Creano stabilità di grandi composti nel corpo Tipicamente simmetrico Legami covalenti polari Scambio diseguale di elettroni L acqua è un grande esempio Tipicamente contengono atomi elettronegativi, quali O, N, F
12 Interazioni: Legami ad Idrogeno Semplice interazione non un vero legame chimico. Più debole (5-15 kcal) Attrazione tra atomi di idrogeno di una molecola e atomi parzialmente carichi negativi di altre molecole (è essenzialmente elettrostatico) Non genera molecole Altera la forma di molecole L acqua è l esempio tipico Spiega l elevata tensione superficiale di H 2 O
13 Regole di Notazione Chimica L abbreviazione dell elemento rappresenta 1 atomo Il numero (#) prima dell abbreviazione dell elemento indica più di 1 atomo Una freccia suddivide a sinistra i Reagenti e a destra i Prodotti (reagenti e prodotti hanno formule chimiche diverse att. Isomeri!) Gli apici indicano uno ione + = perdita di 1 elettrone - = guadagno di 1 elettrone ecc. Le reazioni chimiche devono essere bilanciate : La massa non cambia in una reazione chimica gli atomi in materie prime e in scarti sono gli stessi e sono quindi perfettamente riusabili!
14 Reazioni Chimiche Si hanno quando i legami tra atomi si spezzano e gli atomi si traspongono in nuove combinazioni Hanno un ruolo importante Consentono di ottenere prodotti non stabili inesistenti in natura Forniscono energia (combustione, glicolisi) Il metabolismo è l insieme delle reazioni chimiche che avvengono in un orgasmo vivente. Una reazione particolarmente importante è C 6 H 12 O 6 6CO 2 + 6H 2 O + ATP 3 tipi generali di reazioni importanti in biochimica: Reazioni di decomposizione Reazioni di sintesi Reazioni di scambio
15 Concetti di Base sull Energia Lavoro: movimento o variazione nella struttura isica della materia Energia: capacità di compiere lavoro Energia cinetica Energia associata al movimento (rilasciata) E = ½(mv 2 ) Energia potenziale Energia accumulata (in un campo di forze, in legami, ecc.) Altre forme (gravitazionale, elettromagnetica, nucleare, calore) Si trasforma facilmente da una forma all altra Una forma importante di rilascio di energia è il calore.
16 Reazioni di Decomposizione (C 6 H 10 O 5 ) n + n H 2 O n C 6 H 12 O 6 Catabolismo L energia è rilasciata nella reazione di depolimerizzazione idrolitica. glicogeno Molecole di glucosio Esempio di reazione di decomposizione: rottura idrolitica del glicogeno con rilascio di unità di glucosio
17 Reazioni di Sintesi A + B AB + H 2 O Anabolismo Dell energia è immagazzinata nei legami della macromolecola. Amminoacidi Molecola di proteina Esempio di reazione di sintesi: degli amminoacidi sono legati in sequenza per formare una molecola di proteina
18 Reazioni di Scambio AB + CD AD + CB Reazioni di decomposizioni e sintesi. Scambio di di atomi o gruppi. Reazione esotermica ( H < 0) Se i legami nei prodotti hanno E leg superiore a quella dei reagenti L energia è rilasciata sotto forma di calore Reazioni endotermiche ( H > 0) Se i legami nei prodotti hanno E leg inferiore a quella dei reagenti Si deve fornire e assorbire energia (calore) dal sistema Reazioni Spontanee : ( G < 0) : la reazione avviene spontaneamente da reagenti a prodotti (non si sa in quanto tempo!!); la reazione inversa avviene solo se si fornisce energia.
19 Acidi e Basi (secondo Brönsted) Acido: una sostanza che dissocia rilasciando ioni H + Acidi forti dissociano completamente Acidi deboli dissociano solo parzialmente Base: una sostanza che sottrae ioni idrogeno dalla soluzione o dissocia a dare ioni ossidrile (OH ) Basi forti dissociano completamente Basi deboli dissociano solo parzialmente
20 ph Misura la concentrazione di [H + ] in un mezzo acquoso (ph = -log[h + ]) Se elevati, alterano strutture e funzioni in sistemi biologici Il ph varia tra 0-14; il mezzo è neutro se ph = 7 (acqua distillata) ph sotto 7 = acido; ph sopra 7 = basico Le cellule in sistemi biologici devono mantenere il ph in uno specifico intervallo attorno a 7 (per es. Il sangue è tamponato tra ) Tamponi: Combinazione di un acido e la sua base coniugata che stabilizzano il ph rimuovendo o fornendo ioni idrogeno. Per esempio, Acido Acetico (CH 3 COOH) e ione acetato (CH 3 COO ).
21 Biochimica Nutrienti: elementi e molecole essenziali Metaboliti: tutte le molecole sintetizzate o degradate nelle reazioni chimiche in un organismo vivente Si classificano in base al tipo di atomo e complessità dell aggregato: Composti Inorganici (tutte le combinazioni di elementi senza C); Composti di coordinazione (combinazioni di atomi organizzate attorno ad atomi centrali metallici); Composti Organici (tutte le combinazioni di scheletri di atomi C contenenti anche elementi importanti (H, O, N, P, S, Cl); Composti organometallici (tutte le combinazioni di scheletri di atomi C contenenti anche elementi metallici).
22 Composti Inorganici Biossido di Carbonio (CO 2 ) Ossigeno (O 2 ) Acqua (H 2 O) e acqua ossigenata (H 2 O 2 ) Acidi inorganici (HCl, HNO 3, H 2 SO 4, H 3 PO 4 ) e basi (NaOH, NH 3, NH 2 NH 2 Sali (NaCl, Na 2 CO 3, NaH 2 PO 4, ecc.)
23 Biossido di Carbonio e Ossigeno Biossido di Carbonio Prodotto dalle cellule tramite attività metabolica (fermentazione al.) C 6 H 12 O 6 2 CH 3 CH 2 OH + 2H 2 O + ATP (*) Si sposta nel sangue fino ai polmoni, dove viene rilasciato. Reagisce con acqua a dare acido carbonico e suoi ioni (il processo è lento! Catalisi dell enzima anidrasi carbonica) CO 2 + H 2 O a H 2 CO 3 a H + + HCO 3 a H + + CO 32 Ossigeno Prodotto dalle piante tramite la fotosintesi 6CO 2 + 6H 2 O + luce (E) C 6 H 12 O 6 Usato per processi di combustione e nella respirazione: (*) C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O + ATP
24 Acqua (H 2 O) e sue Proprietà Costituisce il 60-80% in volume delle cellule Tutti i sistemi biologici sono dipendenti dall acqua Proprietà importanti Eccellente solvente per composti ionici e molecole ad elevata polarità Capacità termica (calore specifico) molto elevata Reagente essenziale per molte reazioni metaboliche Soluzioni Solvente vs. soluto L acqua tramite il fenomeno della solvatazione rompe i legami ionici allontanando gli ioni di segno opposto (alta costante dielettrica)
25 Solvatazione di Ioni e Dissociazione di Composti Ionici Polo Negativo Sfere di solvatazione di molecole d acqua Polo Positivo Molecola d acqua Soluzione di cloruro di sodio (NaCl)
26 Acidi e Basi Inorganici Molti acidi inorganici si trovano nelle cellule di organismi viventi. I più importanti sono: Acido carbonico (H 2 CO 3 pk a1 = 6,35; pk a2 = 10,33)* Acido solforico (H 2 SO 4 pk a1 = strong; pk a2 = 1,92)* Acido fosforico (H 3 PO 4 pk a1 = 2.16; pk a2 = 7,21; pk a3 = 12,32)* Acido cloridrico (HCl; strong) Acido nitrico (HNO 3 pk a = strong) Acido silicico (H 4 SiO 4 e i suoi oligomeri, tutti deboli) Acido solfidrico (H 2 S pk a1 = 7,00; pk a2 = > 14)* Tra le basi rilevanti le più importanti sono: Ammoniaca (NH 3 pk b = 4,74)* Molti anioni (per es. HCO 3, H 2 PO 4, HPO 42 ) * a 20 C
27 Sali Un composto ionico formato da qualsiasi catione (eccetto H + ) e qualsiasi anione (eccetto OH - ) Per es. NaCl, CaCO 3, Ca 3 (PO 4 ) 3, CaSO 4, Mg 3 Si 4 O 10 (OH) 2 (Talco) Si dissociano in acqua (più o meno in funzione del loro K ps ) NaCl + n (H 2 O) Na + (id) + Cl (id) Nelle cellule tali composti si indicano come elettroliti Conducono la corrente elettrica in soluzione Devono essere mantenuti in intervalli di concentrazione adeguati In soluzione i cationi non sono legati agli anioni per cui l identità del sale non è evidente se non quando questi si separano per raggiunti limiti di solubilità.
28 Composti Organici Contengono H, C e altri elementi Sono caratterizzati da legami covalenti C-C e C-H forti. Carboidrati Monosaccaridi Disaccaridi Polisaccaridi Lipidi Acidi grassi Grassi Steroidi Fosfolipidi Proteine Funzione delle Proteine Struttura delle Proteine Enzimi Acidi Nucleici Struttura Funzioni ATP Metaboliti secondari
29 Principali Composti Organici in Sistemi Viventi
30 Carboidrati Rapporto 1:2:1 di atomi di carbonio, idrogeno, ossigeno Principale fonte di energia per dismutazione o ossidazione con O 2 Costituiscono solo il 3% del peso totale del corpo umano! 3 principali tipi Monosaccaridi Disaccaridi Polisaccaridi Monosaccaridi: zuccheri semplici contenenti 3-7 C. Glucosio (il combustibile più importante nel corpo), fruttosio, ecc. H HO C H H C OH C H OH C H O H H C OH C OH (a) (b) (c) O
31 Disaccaridi Formati da 2 zuccheri semplici per reazione di condensazione con eliminazione di acqua Saccarosio, lattosio, maltosio Si possono idrolizzare con acqua a formare zuccheri semplici Sintesi per disidratazione Glucosio Fruttosio Saccarosio (a) Nel corso della condensazione si legano due molecole per rimozione di una molecola d acqua. Idrolisi Saccarosio Glucosio Fruttosio (b) L idrolisi inverte il processo; la molecola complessa viene spezzata per aggiunta di una molecola d acqua.
32 Polisaccaridi Nelle piante Amido Cellulosa Pectine Polisaccaridi complessi Negli Animali glicogeno Lunghe catene di glucosio Non si scioglie in acqua Immagazzinato in fegato e muscoli Idrolizzato in glucosio quando serve come combustibile Polisaccaridi complessi Molecole di glucosio (c) Glicogeno, un polisaccaride ramificato di molecole di glucosio è immagazzinato nelle cellule dei muscoli e del fegato
33 Lipidi Contengono H, O, C, P, S, o N Grassi, oli, Cere Insolubili in acqua Costituiscono componenti strutturali essenziali delle cellule Servono come riserva energetica Forniscono il doppio di energia de carboidrati 12% del peso corporeo Si dividono in acidi grassi, grassi, steroidi, fosfolipidi e terpeni
34 Acidi Grassi Lunghe catene idrocarburiche con in fondo un gruppo COOH FA Saturi Tutti I carboni sono saturi (singoli legami covalenti C-C) FA Insaturi Contengono C saturi ma anche doppi legami tra i Carboni Meno atomi di Idrogeno Hanno un ruolo essenziale come riserva di ciba e come costituenti delle pareti cellulari. Saturo Insaturo (a) Acido laurico (C 12 H 24 O 2 ) (b)
35 Grassi Trigliceridi 1 molecola di glicerolo e 3 di acidi grassi Sono deputati allo stoccaggio dell energia Acido grasso 1 Saturo Acido grasso 2 Saturo condensazione Acido grasso 3 Insaturo Idrolisi Glicerolo
36 Steroidi Colesterolo Si trova in: Membrane cellulari Ormoni Estrogeni e testosterone Deriva da: Dieta Fegato
37 Fosfolipidi Sono fatti da digliceridi e gruppi fosfato Hanno regioni polare e nonpolari Compongono le membrane cellulari Gruppi nonlipidici Gruppo fosfato Glicerolo Acidi grassi
38 Proteine Abbondanti e diverse 100,000 differenti tipi nel corpo 20% del peso corporeo Contengono C, H, O, N, e dello S Funzione Struttura Enzimi
39 Funzioni delle Proteine Supporto Movimento Trasporto Tamponamento Regolazioni Metaboliche Coordinazione, comunicazione e controllo Difesa
40 Struttura delle Proteine Composti di catene di amminoacidi Tipiche proteine contengono 1000 amminoacidi Le più grandi contengono 100,000 aa o più Il legame peptidico interconnette gli aa Dipeptide polipeptide Carbonio centrale Gruppo ammino Gruppo R Gruppo acido carbossilico (a) Struttura di un amminoacido Condensazione Idrolisi Glicina (gly) Alanina (ala) (b) Formazione del legame peptidico Legame peptidico
41 Struttura delle Proteine La forma di una proteina depende dall interazione degli amminoacidi : Gruppo R Legami a idrogeno Solvatazione di molecole d acqua Forma = funzione!!!! Piccole variazioni nella struttura possono cambiare le funzioni! Modifiche: Sostituzione di un amminoacido Temperatura ph Denaturazione Se la temperatura è troppo alta, le proteine perdono la loro forma e non hanno più le loro funzioni Se il fenomeno continua, ne consegue la morte
42 Struttura delle Proteine : Proteine Globulari vs. Fibrose (a) Catena polipeptidica Subunità di proteina globulare (b) Mioglobina (c) Emoglobina (d) Fibre di cheratina
43 Enzimi e Reazioni Chimiche La maggior parte delle reazioni chimiche non avviene spontaneamente o così lentamente che saremmo già tutti morti! Substrati Gli enzimi aumentano la of velocità delle reazioni Si rigenerano nel corso della reazione. Sito attivo ENZIMA Stadio 1: I substrati si legano al sito attivo dell enzima Azione di un Enzima Complesso enzima-substrato
44 Acidi Nucleici Costituenti: C, H, O, N, P Immagazzinano ed elaborano le informazioni a livello molecolare Si trovano nelle cellule 2 tipi principali DNA (ac. deossiribonucleico) RNA (ac. ribonucleico) Composti da nucleotidi 3 componenti Zucchero Gruppo fosfato Base azotata Deossiribosio Gruppo fosfato Timina Adenina Legame a idrogeno Adenina Guanina Citosina Timina (DNA) Uracile (RNA) (a) molecola di RNA (b) molecola di DNA
45 Composti ad Alta Energia L energia è ottenuta dal catabolismo di composti organici (glucosio) I legami sono ad alta energia Covalenti; immagazzinano grandi quantità di energia ATP (adenosina trifosfato) Generato dall ADP (adenosina difosfato)
Immagini e concetti della biologia
 Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
I materiali della vita
 I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 10 Le basi della biochimica 3 Sommario 1. Le molecole biologiche si dividono in quattro classi 2. I carboidrati sono il «carburante»
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 10 Le basi della biochimica 3 Sommario 1. Le molecole biologiche si dividono in quattro classi 2. I carboidrati sono il «carburante»
Le molecole biologiche. Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012
 Le molecole biologiche 1 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 2 Il carbonio deve acquistare quattro elettroni
Le molecole biologiche 1 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 2 Il carbonio deve acquistare quattro elettroni
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
Organizzazione della materia
 Organizzazione della materia Elementi: sostanze che non possono essere scisse in altre più semplici mediante reazioni chimiche ordinarie. Atomo: è la porzione più piccola di un elemento, formato da 3 particelle
Organizzazione della materia Elementi: sostanze che non possono essere scisse in altre più semplici mediante reazioni chimiche ordinarie. Atomo: è la porzione più piccola di un elemento, formato da 3 particelle
LE MOLECOLE BIOLOGICHE
 LE MOLECOLE BIOLOGICHE Le cellule contengono quattro famiglie principali di molecole organiche Zuccheri (monosaccaridi) - forniscono una fonte di energia - subunità dei polisaccaridi Amminoacidi - subunità
LE MOLECOLE BIOLOGICHE Le cellule contengono quattro famiglie principali di molecole organiche Zuccheri (monosaccaridi) - forniscono una fonte di energia - subunità dei polisaccaridi Amminoacidi - subunità
I composti organici. Il carbonio e i composti organici
 I composti organici Il carbonio e i composti organici COSA SONO I COMPOSTI ORGANICI? I composti organici sono composti in cui uno o più atomi di carbonio (C) sono uniti tramite un legame covalente ad atomi
I composti organici Il carbonio e i composti organici COSA SONO I COMPOSTI ORGANICI? I composti organici sono composti in cui uno o più atomi di carbonio (C) sono uniti tramite un legame covalente ad atomi
 http://digilander.libero.it/glampis64 Idrogeno, ossigeno, carbonio e azoto costituiscono il 99% delle cellule. I composti del carbonio sono chiamati composti organici o molecole organiche. I composti organici
http://digilander.libero.it/glampis64 Idrogeno, ossigeno, carbonio e azoto costituiscono il 99% delle cellule. I composti del carbonio sono chiamati composti organici o molecole organiche. I composti organici
Indagine biologica: elevato livello di organizzazione delle strutture coinvolte.
 Indagine biologica: elevato livello di organizzazione delle strutture coinvolte. L organizzazione biologica si basa su una gerarchia di livelli strutturali Si parte dall atomo tessuti organi molecola organismo
Indagine biologica: elevato livello di organizzazione delle strutture coinvolte. L organizzazione biologica si basa su una gerarchia di livelli strutturali Si parte dall atomo tessuti organi molecola organismo
Gerard Tortora, Brian Derrickson. Conosciamo
 1 Gerard Tortora, Brian Derrickson Conosciamo il corpo umano Capitolo 1 L organizzazione del corpo umano 1. Che cosa sono l anatomia e la fisiologia 2. I livelli di organizzazione e gli apparati del corpo
1 Gerard Tortora, Brian Derrickson Conosciamo il corpo umano Capitolo 1 L organizzazione del corpo umano 1. Che cosa sono l anatomia e la fisiologia 2. I livelli di organizzazione e gli apparati del corpo
Indice generale 1. Introduzione alla biochimica 2. Acqua, ph, acidi, basi, sali, tamponi
 Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
Di cosa è fatta una cellula?
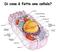 Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O,P,S rappresentano il 99% della massa della cellula - Altri elementi più rari
Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O,P,S rappresentano il 99% della massa della cellula - Altri elementi più rari
LA CHIMICA DELLA VITA
 LA CHIMICA DELLA VITA L elemento presente in tutte le molecole caratteristiche degli esseri viventi è IL CARBONIO Il carbonio ha numero atomico 6 (Z=6). Ha valenza 4: ai suoi atomi mancano 4 elettroni
LA CHIMICA DELLA VITA L elemento presente in tutte le molecole caratteristiche degli esseri viventi è IL CARBONIO Il carbonio ha numero atomico 6 (Z=6). Ha valenza 4: ai suoi atomi mancano 4 elettroni
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Chimica generale e inorganica Studia gli elementi e i composti inorganici
 Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
MOLECOLE. 2 - i legami chimici. Prof. Vittoria Patti
 MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
Capitolo 3 Le biomolecole
 apitolo 3 Le biomolecole opyright 2006 Zanichelli editore I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare
apitolo 3 Le biomolecole opyright 2006 Zanichelli editore I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare
LE MOLECOLE DELLA VITA
 LE MOLECOLE DELLA VITA LE CELLULE SONO COSTITUITE DA ACQUA E BIOMOLECOLE Una biomolecola è un composto chimico che riveste un ruolo importante negli esseri viventi. Le molecole biologiche possono essere
LE MOLECOLE DELLA VITA LE CELLULE SONO COSTITUITE DA ACQUA E BIOMOLECOLE Una biomolecola è un composto chimico che riveste un ruolo importante negli esseri viventi. Le molecole biologiche possono essere
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
La chimica della vita. Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012
 La chimica della vita 1 Tutta la materia è composta da elementi chimici È materia qualsiasi cosa, vivente e non vivente, che occupi dello spazio e che abbia una massa. La materia è composta da elementi
La chimica della vita 1 Tutta la materia è composta da elementi chimici È materia qualsiasi cosa, vivente e non vivente, che occupi dello spazio e che abbia una massa. La materia è composta da elementi
CHIMICA ORGANICA. 2 a D. Novembre Scuola Secondaria di Primo Grado «Bonazzi Lilli» IC PG 14. Ponte Felcino Perugia.
 CHIMICA ORGANICA 2 a D Novembre 2014 Scuola Secondaria di Primo Grado «Bonazzi Lilli» IC PG 14 Ponte Felcino Perugia Manuela Casasoli IL CARBONIO La chimica organica studia i composti organici in cui il
CHIMICA ORGANICA 2 a D Novembre 2014 Scuola Secondaria di Primo Grado «Bonazzi Lilli» IC PG 14 Ponte Felcino Perugia Manuela Casasoli IL CARBONIO La chimica organica studia i composti organici in cui il
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
Elementi sistemati nella TAVOLA PERIODICA DEGLI ELEMENTI in base al numero atomico crescente O, H, N, C (+ del 96% della materia vivente)
 OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
I LEGAMI CHIMICI. I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune
 I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
2. La chimica della vita Tutta la MATERIA è soggetta alle leggi della CHIMICA e della FISICA
 Tutta la MATERIA è soggetta alle leggi della CHIMICA e della FISICA Simbolo Numero atomico % in organismi viventi Elementi che costituiscono circa il 96% del peso degli organismi viventi O 8 65.0 C 6 18.5
Tutta la MATERIA è soggetta alle leggi della CHIMICA e della FISICA Simbolo Numero atomico % in organismi viventi Elementi che costituiscono circa il 96% del peso degli organismi viventi O 8 65.0 C 6 18.5
ACIDI GRASSI INSATURI
 LIPIDI ACIDI GRASSI SATURI ACIDI GRASSI INSATURI TRIGLICERIDI TRIGLICERIDI Grassi neutri o lipidi semplici glicerolo + 1 acido grasso monogliceride glicerolo + 2 acidi grassi digliceride glicerolo + 3
LIPIDI ACIDI GRASSI SATURI ACIDI GRASSI INSATURI TRIGLICERIDI TRIGLICERIDI Grassi neutri o lipidi semplici glicerolo + 1 acido grasso monogliceride glicerolo + 2 acidi grassi digliceride glicerolo + 3
CARBOIDRATI C H O ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO
 CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione
![ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione](/thumbs/57/40353116.jpg) ESERCIZI 1) Il prodotto ionico dell acqua (K w ) vale 10-14 : a. a qualunque temperatura b. solo per una soluzione acida c. solo per una soluzione basica d. solo a T = 25 C 2) Per l acqua pura risulta
ESERCIZI 1) Il prodotto ionico dell acqua (K w ) vale 10-14 : a. a qualunque temperatura b. solo per una soluzione acida c. solo per una soluzione basica d. solo a T = 25 C 2) Per l acqua pura risulta
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa
 Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
LIPIDI. I lipidi (la parola deriva dal greco lìpos, grasso) sono un gruppo di sostanze grasse presente in tutti gli organismi viventi.
 LIPIDI I lipidi (la parola deriva dal greco lìpos, grasso) sono un gruppo di sostanze grasse presente in tutti gli organismi viventi. I lipidi sono composti idrofobi perché non sono solubili in acqua ma
LIPIDI I lipidi (la parola deriva dal greco lìpos, grasso) sono un gruppo di sostanze grasse presente in tutti gli organismi viventi. I lipidi sono composti idrofobi perché non sono solubili in acqua ma
SOLUZIONI DEGLI ESERCIZI
 Dal carbonio agli OGM Biochimica e biotecnologie SOLUZIONI DEGLI ESERCIZI Capitolo 0 Il mondo del carbonio 1. b, e 2. d 3. 7 4. 5. 6. 7. a) Isomeria di posizione; b) i due composti non sono isomeri; c)
Dal carbonio agli OGM Biochimica e biotecnologie SOLUZIONI DEGLI ESERCIZI Capitolo 0 Il mondo del carbonio 1. b, e 2. d 3. 7 4. 5. 6. 7. a) Isomeria di posizione; b) i due composti non sono isomeri; c)
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) POLIMERI Le cellule sintetizzano un enorme numero di grosse molecole a partire da una ristretta serie di
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) POLIMERI Le cellule sintetizzano un enorme numero di grosse molecole a partire da una ristretta serie di
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
Biologia. Lezione 09/11/2010
 Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
Come si costruiscono le molecole in natura ed in laboratorio. Giuseppe Macino
 Come si costruiscono le molecole in natura ed in laboratorio Giuseppe Macino E Dio creo la luce Cosa tiene insieme tutta la materia che forma la terra? Tutto questo e costituito da ELEMENTI Gli elementi
Come si costruiscono le molecole in natura ed in laboratorio Giuseppe Macino E Dio creo la luce Cosa tiene insieme tutta la materia che forma la terra? Tutto questo e costituito da ELEMENTI Gli elementi
CARBOIDRATI SEMPLICI
 CARBOIDRATI Dal greco glucos =dolce Glucidi Zuccheri Sostanze formate acqua e carbonio Hanno forma molecolare (CH₂O)n 1 CARBOIDRATI SEMPLICI Monosaccaridi, una sola unità di poliidrossi aldeide o di poliidrossi
CARBOIDRATI Dal greco glucos =dolce Glucidi Zuccheri Sostanze formate acqua e carbonio Hanno forma molecolare (CH₂O)n 1 CARBOIDRATI SEMPLICI Monosaccaridi, una sola unità di poliidrossi aldeide o di poliidrossi
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
LA CLASSIFICAZIONE DEI COMPOSTI CHIMICI
 LA LASSIFIAZIONE DEI OMPOSTI IMII Inorganici Acqua Sali minerali omposti chimici Idrocarburi arboidrati Organici Alcoli, aldeidi Molecole biologiche o biomolecole Lipidi Proteine Acidi nucleici Vitamine
LA LASSIFIAZIONE DEI OMPOSTI IMII Inorganici Acqua Sali minerali omposti chimici Idrocarburi arboidrati Organici Alcoli, aldeidi Molecole biologiche o biomolecole Lipidi Proteine Acidi nucleici Vitamine
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
I composti organici. Per composto organico si intende un composto contenente carbonio, che forma o deriva da esseri viventi.
 I composti organici Per composto organico si intende un composto contenente carbonio, che forma o deriva da esseri viventi. I composti organici possono essere costituiti da lunghe catene grazie alla capacità
I composti organici Per composto organico si intende un composto contenente carbonio, che forma o deriva da esseri viventi. I composti organici possono essere costituiti da lunghe catene grazie alla capacità
CPIA 1 FOGGIA punto di erogazione San Severo. Prof.ssa ANNA LUCIA L. CANCELLIERE
 CPIA 1 FOGGIA punto di erogazione San Severo Prof.ssa ANNA LUCIA L. CANCELLIERE Sono delle grandi molecole che troviamo nel mondo dei viventi sia come molecole costituenti gli organismi viventi che come
CPIA 1 FOGGIA punto di erogazione San Severo Prof.ssa ANNA LUCIA L. CANCELLIERE Sono delle grandi molecole che troviamo nel mondo dei viventi sia come molecole costituenti gli organismi viventi che come
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
H N H R N H R N R R N R H H H
 AMMINE Sono derivati dell ammoniaca (NH 3 ) nei quali uno o più atomi di idrogeno sono sostituiti da altrettanti radicali alchilici (R-, come ad esempio il gruppo -CH 3 ). Come l ammoniaca anche le ammine
AMMINE Sono derivati dell ammoniaca (NH 3 ) nei quali uno o più atomi di idrogeno sono sostituiti da altrettanti radicali alchilici (R-, come ad esempio il gruppo -CH 3 ). Come l ammoniaca anche le ammine
I composti organici e i loro polimeri
 I ARBIDRATI I composti organici e i loro polimeri La diversità molecolare della vita è basata sulle proprietà del ARBNI. Un atomo di carbonio può formare quattro legami covalenti. Questi legami gli permettono
I ARBIDRATI I composti organici e i loro polimeri La diversità molecolare della vita è basata sulle proprietà del ARBNI. Un atomo di carbonio può formare quattro legami covalenti. Questi legami gli permettono
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
Introduzione alla biologia della cellula. Lezione 2 Le biomolecole
 Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
SOLUZIONI E CONCENTRAZIONE
 SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
CALCOLO DEL ph. ph = - log [1,0x10-3 ] = 3,00
![CALCOLO DEL ph. ph = - log [1,0x10-3 ] = 3,00 CALCOLO DEL ph. ph = - log [1,0x10-3 ] = 3,00](/thumbs/68/59131328.jpg) CALCOLO DEL ph Calcolare il ph di una soluzione di HCl 1,0x10-3 M HCl acido forte che si dissocia completamente HCl H + + Cl - 1 mol di HCl produce 1 mol di H + ph = - log [1,0x10-3 ] = 3,00 Tipici acidi
CALCOLO DEL ph Calcolare il ph di una soluzione di HCl 1,0x10-3 M HCl acido forte che si dissocia completamente HCl H + + Cl - 1 mol di HCl produce 1 mol di H + ph = - log [1,0x10-3 ] = 3,00 Tipici acidi
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
I carboidrati sono poli-idrossialdeidiidrossialdeidi o poli-idrossichetoniidrossichetoni o derivati di questi.
 CARBOIDRATI I CARBOIDRATI I carboidrati sono poli-idrossialdeidiidrossialdeidi o poli-idrossichetoniidrossichetoni o derivati di questi. Unità di base dei carboidrati sono i monosaccaridi. Formula bruta
CARBOIDRATI I CARBOIDRATI I carboidrati sono poli-idrossialdeidiidrossialdeidi o poli-idrossichetoniidrossichetoni o derivati di questi. Unità di base dei carboidrati sono i monosaccaridi. Formula bruta
Lezione 1 ELEMENTI, COMPOSTI E LEGAMI
 Lezione 1 ELEMENTI, COMPOSTI E LEGAMI 1 1.4 Le particolari proprietà dell acqua favoriscono la vita esplorando Nell acqua, l ossigeno acquista una parziale carica negativa, mentre gli atomi di idrogeno
Lezione 1 ELEMENTI, COMPOSTI E LEGAMI 1 1.4 Le particolari proprietà dell acqua favoriscono la vita esplorando Nell acqua, l ossigeno acquista una parziale carica negativa, mentre gli atomi di idrogeno
IL LEGAME A IDROGENO
 IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
Anno scolastico Programma svolto. Testo: Scopriamo la Chimica di F. Bagatti, E. Corradi, A. Desco, C. Ropa Ed.
 Ministero dell Istruzione, dell Università e della Ricerca Istituto d Istruzione Secondaria Superiore di II^ Grado LICEO ARTISTICO A. FRATTINI Via Valverde, 2-21100 Varese tel: 0332820670 fax: 0332820470
Ministero dell Istruzione, dell Università e della Ricerca Istituto d Istruzione Secondaria Superiore di II^ Grado LICEO ARTISTICO A. FRATTINI Via Valverde, 2-21100 Varese tel: 0332820670 fax: 0332820470
INDICE PARTE I CHIMICA. Autori Introduzione
 INDICE Autori Introduzione XI XIII PARTE I CHIMICA Capitolo 1 STRUTTURA DELL ATOMO 3 1.1 Teorie atomiche 3 1.2 Costituenti dell atomo 4 1.3 Numeri quantici 4 1.4 Tipi di orbitali 5 1.5 Aufbau 6 1.6 Sistema
INDICE Autori Introduzione XI XIII PARTE I CHIMICA Capitolo 1 STRUTTURA DELL ATOMO 3 1.1 Teorie atomiche 3 1.2 Costituenti dell atomo 4 1.3 Numeri quantici 4 1.4 Tipi di orbitali 5 1.5 Aufbau 6 1.6 Sistema
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Funzioni dei nucleotidi
 Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
Chimica e chimica della vita
 Chimica e chimica della vita Tocca, Oliver diceva, lanciandomi una barretta non c è niente al mondo come il tungsteno sinterizzato Batteva sulle barrette e queste emettevano un tintinnio profondo Il suono
Chimica e chimica della vita Tocca, Oliver diceva, lanciandomi una barretta non c è niente al mondo come il tungsteno sinterizzato Batteva sulle barrette e queste emettevano un tintinnio profondo Il suono
Teoria di Lewis. Un acido di Lewis è una specie chimica che può formare un legame covalente accettando una coppia di elettroni da un altra specie.
 Teoria di Lewis Spiega perché alcune reazioni hanno proprietà acidobase pur non avendo idrogeni. Nella teoria di Lewis le reazioni acido-base hanno come protagonista la messa in condivisione di una coppia
Teoria di Lewis Spiega perché alcune reazioni hanno proprietà acidobase pur non avendo idrogeni. Nella teoria di Lewis le reazioni acido-base hanno come protagonista la messa in condivisione di una coppia
Livello di organizzazione degli esseri viventi
 Livello di organizzazione degli esseri viventi _Organismo; _Apparato; _Organo; _Tessuti; _Cellule; _Organelli cellulari; _Molecole. Atomo, elemento, molecola, composto, formula, legame, elettronegativita.
Livello di organizzazione degli esseri viventi _Organismo; _Apparato; _Organo; _Tessuti; _Cellule; _Organelli cellulari; _Molecole. Atomo, elemento, molecola, composto, formula, legame, elettronegativita.
BIOMOLECOLE LE BASI DELLA BIOCHIMICA. Capitolo 1 Dal Carbonio agli OGM PLUS
 BIOMOLECOLE LE BASI DELLA BIOCHIMICA Capitolo 1 Dal Carbonio agli OGM PLUS BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici Proteine BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici - monosaccaridi - disaccaridi
BIOMOLECOLE LE BASI DELLA BIOCHIMICA Capitolo 1 Dal Carbonio agli OGM PLUS BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici Proteine BIOMOLECOLE Carboidrati Lipidi Acidi Nucleici - monosaccaridi - disaccaridi
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU)
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
B.U.S.-T.C.S. B. Pascal Reggio Emilia
 Anno Scolastico 2006/2007 Classi 1 e Compiti per le vacanze Materia: Scienze B.U.S.-T.C.S. B. Pascal Reggio Emilia Agli allievi che hanno ottenuto la promozione alla classe seconda senza il debito in Scienze,
Anno Scolastico 2006/2007 Classi 1 e Compiti per le vacanze Materia: Scienze B.U.S.-T.C.S. B. Pascal Reggio Emilia Agli allievi che hanno ottenuto la promozione alla classe seconda senza il debito in Scienze,
L equilibrio dell acqua
 L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
Capitolo 6 La respirazione cellulare
 Capitolo 6 La respirazione cellulare Introduzione alla respirazione cellulare 6.1 La respirazione polmonare rifornisce le nostre cellule di ossigeno ed elimina diossido di carbonio La respirazione polmonare
Capitolo 6 La respirazione cellulare Introduzione alla respirazione cellulare 6.1 La respirazione polmonare rifornisce le nostre cellule di ossigeno ed elimina diossido di carbonio La respirazione polmonare
Nucleotidi e Acidi Nucleici. Struttura di DNA e RNA
 Nucleotidi e Acidi Nucleici Nucleosidi Nucleotidi Funzioni biologiche dei nucleotidi Struttura di DNA e RNA Concatenazione e appaiamento dei nucleotidi Lo scheletro degli acidi nucleici Componenti degli
Nucleotidi e Acidi Nucleici Nucleosidi Nucleotidi Funzioni biologiche dei nucleotidi Struttura di DNA e RNA Concatenazione e appaiamento dei nucleotidi Lo scheletro degli acidi nucleici Componenti degli
Le reazioni esoergoniche e quelle endoergoniche del metabolismo cellulare sono legate dalla molecola di ATP.
 1 METABOLISMO CELLULARE Definizione Metabolismo cellulare insieme delle reazioni che producono e necessitano energia nel nostro corpo. Nel metabolismo si distinguono due fasi: Fase catabolica Insieme delle
1 METABOLISMO CELLULARE Definizione Metabolismo cellulare insieme delle reazioni che producono e necessitano energia nel nostro corpo. Nel metabolismo si distinguono due fasi: Fase catabolica Insieme delle
Arrhenius. HCl H + + Cl - NaOH Na + + OH -
 Arrhenius Un acido è una sostanza che contiene H ed è in grado di cedere ioni H + e base è una sostanza che ha tendenza a cedere ioni OH - in acqua H 2 O HCl H + + Cl - H 2 O NaOH Na + + OH - Reazione
Arrhenius Un acido è una sostanza che contiene H ed è in grado di cedere ioni H + e base è una sostanza che ha tendenza a cedere ioni OH - in acqua H 2 O HCl H + + Cl - H 2 O NaOH Na + + OH - Reazione
Acidi e Basi. Capitolo 15
 Acidi e Basi Capitolo 15 Acidi Hanno un sapore agro. L aceto deve il suo sapore all acido acetico Gli agrumi contengono acido citrico. Provocano il cambio di colore nei coloranti vegetali. Reagiscono con
Acidi e Basi Capitolo 15 Acidi Hanno un sapore agro. L aceto deve il suo sapore all acido acetico Gli agrumi contengono acido citrico. Provocano il cambio di colore nei coloranti vegetali. Reagiscono con
Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe
 1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH
 Nomenclatura AMIDI Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH R-CO-O-CO-R + H 2 O Alcol + Acido estere R-COOH
Nomenclatura AMIDI Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH R-CO-O-CO-R + H 2 O Alcol + Acido estere R-COOH
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Statistiche domande. di 11. chimica generale Esami Esame 7986 Statistiche. Esame del: elementi chimica generale: Bioinformatica
 chimica generale Esami Esame 7986 Statistiche Esame del: 04-02-2015 elementi chimica generale: Bioinformatica Statistiche domande 1) All'aumentare della pressione cosa succede al punto di fusione del ghiaccio?
chimica generale Esami Esame 7986 Statistiche Esame del: 04-02-2015 elementi chimica generale: Bioinformatica Statistiche domande 1) All'aumentare della pressione cosa succede al punto di fusione del ghiaccio?
Lezione 1: Atomi e molecole:
 Lezione 1: Atomi e molecole: La materia è costituita da elementi chimici in forma pura o in combinazioni dette composti. La vita richiede circa 25 elementi chimici. La struttura atomica determina il comportamento
Lezione 1: Atomi e molecole: La materia è costituita da elementi chimici in forma pura o in combinazioni dette composti. La vita richiede circa 25 elementi chimici. La struttura atomica determina il comportamento
Phelan- Pignocchino Le scienze naturali Vol.2. Osservare i viventi SOLUZIONI DEGLI ESERCIZI DEL LIBRO. Capitolo B 2. C 3. B 14.
 Phelan, Pignocchino Le scienze naturali Osservare i viventi SOLUZIONI DEGLI ESERCIZI DEL LIBRO Capitolo 1 1. B 3. B 4. D 5. B 6. D 8. asessuata, unicellulari, dominio, sessuata, pluricellulari, regno.
Phelan, Pignocchino Le scienze naturali Osservare i viventi SOLUZIONI DEGLI ESERCIZI DEL LIBRO Capitolo 1 1. B 3. B 4. D 5. B 6. D 8. asessuata, unicellulari, dominio, sessuata, pluricellulari, regno.
Helena Curtis N. Sue Barnes
 Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
Unità 1. Le molecole della vita
 Unità 1 Le molecole della vita In apertura: Lattosio, sì o no? Latte e latticini sono cibi nutrienti, ricchi di proteine e minerali Per milioni di persone, però, i benefici di questi alimenti sono accompagnati
Unità 1 Le molecole della vita In apertura: Lattosio, sì o no? Latte e latticini sono cibi nutrienti, ricchi di proteine e minerali Per milioni di persone, però, i benefici di questi alimenti sono accompagnati
METALLI: bassa energia di ionizzazione bassa affinità elettronica. NON METALLI: elevata energia di ionizzazione elevata affinità elettronica
 METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
IL METABOLISMO. Dal carbonio agli OGM Capitolo 2
 IL METABOLISMO Dal carbonio agli OGM Capitolo 2 IL METABOLISMO L'insieme delle trasformazioni chimiche ed energetiche che si verificano nelle cellule di un organismo vivente e ne garantiscono la conservazione,
IL METABOLISMO Dal carbonio agli OGM Capitolo 2 IL METABOLISMO L'insieme delle trasformazioni chimiche ed energetiche che si verificano nelle cellule di un organismo vivente e ne garantiscono la conservazione,
Nucleotidi 20/12/2013. Nucleotidi (1) Ribosio Vs. Desossirbosio
 I Nucleotidi Hanno Tre Componenti Nucleotidi https://www2.chemistry.msu.edu/faculty/reusch/virttxtjml/nucacids.htm Nucleotidi (1) Ribosio Vs. Desossirbosio Un Nucleotide è una molecola costituita da un
I Nucleotidi Hanno Tre Componenti Nucleotidi https://www2.chemistry.msu.edu/faculty/reusch/virttxtjml/nucacids.htm Nucleotidi (1) Ribosio Vs. Desossirbosio Un Nucleotide è una molecola costituita da un
 ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
Lipidi: funzioni. Strutturale. Riserva energetica. Segnale.
 Lipidi: funzioni. Strutturale. Riserva energetica. Segnale. Lipidi:classificazione. Saponificabili Non saponificabili Semplici Complessi Prostaglandine Steroidi Cere Trigliceridi Fosfogliceridi Sfingolipidi
Lipidi: funzioni. Strutturale. Riserva energetica. Segnale. Lipidi:classificazione. Saponificabili Non saponificabili Semplici Complessi Prostaglandine Steroidi Cere Trigliceridi Fosfogliceridi Sfingolipidi
Proprietà delle Soluzioni
 Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici
 I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
G i l i A ut u otro r fi G i l i E t E ero r tro r fi I F ototro r fi I C he h mo m tro r fi i us u a s no C e h moete t ro r tr t o r fi
 Organismi differenti utilizzano differenti modalità per ottenere carbonio ed energia: carbonio: Gli Autotrofi usano CO 2 Gli Eterotrofi usano carbonio organico energia: I Fototrofi usano la luce I Chemotrofi
Organismi differenti utilizzano differenti modalità per ottenere carbonio ed energia: carbonio: Gli Autotrofi usano CO 2 Gli Eterotrofi usano carbonio organico energia: I Fototrofi usano la luce I Chemotrofi
ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI
 ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI Nelle reazioni chimiche gli atomi reagenti non cambiano mai la loro natura ( nucleo ) ma la loro configurazione elettronica. Nello specifico ad interagire
ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI Nelle reazioni chimiche gli atomi reagenti non cambiano mai la loro natura ( nucleo ) ma la loro configurazione elettronica. Nello specifico ad interagire
Unità fondamentale di tutti gli organismi viventi.
 La cellula Unità fondamentale di tutti gli organismi viventi. Cellula procariote Cellula animale Cellula vegetale Le cellule procariote e eucariote Cellula procariote Cellula eucariote Cromosomi Membrana
La cellula Unità fondamentale di tutti gli organismi viventi. Cellula procariote Cellula animale Cellula vegetale Le cellule procariote e eucariote Cellula procariote Cellula eucariote Cromosomi Membrana
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
INTRODUZIONE AL METABOLISMO. dal gr. metabolè = trasformazione
 INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
INTRODUZIONE AL METABOLISMO
 INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
Introduzione alla Chimica Organica V Ed.
 William H. Brown - Thomas Poon Introduzione alla Chimica Organica V Ed. Capitolo 2 2.1 Cosa sono gli acidi e le basi secondo Arrhenius? Un Acido di Arrhenius è una sostanze che sciolta in acqua produce
William H. Brown - Thomas Poon Introduzione alla Chimica Organica V Ed. Capitolo 2 2.1 Cosa sono gli acidi e le basi secondo Arrhenius? Un Acido di Arrhenius è una sostanze che sciolta in acqua produce
Capitolo 13 Classificazione e nomenclatura dei composti
 Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Capitolo 13 Classificazione e nomenclatura dei composti 1. I nomi delle sostanze 2. Valenza e numero di ossidazione 3. Leggere e scrivere le formule più semplici 4. La classificazione dei composti inorganici
Carboidrati puri : zucchero e amido nei cibi, cellulosa nel legno, carta e cotone
 Carboidrati Carboidrati puri : zucchero e amido nei cibi, cellulosa nel legno, carta e cotone Glucosio Carboidrati modificati: membrane cellulari, acidi nucleici, Da carbonio idrato: glucosio= C 6 H 12
Carboidrati Carboidrati puri : zucchero e amido nei cibi, cellulosa nel legno, carta e cotone Glucosio Carboidrati modificati: membrane cellulari, acidi nucleici, Da carbonio idrato: glucosio= C 6 H 12
LEZIONE 4. Le soluzioni
 LEZIONE 4 Le soluzioni Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il componente delle
LEZIONE 4 Le soluzioni Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il componente delle
