I RADICALI NEI SISTEMI BIOLOGICI
|
|
|
- Bernardo Gigli
- 9 anni fa
- Visualizzazioni
Transcript
1 I RADICALI NEI SISTEMI BIOLOGICI L OSSIGENO E I SUOI DERIVATI Nei sistemi biologici, uno dei principali intermedi per la formazione di radicali liberi è l ossigeno. L ossigeno pur essendo assolutamente necessario per la vita degli organismi aerobici (animali, piante e batteri aerobici), si dimostra tossico quando la sua concentrazione supera anche di poco quella presente nell aria. E tossico, non di per se, in quanto è scarsamente reattivo, ma a causa dei vari intermedi di riduzione, molto più reattivi dell ossigeno molecolare. σ*p σ*p σ*p σ*p π*p π*p π*p π*p πp πp πp πp σp σp σp σp σ*s σ*s σ*s σ*s σs σs σs σs OSSIGENO (TRIPLETTO) OSSIGENO SINGOLETTO ANIONE SUPEROSSIDO DIANIONE PEROSSIDO Rappresentazione schematica degli orbitali dell ossigeno biatomico in diversi stadi di riduzione. Le frecce rappresentano gli elettroni, e la direzione delle frecce lo spin (+½; -½). L ossigeno si trova in natura sotto forma di molecole biatomiche che presentano due elettroni spaiati di spin uguali sistemati su due orbitali diversi (tripletto), e che quindi possiedono caratteristiche paramagnetiche. Il fatto di possedere elettroni disaccoppiati rende l ossigeno particolarmente reattivo verso le specie radicaliche per formare legami covalenti; infatti i radicali centrati al carbonio, come quelli che si formano durante il processo della perossidazione lipidica, reagiscono in soluzione con l ossigeno con velocità pari alla diffusione, portando alla formazione di radicali perossidi: R R O O + I perossi radicali come vedremo in seguito rivestono un ruolo molto importante nei fenomeni di perossidazione lipidica. 5-1
2 L ossigeno tuttavia, pur favorendo i fenomeni ossidativi, non possiede un elevato potere ossidante: esso infatti ha un potenziale redox di V in O che ne evidenzia il basso carattere ossidante, cioè non strappa facilmente un elettrone da un substrato. Questa è la ragione per cui nell ossidazione di biomolecole, per il trasferimento di un elettrone dalla sostanza biologica all ossigeno, debbono intervenire dei trasferitori di elettroni che in genere sono degli ioni di metalli di transizione nel loro stato di ossidazione più basso o degli enzimi, (come la citocromo ossidasi) che contengono ioni metallici nel loro sito attivo. Radicale superossido Partendo da una molecola di ossigeno e addizionando un elettrone nell orbitale esterno, (figura ) otteniamo il radicale superossido che è il primo prodotto della riduzione univalente dell ossigeno. + e O Questo radicale può essere prodotto accidentalmente, a livello della catena di trasferimento elettronico mitocondriale e microsomiale per trasferimento di un elettrone dai trasportatori di elettroni direttamente all ossigeno che quindi viene ridotto a radicale superossido. Il radicale superossido viene inoltre prodotto durante l azione di alcuni enzimi ossidativi tra cui l aldeide ossidasi, la NAD ossigenasi e la xantina ossidasi. Nelle nostre cellule il radicale superossido viene rapidamente trasformato o per meglio dire, dismutato in acqua ossigenata ed ossigeno, attraverso una reazione nella quale una molecola di superossido si ossida diventando ossigeno e l altra molecola di superossido si riduce e si protona diventando acqua ossigenata. (1) O + + () Il radicale superossido reagisce con proteine, lipidi, polisaccaridi e acidi nucleici ma la sua reattività è piuttosto bassa, tanto che non rappresenta una sostanza eccessivamente tossica per l organismo. La sua azione tossica dipende in larga misura dalla produzione di acqua ossigenata e dall'interazione con essa. In questo modo si genera il radicale idrossile (O ), che è una specie estremamente reattiva, anzi una delle specie radicaliche conosciute più reattive. O + O + O + (Reazione di aber Weiss) (3) La produzione in vivo di superossido può essere però anche funzionale, come nel caso dei fagociti attivati (monociti, nucleofili, eosinofili, macrofagi) che generano questa specie 5-
3 affinché produca per dismutazione (enzimatica o spontanea) acqua ossigenata, la quale viene poi utilizzata per la loro attività fagocitaria. Acqua ossigenata e idrossi radicali Un altro prodotto della riduzione dell ossigeno, è rappresentato dall acqua ossigenata o perossido d idrogeno ( ) che è la forma protonata del dianione perossido ( ), che può essere ottenuto mediante riduzione bivalente dell ossigeno, + e + (4) o indirettamente, mediante riduzione univalente dell a superossido, seguita da dismutazione (eq. ). Nelle cellule l si forma come prodotto primario della riduzione dell ossigeno da parte di numerose ossidasi la maggior parte delle quali è localizzata a livello dei perossizomi. L acqua ossigenata è una specie dannosa in quanto è capace di ossidare composti sulfidrici come i residui di metionina nelle proteine e, a concentrazioni basse può portare alla lisi degli eritrociti umani. La pericolosità dell acqua ossigenata non è dovuta ad un suo attacco diretto a livello dei componenti cellulari, bensì all interazione con le forme ridotte di alcuni metallo-ioni come il ferro bivalente o il rame monovalente, che porta alla formazione dell idrossi radicale e dello ione ossidrilico (eq. 5). + Fe O + O + Fe 3 (Reazione di Fenton) (5) L idrossi radicale si può anche formare, come già accennato, dall interazione del superossido con l acqua ossigenata, come riportato nell eq. 3. Il carattere riducente dello ione superossido spiega perché questa specie, in presenza di ioni metallici diventi dannosa. Lo ione superossido può infatti ridurre il Fe 3 a Fe (eq. 6) e quest ultimo può a sua volta decomporre l acqua ossigenata, dando luogo alla formazione di radicali O secondo la reazione di Fenton (eq. 5). Fe 3 + O Fe + L idrossi radicale si può anche generare per azione fotochimica sulla stessa acqua. Esponendo i tessuti corporei ad esempio alle radiazioni γ, la maggior parte dell energia viene assorbita dall acqua, semplicemente perché l acqua è la componente più abbondante. Questo provoca la rottura omolitica dei legami covalenti O-, portando alla formazione di un radicale idrogeno e uno idrossilico: stadi O intermedi O + (6) 5-3
4 L idrossi radicale è estremamente ossidante, come dimostra la coppia redox, O /O con potenziale E = 1.9 V in acqua, e risulta notevolmente dannoso a livello dei sistemi biologici in quanto reagisce con moltissime molecole di interesse biologico (come ad esempio carboidrati, lipidi, proteine, DNA]) a velocità vicine al limite teorico della diffusione. Il radicale idrossilico è una specie altamente reattiva che si combina velocemente, in meno di un millisecondo, con una molecola nelle immediate vicinanze attraverso tre tipi di reazioni: idrogeno estrazione, addizione e trasferimento elettronico. L idrogeno estrazione può essere effettuata a livello delle membrane biologiche, dove il radicale idrossile risulta estremamente dannoso, a causa dell attacco ossidativo sui lipidi poli-insaturi che innesca il processo autocatalitico di perossidazione lipidica. L idrossi radicale può effettuare reazioni di addizione a doppi legami come quelli presenti nelle strutture aromatiche di purine e pirimidine, che troviamo a livello di RNA e DNA, e può attaccare gli zuccheri, come il deossiribosio presente anche esso nel DNA. Quindi l idrossi radicale può portare a diversi tipi di danni a livello del DNA, che in ultima analisi si traducono in mutazioni, rottura della doppia elica e cancerogenesi. La reattività dell idrossi radicale è talmente vasta che se questo radicale si forma nei sistemi viventi, lascia un segno nella cellula sotto forma di reazioni radicaliche libere a catena, in quanto reagisce immediatamente con qualsiasi molecola biologica nelle sue vicinanze, producendo dei radicali secondari di reattività variabile, che possono diffondere dal sito di origine determinando un danno a distanza. A livello cellulare, ci sono dei sistemi enzimatici in grado di prevenire il danno causato da queste specie radicaliche. L enzima superossido dismutasi (SOD) può eliminare il radicale superossido, che è il primo precursore dell O, mentre le catalasi e le perossidasi possono decomporre l acqua ossigenata. L inibizione della formazione dell idrossi radicale, si può anche attuare attraverso il sequestro di ioni metallici nel loro stato di ossidazione più bassa. Perossi radicale e alcossi radicale I perossi radicali sono il prodotto della reazione di radicali centrati al carbonio con ossigeno molecolare: C + C O O Queste specie radicaliche sono la causa principale della propagazione delle catene di autossidazione (come la perossidazione lipidica) e reagiscono, per idrogeno estrazione, portando alla formazione di alchilidroperossidi e un altro radicale che propaga la catena. (7) 5-4
5 C O O + R C O O + Un aspetto importante della reattività dei perossidi radicali sono le reazioni di terminazione che possono avvenire tramite dimerizzazione del perossido a tetrossido secondo quanto indicato sotto: ROO ROOOOR R (8) ROOOOR RO + ( 1 ) RO ROOR La decomposizione del tetrossido porta alla formazione di ossigeno che in parte può essere ossigeno singoletto ( 1 ) e di dialchilperossido; il radicale alcossilico (RO ) però, se non si accoppia completamente nella gabbia del solvente, può in parte uscire dalla gabbia e reagire come tale. Un altro meccanismo di decomposizione dei perossi radicali (secondari e primari) è stato proposto da Russel nel 1957; il tetrossido si decompone tramite uno stato di transizione ciclico in cui uno degli idrogeni in α viene trasferito per dare chetone, alcool ed ossigeno singoletto come prodotti. C O O O O O C O C C O O O O C Gli alcossi radicali, che richiamano molto da vicino l idrossi radicale, hanno anche se con velocità più basse rispetto a quest ultimo, un buon potere idrogeno estrattore compreso nell intervallo di M -1 s -1, ed una notevole capacità di addizionarsi ad un doppio legame, originando un radicale centrato al carbonio che, come è stato detto precedentemente, può essere l origine di un nuovo perossi radicale quando reagisce con l ossigeno. Anche le reazioni di addizione avvengono con elevata velocità. RO + R RO + R (9) (10) (11) RO + RO C (1) Gli alcossi radicali che si formano per esempio durante la perossidazione lipidica, possono andare incontro a un reazione di β-scissione che porta alla formazione di composti contenenti gruppi carbonilici (soprattutto aldeidi e chetoni) ed idrocarburi. 5-5
6 R β scissione C 3 (C ) 4 O C 3 (C ) 3 C R idrogeno estrazione + O C 3 (C ) 3 C 3 Quindi anche queste specie, possono provocare danni non trascurabili durante le perossidazioni a livello cellulare. Ossigeno singoletto Un altra forma reattiva dell ossigeno che però non è un radicale è l ossigeno singoletto. Questo è uno stato eccitato dell ossigeno molecolare che si forma quando sufficiente energia viene assorbita dalla molecola di ossigeno in modo da attuare una inversione di spin di uno degli elettroni spaiati accompagnata da uno spostamento in un diverso orbitale. L ossigeno singoletto viene considerato un forte ossidante in quanto possiede un potenziale redox di 0.34 V in DMF o 0.79 V in O. Ciò comporta che esso è in grado di reagire con parecchie classi di composti, molte delle quali sono di interesse biologico. Ad esempio, può attaccare i doppi legami dei caroteni, delle clorofille e degli acidi grassi insaturi mediante reazioni di addizione con formazione di idroperossidi o endoperossidi che vanno poi incontro ad ulteriori stadi di degradazione. L ossigeno singoletto dannneggia anche i polipeptidi e le proteine, in quanto ossida soprattutto i residui di metionina, triptofano, istidina e cisteina. Per esempio, con l istidina si ha la rottura dell anello imidazolico: OOC C N C N N 1 OOC C N C COO L ossigeno singoletto è in grado di ossidare le basi puriniche e pirimidiniche provocando quindi danni anche al DNA. Nei sistemi biologici, l ossigeno singoletto può formarsi per dismutazione spontanea del superossido radicale oppure per interazione di quest ultimo con il radicale idrossile o con l acqua ossigenata. La tossicità del superossido radicale deve quindi anche essere riferita alla possibilità di agire da precursore di ossigeno singoletto. Esso si può anche formare durante il processo di perossidazione lipidica in cui sono presenti dei radicali perossilici intermedi che reagendo fra di loro formano un tetrossido che, decomponendosi produce ossigeno singoletto oltre a un composto carbonilico e ad un alcool o ad un perossido (eq. 9). L ossigeno singoletto viene inoltre prodotto durante la reazione fra lo ione ipoclorito e l acqua ossigenata attraverso l enzima mieloperossidasi. (13) (14) 5-6
Reazioni di radicali. Reazioni di propagazione Reazioni di terminazione
 Reazioni di radicali Reazioni di propagazione Reazioni di terminazione Reazioni di propagazione Processi di trasferimento di radicali coinvolgono un radicale ed una molecola di substrato e portano alla
Reazioni di radicali Reazioni di propagazione Reazioni di terminazione Reazioni di propagazione Processi di trasferimento di radicali coinvolgono un radicale ed una molecola di substrato e portano alla
Equilibrio Redox PARADOSSO DELL OSSIGENO: indispensabile per vita aerobia genera specie reattive dell ossigeno (ROS)
 Equilibrio Redox PARADOSSO DELL OSSIGENO: indispensabile per vita aerobia genera specie reattive dell ossigeno (ROS) Altera tutte le molecole biologiche (DNA, RNA, proteine, lipidi.) 1 Radicali endogeni
Equilibrio Redox PARADOSSO DELL OSSIGENO: indispensabile per vita aerobia genera specie reattive dell ossigeno (ROS) Altera tutte le molecole biologiche (DNA, RNA, proteine, lipidi.) 1 Radicali endogeni
Reazione di Maillard
 Reazione di Maillard 1 a fase: reazione di condensazione Base di Schiff (instabile) aldosilamina o chetosilamina Scala di reattività: pentosi>esosi (aldosi)>esosi (chetosi) funzione aminica lontana dal
Reazione di Maillard 1 a fase: reazione di condensazione Base di Schiff (instabile) aldosilamina o chetosilamina Scala di reattività: pentosi>esosi (aldosi)>esosi (chetosi) funzione aminica lontana dal
Fosforilazione ossidativa
 Fosforilazione ossidativa FOSFORILAZIONE OSSIDATIVA La fosforilazione ossidativa è la via finale del metabolismo energetico, in cui gli elettroni (NADH e FADH 2 ) provenienti dalle molecole energetiche
Fosforilazione ossidativa FOSFORILAZIONE OSSIDATIVA La fosforilazione ossidativa è la via finale del metabolismo energetico, in cui gli elettroni (NADH e FADH 2 ) provenienti dalle molecole energetiche
C6H12O6 + 6O2 6CO2 + 6H2O + 36/38 molecole di ATP
 respirazione cellulare Reazioni di ossidazione progressiva dei substrati di natura organica ( tra cui il glucosio rappresenta il principale combustibile ) per produrre ATP che fornirà l energia per le
respirazione cellulare Reazioni di ossidazione progressiva dei substrati di natura organica ( tra cui il glucosio rappresenta il principale combustibile ) per produrre ATP che fornirà l energia per le
Prof.ssa Stacca Prof.ssa Stacca
 La bassa differenza di elettronegatività tra C e H fa sì che i legami presenti negli alcani siano legami covalenti quasi omopolari; di conseguenza gli alcani sono composti apolari. La bassa differenza
La bassa differenza di elettronegatività tra C e H fa sì che i legami presenti negli alcani siano legami covalenti quasi omopolari; di conseguenza gli alcani sono composti apolari. La bassa differenza
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
RADICALI PERSISTENTI. Tempo di vita di diversi minuti o più in soluzione diluita di solventi inerti.
 ADICALI PESISTETI Tempo di vita di diversi minuti o più in soluzione diluita di solventi inerti. Persistenza e stabilità Possono essere studiati con tecniche spettroscopiche convenzionali. La stabilità
ADICALI PESISTETI Tempo di vita di diversi minuti o più in soluzione diluita di solventi inerti. Persistenza e stabilità Possono essere studiati con tecniche spettroscopiche convenzionali. La stabilità
Idrocarburi Saturi. Reazioni
 Idrocarburi Saturi Reazioni Fonti ed usi Gli alcani lineari, ramificati e ciclici si ottengono principalmente dalla lavorazione (frazionamento, cracking, etc.), del petrolio. Fonti ed usi Gli alcani, soprattutto
Idrocarburi Saturi Reazioni Fonti ed usi Gli alcani lineari, ramificati e ciclici si ottengono principalmente dalla lavorazione (frazionamento, cracking, etc.), del petrolio. Fonti ed usi Gli alcani, soprattutto
LA CHIMICA DELLA VITA
 LA CHIMICA DELLA VITA L elemento presente in tutte le molecole caratteristiche degli esseri viventi è IL CARBONIO Il carbonio ha numero atomico 6 (Z=6). Ha valenza 4: ai suoi atomi mancano 4 elettroni
LA CHIMICA DELLA VITA L elemento presente in tutte le molecole caratteristiche degli esseri viventi è IL CARBONIO Il carbonio ha numero atomico 6 (Z=6). Ha valenza 4: ai suoi atomi mancano 4 elettroni
L ossidazione è un processo estremamente importante per il metabolismo dell animale.
 STRESS OSSIDATIVO I LIPIDI, COSÌ COME DEL RESTO ALTRE MACROMOLECOLE QUALI PROTEINE, CARBOIDRATI E ACIDI NUCLEICI, POSSONO ANDARE INCONTRO A REAZIONI DI OSSIDAZIONE L ossidazione è un processo estremamente
STRESS OSSIDATIVO I LIPIDI, COSÌ COME DEL RESTO ALTRE MACROMOLECOLE QUALI PROTEINE, CARBOIDRATI E ACIDI NUCLEICI, POSSONO ANDARE INCONTRO A REAZIONI DI OSSIDAZIONE L ossidazione è un processo estremamente
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
LA FOTOSINTESI: conversione di energia luminosa in energia chimica
 LA FOTOSINTESI: conversione di energia luminosa in energia chimica Fonte principale di carboidrati Via principale di fissazione del carbonio Fonte di ossigeno dell atmosfera La FOTOSINTESI consiste di
LA FOTOSINTESI: conversione di energia luminosa in energia chimica Fonte principale di carboidrati Via principale di fissazione del carbonio Fonte di ossigeno dell atmosfera La FOTOSINTESI consiste di
Verso l esame: allenarsi con le prove esperte La chimica della carta
 Verso l esame: allenarsi con le prove esperte La chimica della carta Quesito 1 RISPOSTE ATTESE DOMANDA 1!Di che tipo sono i legami cerchiati? a. Legami a idrogeno. b. Legami ionici. c. Legami 1-4-ß-glucosidici.
Verso l esame: allenarsi con le prove esperte La chimica della carta Quesito 1 RISPOSTE ATTESE DOMANDA 1!Di che tipo sono i legami cerchiati? a. Legami a idrogeno. b. Legami ionici. c. Legami 1-4-ß-glucosidici.
Alcoli, fenoli ed eteri
 Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Helena Curtis N. Sue Barnes
 Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
Alcoli, fenoli ed eteri
 Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Il carbonio è l elemento di base delle biomolecole. Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici.
 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 1 Il carbonio deve acquistare quattro elettroni per essere stabile
Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 1 Il carbonio deve acquistare quattro elettroni per essere stabile
LA CHIMICA DEL CARBONIO
 LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici.
 LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
CH 3 + CH 3 CH 3 - CH 3. 2 Radicali METILE ETANO
 Nella terminologia chimica vengono denominati radicali liberi atomi o molecole che presentino uno o più elettroni spaiati nell ambito dell orbitale più esterno. In base alla disposizione degli elettroni
Nella terminologia chimica vengono denominati radicali liberi atomi o molecole che presentino uno o più elettroni spaiati nell ambito dell orbitale più esterno. In base alla disposizione degli elettroni
Capitolo 6 La respirazione cellulare
 Capitolo 6 La respirazione cellulare Introduzione alla respirazione cellulare 6.1 La respirazione polmonare rifornisce le nostre cellule di ossigeno ed elimina diossido di carbonio La respirazione polmonare
Capitolo 6 La respirazione cellulare Introduzione alla respirazione cellulare 6.1 La respirazione polmonare rifornisce le nostre cellule di ossigeno ed elimina diossido di carbonio La respirazione polmonare
Meccanismi di azione degli antiossidanti
 Meccanismi di azione degli antiossidanti Materiali rganici Sistemi biologici Lipidi, Proteine, Acidi Nucleici Alimenti Polimeri Materiali plastici, Gomme Lubrificanti Idrocarburi Carburanti Degradazione
Meccanismi di azione degli antiossidanti Materiali rganici Sistemi biologici Lipidi, Proteine, Acidi Nucleici Alimenti Polimeri Materiali plastici, Gomme Lubrificanti Idrocarburi Carburanti Degradazione
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH. ) ed un gruppo carbossilico ( COOH) nella stessa molecola
 Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Immagini e concetti della biologia
 Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Acqua. MACROnutrienti. MICROnutrienti. Vitamine. Componenti minori. Carboidrati Proteine Lipidi. Sali minerali. Nutraceutici
 ALIMENTI E COSMESI Dott. Adele Papetti Laboratorio Nutraceutici e Alimenti [email protected] Master di II livello - SCIENZE COSMETOLOGICHE ALIMENTI Acqua MACROnutrienti MICROnutrienti Carboidrati
ALIMENTI E COSMESI Dott. Adele Papetti Laboratorio Nutraceutici e Alimenti [email protected] Master di II livello - SCIENZE COSMETOLOGICHE ALIMENTI Acqua MACROnutrienti MICROnutrienti Carboidrati
REAZIONI E LORO MECCANISMI
 REAZIONI E LORO MECCANISMI Rivisitazione dei concetti di Omolisi, Eterolisi Reagenti Nucleofili e Reagenti Elettrofili Addizione elettrofila Sostituzione nucleofila Eliminazione Reazioni radicaliche Reazioni
REAZIONI E LORO MECCANISMI Rivisitazione dei concetti di Omolisi, Eterolisi Reagenti Nucleofili e Reagenti Elettrofili Addizione elettrofila Sostituzione nucleofila Eliminazione Reazioni radicaliche Reazioni
CATENA RESPIRATORIA (CR) FOSFORILAZIONE OSSIDATIVA (FO)
 CATENA RESPIRATORIA (CR) FOSFORILAZIONE OSSIDATIVA (FO) - Decarb. ossid. piruvato - -Ossidazione acidi grassi - Vie ossidative aa -Ciclo di Krebs avvengono tutte nella matrice mitocondriale In tutte queste
CATENA RESPIRATORIA (CR) FOSFORILAZIONE OSSIDATIVA (FO) - Decarb. ossid. piruvato - -Ossidazione acidi grassi - Vie ossidative aa -Ciclo di Krebs avvengono tutte nella matrice mitocondriale In tutte queste
Energia e metabolismi energetici
 Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
Le biomolecole si trovano negli organismi viventi
 Le biomolecole si trovano negli organismi viventi I viventi sono formati per la maggior parte da acqua e molecole, chiamate biomolecole. Le biomolecole sono sostanze contenenti carbonio. I composti del
Le biomolecole si trovano negli organismi viventi I viventi sono formati per la maggior parte da acqua e molecole, chiamate biomolecole. Le biomolecole sono sostanze contenenti carbonio. I composti del
fornire energia chimica in vettori attivati ATP e NADH e NADPH e FADH.
 Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
La massa è la quantità di materia di cui è fatta una qualsiasi cosa
 Dall atomo all organizzazione cellulare Tutti gli organismi viventi sono costituiti da atomi Due o più atoni insieme formano le molecole La materia è tutto ciò che occupa uno spazio, ha un volume e una
Dall atomo all organizzazione cellulare Tutti gli organismi viventi sono costituiti da atomi Due o più atoni insieme formano le molecole La materia è tutto ciò che occupa uno spazio, ha un volume e una
 http://digilander.libero.it/glampis64 Idrogeno, ossigeno, carbonio e azoto costituiscono il 99% delle cellule. I composti del carbonio sono chiamati composti organici o molecole organiche. I composti organici
http://digilander.libero.it/glampis64 Idrogeno, ossigeno, carbonio e azoto costituiscono il 99% delle cellule. I composti del carbonio sono chiamati composti organici o molecole organiche. I composti organici
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2015-16 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2015-16 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
ADP + HPO 3, NAD +, NADP +, FAD ATP, NADH, NADPH, FADH 2 ENERGIA CHIMICA
 MACROMOLECOLE CELLULARI Proteine Polisaccaridi Lipidi Acidi nucleici ADP + HPO 3 2-, NAD +, NADP +, FAD Metaboliti complessi RICCHI DI ENERGIA Carboidrati Lipidi Proteine ANABOLISMO (biosintesi) MOLECOLE
MACROMOLECOLE CELLULARI Proteine Polisaccaridi Lipidi Acidi nucleici ADP + HPO 3 2-, NAD +, NADP +, FAD Metaboliti complessi RICCHI DI ENERGIA Carboidrati Lipidi Proteine ANABOLISMO (biosintesi) MOLECOLE
Fotosintesi: processo di traduzione dell energia luminosa in energia chimica. Pianta + Luce
 Fotosintesi: processo di traduzione dell energia luminosa in energia chimica Pianta + Luce CO + + H O (CH O) O 2 2 2 2 La fotosintesi non è un processo peculiare delle piante Luce, solfobatteri anaerobi
Fotosintesi: processo di traduzione dell energia luminosa in energia chimica Pianta + Luce CO + + H O (CH O) O 2 2 2 2 La fotosintesi non è un processo peculiare delle piante Luce, solfobatteri anaerobi
Biologia. La cellula al lavoro
 Biologia La cellula al lavoro Capitolo 5 La cellula al lavoro 1. Il metabolismo cellulare: come le cellule ricavano energia 2. La glicolisi è la prima fase della demolizione del glucosio 3. La respirazione
Biologia La cellula al lavoro Capitolo 5 La cellula al lavoro 1. Il metabolismo cellulare: come le cellule ricavano energia 2. La glicolisi è la prima fase della demolizione del glucosio 3. La respirazione
I LEGAMI CHIMICI. I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune
 I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
Gerard Tortora, Brian Derrickson. Conosciamo
 1 Gerard Tortora, Brian Derrickson Conosciamo il corpo umano Capitolo 1 L organizzazione del corpo umano 1. Che cosa sono l anatomia e la fisiologia 2. I livelli di organizzazione e gli apparati del corpo
1 Gerard Tortora, Brian Derrickson Conosciamo il corpo umano Capitolo 1 L organizzazione del corpo umano 1. Che cosa sono l anatomia e la fisiologia 2. I livelli di organizzazione e gli apparati del corpo
Elementi sistemati nella TAVOLA PERIODICA DEGLI ELEMENTI in base al numero atomico crescente O, H, N, C (+ del 96% della materia vivente)
 OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
Jay Phelan, Maria Cristina Pignocchino. Scopriamo la biologia
 Jay Phelan, Maria Cristina Pignocchino Scopriamo la biologia Capitolo 2 Le molecole della vita 3 1. Le classi delle biomolecole Le biomolecole sono composti organici formati da: catene di atomi di carbonio,
Jay Phelan, Maria Cristina Pignocchino Scopriamo la biologia Capitolo 2 Le molecole della vita 3 1. Le classi delle biomolecole Le biomolecole sono composti organici formati da: catene di atomi di carbonio,
Come le cellule traggono energia dal cibo: produzione di ATP
 Come le cellule traggono energia dal cibo: produzione di ATP L energia è contenuta nei legami chimici delle molecole nutritive; la cellula estrae questa energia e la conserva nell ATP: respirazione cellulare
Come le cellule traggono energia dal cibo: produzione di ATP L energia è contenuta nei legami chimici delle molecole nutritive; la cellula estrae questa energia e la conserva nell ATP: respirazione cellulare
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Una panoramica del ciclo dell acido ciclico
 Ciclo di Krebs Una panoramica del ciclo dell acido ciclico Concetti chiave Il ciclo dell acido citrico, o ciclo di Krebs, o ciclo degli acidi tricarbossilici (TCA), è un processo catalitico a 8 tappe che
Ciclo di Krebs Una panoramica del ciclo dell acido ciclico Concetti chiave Il ciclo dell acido citrico, o ciclo di Krebs, o ciclo degli acidi tricarbossilici (TCA), è un processo catalitico a 8 tappe che
G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 L addizione coniugata In un sistema carbonilico α,β-insaturo dove avverà l attacco di un nucleofilo? Al carbonio carbonilico o al doppio legame? Il sistema ha due centri elettrofili: il carbonio carbonilico
L addizione coniugata In un sistema carbonilico α,β-insaturo dove avverà l attacco di un nucleofilo? Al carbonio carbonilico o al doppio legame? Il sistema ha due centri elettrofili: il carbonio carbonilico
Metabolismo degli xenobiotici
 Prof. Giorgio Sartor degli xenobiotici Copyright 00100 by Giorgio Sartor. All rights reserved. Versione 3. oct 00 degli xenobiotici Scopo Convertire sostanze lipofile in idrofile Facilitare l escrezione
Prof. Giorgio Sartor degli xenobiotici Copyright 00100 by Giorgio Sartor. All rights reserved. Versione 3. oct 00 degli xenobiotici Scopo Convertire sostanze lipofile in idrofile Facilitare l escrezione
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 10 Le basi della biochimica 3 Sommario 1. Le molecole biologiche si dividono in quattro classi 2. I carboidrati sono il «carburante»
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 10 Le basi della biochimica 3 Sommario 1. Le molecole biologiche si dividono in quattro classi 2. I carboidrati sono il «carburante»
a) un movimento contro gradiente di concentrazione che utilizza fonti primarie di energia
 1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
Principali vie di utilizzo del Glucosio
 Principali vie di utilizzo del Glucosio GLICOGENO (Polimero di riserva) Polimero lineare e ramificato di glucosio che si accumula nel fegato e nel muscolo. Nella catena lineare le molecole di glucosio
Principali vie di utilizzo del Glucosio GLICOGENO (Polimero di riserva) Polimero lineare e ramificato di glucosio che si accumula nel fegato e nel muscolo. Nella catena lineare le molecole di glucosio
Specie radicaliche e stress ossidativo
 Prof. Giorgio Sartor Specie radicaliche e stress ossidativo Copyright 2001-2008 by Giorgio Sartor. All rights reserved. Versione 4.1 apr 2008 adicali Specie chimiche con elettroni spaiati occupano da soli
Prof. Giorgio Sartor Specie radicaliche e stress ossidativo Copyright 2001-2008 by Giorgio Sartor. All rights reserved. Versione 4.1 apr 2008 adicali Specie chimiche con elettroni spaiati occupano da soli
Le molecole della vita
 Le molecole della vita Introduzione: cose da sapere per capire. Gli atomi (es. carbonio, ossigeno, idrogeno) si uniscono a formare molecole Le molecole costituiscono tutta la materia che ci circonda Atomi
Le molecole della vita Introduzione: cose da sapere per capire. Gli atomi (es. carbonio, ossigeno, idrogeno) si uniscono a formare molecole Le molecole costituiscono tutta la materia che ci circonda Atomi
Mitocondri. -sono visibili al MO (Ø 0,5 µ e lunghezza da 1 a 6 µ) -assenti nei batteri e presenti in tutte le cellule eucariotiche
 Mitocondri sono organelli deputati alla produzione dell energia, capaci di ossidare i prodotti dell assorbimento intestinale degradandoli e di convertire l energia liberata in ATP processo chiamato respirazione
Mitocondri sono organelli deputati alla produzione dell energia, capaci di ossidare i prodotti dell assorbimento intestinale degradandoli e di convertire l energia liberata in ATP processo chiamato respirazione
Respirazione cellullare
 Respirazione cellullare 1 luce La respirazione è un processo complementare alla fotosintesi e permette di completare il ciclo del Carbonio. fotosintesi CO 2 H 2 O O 2 Carboidrati respirazione Energia utile
Respirazione cellullare 1 luce La respirazione è un processo complementare alla fotosintesi e permette di completare il ciclo del Carbonio. fotosintesi CO 2 H 2 O O 2 Carboidrati respirazione Energia utile
Liceo Classico Pitagora Programma Biologia e Chimica 2016/2017 II F
 Liceo Classico Pitagora Programma Biologia e Chimica 2016/2017 II F 1)Struttura e funzioni della cellula -le caratteristiche degli esseri viventi -la teoria cellulare -la struttura delle cellula -gerarchia
Liceo Classico Pitagora Programma Biologia e Chimica 2016/2017 II F 1)Struttura e funzioni della cellula -le caratteristiche degli esseri viventi -la teoria cellulare -la struttura delle cellula -gerarchia
Indice generale 1. Introduzione alla biochimica 2. Acqua, ph, acidi, basi, sali, tamponi
 Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
Lipidi Semplici: Gliceridi (Mono, Di e Trigliceridi; esteri del GLICEROLO con Ac. Grassi a lunga catena). CERE
 I lipidi sono un gruppo eterogeneo di sostanze. Essi sono caratterizzati dalla insolubilità in acqua (o scarsa solubilità) e dalla affinità per i solventi apolari e per gli altri lipidi (natura fortemente
I lipidi sono un gruppo eterogeneo di sostanze. Essi sono caratterizzati dalla insolubilità in acqua (o scarsa solubilità) e dalla affinità per i solventi apolari e per gli altri lipidi (natura fortemente
Seminario. Ciclo di Krebs 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A
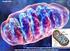 Seminario PASSO PER PASSO 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A Il ciclo dell acido citrico inizia con la reazione di condensazione di un unità con 4
Seminario PASSO PER PASSO 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A Il ciclo dell acido citrico inizia con la reazione di condensazione di un unità con 4
Catena di trasporto degli elettroni (catena respiratoria) e Fosforilazione ossidativa
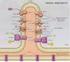 Catena di trasporto degli elettroni (catena respiratoria) e Fosforilazione ossidativa NADH e FADH2 (accettori universali di e-) formati nella glicolisi e nel ciclo di Krebs (e nell ossidazione degli acidi
Catena di trasporto degli elettroni (catena respiratoria) e Fosforilazione ossidativa NADH e FADH2 (accettori universali di e-) formati nella glicolisi e nel ciclo di Krebs (e nell ossidazione degli acidi
PIRIDINA N coinvolto nel ciclo non partecipa all aromaticità con i suoi elettroni N: coppia di non legame all esterno dell anello comportamento
 PIRIDINE LEZIONE 6 PIRIDINA N coinvolto nel ciclo non partecipa all aromaticità con i suoi elettroni N: coppia di non legame all esterno dell anello comportamento basico (pka=5.2) Nucleo della piridina
PIRIDINE LEZIONE 6 PIRIDINA N coinvolto nel ciclo non partecipa all aromaticità con i suoi elettroni N: coppia di non legame all esterno dell anello comportamento basico (pka=5.2) Nucleo della piridina
La fotosintesi e la respirazione cellulare
 La fotosintesi e la respirazione cellulare 1 La fotosintesi immagazzina energia e rilascia ossigeno L ATP è una molecola antica e universale, sintetizzata da tutti gli organismi viventi. L ATP viene utilizzata
La fotosintesi e la respirazione cellulare 1 La fotosintesi immagazzina energia e rilascia ossigeno L ATP è una molecola antica e universale, sintetizzata da tutti gli organismi viventi. L ATP viene utilizzata
Fotosintesi: processo di traduzione dell energia luminosa in energia chimica. Pianta + Luce
 Fotosintesi: processo di traduzione dell energia luminosa in energia chimica Pianta + Luce CO + + H O (CH O) O 2 2 2 2 La fotosintesi non è un processo peculiare delle piante Luce, solfobatteri anaerobi
Fotosintesi: processo di traduzione dell energia luminosa in energia chimica Pianta + Luce CO + + H O (CH O) O 2 2 2 2 La fotosintesi non è un processo peculiare delle piante Luce, solfobatteri anaerobi
ACIDI GRASSI INSATURI
 LIPIDI ACIDI GRASSI SATURI ACIDI GRASSI INSATURI TRIGLICERIDI TRIGLICERIDI Grassi neutri o lipidi semplici glicerolo + 1 acido grasso monogliceride glicerolo + 2 acidi grassi digliceride glicerolo + 3
LIPIDI ACIDI GRASSI SATURI ACIDI GRASSI INSATURI TRIGLICERIDI TRIGLICERIDI Grassi neutri o lipidi semplici glicerolo + 1 acido grasso monogliceride glicerolo + 2 acidi grassi digliceride glicerolo + 3
LA CHIMICA DEL CARBONIO
 LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) colesterolo
LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) colesterolo
I composti organici. Per composto organico si intende un composto contenente carbonio, che forma o deriva da esseri viventi.
 I composti organici Per composto organico si intende un composto contenente carbonio, che forma o deriva da esseri viventi. I composti organici possono essere costituiti da lunghe catene grazie alla capacità
I composti organici Per composto organico si intende un composto contenente carbonio, che forma o deriva da esseri viventi. I composti organici possono essere costituiti da lunghe catene grazie alla capacità
SOLUZIONI DEGLI ESERCIZI
 Dal carbonio agli OGM Biochimica e biotecnologie SOLUZIONI DEGLI ESERCIZI Capitolo 0 Il mondo del carbonio 1. b, e 2. d 3. 7 4. 5. 6. 7. a) Isomeria di posizione; b) i due composti non sono isomeri; c)
Dal carbonio agli OGM Biochimica e biotecnologie SOLUZIONI DEGLI ESERCIZI Capitolo 0 Il mondo del carbonio 1. b, e 2. d 3. 7 4. 5. 6. 7. a) Isomeria di posizione; b) i due composti non sono isomeri; c)
Nucleotidi e acidi nucleici
 Nucleotidi e acidi nucleici ACIDI NUCLEICI Biomolecole fondamentali per tutti gli organismi viventi Unici nella capacità di autoduplicazione Conservazione e trasmissione da una generazione all altra dell
Nucleotidi e acidi nucleici ACIDI NUCLEICI Biomolecole fondamentali per tutti gli organismi viventi Unici nella capacità di autoduplicazione Conservazione e trasmissione da una generazione all altra dell
