SOLUZIONI COMPITO A DI CHIMICA DEL
|
|
|
- Giustina Franceschi
- 7 anni fa
- Visualizzazioni
Transcript
1 SOLUZIONI COMPITO A DI CHIMICA DEL A) Il permanganato di potassio reagisce con il perossido di idrogeno in presenza di acido solforico dando luogo alla formazione di ossigeno, diossido di manganese e solfato di potassio. Bilanciare la reazione e calcolare il volume della soluzione acquosa al 79% in massa di perossido di idrogeno e con densità pari a g ml -1, necessario per ottenere un volume di ossigeno pari 320 ml (misurato a 700 torr e 20 C), noto che la reazione ha un rendimento del 91%. KMnO 4 + H 2 O 2 + H 2 SO 4 O 2 + MnO 2 + K 2 SO 4 MnO e - + 4H 3 O + MnO 2 + 6H 2 O x2 H 2 O 2 + 2H 2 O O 2 + 2e - + 2H 3 O + x3 2MnO H 3 O + +3H 2 O 2 + 6H 2 O 2MnO H 2 O + 3O 2 + 6H 3 O + 2MnO H 3 O + +3H 2 O 2 2MnO 2 + 6H 2 O + 3O 2 La reazione bilanciata è: 2KMnO 4 + 3H 2 O 2 + H 2 SO 4 3O 2 + 2MnO 2 + K 2 SO 4 + 4H 2 O n O2 = [(700/760) atm 0.32 L]/( atm L K -1 mol K)= mol Dalla stechiometria n H2O2 = n O2 = mol In base al rendimento della reazione, pari al 91%, le moli realmente necessarie di perossido di idrogeno sono: n H2O2 = /91 = mol grammi H2O2 = mol 34 g mol -1 = 0,456 g grammi soluzione H 2 O 2 = 0, /79 = 0,58 g Volume soluzione H 2 O 2 = (0,58 g)/(1.397 g ml -1 ) = 0,41 ml 2A) In un recipiente dal volume costante di 5,0 dm 3 si pongono 0,5 mol di azoto gassoso e 1,25 mol di ossigeno gassoso e si porta la temperatura a 900 K. Si instaura un equilibrio omogeneo che porta alla formazione di triossido di diazoto. A equilibrio raggiunto, si constata che il 51% in volume dell'ossigeno si è consumato. Si calcolino la K c e la K p del processo in questione. 2 N 2(g) + 3 O 2(g) 2 N 2 O 3(g) i 0,5 1,25-0,5-2x 1,25-3x 2x e 0,075 0,6125 0,4250 con 3x = 51% di 1,25 cioè x = 0,2125 mol K c = [N 2 O 3 ] 2 / [N 2 ] 2 [O 2 ] 3 = {(0,4250) 2 / [(0,075) 2 (0,6125) 3 ]} V 3 = 1, K p = K c (RT) n con n = -3 K p = 4,
2 3A) Calcolare a 25 C il ph e la pressione osmotica in torr della soluzione ottenuta mescolando volumi uguali di due soluzioni contenenti acido cloridrico 1, M e idrossido di potassio 1, M. Mescolando la soluzione acida e basica si ottiene una reazione di neutralizzazione in cui il volume totale raddoppia e le concentrazioni si dimezzano. HCl + H 2 O H 3 O + + Cl - KOH + (H 2 O) K + + OH - H 3 O + + OH - H 2 O 6, , , Dato il valore della concentrazione degli ioni idrogenoidi rimasti non posso trascurare l'autoprotolisi dell'acqua. H 3 O + + OH - 2 H 2 O 1, , x 1, x K w = [H 3 O + ] [OH - ] = (1, , x ) (1, x) = da cui x = 0, e [H 3 O + ] = 2, M ph = 6,70 π = [ ] tot RT = ([H 3 O + ] + [Cl - ] + [K + ] + [OH - ]) RT = 3, atm = 0,24 Torr dove [H 3 O + ] = 2, M; [OH - ]= 0, M; [Cl - ] = 6, M; [K 2+ ] = 6, M [ ] tot = 1, M 4A) Calcolare il volume di metano (CH 4 ), misurato in condizioni standard, che bisogna bruciare per ottenere il calore necessario per la fusione di 20.0 g di ghiaccio a 0 C e per portare la temperatura dell acqua ottenuta a 25 C noto che: H f CH 4(g) = kj/mol; H f CO 2(g) = kj/mol; H f H 2 O (l) = kj/mol; H fusione H 2 O = 6.25 kj/mol. [La capacità termica dell acqua ovvero la quantità di calore necessaria per innalzare di un grado la temperatura di una mole della sostanza è C H2O(l) = J/(mol K)]. CH 4(g) + 2O 2(g) CO 2(g) + 2H 2 O (l) C (s) + O 2(g) CO 2(g) H 2(g) + 1/2O 2(g) 2H 2 O (l) C (s) + 2H 2(g) CH 4(g) H 0 comb(metano) = H 0 f(co 2(g) ) + 2 H 0 f(h 2 O (l) ) - H 0 f(metano) = ( kj mol -1 ) + 2( kj mol -1 ) (-74,85 kj mol -1 ) = -890,25 kj mol -1 H 2 O (s) H 2 O (l) H 0 fus(acqua) = 6,25 kj/mol n(acqua) = g/pm = 1,11 mol Q fus (acqua) = n H 0 fus(acqua) = 6,94 kj Passaggio dell'acqua da 0 a 25 C: Q = n C T = 2,09 KJ
3 Q TOT = 9,03 KJ n(ch 4 ) = Q TOT / H 0 comb(ch 4 ) = 1, mol V(CH 4 ) = nrt / p = 0,248 l 5A) Ad una soluzione contiene cloruro di cadmio M e bromuro ferrico M si aggiunge idrossido di sodio solido. Calcolare a quale ph inizia la precipitazione, rispettivamente, di idrossido di cadmio [K ps = ] e idrossido ferrico [K ps = ]. Cd(OH) 2 Cd OH Kps = [Cd 2+ ] [OH ] 2 = = x 2 x = = [OH ] [H 3 O + ] = ph = 7.84 Fe(OH) 3 Fe OH Kps = [Fe 3+ ] [OH ] 3 = = x 3 x = = [OH ] [H 3 O + ] = ph = A) Una soluzione acquosa di solfato di sodio è sottoposta ad elettrolisi per 15 min utilizzando elettrodi inerti. Si sviluppano complessivamente ml di gas, misurati a 23 C e 650 mmhg. Si calcoli l intensità di corrente che ha attraversato il circuito. Le reazioni che avvengono agli elettrodi sono: (-) 2H 2 O + 2e - H 2 + 2OH - (+) 3H 2 O ½ O 2 + 2e - + 2H 3 O + 5H 2 O ½ O 2 + H 2 + 4H 2 O La reazione che avviene nella cella elettrolitica è: H 2 O ½ O 2 + H 2 Il gas che si sviluppa agli elettrodi è costituito da H 2 e O 2 rispettivamente nel rapporto 2:1. Le moli totali di gas che si sviluppano sono: n t = [(650/760) atm L]/( atm L K -1 mol K)= mol n H2 = (2/3) n t = mol n O2 = (1/3) n t = mol Riferendosi ad esempio alla reazione che avviene al polo negativo si ha: 1 mol (H 2 prodotto) : C mol -1 2 mol (elettroni messi in gioco) = mol : Q (C) Q = = C i = (Q/t) = 241.2/(15 60) = A SOLUZIONI COMPITO B DI CHIMICA DEL B) L anidride arseniosa reagisce con il perossido di idrogeno in presenza di idrossido di sodio dando luogo alla formazione di arseniato di sodio ed acqua. Bilanciare la reazione e
4 calcolare i grammi di arseniato di sodio che si ottengono mettendo a reagire 300 ml di una soluzione acquosa al 79% in massa di perossido di idrogeno avente densità pari a g ml -1 con g di triossido di diarsenico, noto che la reazione ha un rendimento del 73%. As 2 O 3 + H 2 O 2 + NaOH Na 3 AsO 4 + H 2 O semireazione di ossidazione: As 2 O OH - 2AsO e - + 5H 2 O semireazione di riduzione: H 2 O 2 + 2e - + H 2 O H 2 O + 2OH - semplificando H 2 O presente al primo ed al secondo membro ho: H 2 O 2 + 2e - 2OH - Moltiplico la semireazione di riduzione per 2 (stesso numero di elettroni scambiati) ed ho: As 2 O OH - +2H 2 O 2 2AsO H 2 O + 4OH - Semplificando gli OH - ottengo: As 2 O 3 + 6OH - +2H 2 O 2 2AsO H 2 O La reazione bilanciata è: As 2 O 3 + 6NaOH - +2H 2 O 2 2Na 3 AsO 4 + 5H 2 O La massa della soluzione acquosa di H 2 O 2 che viene messa a reagire è: m = ρv = g ml ml = g massa di H 2 O 2 nella soluzione = /100 = g n H2O2 = (331.1 g)/(34 g mol -1 ) = 9.74 mol n As2O3 = (247.0 g)/(197.8 g mol -1 ) = 1.25 mol As 2 O 3 è il reagente limitante n Na3AsO4 (teoriche) = 2n As2O3 = 2.50 mol n Na3AsO4 che si ottengono realmente = /100 = 1.82 mol grammi Na3AsO4 = 1.82 mol g mol -1 = g NOTA: può andare bene anche la reazione As 2 O 3 + 2H 2 O 2 + 2NaOH 2NaAsO 3 + 3H 2 O, nel qual caso i grammi finali di NaAsO 3 saranno 266,4 g) 2B) In un recipiente dal volume costante di 10,0 dm 3 si pongono 2,0 mol di cloro gassoso e 5,0 mol di ossigeno gassoso, e si porta la temperatura a 700 K. Si instaura un equilibrio omogeneo che porta alla formazione di anidride clorica. A equilibrio raggiunto, si constata che il 70% in volume dell'ossigeno si è consumato. Si calcolino la K c e la K p del processo in questione. 2 Cl 2(g) + 5 O 2(g) 2 Cl 2 O 5(g) i 2,0 5,0-2,0-2x 5,0-5x 2x e 0,6 1,5 1,4 con 5x = 70% di 5,0 cioè x = 0,7 mol K c = [Cl 2 O 5 ] 2 / [Cl 2 ] 2 [O 2 ] 5 = {(1,4) 2 / [(0,6) 2 (1,5) 5 ]} V 5 = 7,
5 K p = K c (RT) n con n = -5 K p = 1, B) Calcolare a 25 C il ph e la pressione osmotica in torr della soluzione ottenuta mescolando volumi uguali di due soluzioni contenenti acido nitrico 1, M e idrossido di calcio 6, M. Mescolando la soluzione acida e basica si ottiene una reazione di neutralizzazione in cui il volume totale raddoppia e le concentrazioni si dimezzano. HNO 3 + H 2 O H 3 O + + NO 3 - Ca(OH) 2 + (H 2 O) Ca OH - H 3 O + + OH - H 2 O 6, , , Dato il valore della concentrazione degli ioni idrogenoidi rimasti non posso trascurare l'autoprotolisi dell'acqua. H 3 O + + OH - 2 H 2 O 1, x 1, , x K w = [H 3 O + ] [OH - ] = (1, x) (1, , x) = da cui x = 0, e [OH - ] = 2, M poh = 6,70 ph = 7,30 π = [ ] tot RT = ([OH - ] + [H 3 O + ] + [NO 3 - ] + [Ca 2+ ]) RT = 2, atm = 0,18 Torr dove [H 3 O + ] = 0, M; [OH - ]= 2, M; [NO 3 - ] = 6, M; [Ca 2+ ] = 3, M [ ] tot = 9, M 4B) Calcolare il volume di butano (C 4 H 10 ), misurato in condizioni standard, che bisogna bruciare per ottenere il calore necessario per la fusione di 50.0 g di ghiaccio a 0 C e per portare la temperatura dell acqua ottenuta a 35 C noto che: H f C 4 H 10(g) = kj/mol; H f CO 2(g) = kj/mol; H f H 2 O (l) = kj/mol; H fusione H 2 O = 6.25 kj/mol. [La capacità termica dell acqua ovvero la quantità di calore necessaria per innalzare di un grado la temperatura di una mole della sostanza è C H2O(l) = J/(mol K). C 4 H 10(g) + 13/2O 2(g) 4CO 2(g) + 5H 2 O (l) C (s) + O 2(g) CO 2(g) H 2(g) + 1/2O 2(g) 2H 2 O (l) C (s) + 2H 2(g) CH 4(g) H 0 comb(butano) = 4 H 0 f(co 2(g) ) + 5 H 0 f(h 2 O (l) ) - H 0 f(butano) = 4( kj mol -1 ) + 5( kj mol -1 ) (-124,7 kj mol -1 ) = ,3 kj mol -1 H 2 O (s) H 2 O (l) H 0 fus(acqua) = 6,25 kj/mol n(acqua) = g/pm = 2,78 mol
6 Q fus (acqua) = n H 0 fus(acqua) = 17,36 kj Passaggio dell'acqua da 0 a 25 C: Q = n C T = 7,32 KJ Q TOT = 24,68 KJ n(c 4 H 10 ) = Q TOT / H 0 comb(c 4 H 10 ) = 8, mol V(C 4 H 10 ) = nrt / p = 0,210 l 5B) Ad una soluzione contiene cloruro di magnesio M e nitrato di argento M si aggiunge idrossido di sodio solido. Calcolare a quale ph inizia la precipitazione, rispettivamente, di idrossido di magnesio [K ps = ] e idrossido di argento [K ps = ]. Mg(OH) 2 Mg OH Kps = [Mg 2+ ] [OH ] 2 = = x 2 x = = [OH ] [H 3 O + ] = ph = 9.04 Ag(OH) Ag + + OH Kps = [Ag + ] [OH ]= = x x = = [OH ] [H 3 O + ] = ph = B) Una soluzione acquosa di acido solforico è sottoposta ad elettrolisi per 90 min con una corrente di 12.1 A utilizzando elettrodi inerti. Calcolare il volume complessivo di idrogeno ed ossigeno formati agli elettrodi, misurato a 25 C e 739 mmhg. Le reazioni che avvengono agli elettrodi sono: (-) 2H 3 O + + 2e - H 2 + 2H 2 O (+) 3H 2 O ½ O 2 + 2e - + 2H 3 O + La reazione che avviene nella cella elettrolitica è: H 2 O ½ O 2 + H 2 Q = i t = = C Riferendosi alla reazione che avviene al polo negativo si ha: 1 mol (H 2 prodotto) : C mol -1 2 mol (elettroni messi in gioco) = n H2 mol : C n H2 = 0.34 mol Al polo positivo si ha: ½ mol (O 2 prodotto) : C mol -1 2 mol (elettroni messi in gioco) = n O2 mol : C n O2 = 0.17 mol Le moli totali di gas che si sviluppano sono: n t = n H2 + n O2 = 0.51 mol V = (0.51 mol atm L K -1 mol K)/[ [(739/760) atm] = L
SOLUZIONI COMPITO A DI CHIMICA DEL
 SOLUZIONI COMPITO A DI CHIMICA DEL 03-07-12 1) Il cloruro di manganese (II) reagisce con l'azoto gassoso in acqua per dare acido manganoso, idrazina gassosa (N 2 H 4 ) ed acido cloridrico. Bilanciare,
SOLUZIONI COMPITO A DI CHIMICA DEL 03-07-12 1) Il cloruro di manganese (II) reagisce con l'azoto gassoso in acqua per dare acido manganoso, idrazina gassosa (N 2 H 4 ) ed acido cloridrico. Bilanciare,
SOLUZIONE DEL COMPITO A DI CHIMICA DEL
 SOLUZIONE DEL COMPITO A DI CHIMICA DEL 05-07-13 1A) 33.5 g di ioduro di sodio e 33.0 g di iodio vengono sciolti in acqua trattati con 17.9 L (a c.n.) di cloro; si formano iodato di sodio, acido iodico
SOLUZIONE DEL COMPITO A DI CHIMICA DEL 05-07-13 1A) 33.5 g di ioduro di sodio e 33.0 g di iodio vengono sciolti in acqua trattati con 17.9 L (a c.n.) di cloro; si formano iodato di sodio, acido iodico
+ 4e - + 16H 3 O + 3S 2- + 36H 2 O 3SO 2-4 + 24e - + 24H 3 O +
 SOLUZIONI COMPITO A DI CHIMICA DEL 22-06-11 1A) 258 g di un minerale contenente il 91% di solfuro di arsenico (III), vengono immessi in 4,0 L di una soluzione acquosa di acido manganico al 10% in peso
SOLUZIONI COMPITO A DI CHIMICA DEL 22-06-11 1A) 258 g di un minerale contenente il 91% di solfuro di arsenico (III), vengono immessi in 4,0 L di una soluzione acquosa di acido manganico al 10% in peso
COMPITO A DI CHIMICA DEL
 COMPITO A DI CHIMICA DEL 17-09-13 1A) Una miscela di solfato di rame pentaidrato e solfato di calcio diidrato viene scaldata fino alla perdita completa di acqua. La diminuzione in peso della miscela risulta
COMPITO A DI CHIMICA DEL 17-09-13 1A) Una miscela di solfato di rame pentaidrato e solfato di calcio diidrato viene scaldata fino alla perdita completa di acqua. La diminuzione in peso della miscela risulta
SOLUZIONI COMPITO PARZIALE CHIMICA
 SOLUZIONI COMPITO PARZIALE CHIMICA 20-05-11 1A) Il permanganato di potassio reagisce con il cloruro di potassio in presenza di acido nitrico in eccesso dando luogo alla formazione di nitrato di potassio,
SOLUZIONI COMPITO PARZIALE CHIMICA 20-05-11 1A) Il permanganato di potassio reagisce con il cloruro di potassio in presenza di acido nitrico in eccesso dando luogo alla formazione di nitrato di potassio,
SOLUZIONI COMPITO A CHIMICA
 SOLUZIONI COMPITO A CHIMICA 16-01-2012 1A) Il permanganato di ammonio si può ottenere dalla reazione tra permanganato di bario e solfato di ammonio, filtrando il precipitato di solfato di bario che si
SOLUZIONI COMPITO A CHIMICA 16-01-2012 1A) Il permanganato di ammonio si può ottenere dalla reazione tra permanganato di bario e solfato di ammonio, filtrando il precipitato di solfato di bario che si
Prima parte dell esame di CHIMICA GENERALE ED INORGANICA CORSO DI LAUREA IN SCIENZE BIOLOGICHE (L-Z) (ELABORATO SIMBOLICO-NUMERICO)
 (Es.1) 1) 4.4 grammi di propano, C 3 H 8, vengono bruciati in aria. Determinare la massa dell ossigeno consumato nella combustione. R = 16 g 2) La costante di equilibrio della seguente reazione di dissociazione
(Es.1) 1) 4.4 grammi di propano, C 3 H 8, vengono bruciati in aria. Determinare la massa dell ossigeno consumato nella combustione. R = 16 g 2) La costante di equilibrio della seguente reazione di dissociazione
SOLUZIONI COMPITO A CHIMICA
 SOLUZIONI COMPITO A CHIMICA 07-07-211 1A) Per combustione di una miscela (0,596 moli totali) di due idrocarburi di formula (C 7 H 16 e C 9 H 20 ) si ottengono 102.420 g di acqua ed anidride carbonica.
SOLUZIONI COMPITO A CHIMICA 07-07-211 1A) Per combustione di una miscela (0,596 moli totali) di due idrocarburi di formula (C 7 H 16 e C 9 H 20 ) si ottengono 102.420 g di acqua ed anidride carbonica.
Esame (0) classei - Codice Prova:
 1) Il diossido di zolfo reagirà con l acqua secondo la reazione: SO 2 (g) + H 2 O (l) H 2 SO 3 (l) Quanto diossido di zolfo è necessario per preparare 27.86 g di H 2 SO 3 (l)? A. 27.86 g B. 0.3394 g C.
1) Il diossido di zolfo reagirà con l acqua secondo la reazione: SO 2 (g) + H 2 O (l) H 2 SO 3 (l) Quanto diossido di zolfo è necessario per preparare 27.86 g di H 2 SO 3 (l)? A. 27.86 g B. 0.3394 g C.
SOLUZIONI COMPITO A DI CHIMICA DEL
 SOLUZIONI COMPITO A DI CHIMICA DEL 18-07-12 1A) 1.3 kg di un campione solido contenente il 40% di permanganato di potassio, il 50% di dicromato di potassio e il 10% di impurezze vengono sciolti in una
SOLUZIONI COMPITO A DI CHIMICA DEL 18-07-12 1A) 1.3 kg di un campione solido contenente il 40% di permanganato di potassio, il 50% di dicromato di potassio e il 10% di impurezze vengono sciolti in una
Problema 1 Mg + 2HCl H 2 + MgCl 2. di Mg 1 Mg 1 H 2 quindi 0,823 moli di H 2 di H 2
 REAZIONI CHIMICHE 1. Con riferimento alla seguente reazione (da bilanciare): Mg + HCl H 2 + MgCl 2 calcolare i grammi di H 2 che si ottengono facendo reagire completamente 20 g di magnesio. utilizzando
REAZIONI CHIMICHE 1. Con riferimento alla seguente reazione (da bilanciare): Mg + HCl H 2 + MgCl 2 calcolare i grammi di H 2 che si ottengono facendo reagire completamente 20 g di magnesio. utilizzando
COMPITO B DI CHIMICA DEL
 COMPITO B DI CHIMICA DEL 220713 1B) Un campione di aria (mm = 29.0 g/mol) del volume di 6.12 L, misurati a c.s., è inquinato da ossido di azoto. Il campione viene fatto passare attraverso 340 ml di una
COMPITO B DI CHIMICA DEL 220713 1B) Un campione di aria (mm = 29.0 g/mol) del volume di 6.12 L, misurati a c.s., è inquinato da ossido di azoto. Il campione viene fatto passare attraverso 340 ml di una
Scritto chimica generale
 Scritto chimica generale 23.01.2012 TESTO A 1. L idrogeno solfuro di ammonio solido si decompone ad ammoniaca gassosa e acido solfidrico gassoso a 25 C. Sapendo che a 25 C la costante per questo equilibrio
Scritto chimica generale 23.01.2012 TESTO A 1. L idrogeno solfuro di ammonio solido si decompone ad ammoniaca gassosa e acido solfidrico gassoso a 25 C. Sapendo che a 25 C la costante per questo equilibrio
Università di Catania Facoltà di Ingegneria CdL Ingegneria Recupero Edilizio Ambientale ESERCIZI DI CHIMICA. Prof. Antonino Mamo
 Università di Catania Facoltà di Ingegneria CdL Ingegneria Recupero Edilizio Ambientale ESERCIZI DI CHIMICA Prof. Antonino Mamo 1) Scrivere le formule di struttura dei seguenti sali: a) permanganato di
Università di Catania Facoltà di Ingegneria CdL Ingegneria Recupero Edilizio Ambientale ESERCIZI DI CHIMICA Prof. Antonino Mamo 1) Scrivere le formule di struttura dei seguenti sali: a) permanganato di
ESERCIZI DI RIEPILOGO GENERALE
 ESERCIZI DI RIEPILOGO GENERALE 1) Scrivere le formule brute e le formule di Lewis per: ammoniaca; ione ammonio; ione solfato; ione bicarbonato; acido acetico; anidride solforosa. Dove necessario, indicare
ESERCIZI DI RIEPILOGO GENERALE 1) Scrivere le formule brute e le formule di Lewis per: ammoniaca; ione ammonio; ione solfato; ione bicarbonato; acido acetico; anidride solforosa. Dove necessario, indicare
ESERCIZI SU. le soluzioni e la loro composizione
 ESERCIZI SU le soluzioni e la loro composizione martedì 15 dicembre 2015 Composizione delle soluzioni definita da grandezze di primario interesse fisico Composizione percentuale in massa % di A = (m A
ESERCIZI SU le soluzioni e la loro composizione martedì 15 dicembre 2015 Composizione delle soluzioni definita da grandezze di primario interesse fisico Composizione percentuale in massa % di A = (m A
RISOLUZIONE ESERCIZI COMPITO 20 GENNAIO 2017
 RISOLUZIONE ESERCIZI COMPITO 20 GENNAIO 2017 Domanda 1 compito A Calcolare il ph di una soluzione ottenuta sciogliendo 30.0 g di acido acetico e 30.0 g di acetato di sodio in 750 ml di soluzione. Per l
RISOLUZIONE ESERCIZI COMPITO 20 GENNAIO 2017 Domanda 1 compito A Calcolare il ph di una soluzione ottenuta sciogliendo 30.0 g di acido acetico e 30.0 g di acetato di sodio in 750 ml di soluzione. Per l
Esame di Chimica Generale 21 Febbraio 2012
 Esame di Chimica Generale 21 Febbraio 2012 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 21 Febbraio 2012 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
COMPITO A DI CHIMICA DEL 15-09-09
 COMPITO A DI CHIMICA DEL 15-09-09 1A) 3,447 g di anidride arsenica (As 2 O 5 ) solida e 6,278 g di zinco metallico vengono fatti reagire con un eccesso di acido solforico. Si calcoli il volume di arsina
COMPITO A DI CHIMICA DEL 15-09-09 1A) 3,447 g di anidride arsenica (As 2 O 5 ) solida e 6,278 g di zinco metallico vengono fatti reagire con un eccesso di acido solforico. Si calcoli il volume di arsina
Prova in itinere di Chimica Generale 28 Gennaio 2011
 Prova in itinere di Chimica Generale 28 Gennaio 2011 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
Prova in itinere di Chimica Generale 28 Gennaio 2011 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
Studenti L-P(2017/18) L-O(2018/19) (Prof.Giuliano Moretti) Risultati della prova scritta del 15 febbraio 2019
 Studenti LP(2017/18) LO(2018/19) (Prof.Giuliano Moretti) Risultati della prova scritta del 15 febbraio 2019 La prova orale si svolgerà secondo il calendario riportato di seguito Presentarsi presso la stanza
Studenti LP(2017/18) LO(2018/19) (Prof.Giuliano Moretti) Risultati della prova scritta del 15 febbraio 2019 La prova orale si svolgerà secondo il calendario riportato di seguito Presentarsi presso la stanza
Olimpiadi di Chimica
 Olimpiadi di Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Massa atomica è la massa di un atomo espressa in unità di massa atomica (uma) Per definizione: 1 atomo 12 C pesa 12 uma
Olimpiadi di Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Massa atomica è la massa di un atomo espressa in unità di massa atomica (uma) Per definizione: 1 atomo 12 C pesa 12 uma
Prova in itinere di Chimica Generale 14 Gennaio 2010
 Prova in itinere di Chimica Generale 14 Gennaio 2010 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
Prova in itinere di Chimica Generale 14 Gennaio 2010 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno
Esame di Chimica Generale 20 Aprile 2011
 Esame di Chimica Generale 20 Aprile 2011 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 20 Aprile 2011 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
ossidazione/riduzione, ossidante/riducente
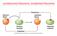 ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox +6-1 -1 +3-1 K 2 Cr 2 O 7 (aq) + HI(aq) KI(aq) + CrI 3 (aq) + I 2 (s) + H 2 O(l) 0 K 2 Cr 2 O 7 (aq) + 6HI(aq) KI(aq) + 2CrI
ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox +6-1 -1 +3-1 K 2 Cr 2 O 7 (aq) + HI(aq) KI(aq) + CrI 3 (aq) + I 2 (s) + H 2 O(l) 0 K 2 Cr 2 O 7 (aq) + 6HI(aq) KI(aq) + 2CrI
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica -
 Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
H 2 SO 4 : mol : 3 = mol REAGENTE LIMITANTE Ca 3 (PO 4 ) 2 : mol : 1 = mol
 1) Partendo da 100.0 g di H 2 SO 4 e 300.0 g di Ca 3 (PO 4 ) 2, calcolare quanti grammi di prodotti si formano e quanti grammi di reagente in eccesso rimangono non reagiti. 3H 2 SO 4 + Ca 3 (PO 4 ) 2 3CaSO
1) Partendo da 100.0 g di H 2 SO 4 e 300.0 g di Ca 3 (PO 4 ) 2, calcolare quanti grammi di prodotti si formano e quanti grammi di reagente in eccesso rimangono non reagiti. 3H 2 SO 4 + Ca 3 (PO 4 ) 2 3CaSO
La reazione tra Mg metallico e CO 2 è 2Mg + CO 2(g) 2 MgO(s) + C (grafite)
 3 kg di butano (C 4 H 10 ) vengono bruciati in una caldaia con un eccesso di aria del 40% in moli. Determinare il calore sviluppato dalla combustione e quanti m 3 (STP) di CO2 vengono prodotti. Determinare
3 kg di butano (C 4 H 10 ) vengono bruciati in una caldaia con un eccesso di aria del 40% in moli. Determinare il calore sviluppato dalla combustione e quanti m 3 (STP) di CO2 vengono prodotti. Determinare
3) La reazione tra Mg metallico e CO 2 è 2Mg + CO 2(g) 2 MgO(s) + C (grafite)
 1) Determinare la variazione di entalpia associata alla seguente reazione e indicare se è esotermica o endotermica: a) Na(s) + ½Cl 2 (g) NaCl(s) Sono note le variazioni di entalpia delle seguenti reazioni:
1) Determinare la variazione di entalpia associata alla seguente reazione e indicare se è esotermica o endotermica: a) Na(s) + ½Cl 2 (g) NaCl(s) Sono note le variazioni di entalpia delle seguenti reazioni:
COMPITO A PARZIALE DI CHIMICA DEL
 CMPIT A PARZIALE DI CHIMICA DEL 10-05-2013 1) La reazione del cloro gassoso con ioduro di cromo(iii), in ambiente alcalino (idrossido di potassio), porta alla formazione di cromato di potassio, periodato
CMPIT A PARZIALE DI CHIMICA DEL 10-05-2013 1) La reazione del cloro gassoso con ioduro di cromo(iii), in ambiente alcalino (idrossido di potassio), porta alla formazione di cromato di potassio, periodato
REAZIONI DI OSSIDO-RIDUZIONE: ESERCIZI RISOLTI. Dr. Francesco Musiani
 REAZIONI DI OSSIDO-RIDUZIONE: ESERCIZI RISOLTI Dr. Francesco Musiani Versione aggiornata al 20.12.2011 Zn (s) + NO 3 - Zn 2+ + NH 4 + Zn (s) Ý Zn 2+ (1) NO - + 3 Ý NH 4 (2) - Bilanciamento di (1): In questa
REAZIONI DI OSSIDO-RIDUZIONE: ESERCIZI RISOLTI Dr. Francesco Musiani Versione aggiornata al 20.12.2011 Zn (s) + NO 3 - Zn 2+ + NH 4 + Zn (s) Ý Zn 2+ (1) NO - + 3 Ý NH 4 (2) - Bilanciamento di (1): In questa
prendono parte alla reazione.
 REAZIONI CHIMICHE A + B = C + D A, B = reagenti C, D = prodotti Es. C 3 H 8 (g) + O 2 (g) = CO 2 (g) + H 2 O (g) propano BILANCIAMENTO DELL EQUAZIONE DI REAZIONE (principio di conservazione della massa)
REAZIONI CHIMICHE A + B = C + D A, B = reagenti C, D = prodotti Es. C 3 H 8 (g) + O 2 (g) = CO 2 (g) + H 2 O (g) propano BILANCIAMENTO DELL EQUAZIONE DI REAZIONE (principio di conservazione della massa)
Esame di Chimica Generale 15 Giugno 2016
 Esame di Chimica Generale 15 Giugno 2016 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 15 Giugno 2016 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Chimica A.A. 2017/2018
 Chimica A.A. 2017/2018 INGEGNERIA BIOMEDICA Tutorato Lezione 9 Calcolare la solubilità molare del solfato di bario in una soluzione 0.020 M di solfato di sodio. Il prodotto di solubilità del solfato di
Chimica A.A. 2017/2018 INGEGNERIA BIOMEDICA Tutorato Lezione 9 Calcolare la solubilità molare del solfato di bario in una soluzione 0.020 M di solfato di sodio. Il prodotto di solubilità del solfato di
A-PDF Merger DEMO : Purchase from to remove the watermark
 A-PDF Merger DEMO : Purchase from www.a-pdf.com to remove the watermark Corso di Laurea in Farmacia/ISF Esame di Chimica Generale ed Inorganica Prova scritta di Stechiometria 3-0-004 Cognome e Nome Corso
A-PDF Merger DEMO : Purchase from www.a-pdf.com to remove the watermark Corso di Laurea in Farmacia/ISF Esame di Chimica Generale ed Inorganica Prova scritta di Stechiometria 3-0-004 Cognome e Nome Corso
ESERCIZI sulle SOLUZIONI
 ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
Appello del 6 luglio 2017 ESERCIZI NUMERICI. Fila A
 Appello del 6 luglio 2017 ESERCIZI NUMERICI Fila A 1C) L acido solforico ossida a caldo il rame con formazione di solfato di rame(ii), biossido di zolfo e acqua, secondo la seguente reazione (da bilanciare):
Appello del 6 luglio 2017 ESERCIZI NUMERICI Fila A 1C) L acido solforico ossida a caldo il rame con formazione di solfato di rame(ii), biossido di zolfo e acqua, secondo la seguente reazione (da bilanciare):
ossidazione/riduzione, ossidante/riducente
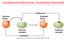 ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox 0 +5 +2 +4 Cu(s) + HNO 3 (aq) Cu(NO 3 ) 2 + NO 2 (g) + H 2 O(l) Determinazione dei numeri di ossidazione Cu(s) + 2HNO 3 (aq)
ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox 0 +5 +2 +4 Cu(s) + HNO 3 (aq) Cu(NO 3 ) 2 + NO 2 (g) + H 2 O(l) Determinazione dei numeri di ossidazione Cu(s) + 2HNO 3 (aq)
In base ai coefficienti stechiometrici posso calcolare quanti grammi di sostanza reagiscono.
 ESERCITAZIONE 6 RAPPORTI PONDERALI E VOLUMETRICI NELLE REAZIONI In base ai coefficienti stechiometrici posso calcolare quanti grammi di sostanza reagiscono. 1) Quanto acido solforico reagisce con 100g
ESERCITAZIONE 6 RAPPORTI PONDERALI E VOLUMETRICI NELLE REAZIONI In base ai coefficienti stechiometrici posso calcolare quanti grammi di sostanza reagiscono. 1) Quanto acido solforico reagisce con 100g
+ MnO 4 + 8H + 5Fe 3+ + Mn H 2 O
 Università degli Studi di Roma Tor Vergata, Facoltà di Scienze MFN Corso di Laurea Triennale in Chimica Applicata, Insegnamento di Chimica Generale Modulo di Stechiometria. AA 2008/2009. Prova scritta,
Università degli Studi di Roma Tor Vergata, Facoltà di Scienze MFN Corso di Laurea Triennale in Chimica Applicata, Insegnamento di Chimica Generale Modulo di Stechiometria. AA 2008/2009. Prova scritta,
Calcolare la resa teorica di AgCl: 0.640g x 100/98.3 = 0.651g. Calcolare le moli di AgCl: massa molare AgCl: g/mol
 Esercizio 1 Quanti millilitri di una soluzione 2.73x10-1 M di AgNO3 bisogna far reagire con una soluzione di HCl per ottenere 640 mg di AgCl sapendo che la resa della reazione è del 98.3%. Scrivere la
Esercizio 1 Quanti millilitri di una soluzione 2.73x10-1 M di AgNO3 bisogna far reagire con una soluzione di HCl per ottenere 640 mg di AgCl sapendo che la resa della reazione è del 98.3%. Scrivere la
CCS Biologia A.A
 CCS Biologia A.A. 2009 2010 2011-2012 Esercizi di preparazione all esame 1 Calcolare il ph di una soluzione ottenuta mescolando 20 ml di HCl 0,1 M con 20 ml di una soluzione di KOH 0,15 M. -scrivere la
CCS Biologia A.A. 2009 2010 2011-2012 Esercizi di preparazione all esame 1 Calcolare il ph di una soluzione ottenuta mescolando 20 ml di HCl 0,1 M con 20 ml di una soluzione di KOH 0,15 M. -scrivere la
ESERCIZIO 1 Per combustione completa in eccesso di ossigeno di un composto costituito da calcio, carbonio e azoto, si formano CaO, CO 2 e NO 2 in
 ESERCIZIO 1 Per combustione completa in eccesso di ossigeno di un composto costituito da calcio, carbonio e azoto, si formano CaO, CO 2 e NO 2 in quantità rispettivamente pari a 3,500, 2,747 e 5,743 g.
ESERCIZIO 1 Per combustione completa in eccesso di ossigeno di un composto costituito da calcio, carbonio e azoto, si formano CaO, CO 2 e NO 2 in quantità rispettivamente pari a 3,500, 2,747 e 5,743 g.
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: H 2 S (aq) + NO 3
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: 2 (aq) + N 3 (aq) + + (aq) (s) + N (g) + 2 (l). Calcolare i grammi di (s) ed il volume di N (g) a 25 C ed 1
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: 2 (aq) + N 3 (aq) + + (aq) (s) + N (g) + 2 (l). Calcolare i grammi di (s) ed il volume di N (g) a 25 C ed 1
Esame di Chimica Generale 22 Febbraio 2011
 Esame di Chimica Generale 22 Febbraio 2011 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 22 Febbraio 2011 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 19 Febbraio 2013
 Esame di Chimica Generale 19 Febbraio 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 19 Febbraio 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Argomenti 2 lezione. Bilanciamento delle reazioni chimiche. Resa teorica e resa effettiva. Esercitazioni di Chimica Generale ed Inorganica 2
 Un composto contenente sodio, cloro e ossigeno ha una percentuale in massa di sodio del 25.42. Se 3.25 g di tale composto forniscono 4.33 x 10 22 atomi di ossigeno, calcolare la formula minima. Na: 25.42
Un composto contenente sodio, cloro e ossigeno ha una percentuale in massa di sodio del 25.42. Se 3.25 g di tale composto forniscono 4.33 x 10 22 atomi di ossigeno, calcolare la formula minima. Na: 25.42
PROVA SCRITTA DI CHIMICA GENERALE ED INORGANICA Scienze e Tecnologie per l Ambiente
 10 Dicembre 2008 eventuale presenza di momento dipolare per I - 3 e per gli anioni dei sali: nitrato di sodio, perclorato di potassio. 2) a) Calcolare il ph di una soluzione di carbonato di sodio 0.10
10 Dicembre 2008 eventuale presenza di momento dipolare per I - 3 e per gli anioni dei sali: nitrato di sodio, perclorato di potassio. 2) a) Calcolare il ph di una soluzione di carbonato di sodio 0.10
Esame di Chimica Generale del 12 Gennaio 2018
 Esame di Chimica Generale del 12 Gennaio 2018 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale del 12 Gennaio 2018 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
DIPARTIMENTO DI FARMACIA C.d.S. in Farmacia CORSO DI CHIMICA GENERALE ED INORGANICA COMPITO SCRITTO - 24 Giugno 2015
 A DIPARTIMENTO DI FARMACIA C.d.S. in Farmacia CORSO DI CHIMICA GENERALE ED INORGANICA COMPITO SCRITTO - 24 Giugno 2015 COGNOME NOME Segnare con una crocetta la risposta (una sola) che si ritiene esatta.
A DIPARTIMENTO DI FARMACIA C.d.S. in Farmacia CORSO DI CHIMICA GENERALE ED INORGANICA COMPITO SCRITTO - 24 Giugno 2015 COGNOME NOME Segnare con una crocetta la risposta (una sola) che si ritiene esatta.
Esame di Chimica Generale 15 Giugno 2011
 Esame di Chimica Generale 15 Giugno 2011 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 15 Giugno 2011 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
See more about
 See more about www.scienzaescuola.it ESERCIZI DI STECHIOMETRIA CON ESEMPI DI SOLUZIONI TIPO. Prof. Gabrielli Luciano (Lic. Scientifico L. da Vinci -Sora FR) P.M : Calcola il P.M. di: Al 2 (SO 4 ) 3 Fe(NO
See more about www.scienzaescuola.it ESERCIZI DI STECHIOMETRIA CON ESEMPI DI SOLUZIONI TIPO. Prof. Gabrielli Luciano (Lic. Scientifico L. da Vinci -Sora FR) P.M : Calcola il P.M. di: Al 2 (SO 4 ) 3 Fe(NO
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Un po di calcoli N moli = massa [gr] / massa atomica [uma] N atomi = N moli * N A N A = numero di Avogadro Quanti
La Vita è una Reazione Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Un po di calcoli N moli = massa [gr] / massa atomica [uma] N atomi = N moli * N A N A = numero di Avogadro Quanti
Nomenclatura delle sostanze chimiche
 Nomenclatura delle sostanze chimiche SOSTANZE CHIMICHE!1 ELEMENTI Metalli Non metalli COMPOSTI Ossidi Anidridi Idrossidi Acidi Sali Idruri - ossiacidi - idracidi METALLI!2 Duttili Malleabili Buoni conduttori
Nomenclatura delle sostanze chimiche SOSTANZE CHIMICHE!1 ELEMENTI Metalli Non metalli COMPOSTI Ossidi Anidridi Idrossidi Acidi Sali Idruri - ossiacidi - idracidi METALLI!2 Duttili Malleabili Buoni conduttori
Reagente limitante / in eccesso
 220,0 g di nitrato di argento vengono aggiunti ad una soluzione contenente 98.0 g di cloruro di calcio. Si forma cloruro di argento e nitrato di calcio. 2 AgNO3 + CaCl2 2 AgCl + Ca(NO3)2 Individuare il
220,0 g di nitrato di argento vengono aggiunti ad una soluzione contenente 98.0 g di cloruro di calcio. Si forma cloruro di argento e nitrato di calcio. 2 AgNO3 + CaCl2 2 AgCl + Ca(NO3)2 Individuare il
Scritto Chimica generale 13.02.2012 Gruppo A
 Scritto Chimica generale 13.02.2012 Gruppo A 1. Calcolare il ph di una soluzione ottenuta mescolando 12.0 ml di una soluzione 1.00 M di nitrato di calcio, 150 ml di una soluzione 1.00 M di acido cloridrico,
Scritto Chimica generale 13.02.2012 Gruppo A 1. Calcolare il ph di una soluzione ottenuta mescolando 12.0 ml di una soluzione 1.00 M di nitrato di calcio, 150 ml di una soluzione 1.00 M di acido cloridrico,
EQUILIBRI IN SOLUZIONI SATURE DI SALI POCO SOLUBILI. K eq = Ba 2+ SO 4 EQUILIBRIO CHIMICO. A a B b. Equilibri eterogenei: Equilibri omogenei:
 EQUILIBRIO CHIMICO aa + bb cc + dd K eq = C c D d A a B b K eq è una costante che dipende esclusivamente dalla natura delle specie all equilibrio e dalla temperatura Equilibri omogenei: Tutte le specie
EQUILIBRIO CHIMICO aa + bb cc + dd K eq = C c D d A a B b K eq è una costante che dipende esclusivamente dalla natura delle specie all equilibrio e dalla temperatura Equilibri omogenei: Tutte le specie
1) Bilanciare la seguente reazione redox con il metodo ionico-elettronico Ag (s) + H + (aq) + NO 3
 A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
Esami di Chimica Generale ed Inorganica per S.F.A del 10/02/2014
 Esami di Chimica Generale ed Inorganica per S.F.A del 10/02/2014 1) Si consideri la reazione da bilanciare in ambiente acido: MnO4 - + H2O2 à Mn +2 + O2 Partendo da una mole di permanganato di potassio
Esami di Chimica Generale ed Inorganica per S.F.A del 10/02/2014 1) Si consideri la reazione da bilanciare in ambiente acido: MnO4 - + H2O2 à Mn +2 + O2 Partendo da una mole di permanganato di potassio
UNIVERSITÀ DEGLI STUDI DI ROMA TOR VERGATA
 I prova in itinere - Compito A - 21.01.2008 1. Calcolare la quantità in grammi di Cl 2 che occupa un volume di 682mL alla temperatura di 38,2C e alla pressione di 435 torr. Quale sarebbe la pressione del
I prova in itinere - Compito A - 21.01.2008 1. Calcolare la quantità in grammi di Cl 2 che occupa un volume di 682mL alla temperatura di 38,2C e alla pressione di 435 torr. Quale sarebbe la pressione del
UNIVERSITÀ DEGLI STUDI DI TORINO
 UNIVERSITÀ DEGLI STUDI DI TORINO Laurea Triennale in Scienze Biologiche TUTORAGGIO DEL CORSO DI CHIMICA GENERALE ED INORGANICA (CORSO A) AA 2017-2018 GIUSEPPE RICCIO giuseppe.riccio@edu.unito.it REAGENTI
UNIVERSITÀ DEGLI STUDI DI TORINO Laurea Triennale in Scienze Biologiche TUTORAGGIO DEL CORSO DI CHIMICA GENERALE ED INORGANICA (CORSO A) AA 2017-2018 GIUSEPPE RICCIO giuseppe.riccio@edu.unito.it REAGENTI
Esercizi bilanciamento redox
 Esercizi bilanciamento redox Bilanciare la reazione e calcolare la massima quantità (in grammi) di zinco nitrato che si ottiene facendo reagire 2.10 10 3 g di acido nitrico puro al 85.0 % p/p con un eccesso
Esercizi bilanciamento redox Bilanciare la reazione e calcolare la massima quantità (in grammi) di zinco nitrato che si ottiene facendo reagire 2.10 10 3 g di acido nitrico puro al 85.0 % p/p con un eccesso
Prova in itinere di Chimica Generale 8 Gennaio 2014
 Prova in itinere di Chimica Generale 8 Gennaio 2014 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 A Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Prova in itinere di Chimica Generale 8 Gennaio 2014 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 A Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
2 H 2 + O 2 2 H 2 O 2 Na + 2 H 2 O 2 Na + + H OH
 Le equazioni chimiche devono essere BILANCIATE, cioè devono indicare le quantità di sostanze che partecipano alla reazione: 1) Legge di conservazione della massa: in una reazione chimica non si creano
Le equazioni chimiche devono essere BILANCIATE, cioè devono indicare le quantità di sostanze che partecipano alla reazione: 1) Legge di conservazione della massa: in una reazione chimica non si creano
Osservazioni su alcuni ossidanti comuni che agiscono in soluzione acquosa
 Osservazioni su alcuni ossidanti comuni che agiscono in soluzione acquosa Esercizio: scrivere la reazione corrispondente ad ogni asterisco e bilanciare. PERMANGANATO Il permanganato di potassio K è un
Osservazioni su alcuni ossidanti comuni che agiscono in soluzione acquosa Esercizio: scrivere la reazione corrispondente ad ogni asterisco e bilanciare. PERMANGANATO Il permanganato di potassio K è un
Esame di Chimica Generale 19 Giugno 2013
 Esame di Chimica Generale 19 Giugno 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 19 Giugno 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
La reazione da bilanciare è quindi: Cu + HNO 3 CuNO 3 + NO. Le due semireazioni da bilanciare saranno: HNO 3 NO (1) Cu CuNO 3 (2)
 Introducendo rame metallico (Cu) in acido nitrico diluito (HNO 3 ) si forma nitrato di rame (CuNO 3 ) e gas ossido nitrico (NO). Scrivere l equazione chimica bilanciata della reazione. La reazione da bilanciare
Introducendo rame metallico (Cu) in acido nitrico diluito (HNO 3 ) si forma nitrato di rame (CuNO 3 ) e gas ossido nitrico (NO). Scrivere l equazione chimica bilanciata della reazione. La reazione da bilanciare
Solubilità dei sali Prodotto di solubilità
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
9065X Chimica. Modello esame svolto. Esempio di compito scritto di Chimica. Politecnico di Torino CeTeM
 svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
11. Un composto contiene il 43,64% di fosforo ed il 56,36% di ossigeno. Qual è la sua formula empirica? (P 2 O 5 )
 ESERCIZI DI CHIMICA 1. Scrivere le formule brute e le formule di struttura corrispondenti ai seguenti composti: ortofosfato di calcio, ossido di sodio, silicato di alluminio, nitrito di magnesio, pirofosfato
ESERCIZI DI CHIMICA 1. Scrivere le formule brute e le formule di struttura corrispondenti ai seguenti composti: ortofosfato di calcio, ossido di sodio, silicato di alluminio, nitrito di magnesio, pirofosfato
Scienziati in Erba Chimica
 Scienziati in Erba Chimica Acqua Oro Zucchero Le soluzioni La diluizione è il procedimento per preparare una soluzione meno concentrata da una soluzione più concentrata. Diluizione Aggiungi Solvente Moli
Scienziati in Erba Chimica Acqua Oro Zucchero Le soluzioni La diluizione è il procedimento per preparare una soluzione meno concentrata da una soluzione più concentrata. Diluizione Aggiungi Solvente Moli
Correzione Parziale del 24/01/2014
 Correzione Parziale del 24/01/2014 Compito A Esercizio 1 L analisi elementare di una sostanza ha dato il seguente risultato: C 52,2%, H 13%, O 34,8%. 3,83 g di questa sostanza vengono introdotti in un
Correzione Parziale del 24/01/2014 Compito A Esercizio 1 L analisi elementare di una sostanza ha dato il seguente risultato: C 52,2%, H 13%, O 34,8%. 3,83 g di questa sostanza vengono introdotti in un
Esame di Chimica Generale 16 Febbraio 2016
 Esame di Chimica Generale 16 Febbraio 2016 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 16 Febbraio 2016 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Facoltà di Ingegneria Corso di Chimica (9 CFU) Venerdì, 7 Febbraio 2014
 Facoltà di Ingegneria Corso di Chimica (9 CFU) Venerdì, 7 Febbraio 2014 Compito 1 1. Data la reazione (da bilanciare con metodo ionico-elettronico) "# 3 + " + "# " + "#$ 2" + 2 quale volume di NO si ottiene
Facoltà di Ingegneria Corso di Chimica (9 CFU) Venerdì, 7 Febbraio 2014 Compito 1 1. Data la reazione (da bilanciare con metodo ionico-elettronico) "# 3 + " + "# " + "#$ 2" + 2 quale volume di NO si ottiene
Esame di Chimica Generale 17 Febbraio 2017
 Esame di Chimica Generale 17 Febbraio 2017 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 17 Febbraio 2017 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
TUTORAGGIO CHIMICA A.A. 2018/2019 Tutoraggio Chimica (Prof. L. Pilia) Nicola Melis
 TUTORAGGIO CHIMICA 18.12.2018 1 Es. 1: Il fluoruro di calcio si discioglie in piccole quantità in acqua. Calcolare il valore di K ps sapendo che [Ca 2+ ] = 2,3*10-4 CaF 2 (s) Ca 2+ (aq) + 2 F - (aq) Es.
TUTORAGGIO CHIMICA 18.12.2018 1 Es. 1: Il fluoruro di calcio si discioglie in piccole quantità in acqua. Calcolare il valore di K ps sapendo che [Ca 2+ ] = 2,3*10-4 CaF 2 (s) Ca 2+ (aq) + 2 F - (aq) Es.
Esame di Chimica Generale del 14 Luglio 2017
 Esame di Chimica Generale del 14 Luglio 2017 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale del 14 Luglio 2017 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Le reazioni chimiche
 Le reazioni chimiche Le reazioni chimiche Le reazioni chimiche Le reazioni chimiche Una reazione chimica è un processo in cui una serie di sostanza (dette reagenti) viene convertita in altre sostanza (dette
Le reazioni chimiche Le reazioni chimiche Le reazioni chimiche Le reazioni chimiche Una reazione chimica è un processo in cui una serie di sostanza (dette reagenti) viene convertita in altre sostanza (dette
Esame di Chimica Generale 16 Luglio 2015
 Esame di Chimica Generale 16 Luglio 2015 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 16 Luglio 2015 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 16 Gennaio 2015
 Esame di Chimica Generale 16 Gennaio 2015 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 16 Gennaio 2015 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Programma Didattico Annuale
 LICEO SCIENTIFICO STATALE GALILEO GALILEI PdQ - 7.06 Ediz.: 1 Rev.: 0 Data 02/09/05 Alleg.: D01 PROG. M2 PROCEDURA della QUALITA' Programma Didattico Annuale Anno Scolastico 2011/2012 MATERIA : Scienze
LICEO SCIENTIFICO STATALE GALILEO GALILEI PdQ - 7.06 Ediz.: 1 Rev.: 0 Data 02/09/05 Alleg.: D01 PROG. M2 PROCEDURA della QUALITA' Programma Didattico Annuale Anno Scolastico 2011/2012 MATERIA : Scienze
Calcolo del numero di moli dei reagenti: P.M. HCl= 36 uma. 36 g/mol. n HCl = 1,9 g = 0,0528 moli
 ESERCIZI DI STECHIOMETRIA IN CUI COMPAIONO SPECIE ALLO STATO GASSOSO Es. ESERCIZIO 1 Nella reazione tra alluminio ed acido cloridrico si sviluppa idrogeno gassoso. Determinare il volume di H 2, misurato
ESERCIZI DI STECHIOMETRIA IN CUI COMPAIONO SPECIE ALLO STATO GASSOSO Es. ESERCIZIO 1 Nella reazione tra alluminio ed acido cloridrico si sviluppa idrogeno gassoso. Determinare il volume di H 2, misurato
PROVA SCRITTA DI CHIMICA GENERALE ED INORGANICA Scienze e Tecnologie per l Ambiente 3 Febbraio 2010
 3 Febbraio 2010 eventuale presenza di momento dipolare per le molecole: PH 3, BrF 5, ione perclorato. 2) Calcolare il ph a 25 C di una soluzione acquosa 0.10 M di acido cloracetico (indicare con HA) sapendo
3 Febbraio 2010 eventuale presenza di momento dipolare per le molecole: PH 3, BrF 5, ione perclorato. 2) Calcolare il ph a 25 C di una soluzione acquosa 0.10 M di acido cloracetico (indicare con HA) sapendo
Una reazione chimica rappresenta un processo di trasformaczioni in cui si rompono e si formano legami chimici. γc + δd
 Una reazione chimica rappresenta un processo di trasformaczioni in cui si rompono e si formano legami chimici αa + βb γc + δd - A e B: reagenti - C e D: prodotti - α,β,γ e δ: coefficienti stechiometrici
Una reazione chimica rappresenta un processo di trasformaczioni in cui si rompono e si formano legami chimici αa + βb γc + δd - A e B: reagenti - C e D: prodotti - α,β,γ e δ: coefficienti stechiometrici
Esempi di calcolo del numero di ossidazione
 ESERCITAZIONE 3 1 Esempi di calcolo del numero di ossidazione 1) Calcolare il numero di ossidazione del Mn nel KMnO 4. K n.o. +1 O n.o. 2 La molecola è neutra per cui: n.o. Mn + n.o. K + 4 n.o. O = 0 Mn
ESERCITAZIONE 3 1 Esempi di calcolo del numero di ossidazione 1) Calcolare il numero di ossidazione del Mn nel KMnO 4. K n.o. +1 O n.o. 2 La molecola è neutra per cui: n.o. Mn + n.o. K + 4 n.o. O = 0 Mn
SOLUZIONI DEL COMPITO DI CHIMICA DEL
 SOLUZIONI DEL COMPITO DI CHIMICA DEL 19-11-12 1) Determinare la formula minima di un composto organico contenente C, H, O e N sapendo che: a) dalla combustione di 1.278 g di tale composto si ottengono
SOLUZIONI DEL COMPITO DI CHIMICA DEL 19-11-12 1) Determinare la formula minima di un composto organico contenente C, H, O e N sapendo che: a) dalla combustione di 1.278 g di tale composto si ottengono
Reazioni lente e reazioni veloci
 CINETICA CHIMICA Reazioni lente e reazioni veloci Cinetica Chimica Studio della velocità di reazione (v) Che cos è la velocità di reazione? è la diminuzione della concentrazione molare del reagente nell
CINETICA CHIMICA Reazioni lente e reazioni veloci Cinetica Chimica Studio della velocità di reazione (v) Che cos è la velocità di reazione? è la diminuzione della concentrazione molare del reagente nell
ATTIVITA' ESTIVA 3ASA
 ATTIVITA' ESTIVA 3ASA PROBLEMI STECHIOMETRIA 1) Nella reazione chimica AsF 3 + C 2 Cl 6 AsCl 3 + C 2 Cl 2 F 4 la resa teorica di C 2 Cl 2 F 4 è stata calcolata in 1,86 mol. Se la resa in percentuale della
ATTIVITA' ESTIVA 3ASA PROBLEMI STECHIOMETRIA 1) Nella reazione chimica AsF 3 + C 2 Cl 6 AsCl 3 + C 2 Cl 2 F 4 la resa teorica di C 2 Cl 2 F 4 è stata calcolata in 1,86 mol. Se la resa in percentuale della
LICEO SCIENTIFICO STATALE Nicola Sensale NOCERA INFERIORE (SA)
 1. 14,0 g di azoto puro (N 2) sono costituiti da un numero di molecole uguale a: A) 6,02 10 23 B) 3,01 10 23 C) 1,20 10 24 D) lo stesso numero di particelle contenute in 12,0 g di 12 C 2 Un recipiente
1. 14,0 g di azoto puro (N 2) sono costituiti da un numero di molecole uguale a: A) 6,02 10 23 B) 3,01 10 23 C) 1,20 10 24 D) lo stesso numero di particelle contenute in 12,0 g di 12 C 2 Un recipiente
Le reazioni chimiche 2
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
3. Le Reazioni Chimiche
 . Le Reazioni Chimiche Equazioni Chimiche e Reazioni Chimiche il simbolismo delle reazioni chimiche il bilanciamento delle equazioni chimiche Reazioni di Precipitazione le soluzioni acquose le reazioni
. Le Reazioni Chimiche Equazioni Chimiche e Reazioni Chimiche il simbolismo delle reazioni chimiche il bilanciamento delle equazioni chimiche Reazioni di Precipitazione le soluzioni acquose le reazioni
A DIPARTIMENTO DI FARMACIA CORSO DI CHIMICA GENERALE ED INORGANICA Compito scritto 22 Settembre 2015
 A DIPARTIMENTO DI FARMACIA CORSO DI CHIMICA GENERALE ED INORGANICA Compito scritto 22 Settembre 2015 COGNOME NOME Segnare con una crocetta la risposta (una sola) che si ritiene esatta. Alle risposte esatte
A DIPARTIMENTO DI FARMACIA CORSO DI CHIMICA GENERALE ED INORGANICA Compito scritto 22 Settembre 2015 COGNOME NOME Segnare con una crocetta la risposta (una sola) che si ritiene esatta. Alle risposte esatte
RNH 3 + OH - C 0 x x x
 Università degli Studi di Roma Tor Vergata, Facoltà di Scienze MFN Corso di Laurea Triennale in Chimica Applicata, Insegnamento di Chimica Generale Modulo di Stechiometria. AA 2009/2010. Soluzioni prima
Università degli Studi di Roma Tor Vergata, Facoltà di Scienze MFN Corso di Laurea Triennale in Chimica Applicata, Insegnamento di Chimica Generale Modulo di Stechiometria. AA 2009/2010. Soluzioni prima
I concetti che devono essere acquisiti per poter svolgere gli esercizi sono:
 STECHIOMETRIA DELLE REAZIONI I concetti che devono essere acquisiti per poter svolgere gli esercizi sono: significato di formula minima e formula molecolare; significato degli indici di una formula; misura
STECHIOMETRIA DELLE REAZIONI I concetti che devono essere acquisiti per poter svolgere gli esercizi sono: significato di formula minima e formula molecolare; significato degli indici di una formula; misura
PROVA SCRITTA DI CHIMICA GENERALE ED INORGANICA Scienze e Tecnologie per l Ambiente 1 Febbraio 2013
 1 Febbraio 2013 1) a) Scrivere le formule di Lewis, l ibridizzazione dell'atomo centrale, la geometria molecolare ed eventuale presenza di momento dipolare per SF 6 e per gli anioni dei sali: fosfato di
1 Febbraio 2013 1) a) Scrivere le formule di Lewis, l ibridizzazione dell'atomo centrale, la geometria molecolare ed eventuale presenza di momento dipolare per SF 6 e per gli anioni dei sali: fosfato di
Composti chimici. Formula minima: CH 3 molecolare: C 2 H 6 di struttura: H H H C C H H H
 Stechiometria Composti chimici Formula minima: CH 3 molecolare: C H 6 di struttura: H H H C C H H H Formula di struttura Formula minima molecolare: C H 6 O Formula di struttura H O H H H H Reazioni
Stechiometria Composti chimici Formula minima: CH 3 molecolare: C H 6 di struttura: H H H C C H H H Formula di struttura Formula minima molecolare: C H 6 O Formula di struttura H O H H H H Reazioni
Il numero di ossidazione
 Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
Il numero di ossidazione Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in
NUMERO DI OSSIDAZIONE Es. HCl H + Cl - H = +1 Cl = -1 H 2. O 2 H + O 2- H = +1 O = -2 Es. NaCl Na + Cl - Na = +1 Cl = -1
 NUMERO DI OSSIDAZIONE Es. HCl H + Cl - H = +1 Cl = -1 H 2 O 2 H + O 2- H = +1 O = -2 Es. NaCl Na + Cl - Na = +1 Cl = -1 Es. H-H, O=O, Cu, Fe = 0 H: +1, (tranne che negli idruri metallici es. NaH 1) O:
NUMERO DI OSSIDAZIONE Es. HCl H + Cl - H = +1 Cl = -1 H 2 O 2 H + O 2- H = +1 O = -2 Es. NaCl Na + Cl - Na = +1 Cl = -1 Es. H-H, O=O, Cu, Fe = 0 H: +1, (tranne che negli idruri metallici es. NaH 1) O:
Chimica generale ed inorganica con laboratorio Canali A-E, F-N e O-Z Prova Scritta del 31/01/2017 COMPITO A
 Chimica generale ed inorganica con laboratorio Canali A-E, F-N e O-Z Prova Scritta del 31/01/2017 COMPITO A 1) Bilanciare la seguente reazione redox con il metodo ionico-elettronico: H 2 O 2 (aq) + H 2
Chimica generale ed inorganica con laboratorio Canali A-E, F-N e O-Z Prova Scritta del 31/01/2017 COMPITO A 1) Bilanciare la seguente reazione redox con il metodo ionico-elettronico: H 2 O 2 (aq) + H 2
ESERCIZI ESERCIZI. 1) Attribuisci un nome ai seguenti composti: a. As 2. h. H 2 SO 3 O 3. ) 2 b. HgO i. H 4. q. Sn(ClO 4. SiO 4. r. Mg(HCO 3 c.
 EERCIZI 1) Attribuisci un nome ai seguenti composti: a. As 2 3 h. 2 3 q. n(cl 4 b. g i. 4 i 4 r. Mg(C 3 c. 2 3 l. 4 2 7 s. Na 4 d. K 2 2 m. 2 ( 4 ) 3 t. 2 ( 4 ) 3 e. N 2 5 n. Ca(N 3 u.ba 2 f. Fe() 3 o.
EERCIZI 1) Attribuisci un nome ai seguenti composti: a. As 2 3 h. 2 3 q. n(cl 4 b. g i. 4 i 4 r. Mg(C 3 c. 2 3 l. 4 2 7 s. Na 4 d. K 2 2 m. 2 ( 4 ) 3 t. 2 ( 4 ) 3 e. N 2 5 n. Ca(N 3 u.ba 2 f. Fe() 3 o.
