Peso atomico (meglio massa atomica)
|
|
|
- Aniello Donati
- 9 anni fa
- Visualizzazioni
Transcript
1 Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22// stamato il 22// Web: htt://digilander.iol.it/rofzucchini Grandezze legate al modello atomico Peso atomico (meglio massa atomica) Peso atomico è la massa esressa come multilo della dodicesima arte della massa dell isotoo iù leggero del carbonio. In ratica si calcola la massa di un qualsiasi atomo relativamente alla massa indicata che vale 27 u =.66 Kg Legge della conservazione della massa (Lavoisier) In ogni reazione chimica la somma delle masse dei reagenti è uguale alla summa delle masse dei rodotti (comrendendo eventualmente i gas rodotti) Legge delle roorzioni definite (Proust) Due elementi che reagiscono er formare un certo comosto si combinano semre secondo roorzioni di masse definite e costanti Legge delle roorzioni multile Diverse masse di un elemento che si combinano con una massa fissata di un altro elemento er formare comosti diversi stanno in raorti esressi da numeri interi Vedere come esemio la roduzione di CO e CO 2 : una massa fissata di carbonio si combina con una adeguata massa di ossigeno o con una quantità doia. Mole Si chiama Mole di una sostanza la quantità di sostanza che contiene un numero di atomi o molecole ari al numero di Avogadro 23 N A = 6.2. In ratica se rendiamo ad esemio del ferro il cui eso atomico vale u ( u =.66 Kg ) e calcoliamo il eso di una mole di ferro otterremo m Fe = =.558 Kg = gr /7
2 Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22// stamato il 22// Web: htt://digilander.iol.it/rofzucchini I cori solidi tendono a dilatarsi all aumentare della temeratura. Dilatazione Le leggi di dilatazione er i solidi sono le seguenti ( λt) l = l lineare ( 2λt) S = S suerficiale ( 3λt) V = V volumica o cubica I termini con il edice indicano la lunghezza, la suerfice e il volume alla temeratura di gradi Celsius. Il coefficiente di dilatazione lineare dei solidi λ è semre un numero molto iccolo, dell ordine di 6 ; er liquidi e er i gas il C coefficiente di dilatazione aumenta (si dilatano di iù) e in articolare er tutti i gas si ha il coefficiente di dilatazione α riferito alla 273 C relazione di dilatazione cubica. Le relazioni er la dilatazione suerficiale e cubica si ricavano calcolando le dilatazioni lineari in 2 e 3 dimensioni. Considero un rettangolo di lati a e b. Avrò a = a ( λt) e b = b ( λt). La suerficie sarà quindi S = ab = a ( λ t) b ( λt) 2 2 ( λ t λ t ) S = S Essendo t λ avrò S = S ( 2λt) da cui onendo ab Con lo stesso rocedimento si giunge alla relazione V = V ( 3λt) a b S = avrò S S ( λt ) 2 = da cui avrò Gas Con i gas si assa dallo studio del unto materiale o di un sistema di oggetti abbastanza limitato, allo studio di aggregati di materia gassosa costituita da un numero molto elevato di atomi o molecole (.es. N ) e di tutti questi oggetti non si ricerca la conoscenza delle grandezze dinamiche dei singoli elementi ma si fa riferimento a grandezze fisiche relative al comlesso del gas considerato: volume, ressione, temeratura, densità. Queste sono grandezze macroscoiche direttamente legate agli stati microscoici dei singoli costituenti il gas, in articolare la terna di grandezze volume, ressione, temeratura determinano univocamente la condizione in cui si trova il gasd e quindi si arla di arametri di stato. 2/7
3 Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22// stamato il 22// Web: htt://digilander.iol.it/rofzucchini Leggi dei gas I gas seguono alcune leggi che ne definiscono il comortamento studiando una terna di grandezze fisiche: volume, ressione e temeratura. I Legge V = V ( αt) ressione costante (isobara) II Legge di Gay-Lussac = ( αt) a a volume costante (isocora) Aare essere resente una temeratura limite inferiore articolare a t = C al cui sueramento le due leggi di Gay-Lussac danno origine a situazioni aradossali quali volumi e ressioni negativi. Questa temeratura è detta anche zero assoluto essendo un limite invalicabile al raffreddamento. Va anche detto che in rossimità dello zero assoluto avvengono fenomeni articolari fra i quali cambiamenti di stato e fenomeni di suerconduzione. Legge di Boyle V = k a temeratura costante (isoterma) 3/7
4 Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22// stamato il 22// Web: htt://digilander.iol.it/rofzucchini Gas erfetto Le leggi enunciate sono valide quando il gas è rarefatto e la temeratura è lontana da quella di liquefazione. Un gas ideale come quello aena descritto è detto gas erfetto. emeratura assoluta E oortuno introdurre una nuova scala termometrica caratterizzata dalla corrisondenza dello zero con la temeratura minima raggiungibile, quindi = t ( K ) t( C) Zero assoluto Ghiaccio fondente Acqua bollente Si uò ricavare la temeratura dello zero assoluto onendo = t = = C α Sarà quindi sufficiente traslare la scala di = t V nella relazione V = V ( αt) da cui si ha C ottenendo la relazione recedentemente citata L unità di misura della temeratura assoluta sarà il Kelvin, definita attraverso i valori esressi in scala Kelvin del ghiaccio fondente e dell acqua bollente. Essendo sulla scala suddiviso il assaggio dal ghiaccio all acqua bollente in arti, il grado Kelvin e il grado centigrado avranno la stessa dimensione. Indicato con = K le equazioni delle leggi recedentemente viste diventano t V V α da cui risulta ( ) = t V = t V = Amche er la relazione sulle ressioni si avrà V V = = 4/7
5 Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22// stamato il 22// Web: htt://digilander.iol.it/rofzucchini E ossibile ricavare una equazione generale, detta equazione generale dei gas erfetti, dalle seguenti considerazioni. Considero 2 trasformazioni, una isoterma che er comodità scelgo a temeratura, seguita da una isobara che ortano lo stato del gas erfetto da ( V, ) (, V, ),. Partendo dal unto A trasformo lungo l isoterma fino allo stato raresentato dal unto B Devo usare la legge di Boyle = V V da cui V V = rasformo ora seguendo l isobara e quindi utilizzando la seconda legge di Gay-Lussac nella forma con le temerature in kelvin V V = che sostituendo sarà ottenendo infine V = V = V Ponendo V nr = con generale dei gas erfetti V V = V J R = = (costante del gas erfetto) avremo infine l equazione mol K V = nr che lega le 3 variabili di stato, V, in un unica equazione di stato, ovvero er ogni stao termodionamico del gas le grandezze fisiche, V, dovranno soddisfare all equazione generale dei gas erfetti. Imlicazione dell equazione general dei gas erfetti è la legge di Avogadro, infatti quando n =, = 273 K e 5 R =. Pa si ha V = =.224 m 3 = 22.4 l 5/7
6 Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22// stamato il 22// Web: htt://digilander.iol.it/rofzucchini scale termometriche F K C R caillare bulbo 6/7
7 Nome file d:\scuola\corsi\corso fisica\termodinamica\leggi dei gas.doc Creato il 26/3/2 7.5 Dimensione file: 4864 byte Andrea Zucchini Elaborato il 22//22 alle ore 5.52, salvato il 22// stamato il 22// Web: htt://digilander.iol.it/rofzucchini F K C R F 9 t( F) = 32 t( C) 5 K ( K) = 273 t( C) C t( C) = ( t( F) ) t( C) = ( K) 273 t( C) = 25. t( R) R t( R) = 8. t( C) 7/7
Il termoscopio. Il termoscopio è uno strumento che serve per decidere, in modo oggettivo, se un corpo è più caldo o più freddo di un altro.
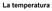 La temperatura Il termoscopio Il termoscopio è uno strumento che serve per decidere, in modo oggettivo, se un corpo è più caldo o più freddo di un altro. In quale vaschetta c è l acqua più calda? temperatura
La temperatura Il termoscopio Il termoscopio è uno strumento che serve per decidere, in modo oggettivo, se un corpo è più caldo o più freddo di un altro. In quale vaschetta c è l acqua più calda? temperatura
Unità 1. La temperatura
 Unità 1 La temperatura 1. Il termometro La sensazione di caldo e di freddo è soggettiva: per renderla misurabile si usa il termoscopio. È un recipiente di vetro con tappo forato e tubicino, contenente
Unità 1 La temperatura 1. Il termometro La sensazione di caldo e di freddo è soggettiva: per renderla misurabile si usa il termoscopio. È un recipiente di vetro con tappo forato e tubicino, contenente
Ultima verifica pentamestre. 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!
 Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
LE LEGGI DEI GAS. Prof. Michele Barcellona
 LE LEGGI DEI GAS Prof. Michele Barcellona STATO DI UN GAS Lo stato di un gas dipende dalle seguenti grandezze: Massa (in moli) Volume V Pressione P Temperatura T LE TRASFORMAZIONI DI UN GAS La modifica
LE LEGGI DEI GAS Prof. Michele Barcellona STATO DI UN GAS Lo stato di un gas dipende dalle seguenti grandezze: Massa (in moli) Volume V Pressione P Temperatura T LE TRASFORMAZIONI DI UN GAS La modifica
UNITÀ 1 La temperatura. Test
 Test 1 Quale delle seguenti affermazioni è vera? A Il termoscopio è un termometro con una scala graduata. B Il termometro è un termoscopio con la scala graduata. C Il termoscopio visualizza variazioni
Test 1 Quale delle seguenti affermazioni è vera? A Il termoscopio è un termometro con una scala graduata. B Il termometro è un termoscopio con la scala graduata. C Il termoscopio visualizza variazioni
Massa degli atomi e delle molecole
 Dallo studio dei volumi di gas nelle reazioni chimiche alle masse degli atomi e delle molecole Lo stato fisico di di un gas è descritto da tre grandezze fisiche: PRESSIONE (p) VOLUME (V) TEMPERATURA (T)
Dallo studio dei volumi di gas nelle reazioni chimiche alle masse degli atomi e delle molecole Lo stato fisico di di un gas è descritto da tre grandezze fisiche: PRESSIONE (p) VOLUME (V) TEMPERATURA (T)
La temperatura e il calore
 La temperatura e il calore Questo simbolo significa che l esperimento si può realizzare con materiali o strumenti presenti nel nostro laboratorio Questo simbolo significa che l esperimento si può realizzare
La temperatura e il calore Questo simbolo significa che l esperimento si può realizzare con materiali o strumenti presenti nel nostro laboratorio Questo simbolo significa che l esperimento si può realizzare
10. LA MISURA DELLA TEMPERATURA
 1. LA MISURA DELLA TEMPERATURA 1.1 L organizzazione della materia Tutte le sostanze sono composte da atomi. Quando due o più atomi si legano assieme formano molecole. Atomi o molecole sono le unità (particelle)
1. LA MISURA DELLA TEMPERATURA 1.1 L organizzazione della materia Tutte le sostanze sono composte da atomi. Quando due o più atomi si legano assieme formano molecole. Atomi o molecole sono le unità (particelle)
Calore e Temperatura
 PROGETTO POTENZIAMENTO DEL LABORATORIO DI FISICA LEZIONI ATTIVE Calore e Temperatura PREREQUISITO Ripetiamo il concetto di ENERGIA DEFINIZIONE TIPOLOGIE TRASFORMAZIONE DISPONIBILITA E CONSUMO FORZE DISSIPATIVE
PROGETTO POTENZIAMENTO DEL LABORATORIO DI FISICA LEZIONI ATTIVE Calore e Temperatura PREREQUISITO Ripetiamo il concetto di ENERGIA DEFINIZIONE TIPOLOGIE TRASFORMAZIONE DISPONIBILITA E CONSUMO FORZE DISSIPATIVE
Stati della materia. Esempio. Fusione e solidificazione. Esempio. Stati di aggregazione della materia
 Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
La temperatura e il calore. Documento riadattato da MyZanichelli.it Isabella Soletta Febbraio 2012 Parte 1/3
 La temperatura e il calore Documento riadattato da MyZanichelli.it Isabella Soletta Febbraio 2012 Parte 1/3 Questo simbolo significa che l esperimento si può realizzare con materiali o strumenti presenti
La temperatura e il calore Documento riadattato da MyZanichelli.it Isabella Soletta Febbraio 2012 Parte 1/3 Questo simbolo significa che l esperimento si può realizzare con materiali o strumenti presenti
ATOMI E MOLECOLE. ATOMO= unità più piccola di un elemento che ne mantiene le caratteristiche chimiche.
 1 ATOMI E MOLECOLE ATOMO= unità più piccola di un elemento che ne mantiene le caratteristiche chimiche. SIMBOLO ATOMICO= 1 o 2 lettere che identificano elemento A= numero di massa (protoni+neutroni) Z=
1 ATOMI E MOLECOLE ATOMO= unità più piccola di un elemento che ne mantiene le caratteristiche chimiche. SIMBOLO ATOMICO= 1 o 2 lettere che identificano elemento A= numero di massa (protoni+neutroni) Z=
Capitolo 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino
 Capitolo 3 LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!!
Capitolo 3 LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!!
Fisica per scienze ed ingegneria
 Serway, Jewett Fisica per scienze ed ingegneria Capitolo 19 Temperatura e principio zero della termodinamica I nostri sensi non sono affidabili per definire lo stato termico dei corpi. Ocorre un metodo
Serway, Jewett Fisica per scienze ed ingegneria Capitolo 19 Temperatura e principio zero della termodinamica I nostri sensi non sono affidabili per definire lo stato termico dei corpi. Ocorre un metodo
GAS IDEALI E REALI. Prendiamo ora in considerazione un sistema particolare termodinamico: il gas. Un gas è un fluido con le seguenti caratteristiche:
 GAS IDEALI E REALI Gas ideale. Prendiamo ora in considerazione un sistema particolare termodinamico: il gas. Un gas è un fluido con le seguenti caratteristiche: - non ha forma, ne volume proprio; - e comprimibile.
GAS IDEALI E REALI Gas ideale. Prendiamo ora in considerazione un sistema particolare termodinamico: il gas. Un gas è un fluido con le seguenti caratteristiche: - non ha forma, ne volume proprio; - e comprimibile.
Esercizi sugli stati ed il diagramma entalpico dell'aria umida
 Esercizi sugli stati ed il diagramma entalico dell'aria umida CESARE MARIA JOPPOLO, STEFANO DE ANTONELLIS, LUCA MOLINAROLI DIPARTIMENTO DI ENERGIA POLITECNICO DI MILANO C. M. Joolo, S. De Antonellis, L.
Esercizi sugli stati ed il diagramma entalico dell'aria umida CESARE MARIA JOPPOLO, STEFANO DE ANTONELLIS, LUCA MOLINAROLI DIPARTIMENTO DI ENERGIA POLITECNICO DI MILANO C. M. Joolo, S. De Antonellis, L.
Leggi dei gas Equazione di stato dei gas perfetti
 Le leggi dei gas Quale descrizione fisico-matematica si può usare per i diversi stati di aggregazione della materia? Essa è tanto più semplice (equazioni) quanto meno interagenti sono fra loro le particelle
Le leggi dei gas Quale descrizione fisico-matematica si può usare per i diversi stati di aggregazione della materia? Essa è tanto più semplice (equazioni) quanto meno interagenti sono fra loro le particelle
i tre stati di aggregazione
 Temperatura e Calore -temperatura -calore e calore specifico -lavoro in termodinamica -trasformazioni termodinamiche -trasformazioni di stato -energia interna 1 i tre stati di aggregazione solido Ordine
Temperatura e Calore -temperatura -calore e calore specifico -lavoro in termodinamica -trasformazioni termodinamiche -trasformazioni di stato -energia interna 1 i tre stati di aggregazione solido Ordine
ESERCITAZIONE 4: MONOPOLIO E CONCORRENZA PERFETTA
 ESERCITAZIONE 4: MONOPOLIO E CONCORRENZA PERFETTA Esercizio : Scelta ottimale di un monoolista e imoste Si consideri un monoolista con la seguente funzione di costo totale: C ( ) = 400 + + 0 0 La domanda
ESERCITAZIONE 4: MONOPOLIO E CONCORRENZA PERFETTA Esercizio : Scelta ottimale di un monoolista e imoste Si consideri un monoolista con la seguente funzione di costo totale: C ( ) = 400 + + 0 0 La domanda
Lezione 2. Leggi ponderali
 Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
LEGGI PONDERALI DELLA CHIMICA
 LEGGI PONDERALI DELLA CHIMICA LEGGE DI LAVOISIER (1743-1794) In ogni reazione la massa totale dei reagenti è uguale alla massa totale dei prodotti. Massa Totale R = Massa Totale P Esempio rame + zolfo
LEGGI PONDERALI DELLA CHIMICA LEGGE DI LAVOISIER (1743-1794) In ogni reazione la massa totale dei reagenti è uguale alla massa totale dei prodotti. Massa Totale R = Massa Totale P Esempio rame + zolfo
Lo stato gassoso e le sue proprietà
 Lo stato gassoso e le sue proprietà Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1
Lo stato gassoso e le sue proprietà Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 3. Le trasformazioni della materia SEGUI LA MAPPA Le leggi 1 Le leggi ANTOINE LAURENT
Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 3. Le trasformazioni della materia SEGUI LA MAPPA Le leggi 1 Le leggi ANTOINE LAURENT
Fisica Applicata, Area Infermieristica, M. Ruspa REGIMI DI MOTO DI UN FLUIDO REALE
 REGIMI DI MOTO DI UN FLUIDO REALE MOTO LAMINARE O TURBOLENTO? Dipende dalla velocita di scorrimento del fluido! VELOCITA CRITICA La velocita critica per un fluido di viscosita η e di densita d che scorre
REGIMI DI MOTO DI UN FLUIDO REALE MOTO LAMINARE O TURBOLENTO? Dipende dalla velocita di scorrimento del fluido! VELOCITA CRITICA La velocita critica per un fluido di viscosita η e di densita d che scorre
Chimica. 1) Il simbolo del Carbonio è: A) C B) Ca. C) Ce D) Cu. 2) Secondo il principio della conservazione della materia:
 Chimica 1) Il simbolo del Carbonio è: A) C B) Ca C) Ce D) Cu 2) Secondo il principio della conservazione della materia: A) Durante le reazioni chimiche il numero totale di atomi di ciascun elemento chimico
Chimica 1) Il simbolo del Carbonio è: A) C B) Ca C) Ce D) Cu 2) Secondo il principio della conservazione della materia: A) Durante le reazioni chimiche il numero totale di atomi di ciascun elemento chimico
T = t o (1.1) Nella scala kelvin il ghiaccio fonde a 273 K e l acqua bolle a 373 K. Un grado kelvin è uguale a un grado celsius
 Termologia. La temperatura è la grandezza fisica che misura lo stato termico di un sistema fisico (un corpo). 2. Scale termometriche. - Scala Celsius ( o C). Proposta nel 742. 0 o C è la temperatura di
Termologia. La temperatura è la grandezza fisica che misura lo stato termico di un sistema fisico (un corpo). 2. Scale termometriche. - Scala Celsius ( o C). Proposta nel 742. 0 o C è la temperatura di
GAS. Forze di legame intermolecolari ridotte Stato altamente disordinato
 I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
La stechiometria studia i rapporti quantitativi fra le masse delle sostanze coinvolte in una reazione chimica.
 La Stechiometria La stechiometria studia i rapporti quantitativi fra le masse delle sostanze coinvolte in una reazione chimica. La stechiometria di reazione indica in che rapporti due o più sostanze reagiscono
La Stechiometria La stechiometria studia i rapporti quantitativi fra le masse delle sostanze coinvolte in una reazione chimica. La stechiometria di reazione indica in che rapporti due o più sostanze reagiscono
1.Pressione di un Gas
 1.Pressione di un Gas Un gas è formato da molecole che si muovono in modo disordinato, urtandosi fra loro e urtando contro le pareti del recipiente che le contiene. Durante gli urti, le molecole esercitano
1.Pressione di un Gas Un gas è formato da molecole che si muovono in modo disordinato, urtandosi fra loro e urtando contro le pareti del recipiente che le contiene. Durante gli urti, le molecole esercitano
Capitolo 5 La quantità chimica: la mole
 Capitolo 5 La quantità chimica: la mole 1. La massa di atomi e molecole: un po di storia 2. Le reazioni tra i gas e il principio di Avogadro 3. Quanto pesano un atomo o una molecola? 4. La massa atomica
Capitolo 5 La quantità chimica: la mole 1. La massa di atomi e molecole: un po di storia 2. Le reazioni tra i gas e il principio di Avogadro 3. Quanto pesano un atomo o una molecola? 4. La massa atomica
Tonzig La fisica del calore
 0 Tonzig La fisica del calore c) Per stati di equilibrio caratterizzati da uno stesso valore della ressione (e del numero di moli), volume e temeratura assoluta sono direttamente roorzionali. Se 0 è il
0 Tonzig La fisica del calore c) Per stati di equilibrio caratterizzati da uno stesso valore della ressione (e del numero di moli), volume e temeratura assoluta sono direttamente roorzionali. Se 0 è il
Lezione 10 Termodinamica
 rgomenti della lezione: Lezione 0 ermodinamica relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot secondo riiio della termodinamica cenni sull entroia
rgomenti della lezione: Lezione 0 ermodinamica relazione di Mayer trasformazioni adiabatiche trasformazioni isoterme macchine termiche ciclo di arnot secondo riiio della termodinamica cenni sull entroia
UNITA DI MISURA. Le unità di misura sono molto importanti
 Le unità di misura sono molto importanti UNITA DI MISURA 1000 è solo un numero 1000 LIRE unità di misura monetaria 1000 EURO unità di misura monetaria ma il valore di acquisto è molto diverso! 1000 Euro/mese
Le unità di misura sono molto importanti UNITA DI MISURA 1000 è solo un numero 1000 LIRE unità di misura monetaria 1000 EURO unità di misura monetaria ma il valore di acquisto è molto diverso! 1000 Euro/mese
Introduzione alla Chimica. Paolo Mazza
 Introduzione alla Chimica Paolo Mazza 2 aprile 2013 Indice 1 Introduzione 2 2 Le teorie della materia 4 2.1 Teoria atomica.................................... 4 2.2 Teoria cinetica.....................................
Introduzione alla Chimica Paolo Mazza 2 aprile 2013 Indice 1 Introduzione 2 2 Le teorie della materia 4 2.1 Teoria atomica.................................... 4 2.2 Teoria cinetica.....................................
TERMODINAMICA. Il sistema è il corpo o l insieme dei corpi sotto esame.
 TERMODINAMICA SISTEMI TERMODINAMICI Il sistema è il corpo o l insieme dei corpi sotto esame. L ambiente esterno è l insieme di tutti i corpi che possono interagire con il sistema. Tipi di sistemi termodinamici
TERMODINAMICA SISTEMI TERMODINAMICI Il sistema è il corpo o l insieme dei corpi sotto esame. L ambiente esterno è l insieme di tutti i corpi che possono interagire con il sistema. Tipi di sistemi termodinamici
Esercizi di termologia
 Esercizi di termologia L. Paolucci 4 dicembre 2009 Sommario Termologia: esercizi e problemi con soluzioni. Per la classe seconda. Anno Scolastico 2009/0. Versione: v Si ricordi che cal 4,86. Quindi il
Esercizi di termologia L. Paolucci 4 dicembre 2009 Sommario Termologia: esercizi e problemi con soluzioni. Per la classe seconda. Anno Scolastico 2009/0. Versione: v Si ricordi che cal 4,86. Quindi il
LAVORO DI UN GAS. Espansione di un gas a pressione costante V A V B
 LORO DI UN GS Esansione di un gas a ressione costante L F h S h Δ 1 LORO DI UN GS Se la ressione non è costante durante la trasformazione il lavoro si calcola come somma dei lavori comiuti in iccole trasformazioni
LORO DI UN GS Esansione di un gas a ressione costante L F h S h Δ 1 LORO DI UN GS Se la ressione non è costante durante la trasformazione il lavoro si calcola come somma dei lavori comiuti in iccole trasformazioni
Programma svolto a.s. 2015/2016. Materia: fisica
 Programma svolto a.s. 2015/2016 Classe: 4A Docente: Daniela Fadda Materia: fisica Dettagli programma Cinematica e dinamica: moto circolare uniforme (ripasso); moto armonico (ripasso); moto parabolico (ripasso);
Programma svolto a.s. 2015/2016 Classe: 4A Docente: Daniela Fadda Materia: fisica Dettagli programma Cinematica e dinamica: moto circolare uniforme (ripasso); moto armonico (ripasso); moto parabolico (ripasso);
ATOMI E MOLECOLE. Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti).
 1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
La temperatura. La materia può trovarsi in tre stati diversi di aggregazione diversi: solido, liquido e gassoso
 1 La temperatura La materia può trovarsi in tre stati diversi di aggregazione diversi: solido, liquido e gassoso Qualunque sia lo stato di aggregazione, le particelle (molecole o atomi) di cui è fatta
1 La temperatura La materia può trovarsi in tre stati diversi di aggregazione diversi: solido, liquido e gassoso Qualunque sia lo stato di aggregazione, le particelle (molecole o atomi) di cui è fatta
Le leggi fondamentali della chimica
 Le leggi fondamentali della chimica Dalla bilancia di Lavoisier alla teoria atomica di Dalton Lavoisier si mise a studiare le trasformazioni della materia utilizzando in modo sistematico la bilancia. cioè,
Le leggi fondamentali della chimica Dalla bilancia di Lavoisier alla teoria atomica di Dalton Lavoisier si mise a studiare le trasformazioni della materia utilizzando in modo sistematico la bilancia. cioè,
Dilatazione termica. Δl=α l o Δt. ΔA = 2 α A o Δt. ( ) Δl=α l o Δt. α = coefficiente di dilatazione termica lineare
 Acroolis Atene Eretteo: sostituzione di armature in acciaio con strutture in itanio. Esemi di restauro negativo acciaio contro ferro sigillato in iombo. Recuero di restauri inoortuni con sostituzione mediante
Acroolis Atene Eretteo: sostituzione di armature in acciaio con strutture in itanio. Esemi di restauro negativo acciaio contro ferro sigillato in iombo. Recuero di restauri inoortuni con sostituzione mediante
FISICA. Termodinamica GAS PERFETTI. Autore: prof. Pappalardo Vincenzo docente di Matematica e Fisica
 FISICA Termodinamica GAS PERFETTI Autore: prof. Pappalardo Vincenzo docente di Matematica e Fisica SISTEMI, STATI E VARIABILI TERMODINAMICHE Tutto ciò che circonda un sistema, che può influenzare e modificare
FISICA Termodinamica GAS PERFETTI Autore: prof. Pappalardo Vincenzo docente di Matematica e Fisica SISTEMI, STATI E VARIABILI TERMODINAMICHE Tutto ciò che circonda un sistema, che può influenzare e modificare
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 5 La quantità chimica: la mole 3 Sommario 1. La massa di atomi e molecole: cenni storici 2. Quanto pesa un atomo o una molecola
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 5 La quantità chimica: la mole 3 Sommario 1. La massa di atomi e molecole: cenni storici 2. Quanto pesa un atomo o una molecola
Corso di Chimica Generale e Inorganica
 Corso di Chimica Generale e Inorganica Prof. Manuel Sergi Testi consigliati: QUALSIASI TESTO UNIVERSITARIO DI CHIMICA GENERALE VA BENE! Sacco, Pasquali, Marchetti Chimica generale e inorganica Casa Editrice
Corso di Chimica Generale e Inorganica Prof. Manuel Sergi Testi consigliati: QUALSIASI TESTO UNIVERSITARIO DI CHIMICA GENERALE VA BENE! Sacco, Pasquali, Marchetti Chimica generale e inorganica Casa Editrice
Relazioni di massa nelle reazioni chimiche. Capitolo 3
 Relazioni di massa nelle reazioni chimiche Capitolo 3 Micro mondo atomi & molecole Macro mondo grammi Massa atomica è la massa di un atomo espressa in unità di massa atomica (uma) Per definizione: 1 atomo
Relazioni di massa nelle reazioni chimiche Capitolo 3 Micro mondo atomi & molecole Macro mondo grammi Massa atomica è la massa di un atomo espressa in unità di massa atomica (uma) Per definizione: 1 atomo
GAS. Forze di legame intermolecolari ridotte Stato altamente disordinato
 I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
LA 1 a LEGGE DI VOLTA E GAY LUSSAC O DELLE ISOBARICHE
 1 LA 1 a LEGGE DI VOLTA E GAY LUSSAC O DELLE ISOBARICHE L energia si presenta in diverse forme e una delle più importanti è il calore. I fenomeni naturali sono quasi sempre accompagnati da sviluppo o assorbimento
1 LA 1 a LEGGE DI VOLTA E GAY LUSSAC O DELLE ISOBARICHE L energia si presenta in diverse forme e una delle più importanti è il calore. I fenomeni naturali sono quasi sempre accompagnati da sviluppo o assorbimento
TRASFORMAZIONI FISICHE. Le trasformazioni fisiche producono una modificazione fisica della materia e non producono nuove sostanze.
 RIPASSO DI CHIMICA TRASFORMAZIONI FISICHE TRASFORMAZIONI CHIMICHE(REAZIONI) REAGENTI PRODOTTI SINTOMI DI UNA REAZIONI ELEMENTI COMPOSTI,SIMBOLI DEGLI ELEMENTI DIFFERENZE TRA MISCUGLI E COMPOSTI LEGGE DI
RIPASSO DI CHIMICA TRASFORMAZIONI FISICHE TRASFORMAZIONI CHIMICHE(REAZIONI) REAGENTI PRODOTTI SINTOMI DI UNA REAZIONI ELEMENTI COMPOSTI,SIMBOLI DEGLI ELEMENTI DIFFERENZE TRA MISCUGLI E COMPOSTI LEGGE DI
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 6 Le leggi dei gas 1. I gas ideali e la teoria cinetico-molecolare 2. La pressione dei gas 3.
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 6 Le leggi dei gas 1. I gas ideali e la teoria cinetico-molecolare 2. La pressione dei gas 3.
MASSE ATOMICHE. Oggi è possibile misurare accuratamente le masse atomiche tramite uno strumento chiamato spettrometro di massa
 Stechiometria MASSE ATOMICHE Dal 1969 si usa una scala basata sull'isotopo 12 C : a tale isotopo è stata arbitrariamente assegnata una massa di 12 unità di massa atomica. Una unità di massa atomica (a.m.u.)=
Stechiometria MASSE ATOMICHE Dal 1969 si usa una scala basata sull'isotopo 12 C : a tale isotopo è stata arbitrariamente assegnata una massa di 12 unità di massa atomica. Una unità di massa atomica (a.m.u.)=
Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio:
 Reazioni chimiche Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio: CH 4 + 2O 2 CO 2 + 2H 2 O La reazione chimica è formata da reagenti
Reazioni chimiche Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio: CH 4 + 2O 2 CO 2 + 2H 2 O La reazione chimica è formata da reagenti
Stati di aggregazione della materia. GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti
 9. I Gas Farmacia Stati di aggregazione della materia GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti Stato solido Nello stato solido l energia di
9. I Gas Farmacia Stati di aggregazione della materia GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti Stato solido Nello stato solido l energia di
Reazioni ed Equazioni Chimiche
 ESERCITAZIONE 2 Reazioni ed Equazioni Chimiche Reazione chimica Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI) Equazioni chimiche Traduzione scritta delle reazioni chimiche
ESERCITAZIONE 2 Reazioni ed Equazioni Chimiche Reazione chimica Trasformazione di una o più sostanze (REAGENTI) in una o più sostanze (PRODOTTI) Equazioni chimiche Traduzione scritta delle reazioni chimiche
temperatura ambientale massa totale d aria contenuta nella stanza temperatura raggiunta nella stanza dalla massa d aria pressione atmosferica
 Esercizio n.21 di pagina 26. L 1 = 6 m L 2 = 8 m L 3 = 10 m t 0F = 20 F M = 28.8 kg/kmol = 28.8 g/mol m =? t 1F = 75 F p a = 1.013 10 5 Pa temperatura ambientale massa molecolare media dell aria massa
Esercizio n.21 di pagina 26. L 1 = 6 m L 2 = 8 m L 3 = 10 m t 0F = 20 F M = 28.8 kg/kmol = 28.8 g/mol m =? t 1F = 75 F p a = 1.013 10 5 Pa temperatura ambientale massa molecolare media dell aria massa
Corso di laurea in Chimica e Tecnologia Farmaceutiche Corso di Chimica Generale e Inorganica CH 3
 Corso di laurea in Chimica e Tecnologia Farmaceutiche Corso di Chimica Generale e Inorganica - LA MATERIA- COOH O O Al(OH) 4 - CH 3 Prof.ssa Ivana Fenoglio I lucidi forniti non sono da utilizzare come
Corso di laurea in Chimica e Tecnologia Farmaceutiche Corso di Chimica Generale e Inorganica - LA MATERIA- COOH O O Al(OH) 4 - CH 3 Prof.ssa Ivana Fenoglio I lucidi forniti non sono da utilizzare come
Aspetti quali-quantitativi delle reazioni chimiche unità 1, modulo B del libro unità 2, modulo E del libro
 Aspetti quali-quantitativi delle reazioni chimiche unità 1, modulo B del libro unità 2, modulo E del libro Trovare una bilancia che possa pesare un atomo è un sogno irrealizzabile. Non potendo determinare
Aspetti quali-quantitativi delle reazioni chimiche unità 1, modulo B del libro unità 2, modulo E del libro Trovare una bilancia che possa pesare un atomo è un sogno irrealizzabile. Non potendo determinare
Riassunto. Familiarizzare con i concetti fisici
 Riassunto Grandezze vettoriali e scalari Le grandezze del moto Le cause del moto: Leggi di newton! Moto in iù dimensioni Lavoro Energia e sua conservazione Quantità di moto e sua conservazione amiliarizzare
Riassunto Grandezze vettoriali e scalari Le grandezze del moto Le cause del moto: Leggi di newton! Moto in iù dimensioni Lavoro Energia e sua conservazione Quantità di moto e sua conservazione amiliarizzare
Termologia. Paolo Bagnaia - CTF Esercizi di termologia e termodinamica 1
 ermologia Paolo Bagnaia - CF - 3 - Esercizi di termologia e termodinamica 1 Esercizio Un cubetto di ghiaccio di 150 g alla temeratura di 0 C è gettato in unreciiente, i che contiene 300 g di acqua alla
ermologia Paolo Bagnaia - CF - 3 - Esercizi di termologia e termodinamica 1 Esercizio Un cubetto di ghiaccio di 150 g alla temeratura di 0 C è gettato in unreciiente, i che contiene 300 g di acqua alla
LA STRUTTURA DELLA MATERIA
 LA STRUTTURA DELLA MATERIA La materia è tutto ciò che ci circonda, che occupa uno spazio e ha una massa La materia si presenta sotto diverse forme, dette sostanze. Sono sostanze: il vetro, il legno, il
LA STRUTTURA DELLA MATERIA La materia è tutto ciò che ci circonda, che occupa uno spazio e ha una massa La materia si presenta sotto diverse forme, dette sostanze. Sono sostanze: il vetro, il legno, il
L equilibrio dei gas. Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura
 Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
GAS IDEALI (o gas perfetti )
 GAS IDEALI (o gas perfetti ) TEORIA CINETICA DEI GAS (modello di gas ideale ) molecole puntiformi moto rettilineo ed urti elastici forze attrattive - repulsive intermolecolari nulle PARAMETRI DELLO STATO
GAS IDEALI (o gas perfetti ) TEORIA CINETICA DEI GAS (modello di gas ideale ) molecole puntiformi moto rettilineo ed urti elastici forze attrattive - repulsive intermolecolari nulle PARAMETRI DELLO STATO
