La chimica della pelle
|
|
|
- Annunziata Morandi
- 9 anni fa
- Просмотров:
Транскрипт
1 La chimica della pelle 1
2 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso un atomo di carbonio. Hanno formula generale: HO R C CH O NH 2 La catena laterale R può contenere anche un altro gruppo acido o amminico, in questi casi l aminoacido acquista carattere polare. Gli aminoacidi più importanti presenti in natura sono circa duecento, ma quelli che costituiscono le proteine sono molti meno. Alcuni di questi sono detti aminoacidi fondamentali perché gli organismi umani ed animali non riescono a sintetizzarli e sono perciò costretti ad assumerli con l alimentazione. Gli aminoacidi più comuni presenti nelle proteine sono circa una ventina e differiscono tra loro per il gruppo funzionale R. 2
3 Gli amminoacidi Aminoacidi acidi OH Aminoacidi neutri CH 3 O O O CH 3 NH 2 Acido glutammico Aminoacidi basici NH 2 Valina NH 2 O NH NH NH 2 Arginina 3
4 I peptidi Sono quei composti in cui due o più aminoacidi sono legati assieme in una sequenza lineare, ed il gruppo carbossilico di ciascuno di essi è legato al gruppo amminico del seguente. In dipendenza del numero di aminoacidi legati, si può parlare di dipeptidi, tripeptidi e così via. Peptidi costituiti da numerosi aminoacidi sono chiamati polipeptidi. 4
5 Le proteine Molecole azotate ad alto peso molecolare, solubili o insolubili, che rappresentano i maggiori costituenti del protoplasma e dei tessuti animali. Sono composti da aminoacidi, uniti tra loro da legami peptidici in una o più catene polipeptidiche. A volte tali complessi sono legati ad un gruppo prostetico. Conformazione: struttura tridimensionale della proteina Proteine globulari: catena polipeptidica disposta in una struttura sferica Proteine fibrose: catene polipeptidiche disposte parallelamente lungo un unico asse, in modo da generare lunghe fibre o strati 5
6 Le proteine Struttura primaria: indica la sequenza degli aminoacidi nella catena. Struttura secondaria: si riferisce alla conformazione estesa o avvolta a spirale delle catene polipeptidiche, come sono soprattutto nelle proteine fibrose. Struttura terziaria: si riferisce alla maniera in cui è ripiegata o avvolta la catena polipeptidica per formare la struttura compatta, strettamente arrotolata, delle proteine globulari. Struttura quaternaria: denota la maniera in cui sono disposte o raggruppate nello spazio le singole catene polipeptidiche di una proteina formata da più catene. 6
7 Le proteine A seconda della conformazione spaziale che la proteina può assumere, esse si suddividono in fibrose o globulari: nelle proteine fibrose le singole catene polipeptidichethe, ciascuna delle quali è costituita da macromolecole, sono orientate lungo un asse preferenziale e sono legate attraverso legami trasversali (per lo più legami idrogeno). In questo modo la struttura acquista stabilità e perciò diventano insolubili in acqua. sono proteine fibrose il Collagene, l Elastina e la Cheratina. nelle proteine globulari, le molecole sono disposte in una forma rozzamente sferica, per l azione di deboli legami trasversali (elettrostatici o legami idrogeno) tra diverse parti della catena polipeptidica. La rottura di questi legami provoca una irreversibile modifica nella struttura proteica, con conseguente denaturazione della proteina, la quale perde gran parte delle sue proprietà biologiche, pur mantenendo inalterata la sequenza degli aminoacidi nella catena. L Albumina e la Globulina sono le proteine più importanti in questa categoria. 7
8 Le proteine Punto isoelettrico Punto o intervallo in una scala di ph al quale la concentrazione della parte anionica di un anfolita equivale alla parte cationica, il ph in cui l anfolita stesso non viene attratto in un campo magnetico. Il punto isoelettrico della maggior parte delle proteine si trova in un intervallo compreso tra 4 e 7. Il punto isoelettrico del cuoio conciato è diverso da quello della pelle grezza, ed a sua volta è differente da quello di una pelle in trippa. Esso infatti viene shiftato dalla concia al vegetale verso ph acidi, e verso l alcalinità dalla tradizionale concia cationica al cromo. Punto isoelettrico del collagene Fase di lavorazione ph Pelle grezza Pelle calcinata Pelle conciata al Cr 7,2 4,5 5,5 8
9 Il collagene Il Collagene costituisce senza dubbio la parte proteica principale della pelle. Si forma essenzialmente dalla polimerizzazione del protocollagene in composti più complessi, le microfibrille (di diametro circa 0,001µ). Queste molecole sono legate, grazie a particolari sostanze, in strutture sempre più organizzate: le fibrille (0,1µ), le fibre (5-10 µ) e fasci fibrosi (possono raggiungere anche i 100 µ). Il protocollagene è una catena di aminoacidi (lunga 2800Å e spessa 15Å) costituite da tre catene polipeptidiche, disposte a formare una spirale, e composte principalmente da glicina (ca. 30%), prolina (25%) ed idrossiprolina (25%). Le catene aminoacidiche del collagene hanno una struttura periodica che deriva dalla ripetizione di sequenze di tre aminoacidi, il primo dei quali è sempre la glicina, mentre gli altri due sono variabili (Gly-X-Y). Le tre catene polipeptiche che costituiscono il collagene sono disposte tridimensionalmente in una struttura elicoidale (helix coil). 9
10 Le cheratine Le cheratine sono diffuse in natura e costituiscono la parte principale di lana, capelli, unghie, corna, piume, scaglie ecc A seconda della loro struttura si dividono in: α-cheratine: contengono alte concentrazioni di un aminoacido solfonato, la cistina. Questo aminoacido è in grado di formare legami a ponte -S-S- tra catene proteiche, allungando la struttura, rendendola più dura e resistente. Una alta concentrazione di queste cheratine è presente infatti nelle unghie e negli zoccoli degli animali. Se il contenuto di cistina diminuisce, si ha una maggiore elasticità della catena proteica, come nel caso dei capelli o della lana. β-cheratine: non contengono cistina, e si trovano nelle fibre secrete dai ragni o dai bachi da seta. Hanno una struttura detta a libro aperto, diversa dalla struttura α-elica delle α- cheratine. Tutte le cheratine sono insolubili in acqua, nei normali solventi organici ed in soluzioni alcaline, possono però essere attaccate da agenti riducenti ed ossidanti. I primi trasformano il ponte disolfuro (-S-S-) in gruppi tiolici SH, i secondi originano gruppi SO 3. 10
11 Le globuline Sono una immensa classe di proteine comprendenti numerose molecole di interesse biologico quali gli enzimi, gli anticorpi ecc Sono assai diffusi in natura e spesso si trovano associate ad altre proteine globulari, le albumine. Entrambe hanno la caratteristica di essere solubili in acqua ed in soluzione salina. 11
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
I PROTIDI ASPETTI GENERALI
 I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
Introduzione alla biologia della cellula. Lezione 2 Le biomolecole
 Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Proprietà comuni. Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici
 Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COOH che un gruppo amminico -NH2. Le proteine, a
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COOH che un gruppo amminico -NH2. Le proteine, a
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi. Possono assumere forme diverse a seconda della funzione
 Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
LE PROTEINE -struttura tridimensionale-
 LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
a) un movimento contro gradiente di concentrazione che utilizza fonti primarie di energia
 1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
Proteine: struttura e funzione
 Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Biologia. Lezione 09/11/2010
 Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
Proteine. Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana)
 Proteine Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana) Ormoni e Fattori di crescita Anticorpi Trasporto Trasporto (emoglobina, LDL, HDL.) Fenotipo Proteine
Proteine Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana) Ormoni e Fattori di crescita Anticorpi Trasporto Trasporto (emoglobina, LDL, HDL.) Fenotipo Proteine
Aminoacidi. Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α
 Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
La struttura delle proteine
 La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
Il carbonio è l elemento di base delle biomolecole. Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici.
 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 1 Il carbonio deve acquistare quattro elettroni per essere stabile
Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 1 Il carbonio deve acquistare quattro elettroni per essere stabile
α-cheratine (α-elica) collageni e cheratine β-cheratine (conformazione β) M.N. Gadaleta
 Per la scoperta delle conformazioni più comuni delle catene polipeptidiche cioè α-elica e β-conformazione è stato particolarmente importante lo studio delle cheratine, proteine fibrose, e l analisi della
Per la scoperta delle conformazioni più comuni delle catene polipeptidiche cioè α-elica e β-conformazione è stato particolarmente importante lo studio delle cheratine, proteine fibrose, e l analisi della
Funzioni delle proteine
 Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
Immagini e concetti della biologia
 Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
LE PROTEINE SINTESI PROTEICA. funzione delle proteine nel nostro organismo
 LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
Jay Phelan, Maria Cristina Pignocchino. Scopriamo la biologia
 Jay Phelan, Maria Cristina Pignocchino Scopriamo la biologia Capitolo 2 Le molecole della vita 3 1. Le classi delle biomolecole Le biomolecole sono composti organici formati da: catene di atomi di carbonio,
Jay Phelan, Maria Cristina Pignocchino Scopriamo la biologia Capitolo 2 Le molecole della vita 3 1. Le classi delle biomolecole Le biomolecole sono composti organici formati da: catene di atomi di carbonio,
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
Le proteine. Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico.
 Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
Formazione. di un peptide.
 Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
CARBOIDRATI C H O ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO
 CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
scaricato da I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE
 Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Le molecole biologiche. Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012
 Le molecole biologiche 1 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 2 Il carbonio deve acquistare quattro elettroni
Le molecole biologiche 1 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 2 Il carbonio deve acquistare quattro elettroni
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Le biomolecole si trovano negli organismi viventi
 Le biomolecole si trovano negli organismi viventi I viventi sono formati per la maggior parte da acqua e molecole, chiamate biomolecole. Le biomolecole sono sostanze contenenti carbonio. I composti del
Le biomolecole si trovano negli organismi viventi I viventi sono formati per la maggior parte da acqua e molecole, chiamate biomolecole. Le biomolecole sono sostanze contenenti carbonio. I composti del
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH. ) ed un gruppo carbossilico ( COOH) nella stessa molecola
 Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
moli OH - /mole amminoacido
 ) ) Di seguito è riportata la curva di titolazione di un amminoacido. Osservando il grafico: a) stabilire il valore dei pka dell aminoacido b) calcolare il valore del pi e individuarlo sul grafico. c)
) ) Di seguito è riportata la curva di titolazione di un amminoacido. Osservando il grafico: a) stabilire il valore dei pka dell aminoacido b) calcolare il valore del pi e individuarlo sul grafico. c)
AMMINO ACIDI. L equilibrio è regolato dal ph
 AMMINO ACIDI AMMINO ACIDI Amminoacido: un composto difunzionale che contiene nell ambito della stessa molecola una funzione amminica -NH 2 e una funzione carbossilica -COOH α-ammino acido: I due gruppi
AMMINO ACIDI AMMINO ACIDI Amminoacido: un composto difunzionale che contiene nell ambito della stessa molecola una funzione amminica -NH 2 e una funzione carbossilica -COOH α-ammino acido: I due gruppi
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH
 Nomenclatura AMIDI Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH R-CO-O-CO-R + H 2 O Alcol + Acido estere R-COOH
Nomenclatura AMIDI Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH R-CO-O-CO-R + H 2 O Alcol + Acido estere R-COOH
9) Scrivere un disaccaride formato dal β-d-galattosio e dall α-d-n-acetil-glucosammina legati da un legame glicosidico β(1-4).
 CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
Formazione del legame peptidico:
 Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
Depilazione-calcinazione
 Depilazione-calcinazione 1 Scopo della lavorazione La depilazione serve per eliminare dalla pelle il pelo e lo strato di epidermide (formato anch esso da cheratine) che per sua natura chimica non sarebbe
Depilazione-calcinazione 1 Scopo della lavorazione La depilazione serve per eliminare dalla pelle il pelo e lo strato di epidermide (formato anch esso da cheratine) che per sua natura chimica non sarebbe
Macromolecole Biologiche. La struttura secondaria (III)
 La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI PROTEINE. sono ACIDI NUCLEICI. molecole complesse = POLIMERI. formate dall'unione di
 LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
Chimica Biologica A.A α-elica foglietto β reverse turn
 Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Percorsi di chimica organica - Soluzioni degli esercizi del testo
 ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
I composti organici. Il carbonio e i composti organici
 I composti organici Il carbonio e i composti organici COSA SONO I COMPOSTI ORGANICI? I composti organici sono composti in cui uno o più atomi di carbonio (C) sono uniti tramite un legame covalente ad atomi
I composti organici Il carbonio e i composti organici COSA SONO I COMPOSTI ORGANICI? I composti organici sono composti in cui uno o più atomi di carbonio (C) sono uniti tramite un legame covalente ad atomi
Proteine strutturali Sostegno meccanico Cheratina: costituisce i capelli Collagene: costituisce le cartilagini Proteine di immagazzinamento
 Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
Vittoria Patti MACROMOLECOLE BIOLOGICHE. 4. proteine
 Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Gli acidi nucleici, DNA (acido deossiribonucleico) e RNA (acido. ribonucleico), sono polimeri biologicamente importanti in quanto
 Gli acidi nucleici, DA (acido deossiribonucleico) e RA (acido ribonucleico), sono polimeri biologicamente importanti in quanto svolgono ruoli fondamentali nell ereditarietà e nella sintesi proteica. Sono
Gli acidi nucleici, DA (acido deossiribonucleico) e RA (acido ribonucleico), sono polimeri biologicamente importanti in quanto svolgono ruoli fondamentali nell ereditarietà e nella sintesi proteica. Sono
Fondamentali in ogni organismo, hanno molteplici ruoli:
 Le proteine Fondamentali in ogni organismo, hanno molteplici ruoli: Componenti strutturali (collagene, tessuto connettivo, citoscheletro, pelle) Trasportatori (emoglobina, albumina) Trasmettitori di messaggi
Le proteine Fondamentali in ogni organismo, hanno molteplici ruoli: Componenti strutturali (collagene, tessuto connettivo, citoscheletro, pelle) Trasportatori (emoglobina, albumina) Trasmettitori di messaggi
Chimotripsina Una proteina globulare. Glicina Un amminoacido
 Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
Di cosa è fatta una cellula?
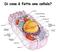 Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O,P,S rappresentano il 99% della massa della cellula - Altri elementi più rari
Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O,P,S rappresentano il 99% della massa della cellula - Altri elementi più rari
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa.
 La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE
 CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
Daniela Carotti. Dipartimento di Scienze Biochimiche III piano - stanza 310.
 Daniela Carotti Dipartimento di Scienze Biochimiche III piano - stanza 310 06 49910969 [email protected] organismo cellula componenti biochimiche acqua ioni carboidrati riserva di energia ruolo
Daniela Carotti Dipartimento di Scienze Biochimiche III piano - stanza 310 06 49910969 [email protected] organismo cellula componenti biochimiche acqua ioni carboidrati riserva di energia ruolo
α-amminoacidi O α O α R CH C O - NH 3 forma ionizzata sale interno (zwitterione) OH NH 2 forma non ionizzata (non esistente in realtà)
 Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
SOLUZIONI DEGLI ESERCIZI
 Niccolò Taddei - Biochimica apitolo 3 GLI AMMINAOIDI E LE PROTEINE DEGLI ESERIZI 1 Le proteine costituiscono una grande famiglia di biomolecole molto diffuse in natura; sono costituite da unità strutturali
Niccolò Taddei - Biochimica apitolo 3 GLI AMMINAOIDI E LE PROTEINE DEGLI ESERIZI 1 Le proteine costituiscono una grande famiglia di biomolecole molto diffuse in natura; sono costituite da unità strutturali
Gli amminoacidi ( 20) hanno proprietà strutturali comuni
 Quando nel XIX secolo gli scienziati rivolsero per la prima volta la loro attenzione alla nutrizione, in breve tempo scoprirono che i prodotti naturali contenenti azoto erano essenziali per la nutrizione
Quando nel XIX secolo gli scienziati rivolsero per la prima volta la loro attenzione alla nutrizione, in breve tempo scoprirono che i prodotti naturali contenenti azoto erano essenziali per la nutrizione
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale:
 Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
Gli amminoacidi Gli amminoacidi sono dei composti polifunzionali che hanno formula generale: N 2 Il nome ordinario degli amminoacidi prevale su quello della nomenclatura IUPA. Si possono avere α-amminoacidi,
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
