Amminoacidi Peptidi Proteine
|
|
|
- Lelia Murgia
- 8 anni fa
- Visualizzazioni
Transcript
1 Amminoacidi Peptidi Proteine
2 Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L
3 IDROFOBOCI
4 IDROFOBOCI
5 IDROFILICI
6 Secondo gruppo amminico primario IDROFILICI Gruppo imidazolico Gruppo guanidinico Secondo Gruppo carbossilico
7 FORMAZIONE DEI PONTI DISOLFURO PONTE DISOLFURO
8 PROPRIETÀ ACIDO-BASE DEGLI AMMINOACIDI Ione dipolare zwitterione Sono molecole ANFOTERE Donatore di protoni Accettore di protoni
9 La carica degli aminoacidi dipende dal ph della soluzione dal proprio punto isoelettrico carica positiva al di sotto del pi carica negativa al di sopra del pi carica netta 0 al pi
10 Peptidi & Proteine Polimeri di Amminoacidi Amminoacidi Peptidi Catene di Amminoacidi proteine
11 Il legame Peptidico
12 Il legame Peptidico Dipolo Più corto di un legame singolo Ha parziale carattere di doppio legame È rigido, non permette deformazioni e rotazioni attorno al legame C-N
13 Ciascun carbonio α appartiene contemporaneamente a due piani peptidici, i quali formano un angolo diedro Il legame peptidico è quasi sempre di tipo trans in quanto l impedimento sterico tra gruppi R di aminoacidi contigui rende poco stabile la configurazione cis
14 peptide Oligopeptide: piccolo numero di Amminoacidi Polipeptide: elevato numero di Amminoacidi, Massa molecolare < Proteina: elevato numero di Amminoacidi, Massa molecolare >
15 Proteine Semplici Contengono solo amminoacidi Coniugate Contengono gruppi chimici addizzionali associati
16 Proteine: Livelli strutturali La sequenza amminoacidica determina il ripiegamento in una specifica struttura tridimensionale che a sua volta stabilisce la funzione della proteina
17 La SEQUENZA con cui si ripetono i residui amminoacidici definisce la STRUTTURA PRIMARIA Proteine con lo stesso numero di residui aminoacidici che differiscono nella struttura primaria svolgono funzioni diverse. Le proteine si distinguono per la COMPOSIZIONE e per la SEQUENZA dei residui amminoacidici
18 Struttura secondaria delle proteine Tipica disposizione spaziale dei residui amminoacidici che sono adiacenti nella struttura primaria. Ripiegamento della catena polipeptica la cui catena principale si dispone nello spazio tridimensionale formando una struttura ripetitiva. Conformazione: organizzazione spaziale degli atomi di una proteina. α-elica, β-foglietto
19 Struttura secondaria delle proteine Per conformazione si intende l organizzazione spaziale degli atomi di una proteina. Le Conformazioni che una proteina può assumere sono quelle termodinamicamente più stabili (minore ΔG) Le proteine che si trovano nella loro conformazione funzionale vengono dette native Possiamo quindi definire la stabilità di una proteina come la sua tendenza a mantenere la conformazione nativa
20 Struttura secondaria delle proteine 1) INTERAZIONI IDROFOBICHE: Le catene laterali degli amminoacidi idrofobici tendono a raggrupparsi all interno delle proteine 2) LEGAMI H Massimo numero all interno della proteina
21 Struttura secondaria delle proteine: α elica N C C=O α - eliche delle proteine: destrorsa ogni giro di elica 3,6 residui di amminoacidi passo = 3,6 residui
22 Struttura secondaria delle proteine: α elica stabilizzata da legami idrogeno il gruppo C=O di un amminoacido forma un legame H con il gruppo N-H dell amminoacido che si trova 4 residui più avanti nella stessa catena
23 Struttura secondaria delle proteine: α elica stabilizzata da legami idrogeno L atomo di ossigeno del legame peptidico di ogni aminoacido forma legame idrogeno con l idrogeno del legame peptidico del quarto aminoacido successivo
24 PROLINA & GLICINA: residui incompatibili con la struttura dell α-elica Dove c è una prolina c è un ripiegamento
25 Struttura secondaria delle proteine: Stabilizzato tramite legami idrogeno Foglietto β tra segmenti adiacenti della catena polipeptidica
26 Struttura secondaria delle proteine: Foglietto β
27 Ripiegamenti β Collegano le estremità di due segmenti adiacenti con strutture ad α elica oppure a foglietto β
28 Struttura terziaria delle proteine Definisce la disposizione di tutti gli atomi di una proteina nello spazio tridimensionale
29 Struttura terziaria delle proteine
30 Struttura terziaria delle proteine
31 Struttura terziaria delle proteine
32 Struttura terziaria delle proteine Residui Polari Residui Apolari Gli amminoacidi apolari tendono a sfuggire il contatto con l acqua e guidano interi segmenti della proteina ad occupare zone più interne della macromolecola ripiegata Gli amminoacidi polari si trovano più frequentemente sulla superficie della proteina stessa, a contatto con le molecole d acqua
33 Struttura terziaria delle proteine le interazioni tra le catene laterali degli aminoacidi determinano il modo in cui una lunga catena polipeptidica si ripiega nella forma tridimensionale della proteina
34 Ripiegamento non corretto delle proteine
35 Struttura quaternaria delle proteine Complessi tridimensionali che derivano dall associazione di due o più catene polipeptidiche SUBUNITA
36 Considerando i diversi livelli di organizzazione strutturale possiamo classificare le proteine in base a struttura e solubilità Globulari Fibrose la maggior parte degli enzimi e delle proteine regolatrici determinano la resistenza, la forma e la protezione esterna delle cellule
37 Classificazione, Struttura & Funzione delle proteine Proteine fibrose: catene polipeptidiche disposte in lunghi fasci o foglietti. Normalmente è presente un solo elemento di struttura 2 a ripetuto più volte. Prevalente funzione strutturale. Insolubili in acqua. Proteine globulari: Segmenti di una catena o di catene polipeptidiche diverse si avvolgono l uno sull altro catene polipeptidiche ripiegate e forma sferica. Normalmente sono presenti più tipi di struttura 2 a. Prevalente funzione regolatoria ed enzimatica.
38 Gli Enzimi
39 catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche Gli Enzimi Sono le proteine più importanti e più specializzate Presentano un elevato grado di specificità per il substrato Operano in soluzioni acquose con temperature e ph blandi
40 Struttura generale degli enzimi Sono proteine globulari complesse : Addotto enzima-substrato Parte proteica Parte non-proteica Cofattore (ione metallico) Coenzima (natura organica: vitamina o altro) Gruppo Prostetico
41 SITO ATTIVO: specifica porzione dell enzima, deputata al legame con il substrato che porta alla formazione dell addotto ES Addotto ES
42 Proprietà dei Catalizzatori I catalizzatori sono sostanze capaci di abbassare l energia di attivazione rendendo piú facile la formazione dell addotto ES: la reazione diviene quindi piú veloce.
43
44 La K equilibrio è correlata alla variazione di energia libera ΔG = in condizioni standard: 25 C, 1M K eq = [P] [S] ΔG = - R T lnk eq Un ΔG negativo indica che la formazione dei prodotti è favorita termodinamicamente, ma non fornisce informazioni sulla velocità della reazione
45 E+S ES EP E+P viene resa più veloce sia la reazione diretta, sia la reazione inversa viene raggiunto più velocemente l equilibrio ΔG =energia di attivazione G prodotti -G substrati ( G ) < 0 Reazione esoergonica
46 E+S ES EP E+P Stato di transizione (ǂ) Stato di transizione (ǂ) Reazione ESOERGONICA Reazione ENDOERGONICA
47 A(S) B(P) I catalizzatori abbassano l energia di attivazione delle reazioni favoriscono lo stato di transizione formando l addotto ES G prodotti -G substrati ( G ) < 0 Reazione esoergonica
48
49 Molti catalizzatori non facilitano la formazione dello stato di transizione, ma sostituiscono la reazione difficile con 2 o più reazioni entrambe con uno stato di transizione facile da formare E+S ES EP E+P Risultato: accelerazione della reazione globale. ΔG =energia di attivazione
50
51 A(S) B(P)
52 ADDOTTO Enzima-Substrato L energia usata per aumentare la velocità enzimatica deriva dalle interazioni deboli (legami idrogeno, interazioni ioniche e idrofobiche) che si formano tra enzima e substrato ENERGIA di LEGAME
53 Gli enzimi sono caratterizzati da elevata specificità
54 CATALISI ENZIMATICA
55 CATALISI ENZIMATICA
56 CATALISI ENZIMATICA Adattamento indotto
57 Enzimi: Aumentano la velocità di una reazione ma NON ne modificano l equilibrio Consideriamo la generica equazione: a A + b B c C + d D Definiamo costante di equilibrio K eq K eq = [P] [S] K eq [ C] [ A] c a [ D] [ B] d b a temperatura costante! Le concentrazioni sono all equilibrio La velocità della reazione diretta è uguale alla velocità della reazione inversa
58 CINETICA ENZIMATICA velocità di una reazione (V): numero di molecole di substrato che si trasformano in prodotto nell unità di tempo. (V) si esprime come mmol/l di prodotto formatosi in un minuto (mm/min). Velocità iniziale V 0 Nelle analisi delle reazioni enzimatiche si utilizzano soltanto le velocità di reazione iniziali (v 0 ), quelle che si misurano non appena si mescolano l enzima ed il substrato. In tal modo la variazione di [S] può essere considerata trascurabile.
59 FATTORI CHE MODIFICANO LA VELOCITA DELLE REAZIONI ENZIMATICHE: 1) ph (curva a campana) 2) temperatura (curva bifasica a causa della denaturazione) 3) [S] (iperbole rettangolare a causa della saturazione) 4) inibitori CINETICA ENZIMATICA
60 CINETICA ENZIMATICA: ph Ciascun enzima ha un ph ottimale al quale la reazione è catalizzata con la massima efficienza. Esso in genere rispecchia il ph dell ambiente in cui l enzima svolge normalmente le sue funzioni. La concentrazione degli H + (ph) influenza l attività enzimatica modificando la geometria del sito attivo e la distribuzione delle cariche elettriche dei gruppi coinvolti nel legame del substrato o nel processo catalitico stesso. Valori di ph estremi possono anche provocare la denaturazione dell enzima.
61 CINETICA ENZIMATICA: ph
62 CINETICA ENZIMATICA: temperatura La velocità di reazione aumenta con l aumentare della temperatura fino a raggiungere un picco. Un ulteriore innalzamento della temperatura provoca una diminuzione della velocità di reazione a causa della denaturazione dell enzima.
63 CINETICA ENZIMATICA: temperatura
64 CINETICA ENZIMATICA: concentrazione del substrato La velocità di una reazione catalizzata da un enzima aumenta all aumentare della concentrazione del substrato fino a raggiungere una velocità massima (V max ). In questa condizione i siti attivi dell enzima sono saturi del substrato Quando tutto l enzima è saturato con il substrato: [ES] = [E tot ] V 0 = Vmax
65 CINETICA DELLO STATO STAZIONARIO STATO PRESTAZIONARIO: E + S S in grande eccedenza [ES ] [ES ] costante nel tempo
66 La curva che esprime la relazione tra V 0 e S ha un andamento iperbolico ed è espressa algebricamente dalla equazione di Michaelis-Menten Costante di Michaelis e Menten La Km è quella concentrazione di substrato a cui la V 0 è pari a metà della Vmax
67 L equazione di Michaelis-Menten descrive la variazione della velocità di reazione al variare della concentrazione del substrato. v 0 = velocità iniziale della reazione V max = velocità massima K m = costante di Michaelis-Menten [S] = concentrazione del substrato
68 Caratteristiche della K m La K m è pari alla concentrazione di substrato alla quale la velocità della reazione (V 0 ) è 1/2 della V max. La K m riflette l affinità dell enzima per il substrato: K m piccola = alta affinità dell enzima per il substrato K m grande = bassa affinità dell enzima per il substrato. Ogni enzima ha una K m caratteristica per un dato substrato. La K m non varia al variare della [E].
69 I PARAMETRI CINETICI POSSONO ESSERE USATI PER CONFRONTARE LE ATTIVITA DEGLI ENZIMI
70 Inibizione Enzimatica Inibitori ostacolano o impediscono il funzionamento degli enzimi Inibitore reversibile: Ha un azione temporanea, è possibile allontanare l inibitore dall enzima, consentendo il regolare esplicarsi dell attività catalitica. inibitore irreversibile: la ripresa dell attività enzimatica non è possibile, in quanto non è possibile in nessun modo allontanare l inibitore dall enzima
71 Inibizione Enzimatica Un Inibitore di tipo competitivo si lega al sito attivo dell enzima, precludendo il legame dell enzima stesso col substrato. Si forma un addotto enzima-inibitore, che non può evolvere verso il prodotto e che sottrae enzima alla reazione catalitica.
72 Inibizione Enzimatica un inibitore incompetitivo si lega ad un sito distinto da quello del substrato, legandosi al complesso ES
73 Inibizione Enzimatica un inibitore misto si lega ad un sito distinto da quello del substrato, ma si può legare sia all addotto ES sia al solo E
74 Enzimi regolatori Aumentano o diminuiscono la loro attività catalitica in risposta a determinati segnali tali enzimi non seguono la cinetica di Michaelis Menten e sono responsabili della modulazione della velocità con cui decorre interi processi metabolici struttura quaternaria (due o più subunità proteiche) in essi esistono più siti chimicamente attivi ENZIMI ALLOSTERICI Legano Effettori o MODULATORI: molecola che interagendo con l enzima in siti lontani dal sito attivo, esercita un effetto positivo o negativo sulla sua attività Modificazioni covalenti reversibili
75 Enzimi regolatori Enzimi allosterici: Agiscono mediante legame non covalente e reversibile di Modulatori allosterici Modificazione allosterica OMOTROPICI Il substrato è esso stesso un modulatore ETEROTROPICI Il modulatore è una molecola diversa dal substrato
76 Enzimi regolatori
77 Enzimi regolatori Inibizione retroattiva Gli enzimi allosterici possono essere inibiti dai prodotti terminali di una via metabolica un enzima regolatore controlla le quantità di sostanze che devono essere trasformate in una via metabolica (catalizza la reazione più lenta, in genere la prima di una serie)
78 Inibizione retroattiva Enzimi regolatori
79 Enzimi regolatori modificazione covalente reversibile
80 Enzimi regolatori modificazione covalente reversibile
81 Enzimi regolatori Scissione proteolitica di un precursore (zimogeno inattivo) modificazione covalente irreversibile
82 Enzimi regolatori
83 Enzimi regolatori
84 Coenzimi e Cofattori Molti enzimi per poter essere attivi richiedono la presenza di ioni metallici o di altre molecole, talvolta legate con legami covalenti: Coenzimi o cofattori Cofattore: ione o molecola NON PROTEICA la cui presenza è indispensabile perché l enzima possa svolgere la sua attività catalitica. Interagiscono con l apoezima solo durante il ciclo catalitico. Tra i cofattori hanno rilevante importanza gli ioni di alcuni elementi metallici, Ca, Mg, Mn, Zn, Cu (tutti gli enzimi che utilizzano ATP richiedono la presenza di ioni Mg 2+ ).
85 Coenzimi e Cofattori Molti enzimi per poter essere attivi richiedono la presenza di ioni metallici o di altre molecole, talvolta legate con legami covalenti: Coenzimi o cofattori Coenzimi: sono molecole organiche (alcuni di essi derivano da vitamine idrosolubili) prendono parte direttamente all azione catalitica dell enzima spesso si ritrovano modificati chimicamente al termine della reazione (es. NAD + / NADH).
86 Coenzimi I coenzimi da soli sono cataliticamente inattivi ma, unendosi all apoenzima, formano l enzima cataliticamente attivo. Uno stesso coenzima può essere unito a diverse proteine per cui si deduce che la specificità dell azione enzimatica è proprietà dell apoenzima e non del coenzima. La maggior parte dei coenzimi è strettamente legata alle vitamine. Per diventare coenzima, la vitamina subisce delle trasformazioni che vanno dalla semplice fosforilazione (uno dei casi più comuni) a trasformazioni più complesse. La trasformazione della vitamina in coenzima avviene all interno delle cellule ed è di natura enzimatica. I coenzimi possono essere classificati in gruppi diversi, in base al tipo di reazione catalizzata.
87 Coenzimi Coenzimi derivati dalle vitamine idrosolubili Le vitamine sono necessarie per la sintesi di coenzimi e devono essere ottenute con la dieta Piante e microorganismi sono produttori di vitamine La maggior parte delle vitamine deve essere ulteriormente trasformata per generare coenzimi
88 Cofattori Niacina (Vit. B 3 o PP) NAD + e NADP + La niacina (acido nicotinico) è un precursore di NAD + e NADP + NAD = Nicotinamide Adenina Dinucleotide NADP = Nicotinamide Adenina Dinucleotide Fosfato NAD + e NADP + fungono da coenzimi in molte reazioni di ossidoriduzione
89 Cofattori NAD + NADH
90 Cofattori Il NAD + funziona da deidrogenante: porta via 2 atomi di H dal substrato. Uno viene perso sotto forma di ione H +, l altro viene perso come idruro H - che si lega immediatamente all anello piridinico cationico
91 Coenzimi Riboflavina (Vit. B 2 ) coenzimi FAD e FMN FAD = Flavin Adenin Dinucleotide FMN = Flavin mono-nucleotide I coenzimi Flavinici sono coinvolti in reazioni di ossido riduzione catalizzate da molti enzimi (flavoenzimi o flavoproteine) Uova, latte, carne, cereali
92 Coenzimi
93 Coenzimi Partecipa alle reazioni di trasferimento di radicali ACILICI, come quelli che avvengono nell ossidazione di carboidrati, acidi grassi e aminoacidi. Acido Pantotenico (Vit B5) Coenzima A (CoA) I gruppi acile sono legati covalentemente al gruppo SH del CoA a formare tioesteri FONTE: Cereali, legumi, carne
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE
 CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA I ESERCITAZIONE 1) Che tipo di ibridazione ha il carbonio coinvolto nel doppio legame degli alcheni? Descrivi brevemente. Alcheni Ibridazione sp 2 2s p x p
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre
 Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
LE PROTEINE -struttura tridimensionale-
 LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
Aminoacidi. Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α
 Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Proprietà comuni. Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici
 Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi. Possono assumere forme diverse a seconda della funzione
 Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH
 Nomenclatura AMIDI Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH R-CO-O-CO-R + H 2 O Alcol + Acido estere R-COOH
Nomenclatura AMIDI Alcol + alcol etere R-OH + R -OH R-O-R + H 2 O Aldeide + alcol emiacetale R-CHO + R -OH R-CHOH-O-R Acido + Acido anidride R-COOH + R -COOH R-CO-O-CO-R + H 2 O Alcol + Acido estere R-COOH
I PROTIDI ASPETTI GENERALI
 I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
IL GRUPPO EME. PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici.
 IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
INTRODUZIONE AL METABOLISMO
 INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA
 Cap.15 BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA I Legge della Termodinamica: Il contenuto energetico dell
Cap.15 BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA I Legge della Termodinamica: Il contenuto energetico dell
Proteine. Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana)
 Proteine Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana) Ormoni e Fattori di crescita Anticorpi Trasporto Trasporto (emoglobina, LDL, HDL.) Fenotipo Proteine
Proteine Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana) Ormoni e Fattori di crescita Anticorpi Trasporto Trasporto (emoglobina, LDL, HDL.) Fenotipo Proteine
Percorsi di chimica organica - Soluzioni degli esercizi del testo
 ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
Chimica Biologica A.A α-elica foglietto β reverse turn
 Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
REGOLAZIONE DELL ATTIVITA ENZIMATICA 1) MODULAZIONE ALLOSTERICA NON-COVALENTE (REVERSIBILE)
 REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
Formazione del legame peptidico:
 Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
catabolismo anabolismo
 Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
BIOLOGIA GENERALE 19 dicembre 2006
 Biologia generale Massolo Alessandro [email protected]; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
Biologia generale Massolo Alessandro [email protected]; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
scaricato da I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE
 Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
La chimica della pelle
 La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
La struttura delle proteine
 La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
COMPORTAMENTO ANFOTERO DEGLI AA
 Proprietà acido-basiche degli aminoacidi FORMA NON IONICA Non esiste a nessun valore di ph FORMA ZWITTERIONICA È la forma prevalente a ph 7 COMPORTAMENTO ANFOTERO DEGLI AA CARICA NETTA +1 CARICA NETTA
Proprietà acido-basiche degli aminoacidi FORMA NON IONICA Non esiste a nessun valore di ph FORMA ZWITTERIONICA È la forma prevalente a ph 7 COMPORTAMENTO ANFOTERO DEGLI AA CARICA NETTA +1 CARICA NETTA
Introduzione alla biologia della cellula. Lezione 2 Le biomolecole
 Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Gli enzimi e la catalisi
 Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
Chimotripsina Una proteina globulare. Glicina Un amminoacido
 Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
Chimotripsina Una proteina globulare Glicina Un amminoacido - In teoria un numero enorme di differenti catene polipeptidiche potrebbe essere sintetizzato con i 20 amminoacidi standard. 20 4 = 160.000 differenti
Funzioni dei nucleotidi
 Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Energia e metabolismi energetici
 Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
Helena Curtis N. Sue Barnes
 Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
GLI ENZIMI: proteine con attività CATALITICA
 Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Le proteine. Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico.
 Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Energia di attivazione
 Energia di attivazione La maggior parte delle reazioni chimiche avviene con un apporto iniziale di energia per poter prendere l avvio procedere alla giusta velocità. Questo vale per le reazioni esoergoniche
Energia di attivazione La maggior parte delle reazioni chimiche avviene con un apporto iniziale di energia per poter prendere l avvio procedere alla giusta velocità. Questo vale per le reazioni esoergoniche
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Macromolecole Biologiche. La struttura secondaria (III)
 La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
BIOCHIMICA APPLICATA e CLINICA
 BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
INTRODUZIONE AL METABOLISMO. dal gr. metabolè = trasformazione
 INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
Amminoacidi/peptidi/proteine. Chimica Organica II
 Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
ENERGIA LIBERA DI GIBBS (G)
 METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
Diagramma di Ramachandran
 Chimica Biologica A.A. 2010-2011 Diagramma di Ramachandran Diagramma di Ramachandran Catena polipeptidica La formazione in successione di legami peptidici genera la cosiddetta catena principale o scheletro
Chimica Biologica A.A. 2010-2011 Diagramma di Ramachandran Diagramma di Ramachandran Catena polipeptidica La formazione in successione di legami peptidici genera la cosiddetta catena principale o scheletro
Seminario. Ciclo di Krebs 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A
 Seminario PASSO PER PASSO 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A Il ciclo dell acido citrico inizia con la reazione di condensazione di un unità con 4
Seminario PASSO PER PASSO 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A Il ciclo dell acido citrico inizia con la reazione di condensazione di un unità con 4
Enzimi come catalizzatori biologici
 Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
ACIDI GRASSI INSATURI
 LIPIDI ACIDI GRASSI SATURI ACIDI GRASSI INSATURI TRIGLICERIDI TRIGLICERIDI Grassi neutri o lipidi semplici glicerolo + 1 acido grasso monogliceride glicerolo + 2 acidi grassi digliceride glicerolo + 3
LIPIDI ACIDI GRASSI SATURI ACIDI GRASSI INSATURI TRIGLICERIDI TRIGLICERIDI Grassi neutri o lipidi semplici glicerolo + 1 acido grasso monogliceride glicerolo + 2 acidi grassi digliceride glicerolo + 3
Biologia. Lezione 09/11/2010
 Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
Biologia Lezione 09/11/2010 Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono macromolecole formate da unità (MONOMERI)
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COOH che un gruppo amminico -NH2. Le proteine, a
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COOH che un gruppo amminico -NH2. Le proteine, a
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione -
 Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più
 Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Le molecole biologiche. Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012
 Le molecole biologiche 1 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 2 Il carbonio deve acquistare quattro elettroni
Le molecole biologiche 1 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 2 Il carbonio deve acquistare quattro elettroni
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30)
 TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
PIANO DI LAVORO ANNUALE
 PIANO DI LAVORO ANNUALE Classe 5D2 A.S. 2015/2016 Disciplina: CHIMICA ORGANICA E BIOCHIMICA Docente: prof.ssa Palma Elena Ore settimanali: 4 (2 laboratorio) Libro di testo: Rippa, Ricciotti La chimica
PIANO DI LAVORO ANNUALE Classe 5D2 A.S. 2015/2016 Disciplina: CHIMICA ORGANICA E BIOCHIMICA Docente: prof.ssa Palma Elena Ore settimanali: 4 (2 laboratorio) Libro di testo: Rippa, Ricciotti La chimica
FUNZIONI BIOLOGICHE DELLE PROTEINE
 FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica
 Brevetti Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica Committente:
Brevetti Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica Committente:
Esempi di funzioni svolte dalle proteine
 Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
Di cosa è fatta una cellula?
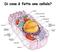 Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O rappresentano il 96% della massa della cellula - Altri component frequenti
Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O rappresentano il 96% della massa della cellula - Altri component frequenti
Formazione. di un peptide.
 Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
CARBOIDRATI C H O ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO
 CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
La catalisi enzimatica. Copyright 2013 Zanichelli editore S.p.A.
 La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Concetti chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Concetti chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
Immagini e concetti della biologia
 Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Introduzione allo studio del metabolismo Parte I
 Introduzione allo studio del metabolismo Parte I FOTOTROFI Le piante ed alcuni tipi di batteri ricavano l energia libera dal Sole mediante la fotosintesi, un processo in cui l energia luminosa è convertita
Introduzione allo studio del metabolismo Parte I FOTOTROFI Le piante ed alcuni tipi di batteri ricavano l energia libera dal Sole mediante la fotosintesi, un processo in cui l energia luminosa è convertita
Gli amminoacidi ( 20) hanno proprietà strutturali comuni
 Quando nel XIX secolo gli scienziati rivolsero per la prima volta la loro attenzione alla nutrizione, in breve tempo scoprirono che i prodotti naturali contenenti azoto erano essenziali per la nutrizione
Quando nel XIX secolo gli scienziati rivolsero per la prima volta la loro attenzione alla nutrizione, in breve tempo scoprirono che i prodotti naturali contenenti azoto erano essenziali per la nutrizione
le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. STRUTTURA TERZIARIA
 STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
Di cosa è fatta una cellula?
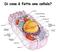 Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O,P,S rappresentano il 99% della massa della cellula - Altri elementi più rari
Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O,P,S rappresentano il 99% della massa della cellula - Altri elementi più rari
Macromolecole Biologiche. La struttura secondaria (I)
 La struttura secondaria (I) La struttura secondaria Struttura primaria PRPLVALLDGRDETVEMPILKDVATVAFCDAQSTQEIHE Struttura secondaria La struttura secondaria Le strutture secondarie sono disposizioni regolari
La struttura secondaria (I) La struttura secondaria Struttura primaria PRPLVALLDGRDETVEMPILKDVATVAFCDAQSTQEIHE Struttura secondaria La struttura secondaria Le strutture secondarie sono disposizioni regolari
Funzioni delle proteine
 Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
I materiali della vita
 I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
INIBIZIONE ENZIMATICA REVERSIBILE
 INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA 2 ESERCITAZIONE
 CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA 2 ESERCITAZIONE 1) Il collagene è una proteina (globulare / fibrosa). È formata da tre (catene alfa/alfa eliche) con andamento (destrorso/sinistrorso) che vanno
CORSO DI BIOCHIMICA PER INGEGNERIA BIOMEDICA 2 ESERCITAZIONE 1) Il collagene è una proteina (globulare / fibrosa). È formata da tre (catene alfa/alfa eliche) con andamento (destrorso/sinistrorso) che vanno
STRUTTURA TRIDIMENSIONALE DELLE PROTEINE
 STRUTTURA TRIDIMENSIONALE DELLE PROTEINE Biologia della Cellula Animale 2016 1 STRUTTURA PROTEINE Cooper: The Cell, a Molecular Approach, 2 nd ed. http://en.wikipedia.org/wiki/protein_structure STRUTTURA
STRUTTURA TRIDIMENSIONALE DELLE PROTEINE Biologia della Cellula Animale 2016 1 STRUTTURA PROTEINE Cooper: The Cell, a Molecular Approach, 2 nd ed. http://en.wikipedia.org/wiki/protein_structure STRUTTURA
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Le molecole biologiche. Le proteine
 Le molecole biologiche Le proteine Le proteine sono macromolecole che costituiscono la maggior parte delle strutture cellulari ed extra-cellulari Così come nel caso di lipidi e carboidrati, anch esse
Le molecole biologiche Le proteine Le proteine sono macromolecole che costituiscono la maggior parte delle strutture cellulari ed extra-cellulari Così come nel caso di lipidi e carboidrati, anch esse
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
