INIBIZIONE ENZIMATICA REVERSIBILE
|
|
|
- Filiberto Lentini
- 8 anni fa
- Visualizzazioni
Transcript
1 INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax, la Km o entrambe. Quando l inibitore si lega all enzima si stabilisce un equilibrio che porta alla formazione del complesso inattivo EI. E + I EI Kdiss = K i = Costante di inibizione [E] [I] [EI] INIBITORI COMPETITIVI INIBITORI NON COMPETITIVI INIBITORI INCOMPETITIVI
2 INIBITORI COMPETITIVI Competono con il substrato per il sito attivo. Sono in genere analoghi strutturali del substrato. Rimuovono l enzima dal ciclo catalitico naturale. In presenza di Inibitore COMPETITIVO: Aumenta la dissociazione del complesso ES e quindi aumenta la k -1 k 1 k -1 Km = k -1 k 1 Km aumenta (Km app ) CONCENTRAZIONI SATURANTI DI SUBSTRATO v 0 = Vmax [S] Km app + [S] Vmax rimane inalterata, In presenza di [S] saturanti l inibitore è scalzato dal sito attivo.
3 v 0 (μm/min) Vmax inalterata ½ Vmax In presenza di Inibitore competitivo Km aumenta (Km app ) 1/ Vmax =invariato Km Kmapp 1 mm - 1/Km = diventa meno negativo Assenza di I comp.
4 Inibizione competitiva: il trattamento con etanolo dell'avvelenamento da metanolo L Etanolo è il più comune substrato dell enzima: Alcool deidrogenasi (ADH), presente nel fegato. Altri alcoli possono essere substrati di quest enzima: per es. il METANOLO ALCOOL- DEIDROGENASI Intossicazione da metanolo: è trasformato in un prodotto tossico che NON può essere metabolizzato. ALCOOL- DEIDROGENASI Può essere metabolizzata: non è tossica per l organismo e viene convertita in acetato che può essere utilizzato dal fegato Nei casi di intossicazione da metanolo si può usare un eccesso di etanolo, che va a competere per l ADH e rimuove il metanolo dal sito attivo dell enzima, consente quindi la rimozione di METOH attraverso i reni.
5 INIBIZIONE DA PARTE DEL PRODOTTO DELLA REAZIONE In alcuni casi, in reazioni irreversibili i prodotti della reazione agiscono da INIBITORI COMPETITIVI REVERSIBILI dell enzima che catalizza la loro formazione. (per es.: esochinasi, glucosio-6-fosfato fosfatasi) glucosio ATP esochinasi glucosio-6-fosfato _ glucosio-6-fosfato glucosio glucosio-6-fosfato fosfatasi _ P i
6 v 0 (μm/min) IN. INCOMPETITIVI Si legano all enzima solo dopo che si è già formato il complesso ES. k 1 k -1 ES viene rimosso dal mezzo e quindi la Vmax diminuisce (Vmax = k 2 [ES] = k 2 [E] tot ) A B Vmax Se diminuisce [ES] tutto l equilibrio si sposta verso la formazione di ES e quindi di ESI. Dunque, diminuisce anche la Km. Apparentemente aumenta l affinità dell enzima per il substrato ½ Vmax Vmax app + In. INCOMP In presenza di In. INCOMP aumenta la k 1 e quindi: Km app Km [S] mm Km = k -1 k 1 Km diminuisce (Km app ) in assenza di Inibitori
7 ½ Vmax v 0 (μm/min) Inibitore assente La Vmax è più bassa in presenza di un inibitore incompetitivo Vmax 1/V 0 1/Vmax = aumenta perché diminuisce Vmax Vmax app 1/Vmax + In. INCOMP - 1/Km app La pendenza della retta è la stessa Km app Km [S] mm - 1/Km La Km è più bassa in presenza di un inibitore incompetitivo
8 v 0 (μm/min) INIBITORI NON COMPETITIVI PURI Possono legarsi all enzima libero oppure al complesso ES Vmax A Km aumenta Km diminuisce B Vmax app ½ Vmax + In. NON COMP. ½ Vmax app Diminuisce la Vmax (perchè il Complesso ES è sottratto dal mezzo). La Km rimane invariata (con i NON-competitivi PURI), perché l inattivazione dell enzima libero (E EI) e quella del complesso (ES ESI) avvengono con la stessa velocità. Km [S] mm Diverse sostanze tossiche sono inibitori non competitivi di enzimi: METALLI PESANTI (MERCURIO, PIOMBO) inibiscono numerosi enzimi agendo sui gruppi -SH di residui di cisteina dell enzima o di cofattori enzimatici.
9 puro 1/v 0 1 Vmax app 1 Vmax -1 Km
10 INIBIZIONE IRREVERSIBILE Gli inibitori irreversibili si legano FORTEMENTE (in modo COVALENTE o NON- COVALENTE) all enzima inattivandolo. Reagiscono con i gruppi funzionali del sito attivo impedendo al substrato di accedervi o impedendo la sua trasformazione. Analoghi dello stato di transizione Bloccano enzimi con residui di Ser nel sito attivo: Proteasi seriniche (chimotrispina ); Esterasi a serina (Acetilcolinesterasi) Es: composti organofosforici (DFP (diisopropilfluorofosfato), Sarin..), fisostigmina (alcaloide vegetale) DFP addotto inattivo Sono composti con una struttura tetraedrica intorno all atomo di fosforo che assomiglia allo stato di transizione della reazione catalizzata da tali enzimi. Stabiliscono interazioni col sito attivo che sono molto più forti di quelle che si otterrebbero nel complesso ES. J. M. Berg et al., BIOCHIMICA, 7/E, Zanichelli editore S.p.A. Copyright 2012
11 Sono molto selettivi. Hanno gruppi funzionali che si Analoghi del substrato legano specificatamente e stabilmente con il sito di legame per il substrato e che reagiscono con il sito catalitico. Es: TPCK (N-tosil-Lfenilalaninaclorometilchetone) Blocca specificatamente la chimotripsina (proteasi a serina) Possiede un gruppo fenilico che va a legarsi nel sito di legame per il substrato (tasca idrofobica dell enzima) e un atomo di cloro che si trova nella giusta posizione per reagire con l His-57 del sito catalitico della chimotripsina. Sito attivo della chimotripsina ADDOTTO PERMANENTE
12 Inibitori suicidi Molecole che si legano al sito attivo dell enzima, dando inizio al ciclo catalitico e quando iniziano ad essere trasformate dall enzima vi si associano stabilmente inattivandolo. Es: SERPINE (SERine-Protease-INhibitors) = sono proteine che funzionano da inibitori di proteasi a serina e ne regolano l attività proteolitica, possono avere funzione di difesa nei confronti di proteasi seriniche esogene, hanno un ruolo protettivo nei processi infiammatori. TRIPSINA (PROTEASI A SERINA) Si inseriscono nel sito attivo della proteasi con un ansa chiamata RCL (= Loop del centro reattivo). LA SERPINA VIENE TAGLIATA DALLA TRIPSINA E UN FRAMMENTO DI SERPINA RIMANE LEGATO ALL ENZIMA. ALFA 1- ANTI- TRIPSINA (SERPINA) Questo frammento di serpina subisce un cambiamento conformazionale e si forma un complesso proteasi/serpina inscindibile
13 MECCANISMI DI CATALISI Ogni enzima ha un suo specifico meccanismo catalitico ma spesso più meccanismi si integrano: 1) CATALISI PER EFFETTO DI PROSSIMITA E ORIENTAMENTO 2) CATALISI DA LEGAME PREFERENZIALE PER LO STATO DI TRANSIZIONE 3) CATALISI ACIDO-BASE 4) CATALISI COVALENTE 5) CATALISI MEDIANTE IONI METALLICI
14 I primi due meccanismi sono comuni a tutti gli enzimi CATALISI favorita dalla PROSSIMITA e dall ORIENTAMENTO: 1) Gli enzimi bloccando il substrato nel sito di legame aumentano la prossimità dei gruppi funzionali che devono reagire (è come se aumentassimo la concentrazione dei reagenti nel sito attivo) 2) diminuisce la libertà di movimento e quindi l entropia dei reagenti, l energia necessaria a compensare questo aumento di ordine del sistema è fornita dalla formazione di legami fra il sito attivo dell enzima e il substrato. CATALISI favorita dal LEGAME PREFERENZIALE PER LO STATO DI TRANSIZIONE il sito attivo dell enzima si adatta perfettamente al substrato quando viene raggiunto lo stato di transizione: la complementarietà abbassa la ΔG e accelera la trasformazione
15 CATALISI ACIDO-BASE Trasferimento di ioni H + o OH - dal o al substrato e comporta la rottura di legami Favorisce quelle reazioni in cui si forma un intermedio carico instabile Specifica: quando l accettore o il donatore di ioni H + o OH - è l H 2 O Generale: quando sono coinvolte le catene laterali ionizzabili di residui amminoacidici del sito Catalitico. I pka di tali residui possono variare molto rispetto a quelli dei singoli amminoacidi in soluzione.
16 CATALISI COVALENTE Comporta la formazione di intermedi in cui il substrato è legato covalentemente con un residuo amminoacidico del sito attivo dell enzima. La catena laterale reattiva dell enzima può comportarsi sia da nucleofilo che da elettrofilo. La più comune è la catalisi nucleofila (un gruppo funzionale dell enzima si comporta da nucleofilo): H 2 O Enz-R-O S Enz-R-O-S Enz-R-OH + P
17 CATALISI TRAMITE IONI METALLICI quando nel sito attivo sono presenti ioni metallici che servono a: stabilizzare lo stato di transizione proteggere cariche negative (Mg 2+ nelle chinasi scherma le cariche negative dell ATP e facilita l attacco nucleofilo del substrato al fosforo) orientare il substrato partecipare a reazioni di ossido-riduzione METALLO-ENZIMI: metallo di transizione legato fortemente all enzima (Fe, Cu, Mn, Zn, Co) ENZIMI ATTIVATI DA METALLI: legano debolmente un metallo alcalino o alcalino-terroso
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
REGOLAZIONE DELL ATTIVITA ENZIMATICA 1) MODULAZIONE ALLOSTERICA NON-COVALENTE (REVERSIBILE)
 REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Enzimi: catalizzatori biologici
 Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
La catalisi enzimatica. Copyright 2013 Zanichelli editore S.p.A.
 La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Concetti chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Concetti chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Inibizione Enzimatica
 Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
BIOCHIMICA APPLICATA e CLINICA
 BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe. Substrato
 Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe Substrato Nelson Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright 2014 6 11
Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe Substrato Nelson Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright 2014 6 11
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Termodinamica ENTALPIA...6
 Termodinamica ORGANISMI PRIMO VIVENTI ED ENERGIA...2 PRINCIPIO DELLA TERMODINAMICA...5 ENTALPIA...6 SECONDO PRINCIPIO DELLA TERMODINAMICA... 7 energia libera di Gibbs (G)...9 Variazione di energia libera
Termodinamica ORGANISMI PRIMO VIVENTI ED ENERGIA...2 PRINCIPIO DELLA TERMODINAMICA...5 ENTALPIA...6 SECONDO PRINCIPIO DELLA TERMODINAMICA... 7 energia libera di Gibbs (G)...9 Variazione di energia libera
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
GLI ENZIMI: proteine con attività CATALITICA
 Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30)
 TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
FUNZIONI BIOLOGICHE DELLE PROTEINE
 FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
Esempi di funzioni svolte dalle proteine
 Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più
 Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Il trasporto del glucosio
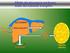 Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre
 Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Enzimi come catalizzatori biologici
 Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione -
 Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
Acido maleico anidride maleica acido ftalico andidride ftalica
 Le anidridi si ottengono per disidratazione da due molecole di acido (la reazione è particolarmente facile per ottenere anidridi cicliche) Acido maleico anidride maleica acido ftalico andidride ftalica
Le anidridi si ottengono per disidratazione da due molecole di acido (la reazione è particolarmente facile per ottenere anidridi cicliche) Acido maleico anidride maleica acido ftalico andidride ftalica
Gli enzimi e la catalisi
 Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
Proteasi Serina proteasi Serina proteasi-coagulazione del sangue
 Proteasi Serina proteasi Serina proteasi-coagulazione del sangue PROTEASI Le proteasi catalizzano la scissione idrolitica di un legame peptidico Peptide bond -carboxyl group & -amino group La reazione
Proteasi Serina proteasi Serina proteasi-coagulazione del sangue PROTEASI Le proteasi catalizzano la scissione idrolitica di un legame peptidico Peptide bond -carboxyl group & -amino group La reazione
catabolismo anabolismo
 Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
REGOLAZIONE ENZIMATICA
 REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
I catalizzatori della cellula: gli ENZIMI
 I catalizzatori della cellula: gli ENZIMI LA CATALISI ENZIMATICA E NECESSARIA PER PERMETTERE A MOLTE REAZIONI BIOCHIMICHE DI PROCEDERE AD UNA VELOCITA CONVENIENTE IN CONDIZIONI BIOLOGICHE UNA REAZIONE
I catalizzatori della cellula: gli ENZIMI LA CATALISI ENZIMATICA E NECESSARIA PER PERMETTERE A MOLTE REAZIONI BIOCHIMICHE DI PROCEDERE AD UNA VELOCITA CONVENIENTE IN CONDIZIONI BIOLOGICHE UNA REAZIONE
BIOLOGIA GENERALE 19 dicembre 2006
 Biologia generale Massolo Alessandro [email protected]; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
Biologia generale Massolo Alessandro [email protected]; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
Il metabolismo cellulare
 Il metabolismo cellulare L obesità è problema sanitario e sociale Tessuto adiposo bianco e bruno È tutta una questione di energia: Se si assumono più molecole energetiche di quelle che ci servono per costruire
Il metabolismo cellulare L obesità è problema sanitario e sociale Tessuto adiposo bianco e bruno È tutta una questione di energia: Se si assumono più molecole energetiche di quelle che ci servono per costruire
Energia di attivazione
 Energia di attivazione La maggior parte delle reazioni chimiche avviene con un apporto iniziale di energia per poter prendere l avvio procedere alla giusta velocità. Questo vale per le reazioni esoergoniche
Energia di attivazione La maggior parte delle reazioni chimiche avviene con un apporto iniziale di energia per poter prendere l avvio procedere alla giusta velocità. Questo vale per le reazioni esoergoniche
Biosintesi non ribosomiale di metaboliti peptidici bioattivi
 Biosintesi non ribosomiale di metaboliti peptidici bioattivi Strutture di alcuni peptidi bioattivi prodotti da batteri e funghi Come vengono prodotti questi peptidi? Hanno strutture complesse (spesso
Biosintesi non ribosomiale di metaboliti peptidici bioattivi Strutture di alcuni peptidi bioattivi prodotti da batteri e funghi Come vengono prodotti questi peptidi? Hanno strutture complesse (spesso
Gli enzimi sono catalizzatori nelle reazioni dei sistemi biologici Essi non sono gli unici catalizzatori biologici, esistono infatti:
 Cinetica enzimatica Gli enzimi sono catalizzatori nelle reazioni dei sistemi biologici Essi non sono gli unici catalizzatori biologici, esistono infatti: ribozimi e abzimi Quasi tutti gli enzimi sono proteine
Cinetica enzimatica Gli enzimi sono catalizzatori nelle reazioni dei sistemi biologici Essi non sono gli unici catalizzatori biologici, esistono infatti: ribozimi e abzimi Quasi tutti gli enzimi sono proteine
La catalisi enzimatica. Copyright 2013 Zanichelli editore S.p.A.
 La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Conce& chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Conce& chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
Applicazioni biotecnologiche degli enzimi: le lipasi
 Applicazioni biotecnologiche degli enzimi: le lipasi Le lipasi Catalizzano l idrolisi e la sintesi di acilgliceroli Sono stabili in solventi organici Non richiedono cofattori Hanno bassa specificità di
Applicazioni biotecnologiche degli enzimi: le lipasi Le lipasi Catalizzano l idrolisi e la sintesi di acilgliceroli Sono stabili in solventi organici Non richiedono cofattori Hanno bassa specificità di
Applicazioni biotecnologiche degli enzimi: le lipasi
 Applicazioni biotecnologiche degli enzimi: le lipasi Le lipasi Catalizzano l idrolisi e la sintesi di acilgliceroli Sono stabili in solventi organici Non richiedono cofattori Hanno bassa specificità di
Applicazioni biotecnologiche degli enzimi: le lipasi Le lipasi Catalizzano l idrolisi e la sintesi di acilgliceroli Sono stabili in solventi organici Non richiedono cofattori Hanno bassa specificità di
Cr Mn Fe Co Ni Cu Zn. Chimica Inorganica Biologica Vita ed Energia
 Vita ed Energia I processi chimici alla base della chimica della vita sono due: Uso dell E solare per produrre materia e O 2 da CO 2 e H 2 O Produzione di E mediante ossidazione di materia con formazione
Vita ed Energia I processi chimici alla base della chimica della vita sono due: Uso dell E solare per produrre materia e O 2 da CO 2 e H 2 O Produzione di E mediante ossidazione di materia con formazione
Funzioni dei nucleotidi
 Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Fosforilazione a livello del substrato
 10 piruvato chinasi Fosfoenolpiruvato Rib Adenina Piruvato ADP Rib ATP Adenina Fosforilazione a livello del substrato 3 Fosfofruttochinasi-1 (PFK-1) Fruttosio 6-fosfato Fruttosio 1,6-bisfosfato 1 esochinasi
10 piruvato chinasi Fosfoenolpiruvato Rib Adenina Piruvato ADP Rib ATP Adenina Fosforilazione a livello del substrato 3 Fosfofruttochinasi-1 (PFK-1) Fruttosio 6-fosfato Fruttosio 1,6-bisfosfato 1 esochinasi
GLICOLISI ADP ATP. Condizioni aerobiche. Condizioni anaerobiche ATP
 GLICOLISI È la parte iniziale del processo di degradazione ossidativa dei carboidrati. Durante la loro ossidazione l energia immagazzinata nel loro scheletro carbonioso è utilizzata per produrre ATP e
GLICOLISI È la parte iniziale del processo di degradazione ossidativa dei carboidrati. Durante la loro ossidazione l energia immagazzinata nel loro scheletro carbonioso è utilizzata per produrre ATP e
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
INTRODUZIONE AL METABOLISMO
 INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
Applicazioni biotecnologiche degli enzimi: le proteasi
 Applicazioni biotecnologiche degli enzimi: le proteasi Campi di applicazione delle proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento
Applicazioni biotecnologiche degli enzimi: le proteasi Campi di applicazione delle proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento
SOSTITUZIONE NUCLEOFILA BIMOLECOLARE
 SOSTITUZIONE NUCLEOFILA BIMOLECOLARE Elettrofilo (atomo di C) Nucleofilo Alogenuri metilici, primari e molti secondari reagiscono con nucleofili attraverso un processo bimolecolare. 1 Processo a 10 e-,
SOSTITUZIONE NUCLEOFILA BIMOLECOLARE Elettrofilo (atomo di C) Nucleofilo Alogenuri metilici, primari e molti secondari reagiscono con nucleofili attraverso un processo bimolecolare. 1 Processo a 10 e-,
Applicazioni biotecnologiche degli enzimi: le proteasi
 Applicazioni biotecnologiche degli enzimi: le proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento più o meno elevata 4 classi sulla
Applicazioni biotecnologiche degli enzimi: le proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento più o meno elevata 4 classi sulla
La via per accelerare i processi biologici
 La via per accelerare i processi biologici ENZIMI Sono delle proteine altamente specializzare con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa.
La via per accelerare i processi biologici ENZIMI Sono delle proteine altamente specializzare con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa.
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO
 EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Trasporto dell ossigeno In tutti gli animali superiori, il metabolismo è aerobico L energia che si può estrarre dal glucosio
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Trasporto dell ossigeno In tutti gli animali superiori, il metabolismo è aerobico L energia che si può estrarre dal glucosio
Velocità di reazione
 1 Velocità di reazione A B V = - d[a] dt = d[b] dt V= Velocità istantanea: coefficiente angolare della retta tangente alla curva in quel punto Quando t=0 la velocità istantanea sarà massima (V 0 ) 2 Energia
1 Velocità di reazione A B V = - d[a] dt = d[b] dt V= Velocità istantanea: coefficiente angolare della retta tangente alla curva in quel punto Quando t=0 la velocità istantanea sarà massima (V 0 ) 2 Energia
Lezione n. 11. Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
Biosintesi non ribosomiale di metaboliti peptidici bioattivi
 Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
SOLUZIONI DEGLI ESERCIZI
 Niccolò Taddei - Biochimica Capitolo 4 GLI ENZIMI 1 Un enzima è un particolare tipo di proteina con funzione di catalizzatore, cioè è in grado di aumentare la velocità di una reazione chimica. Gli enzimi
Niccolò Taddei - Biochimica Capitolo 4 GLI ENZIMI 1 Un enzima è un particolare tipo di proteina con funzione di catalizzatore, cioè è in grado di aumentare la velocità di una reazione chimica. Gli enzimi
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Biosintesi e modificazione degli antibiotici -lattamici. Penicilline e cefalosporine
 Biosintesi e modificazione degli antibiotici -lattamici. Penicilline e cefalosporine Struttura di alcuni antibiotici -lattamici Meccanismo d azione della penicillina La penicillina inibisce la transpeptidasi,
Biosintesi e modificazione degli antibiotici -lattamici. Penicilline e cefalosporine Struttura di alcuni antibiotici -lattamici Meccanismo d azione della penicillina La penicillina inibisce la transpeptidasi,
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
Reazione di Briggs Rauscher
 Cinetica chimica 1 Reazione di Briggs Rauscher a) Come varia nel tempo la composizione chimica di un sistema? b) Qual è il meccanismo secondo cui avviene una reazione chimica? c) Come è possibile modificare
Cinetica chimica 1 Reazione di Briggs Rauscher a) Come varia nel tempo la composizione chimica di un sistema? b) Qual è il meccanismo secondo cui avviene una reazione chimica? c) Come è possibile modificare
1/v
 1. Nel seguente grafico sono descritti i risultati di cinetica enzimatica ottenuti in 3 esperimenti condotti in assenza di inibitori e in presenza di un inibitore a due diverse concentrazioni. a) Individuare
1. Nel seguente grafico sono descritti i risultati di cinetica enzimatica ottenuti in 3 esperimenti condotti in assenza di inibitori e in presenza di un inibitore a due diverse concentrazioni. a) Individuare
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
Capitolo 5 L energia e il trasporto
 Capitolo 5 L energia e il trasporto La cellula e l energia 5.1 L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità
Capitolo 5 L energia e il trasporto La cellula e l energia 5.1 L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità
NADH e NADPH. ATP = 1 moneta (energetica) della cellula NADH, NADPH = 2 moneta (potere riducente)
 NADH e NADPH ATP = 1 moneta (energetica) della cellula NADH, NADPH = 2 moneta (potere riducente) NADH e NADPH non sono funzionalmente intercambiabili. [NAD + ]/[NADH] ~ 1000 favorisce ossidazione [NADP
NADH e NADPH ATP = 1 moneta (energetica) della cellula NADH, NADPH = 2 moneta (potere riducente) NADH e NADPH non sono funzionalmente intercambiabili. [NAD + ]/[NADH] ~ 1000 favorisce ossidazione [NADP
CICLO DI KREBS (o DELL ACIDO CITRICO)
 CICLO DI KREBS (o DELL ACIDO CITRICO) È un processo ossidativo che ha un ruolo centrale nel metabolismo energetico delle cellule eucariotiche. Avviene nella matrice mitocondriale. È alimentato soprattutto
CICLO DI KREBS (o DELL ACIDO CITRICO) È un processo ossidativo che ha un ruolo centrale nel metabolismo energetico delle cellule eucariotiche. Avviene nella matrice mitocondriale. È alimentato soprattutto
La termodinamica studia i flussi/trasformazioni di energia. Bioenergetica: termodinamica applicata ai sistemi biologici
 LA CAPACITÀ DI USARE ENERGIA È CARATTERISTICA DEI SISTEMI VIVENTI Bisogni degli esseri viventi: Energia (luce, molecole organiche) Catalizzatori biologici (enzimi) La termodinamica studia i flussi/trasformazioni
LA CAPACITÀ DI USARE ENERGIA È CARATTERISTICA DEI SISTEMI VIVENTI Bisogni degli esseri viventi: Energia (luce, molecole organiche) Catalizzatori biologici (enzimi) La termodinamica studia i flussi/trasformazioni
INTRODUZIONE AL METABOLISMO. dal gr. metabolè = trasformazione
 INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
Regolazione della Glicolisi
 Regolazione della Glicolisi Enzimi regolati della glicolisi: 1) esochinasi. da: Champe La esochinasi: ha bassa Km per Glu 0,2mM: questo assicura la captazione anche di poche molecole di glucosio, presenti
Regolazione della Glicolisi Enzimi regolati della glicolisi: 1) esochinasi. da: Champe La esochinasi: ha bassa Km per Glu 0,2mM: questo assicura la captazione anche di poche molecole di glucosio, presenti
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI
 REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
S N. Reazioni di Sostituzione Nucleofila. Nucleofilo: Nu: + C X C + Nu + X - Sostituzione Nucleofila:
 Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
Amminoacidi/peptidi/proteine. Chimica Organica II
 Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Biosintesi dei carboidrati
 Biosintesi dei carboidrati Gluconeogenesi: sintesi di glucosio da precursori non saccaridici La riserva di glucosio dell organismo (glucosio + glicogeno) è sufficiente per circa 1 giorno. La via gluconeogenetica
Biosintesi dei carboidrati Gluconeogenesi: sintesi di glucosio da precursori non saccaridici La riserva di glucosio dell organismo (glucosio + glicogeno) è sufficiente per circa 1 giorno. La via gluconeogenetica
Complesso della piruvato deidrogenasi (1) Stechiometria della reazione finale
 Ciclo di Krebs 1 Complesso della piruvato deidrogenasi (1) Stechiometria della reazione finale 2 Complesso della piruvato deidrogenasi (2) FAD Diidrolipoil deidrogenasi Piruvato decarbossilasi E 3 Diidrolipoil
Ciclo di Krebs 1 Complesso della piruvato deidrogenasi (1) Stechiometria della reazione finale 2 Complesso della piruvato deidrogenasi (2) FAD Diidrolipoil deidrogenasi Piruvato decarbossilasi E 3 Diidrolipoil
IL GRUPPO EME. PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici.
 IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
Laboratorio Fitness & Wellness
 Laboratorio Fitness & Wellness Anno Accademico 2015/2016 Ewan Thomas, MSc Principi di Bioenergetica e Biomeccanica Metabolismo Catabolismo Processi di degradazione che permettono di liberare energia Anabolismo
Laboratorio Fitness & Wellness Anno Accademico 2015/2016 Ewan Thomas, MSc Principi di Bioenergetica e Biomeccanica Metabolismo Catabolismo Processi di degradazione che permettono di liberare energia Anabolismo
ENERGIA LIBERA DI GIBBS (G)
 METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
Prof. Maria Nicola GADALETA DISPENSA N. 23
 Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia.
 La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia. Il ciclo dell acido citrico è una via metabolica centrale
La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia. Il ciclo dell acido citrico è una via metabolica centrale
