BIOCHIMICA APPLICATA e CLINICA
|
|
|
- Camillo Zani
- 8 anni fa
- Visualizzazioni
Transcript
1 BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo
2 BIOCHIMICA APPLICATA e CLINICA Password Moodle: BACfarma Regolazione enzimatica, Biosegnalazione, Regolazione delle vie metaboliche, Integrazione metabolica Nelson DL e Cox MM - I PRINCIPI DI BIOCHIMICA DI LEHNINGER, (V edizione) Zanichelli 2010 Cap. 6, 12, 14, 15, 16,17, 19, 21, 23 Ormoni Levy MN, Koeppen, BM, Stanton, BA PRINCIPI DI FISIOLOGIA di Berne & Levy, (IV edizione) Elsevier Masson 2007 Capitoli in alternativa Carbone E, Cicirata F e Aicardi G FISIOLOGIA dalle molecole ai sistemi integrati (I edizione) EdiSES 2008 Capitoli 20-25, 28 Biochimica d organo Caldarera CM BIOCHIMICA SISTEMATICA UMANA, (II edizione), CLUEB Economica, 2007 (.pdf allegato)
3 REGOLAZIONE ENZIMATICA Cap. 6, 15 Lehninger L attività degli enzimi è regolata : CONTROLLO DA SUBSTRATO Legge di Michaelis-Menten CONTROLLO GENICO Viene regolata la quantità dell enzima CONTROLLO ALLOSTERICO INTERAZIONE CON ALTRE PROTEINE (Partners) MODIFICAZIONI COVALENTI REVERSIBILI Fosforilazione MODIFICAZIONI COVALENTI IRREVERSIBILI taglio proteolitico della catena enzimatica
4 Cinetica secondo Michaelis e Menten Il valore di K M è una misura di quanto strettamente il substrato sia legato all enzima (affinità) Tanto maggiore sarà il valore di K M tanto più debole sarà l interazione tra substrato ed enzima
5 CONFRONTO TRA K M È la prima reazione di modificazione del glucosio una volta trasportato all interno della cellula: TAPPA FONDAMENTALE PER ogni suo impiego (in senso catabolico o anabolico) Fosforilazione del glucosio a glucosio-6-fosfato La fosforilazione del glucosio è catalizzata da una famiglia di enzimi diversi: ESOCHINASI (I, II, e III) e GLUCOCHINASI (Esochinasi IV) ESOCHINASI e GLUCOCHINASI hanno una diversa K M K M ESOCHINASI (I,II,III) = µm ( mm) K M GLUCOCHINASI = 10 mm Il legame del glucosio alla glucochinasi è da 66 a 500 volte più debole di quello all esochinasi
6 V Vmax K M ESOCHINASI = 150 µm (0.15 mm) ½ Vmax A [glucosio] > 0.7 mm l enzima è saturo: concentrazioni ancora maggiori non alterano la velocità [glucosio] mm Con questo intervallo di [glucosio] come sarà la curva per la glucochinasi (K M = 10 mm)? Per ottenere la curva della glucochinasi bisogna usare concentrazioni di glucosio maggiori V Vmax K M GLUCOCHINASI = 10 mm ½ Vmax Per saturare l enzima bisogna arrivare a 30mM glucosio [glucosio] mm Con questo intervallo di [glucosio] come sarà la curva per l esochinasi?
7 Che senso ha avere enzimi che catalizzano la stessa reazione, ma con K M così diverse? K M ESOCHINASI (I, II, III) = μm K M GLUCOCHINASI (ESOCHINASI IV) = 10 mm È espressa in tutti i tessuti È espressa solo nel FEGATO e nelle cellule β del pancreas La concentrazione di glucosio nel sangue (glicemia) varia da 4mM a digiuno a circa 10 mm dopo un pasto (nel circolo entero-epatico) V Vmax ½ Vmax [glucosio] mm
8 V Vmax ½ Vmax [glucosio] mm K M ESOCHINASI = mm È espressa in tutti i tessuti A digiuno l enzima lavora alla sua Vmax (saturo): aumenti di glucosio non alterano la velocità della reazione. I tessuti vengono EGUALMENTE riforniti di G6P INDIPENDENTEMENTE dallo stato nutrizionale K M GLUCOCHINASI = 10 mm È espressa solo nel FEGATO Dopo un pasto, l aumento della [glucosio] fa aumentare la velocità della reazione catalizzata dalla glucochinasi nel FEGATO, (ma NON negli altri tessuti) aumenta la fosforilazione del glucosio.
9 REGOLAZIONE ENZIMATICA L attività degli enzimi è regolata : CONTROLLO DA SUBSTRATO CONTROLLO GENICO (+/-) Viene regolata la quantità dell enzima
10 REGOLAZIONE ENZIMATICA CONTROLLO GENICO (+/-) Viene regolata l ESPRESSIONE (quantità) dell enzima a livello di trascrizione e traduzione del gene Tempo: decine di min - ore E REVERSIBILE interruttore trascrizionale: Attivazione (o inattivazione) di Fattori di Trascrizione su specifici Promotori Vmax è funzione della quantità di enzima presente K cat è chiamata numero di turnover: pari al numero di molecole di substrato convertite in prodotto nell unità di tempo (sec) per ciascuna molecola di enzima. Dimensioni = sec -1
11 V Vmax 20 E Glucosio 6-P µmol/min Vmax E K M GLUCOCHINASI = 10 mm l insulina ne stimola la trascrizione di circa 20 volte in 30 min [glucosio] mm
12 REGOLAZIONE ENZIMATICA L attività degli enzimi è regolata : CONTROLLO DA SUBSTRATO CONTROLLO GENICO (+) Viene regolata la quantità dell enzima CONTROLLO ALLOSTERICO (+/-) deriva da una molecola che si lega ad un sito diverso dal sito di legame
13 Regolazione allosterica. Gli enzimi allosterici hanno siti di legame per gli attivatori o inibitori (EFFETTORI o MODULATORI) diversi dal sito attivo del substrato enzima allosterico è in generale una proteina oligomerica che può esistere in due conformazioni (T e R) caratterizzate da bassa (T) o elevata (R) attività catalitica Enzima inattivo T effettore + effettore - Enzima attivo R Il legame con l effettore ha la conseguenza di stabilizzare una delle due conformazioni
14 Effettori allosterici sono soprattutto METABOLITI INTRACELLULARI Tra i principali modulatori allosterici ci sono gli indicatori dello stato energetico ATP/ADP/AMP NAD/NADH Citrato & acetil CoA E la CONCENTRAZIONE dei modulatori allosterici a determinare l effetto La costante di dissociazione definisce l affinità di un modulatore allosterico per il suo sito di legame sull enzima, ed ha le dimensioni di una concentrazione E + M [E] [M] [EM] EM = K d
15 REGOLAZIONE ENZIMATICA L attività degli enzimi è regolata : CONTROLLO DA SUBSTRATO CONTROLLO GENICO (+/-) CONTROLLO ALLOSTERICO (+/-) da metaboliti Per INTERAZIONE CON ALTRE PROTEINE (Partners; +/-)
16 STIMOLAZIONE O INIBIZIONE DA PARTE DI PROTEINE DI CONTROLLO INTERAZIONE PROTEINA-PROTEINA Partner attivatore Enzima inattivo Transizione conformazionale Attivazione di altre copie dell enzima substrati Enzima attivo prodotti
17 REGOLAZIONE ENZIMATICA L attività degli enzimi è regolata : CONTROLLO DA SUBSTRATO CONTROLLO GENICO (+/-) l enzima è prodotto solo quando serve. Viene regolata la quantità dell enzima CONTROLLO ALLOSTERICO (+/-) da metaboliti Per INTERAZIONE CON ALTRE PROTEINE (Partners; +/-) MODIFICAZIONI COVALENTI REVERSIBILI (+/-) Fosforilazione
18
19 Lo stato di fosforilazione di molti enzimi ne regola DIRETTAMENTE l attività
20 Protein chinasi I substrati sono proteine Chinasi: fosforilazione Protein fosfatasi H 2 O Per poter avere un significato biologico la fosforilazione deve poter essere REVERSIBILE DEFOSFORILAZIONE: idrolisi del legame fosfo-estere
21 REGOLAZIONE ENZIMATICA L attività degli enzimi è regolata : CONTROLLO DA SUBSTRATO Tutti CONTROLLO GENICO CONTROLLO ALLOSTERICO metaboliti o partners proteici MODIFICAZIONI COVALENTI REVERSIBILI Fosforilazione ENZIMI REGOLATORI Catalizzano la reazione più lenta di una via metabolica e quindi controllano la velocità complessiva della via stessa. In generale sono enzimi allosterici e vengono controllati anche mediante fosforilazione e controllo genico (non tutti) COORDINAMENTO dell ATTIVITA METABOLICA
La midollare del surrene e le catecolamine Berne & Levy cap. 48
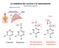 La midollare del surrene e le catecolamine Berne & Levy cap. 48 75-80% 3 H 2 N H 2 C H 2 N H 2 C HC OH N H H 2 C HC OH 2 HO HC H C HO HC HO HC OH HO HC OH OH OH Catechol Dopamine Norepinephrine (Noradrenalina)
La midollare del surrene e le catecolamine Berne & Levy cap. 48 75-80% 3 H 2 N H 2 C H 2 N H 2 C HC OH N H H 2 C HC OH 2 HO HC H C HO HC HO HC OH HO HC OH OH OH Catechol Dopamine Norepinephrine (Noradrenalina)
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Il trasporto del glucosio
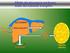 Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
REGOLAZIONE DELL ATTIVITA ENZIMATICA 1) MODULAZIONE ALLOSTERICA NON-COVALENTE (REVERSIBILE)
 REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
REGOLAZIONE ENZIMATICA
 REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
REGOLAZIONE DEL METABOLISMO GLUCIDICO
 REGOLAZIONE DEL METABOLISMO GLUCIDICO IL METABOLISMO DEL GLICOGENO E FINEMENTE REGOLATO: Quando è attiva la sua sintesi non è attiva la sua demolizione e viceversa I principali ormoni che controllano il
REGOLAZIONE DEL METABOLISMO GLUCIDICO IL METABOLISMO DEL GLICOGENO E FINEMENTE REGOLATO: Quando è attiva la sua sintesi non è attiva la sua demolizione e viceversa I principali ormoni che controllano il
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
REGOLAZIONE DEL METABOLISMO GLUCIDICO
 REGOLAZIONE DEL METABOLISMO GLUCIDICO IL METABOLISMO DEL GLICOGENO E FINEMENTE REGOLATO: Quando è attiva la sua sintesi non è attiva la sua demolizione e viceversa I principali ormoni che controllano il
REGOLAZIONE DEL METABOLISMO GLUCIDICO IL METABOLISMO DEL GLICOGENO E FINEMENTE REGOLATO: Quando è attiva la sua sintesi non è attiva la sua demolizione e viceversa I principali ormoni che controllano il
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
GLICOLISI ADP ATP. Condizioni aerobiche. Condizioni anaerobiche ATP
 GLICOLISI È la parte iniziale del processo di degradazione ossidativa dei carboidrati. Durante la loro ossidazione l energia immagazzinata nel loro scheletro carbonioso è utilizzata per produrre ATP e
GLICOLISI È la parte iniziale del processo di degradazione ossidativa dei carboidrati. Durante la loro ossidazione l energia immagazzinata nel loro scheletro carbonioso è utilizzata per produrre ATP e
Funzioni dei nucleotidi
 Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre
 Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Regolazione della Glicolisi
 Regolazione della Glicolisi Enzimi regolati della glicolisi: 1) esochinasi. da: Champe La esochinasi: ha bassa Km per Glu 0,2mM: questo assicura la captazione anche di poche molecole di glucosio, presenti
Regolazione della Glicolisi Enzimi regolati della glicolisi: 1) esochinasi. da: Champe La esochinasi: ha bassa Km per Glu 0,2mM: questo assicura la captazione anche di poche molecole di glucosio, presenti
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
SEI PRONTO PER LA VERIFICA? SOLUZIONI
 Capitoli E1 - E2 1. B 2. D 3. D 4. C 5. A 7. B 8. C 9. B, E 10. A, D 11. F, V, F, V SEI PRONTO PER LA VERIFICA? SOLUZIONI 12. Gli inibitori sono molecole che si legano agli enzimi e riducono la velocità
Capitoli E1 - E2 1. B 2. D 3. D 4. C 5. A 7. B 8. C 9. B, E 10. A, D 11. F, V, F, V SEI PRONTO PER LA VERIFICA? SOLUZIONI 12. Gli inibitori sono molecole che si legano agli enzimi e riducono la velocità
Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe. Substrato
 Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe Substrato Nelson Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright 2014 6 11
Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe Substrato Nelson Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright 2014 6 11
Informazioni sul corso a.a v.1. Insegnamento di Biochimica 090SM BIO/10 6 CFU 48 ore
 Informazioni sul corso a.a 2017-18 v.1 Insegnamento di Biochimica 090SM BIO/10 6 CFU 48 ore Informazioni sul corso Marco Scocchi Dip. Di Scienze della Vita - Prof. Associato Tel. 040-5588704 [email protected]
Informazioni sul corso a.a 2017-18 v.1 Insegnamento di Biochimica 090SM BIO/10 6 CFU 48 ore Informazioni sul corso Marco Scocchi Dip. Di Scienze della Vita - Prof. Associato Tel. 040-5588704 [email protected]
Utilizzo del glucosio: la glicolisi
 Utilizzo del glucosio: la glicolisi GLUCOSIO Sistema rapido, reversibile, GLICOLISI avviene anche in assenza di ossigeno. Produce poca energia OSSIDAZIONE PIRUVATO Fermentazione LATTATO ACETATO CICLO DI
Utilizzo del glucosio: la glicolisi GLUCOSIO Sistema rapido, reversibile, GLICOLISI avviene anche in assenza di ossigeno. Produce poca energia OSSIDAZIONE PIRUVATO Fermentazione LATTATO ACETATO CICLO DI
catabolismo anabolismo
 Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
Fosforilazione a livello del substrato
 10 piruvato chinasi Fosfoenolpiruvato Rib Adenina Piruvato ADP Rib ATP Adenina Fosforilazione a livello del substrato 3 Fosfofruttochinasi-1 (PFK-1) Fruttosio 6-fosfato Fruttosio 1,6-bisfosfato 1 esochinasi
10 piruvato chinasi Fosfoenolpiruvato Rib Adenina Piruvato ADP Rib ATP Adenina Fosforilazione a livello del substrato 3 Fosfofruttochinasi-1 (PFK-1) Fruttosio 6-fosfato Fruttosio 1,6-bisfosfato 1 esochinasi
Fosforilazione a livello del substrato
 10 piruvato chinasi Fosfoenolpiruvato Rib Adenina Piruvato ADP Rib ATP Adenina Fosforilazione a livello del substrato 3 Fosfofruttochinasi-1 (PFK-1) Fruttosio 6-fosfato Fruttosio 1,6-bisfosfato 1 esochinasi
10 piruvato chinasi Fosfoenolpiruvato Rib Adenina Piruvato ADP Rib ATP Adenina Fosforilazione a livello del substrato 3 Fosfofruttochinasi-1 (PFK-1) Fruttosio 6-fosfato Fruttosio 1,6-bisfosfato 1 esochinasi
09/05/17. REGOLAZIONE ALLOSTERICA determinano cambiamenti di velocità delle vie
 1 FASE DI ASSORBIMENTO due quattro ore successive ad un pasto a. Aumento glucosio ematico, a.a. Ed trigliceridi b. Aumento secrezione insulina diminuzione glucagone c. Aumento sintesi del glicogeno, proteine
1 FASE DI ASSORBIMENTO due quattro ore successive ad un pasto a. Aumento glucosio ematico, a.a. Ed trigliceridi b. Aumento secrezione insulina diminuzione glucagone c. Aumento sintesi del glicogeno, proteine
NADH e NADPH. ATP = 1 moneta (energetica) della cellula NADH, NADPH = 2 moneta (potere riducente)
 NADH e NADPH ATP = 1 moneta (energetica) della cellula NADH, NADPH = 2 moneta (potere riducente) NADH e NADPH non sono funzionalmente intercambiabili. [NAD + ]/[NADH] ~ 1000 favorisce ossidazione [NADP
NADH e NADPH ATP = 1 moneta (energetica) della cellula NADH, NADPH = 2 moneta (potere riducente) NADH e NADPH non sono funzionalmente intercambiabili. [NAD + ]/[NADH] ~ 1000 favorisce ossidazione [NADP
GLI ENZIMI: proteine con attività CATALITICA
 Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI
 METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI Glicolisi: Glucosio Glucosio Piruvato Piruvato Gluconeogenesi La Glicolisi (dal greco glykys dolce e lysis scissione) E` la via metabolica che
METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI Glicolisi: Glucosio Glucosio Piruvato Piruvato Gluconeogenesi La Glicolisi (dal greco glykys dolce e lysis scissione) E` la via metabolica che
Regolazione ormonale del metabolismo energetico. Lezione del 11 marzo 2014
 Regolazione ormonale del metabolismo energetico Lezione del 11 marzo 2014 Effetti fisiologici e metabolici dell adrenalina: preparazione all azione EFFETTO IMMEDIATO EFFETTO COMPLESSIVO Effetto fisiologico
Regolazione ormonale del metabolismo energetico Lezione del 11 marzo 2014 Effetti fisiologici e metabolici dell adrenalina: preparazione all azione EFFETTO IMMEDIATO EFFETTO COMPLESSIVO Effetto fisiologico
I più comuni polisaccaridi sono: AMIDO CELLULOSA GLICOGENO DESTRINA
 GLICOGENO POLISACCARIDI La maggior parte dei carboidrati che si ritrovano in natura sono polimeri ad alto peso molecolare chiamati polisaccaridi L u n i t à m o n o s a c c a r i d i c a p i ù frequente
GLICOGENO POLISACCARIDI La maggior parte dei carboidrati che si ritrovano in natura sono polimeri ad alto peso molecolare chiamati polisaccaridi L u n i t à m o n o s a c c a r i d i c a p i ù frequente
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30)
 TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
La quantità di glu presente nei liquidi extracellulari è di circa 20g, 80kcal.
 I principali nutrienti metabolici sono il glucosio e gli acidi grassi. In circostanze normali il glucosio è l unico nutriente che possa essere utilizzato dal cervello. E anche utilizzato preferenzialmente
I principali nutrienti metabolici sono il glucosio e gli acidi grassi. In circostanze normali il glucosio è l unico nutriente che possa essere utilizzato dal cervello. E anche utilizzato preferenzialmente
METABOLISMO DEL GLICOGENO
 METABOLISMO DEL GLICOGENO GLICOGENO: Polisaccaride di riserva del regno animale Organi principali: FEGATO MUSCOLO SCHELETRICO Glicogeno Glucosio Glucosio-6P Via del pentoso fosfato Glucosio Fruttosio-6P
METABOLISMO DEL GLICOGENO GLICOGENO: Polisaccaride di riserva del regno animale Organi principali: FEGATO MUSCOLO SCHELETRICO Glicogeno Glucosio Glucosio-6P Via del pentoso fosfato Glucosio Fruttosio-6P
1. Ossidoreduttasi 2. Transferasi 3. Idrolasi 4. Liasi 5. Isomerasi 6. Ligasi
 1. Ossidoreduttasi 2. Transferasi 3. Idrolasi 4. Liasi 5. Isomerasi 6. Ligasi ATP + glucosio glucochinasi ADP + glucosio-6-p E.C 2.7.1.2 glucochinasi E.C 2.7.1.1 esochinasi Energia libera,g S k 1 k 1 =
1. Ossidoreduttasi 2. Transferasi 3. Idrolasi 4. Liasi 5. Isomerasi 6. Ligasi ATP + glucosio glucochinasi ADP + glucosio-6-p E.C 2.7.1.2 glucochinasi E.C 2.7.1.1 esochinasi Energia libera,g S k 1 k 1 =
Regolazione dell espressione genica
 Regolazione dell espressione genica Ogni processo che porta dal DNA alla proteina funzionale è soggetto a regolazione. Il primo processo relativo alla trascrizione è il più importante punto di regolazione
Regolazione dell espressione genica Ogni processo che porta dal DNA alla proteina funzionale è soggetto a regolazione. Il primo processo relativo alla trascrizione è il più importante punto di regolazione
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Il pancreas endocrino
 Il pancreas endocrino 1 Indice degli argomenti Che cos è il pancreas endocrino??? Funzioni principali degli ormoni pancreatici Anatomia del pancreas endocrino Innervazione nervosa Cellule β : INSULINA
Il pancreas endocrino 1 Indice degli argomenti Che cos è il pancreas endocrino??? Funzioni principali degli ormoni pancreatici Anatomia del pancreas endocrino Innervazione nervosa Cellule β : INSULINA
Scaricato da 21/01/2011
 DIETA BILANCIATA % contenuto equivalenti energetico calorici CARBOIDRATI 58 4.1 kcal/g LIPIDI 30 9.3 kcal/g PROTEINE 12 4.4 kcal/g 1 2 GLUCIDI DELLA DIETA LA DIGESTIONE DEI GLUCIDI - Amido - inizia nella
DIETA BILANCIATA % contenuto equivalenti energetico calorici CARBOIDRATI 58 4.1 kcal/g LIPIDI 30 9.3 kcal/g PROTEINE 12 4.4 kcal/g 1 2 GLUCIDI DELLA DIETA LA DIGESTIONE DEI GLUCIDI - Amido - inizia nella
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio. GLUCONEOGENESI (sintesi da precursori non glucidici)
 DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
Università di Roma Tor Vergata Scienze della Nutrizione Umana Biochimica della Nutrizione - Prof.ssa Luciana Avigliano A.A.
 Università di Roma Tor Vergata Scienze della Nutrizione Umana Biochimica della Nutrizione - Prof.ssa Luciana Avigliano A.A. 2011-12 Nutrienti quali regolatori delle funzioni cellulari AZIONE REGOLATORIA
Università di Roma Tor Vergata Scienze della Nutrizione Umana Biochimica della Nutrizione - Prof.ssa Luciana Avigliano A.A. 2011-12 Nutrienti quali regolatori delle funzioni cellulari AZIONE REGOLATORIA
BIOSEGNALAZIONE cap. 15, 15, 23 Lehninger Berne & Levy cap. 41
 BIOSEGNALAZIONE cap. 15, 15, 23 Lehninger Berne & Levy cap. 41 Un sistema vivente è capace di ricevere, rispondere e adattarsi ai cambiamenti dell ambiente circostante. I cambiamenti si manifestano sotto
BIOSEGNALAZIONE cap. 15, 15, 23 Lehninger Berne & Levy cap. 41 Un sistema vivente è capace di ricevere, rispondere e adattarsi ai cambiamenti dell ambiente circostante. I cambiamenti si manifestano sotto
1. L'enzima che catalizza la trasformazione della 3-fosfogliceraldeide in acido 1,3 difosfoglicerico è una:
 1. L'enzima che catalizza la trasformazione della 3-fosfogliceraldeide in acido 1,3 difosfoglicerico è una: a) idrolasi b) isomerasi c) aldolasi d) fosfatasi e) deidrogenasi 2. Quale dei sottoelencati
1. L'enzima che catalizza la trasformazione della 3-fosfogliceraldeide in acido 1,3 difosfoglicerico è una: a) idrolasi b) isomerasi c) aldolasi d) fosfatasi e) deidrogenasi 2. Quale dei sottoelencati
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione -
 Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
Lattato. Glicolisi. Piruvato
 Lattato Glicolisi Piruvato REAZIONI MITOCONDRIALI DEL PIRUVATO + Piruvato Deidrogenasi + CO 2 + H 2 O ATP ADP + Pi Piruvato Carbossilasi + 2 H + ossalacetato La Piruvato Carbossilasi è una proteina Mitocondriale
Lattato Glicolisi Piruvato REAZIONI MITOCONDRIALI DEL PIRUVATO + Piruvato Deidrogenasi + CO 2 + H 2 O ATP ADP + Pi Piruvato Carbossilasi + 2 H + ossalacetato La Piruvato Carbossilasi è una proteina Mitocondriale
Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio
 Cinetica enzimatica Cenni alla cinetica delle reazioni Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio OVVERO: CINETICA ENZIMATICA LO
Cinetica enzimatica Cenni alla cinetica delle reazioni Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio OVVERO: CINETICA ENZIMATICA LO
Scheletrico Striato. Cardiaco Striato. Liscio
 IL METABOLISMO DEL TESSUTO MUSCOLARE Scheletrico Striato La maggior parte della massa muscolare corporea Volontario Cardiaco Striato Cuore Involontario Liscio Non striato Visceri e vasi sanguigni Involontario
IL METABOLISMO DEL TESSUTO MUSCOLARE Scheletrico Striato La maggior parte della massa muscolare corporea Volontario Cardiaco Striato Cuore Involontario Liscio Non striato Visceri e vasi sanguigni Involontario
Esempi di funzioni svolte dalle proteine
 Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
Una risposta cellulare specifica può essere determinata dalla presenza di mediatori chimici (ormoni o altre molecole), dall interazione con altre
 Una risposta cellulare specifica può essere determinata dalla presenza di mediatori chimici (ormoni o altre molecole), dall interazione con altre cellule (contatto cellula-cellula) o con strutture extracellulari
Una risposta cellulare specifica può essere determinata dalla presenza di mediatori chimici (ormoni o altre molecole), dall interazione con altre cellule (contatto cellula-cellula) o con strutture extracellulari
INTRODUZIONE AL METABOLISMO
 INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
REGOLAZIONE DELLA SINTESI PROTEICA NEI PROCARIOTI
 REGOLAZIONE DELLA SINTESI PROTEICA NEI PROCARIOTI La regolazione dell espressione genica Quali sono i meccanismi che determinano l accensione o lo spegnimento dell espressione di un gene? La regolazione
REGOLAZIONE DELLA SINTESI PROTEICA NEI PROCARIOTI La regolazione dell espressione genica Quali sono i meccanismi che determinano l accensione o lo spegnimento dell espressione di un gene? La regolazione
INTRODUZIONE AL METABOLISMO. dal gr. metabolè = trasformazione
 INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
Modulo 11 biosegnalazione
 Modulo 11 biosegnalazione La trasduzione del segnale Capacità di ricevere e rispondere a segnali esterni alla membrana è un processo fondamentale per la vita. Organismi pluricellulari si scambiano informazioni:
Modulo 11 biosegnalazione La trasduzione del segnale Capacità di ricevere e rispondere a segnali esterni alla membrana è un processo fondamentale per la vita. Organismi pluricellulari si scambiano informazioni:
GLUCOSIO. Vena porta DIGESTIONE DEI DISACCARIDI. Enzimi parete intestinale
 DIGESTIONE DELL AMIDO AMIDO Amilasi salivare DESTRINE Amilasi pancreatica MALTOSIO Enzimi parete intestinale GLUCOSIO Vena porta DIGESTIONE DEI DISACCARIDI DISACCARIDI Enzimi parete intestinale MONOSACCARIDI
DIGESTIONE DELL AMIDO AMIDO Amilasi salivare DESTRINE Amilasi pancreatica MALTOSIO Enzimi parete intestinale GLUCOSIO Vena porta DIGESTIONE DEI DISACCARIDI DISACCARIDI Enzimi parete intestinale MONOSACCARIDI
Carboidrati! Oligosaccaridi Polisaccaridi. B) Carboidrati complessi
 Carboidrati! Sono i composti organici più abbondanti sulla terra Contengono: C, H, O Sono Aldeidi o Chetoni poliossidrilici Possono essere suddivisi in: A) Zuccheri semplici Monosaccaridi B) Carboidrati
Carboidrati! Sono i composti organici più abbondanti sulla terra Contengono: C, H, O Sono Aldeidi o Chetoni poliossidrilici Possono essere suddivisi in: A) Zuccheri semplici Monosaccaridi B) Carboidrati
Catabolismo dei carboidrati Glicolisi
 Catabolismo dei carboidrati Glicolisi Principali vie di utilizzo del Glucosio L estrazione dell energia dai composti organici può essere divisa in tre stadi Metabolismo del glucosio C 6 H 12 O 6 + 6O 2
Catabolismo dei carboidrati Glicolisi Principali vie di utilizzo del Glucosio L estrazione dell energia dai composti organici può essere divisa in tre stadi Metabolismo del glucosio C 6 H 12 O 6 + 6O 2
1/v
 1. Nel seguente grafico sono descritti i risultati di cinetica enzimatica ottenuti in 3 esperimenti condotti in assenza di inibitori e in presenza di un inibitore a due diverse concentrazioni. a) Individuare
1. Nel seguente grafico sono descritti i risultati di cinetica enzimatica ottenuti in 3 esperimenti condotti in assenza di inibitori e in presenza di un inibitore a due diverse concentrazioni. a) Individuare
La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia.
 La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia. Il ciclo dell acido citrico è una via metabolica centrale
La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia. Il ciclo dell acido citrico è una via metabolica centrale
Strategie catalitiche
 Strategie catalitiche catalisi acido-base catalisi covalente catalisi da metalli Dati molecolari di alcune proteine Citocromo C (umano) Ribonucleasi A (pancreas di bue) Lisozima (bianco dell uovo) Mioglobina
Strategie catalitiche catalisi acido-base catalisi covalente catalisi da metalli Dati molecolari di alcune proteine Citocromo C (umano) Ribonucleasi A (pancreas di bue) Lisozima (bianco dell uovo) Mioglobina
CHETOGENESI (PRODUZIONE DI CORPI CHETONICI)
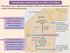 CHETOGENESI (PRODUZIONE DI CORPI CHETONICI) Bassa glicemia (es.: digiuno) o di Diabete mellito non trattato (insufficiente captazione insulino-dipendente di glucosio) La glicolisi è inibita ma la β-ossidazione
CHETOGENESI (PRODUZIONE DI CORPI CHETONICI) Bassa glicemia (es.: digiuno) o di Diabete mellito non trattato (insufficiente captazione insulino-dipendente di glucosio) La glicolisi è inibita ma la β-ossidazione
Cap.16 GLICOLISI. Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP H 2 O 2 NAD + 2 NADH + 2H +
 Cap.16 GLICOLISI Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP 2 + 2 H 2 O 2 NAD + 2 NADH + 2H + Via metabolica in 10 tappe (reazioni) La glicolisi può
Cap.16 GLICOLISI Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP 2 + 2 H 2 O 2 NAD + 2 NADH + 2H + Via metabolica in 10 tappe (reazioni) La glicolisi può
La Farmacogenetica studia:
 La Farmacogenetica studia: a) Gli effetti dei farmaci sull espressione genica b) La sintesi di farmaci da parte di organismi geneticamente modificati c) Nessuna delle risposte è esatta d) La terapia genica
La Farmacogenetica studia: a) Gli effetti dei farmaci sull espressione genica b) La sintesi di farmaci da parte di organismi geneticamente modificati c) Nessuna delle risposte è esatta d) La terapia genica
INIBIZIONE ENZIMATICA REVERSIBILE
 INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
I Lincei per una nuova didattica nella Scuola: una rete nazionale Polo di Brescia
 I Lincei per una nuova didattica nella Scuola: una rete nazionale Polo di Brescia Edizione 2016-2017 Metabolismo: equilibrio e omeostasi dei processi cellulari Lezione: Le principali vie metaboliche, il
I Lincei per una nuova didattica nella Scuola: una rete nazionale Polo di Brescia Edizione 2016-2017 Metabolismo: equilibrio e omeostasi dei processi cellulari Lezione: Le principali vie metaboliche, il
Fondamenti di Chimica Farmaceutica. Inibizione enzimatica
 Fondamenti di Chimica Farmaceutica Inibizione enzimatica Cinetica enzimatica E + S k 1 k 1 ES k2 E + P La reazione catalizzata dall enzima avviene in due passaggi: la formazione del complesso enzima-substrato:
Fondamenti di Chimica Farmaceutica Inibizione enzimatica Cinetica enzimatica E + S k 1 k 1 ES k2 E + P La reazione catalizzata dall enzima avviene in due passaggi: la formazione del complesso enzima-substrato:
Scheletrico Striato. Cardiaco Striato. Liscio
 IL METABOLISMO DEL TESSUTO MUSCOLARE Scheletrico Striato La maggior parte della massa muscolare corporea Volontario Cardiaco Striato Cuore Involontario Liscio Non striato Visceri e vasi sanguigni Involontario
IL METABOLISMO DEL TESSUTO MUSCOLARE Scheletrico Striato La maggior parte della massa muscolare corporea Volontario Cardiaco Striato Cuore Involontario Liscio Non striato Visceri e vasi sanguigni Involontario
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
Ruolo del fegato nella nutrizione
 Ruolo del fegato nella nutrizione Centro di distribuzione dei nutrienti per tutti gli altri organi Annulla le fluttuazioni del metabolismo determinate dall assunzione intermittente del cibo Funge da deposito
Ruolo del fegato nella nutrizione Centro di distribuzione dei nutrienti per tutti gli altri organi Annulla le fluttuazioni del metabolismo determinate dall assunzione intermittente del cibo Funge da deposito
CINETICA ENZIMATICA - velocità di reazione
 [P] Velocità iniziale (V 0 ) CINETICA ENZIMATICA - velocità di reazione + + k 1 E + S ES ES E + P k 2 k 3 k 4 V = d[p]/dt = k 3 [ES] Velocità iniziale (V 0 ) quando [S] >> [P] V max t CINETICA ENZIMATICA:
[P] Velocità iniziale (V 0 ) CINETICA ENZIMATICA - velocità di reazione + + k 1 E + S ES ES E + P k 2 k 3 k 4 V = d[p]/dt = k 3 [ES] Velocità iniziale (V 0 ) quando [S] >> [P] V max t CINETICA ENZIMATICA:
Una panoramica del ciclo dell acido ciclico
 Ciclo di Krebs Una panoramica del ciclo dell acido ciclico Concetti chiave Il ciclo dell acido citrico, o ciclo di Krebs, o ciclo degli acidi tricarbossilici (TCA), è un processo catalitico a 8 tappe che
Ciclo di Krebs Una panoramica del ciclo dell acido ciclico Concetti chiave Il ciclo dell acido citrico, o ciclo di Krebs, o ciclo degli acidi tricarbossilici (TCA), è un processo catalitico a 8 tappe che
Immunologia e Immunopatologia ATTIVAZIONE DEI LINFOCITI T
 Immunologia e Immunopatologia ATTIVAZIONE DEI LINFOCITI T Le fasi dell immunità specifica cellulo-mediata 1. Attivazione dei linfociti T 2. Differenziamento linfociti T effettori 3. Reazioni immunitarie
Immunologia e Immunopatologia ATTIVAZIONE DEI LINFOCITI T Le fasi dell immunità specifica cellulo-mediata 1. Attivazione dei linfociti T 2. Differenziamento linfociti T effettori 3. Reazioni immunitarie
FUNZIONI delle PROTEINE
 FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
TRASDUZIONE DEL SEGNALE CELLULARE
 TRASDUZIONE DEL SEGNALE CELLULARE RECETTORI I recettori ormonali sono proteine (spesso glicoproteine) capaci di riconoscere e legare l ormone L interazione tra ormone e recettore è estremamente specifica
TRASDUZIONE DEL SEGNALE CELLULARE RECETTORI I recettori ormonali sono proteine (spesso glicoproteine) capaci di riconoscere e legare l ormone L interazione tra ormone e recettore è estremamente specifica
