Interrogazione a risposta scritta. Il sottoscritto consigliere. visti
|
|
|
- Laura Corsini
- 6 anni fa
- Visualizzazioni
Transcript
1 Interrogazione a risposta scritta Il sottoscritto consigliere visti l art. 32 della Costituzione che stabilisce che la Repubblica tutela il diritto fondamentale alla salute; la legge n. 94, dell 8 aprile 1998, di conversione del decreto legge 17 febbraio 1998, n. 23 Disposizioni urgenti in materia di sperimentazioni cliniche in campo oncologico e altre misure in materia sanitaria (più noto come Decreto Di Bella") che, stabilendo modalità e criteri precisi, regolamenta la possibilità per il medico di prescrivere farmaci anche per indicazioni o vie di somministrazione non registrate: in singoli casi, in assenza documentabile di efficaci alternative di cura, in presenza di letteratura scientifica accreditata che ne sostenga il razionale utilizzo e purché ciò avvenga sotto la diretta responsabilità del medico prescrittore, che ha il preciso obbligo di informare il paziente, rimanendo, per il medico, l'impegno di accertarsi che l'informazione sia stata compresa dal paziente nelle sue declinazioni (eventuali alternative, possibili rischi associati alla terapia) e di acquisirne il consenso scritto, tenendo così conto dell'esistenza di farmaci efficaci per indicazioni terapeutiche non approvate per ragioni diverse; la legge 23 dicembre 1996, n. 648 Conversione in legge del decreto legge 21 ottobre 1996, n. 536, recante misure per il contenimento della spesa farmaceutica e la rideterminazione del tetto di spesa per l'anno 1996 che introduce la possibilità di prescrivere ed erogare, a carico del Servizio Sanitario Nazionale, medicinali inseriti in un apposito elenco predisposto ed aggiornato periodicamente dalla CUF (successivamente dall AIFA che l ha sostituita nel 2003) che comprende, tra l altro, medicinali da impiegare per una indicazione terapeutica diversa da quella autorizzata in Italia; la delibera di Giunta regionale n. 1628, del 26 ottobre 2009, Temporanea erogabilità del medicinale Bevacizumab a carico del SSR nell'ambito delle strutture della Regione Emilia- Romagna per il trattamento di nuovi casi di degenerazione maculare legata all'età (DMLE) in cui si stabilisce di consentire la temporanea erogabilità del medicinale Bevacizumab a carico del SSR nell ambito delle strutture della Regione Emilia-Romagna, anche per il trattamento di nuovi casi di DMLE, previa acquisizione del consenso informato del paziente ; la delibera di Giunta regionale n. 186, del 20 febbraio 2012, Determinazioni in merito alla propria deliberazione n. 1628/2009 concernente l'erogabilità del medicinale Bevacizumab a carico del SSR che sospende con decorrenza dal 12 marzo 2012 l efficacia della D.G.R. n. 1628/2009, per il tempo necessario alla conclusione del confronto tecnico-scientifico con AIFA in merito alle conclusioni dello studio CATT e alla condivisione delle condizioni di sicurezza d uso del bevacizumab mentre stabilisce che, per quanto riguarda i pazienti che attualmente stanno assumendo bevacizumab, sia garantita la continuità per i cicli terapeutici già programmati; l interrogazione oggetto n del 22 ottobre 2012 e la relativa risposta dell assessore regionale alle Politiche per la salute del 6 novembre 2012; premesso che in Italia, la degenerazione maculare senile (Age related Macular Degeneration - AMD o in italiano DMLE), colpisce circa 1 milione di persone, di cui risultano essere affette dalla forma più devastante: la AMD essudativa, una forma più rara, ma più grave, poiché ha un andamento rapido e progressivo e provoca una grave perdita della capacità visiva, portando alla formazione di uno scotoma centrale (zona centrale di cecità) secondario alla formazione di neovasi in prossimità o al centro della macula, questi vasi sanguigni neoformati provengono, quasi esclusivamente, dalla coroide (neovascolarizzazione coroideale o choroidal neovascularization, CNV) e provocano la formazione di una cicatrice
2 fibrovascolare che distrugge definitivamente la retina centrale, tanto più ampie e vicine al centro della macula sono le lesioni neovascolari, quanto più grave è la loro prognosi; i farmaci anti-angiogenici (antivegf) rappresentano una concreta prospettiva terapeutica per i pazienti che ne sono affetti; in questo ambito esistono due categorie farmacologiche per il trattamento intravitreale delle maculopatie correlate all età: farmaci cosiddetti on-label e farmaci cosiddetti offlabel, i primi sono utilizzati nel rispetto delle indicazioni riportate sulla scheda tecnica del prodotto, mentre i secondi sono impiegati in condizioni non previste dalla scheda tecnica stessa, rientrano tra gli on-label il Pegaptanib (Macugen) ed il Ranibizumab (Lucentis), approvati per il trattamento della AMD essudativa dalla Food and Drug Administration (FDA), dalla European Medicines Agency (EMA) e, in Italia, dall Agenzia Italiana del Farmaco (AIFA), mentre, è off-label il Bevacizumab (Avastin), per le maculopatie non correlate all età tutti e tre i farmaci citati sono off-label ; le maculopatie, sia correlate che non correlate, possono essere in forma essudativa (o anche detta umida, che è la forma più aggressiva) o in forma secca; l Avastin è prodotto dall azienda Roche che, inspiegabilmente, a distanza ormai di anni, non ha mai dimostrato nessun interesse alla sua formulazione e registrazione come farmaco per curare la AMD, il Lucentis è prodotto dall azienda Novartis, il Macugen è prodotto dall azienda Pfizer, quest ultimo farmaco è considerato, generalmente, meno efficace, inoltre, esiste una rilevante partecipazione azionaria di Novartis in Roche (33%) ; per poter impiegare Avastin per via intravitreale è necessario riformulare il farmaco, cioè scomporlo in tante piccole porzioni e questo è quello che la legge n. 648/1996 ammette a livello nazionale per alcuni farmaci e che, quotidianamente, avviene per il trattamento di diverse patologie (anche per l impiego pediatrico di un farmaco formulato per adulti ); l Avastin ha un prezzo di circa quindici - venti euro (considerando la quantità di principio attivo utilizzata per la terapia della AMD mediante iniezione intravitreale), mentre il costo del Lucentis è maggiore di circa volte (anche dell ordine dei euro), il Macugen ha un prezzo elevato circa pari a quello di Lucentis; l ammontare della spesa sostenuta, dal 2005 ad oggi, dalla Regione Emilia-Romagna per Bevacizumab (Avastin) solo per l uso in oculistica escludendo l uso oncologico e per Ranibizumab (Lucentis) è il seguente: mesi 2012 Bevacizumab (Avastin) Ranibizumab (Lucentis) in cui appare evidente come, nei soli primi 9 mesi del 2012, il costo sopportato dalla collettività per Lucentis sia stato maggiore a quello sopportato per 7 anni per Avastin; fino al dicembre 2008, Ranibizumab (Lucentis) e Pegaptanib (Macugen), non erano rimborsabili dal SSN, a differenza del Bevacizumab (Avastin) che veniva rimborsato come farmaco off label per il trattamento delle maculopatie essudative e del glaucoma neovascolare; successivamente, l AIFA ha inserito i farmaci Ranibizumab e Pegaptanib in classe H/OSP1 per il trattamento della AMD essudativa legata all'età nelle seguenti condizioni: diagnosi di degenerazione maculare essudativa legata all'età; acuità visiva con la migliore correzione 2/10; trattamento per occhio singolo;
3 nessuna precedente iniezione intravitreale con altri inibitori della neovascolarizzazione (Bevacizumab); confezione uso singolo; payment by results per i pazienti non responder: payback totale fino a tre dosi, tramite nota di accredito da parte dell azienda farmaceutica all azienda ospedaliera; ancora successivamente all inserimento di Ranibizumab (Lucentis) e Pegaptanib (Macugen) in classe H/OSP1, l AIFA ha provveduto all esclusione del Bevacizumab (Avastin) dall elenco dei farmaci erogabili ai sensi della legge 648/96 per l indicazione relativa al trattamento off-label della AMD essudativa legata all'età; anche dopo il 2007 i medici oculisti hanno continuato ad utilizzare Avastin per uso intravitreale per diverse patologie afferenti e tale comportamento è dipeso dagli studi comparativi di confronto tra Avastin e Lucentis (studio CATT Research Group, condotto su 1208 pazienti dall istituto americano National Eye Institute e studio IVAN - condotto su 610 pazienti nel Regno Unito) che concludevano per una sovrapponibilità tra i farmaci, dal punto di vista di loro efficacia e sicurezza (la maggior parte degli effetti indesiderati dei farmaci anti VEGF è correlata alla procedura di iniezione, che è comune ad entrambi), a fronte di un potenziale risparmio nell uso di Bevacizumab, piuttosto che Ranibizumab; entrambi i farmaci derivano dallo stesso anticorpo e hanno il medesimo meccanismo d azione e sono stati sviluppati entrambi dall azienda Genentech che, due anni dopo la vendita del farmaco Lucentis a Novartis, è stata acquistata, per 46,8 miliardi di dollari, da Roche (azienda farmaceutica che commercializza Bevacizumab in Europa e che, negli Stati Uniti, commercializza Ranibizumab appunto attraverso la stessa Genentech); l unica differenza, tra i due farmaci, sarebbe rappresentata dal fatto che Bevacizumab è stato registrato in Europa come farmaco antitumorale nel 2005, mentre Ranibizumab è stato registrato per la degenerazione maculare senile nel 2007; anche la Società Oftalmologica Italiana (SOI) evidenzia che i risultati dello studio CATT, sopra citato, sono un indiscutibile conferma della validità di questa terapia intravitreale, e che l impiego off-label di Avastin da parte degli oculisti è validato scientificamente; considerato che la Commissione Regionale del Farmaco (CRF) della Regione Emilia-Romagna, nella seduta del 16 luglio 2009, decideva di adottare un protocollo d uso dei tre farmaci: Pegaptanib (Macugen), Ranibizumab (Lucentis) e Bevacizumab (Avastin), che prevedeva al punto 1: l uso prevalente di Bevacizumab (Avastin) per le motivazioni sopra illustrate (uso consolidato a livello nazionale e internazionale indipendentemente dall acuità visiva, sicurezza, economicità) l adozione della delibera di Giunta regionale n. 1628/2009 aveva consentito, a parità di condizioni di efficacia e di sicurezza dei Pegaptanib (Macugen), Ranibizumab (Lucentis) e Bevacizumab (Avastin), una significativa riduzione della spesa farmaceutica a carico del servizio sanitario pubblico e aveva tutelato, altresì, la libertà di scelta terapeutica da parte dei professionisti del SSN; con la nota del responsabile del Servizio Politica del farmaco della Direzione Generale Sanità e politiche sociali della Regione Emilia-Romagna, del 5 ottobre 2012, prot. n. 2012/233505, in cui si fa riferimento alla nota AIFA del 3 ottobre 2012, si provvedeva a sospendere, con decorrenza immediata, l uso di Avastin per via intravitreale; nella stessa nota si ammetteva che per i nuovi casi riconducibili alla legge 648/1996 al momento non vi sono alternative terapeutiche registrate, pertanto si attendono indicazioni dall Agenzia ; successivamente, in data 18 ottobre 2012, l AIFA ha emanato la nota prot. STDG 1886.P in cui si comunicava che: ferma restando l esclusione di Avastin (Bevacizumab) dall elenco dei medicinali erogabili ai sensi della Legge n. 648/96, si fa presente che per gli usi offlabel di questo prodotto i medici, alla luce delle considerazioni svolte al precedente paragrafo, sulla base della propria valutazione e responsabilità, potranno comunque, in applicazione della legge n. 94/1998 (cd. legge Di Bella), prescrivere il suddetto farmaco così facendo, cioè togliendo l Avastin
4 dall ambito della legge 648, si è escluso il farmaco dalla rimborsabilità, da parte del SSN, non comportando, invece, alcuna implicazione restrittiva alla possibilità di utilizzare Avastin off label diversa da quelle che c erano in precedenza e legate all AIC del prodotto ed alla legge Di Bella; il 14 settembre 2012, era stato emanato il D.L. 158/2012 Disposizioni urgenti per promuovere lo sviluppo del Paese mediante un più alto livello di tutela della salute (cosiddetto decreto Balduzzi) n. 189 che, all art. 11, comma 3, lettera b) prevedeva se è disponibile un alternativa terapeutica nell ambito dei farmaci autorizzati, la presenza nell elenco di cui al precedente periodo del medicinale non autorizzato, con conseguente erogazione dello stesso a carico del Servizio Sanitario Nazionale, è ammessa unicamente nel caso in cui a giudizio della Commissione tecnico scientifica dell AIFA, il medicinale possieda un profilo di sicurezza, con riferimento all impiego proposto, non inferiore a quella del farmaco autorizzato e quest ultimo risulti eccessivamente oneroso per il Servizio sanitario nazionale, agli effetti del presente comma il medicinale già autorizzato è considerato eccessivamente oneroso se il costo medio della terapia basata sul suo impiego supera di almeno il 50 per cento il costo medio della terapia basata sull impiego del farmaco non autorizzato, quindi, introducendo modificazioni, ai fini della rimborsabilità dei farmaci e consentendo di utilizzare il farmaco off-label, ai sensi della cosiddetta legge Di Bella, anche quando esistesse un farmaco on-label registrato, ma molto più costoso, affrontava il problema dell Avastin, ma questa parte è stata cassata dalla legge di conversione dell 8 novembre 2012; nell ordinanza n. 378, del 2 febbraio 2012, del Tribunale Amministrativo dell Emilia- Romagna, con cui si ritiene rilevante la questione di legittimità costituzionale dell art. 1, comma 4 del D.L. n. 536 del 1996, convertito dalla legge n. 448 del 23 dicembre 1996 e dell art. 8 del D.Lgs. 219 del 2006, in relazione al ricorso, proposto da Novartis Farma s.p.a. contro la Regione Emilia-Romagna, sulla possibilità di somministrare e rimborsare Bevacizumab (Avastin) quale farmaco off-label anche per le patologie per cui esista farmaco on-label (Ranibizumab (Lucentis) e Pegaptanib (Macugen)) si afferma:... In tal modo si porrebbe rimedio a situazioni nelle quali, come è avvenuto nel caso in questione, a causa di un inesistente concorrenza tra impresa produttrice del farmaco off label e quella produttrice del farmaco ordinariamente utilizzato on label, l obbligo per il Servizio Sanitario Regionale di prescrivere il farmaco on label costringerebbe l amministrazione regionale e, dunque la collettività, a sopportare un costo economico oggettivamente eccessivo, se non addirittura esorbitante, derivante dall alto prezzo del secondo farmaco... rispetto a quello - comunque parimenti efficace e già da tempo utilizzato quale farmaco off label per la cura della patologia oftalmica D.M.L.E. fino al momento dell immissione in commercio di Lucentis.... A causa di quanto dispongono le norme sospettate di illegittimità costituzionale, la Regione non può, infatti, correttamente ed efficacemente esercitare il necessario, dovuto controllo sulla sua spesa sanitaria, essendo costretta a sopportare l alto prezzo dell unico farmaco autorizzato per la cura di una determinata patologia che è in concreto a carico del Servizio Sanitario Regionale, senza avere alcuna possibilità di attivarsi essa stessa - stante l interessata inerzia della impresa produttrice - per richiedere l autorizzazione di altro farmaco, già utilizzato off label, ma avente, tuttavia, riconosciuta e provata pari efficacia rispetto al farmaco ufficiale ed un costo, come si è accertato, considerevolmente inferiore. ; il 22 novembre 2012 l AIFA ha inviato una nota all AIMO (Associazione Italiana Medici Oculisti) in cui si legge, tra l altro: AIFA è peraltro consapevole di alcuni problemi al momento presenti per il trattamento di pazienti con patologie così gravi che potrebbero comportare la perdita della vista. Le problematiche più importanti sembrerebbero soprattutto riguardare il trattamento del secondo occhio in soggetti affetti da degenerazione maculare bilaterale e i pazienti con acuità visiva inferiore a 2/10, condizioni per le quali il farmaco Lucentis non era rimborsato.... Inoltre, per quanto riguarda il problema relativo al costo molto elevato delle alternative, in particolare di Lucentis che, per una diversa disponibilità di risorse economiche potrebbe penalizzare i pazienti di alcune Regioni, AIFA ha provveduto a negoziare con la ditta produttrice di Lucentis condizioni significativamente più favorevoli per il SSN. ;
5 evidenziato che la recente revisione della scheda tecnica del farmaco Avastin, ha portato all inserimento delle complicanze legate al suo uso per somministrazione intravitreale ma, come già detto sopra, le complicanze descritte sono tipiche di tutti i farmaci anti-vegf e, quindi, anche dei farmaci on-label come Lucentis e Macugen; i dati clinici disponibili sono numerosi e indicano tutti una sostanziale equivalenza tra Bevacizumab (Avastin) e Ranibizumab (Lucentis), nonostante l evidente sforzo congiunto, per far apparire migliore il Ranibizumab, di Genentech (che commercializza il prodotto nei soli Stati Uniti) e Novartis (che lo commercializza nel resto del mondo) e non si riesce a giustificare l enorme divario di costo esistente tra i due prodotti, che possiedono solo minime differenze di efficacia e sicurezza di impiego. Interroga la Giunta regionale e l assessore competente per sapere: 1. quale sia il quadro aggiornato relativo alla vicenda, sopra esposta, relativamente a tutti gli aspetti esaminati; 2. se siano state assunte ulteriori determinazioni sull utilizzo a carico del SSR di Bevacizumab, in particolare se, alla luce di quanto esposto sopra, sia intenzione della Regione permettere l utilizzo del Bevacizumab per uso intravitreale, in pendenza del giudizio di costituzionalità, nel rispetto delle disposizioni di cui alla Legge 94/1998 (c.d. Legge Di Bella), alle strutture sanitarie dipendenti dal Servizio Sanitario Regionale dell Emilia Romagna, ovvero se si ritenga di persistere nel negare detta possibilità e, in tal caso le ragioni sottese a tale scelta e la corrispondente incidenza sul bilancio regionale; 3. se la Regione abbia dato seguito alla previsione, di cui alla delibera di Giunta regionale n. 186/2012, di intraprendere iniziative in sede legislativa, normativa ed amministrativa, e nei confronti delle altre Istituzioni competenti, con lo scopo di ricercare e costruire tutte le più utili misure per assicurare maggiore coerenza tra le competenze e responsabilità degli organi statali in materia di farmaci erogabili a carico del SSN e le competenze e responsabilità regionali sul governo della spesa farmaceutica e, in caso affermativo, quali siano stati gli atti assunti; 4. se, come previsto dalla medesima delibera di Giunta regionale n. 186/2012, sia richiesto l accesso agli atti istruttori e propedeutici alla risposta del Direttore Generale di AIFA del 13 febbraio 2012 e quali siano state le eventuali risultanze; 5. se la Commissione Regionale del Farmaco della Regione Emilia-Romagna sia stata consultata, prima di disporre l inutilizzabilità del Bevacizumab per via intravitreale con il provvedimento del responsabile del Servizio Politica del farmaco della Direzione Generale Sanità e politiche sociali della Regione Emilia-Romagna, del 5 ottobre 2012, prot. n. 2012/ e, in caso di risposta positiva, quale sia stato il parere fornito, in caso di risposta negativa, le motivazioni per cui non si sia ritenuto di consultarla; 6. se la Commissione Regionale del Farmaco della Regione Emilia-Romagna sia stata consultata dopo il provvedimento di cui al punto precedente e, in caso di risposta positiva quale sia stato il parere fornito, in caso di risposta negativa, perché non sia stata consultata; 7. quali siano, nel dettaglio, le condizioni, significativamente più favorevoli per il SSN, che AIFA ha provveduto a negoziare con la ditta produttrice di Lucentis di cui alla nota della stessa AIFA del 22 novembre 2012 sopra citata; 8. se non si ritenga necessario un coordinamento ed una unità d intenti con le altre Regioni e, innanzi tutto, con la Regione Veneto oggetto anch essa di ricorsi al TAR, da parte di Novartis contro atti regionali; 9. se non ritenga il comportamento delle aziende coinvolte, in special modo Novartis e Roche, meritevole di una segnalazione alle autorità competenti, stante l inesistente concorrenza tra impresa produttrice del farmaco off label e quella produttrice del farmaco ordinariamente
6 utilizzato on label e stante l esistenza di una probabile intesa nascosta in danno della collettività. Il Consigliere Giovanni Favia
I SESSIONE: FOCUS SULLE MALATTIE RARE
 CORSO DI FORMAZIONE SUL CAMPO A CURA DELL OSSERVATORIO NAZIONALE SIFO Torino, 5 Giugno 2015 I SESSIONE: FOCUS SULLE MALATTIE RARE Erica Daina Coordinamento Malattie Rare Regione Lombardia Centro di Ricerche
CORSO DI FORMAZIONE SUL CAMPO A CURA DELL OSSERVATORIO NAZIONALE SIFO Torino, 5 Giugno 2015 I SESSIONE: FOCUS SULLE MALATTIE RARE Erica Daina Coordinamento Malattie Rare Regione Lombardia Centro di Ricerche
UTILIZZO DEI MEDICINALI FUORI INDICAZIONE (OFF-LABEL)
 Azienda Ospedaliero- Universitaria Maggiore della Carità di Novara DIREZIONE SANITARIA S.C.D.O. FARMACIA DATA: 20.02.2008 REV. N 00 PAG. 1/8 UTILIZZO DEI MEDICINALI FUORI INDICAZIONE (OFF-LABEL) REDATTO
Azienda Ospedaliero- Universitaria Maggiore della Carità di Novara DIREZIONE SANITARIA S.C.D.O. FARMACIA DATA: 20.02.2008 REV. N 00 PAG. 1/8 UTILIZZO DEI MEDICINALI FUORI INDICAZIONE (OFF-LABEL) REDATTO
Allegato A Prescrizione, impiego ed erogazione di farmaci off-label
 Allegato A Prescrizione, impiego ed erogazione di farmaci off-label PREMESSA L'autorizzazione all'immissione in commercio (AIC) per un medicinale viene rilasciata, dagli enti regolatori preposti, a seguito
Allegato A Prescrizione, impiego ed erogazione di farmaci off-label PREMESSA L'autorizzazione all'immissione in commercio (AIC) per un medicinale viene rilasciata, dagli enti regolatori preposti, a seguito
IL DIRETTORE GENERALE. Visto l art. 8, della legge 24 dicembre 1993, n. 537 e s.m.i.;
 PRONTUARIO FARMACEUTICO NAZIONALE 2006 Elenco dei medicinali di classe a) rimborsabili dal Servizio sanitario nazionale (SSN) ai sensi dell art. 48, comma 5, lettera c), del decreto-legge 30 settembre
PRONTUARIO FARMACEUTICO NAZIONALE 2006 Elenco dei medicinali di classe a) rimborsabili dal Servizio sanitario nazionale (SSN) ai sensi dell art. 48, comma 5, lettera c), del decreto-legge 30 settembre
AGENZIA ITALIANA DEL FARMACO
 AGENZIA ITALIANA DEL FARMACO DETERMINA 28 aprile 2017 Inserimento di una indicazione terapeutica del medicinale per uso umano «Bevacizumab Avastin» nell'elenco ex lege n. 648/1996 parziale modifica alla
AGENZIA ITALIANA DEL FARMACO DETERMINA 28 aprile 2017 Inserimento di una indicazione terapeutica del medicinale per uso umano «Bevacizumab Avastin» nell'elenco ex lege n. 648/1996 parziale modifica alla
AGENZIA ITALIANA DEL FARMACO
 AGENZIA ITALIANA DEL FARMACO DETERMINA 14 novembre 2012. Modifica alla Nota 13 di cui alla determina n. 163 del 15 luglio 2011. (Determina n. STDG 2049.P) IL DIRETTORE GENERALE Visti gli articoli 8 e 9
AGENZIA ITALIANA DEL FARMACO DETERMINA 14 novembre 2012. Modifica alla Nota 13 di cui alla determina n. 163 del 15 luglio 2011. (Determina n. STDG 2049.P) IL DIRETTORE GENERALE Visti gli articoli 8 e 9
DELIBERAZIONE DELLA GIUNTA REGIO- NALE 20 gennaio 2009, n. 20
 DELIBERAZIONE DELLA GIUNTA REGIO- NALE 20 gennaio 2009, n. 20 Riformulazione D.G.R. n. 362/05 e 1027/06. Adozione definitiva note AIFA anni 2006, 2007 e 2008. Assente l Assessore alle Politiche della Salute,
DELIBERAZIONE DELLA GIUNTA REGIO- NALE 20 gennaio 2009, n. 20 Riformulazione D.G.R. n. 362/05 e 1027/06. Adozione definitiva note AIFA anni 2006, 2007 e 2008. Assente l Assessore alle Politiche della Salute,
I. R. C. C.S. Rev. 0 Pag. 1/12
 Pag. 1/12 REDAZIONE VERIFICA APPROVAZIONE DATA FUNZIONE FIRMA DIRETTORE SANITARIO DI PRESIDIO DIRETTORE SANITARIO DI PRESIDIO DIRETTORE SANITARIO DI PRESIDIO 1 Pag. 2/12 INDICE 1. INTRODUZIONE 2. DEFINIZIONE
Pag. 1/12 REDAZIONE VERIFICA APPROVAZIONE DATA FUNZIONE FIRMA DIRETTORE SANITARIO DI PRESIDIO DIRETTORE SANITARIO DI PRESIDIO DIRETTORE SANITARIO DI PRESIDIO 1 Pag. 2/12 INDICE 1. INTRODUZIONE 2. DEFINIZIONE
Modifica Nota AIFA 13 27/11/2012 (Livello 2)
 Modifica Nota AIFA 13 27/11/2012 (Livello 2) GAZZETTA UFFICIALE N.277 DEL 27 NOVEMBRE 2012 AGENZIA ITALIANA DEL FARMACO DETERMINA 14 Novembre 2012 Modifica alla Nota 13 di cui alla determina n. 163 del
Modifica Nota AIFA 13 27/11/2012 (Livello 2) GAZZETTA UFFICIALE N.277 DEL 27 NOVEMBRE 2012 AGENZIA ITALIANA DEL FARMACO DETERMINA 14 Novembre 2012 Modifica alla Nota 13 di cui alla determina n. 163 del
Titolare A.I.C.: NOVARTIS EUROPHARM LTD
 DETERMINAZIONE 4 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Onbrez Breezhaler» (indacaterolo) - autorizzata con procedura centralizzata europea dalla Commissione Europea.
DETERMINAZIONE 4 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Onbrez Breezhaler» (indacaterolo) - autorizzata con procedura centralizzata europea dalla Commissione Europea.
Terapie senza AIC e non in CTs LEGGE 648. Maggio
 Terapie senza AIC e non in CTs LEGGE 648 Maggio 2012 1 Quadro normativo Legge 648 del 1996: rimborso per farmaci: Non ancora autorizzati in Italia In sperimentazione clinica ma ancora senza AIC Per indicazioni
Terapie senza AIC e non in CTs LEGGE 648 Maggio 2012 1 Quadro normativo Legge 648 del 1996: rimborso per farmaci: Non ancora autorizzati in Italia In sperimentazione clinica ma ancora senza AIC Per indicazioni
Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 1/7
 giunta regionale Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 1/7 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO
giunta regionale Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 1/7 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO
GU n. 45 del AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 11 febbraio 2008
 GU n. 45 del 22-2-2008 AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 11 febbraio 2008 Approvazione dei piani terapeutici AIFA (template) relativi alle ex Note AIFA 12, 32, 32- bis. (GU n. 45 del 22-2-2008)
GU n. 45 del 22-2-2008 AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 11 febbraio 2008 Approvazione dei piani terapeutici AIFA (template) relativi alle ex Note AIFA 12, 32, 32- bis. (GU n. 45 del 22-2-2008)
Componente e Responsabile Qualità Comitato di Etica ASL Salerno Segretario Scientifico Commissione Terapeutica Aziendale ASL Salerno
 L IMPIEGO OFF-LABEL DEI FARMACI Verona 30 novembre 2013 Brunella Piucci Farmacista P.O. Nocera Inferiore - Salerno Componente e Responsabile Qualità Comitato di Etica ASL Salerno Segretario Scientifico
L IMPIEGO OFF-LABEL DEI FARMACI Verona 30 novembre 2013 Brunella Piucci Farmacista P.O. Nocera Inferiore - Salerno Componente e Responsabile Qualità Comitato di Etica ASL Salerno Segretario Scientifico
Regime di rimborsabilità e prezzo di vendita del medicinale PROLIA (denosumab). (Determinazione/C n. 2535/2011).
 DETERMINAZIONE 8 agosto 2011. Regime di rimborsabilità e prezzo di vendita del medicinale PROLIA (denosumab). (Determinazione/C n. 2535/2011). Regime di rimborsabilità e prezzo di vendita della specialità
DETERMINAZIONE 8 agosto 2011. Regime di rimborsabilità e prezzo di vendita del medicinale PROLIA (denosumab). (Determinazione/C n. 2535/2011). Regime di rimborsabilità e prezzo di vendita della specialità
DETERMINAZIONE 24 novembre Regime di rimborsabilità e prezzo di vendita del medicinale per uso umano «Zarzio». (Determinazione /C320/2009).
 DETERMINAZIONE 24 novembre 2009. Regime di rimborsabilità e prezzo di vendita del medicinale per uso umano «Zarzio». (Determinazione /C320/2009). Regime di rimborsabilità e prezzo di vendita della specialità
DETERMINAZIONE 24 novembre 2009. Regime di rimborsabilità e prezzo di vendita del medicinale per uso umano «Zarzio». (Determinazione /C320/2009). Regime di rimborsabilità e prezzo di vendita della specialità
DECRETI E DELIBERE DI ALTRE AUTORITÀ
 DECRETI E DELIBERE DI ALTRE AUTORITÀ DETERMINAZIONE 7 luglio 2010. AGENZIA ITALIANA DEL FARMACO Regime di rimborsabilità e prezzo di vendita del medicinale «Victoza». (Determinazione/C 397/2010). Regime
DECRETI E DELIBERE DI ALTRE AUTORITÀ DETERMINAZIONE 7 luglio 2010. AGENZIA ITALIANA DEL FARMACO Regime di rimborsabilità e prezzo di vendita del medicinale «Victoza». (Determinazione/C 397/2010). Regime
R E P U B B L I C A I T A L I A N A. Il Consiglio di Stato. in sede giurisdizionale (Sezione Terza) ORDINANZA
 N. 02021/2014 REG.PROV.CAU. N. 09113/2013 REG.RIC. R E P U B B L I C A I T A L I A N A Il Consiglio di Stato in sede giurisdizionale (Sezione Terza) ha pronunciato la presente ORDINANZA sul ricorso numero
N. 02021/2014 REG.PROV.CAU. N. 09113/2013 REG.RIC. R E P U B B L I C A I T A L I A N A Il Consiglio di Stato in sede giurisdizionale (Sezione Terza) ha pronunciato la presente ORDINANZA sul ricorso numero
R E P U B B L I C A I T A L I A N A. Il Consiglio di Stato. in sede giurisdizionale (Sezione Terza) ORDINANZA
 N. 02021/2014 REG.PROV.CAU. N. 09113/2013 REG.RIC. R E P U B B L I C A I T A L I A N A Il Consiglio di Stato in sede giurisdizionale (Sezione Terza) ha pronunciato la presente ORDINANZA sul ricorso numero
N. 02021/2014 REG.PROV.CAU. N. 09113/2013 REG.RIC. R E P U B B L I C A I T A L I A N A Il Consiglio di Stato in sede giurisdizionale (Sezione Terza) ha pronunciato la presente ORDINANZA sul ricorso numero
Rispetto delle indicazioni registrate Malattie Rare. Alessandra Ferretti Dip. Assistenza Farmaceutica AUSL Reggio Emilia
 Rispetto delle indicazioni registrate Malattie Rare Alessandra Ferretti Dip. Assistenza Farmaceutica AUSL Reggio Emilia Ricettazione in MG Reggio Emilia 25 febbraio 2009 INDICAZIONI TERAPEUTICHE AUTORIZZATE
Rispetto delle indicazioni registrate Malattie Rare Alessandra Ferretti Dip. Assistenza Farmaceutica AUSL Reggio Emilia Ricettazione in MG Reggio Emilia 25 febbraio 2009 INDICAZIONI TERAPEUTICHE AUTORIZZATE
IL DIRETTORE GENERALE. VISTI gli articoli 8 e 9 del decreto legislativo 30 luglio 1999, n. 300;
 DETERMINAZIONE 4 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Temozolomide Teva» (temozolomide) - autorizzata con procedura centralizzata europea dalla Commissione Europea.
DETERMINAZIONE 4 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Temozolomide Teva» (temozolomide) - autorizzata con procedura centralizzata europea dalla Commissione Europea.
Titolare A.I.C.: HOSPIRA UK LTD Queensway Royal Leamington Spa Warwickshire CV31 RW Regno Unito
 DETERMINAZIONE 4 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Temozolomide ospira» (temozolomide) - autorizzata con procedura centralizzata europea dalla Commissione Europea.
DETERMINAZIONE 4 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Temozolomide ospira» (temozolomide) - autorizzata con procedura centralizzata europea dalla Commissione Europea.
Bollettino Ufficiale della Regione Puglia - n. 97 del
 Bollettino Ufficiale della Regione Puglia - n. 97 del 17-8-2017 46693 DETERMINAZIONE DEL DIRIGENTE SEZIONE RISORSE UMANE E STRUMENTALI 27 luglio 2017, n. 307 Aggiornamento del Prontuario Terapeutico Regionale
Bollettino Ufficiale della Regione Puglia - n. 97 del 17-8-2017 46693 DETERMINAZIONE DEL DIRIGENTE SEZIONE RISORSE UMANE E STRUMENTALI 27 luglio 2017, n. 307 Aggiornamento del Prontuario Terapeutico Regionale
IL DIRETTORE GENERALE. VISTI gli articoli 8 e 9 del decreto legislativo 30 luglio 1999, n. 300;
 DETERMINAZIONE 6 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Nplate» (romiplostim) - autorizzata con procedura centralizzata europea dalla Commissione Europea. (Determinazione/C
DETERMINAZIONE 6 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Nplate» (romiplostim) - autorizzata con procedura centralizzata europea dalla Commissione Europea. (Determinazione/C
AUDIZIONE Camera dei Deputati. Malattie rare. Pierluigi Russo. Roma, 29 Aprile 2015
 AUDIZIONE Camera dei Deputati Malattie rare Pierluigi Russo Roma, 29 Aprile 2015 Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono personali e non impegnano in alcun
AUDIZIONE Camera dei Deputati Malattie rare Pierluigi Russo Roma, 29 Aprile 2015 Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono personali e non impegnano in alcun
Allegato 2 Documento sulla metodologia per l aggiornamento del Prontuario Farmaceutico Nazionale 2004
 Allegato 2 Documento sulla metodologia per l aggiornamento del Prontuario Farmaceutico Nazionale 2004 Aggiornamento del Prontuario Terapeutico Premessa Il presente documento è stato predisposto al fine
Allegato 2 Documento sulla metodologia per l aggiornamento del Prontuario Farmaceutico Nazionale 2004 Aggiornamento del Prontuario Terapeutico Premessa Il presente documento è stato predisposto al fine
GRUPPO DI LAVORO INTERDISCIPLINARE ED INTERAZIENDALE
 GRUPPO DI LAVORO INTERDISCIPLINARE ED INTERAZIENDALE Moduli di consenso informato Federica Pieri L eparina vista dal Farmacista Appropriatezza prescrittiva (evidenze efficacia/tossicità) Sostenibilità
GRUPPO DI LAVORO INTERDISCIPLINARE ED INTERAZIENDALE Moduli di consenso informato Federica Pieri L eparina vista dal Farmacista Appropriatezza prescrittiva (evidenze efficacia/tossicità) Sostenibilità
BOLLETTINO UFFICIALE DELLA REGIONE CAMPANIA - N. 67 DEL 19 DICEMBRE 2005
 BOLLETTINO UFFICIALE DELLA REGIONE CAMPANIA - N. 67 DEL 19 DICEMBRE 2005 REGIONE CAMPANIA - Giunta Regionale - Seduta del 26 novembre 2005 - Deliberazione N. 1690 - Area Generale di Coordinamento N. 20
BOLLETTINO UFFICIALE DELLA REGIONE CAMPANIA - N. 67 DEL 19 DICEMBRE 2005 REGIONE CAMPANIA - Giunta Regionale - Seduta del 26 novembre 2005 - Deliberazione N. 1690 - Area Generale di Coordinamento N. 20
funzioni di indirizzo vigilanza personalità giuridica di diritto pubblico e di autonomia organizzativa, patrimoniale, finanziaria e gestionale.
 AIFA. Art. 48,comma 13, del decreto-legge 30 settembre 2003,n.269,convertito nella legge 24 novembre 2003,n.326 Decreto 20 settembre 2004, n.245 Regolamento recante norme sull organizzazione ed il funzionamento
AIFA. Art. 48,comma 13, del decreto-legge 30 settembre 2003,n.269,convertito nella legge 24 novembre 2003,n.326 Decreto 20 settembre 2004, n.245 Regolamento recante norme sull organizzazione ed il funzionamento
SENATO DELLA REPUBBLICA XIV LEGISLATURA
 SENATO DELLA REPUBBLICA XIV LEGISLATURA N. 3447 DISEGNO DI LEGGE presentato dal Presidente del Consiglio dei ministri (BERLUSCONI) e dal Ministro della salute (STORACE) COMUNICATO ALLA PRESIDENZA IL 30
SENATO DELLA REPUBBLICA XIV LEGISLATURA N. 3447 DISEGNO DI LEGGE presentato dal Presidente del Consiglio dei ministri (BERLUSCONI) e dal Ministro della salute (STORACE) COMUNICATO ALLA PRESIDENZA IL 30
Azienda Usl3 di Pistoia protocollo uso farmaci off label (agg 2010)
 PRESCRIZIONI DI FARMACI AL DI FUORI DELLE INDICAZIONI AUTORIZZATE NEL DECRETO A.I.C TRATTAMENTI IN OFF LABEL La prescrizione di un farmaco per una indicazione clinica (e relative dosi, modi e tempi di
PRESCRIZIONI DI FARMACI AL DI FUORI DELLE INDICAZIONI AUTORIZZATE NEL DECRETO A.I.C TRATTAMENTI IN OFF LABEL La prescrizione di un farmaco per una indicazione clinica (e relative dosi, modi e tempi di
CRITERI PER LA VALUTAZIONE DEI FARMACI C(nn) DA PARTE DELLA COMMISSIONE REGIONALE DEL FARMACO (CRF)
 Direzione Generale Cura della Persona, Salute e Welfare Commissione Regionale Farmaco (D.G.R. 1540/2006 e 392/2015) Documento PTR n. 211 relativo a: CRITERI PER LA VALUTAZIONE DEI FARMACI C(nn) DA PARTE
Direzione Generale Cura della Persona, Salute e Welfare Commissione Regionale Farmaco (D.G.R. 1540/2006 e 392/2015) Documento PTR n. 211 relativo a: CRITERI PER LA VALUTAZIONE DEI FARMACI C(nn) DA PARTE
Regione Lazio. Decreti del Commissario ad Acta 23/01/ BOLLETTINO UFFICIALE DELLA REGIONE LAZIO - N. 7
 Regione Lazio Decreti del Commissario ad Acta Decreto del Commissario ad Acta 15 gennaio 2014, n. U00003 Modifica alla Deliberazione del 27 febbraio 2007, n.124. OGGETTO: Modifica alla Deliberazione del
Regione Lazio Decreti del Commissario ad Acta Decreto del Commissario ad Acta 15 gennaio 2014, n. U00003 Modifica alla Deliberazione del 27 febbraio 2007, n.124. OGGETTO: Modifica alla Deliberazione del
Allegato B al Decreto n. 147 del 19 agosto 2014 pag. 1/6
 giunta regionale Allegato B al Decreto n. 147 del 19 agosto 2014 pag. 1/6 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO
giunta regionale Allegato B al Decreto n. 147 del 19 agosto 2014 pag. 1/6 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO
Legislazione sui farmaci equivalenti, provvedimenti regionali, risparmi. farmaci genericati. Dott.ssa Maria Susanna Rivetti
 Legislazione sui farmaci equivalenti, provvedimenti regionali, risparmi realizzati e possibili con l uso dei farmaci genericati Dott.ssa Maria Susanna Rivetti NORMATIVA DI RIFERIMENTO LA LEGGE 425/1996
Legislazione sui farmaci equivalenti, provvedimenti regionali, risparmi realizzati e possibili con l uso dei farmaci genericati Dott.ssa Maria Susanna Rivetti NORMATIVA DI RIFERIMENTO LA LEGGE 425/1996
IL DIRETTORE GENERALE
 Italia Determinazione AIFA 16.07.2009 (GU n. 180 del 5-8-2009) Modifiche alla Nota AIFA 79 di cui alla determinazione dell'agenzia Italiana del Farmaco del 22 maggio 2009. IL DIRETTORE GENERALE Visti gli
Italia Determinazione AIFA 16.07.2009 (GU n. 180 del 5-8-2009) Modifiche alla Nota AIFA 79 di cui alla determinazione dell'agenzia Italiana del Farmaco del 22 maggio 2009. IL DIRETTORE GENERALE Visti gli
Bevacizumab vs Ranibizumab: esperienze dello studio CATT
 Bevacizumab vs Ranibizumab: esperienze dello studio CATT E stato pubblicato sul New England Journal of Medicine il risultato di un trial clinico randomizzato, multicentrico il cui scopo era confrontare
Bevacizumab vs Ranibizumab: esperienze dello studio CATT E stato pubblicato sul New England Journal of Medicine il risultato di un trial clinico randomizzato, multicentrico il cui scopo era confrontare
Diritto alla salute e sostenibilità in una sanità federale. La SIFO interroga e propone
 Diritto alla salute e sostenibilità in una sanità federale. La SIFO interroga e propone XXXI Congresso Nazionale SIFO Cagliari 6-8 ottobre 2010 Tavola rotonda Regole e strumenti di sistema e di indirizzo.
Diritto alla salute e sostenibilità in una sanità federale. La SIFO interroga e propone XXXI Congresso Nazionale SIFO Cagliari 6-8 ottobre 2010 Tavola rotonda Regole e strumenti di sistema e di indirizzo.
PROCEDURA AZIENDALE PER LA RICHIESTA DI MEDICINALI UTILIZZATI AL DI FUORI DELLE INDICAZIONI TERAPEUTICHE AUTORIZZATE
 UTILIZZATI AL DI FUORI DATA REVISIONE REDAZIONE VALIDAZIONE AUTORIZZAZIONE N ARCHIVIAZIONE Maggio 2016 Dott. Paolo Marchi (Specializzando 3 anno SSFO) Dott.ssa M. G. Moretti (Dirigente Farmacista) Dott.ssa
UTILIZZATI AL DI FUORI DATA REVISIONE REDAZIONE VALIDAZIONE AUTORIZZAZIONE N ARCHIVIAZIONE Maggio 2016 Dott. Paolo Marchi (Specializzando 3 anno SSFO) Dott.ssa M. G. Moretti (Dirigente Farmacista) Dott.ssa
Modifica Nota AIFA 13 (Determinazione 06 Giugno 2011) (Livello 2)
 Modifica Nota AIFA 13 (Determinazione 06 Giugno 2011) (Livello 2) GAZZETTA UFFICIALE N.163 DEL 15 LUGLIO 2011 AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 6 Giugno 2011 Modifiche alla Nota AIFA 13 di cui
Modifica Nota AIFA 13 (Determinazione 06 Giugno 2011) (Livello 2) GAZZETTA UFFICIALE N.163 DEL 15 LUGLIO 2011 AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 6 Giugno 2011 Modifiche alla Nota AIFA 13 di cui
DETERMINAZIONE 25 marzo Regime di rimborsabilità e prezzo di vendita del medicinale per uso umano «Ranexa». (Determinazione n. 360/2010).
 DETERMINAZIONE 25 marzo 2010. Regime di rimborsabilità e prezzo di vendita del medicinale per uso umano «Ranexa». (Determinazione n. 360/2010). Regime di rimborsabilità e prezzo di vendita della specialità
DETERMINAZIONE 25 marzo 2010. Regime di rimborsabilità e prezzo di vendita del medicinale per uso umano «Ranexa». (Determinazione n. 360/2010). Regime di rimborsabilità e prezzo di vendita della specialità
Regole e Qualità nell Industria Farmaceutica III incontro Nazionale dei Regulatory Affairs
 Regole e Qualità nell Industria Farmaceutica III incontro Nazionale dei Regulatory Affairs Legge Balduzzi: art. 11 Revisione del prontuario ed altre disposizioni dirette a favorire l impiego razionale
Regole e Qualità nell Industria Farmaceutica III incontro Nazionale dei Regulatory Affairs Legge Balduzzi: art. 11 Revisione del prontuario ed altre disposizioni dirette a favorire l impiego razionale
Decreto del Presidente in qualità di Commissario ad acta (delibera del Consiglio dei Ministri del 21 marzo 2013)
 OGGETTO: Modifica e integrazione al Decreto del Commissario ad acta U0003 del 15 gennaio. IL COMMISSARIO AD ACTA VISTA la Legge costituzionale 18 ottobre 2001, n.3; VISTO lo Statuto della Regione Lazio;
OGGETTO: Modifica e integrazione al Decreto del Commissario ad acta U0003 del 15 gennaio. IL COMMISSARIO AD ACTA VISTA la Legge costituzionale 18 ottobre 2001, n.3; VISTO lo Statuto della Regione Lazio;
DETERMINAZIONE 12 luglio Regime di rimborsabilità e prezzo di vendita del medicinale «Onglyza». (Determinazione/C 412/2010).
 DETERMINAZIONE 12 luglio 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Onglyza». (Determinazione/C 412/2010). Regime di rimborsabilità e prezzo di vendita della specialità medicinale
DETERMINAZIONE 12 luglio 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Onglyza». (Determinazione/C 412/2010). Regime di rimborsabilità e prezzo di vendita della specialità medicinale
IL DIRETTORE GENERALE. VISTI gli articoli 8 e 9 del decreto legislativo 30 luglio 1999, n. 300;
 DETERMINAZIONE 4 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Simponi» (golimumab) - autorizzata con procedura centralizzata europea dalla Commissione Europea. (Determinazione/C
DETERMINAZIONE 4 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Simponi» (golimumab) - autorizzata con procedura centralizzata europea dalla Commissione Europea. (Determinazione/C
Ministero della Salute
 Ministero della Salute Disposizioni in materia di medicinali per terapie avanzate preparati su IL MINISTRO Visto il decreto legislativo 24 aprile 2006, n. 219 successive direttive di modifica) relativa
Ministero della Salute Disposizioni in materia di medicinali per terapie avanzate preparati su IL MINISTRO Visto il decreto legislativo 24 aprile 2006, n. 219 successive direttive di modifica) relativa
genziali nelle società in house della Regione Puglia; - di pubblicare il presente provvedimento sul B.U.R.P.
 13820 genziali nelle società in house della Regione Puglia; - di pubblicare il presente provvedimento sul B.U.R.P. Il Segretario della Giunta Teresa Scaringi Il Presidente della Giunta Alba Sasso DELIBERAZIONE
13820 genziali nelle società in house della Regione Puglia; - di pubblicare il presente provvedimento sul B.U.R.P. Il Segretario della Giunta Teresa Scaringi Il Presidente della Giunta Alba Sasso DELIBERAZIONE
FARMACI e DINTORNI FARMACI OFF-LABEL. Dott.ssa Stella Sferra Dipartimento Farmaceutico Interaziendale Ferrara, 16 Febbraio 2008
 Dipartimento Farmaceutico Interaziendale FARMACI e DINTORNI FARMACI OFF-LABEL Dott.ssa Stella Sferra Dipartimento Farmaceutico Interaziendale Ferrara, 16 Febbraio 2008 FINANZIARIA 2007 Art. 796 (comma
Dipartimento Farmaceutico Interaziendale FARMACI e DINTORNI FARMACI OFF-LABEL Dott.ssa Stella Sferra Dipartimento Farmaceutico Interaziendale Ferrara, 16 Febbraio 2008 FINANZIARIA 2007 Art. 796 (comma
IL DIRETTORE GENERALE
 GAZZETTA UFFICIALE N.270 DEL 18 NOVEMBRE 2010 AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 2 Novembre 2010 Aggiornamento del Piano terapeutico Aifa per prescrizione di fattori di crescita granulocitari
GAZZETTA UFFICIALE N.270 DEL 18 NOVEMBRE 2010 AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 2 Novembre 2010 Aggiornamento del Piano terapeutico Aifa per prescrizione di fattori di crescita granulocitari
Bollettino Ufficiale della Regione Puglia - n. 59 del
 25496 Bollettino Ufficiale della Regione Puglia - n. 59 del 23-5-2017 DELIBERAZIONE DELLA GIUNTA REGIONALE 09 maggio 2017, n. 700 Misure urgenti per la razionalizzazione della spesa farmaceutica - Interventi
25496 Bollettino Ufficiale della Regione Puglia - n. 59 del 23-5-2017 DELIBERAZIONE DELLA GIUNTA REGIONALE 09 maggio 2017, n. 700 Misure urgenti per la razionalizzazione della spesa farmaceutica - Interventi
TRATTAMENTO FARMACOLOGICO DELLA DISFUNZIONE ERETTILE NEI SOGGETTI MEDULLOLESI O SOTTOPOSTI A PROSTATECTOMIA RADICALE
 Progr.Num. 958/2015 GIUNTA DELLA REGIONE EMILIA ROMAGNA Questo giorno lunedì 20 del mese di luglio dell' anno 2015 si è riunita nella residenza di la Giunta regionale con l'intervento dei Signori: via
Progr.Num. 958/2015 GIUNTA DELLA REGIONE EMILIA ROMAGNA Questo giorno lunedì 20 del mese di luglio dell' anno 2015 si è riunita nella residenza di la Giunta regionale con l'intervento dei Signori: via
DECRETI E DELIBERE DI ALTRE AUTORITÀ
 DECRETI E DELIBERE DI ALTRE AUTORITÀ DETERMINAZIONE 13 gennaio 2010. AGENZIA ITALIANA DEL FARMACO Aggiornamento della classificazione, ai fini della fornitura, di medicinali rimborsati dal Servizio sanitario
DECRETI E DELIBERE DI ALTRE AUTORITÀ DETERMINAZIONE 13 gennaio 2010. AGENZIA ITALIANA DEL FARMACO Aggiornamento della classificazione, ai fini della fornitura, di medicinali rimborsati dal Servizio sanitario
ALLEGATO TECNICO PER PROGETTI DI FARMACOVIGILANZA ATTIVA FINANZIABILI ATTRAVERSO I FONDI FV 2010/11
 Allegato B ALLEGATO TECNICO PER PROGETTI DI FARMACOVIGILANZA ATTIVA FINANZIABILI ATTRAVERSO I FONDI FV 2010/11 REGIONE: Sardegna RESPONSABILI TECNICO-SCIENTIFICO DEL PROGETTO nome: Michela cognome: Pellecchia
Allegato B ALLEGATO TECNICO PER PROGETTI DI FARMACOVIGILANZA ATTIVA FINANZIABILI ATTRAVERSO I FONDI FV 2010/11 REGIONE: Sardegna RESPONSABILI TECNICO-SCIENTIFICO DEL PROGETTO nome: Michela cognome: Pellecchia
ORIGINALE DELIBERAZIONE DEL DIRETTORE GENERALE N. 565 del 09/10/2015
 DELIBERAZIONE DEL DIRETTORE GENERALE N. 565 del 09/10/2015 Il Direttore Generale dell Azienda U.L.S.S. n. 21, dott. Massimo Piccoli, nominato con D.P.G.R.V. n. 240 del 29/12/2012, coadiuvato dai Direttori:
DELIBERAZIONE DEL DIRETTORE GENERALE N. 565 del 09/10/2015 Il Direttore Generale dell Azienda U.L.S.S. n. 21, dott. Massimo Piccoli, nominato con D.P.G.R.V. n. 240 del 29/12/2012, coadiuvato dai Direttori:
Angelo Bianchetti Gruppo di Ricerca Geriatrica, Brescia Istituto Clinico S.Anna, Gruppo San Donato, Brescia
 LA PRESCRIZIONE DEI FARMACI ANTIPSICOTICI NEI SOGGETTI CON DEMENZA: LA SITUAZIONE ITALIANA Angelo Bianchetti Gruppo di Ricerca Geriatrica, Brescia Istituto Clinico S.Anna, Gruppo San Donato, Brescia LA
LA PRESCRIZIONE DEI FARMACI ANTIPSICOTICI NEI SOGGETTI CON DEMENZA: LA SITUAZIONE ITALIANA Angelo Bianchetti Gruppo di Ricerca Geriatrica, Brescia Istituto Clinico S.Anna, Gruppo San Donato, Brescia LA
DETERMINAZIONE 17 dicembre 2008
 DETERMINAZIONE 17 dicembre 2008 Regime di rimborsabilita' e prezzo di vendita del medicinale «Eucreas» (vildagliptin + metformina cloridrato), autorizzata con procedura centralizzata europea dalla Commissione
DETERMINAZIONE 17 dicembre 2008 Regime di rimborsabilita' e prezzo di vendita del medicinale «Eucreas» (vildagliptin + metformina cloridrato), autorizzata con procedura centralizzata europea dalla Commissione
Delibera della Giunta Regionale n. 665 del 08/10/2010
 Delibera della Giunta Regionale n. 665 del 08/10/2010 A.G.C. 20 Assistenza Sanitaria Settore 4 Farmaceutico Oggetto dell'atto: PRONTUARIO TERAPEUTICO OSPEDALIERO REGIONALE O P.T.O.R. 2009-2010- AGGIORNAMENTO
Delibera della Giunta Regionale n. 665 del 08/10/2010 A.G.C. 20 Assistenza Sanitaria Settore 4 Farmaceutico Oggetto dell'atto: PRONTUARIO TERAPEUTICO OSPEDALIERO REGIONALE O P.T.O.R. 2009-2010- AGGIORNAMENTO
I piani terapeutici informatizzati in Regione Liguria. Dott.ssa Maria Susanna Rivetti
 I piani terapeutici informatizzati in Regione Liguria Dott.ssa Maria Susanna Rivetti 1 Note limitative Con il provvedimento 30 dicembre 1993 di riclassificazione dei medicinali sono state introdotte le
I piani terapeutici informatizzati in Regione Liguria Dott.ssa Maria Susanna Rivetti 1 Note limitative Con il provvedimento 30 dicembre 1993 di riclassificazione dei medicinali sono state introdotte le
Modalità di presentazione e tipologia dei dati da inserire nelle banche dati per il monitoraggio della terapia genica e cellulare somatica
 Modalità di presentazione e tipologia dei dati da inserire nelle banche dati per il monitoraggio della terapia genica e cellulare somatica IL PRESIDENTE DELL ISTITUTO SUPERIORE DI SANITÀ VISTO il decreto
Modalità di presentazione e tipologia dei dati da inserire nelle banche dati per il monitoraggio della terapia genica e cellulare somatica IL PRESIDENTE DELL ISTITUTO SUPERIORE DI SANITÀ VISTO il decreto
Approvato il 7 Marzo Prot. 045/S/2013/I
 Ruolo della medicina basata sull evidenza per l accesso alla terapia intravitreale off label da parte di giovani pazienti affetti da maculopatia dovuta alla miopia elevata DOCUMENTO UFFICIALE DELLA SOCIETA
Ruolo della medicina basata sull evidenza per l accesso alla terapia intravitreale off label da parte di giovani pazienti affetti da maculopatia dovuta alla miopia elevata DOCUMENTO UFFICIALE DELLA SOCIETA
Open Speech: l AIFA incontra le Associazioni 8 febbraio 2013 Ad un anno dall incontro cosa è successo in termini di coinvolgimento delle associazioni?
 Open Speech: l AIFA incontra le Associazioni 8 febbraio 2013 Ad un anno dall incontro cosa è successo in termini di coinvolgimento delle associazioni? Le maggiori criticità nell accesso al farmaco dal
Open Speech: l AIFA incontra le Associazioni 8 febbraio 2013 Ad un anno dall incontro cosa è successo in termini di coinvolgimento delle associazioni? Le maggiori criticità nell accesso al farmaco dal
PROPOSTA DI DELIBERAZIONE DELLA GIUNTA REGIONALE
 DIPARTIMENTO PROMOZIONE DELLA SALUTE, DEL BENESSERE SOCIALE E DELLO SPORT PER TUTTI SEZIONE RISORSE STRUMENTALI E TECNOLOGICHE PROPOSTA DI DELIBERAZIONE DELLA GIUNTA REGIONALE Codice CIFRA: SIS/DEL/2017/
DIPARTIMENTO PROMOZIONE DELLA SALUTE, DEL BENESSERE SOCIALE E DELLO SPORT PER TUTTI SEZIONE RISORSE STRUMENTALI E TECNOLOGICHE PROPOSTA DI DELIBERAZIONE DELLA GIUNTA REGIONALE Codice CIFRA: SIS/DEL/2017/
VISTA la segnalazione della Società Oftalmologica Italiana, pervenuta in data 18 gennaio 2013, e successivamente integrata in data 25 gennaio 2013;
 I760 - ROCHE-NOVARTIS/FARMACI AVASTIN E LUCENTIS Provvedimento n. 24207 L AUTORITÀ GARANTE DELLA CONCORRENZA E DEL MERCATO NELLA SUA ADUNANZA del 6 febbraio 2013; SENTITO il Relatore Professor Piero Barucci;
I760 - ROCHE-NOVARTIS/FARMACI AVASTIN E LUCENTIS Provvedimento n. 24207 L AUTORITÀ GARANTE DELLA CONCORRENZA E DEL MERCATO NELLA SUA ADUNANZA del 6 febbraio 2013; SENTITO il Relatore Professor Piero Barucci;
Circolare Regione Lombardia Protocollo G
 Circolare Regione Lombardia Protocollo G1.2017.0023889 21.07.2017 Oggetto: DETERMINA 15 giugno 2017 - Nuove indicazioni terapeutiche del medicinale per uso umano «Volibris» (ambrisentan), non rimborsate
Circolare Regione Lombardia Protocollo G1.2017.0023889 21.07.2017 Oggetto: DETERMINA 15 giugno 2017 - Nuove indicazioni terapeutiche del medicinale per uso umano «Volibris» (ambrisentan), non rimborsate
Dipartimento Farmaceutico Interaziendale. PRESCRIZIONE DI FARMACI PER INDICAZIONI NON AUTORIZZATE DALL AIFA ( Off Label )
 POCEDUA ev. 0 Pag. 1/8 PESCIZIONE DI FAMACI PE INDICAZIONI N AUTOIZZATE DALL AIFA ( Off Label ) 1. Lista di distribuzione...1 2. Emissione...1 3. Scopo...2 4. Campo di applicazione...2 5. iferimenti...2
POCEDUA ev. 0 Pag. 1/8 PESCIZIONE DI FAMACI PE INDICAZIONI N AUTOIZZATE DALL AIFA ( Off Label ) 1. Lista di distribuzione...1 2. Emissione...1 3. Scopo...2 4. Campo di applicazione...2 5. iferimenti...2
L AUTORITÀ GARANTE DELLA CONCORRENZA E DEL MERCATO. VISTO l articolo 101 del Trattato sul Funzionamento dell Unione Europea (TFUE);
 L AUTORITÀ GARANTE DELLA CONCORRENZA E DEL MERCATO NELLA SUA ADUNANZA del 6 febbraio 2013; SENTITO il Relatore Professor Piero Barucci; VISTA la legge 10 ottobre 1990, n. 287; VISTO l articolo 101 del
L AUTORITÀ GARANTE DELLA CONCORRENZA E DEL MERCATO NELLA SUA ADUNANZA del 6 febbraio 2013; SENTITO il Relatore Professor Piero Barucci; VISTA la legge 10 ottobre 1990, n. 287; VISTO l articolo 101 del
Farmaci Off-Label. Bruno Bembi. Malattie Rare. Malattie Rare e Disabilità Costruire un Respiro Unico
 Malattie Rare e Farmaci Off-Label Bruno Bembi Centro Regionale di Coordinamento delle Malattie Rare Roma, 5 marzo 2010 Malattie Rare e Disabilità Costruire un Respiro Unico cambia la sua medicina cambia
Malattie Rare e Farmaci Off-Label Bruno Bembi Centro Regionale di Coordinamento delle Malattie Rare Roma, 5 marzo 2010 Malattie Rare e Disabilità Costruire un Respiro Unico cambia la sua medicina cambia
AZIENDA USL N.12 DI VIAREGGIO
 AZIENDA USL N.12 DI VIAREGGIO DETERMINAZIONE DIRIGENZIALE assunta ai sensi dell'art. 50 dello Statuto approvato con deliberazione n. 316 del 16/10/2013 Oggetto: SIG.RA LUCARELLI SARA - C.P.S. INFERMIERE
AZIENDA USL N.12 DI VIAREGGIO DETERMINAZIONE DIRIGENZIALE assunta ai sensi dell'art. 50 dello Statuto approvato con deliberazione n. 316 del 16/10/2013 Oggetto: SIG.RA LUCARELLI SARA - C.P.S. INFERMIERE
Titolare A.I.C.: Eli Lilly Nederland BV, Grootslag 1-5, NL-3991 RA Houten, Paesi Bassi.
 DETERMINAZIONE 29 dicembre 2009. Regime di rimborsabilità e prezzo di vendita della specialità medicinale per uso umano «EÞ ent». (Determinazione/C n. 335/2009). Regime di rimborsabilità e prezzo di vendita
DETERMINAZIONE 29 dicembre 2009. Regime di rimborsabilità e prezzo di vendita della specialità medicinale per uso umano «EÞ ent». (Determinazione/C n. 335/2009). Regime di rimborsabilità e prezzo di vendita
Deliberazione n. 5/2016/PAR. Corte dei conti. Visto il decreto del Presidente della Repubblica 16 gennaio 1978 n. 21 e
 Deliberazione n. 5/2016/PAR Repubblica italiana Corte dei conti La Sezione del controllo per la Regione Sardegna composta dai magistrati: Dott. Francesco Petronio Dott. ssa Maria Paola Marcia Dott. ssa
Deliberazione n. 5/2016/PAR Repubblica italiana Corte dei conti La Sezione del controllo per la Regione Sardegna composta dai magistrati: Dott. Francesco Petronio Dott. ssa Maria Paola Marcia Dott. ssa
Decreto Dirigenziale n. 8 del 31/05/2017
 Decreto Dirigenziale n. 8 del 31/05/2017 Dipartimento 50 - GIUNTA REGIONALE DELLA CAMPANIA Direzione Generale 4 - DG per la tutela della salute e il coordin. del sist. sanitario regionale U.O.D. 6 - Politica
Decreto Dirigenziale n. 8 del 31/05/2017 Dipartimento 50 - GIUNTA REGIONALE DELLA CAMPANIA Direzione Generale 4 - DG per la tutela della salute e il coordin. del sist. sanitario regionale U.O.D. 6 - Politica
Supplemento ordinario n. 210 alla GAZZETTA UFFICIALE Serie generale - n. 202
 Supplemento ordinario n. 210 alla GZZETT UFFICILE Serie generale - n. 202 DETERMINZIONE 6 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «ranesp» (darbepoetina alfa) - autorizzata
Supplemento ordinario n. 210 alla GZZETT UFFICILE Serie generale - n. 202 DETERMINZIONE 6 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «ranesp» (darbepoetina alfa) - autorizzata
IL DIRETTORE GENERALE
 DECRETO DIREZIONE GENERALE SANITA' N. 8765 DEL 03/09/2009 Identificativo Atto n. 729 Oggetto: APPROVAZIONE DEL PERCORSO DI VERIFICA DI QUALITÀ DENOMINATO "CONTROLLO QUALITÀ INIEZIONI INTRAVITREALI PER
DECRETO DIREZIONE GENERALE SANITA' N. 8765 DEL 03/09/2009 Identificativo Atto n. 729 Oggetto: APPROVAZIONE DEL PERCORSO DI VERIFICA DI QUALITÀ DENOMINATO "CONTROLLO QUALITÀ INIEZIONI INTRAVITREALI PER
REGIONE AUTONOMA DELLA SARDEGNA DELIBERAZIONE N. 34/ 9 DEL
 DELIBERAZIONE N. 34/ 9 Oggetto: Revisione del nomenclatore tariffario delle prestazioni di specialistica ambulatoriale emanato con la Delib.G.R. n. 19/ 6 del 28 aprile 1998. Primo riequilibrio delle tariffe
DELIBERAZIONE N. 34/ 9 Oggetto: Revisione del nomenclatore tariffario delle prestazioni di specialistica ambulatoriale emanato con la Delib.G.R. n. 19/ 6 del 28 aprile 1998. Primo riequilibrio delle tariffe
COMMISSIONE UNICA DEL FARMACO COMUNICATO
 COMMISSIONE UNICA DEL FARMACO COMUNICATO DOMANDE PER L AMMISSIONE ALLA RIMBORSABILITÀ DEI MEDICINALI IN APPLICAZIONE DEL DISPOSTO DELL ARTICOLO 36, COMMA 8, DELLA LEGGE N.449/1997 La Commissione Unica
COMMISSIONE UNICA DEL FARMACO COMUNICATO DOMANDE PER L AMMISSIONE ALLA RIMBORSABILITÀ DEI MEDICINALI IN APPLICAZIONE DEL DISPOSTO DELL ARTICOLO 36, COMMA 8, DELLA LEGGE N.449/1997 La Commissione Unica
AGENZIA ITALIANA DEL FARMACO
 DETERMINAZIONE 28 febbraio 2007 AGENZIA ITALIANA DEL FARMACO Regime di rimborsabilita' e prezzo di vendita della specialita' medicinale «Gardasil» (vaccino papillomavirus umano), autorizzata con procedura
DETERMINAZIONE 28 febbraio 2007 AGENZIA ITALIANA DEL FARMACO Regime di rimborsabilita' e prezzo di vendita della specialita' medicinale «Gardasil» (vaccino papillomavirus umano), autorizzata con procedura
PRESCRIVIBILITA DEI FARMACI: NORME ED UNIFORMITA D APPLICAZIONE
 PRESCRIVIBILITA DEI FARMACI: NORME ED UNIFORMITA D APPLICAZIONE ACI CASTELLO (CT), 13 GENNAIO 2017 Prescrivibilità dei farmaci di cui alla legge 648/96 Silvana Mansueto Uso off-label dei farmaci Si definisce
PRESCRIVIBILITA DEI FARMACI: NORME ED UNIFORMITA D APPLICAZIONE ACI CASTELLO (CT), 13 GENNAIO 2017 Prescrivibilità dei farmaci di cui alla legge 648/96 Silvana Mansueto Uso off-label dei farmaci Si definisce
- per F. Hoffmann-La Roche Ltd. e Roche S.p.a., in solido, euro; - per Novartis AG e Novartis Farma S.p.a., in solido,
 SENATO DELLA REPUBBLICA GRUPPO PARLAMENTARE "MOVIMENTO 5 STELLE" -------- MOZIONE DI SFIDUCIA INDIVIDUALE NEI CONFRONTI DEL MINISTRO DELLA SALUTE, BEATRICE LORENZIN Il Senato, premesso che: il 3 ottobre
SENATO DELLA REPUBBLICA GRUPPO PARLAMENTARE "MOVIMENTO 5 STELLE" -------- MOZIONE DI SFIDUCIA INDIVIDUALE NEI CONFRONTI DEL MINISTRO DELLA SALUTE, BEATRICE LORENZIN Il Senato, premesso che: il 3 ottobre
Oggetto: Direttive alle Aziende Sanitarie relative alla gestione dei Registri di monitoraggio dell Agenzia Italiana del Farmaco (AIFA).
 Oggetto: Direttive alle Aziende Sanitarie relative alla gestione dei Registri di monitoraggio dell Agenzia Italiana del Farmaco (AIFA). L Assessore dell Igiene e Sanità e dell Assistenza Sociale riferisce
Oggetto: Direttive alle Aziende Sanitarie relative alla gestione dei Registri di monitoraggio dell Agenzia Italiana del Farmaco (AIFA). L Assessore dell Igiene e Sanità e dell Assistenza Sociale riferisce
La ricetta SSN per la prescrizione dei farmaci
 La ricetta SSN per la prescrizione dei farmaci Prescrizione di farmaci a carico del Servizio Sanitario Nazionale. Il ricettario viene fornito dall Azienda ULSS competente a medici dipendenti o convenzionati;
La ricetta SSN per la prescrizione dei farmaci Prescrizione di farmaci a carico del Servizio Sanitario Nazionale. Il ricettario viene fornito dall Azienda ULSS competente a medici dipendenti o convenzionati;
Resp. Dott. Salvatore Cossu
 AZIENDA OSPEDALIERO UNIVERSITARIA DI SASSARI Via Coppino, 26-07100 SASSARI C.F. - P. IVA 02268260904 DELIBERAZIONE DEL DIRETTORE GENERALE N. 366 DEL 25/10/2016 OGGETTO: Selezione per titoli ed esami, per
AZIENDA OSPEDALIERO UNIVERSITARIA DI SASSARI Via Coppino, 26-07100 SASSARI C.F. - P. IVA 02268260904 DELIBERAZIONE DEL DIRETTORE GENERALE N. 366 DEL 25/10/2016 OGGETTO: Selezione per titoli ed esami, per
DIREZIONE DIRITTI DI CITTADINANZA E COESIONE SOCIALE SETTORE CONSULENZA GIURIDICA, RICERCA E SUPPORTO ORGANISMI DI GOVERNO CLINICO BELVEDERE KATIA
 REGIONE TOSCANA DIREZIONE DIRITTI DI CITTADINANZA E COESIONE SOCIALE SETTORE CONSULENZA GIURIDICA, RICERCA E SUPPORTO ORGANISMI DI GOVERNO CLINICO Il Dirigente Responsabile: BELVEDERE KATIA Decreto non
REGIONE TOSCANA DIREZIONE DIRITTI DI CITTADINANZA E COESIONE SOCIALE SETTORE CONSULENZA GIURIDICA, RICERCA E SUPPORTO ORGANISMI DI GOVERNO CLINICO Il Dirigente Responsabile: BELVEDERE KATIA Decreto non
COMPETENZE REGIONE DELIBERA DI GIUNTA REGIONALE NOTIFICA AZIENDE
 COMPETENZE REGIONE INDIVIDUAZIONE CENTRI PRESCRITTORI ISTRUTTORIA ARS RICHIESTA DIREZIONI SANITARIE PROPOSTE IN BASE A: COMPETENZE SPECIALISTICHE N CASI TRATTATI DOTAZIONI STRUMENTALI /AUTORIZZAZIONI PARTICOLARI
COMPETENZE REGIONE INDIVIDUAZIONE CENTRI PRESCRITTORI ISTRUTTORIA ARS RICHIESTA DIREZIONI SANITARIE PROPOSTE IN BASE A: COMPETENZE SPECIALISTICHE N CASI TRATTATI DOTAZIONI STRUMENTALI /AUTORIZZAZIONI PARTICOLARI
UNITA LOCALE SOCIO-SANITARIA N. 7 DELIBERAZIONE DEL DIRETTORE GENERALE
 Delibera n. 244 del 26/02/2015 REGIONE DEL VENETO UNITA LOCALE SOCIO-SANITARIA N. 7 PIEVE DI SOLIGO DELIBERAZIONE DEL DIRETTORE GENERALE L`anno duemilaquindici, il giorno ventisei del mese di Febbraio
Delibera n. 244 del 26/02/2015 REGIONE DEL VENETO UNITA LOCALE SOCIO-SANITARIA N. 7 PIEVE DI SOLIGO DELIBERAZIONE DEL DIRETTORE GENERALE L`anno duemilaquindici, il giorno ventisei del mese di Febbraio
DOCUMENTO DI CONFRONTO DEI COSTI TRA PRINCIPI ATTIVI APPARTENENTI A CATEGORIE TERAPEUTICHE AD ELEVATO IMPATTO DI SPESA TERRITORIALE
 1/12 DOCUMENTO DI CONFRONTO DEI COSTI TRA PRINCIPI ATTIVI APPARTENENTI A CATEGORIE TERAPEUTICHE AD ELEVATO IMPATTO DI SPESA TERRITORIALE PREMESSA Nel 2014 la spesa farmaceutica territoriale della Regione
1/12 DOCUMENTO DI CONFRONTO DEI COSTI TRA PRINCIPI ATTIVI APPARTENENTI A CATEGORIE TERAPEUTICHE AD ELEVATO IMPATTO DI SPESA TERRITORIALE PREMESSA Nel 2014 la spesa farmaceutica territoriale della Regione
DEGENERAZIONE MACULARE SENILE
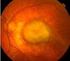 DEGENERAZIONE MACULARE SENILE E una malattia della retina centrale legata all età E la più frequente causa di cecità legale (cecità centrale non cecità assoluta!) che interessa la popolazione anziana -
DEGENERAZIONE MACULARE SENILE E una malattia della retina centrale legata all età E la più frequente causa di cecità legale (cecità centrale non cecità assoluta!) che interessa la popolazione anziana -
Piazza Città di Lombardia n Milano. Tel
 Regione Lombardia - Giunta DIREZIONE GENERALE SALUTE GOVERNO DEI DATI, DELLE STRATEGIE E PIANI DEL SISTEMA SANITARIO FARMACEUTICA, PROTESICA E DISPOSITIVI MEDICI Piazza Città di Lombardia n.1 20124 Milano
Regione Lombardia - Giunta DIREZIONE GENERALE SALUTE GOVERNO DEI DATI, DELLE STRATEGIE E PIANI DEL SISTEMA SANITARIO FARMACEUTICA, PROTESICA E DISPOSITIVI MEDICI Piazza Città di Lombardia n.1 20124 Milano
SERVIZIO SANITARIO NAZIONALE - REGIONE VENETO AZIENDA SANITARIA - U.L.S.S. N. 22 DELIBERAZIONE DEL DIRETTORE GENERALE N. 182 DEL 30/04/2009
 SERVIZIO SANITARIO NAZIONALE - REGIONE VENETO AZIENDA SANITARIA - U.L.S.S. N. 22 DELIBERAZIONE DEL DIRETTORE GENERALE N. 182 DEL 30/04/2009 O G G E T T O PROGETTO REGIONALE NON LASCIAMOCI CON L AMARO IN
SERVIZIO SANITARIO NAZIONALE - REGIONE VENETO AZIENDA SANITARIA - U.L.S.S. N. 22 DELIBERAZIONE DEL DIRETTORE GENERALE N. 182 DEL 30/04/2009 O G G E T T O PROGETTO REGIONALE NON LASCIAMOCI CON L AMARO IN
PROVINCIA AUTONOMA DI TRENTO
 PROVINCIA AUTONOMA DI TRENTO AGENZIA PER LA FAMIGLIA, LA NATALITA' E LE POLITICHE GIOVANILI Prot. n. DETERMINAZIONE DEL DIRIGENTE N. 38 DI DATA 07 Febbraio 2017 OGGETTO: Legge provinciale 18 giugno 2012,
PROVINCIA AUTONOMA DI TRENTO AGENZIA PER LA FAMIGLIA, LA NATALITA' E LE POLITICHE GIOVANILI Prot. n. DETERMINAZIONE DEL DIRIGENTE N. 38 DI DATA 07 Febbraio 2017 OGGETTO: Legge provinciale 18 giugno 2012,
Il caso Avastin: tra regolamentazione dell uso dei farmaci e contenimento della spesa
 MEDIC 2014; 22(2): 91-98 91 etica della ricerca Research ethics Il caso Avastin: tra regolamentazione dell uso dei farmaci e contenimento della spesa The Avastin affaire : between regulation of drug use
MEDIC 2014; 22(2): 91-98 91 etica della ricerca Research ethics Il caso Avastin: tra regolamentazione dell uso dei farmaci e contenimento della spesa The Avastin affaire : between regulation of drug use
RICERCA E SVILUPPO DI NUOVI FARMACI
 RICERCA E SVILUPPO DI NUOVI FARMACI In passato le scoperte dei farmaci erano occasionali. Si trattava di sostanze di derivazione vegetale o animale STRATEGIE DI RICERCA: Quali sono i fattori che influenzano
RICERCA E SVILUPPO DI NUOVI FARMACI In passato le scoperte dei farmaci erano occasionali. Si trattava di sostanze di derivazione vegetale o animale STRATEGIE DI RICERCA: Quali sono i fattori che influenzano
LA GIUNTA REGIONALE. RICHIAMATA la seguente normativa in tema di malattie rare:
 OGGETTO : Revisione dei presidi e dei centri di riferimento della rete regionale per la prevenzione, la sorveglianza, la diagnosi e la terapia delle malattie. N. 1519 del REGISTRO ATTI DELLA GIUNTA IN
OGGETTO : Revisione dei presidi e dei centri di riferimento della rete regionale per la prevenzione, la sorveglianza, la diagnosi e la terapia delle malattie. N. 1519 del REGISTRO ATTI DELLA GIUNTA IN
La Cannabis nelle Regioni italiane. Dott.ssa Marilù Giusto
 La Cannabis nelle Regioni italiane D. Min. Sal. 23/01/2013: Inserimento nella Tabella II, sezione B, dei medicinali di origine vegetale a base di Cannabis (sostanze e preparazioni vegetali, inclusi estratti
La Cannabis nelle Regioni italiane D. Min. Sal. 23/01/2013: Inserimento nella Tabella II, sezione B, dei medicinali di origine vegetale a base di Cannabis (sostanze e preparazioni vegetali, inclusi estratti
REGIONE PIEMONTE BU29 18/07/2013
 REGIONE PIEMONTE BU29 18/07/2013 Deliberazione della Giunta Regionale 28 giugno 2013, n. 9-6021 Recepimento dell'intesa tra il Governo, le Regioni e le Province autonome sul documento recante "Disciplinare
REGIONE PIEMONTE BU29 18/07/2013 Deliberazione della Giunta Regionale 28 giugno 2013, n. 9-6021 Recepimento dell'intesa tra il Governo, le Regioni e le Province autonome sul documento recante "Disciplinare
PARTE SECONDA. DELIBERAZIONE DELLA GIUNTA REGIO- NALE 4 dicembre 2009, n. 2397
 Bollettino Ufficiale della Regione Puglia - n. 6 del 12-01-2010 1181 PARTE SECONDA Deliberazioni del Consiglio e della Giunta DELIBERAZIONE DELLA GIUNTA REGIO- NALE 4 dicembre 2009, n. 2397 Approvazione
Bollettino Ufficiale della Regione Puglia - n. 6 del 12-01-2010 1181 PARTE SECONDA Deliberazioni del Consiglio e della Giunta DELIBERAZIONE DELLA GIUNTA REGIO- NALE 4 dicembre 2009, n. 2397 Approvazione
I registri AIFA nella regione Umbria (sistema reportistica SAS)
 Perugia, 15 settembre 2015 I registri AIFA nella regione Umbria (sistema reportistica SAS) Dott.ssa Mariangela Rossi Regione Umbria Sezione Assistenza Farmaceutica e Integrativa 075 504 5271 - mrossi@regione.umbria.it
Perugia, 15 settembre 2015 I registri AIFA nella regione Umbria (sistema reportistica SAS) Dott.ssa Mariangela Rossi Regione Umbria Sezione Assistenza Farmaceutica e Integrativa 075 504 5271 - mrossi@regione.umbria.it
PROPOSTA DI DELIBERAZIONE DELLA GIUNTA REGIONALE
 PROPOSTA DI DELIBERAZIONE DELLA GIUNTA REGIONALE Codice CIFRA: ATP/DEL/2016/ OGGETTO: Comitati Etici ai sensi del Decreto-legge n.158 del 13.09.2012 convertito con modificazioni dalla legge 8 novembre
PROPOSTA DI DELIBERAZIONE DELLA GIUNTA REGIONALE Codice CIFRA: ATP/DEL/2016/ OGGETTO: Comitati Etici ai sensi del Decreto-legge n.158 del 13.09.2012 convertito con modificazioni dalla legge 8 novembre
DETERMINAZIONE DEL DIRIGENTE SER- VIZIO PROGRAMMAZIONE ASSISTENZA TERRITORIALE PREVENZIONE 5 luglio 2011, n. 261
 20032 Bollettino Ufficiale della Regione Puglia - n. 107 del 07-07-2011 DETERMINAZIONE DEL DIRIGENTE SER- VIZIO PROGRAMMAZIONE ASSISTENZA TERRITORIALE PREVENZIONE 5 luglio 2011, n. 261 Concorso per la
20032 Bollettino Ufficiale della Regione Puglia - n. 107 del 07-07-2011 DETERMINAZIONE DEL DIRIGENTE SER- VIZIO PROGRAMMAZIONE ASSISTENZA TERRITORIALE PREVENZIONE 5 luglio 2011, n. 261 Concorso per la
/07/2016-AIFA-COD_UO-P
 PQ&C/OTB/DDG 0077952-27/07/2016-AIFA-COD_UO-P Roma, Ufficio Qualità dei Prodotti e Contraffazione Alla BIOTEST ITALIA S.r.l. Via L. da Vinci, n. 43 20090 Trezzano sul Naviglio (Mi) Fax 02/48402068 Agli
PQ&C/OTB/DDG 0077952-27/07/2016-AIFA-COD_UO-P Roma, Ufficio Qualità dei Prodotti e Contraffazione Alla BIOTEST ITALIA S.r.l. Via L. da Vinci, n. 43 20090 Trezzano sul Naviglio (Mi) Fax 02/48402068 Agli
