Corso di CHIMICA Annalisa Vacca Dipartimento di Ingegneria Meccanica, Chimica e dei Materiali
|
|
|
- Isidoro Righi
- 6 anni fa
- Visualizzazioni
Transcript
1 Corso di CHIMICA Annalisa Vacca Dipartimento di Ingegneria Meccanica, Chimica e dei Materiali Dipartimento di ingegneria chimica e materiali (secondo piano) Aula Magna
2 Contatti Indirizzo Telefono: Pagina personale: people.unica.it/annalisavacca SEZIONE DIDATTICA Scheda del corso programma Lucidi di lezione Esercitazioni Esercizi svolti AVVISI Informazioni su: - Date di pre-esami ed esami - Esiti delle prove scritte
3
4 CHIMICA Scienza che studia le proprietà, la struttura e le trasformazione della materia. OBIETTIVO DEL CORSO Fornire i concetti di base di chimica necessari per affrontare lo studio delle tecnologie. La tecnologia è l applicazione delle conoscenze scientifiche per la realizzazione di nuovi prodotti che migliorino la qualità della vita
5 Perchè studiare la chimica? Tutto ciò che ci circonda ha a che fare con la chimica. Spiega ciò che osserviamo attorno a noi.
6 QUARTO SECOLO a.c. Aristotele Il mondo era spiegato da 4 elementi ARIA TERRA FUOCO ACQUA che mescolandosi in diverse proporzioni formano le diverse proprietà della materia, come i colori. Democrito Ipotizza che materia è fatta di atomi. Alchimia (~300 a.c d.c.) L alchimia ebbe due filoni principali: Uno mineralogico per ottenere l oro (pietra filosofale) Uno medico per l elisir di lunga vita METODO SCIENTIFICO (1500) Galileo Galilei Francis Bacon
7 Il metodo scientifico Osservazione -> Individuare un problema Ipotesi -> proporre una spiegazione all osservazione fatta Sperimentazione -> si usano una o più procedure per testare l ipotesi (misure, raccolta di dati) Teoria Legge Osservazione di un fenomeno Ipotesi Esperimento Nuova ipotesi Raccolta e analisi critica dei dati sperimentali L ipotesi deve essere rivista se non viene supportata da dati sperimentali NO L ipotesi è verificata? SI Si formula la legge Se i dati raccolti mostrano una regolarità significativa vengono espressi sotto forma di legge. La legge può essere rappresentata da una relazione matematica
8 Articolazione del corso 1) INTRODUZIONE Leggi fondamentali della chimica Lavoisier Proust Dalton Avogadro Peso atomico Mole Formule chimiche Stechiometria
9 STRUTTURA DELLA MATERIA Struttura dell atomo Articolazione del corso Proprietà chimiche degli elementi Sistema periodico degli elementi Legame chimico Proprietà delle molecole Stati di aggregazione della materia Stato gassoso, solido e liquido
10 Articolazione del corso TRASFORMAZIONE DELLA MATERIA Termodinamica Chimica Primo principio della termodinamica Secondo principio della termodinamica Calcolo del calore di reazione Processi reversibile e irreversibili Cambiamenti di stato Sistemi a un componente Tensione di vapore e sua dipendenza dalla temperatura Sistemi a due o più componenti Soluzioni e loro proprietà
11 EQUILIBRIO CHIMICO In fase omogenea Equilibri ionici in soluzione Articolazione del corso In fase eterogenea Equilibri acido-base Calcoli di ph ELEMENTI DI ELETTROCHIMICA Pile Elettrolisi
12 Libri di testo consigliati: Palmisano-Schiavello: Elementi di Chimica Edises - Napoli Palmisano-Schiavello: Fondamenti di Chimica Edises - Napoli D.W.Oxtoboy, N.H.Nachtrib: Chimica moderna Edises - Napoli Biblioteca di Facoltà
13 Corso di chimica 6 CFU 60 ore di didattica frontale Lezioni + esercitazioni 1CFU = 25 ore di studio individuale 150 ore
14 Modalità di Esame GLI APPELLI DI ESAME 3 appelli nella sessione gennaio-febbraio 4 appelli nella sessione giugno-luglio-settembre Inizio a.a. Lezioni Esami Lezioni Esami Ott Nov Dic Gen Feb Mar Apr Mag Giu Lug Ago Set Ott I semestre ISCRIZIONE ALL ESAME II semestre I pre-esame nel periodo metà Novembre II pre-esame nel periodo dal 7 Gennaio L iscrizione si effettua per via telematica Sito UNICA -> servizi on-line agli studenti
15
16 ISCRIZIONE ALL ESAME L iscrizione si effettua per via telematica. UNICA -> servizi on-line agli studenti Iscriversi solo per la seconda prova intermedia
17
18 Unità di misura SI Sistema Internazionale mks Lunghezza (metro) m Massa (chilogrammo) kg Tempo (secondi) s
19 Il Sistema Internazionale (SI)
20
21 Dalle grandezze fondamentali si ricavano le grandezze derivate. Ogni grandezza fondamentale ha una sua unità di misura la cui combinazione fornisce le unità di misura delle grandezze derivate.
22 MATERIA La materia e tutto cio che possiede una massa ed occupa uno spazio. La materia può esistere in tre stati fisici: - solido forma e volume definiti - liquido volume definito e forma non definita - gassoso forma e volume non definiti Proprietà della materia FISICHE E la caratteristica di una sostanza che può essere osservata senza trasformarla in un altra sostanza. Esempi: -Stato fisico -Temperatura di ebollizione -Colore -Densità CHIMICHE E la caratteristica di una sostanza che descrive il modo di resistere o subire cambiamenti per originare una nuova sostanza. Esempio: Il ferro (Fe) reagisce con l ossigeno (O 2 ) e l acqua (H 2 O) presenti nella atmosfera ossidandosi. L oro (Au) nelle stesse condizioni rimane inalterato
23
24 SOSTANZA PURA E un singolo tipo di materia che non può essere separato in altri tipi di materia utilizzando metodi fisici. DECOMPONIBILE NON DECOMPONIBILE COMPOSTO gli atomi sono di almeno due tipi Acqua H 2 O Metano CH 4 ELEMENTO tutti i suoi atomi sono dello stesso tipo Ferro (Fe) Ossigeno (O 2 ) MISCELA Combinazione fisica di una o più sostanze OMOGENEA Benzina Aria ETEROGENEA Nebbia Fango
25 TRASFORMAZIONI DELLA MATERIA CAMBIAMENTO FISICO È un processo che non determina il cambiamento della natura della sostanza; non si formano nuovi composti ghiaccio Acqua liquida Vapore acqueo Il cambiamento associato alla fusione del ghiaccio in acqua liquida ed alla successiva evaporazione non modifica la natura della sostanza CAMBIAMENTO CHIMICO È un processo durante il quale cambia la natura delle sostanze e si formano nuovi composti Durante la combustione del metano vengono prodotti acqua e biossido di carbonio. CH 4 + 2O 2 2H 2 O + CO 2 + ENERGIA Al termine della combustione la natura delle sostanze è variata
26 Procedimento per classificare una campione di materia
27 Separazione delle sostanze da una miscela acqua + cloruro di sodio Soluzione di NaCl residuo ACQUA elettrolisi IDROGENO OSSIGENO CLORURO DI SODIO elettrolisi SODIO CLORO MISCUGLIO SOSTANZA ELEMENTI
28 ELEMENTI Sono sostanze pure che non possono essere decomposte in sostanze più semplici mediante reazioni Costituiscono i mattoni più semplici della materia I composti e le molecole sono formati dalle infinite combinazioni di un numero limitatato di elementi. Per esempio i composti del carbonio con pochi altri elementi (idrogeno, ossigeno e azoto) sono milioni: sono i composti organici. Attualmente gli elementi chimici conosciuti sono poco più di un centinaio dei quali 90 sono presenti in presenti in natura.
29 I SIMBOLI ATOMICI I simboli atomici sono una notazione sintetica composta da una o due lettere del nome corrispondente ad un particolare elemento. A volte si usano le prime lettere del nome latino S Zolfo da Sulfur Au Oro da Aurum Na Sodio da Natrium Cl Cloro
30
31 Composti Possono essere molecolari formati da molecole. o ionici formati da ioni. Molecole e composti molecolari una molecola è un gruppo definito e distinto di atomi legati assieme. una formula molecolare indica il numero di atomi di ciascun elemento presente in una molecola. esempi acqua H 2 O ammoniaca NH 3 metano CH 4
32
33
34 Le formule delle sostanze Le sostanze elementari ed i composti sono rappresentati graficamente con simboli convenzionali: Le formule chimiche FORMULA MINIMA: si ricava dall analisi elementare della sostanza e indica il rapporto tra i più piccoli valori interi di atomi presenti in un composto C 2 H 2 etino H-C C-H CH C 6 H 6 benzene FORMULA MOLECOLARE: Indica il numero effettivo di atomi di ciascun elemento in un composto FORMULA DI STRUTTURA: Mostra come sono legati fra loro gli atomi di una molecola
35 La teoria atomica di Dalton 1. Tutta la materia è composta da particelle estremamente piccole e indivisibili: gli atomi. 2. Gli atomi di uno stesso elemento sono uguali tra loro 3. Atomi di elementi diversi hanno masse differenti 4. Una reazione chimica consiste nella ricombinazione degli atomi presenti nelle sostanze reagenti in modo da dare nuove combinazioni chimiche presenti nelle sostanze formate dalla reazione 5. Gli atomi si combinano tra loro secondo rapporti definiti e costanti espressi da numeri interi. ossigeno idrogeno carbonio azoto acqua
36
37 Lavoisier e la legge di conservazione della massa Lavoisier introdusse il metodo scientifico nello studio dei processi chimici basando le sue deduzioni su risultati sperimentali riproducibili. Gli esperimenti consistevano nel riscaldare dei metalli (stagno o piombo) in recipienti chiusi con quantità limitate di aria. Il peso dell intero recipiente risultava immutato prima e dopo la reazione. Analogamente bruciando la legna la cenere residua era più leggera del legno di partenza ma il peso del recipiente rimaneva lo stesso. La massa totale delle sostanze reagenti coinvolte in una reazione chimica è uguale alla massa totale delle sostanze prodotte. 2 g di Idrogeno + 16 g di Ossigeno = 18 g di Acqua
38 Legge delle proporzioni definite (o legge di Proust) Un composto puro, qualunque sia l origine o il modo di preparazione, contiene sempre quantità definite e costanti degli elementi proporzionali alla loro massa CuO Rame: 79,8 % Ossigeno: 20,2 % CARBONIO C 100 g di CuO 79.8 g di Rame 20.2 g di Ossigeno OSSIGENO O Possono combinarsi per dare due composti 1) 1 g di C 2) 1 g di C 1,33 g di O 2,66 g di O Il composto 2 ha il doppio degli atomi di ossigeno rispetto al composto 1 CO CO 2
39 La legge di Avogadro, 1811 Volumi uguali di gas diversi, nelle stesse condizioni di temperatura e pressione, contengono lo stesso numero di molecole La legge di Gay-Lussac, 1808 Data la reazione fra due gas, i volumi dei reagenti e dei prodotti gassosi stanno fra di loro in rapporto come numeri interi semplici (misurati a parità di pressione e temperatura). Le relazioni tra i volumi di gas che reagiscono tra di loro (a P,T cost) sono analoghe ai rapporti di combinazione tra le sostanze 2 vol. di idrogeno più 1 vol. di ossigeno danno 2 vol. di acqua (vapore) 2 H 2 + O 2 2 H 2 O
40 PARTICELLE SUBATOMICHE Vari esperimenti condotti all'inizio del 1900 utilizzando tubi catodici dimostrarono che gli atomi non sono indivisibili. Essi sono costituiti da particelle più piccole (particelle subatomiche). Se a due elettrodi posti alle estremità di un tubo in cui è fatto il vuoto viene applicato un alto voltaggio, dall'elettrodo negativo (catodo) si dipartono dei raggi detti raggi catodici. Thomson dimostrò che tali raggi sono costituiti da un flusso di particelle cariche negativamente che chiamò elettroni.
41 ESPERIMENTO DI THOMSON Misura del rapporto carica/massa dell'elettrone: un fascio di raggi catodici attraversa un campo elettrico e un campo magnetico. L'esperimento è predisposto in modo che il campo elettrico devii il fascio in una direzione mentre il campo magnetico lo devia nella direzione opposta. Bilanciando gli effetti è possibile determinare il rapporto carica/massa dell'elettrone. e/m=1, C/Kg
42
43 Esperimento di Millikan Dal voltaggio necessario a contrastare la forza di gravità per mantenere ferme le gocce cariche fu possibile determinare la carica presente sulle gocce. Fu trovato che tutte le cariche elettriche sono multiple di una carica elementare minima e assunta come carica dell'elettrone. e= - 1, C (coulomb) Dal rapporto carica/massa determinato da Thomson si determino quindi la massa dell elettrone: m e = 9, Kg
44 Particella (simbolo) Particelle subatomiche Carica assoluta Carica relativa Massa assoluta Massa relativa Protone (p) C g Elettrone (e) C g Neutrone (n) g L ATOMO E UN SISTEMA ELETTRICAMENTE NEUTRO Modello di Thomson: il volume dell atomo è completamente occupato da protoni, neutroni ed elettroni in modo uniforme.
45 L'esperimento di Rutherford La lamina d oro bombardata da particelle alfa (particelle costituite da 2 neutroni e 2 protoni) ne devia poche. La maggior parte delle particelle passano attraverso la lamina senza subire deviazioni, alcune vengono deflesse mentre poche sono addirittura respinte. Modello di Rutherford: modello simile al modello planetario. Nel nucleo si concentra quasi tutta la massa atomica mentre gli elettroni sono esterni al nucleo e sono in numero sufficiente a bilanciare le cariche.
46 Struttura dell atomo Gli atomi sono costituiti da un nucleo positivo e da elettroni negativi. Il nucleo ha un raggio di 10-4 Å. Il raggio di un atomo è dell'ordine di 1 Å. Proporzione 100m vs 1mm
47 NUMERO ATOMICO E NUMERO DI MASSA In un atomo il numero di elettroni è uguale a quello di protoni: Questo numero viene denominato numero atomico Z Z = N protoni = N elettroni Il numero di protoni caratterizza la specie atomica. Il numero di massa A rappresenta la somma nel numero di neutroni e di protoni presenti nell atomo. A Z X 1 12 H C 16 O 1 6 8
48
49 Atomi i cui nuclei hanno lo stesso numero di protoni ma diverso numero di neutroni sono detti isotopi. Gli isotopi di un elemento hanno la stessa reattività chimica Ad esempio l'idrogeno ha tre isotopi: H H H idrogeno 1 protone nessun neutrone deuterio 1 protone 1 neutrone trizio 1 protone 2 neutroni Gli elementi presenti in natura sono in genere miscele di isotopi: Cloro 75,8 % 24,2 % Cl Cl Ossigeno % 0.037% 0.204% 8O O O
50 Unità di massa atomica e mole
51 Particella Carica Massa Massa relativa Protone (p) g Elettrone (e) g Neutrone (n) g Numero di massa A p + n Numero atomico Z Z=numero di protoni Caratterizza l elemento A Z X Isotopi Stesso numero di protoni (Z) Diverso numero di neutroni (A)
52 Unità di massa atomica u.m.a. La massa di un atomo è troppo piccola e viene quindi definita in rapporto a quella di un nuclide di riferimento. Per convenzione la massa del nuclide 12 C è stata definita come esattamente = a 12. 1/12 della sua massa è l unità di riferimento = u.m.a. u.m.a. = 1, Kg 14 C 14, u.m.a 1 H 1, u.m.a
53 Massa atomica Si definisce massa atomica di un elemento la massa relativa e media di quell'elemento rispetto ad 1/12 della massa di un nuclide di 12 C. Massa atomica Media ponderata Il peso atomico dell'idrogeno è: 1, u.m.a 0, , u.m.a 0,00015 = 1, u.m.a
54 Il peso atomico del carbonio è: 12 u.m.a. 0, , u.m.a 0,0111 = 12,0111 u.m.a Nuclide Massa relativa % di nuclidi 11 C 11, tracce 12 C 12, 98,89 13 C 13, ,11 14 C 14, tracce
55 Isotope trends among the elements:
56 Una unità di massa atomica (u.m.a)= un dodicesimo della massa dell'atomo di carbonio-12 = 1, Kg Peso atomico= massa atomica media di un elemento allo stato naturale espresso in unità di massa atomica
57 PESO MOLECOLARE Il peso molecolare di una sostanza è la somma dei pesi atomici di tutti gli atomi nella molecola della sostanza. H 2 O PA(H)=1,0 u.m.a. PA(O)=16,0 u.m.a. Nel caso di composti ionici si parla di peso formula di quel composto riferendoci ad unità formula NaCl PA(Na)=22,99 u.m.a. PA(Cl)=35,45 u.m.a. PF(NaCl)=22, ,45 =58,44 u.m.a.
58 Peso molecolare esempi: I 2 PA(I) = u.m.a. H 2 SO 4 PA (H) = 1 u.m.a. PA (S)= u.m.a. PA (O) = 16 u.m.a.
59 Peso Molecolare somma dei pesi atomici di tutti gli elementi contenuti in una molecola di una sostanza elementare o di un composto 1. I 2 : 126.9x2= H 2 SO 4 : ( x 2) ( x 4) =
60 La mole La mole è la quantità di sostanza che contiene un numero di particelle N ( atomi, molecole, ioni.) pari al numero di Avogadro NUMERO DI AVOGADRO N = 6, u.m.a. = 1, g 1 mole di u.m.a = 1, x 6, = 1 g
61 La mole La mole è la quantità di sostanza che contiene un numero di particelle N ( atomi, molecole, ioni.) pari al numero di Avogadro NUMERO DI AVOGADRO N = 6, u.m.a. = 1, g massa di 12 C = 12 x 1, g = 1, g Una mole di 12 C corrisponde a: massa di 12 C x N = 1, g x 6, = 12 g La mole è la quantità in grammi di sostanza che contiene un numero N di particelle uguale a quello presente in 12 g di 12 C.
62 N A =6,022 x Si sceglie il valore di N A in modo che N A molecole abbiano una massa in grammi numericamente uguale alla massa molecolare. Una mole di particelle = un numero di Avogadro di particelle 1,0 mol di atomi di carbonio = 6, atomi di carbonio 1,0 mol di atomi di carbonio 6, ,011 g = atomi di carbonio di carbonio = Le unità di massa molare sono g/mol.
63 Quantità pari a una mole di sostanze diverse hanno peso differente
64 Carbonio + ossigeno biossido di carbonio C(s) + O 2 (g) CO 2 (g) 1 atomo di carbonio + 1 molecola di ossigeno = 1 molecola di biossido di carbonio N atomi di carbonio + N molecole di ossigeno = N molecole di biossido di carbonio Scegliendo N pari al numero di Avogadro 1 mole di atomi di carbonio + 1 mole di molecole di ossigeno = 1 mole di molecole di biossido di carbonio Dal micro al macroscopico 12 g carbonio + 32 g di ossigeno = 44 g di biossido di carbonio
65 Calcolidi moli Dai grammi alle moli numero di moli (n) massa( g) massa molare (g/mol) A quante moli corrispondono 10,0 g di C 2 H 5 OH?
66 Calcolidi moli Dai grammi alle moli numero di moli (n) massa( g) massa molare (g/mol) A quante moli corrispondono 10,0 g di C 2 H 5 OH? PM(C 2 H 5 OH) =12,0 x 2 +16,0 + 6 x 1,01= 46,1 u.m.a. Massa molare = 46,1 g/mol n 10,0 g 46,1 g/mol 0,217 mol
67 Dalle moli ai grammi massa(g) numerodi moli (n) x massa molare(g/mol) Quanto pesano 2 moli di H 2 O?
68 Dalle moli ai grammi massa(g) numerodi moli (n) x massa molare(g/mol) Quanto pesano 2 moli di H 2 O? PM(H 2 O)= 1 x = 18 u.m.a. Peso = 2 mol x 18 g/mol= 36 g
69 Numero di molecole per una data massa Quante molecole ci sono in 3,46 g di HCl?
70 Numero di molecole per una data massa Quante molecole ci sono in 3,46 g di HCl? PM(HCl)= 1,0 + 35,5=36,5 n HCl 3,46 g 36,5 g/mol 0,0948 mol Numero di molecole = 0,0948 mol x 6, molecole/mol = = 5, molecole
71 REAZIONI CHIMICHE Equazioni chimiche Una equazione chimica è la rappresentazione simbolica di una reazione chimica in termini di formule chimiche 2 Na + Cl 2 2 NaCl Reagente Prodotto Coefficiente stechiometrico In molti casi è utile indicare gli stati o le fasi delle sostanze ponendo appropriati simboli fra parentesi indicanti le fasi dopo le formule (g) = gas (l) = liquido (s) = solido (aq) = soluzione acquosa 2Na(s) + Cl 2 (g) 2 NaCl(s)
72 Stechiometria STECHIOMETRIA DELLE REAZIONI: relazione quantitativa tra le quantità dei reagenti consumati e quelle dei prodotti formati nel corso della reazione chimica, espressa dall equazione bilanciata della reazione. BILANCIAMENTO DI REAZIONI CHIMICHE Quando in una equazione chimica i coefficienti stechiometrici sono scritti correttamente il totale degli atomi di ogni elemento è uguale in entrambi i membri dell'equazione. L'equazione chimica è allora bilanciata.
73 2 NO + O 2 2 NO 2 2 atomi N 2 atomi N 4 atomi O 4 atomi O OK! ESEMPIO bilanciare la seguente reazione: N 2 (g) + H 2 (g) NH 3 (g)
74 Stechiometria N 2 (g) + 3H 2 (g) 2NH 3 (g) Quanto idrogeno e quanto azoto sono necessari per produrre 1 Kg di NH 3?
75 Stechiometria N 2 (g) + 3H 2 (g) 2NH 3 (g) Quanto idrogeno e quanto azoto sono necessari per produrre 1 Kg di NH 3? prima di tutto si calcolano le moli di NH 3 contenute in 1000 grammi n NH g NH 3 17,0 g /mol 58,82 mol
76 N 2 (g) + 3H 2 (g) 2NH 3 (g) - Dalla stechiometria della reazione si osserva che ogni 2 moli di NH 3 che si formano richiedono 3 moli di H 2 che reagiscono n H mol NH 3 3 mol H2 2 mol NH 3 88,23 mol H 2 1mol N n 2 N mol NH3 2 mol NH 3 29,41 mol N 2 Massa di H 2 = 88,23 mol H 2 x 2 g / mol = 176,5 g Massa di N 2 = 29,41 mol N 2 x 28 g / mol = 823,5 g Massa totale dei reagenti = 176,5 g + 823,5 g = 1000 g
77 Riepilogando: bisogna passare necessariamente attraverso le moli, perché convertire direttamente tra le masse non è possibile. n A A +... n B B +... grammi A PM A n Moli A n B A moli B PM B
78 Esempio Data la reazione, Fe 2 O 3 (s) + 3 CO (g) 2 Fe (s) + 3 CO 2 (g) Calcolare quanti grammi di ferro e CO 2 si possono produrre da 1,00 Kg di Fe 2 O 3 e quanti grammi di CO sono necessari.
79 Esempio Data la reazione, Fe 2 O 3 (s) + 3 CO (g) 2 Fe (s) + 3 CO 2 (g) Calcolare quanti grammi di ferro e CO 2 si possono produrre da 1,00 Kg di Fe 2 O 3 e quanti grammi di CO sono necessari. Le moli di ossido di ferro a disposizione sono: n Fe2O3 = 3 1,00 10 g 159,6 g/mol = 6,25 mol
80 Moli iniziali Fe 2 O 3 (s) + 3 CO (g) 2 Fe (s) + 3 CO 2 (g) Per far reagire tutto l ossido sono necessarie il triplo delle moli di CO Fe 2 O 3 (s) + 3 CO (g) 2 Fe (s) + 3 CO 2 (g) Moli iniziali x Moli finali 2x6.25 3x6.25 Quando tutto l ossido ha reagito con tutto il CO che occorreva, si formeranno il doppio delle moli di Fe e il triplo di CO 2 Moltiplicando ciascun numero di moli per il relativo peso atomico o molecolare otteniamo i grammi di ciascun componente della reazione Fe 2 O 3 (s) + 3 CO (g) 2 Fe (s) + 3 CO 2 (g) grammi iniziali grammi finali
81 REAGENTE LIMITANTE Può capitare che i reagenti siano combinati in quantità diverse dalle proporzioni molari date dall'equazione chimica. In tal caso solo uno dei reagenti il reagente limitante si consuma completamente mentre parte dell'altro reagente il reagente in eccesso rimane inalterato. 2 H 2 (g) + O 2 (g) 2 H 2 O(g) Inizio 2 mol 1 mol - Fine mol 2 H 2 (g) + O 2 (g) 2 H 2 O(g) Inizio 2 mol 0.5 mol - Fine 1 mol - 1 mol Reagente limitante
82 Esempio 1 Data la reazione, 2 Al(s) + 3 Cl 2 (g) Al 2 Cl 6 (s) Determinare quanti grammi di Al 2 Cl 6 si possono ottenere facendo reagire 50 g di Al e 250 grammi di Cl 2. Pesi atomici P.A. Al g/mol Al 2 Cl g/mol Pesi molecolari Cl g/mol Cl g/mol Calcoliamo il numero di moli dei reagenti: n Al g PA Al Al 50 g 26.98g/mol 1.85 n Cl 2 PM g Cl 2 Cl g 70.9 g/mol Al(s) + 3 Cl 2 (g) Al 2 Cl 6 (s) Moli iniziali
83 Per far reagire completamente 1.85 moli di Al quanto Cl 2 mi occorrerebbe? Ho a disposizione più cloro di quello 3 necessario a far reagire tutto l alluminio: ncl 2 n Al Cl 2 reagente in eccesso Al reagente limitante Devo quindi utilizzare le moli del reagente limitante per calcolare la quantità massima di prodotto che posso ottenere Per ogni mole di Al ottengo mezza mole di Al 2 Cl 6 quindi n 1 2 n 1 x Al2Cl 6 Al Al(s) + 3 Cl 2 (g) Al 2 Cl 6 (s) Moli iniziali Moli reagite Moli finali - ( )= grammi finali - (0.75*70.9)=53.17 (0.925*266.66)= Cl 2 avanzato
84 Esempio 2 Data la reazione, N 2 (g) + H 2 (g) NH 3 (g) A) Bilanciarla B) Determinare quanti grammi di ammoniaca si possono ottenere facendo reagire 50 g di azoto e 30 g di idrogeno Pesi atomici P.A. N H g/mol 1.01 g/mol Pesi molecolari N 2 H 2 NH g/mol 2.02 g/mol g/mol
85 N 2 (g) + 3H 2 (g) 2NH 3 (g) Calcoliamo il numero di moli dei reagenti: n n N2 H 2 gn 2 50 g 1. 78mol PM 28.02g/mol N 2 g H 30 g mol PM 2.02 g/mol H 2 N 2 (g) + 3H 2 (g) 2NH 3 (g) Moli iniziali
86 Per far reagire completamente 1.78 moli di N 2 quanto H 2 mi occorrerebbe? Ho a disposizione più idrogeno di quello nh 2 3n N necessario a far reagire tutto l azoto: H 2 reagente in eccesso N 2 reagente limitante Devo quindi utilizzare le moli del reagente limitante per calcolare la quantità massima di prodotto che posso ottenere Per ogni mole di N 2 ottengo 2 moli di NH 3 quindi n NH3 2n N N 2 (g) + 3H 2 (g) 2NH 3 (g) Moli iniziali Moli reagite Moli finali - ( )= grammi finali - (9.51*2.02)=19.21 (3.56*17.04)= H 2 avanzato
87 Esercizio 2 Data la reazione, 2 NaOH +MgCl 2 Mg(OH) 2 + 2NaCl Determinare quanto cloruro di sodio e idrossido di magnesio si producono aggiungendo 30 g di MgCl 2 a 50 g di soluzione acquosa di NaOH al 30% in peso. Pesi atomici P.A. Na O H Mg Cl g/mol 16 g/mol 1.01 g/mol g/mol g/mol Pesi molecolari NaOH MgCl 2 Mg(OH) 2 NaCl 40 g/mol g/mol g/mol g/mol Calcoliamo il numero di moli dei reagenti: n MgCl 2 PM g MgCl 2 MgCl 2 30 g 95.21g/mol 0.32
88 Dei 50 grammi di soluzione acquosa di NaOH solo il 30% è costituito da NaOH, Ossia 0.3x50=15 g n NaOH g PM NaOH NaOH 15g 40 g/mol NaOH (l) +MgCl 2 Mg(OH) 2 + 2NaCl Moli iniziali Per far reagire completamente moli di NaOH quanto MgCl 2 mi occorrerebbe? n MgCl n NaOH 0.19 Ho a disposizione più MgCl2 di quello necessario a far reagire tutto l NaOH: MgCl 2 reagente in eccesso NaOH reagente limitante Devo quindi utilizzare le moli del reagente limitante per calcolare la quantità massima di prodotti che posso ottenere
89 Per ogni mole di NaOH ottengo 0.5 moli di Mg(OH)2 e 1 mole di NaCl quindi Moli reagite NaOH (l) +MgCl 2 Mg(OH) 2 + 2NaCl Moli iniziali Moli finali - ( ) =0.13 grammi finali - (0.13*95.21) (0.19*58.33) (0.375*58.44) =12.38 = =21.92
Corso di CHIMICA Dott. Annalisa Vacca Dipartimento di Ingegneria Chimica e Materiali
 Corso di CHIMICA Dott. Annalisa Vacca Dipartimento di Ingegneria Chimica e Materiali Dipartimento di ingegneria chimica e materiali (secondo piano) Aula Magna Orario di ricevimento: Da Lunedì a Venerdì
Corso di CHIMICA Dott. Annalisa Vacca Dipartimento di Ingegneria Chimica e Materiali Dipartimento di ingegneria chimica e materiali (secondo piano) Aula Magna Orario di ricevimento: Da Lunedì a Venerdì
Corso di CHIMICA Annalisa Vacca Dipartimento di Ingegneria Meccanica, Chimica e dei Materiali
 Corso di CHIMICA Annalisa Vacca Dipartimento di Ingegneria Meccanica, Chimica e dei Materiali Dipartimento di ingegneria chimica e materiali (secondo piano) Aula Magna Orario di ricevimento: Da Lunedì
Corso di CHIMICA Annalisa Vacca Dipartimento di Ingegneria Meccanica, Chimica e dei Materiali Dipartimento di ingegneria chimica e materiali (secondo piano) Aula Magna Orario di ricevimento: Da Lunedì
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni
 CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni Lavoisier e la legge di conservazione della massa Lavoisier riconobbe l importanza delle misurazioni accurate
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni Lavoisier e la legge di conservazione della massa Lavoisier riconobbe l importanza delle misurazioni accurate
Corso di CHIMICA Simonetta Palmas Dipartimento di Ingegneria Meccanica, Chimica e dei Materiali
 Corso di CHIMICA Simonetta Palmas Dipartimento di Ingegneria Meccanica, Chimica e dei Materiali Dipartimento di ingegneria chimica e materiali (secondo piano) Aula Magna Orario delle lezioni: http://facolta.unica.it/ingegneriarchitettura/files/2014/10/elettrica-elettronica.pdf
Corso di CHIMICA Simonetta Palmas Dipartimento di Ingegneria Meccanica, Chimica e dei Materiali Dipartimento di ingegneria chimica e materiali (secondo piano) Aula Magna Orario delle lezioni: http://facolta.unica.it/ingegneriarchitettura/files/2014/10/elettrica-elettronica.pdf
Loriano Storchi.
 Loriano Storchi loriano@storchi.org http://www.storchi.org/ Metodo scientifico Nessuna quantità di esperimenti potrà dimostrare che ho ragione; un unico esperimento potrà dimostrare che ho sbagliato Il
Loriano Storchi loriano@storchi.org http://www.storchi.org/ Metodo scientifico Nessuna quantità di esperimenti potrà dimostrare che ho ragione; un unico esperimento potrà dimostrare che ho sbagliato Il
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni
 CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni composto materia sostanza pura miscela omogenea elemento eterogenea Elementi, Composti e Miscele Miscela eterogenea
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni composto materia sostanza pura miscela omogenea elemento eterogenea Elementi, Composti e Miscele Miscela eterogenea
MASSE ATOMICHE. Oggi è possibile misurare accuratamente le masse atomiche tramite uno strumento chiamato spettrometro di massa
 Stechiometria MASSE ATOMICHE Dal 1969 si usa una scala basata sull'isotopo 12 C : a tale isotopo è stata arbitrariamente assegnata una massa di 12 unità di massa atomica. Una unità di massa atomica (a.m.u.)=
Stechiometria MASSE ATOMICHE Dal 1969 si usa una scala basata sull'isotopo 12 C : a tale isotopo è stata arbitrariamente assegnata una massa di 12 unità di massa atomica. Una unità di massa atomica (a.m.u.)=
Chimica generale e inorganica
 Corso di: Chimica generale e inorganica Prof. Roberta Spadaccini rspadacc@unisannio.it Orario di ricevimento: lunedi 16-17 Libri di testo consigliati: Brown-Lemay Fondamenti di chimica EDISES Giannoccaro
Corso di: Chimica generale e inorganica Prof. Roberta Spadaccini rspadacc@unisannio.it Orario di ricevimento: lunedi 16-17 Libri di testo consigliati: Brown-Lemay Fondamenti di chimica EDISES Giannoccaro
PESO MOLECOLARE. Il peso molecolare di una sostanza è la somma dei pesi atomici di tutti gli atomi nella molecola della sostanza.
 PESO MOLECOLARE Il peso molecolare di una sostanza è la somma dei pesi atomici di tutti gli atomi nella molecola della sostanza. H 2 O PA(H)=1,0 u.m.a. PA(O)=16,0 u.m.a. PM(H 2 O)=2 x 1,0 + 16,0 =18,0
PESO MOLECOLARE Il peso molecolare di una sostanza è la somma dei pesi atomici di tutti gli atomi nella molecola della sostanza. H 2 O PA(H)=1,0 u.m.a. PA(O)=16,0 u.m.a. PM(H 2 O)=2 x 1,0 + 16,0 =18,0
Corso di chimica generale
 Corso di chimica generale Dr. Riccardo Montioli Email: riccardo.montioli@univr.it Programma - La materia e l energia - Le particelle subatomiche e la misura della massa - L atomo, teorie e struttura -
Corso di chimica generale Dr. Riccardo Montioli Email: riccardo.montioli@univr.it Programma - La materia e l energia - Le particelle subatomiche e la misura della massa - L atomo, teorie e struttura -
Lezione 2. Leggi ponderali
 Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
LEGGI PONDERALI DELLA CHIMICA
 LEGGI PONDERALI DELLA CHIMICA LEGGE DI LAVOISIER (1743-1794) In ogni reazione la massa totale dei reagenti è uguale alla massa totale dei prodotti. Massa Totale R = Massa Totale P Esempio rame + zolfo
LEGGI PONDERALI DELLA CHIMICA LEGGE DI LAVOISIER (1743-1794) In ogni reazione la massa totale dei reagenti è uguale alla massa totale dei prodotti. Massa Totale R = Massa Totale P Esempio rame + zolfo
CHIMICA GENERALE ED INORGANICA
 Corso di CHIMICA GENERALE ED INORGANICA Prof. Nazzareno Re Orario delle lezioni: Martedì 11-13 Mercoledì 11-13 Giovedì 11-13 Esercitazioni: Giovedì 14-16 Orario di ricevimento: Martedì 14-16 Mercoledì
Corso di CHIMICA GENERALE ED INORGANICA Prof. Nazzareno Re Orario delle lezioni: Martedì 11-13 Mercoledì 11-13 Giovedì 11-13 Esercitazioni: Giovedì 14-16 Orario di ricevimento: Martedì 14-16 Mercoledì
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare
 Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
MASSE ATOMICHE. 1,000 g di idrogeno reagiscono con 7,9367 g di ossigeno massa atomica ossigeno=2 x 7,9367=15,873 g (relativa all'idrogeno)
 MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
Carica e massa di particelle atomiche
 Carica e massa di particelle atomiche Protone Elettrone Neutrone Carica (Coulomb) + 1,602. 10-19 - 1,602. 10-19 0 Carica relativa a 1,602. 10-19 + 1-1 0 Massa (Kg) 1,673. 10-27 9,109. 10-31 1,675.10-27
Carica e massa di particelle atomiche Protone Elettrone Neutrone Carica (Coulomb) + 1,602. 10-19 - 1,602. 10-19 0 Carica relativa a 1,602. 10-19 + 1-1 0 Massa (Kg) 1,673. 10-27 9,109. 10-31 1,675.10-27
Esercizi di. Stechiometria dei composti. mercoledì 9 dicembre 2015
 Esercizi di Stechiometria dei composti mercoledì 9 dicembre 2015 Il cloro ha due isotopi stabili contenenti rispettivamente 18 e 20 neutroni. Utilizzando la tavola periodica degli elementi, scrivere i
Esercizi di Stechiometria dei composti mercoledì 9 dicembre 2015 Il cloro ha due isotopi stabili contenenti rispettivamente 18 e 20 neutroni. Utilizzando la tavola periodica degli elementi, scrivere i
STRUTTURA ATOMICA LE PARTICELLE SUBATOMICHE E I PRIMI MODELLI ATOMICI
 STRUTTURA ATOMICA LE PARTICELLE SUBATOMICHE E I PRIMI MODELLI ATOMICI STRUTTURA DELL'ATOMO Vari esperimenti condotti fra la fine del 1800 e l inizio del 1900 dimostrarono che gli atomi non sono indivisibili,
STRUTTURA ATOMICA LE PARTICELLE SUBATOMICHE E I PRIMI MODELLI ATOMICI STRUTTURA DELL'ATOMO Vari esperimenti condotti fra la fine del 1800 e l inizio del 1900 dimostrarono che gli atomi non sono indivisibili,
Pesi atomici e molecolari La mole
 Pesi atomici e molecolari La mole Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 QUALE
Pesi atomici e molecolari La mole Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 QUALE
Loriano Storchi.
 Loriano Storchi loriano@storchi.org http://www.storchi.org/ Metodo scientifico Nessuna quantità di esperimenti potrà dimostrare che ho ragione; un unico esperimento potrà dimostrare che ho sbagliato Il
Loriano Storchi loriano@storchi.org http://www.storchi.org/ Metodo scientifico Nessuna quantità di esperimenti potrà dimostrare che ho ragione; un unico esperimento potrà dimostrare che ho sbagliato Il
Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C
 A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 1: mole, bilanciamento di equazioni chimiche non redox, formule minime e
A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 1: mole, bilanciamento di equazioni chimiche non redox, formule minime e
Chimica. Lezione 1 La materia
 Chimica Lezione 1 La materia Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido, gassoso) o della COMPOSIZIONE
Chimica Lezione 1 La materia Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido, gassoso) o della COMPOSIZIONE
Laboratorio di Chimica Generale ed Inorganica. Lezione 3. Atomi ed elementi Unità di massa atomica Mole
 Laboratorio di Chimica Generale ed Inorganica Lezione 3 Atomi ed elementi Unità di massa atomica Mole Dott.ssa Lorenza Marvelli Dipartimento di Scienze Chimiche e Farmaceutiche Laboratorio di Chimica Generale
Laboratorio di Chimica Generale ed Inorganica Lezione 3 Atomi ed elementi Unità di massa atomica Mole Dott.ssa Lorenza Marvelli Dipartimento di Scienze Chimiche e Farmaceutiche Laboratorio di Chimica Generale
Classificazione della materia 3 STATI DI AGGREGAZIONE
 Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Aspetti quali-quantitativi delle reazioni chimiche unità 1, modulo B del libro unità 2, modulo E del libro
 Aspetti quali-quantitativi delle reazioni chimiche unità 1, modulo B del libro unità 2, modulo E del libro Trovare una bilancia che possa pesare un atomo è un sogno irrealizzabile. Non potendo determinare
Aspetti quali-quantitativi delle reazioni chimiche unità 1, modulo B del libro unità 2, modulo E del libro Trovare una bilancia che possa pesare un atomo è un sogno irrealizzabile. Non potendo determinare
Chimica. 1) Il simbolo del Carbonio è: A) C B) Ca. C) Ce D) Cu. 2) Secondo il principio della conservazione della materia:
 Chimica 1) Il simbolo del Carbonio è: A) C B) Ca C) Ce D) Cu 2) Secondo il principio della conservazione della materia: A) Durante le reazioni chimiche il numero totale di atomi di ciascun elemento chimico
Chimica 1) Il simbolo del Carbonio è: A) C B) Ca C) Ce D) Cu 2) Secondo il principio della conservazione della materia: A) Durante le reazioni chimiche il numero totale di atomi di ciascun elemento chimico
Chimica. Scienza che studia: proprietà, composizione e struttura della materia, e le trasformazioni che in essa avvengono
 Chimica Scienza che studia: proprietà, composizione e struttura della materia, e le trasformazioni che in essa avvengono La Chimica è una scienza sperimentale: Si basa su misure ottenute da esperimenti
Chimica Scienza che studia: proprietà, composizione e struttura della materia, e le trasformazioni che in essa avvengono La Chimica è una scienza sperimentale: Si basa su misure ottenute da esperimenti
Reazioni chimiche e stechiometria
 Reazioni chimiche e stechiometria REAZIONI CHIMICHE Trasformazione di una o più sostanze (reagenti) in una o più sostanze (prodotti) EQUAZIONE CHIMICA Una equazione chimica è la rappresentazione simbolica
Reazioni chimiche e stechiometria REAZIONI CHIMICHE Trasformazione di una o più sostanze (reagenti) in una o più sostanze (prodotti) EQUAZIONE CHIMICA Una equazione chimica è la rappresentazione simbolica
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica -
 Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
Scienziati in Erba Chimica
 Scienziati in Erba Chimica Acqua Oro Zucchero La Chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola periodica degli elementi
Scienziati in Erba Chimica Acqua Oro Zucchero La Chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola periodica degli elementi
+ + Corso di Chimica e Propedeutica Biochimica Le equazioni chimiche e la stechiometria. CH 4 (g)+ 2 O 2 (g) CO 2 (g) + 2 H 2 O(l) 1
 Corso di Chimica e Propedeutica Biochimica Le equazioni chimiche e la stechiometria + + 1 molecola di metano (CH 4 ) 2 molecole di ossigeno (O 2 ) 1 molecola di biossido di carbonio (CO 2 ) 2 molecole
Corso di Chimica e Propedeutica Biochimica Le equazioni chimiche e la stechiometria + + 1 molecola di metano (CH 4 ) 2 molecole di ossigeno (O 2 ) 1 molecola di biossido di carbonio (CO 2 ) 2 molecole
Elementi: specie chimiche che resistono bene ad ogni tentativo di decomposizione. Composti: specie chimiche definite formate da due o più elementi
 Elementi: specie chimiche che resistono bene ad ogni tentativo di decomposizione Composti: specie chimiche definite formate da due o più elementi Elemento Simbolo nomi con radici latine nomi derivati dalla
Elementi: specie chimiche che resistono bene ad ogni tentativo di decomposizione Composti: specie chimiche definite formate da due o più elementi Elemento Simbolo nomi con radici latine nomi derivati dalla
Le leggi ponderali, la mole e il calcolo stechiometrico. Lezioni 33-38
 Le leggi ponderali, la mole e il calcolo stechiometrico Lezioni 33-38 Isotopi Atomi che hanno lo stesso numero di protoni, ma differente numero di neutroni, sono definiti isotopi Gli isotopi di uno stesso
Le leggi ponderali, la mole e il calcolo stechiometrico Lezioni 33-38 Isotopi Atomi che hanno lo stesso numero di protoni, ma differente numero di neutroni, sono definiti isotopi Gli isotopi di uno stesso
Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza?
 Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza? Fisicamente è impossibile contare gli atomi contenuti in una data quantita di sostanza. E impossibile
Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza? Fisicamente è impossibile contare gli atomi contenuti in una data quantita di sostanza. E impossibile
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia. Massa atomica MOLE. a.a.
 Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia Massa atomica MOLE a.a. 2016-17 MATERIA costituita da ATOMI Miscele OMOGENEE o soluzioni Hanno la
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia Massa atomica MOLE a.a. 2016-17 MATERIA costituita da ATOMI Miscele OMOGENEE o soluzioni Hanno la
Cosa è una reazione chimica?
 Cosa è una reazione chimica? Una reazione chimica è un processo o trasformazione della materia che porta alla formazione di nuove sostanze, i prodotti, trasformando profondamente le sostanze di partenza,
Cosa è una reazione chimica? Una reazione chimica è un processo o trasformazione della materia che porta alla formazione di nuove sostanze, i prodotti, trasformando profondamente le sostanze di partenza,
Relazioni di massa nelle reazioni chimiche. Capitolo 3
 Relazioni di massa nelle reazioni chimiche Capitolo 3 Micro mondo atomi & molecole Macro mondo grammi Massa atomica è la massa di un atomo espressa in unità di massa atomica (uma) Per definizione: 1 atomo
Relazioni di massa nelle reazioni chimiche Capitolo 3 Micro mondo atomi & molecole Macro mondo grammi Massa atomica è la massa di un atomo espressa in unità di massa atomica (uma) Per definizione: 1 atomo
Calcolare quante moli di zinco sono contenute in 5,50 g di Zn. (Massa molare (m.m.) Zn = 65,409 g mol -1 ).
 Calcolare quante moli di zinco sono contenute in 5,50 g di Zn. (Massa molare (m.m.) Zn = 65,409 g mol -1 ). moli Zn = massa Zn / m.m. Zn = 5,50 / 65,409 g mol -1 = 8,41 10-2 mol Calcolare a quante moli
Calcolare quante moli di zinco sono contenute in 5,50 g di Zn. (Massa molare (m.m.) Zn = 65,409 g mol -1 ). moli Zn = massa Zn / m.m. Zn = 5,50 / 65,409 g mol -1 = 8,41 10-2 mol Calcolare a quante moli
Struttura atomica della materia
 Struttura atomica della materia 1 FASE fase 3 fase 1 fase 2 FASE: porzione di materia chimicamente e fisicamente omogenea delimitata da superfici di separazione ben definite 2 Classificazione della materia
Struttura atomica della materia 1 FASE fase 3 fase 1 fase 2 FASE: porzione di materia chimicamente e fisicamente omogenea delimitata da superfici di separazione ben definite 2 Classificazione della materia
Massa degli atomi e delle molecole
 Dallo studio dei volumi di gas nelle reazioni chimiche alle masse degli atomi e delle molecole Lo stato fisico di di un gas è descritto da tre grandezze fisiche: PRESSIONE (p) VOLUME (V) TEMPERATURA (T)
Dallo studio dei volumi di gas nelle reazioni chimiche alle masse degli atomi e delle molecole Lo stato fisico di di un gas è descritto da tre grandezze fisiche: PRESSIONE (p) VOLUME (V) TEMPERATURA (T)
Corso di Studi in Scienze Naturali Corso di Chimica Generale e Inorganica Dott.ssa Maria Cristina Paganini Prof. Elio Giamello
 Corso di Studi in Scienze Naturali Corso di Chimica Generale e Inorganica Dott.ssa Maria Cristina Paganini Prof. Elio Giamello Avvertenza: Le immagini seguenti, proiettate durante le lezioni sono tratte
Corso di Studi in Scienze Naturali Corso di Chimica Generale e Inorganica Dott.ssa Maria Cristina Paganini Prof. Elio Giamello Avvertenza: Le immagini seguenti, proiettate durante le lezioni sono tratte
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero La vita è una reazione chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola
La Vita è una Reazione Chimica Acqua Oro Zucchero La vita è una reazione chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola
reazioni Sostanze Reazioni di sintesi Reazioni di decomposizione
 Si consumano nelle reazioni Si formano nelle reagenti Si trasformano con prodotti Sostanze Sostanze semplici Sostanze composte Non ottenibili con Non decomponibili con Reazioni di sintesi Reazioni di decomposizione
Si consumano nelle reazioni Si formano nelle reagenti Si trasformano con prodotti Sostanze Sostanze semplici Sostanze composte Non ottenibili con Non decomponibili con Reazioni di sintesi Reazioni di decomposizione
LE TEORIE DELLA MATERIA
 IL CONCETTO DIATOMO HA RADICI ANTICHE LE TEORIE DELLA MATERIA FILOSOFI GRECI: LEUCIPPO circa 450 a.c. La materia non è continua ma è formata da particelle piccolissime. DEMOCRITO circa 400 a.c. discepolo
IL CONCETTO DIATOMO HA RADICI ANTICHE LE TEORIE DELLA MATERIA FILOSOFI GRECI: LEUCIPPO circa 450 a.c. La materia non è continua ma è formata da particelle piccolissime. DEMOCRITO circa 400 a.c. discepolo
Sommario della lezione 4. Proprietà periodiche. Massa atomica e massa molecolare. Concetto di mole. Prime esercitazioni
 Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
Massa assoluta e relativa e mole
 Massa assoluta e relativa e mole Massa atomica assoluta.. Massa di un atomo di un dato elemento. In questo caso si parla spesso di peso atomico assoluto, che viene espresso in grammi: l'ordine dei valori
Massa assoluta e relativa e mole Massa atomica assoluta.. Massa di un atomo di un dato elemento. In questo caso si parla spesso di peso atomico assoluto, che viene espresso in grammi: l'ordine dei valori
ATOMI E MOLECOLE. ATOMO= unità più piccola di un elemento che ne mantiene le caratteristiche chimiche.
 1 ATOMI E MOLECOLE ATOMO= unità più piccola di un elemento che ne mantiene le caratteristiche chimiche. SIMBOLO ATOMICO= 1 o 2 lettere che identificano elemento A= numero di massa (protoni+neutroni) Z=
1 ATOMI E MOLECOLE ATOMO= unità più piccola di un elemento che ne mantiene le caratteristiche chimiche. SIMBOLO ATOMICO= 1 o 2 lettere che identificano elemento A= numero di massa (protoni+neutroni) Z=
U.M.A. e le masse ATOMICHE
 U.M.A. e le masse ATOMICHE L unità di massa atomica (u.m.a.) viene definita come 1/12 della massa del 12 C Il peso atomico (massa atomica relativa) di un atomo viene definito come: massa atomo considerato
U.M.A. e le masse ATOMICHE L unità di massa atomica (u.m.a.) viene definita come 1/12 della massa del 12 C Il peso atomico (massa atomica relativa) di un atomo viene definito come: massa atomo considerato
Capitolo 5 La quantità chimica: la mole
 Capitolo 5 La quantità chimica: la mole 1. La massa di atomi e molecole: un po di storia 2. Le reazioni tra i gas e il principio di Avogadro 3. Quanto pesano un atomo o una molecola? 4. La massa atomica
Capitolo 5 La quantità chimica: la mole 1. La massa di atomi e molecole: un po di storia 2. Le reazioni tra i gas e il principio di Avogadro 3. Quanto pesano un atomo o una molecola? 4. La massa atomica
Corso di CHIMICA INORGANICA
 Corso di CHIMICA INORGANICA Lezione Seconda La teoria atomica La massa atomica e il concetto di Isotopi Dentro l atomo, le particelle subatomiche La Tavola Periodica degli Elementi 2 Gli atomi di un certo
Corso di CHIMICA INORGANICA Lezione Seconda La teoria atomica La massa atomica e il concetto di Isotopi Dentro l atomo, le particelle subatomiche La Tavola Periodica degli Elementi 2 Gli atomi di un certo
Il modello strutturale dell atomo
 Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Chimica generale. Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari PARTE 2-2
 Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari PARTE 2-2 1 Molecole, moli, equazioni chimiche, bilanciamento delle
Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari PARTE 2-2 1 Molecole, moli, equazioni chimiche, bilanciamento delle
Chimica. La scienza che studia le trasformazioni della materia. Acqua (ghiaccio) Acqua (Liquido) Trasformazione Fisica
 Nozioni di Base Chimica La scienza che studia le trasformazioni della materia Acqua (ghiaccio) ----- Acqua (Liquido) Trasformazione Fisica Metano + Ossigeno -- Anidride Carbonica + Acqua Trasformazione
Nozioni di Base Chimica La scienza che studia le trasformazioni della materia Acqua (ghiaccio) ----- Acqua (Liquido) Trasformazione Fisica Metano + Ossigeno -- Anidride Carbonica + Acqua Trasformazione
Esercizi di stechiometria
 Esercizi di stechiometria La reazione globale da bilanciare) per ottenere il carbonato di sodio secondo il processo di Solvay è la seguente: Calcolare quanto cloruro di sodio NaCl) occorre per ottenere
Esercizi di stechiometria La reazione globale da bilanciare) per ottenere il carbonato di sodio secondo il processo di Solvay è la seguente: Calcolare quanto cloruro di sodio NaCl) occorre per ottenere
Le sostanze chimiche prof. Matteo Scapellato
 1. Fenomeni fisici e fenomeni chimici a) Fenomeno fisico: è una trasformazione che non cambia la natura delle sostanze 1 b) Fenomeno chimico o reazione chimica: è una trasformazione che cambia la natura
1. Fenomeni fisici e fenomeni chimici a) Fenomeno fisico: è una trasformazione che non cambia la natura delle sostanze 1 b) Fenomeno chimico o reazione chimica: è una trasformazione che cambia la natura
Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio:
 Reazioni chimiche Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio: CH 4 + 2O 2 CO 2 + 2H 2 O La reazione chimica è formata da reagenti
Reazioni chimiche Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio: CH 4 + 2O 2 CO 2 + 2H 2 O La reazione chimica è formata da reagenti
CHIMICA GENERALE CON LABORATORIO ED ELEMENTI DI ORGANICA (12 CFU) STRUTTURA DEL CORSO
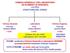 CHIMICA GENERALE CON LABORATORIO ED ELEMENTI DI ORGANICA (12 CFU) STRUTTURA DEL CORSO Chimica Generale Laboratorio Chimica Organica Prof.ssa Barbara Milani 7 CFU Prof. Tiziano Montini 2 CFU Lezione: 8/11
CHIMICA GENERALE CON LABORATORIO ED ELEMENTI DI ORGANICA (12 CFU) STRUTTURA DEL CORSO Chimica Generale Laboratorio Chimica Organica Prof.ssa Barbara Milani 7 CFU Prof. Tiziano Montini 2 CFU Lezione: 8/11
Compiti estivi di chimica classe 1Ag
 Compiti estivi di chimica classe Ag Separare un miscuglio secondo le tecniche studiate. Quale metodo di separazione potrebbe essere utilizzato per separare un miscuglio formato da sale mescolato con frammenti
Compiti estivi di chimica classe Ag Separare un miscuglio secondo le tecniche studiate. Quale metodo di separazione potrebbe essere utilizzato per separare un miscuglio formato da sale mescolato con frammenti
Stechiometria. Stechiometria. Stechiometria
 Stechiometria attendibilità: è la qualità globale di un dato. Dipende da: sensibilità: è la più piccola quantità che si riesce a determinare, cioè a distinguere sicuramente da zero. accuratezza: è la concordanza
Stechiometria attendibilità: è la qualità globale di un dato. Dipende da: sensibilità: è la più piccola quantità che si riesce a determinare, cioè a distinguere sicuramente da zero. accuratezza: è la concordanza
Capitolo 10. Prof. Vincenzo Leo - Chimica - ITA Emilio Sereni 1
 Capitolo 10 N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo Leo - Chimica - ITA Emilio Sereni
Capitolo 10 N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo Leo - Chimica - ITA Emilio Sereni
Calcoli stechiometrici su: La mole Composizione percentuale dei composti chimici Formule molecolari ed empiriche Composizione di miscele
 Calcoli stechiometrici su: La mole Composizione percentuale dei composti chimici Formule molecolari ed empiriche Composizione di miscele La mole (mol) è l unità di misura della grandezza fondamentale quantità
Calcoli stechiometrici su: La mole Composizione percentuale dei composti chimici Formule molecolari ed empiriche Composizione di miscele La mole (mol) è l unità di misura della grandezza fondamentale quantità
Problema 1 Mg + 2HCl H 2 + MgCl 2. di Mg 1 Mg 1 H 2 quindi 0,823 moli di H 2 di H 2
 REAZIONI CHIMICHE 1. Con riferimento alla seguente reazione (da bilanciare): Mg + HCl H 2 + MgCl 2 calcolare i grammi di H 2 che si ottengono facendo reagire completamente 20 g di magnesio. utilizzando
REAZIONI CHIMICHE 1. Con riferimento alla seguente reazione (da bilanciare): Mg + HCl H 2 + MgCl 2 calcolare i grammi di H 2 che si ottengono facendo reagire completamente 20 g di magnesio. utilizzando
Programma svolto nell a.s
 ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: De Rosa Giovanna Classe: I Sez.:
ISTITUTO DI ISTRUZIONE SUPERIORE VIA SILVESTRI, 301 ROMA Sez. associata: I.T.C.G. "Alberto Ceccherelli" - Via di Bravetta, 383 Materia: Scienze Integrate - CHIMICA Docente: De Rosa Giovanna Classe: I Sez.:
UNITA DIDATTICA P A1.01
 Titolo: Grandezze fisiche fondamentali e derivate, unità di misura. Conversioni di unità di misura e notazione scientifica. Codice: A1-P-Tec-Gra Campo di indagine della chimica. Il Sistema Internazionale
Titolo: Grandezze fisiche fondamentali e derivate, unità di misura. Conversioni di unità di misura e notazione scientifica. Codice: A1-P-Tec-Gra Campo di indagine della chimica. Il Sistema Internazionale
Intro & Stechiometria
 CHIMICA Studio della materia (composizione, stru7ura e proprietà) e dei suoi cambiamen; (trasformazioni) Azione: su due livelli macroscopico (proprietà e trasformazioni della materia visibile) microscopico
CHIMICA Studio della materia (composizione, stru7ura e proprietà) e dei suoi cambiamen; (trasformazioni) Azione: su due livelli macroscopico (proprietà e trasformazioni della materia visibile) microscopico
Le sostanze chimiche
 Le sostanze chimiche Ingredienti base della materia La materia si presenta con diverse forme. Accade perché esistono moltissimi «ingredienti di base» che mescolandosi tra loro danno innumerevoli combinazioni.
Le sostanze chimiche Ingredienti base della materia La materia si presenta con diverse forme. Accade perché esistono moltissimi «ingredienti di base» che mescolandosi tra loro danno innumerevoli combinazioni.
Aspetti formali e ponderali delle reazioni chimiche
 i g t c unità g1 obiettivo x + Aspetti formali e ponderali delle reazioni chimiche 1 L equazione chimica Saper rappresentare una trasformazione chimica mediante un equazione che utilizza simboli e formule
i g t c unità g1 obiettivo x + Aspetti formali e ponderali delle reazioni chimiche 1 L equazione chimica Saper rappresentare una trasformazione chimica mediante un equazione che utilizza simboli e formule
Definizione rigorosa di Mole. Definizione rigorosa di u.m.a. = Dalton. 1 u.m.a. = 1/12 della massa di un atomo di 12 C
 Definizione rigorosa di Mole Quantità di sostanza di un sistema che contiene un numero di entità elementari pari al numero di atomi presente in 0.012 kg di carbonio(12). Quant è grande questo numero? N
Definizione rigorosa di Mole Quantità di sostanza di un sistema che contiene un numero di entità elementari pari al numero di atomi presente in 0.012 kg di carbonio(12). Quant è grande questo numero? N
MASSE ATOMICHE RELATIVE - MOLE
 MASSE ATOMICHE RELATIVE - MOLE Massa Atomica Massa Molecolare La mole Massa Molare Composizione percentuale dei composti chimici Formula Minima e Formula Molecolare MASSA ATOMICA Pur essendo ormai note
MASSE ATOMICHE RELATIVE - MOLE Massa Atomica Massa Molecolare La mole Massa Molare Composizione percentuale dei composti chimici Formula Minima e Formula Molecolare MASSA ATOMICA Pur essendo ormai note
Laboratorio di Chimica Generale ed Inorganica. Lezione 6. Leggi fondamentali della chimica
 Laboratorio di Chimica Generale ed Inorganica Lezione 6 Leggi fondamentali della chimica Dott.ssa Lorenza Marvelli Dipartimento di Scienze Chimiche e Farmaceutiche Laboratorio di Chimica Generale ed Inorganica
Laboratorio di Chimica Generale ed Inorganica Lezione 6 Leggi fondamentali della chimica Dott.ssa Lorenza Marvelli Dipartimento di Scienze Chimiche e Farmaceutiche Laboratorio di Chimica Generale ed Inorganica
Atomo: modello microscopico
 Atomo: modello microscopico 1 Modello atomico di Dalton (1808) Materia è composta di atomi indivisibili e indistruttibili Atomi uguali hanno identica massa e identiche proprietà chimiche Gli atomi non
Atomo: modello microscopico 1 Modello atomico di Dalton (1808) Materia è composta di atomi indivisibili e indistruttibili Atomi uguali hanno identica massa e identiche proprietà chimiche Gli atomi non
Capitolo 3. LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino
 Capitolo 3 LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!!
Capitolo 3 LE TRASFORMAZIONI CHIMICHE DELLA MATERIA La teoria particellare un po' più da vicino N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!!
LA STRUTTURA DELL ATOMO
 Capitolo 4 LA STRUTTURA DELL ATOMO N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo Leo - Chimica
Capitolo 4 LA STRUTTURA DELL ATOMO N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo Leo - Chimica
ATOMI E MOLECOLE. Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti).
 1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
Esercitazioni di Elementi di Chimica. Modulo 2 Struttura della Materia
 Esercitazioni di Elementi di Chimica Modulo 2 Struttura della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Qual è lo stato fisico
Esercitazioni di Elementi di Chimica Modulo 2 Struttura della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Qual è lo stato fisico
UNITA DI MISURA. Le unità di misura sono molto importanti
 Le unità di misura sono molto importanti UNITA DI MISURA 1000 è solo un numero 1000 LIRE unità di misura monetaria 1000 EURO unità di misura monetaria ma il valore di acquisto è molto diverso! 1000 Euro/mese
Le unità di misura sono molto importanti UNITA DI MISURA 1000 è solo un numero 1000 LIRE unità di misura monetaria 1000 EURO unità di misura monetaria ma il valore di acquisto è molto diverso! 1000 Euro/mese
Atomi, Molecole e Ioni. Capitolo 2
 Atomi, Molecole e Ioni Capitolo 2 La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti gli atomi di un dato elemento sono identici
Atomi, Molecole e Ioni Capitolo 2 La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti gli atomi di un dato elemento sono identici
Chimica: Studio della materia e delle sue interazioni.
 Chimica: Studio della materia e delle sue interazioni. La descrizione della materia viene affrontata da: punto di vista microscopico: studio di atomi e molecole le loro interazioni e le reazioni chimiche
Chimica: Studio della materia e delle sue interazioni. La descrizione della materia viene affrontata da: punto di vista microscopico: studio di atomi e molecole le loro interazioni e le reazioni chimiche
A a B b C c. a : b : c
 Consideriamo un composto di formula generica: A a B b C c La formula di un composto (ionico o molecolare) fornisce in maniera immediata e diretta la sua composizione atomica: Una molecola di formula A
Consideriamo un composto di formula generica: A a B b C c La formula di un composto (ionico o molecolare) fornisce in maniera immediata e diretta la sua composizione atomica: Una molecola di formula A
Trasformazioni fisiche e chimiche
 Trasformazioni fisiche e chimiche Le trasformazioni fisiche I passaggi di stato sono esempi di trasformazioni fisiche poiché la materia non cambia la sua composizione chimica, ma solo il suo stato fisico.
Trasformazioni fisiche e chimiche Le trasformazioni fisiche I passaggi di stato sono esempi di trasformazioni fisiche poiché la materia non cambia la sua composizione chimica, ma solo il suo stato fisico.
struttura atomica della materia La chimica
 Struttura atomica della materia 1 La chimica La chimica è la scienza che si occupa dello studio della composizione e delle proprietà delle varie forme della materia 2 bbvbsxbfxbfx 1 Classificazione della
Struttura atomica della materia 1 La chimica La chimica è la scienza che si occupa dello studio della composizione e delle proprietà delle varie forme della materia 2 bbvbsxbfxbfx 1 Classificazione della
Struttura atomica della materia
 Struttura atomica della materia 1 FASE fase 3 fase 1 fase 2 FASE: porzione di materia chimicamente e fisicamente omogenea delimitata da superfici di separazione ben definite 2 Classificazione della materia
Struttura atomica della materia 1 FASE fase 3 fase 1 fase 2 FASE: porzione di materia chimicamente e fisicamente omogenea delimitata da superfici di separazione ben definite 2 Classificazione della materia
2. La struttura dell atomo
 2. La struttura dell atomo 2.1 Particelle elementari 2.2 I modelli atomici: storia dell atomo 2.3 Numero atomico e numero di massa; 2.4 Isotopi; 2.5 Elementi e tavola periodica 2.1 Particelle elementari
2. La struttura dell atomo 2.1 Particelle elementari 2.2 I modelli atomici: storia dell atomo 2.3 Numero atomico e numero di massa; 2.4 Isotopi; 2.5 Elementi e tavola periodica 2.1 Particelle elementari
Cos è. la Chimica? G. Micera Chimica Generale e Inorganica
 Cos è la Chimica? La Chimica descrive la materia, le sue proprietà, le trasformazioni che essa subisce, e le variazioni di energia associate Materia è tutto ciò che ha massa e volume Energia è la capacità
Cos è la Chimica? La Chimica descrive la materia, le sue proprietà, le trasformazioni che essa subisce, e le variazioni di energia associate Materia è tutto ciò che ha massa e volume Energia è la capacità
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
Lezione 20: Atomi e molecole
 Lezione 20 - pag.1 Lezione 20: Atomi e molecole 20.1. Il punto della situazione Abbiamo visto, nella lezione precedente, come il modello atomico sia in grado di spiegare la grande varietà di sostanze che
Lezione 20 - pag.1 Lezione 20: Atomi e molecole 20.1. Il punto della situazione Abbiamo visto, nella lezione precedente, come il modello atomico sia in grado di spiegare la grande varietà di sostanze che
risposte agli esercizi del libro
 risposte agli esercizi del libro 1 SOLUZIONI ESERCIZI FINE CPITOLO 1 B D C 4 C 5 B 6 C 7 D 8 9 D 11 C 1 B 1 B 14 B 15 C 16 C 18 B 19 a) fisica; b) materiale; c) macroscopica; d) fusione; e) hanno-non occupano
risposte agli esercizi del libro 1 SOLUZIONI ESERCIZI FINE CPITOLO 1 B D C 4 C 5 B 6 C 7 D 8 9 D 11 C 1 B 1 B 14 B 15 C 16 C 18 B 19 a) fisica; b) materiale; c) macroscopica; d) fusione; e) hanno-non occupano
Stati di Aggregazione e Composizione - elementi atomo - composti - miscele omo- ed eterogenee L Atomo - particelle subatomiche e proprietà - Numero
 1. La Materia Stati di Aggregazione e Composizione - elementi atomo - composti - miscele omo- ed eterogenee L Atomo - particelle subatomiche e proprietà - Numero Atomico e Numero di Massa Gli Isotopi La
1. La Materia Stati di Aggregazione e Composizione - elementi atomo - composti - miscele omo- ed eterogenee L Atomo - particelle subatomiche e proprietà - Numero Atomico e Numero di Massa Gli Isotopi La
Le reazioni chimiche
 Le reazioni chimiche Le reazioni chimiche Le reazioni chimiche Le reazioni chimiche Una reazione chimica è un processo in cui una serie di sostanza (dette reagenti) viene convertita in altre sostanza (dette
Le reazioni chimiche Le reazioni chimiche Le reazioni chimiche Le reazioni chimiche Una reazione chimica è un processo in cui una serie di sostanza (dette reagenti) viene convertita in altre sostanza (dette
Corso di CHIMICA LEZIONE 1
 Corso di CHIMICA LEZIONE 1 MATERIA tutto ciò occupa spazio e ha massa si presenta in natura sottoforma di Miscugli: sostanze mescolate insieme in vario modo (rocce, acqua marina, aria, cellule) Sostanze
Corso di CHIMICA LEZIONE 1 MATERIA tutto ciò occupa spazio e ha massa si presenta in natura sottoforma di Miscugli: sostanze mescolate insieme in vario modo (rocce, acqua marina, aria, cellule) Sostanze
Esercizi sui Bilanci di Massa
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Bilanci di Massa Prof. Dipartimento CMIC Giulio Natta http://iscamap.corsi.chem.polimi.it/citterio Punti
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Bilanci di Massa Prof. Dipartimento CMIC Giulio Natta http://iscamap.corsi.chem.polimi.it/citterio Punti
Chimica e laboratorio
 ITIS H.HERTZ Progetto Monoennio Chimica e laboratorio PARTE PRIMA I MODULO: Struttura atomica e molecolare della materia PESO : 70% UNITA ORARIE PREVISTE : 20 h Unità A: ATOMI Descrivere le caratteristiche
ITIS H.HERTZ Progetto Monoennio Chimica e laboratorio PARTE PRIMA I MODULO: Struttura atomica e molecolare della materia PESO : 70% UNITA ORARIE PREVISTE : 20 h Unità A: ATOMI Descrivere le caratteristiche
La mole è definita come quella quantità di sostanza che contiene un numero di Avogadro di atomi o
 CHIMICA GENERALE ED INORGANICA Corso di Laurea Triennale in Biotecnologie Esercizi I Parte 1. a) Cosa si intende per mole di una sostanza? Anche più di una risposta! La mole è definita come quella quantità
CHIMICA GENERALE ED INORGANICA Corso di Laurea Triennale in Biotecnologie Esercizi I Parte 1. a) Cosa si intende per mole di una sostanza? Anche più di una risposta! La mole è definita come quella quantità
Mole e modelli atomici
 www.matematicamente.it La mole e i modelli atomici dai test di medicina 1 Mole e modelli atomici Domande tratte dai test di ammissione a medicina, odontoiatria e veterinaria 1. Quale delle seguenti affermazioni
www.matematicamente.it La mole e i modelli atomici dai test di medicina 1 Mole e modelli atomici Domande tratte dai test di ammissione a medicina, odontoiatria e veterinaria 1. Quale delle seguenti affermazioni
Atomi, molecole e ioni
 Atomi, molecole e ioni anione + - catione Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento
Atomi, molecole e ioni anione + - catione Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento
Sommario della lezione 5. Esercizi sui concetti di Mole e Composizione percentuale. Formule chimiche
 Sommario della lezione 5 Esercizi sui concetti di Mole e Composizione percentuale Formule chimiche Qual è la massa molecolare del glucosio? Il glucosio è costituito da molecole di formula C 6 H 12 O 6.
Sommario della lezione 5 Esercizi sui concetti di Mole e Composizione percentuale Formule chimiche Qual è la massa molecolare del glucosio? Il glucosio è costituito da molecole di formula C 6 H 12 O 6.
Capitolo 2. Cenni alla Composizione e Struttura dell atomo
 Master in Verifiche di qualità in radiodiagnostica, medicina nucleare e radioterapiar Capitolo 2 Cenni alla Composizione e Struttura dell atomo 24 Atomi, Molecole,, e Ioni L idea di Atomo è antica come
Master in Verifiche di qualità in radiodiagnostica, medicina nucleare e radioterapiar Capitolo 2 Cenni alla Composizione e Struttura dell atomo 24 Atomi, Molecole,, e Ioni L idea di Atomo è antica come
Ultima verifica pentamestre. 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!
 Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
Chimica Generale ed Inorganica
 Chimica Generale ed Inorganica Chimica Generale prof. Dario Duca H 2 O, CO, CO 2 MgO legge di conservazione della massa Lavoisier legge della composizione costante Proust teoria atomica di Dalton i) gli
Chimica Generale ed Inorganica Chimica Generale prof. Dario Duca H 2 O, CO, CO 2 MgO legge di conservazione della massa Lavoisier legge della composizione costante Proust teoria atomica di Dalton i) gli
